Перейти к:
Патогенетический подход к лечению коагулопатического кровотечения в акушерстве
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.557
Аннотация
Цель: обосновать дифференцированный подход к лечению акушерских коагулопатических кровотечений в зависимости от характера нарушений системы гемостаза.
Материалы и методы. Проведено проспективное когортное исследование с участием 52 пациенток с послеродовым кровотечением (ПРК), родивших в период с 2021 по 2023 гг. Диагностика и лечение коагулопатии проводилось по алгоритму с использованием параметров тромбоэластометрии (ТЭМ). Пациенток разделили на 3 группы в зависимости от объема кровопотери: группа 1 (n = 19) – кровопотеря до 1500 мл; группа 2 (n = 14) – кровопотеря 1500–1999 мл; группа 3 (n = 19) – кровопотеря 2000 мл и более. Определяли показатели гемостаза: количество тромбоцитов, протромбиновый индекс, активированное частичное тромбопластиновое время (АЧТВ), уровень фибриногена по Клаусу, международное нормализованное отношение и параметры ТЭМ, включающие время свертывания (англ. clotting time, CT), время образования сгустка (англ. clot formation time, CFT), максимальную плотность сгустка (англ. maximum clot firmness, MCF), максимальную плотность сгустка на 10-й минуте (А10) на каналах EXTEM (тест, при котором для активации внешнего пути коагуляции используется рекомбинантный тканевой фактор), FIBTEM (тест, в котором активность тромбоцитов подавляется цитохалазином D, что позволяет обнаруживать дефицит фибриногена или качественные нарушения полимеризации фибрина) и INTEM (тест, где в качестве контактного активатора внутреннего пути коагуляции используется эллаговая кислота). Образцы крови отбирали до введения компонентов и препаратов крови, транексамовой кислоты.
Результаты. Выявлены статистически значимые различия между уровнем фибриногена, параметрами MCF и A10 на канале FIBTEM в зависимости от объема кровопотери (р < 0,05), что свидетельствовало о снижении качества фибринового сгустка с увеличением объема кровопотери. Установлены высокой тесноты прямые связи между значениями фибриногена, MCF и A10, которые демонстрируют, что при уменьшении уровня фибриногена на момент кровотечения на 1,0 г/л следует ожидать уменьшения MCF на 3,802 мм (полученная модель объясняет 64,3 % наблюдаемой дисперсии), а А10 – на 3,497 мм (полученная модель объясняет 64,1 % наблюдаемой дисперсии). Всем пациенткам, у которых объем кровопотери достигал более 2000 мл, вводили криопреципитат, различия показателей статистически значимы между группой 3 в сравнении с группами 1 и 2 (р < 0,001). Параметры тромбоэластометрии CT и CFT на канале INTEM также коррелировали с объемом кровопотери и имели статистически значимую прямую корреляционную связь заметной тесноты (по шкале Чеддока) между АЧТВ и СТ (ρ = 0,612; р < 0,001) и умеренной тесноты между АЧТВ и CFT (rxy = 0,44; р = 0,017). Необходимость в переливании свежезамороженной плазмы (СЗП) и препаратов протромбинового комплекса (ППК) возникала при АЧТВ более 35 секунд в 77 % случаев (среди всех пациенток), при параметре СТ более 260 секунд – в 63 % случаев и СFT более 110 секунд – в 63 % случаев, соответственно; различия показателей статистически значимы при сравнении с показателями пациенток, которым не требовалось введение СЗП и ППК (р < 0,05). Благодаря протоколу контролируемой трансфузии, в группе 1 в 57,9 % случаев удалось обойтись без трансфузионной терапии; различия показателей статистически значимы в сравнении с группами 2 и 3 (р < 0,05).
Заключение. Применение метода ТЭМ в диагностике нарушений в системе гемостаза при ПРК позволило дифференцированно и в короткие сроки применить патогенетически обоснованную терапию компонентами и препаратами крови только в тех случаях, где она требовалась.
Ключевые слова
Для цитирования:
Сушко Т.А., Зайнулина М.С. Патогенетический подход к лечению коагулопатического кровотечения в акушерстве. Акушерство, Гинекология и Репродукция. 2025;19(2):216-229. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.557
For citation:
Sushko T.A., Zainulina M.S. Pathogenetic approach to the treatment of coagulopathic bleeding in obstetrics. Obstetrics, Gynecology and Reproduction. 2025;19(2):216-229. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.557
Введение / Introduction
Послеродовое кровотечение (ПРК) по-прежнему остается одним из основных факторов риска материнской заболеваемости и смертности. ПРК имеет множество причинных факторов, что затрудняет прогнозирование его возникновения, и не всегда возможно предугадать его тяжесть. Основную долю причин, приводящих к ПРК, составляют гипотонические кровотечения, кровотечения, связанные с патологией прикрепления и расположения плаценты, последовые кровотечения. При этом кровотечения, связанные с известными нарушениями в системе гемостаза (дефициты факторов свертывания, болезнь Виллебранда, тромбоцитопения и др.), приводят к кровотечениям лишь в 2,0 % случаев. Однако коагулопатический характер кровотечения встречается достаточно часто и возникает не первично, а вторично в результате коагулопатии потребления (при отсутствии своевременного хирургического лечения гипотонического кровотечения), а также в результате неадекватной инфузионной терапии, приводящей к гемодилюции [1].
Мониторинг нарушений в системе коагуляции у пациенток с ПРК посредством вязкоупругих методов, которые позволяют быстро оценить, имеет ли место коагулопатия в данной ситуации и какие звенья системы гемостаза находятся в дефиците (фибриноген, другие факторы свертывания, тромбоциты), может иметь решающее значение для быстрого начала целенаправленной терапии, гемостатического контроля и улучшения исходов за счет минимизации трансфузионной терапии и соблюдения правил менеджмента крови пациента. Однако необходимы дальнейшие исследования для определения диапазонов референтных значений, которые следует считать «нормальными» в той или иной ситуации [2].
Менеджмент крови пациента (МКП) – это своевременное применение научно обоснованных медицинских и хирургических концепций, направленных на поддержание концентрации гемоглобина, оптимизацию процессов гемостаза и минимизацию кровопотери в целях улучшения результатов лечения пациентов. Таким образом, в случае ПРК необходимо не допустить развития вторичной коагулопатии, вовремя справиться с уже развившейся коагулопатией и не допустить трансфузию компонентов крови там, где это не требуется [3].
Разнообразие потенциальных причин ПРК затрудняет прогнозирование его возникновения и тяжесть вероятной коагулопатии. Во многих случаях нет идентифицируемого фактора риска. Развитие вторичной коагулопатии, преимущественно за счет потребления факторов свертывания и в первую очередь фибриногена, может возникнуть как следствие первоначально различных причин, не связанных с коагулопатией. Быстрая коррекция коагулопатий, которые развиваются во время ПРК, может иметь решающее значение для контроля кровотечения и улучшения результатов. Однако соответствующее гемостатическое вмешательство может зависеть от доступности тромбоэластометрии/тромбоэластографии (ТЭМ/ТЭГ), которые позволяют быстро диагностировать причину кровотечения [2].
Поскольку протоколы массивной трансфузии, состоящие из раннего переливания компонентов крови – эритроцитарной взвеси, свежезамороженной плазмы (СЗП) и тромбоцитов в соотношении 1:1:1, считались приемлемыми для пациентов с травмами, этот алгоритм лечения решено было сделать стандартом и при лечении массивного акушерского кровотечения (МАК), хотя научных доказательств адекватности этого протокола, с точки зрения менеджмента крови пациента, достаточно мало [1].
Использование мониторинга коагуляции методами ТЭМ/ТЭГ у акушерских пациенток поднимает важный вопрос о том, какие референсные значения лучше всего отражают «нормальный» гемостаз у рожениц, и какие значения должны указывать на необходимость введения препаратов протромбинового комплекса (ППК), антифибринолитиков или трансфузии необходимых компонентов крови [2].
Значения протромбинового времени (ПВ) и активированного частичного тромбопластинового времени (АЧТВ) могут оставаться в нормальных пределах даже при МАК [4]. Как ПВ, так и АЧТВ, по данным других исследователей, имеют ограниченную ценность для мониторинга гемостаза во время ПРК из-за длительности выполнения тестов [4–6]. Один из обзоров 18 501 родов, проведенный в Великобритании, выявил 456 случаев, осложненных кровопотерей ≥ 1500 мл, и показал, что значения ПВ не коррелировали с объемом кровотечения, а величины АЧТВ коррелировали слабо [4]. Результаты совпадают с более ранними исследованиями, в которых авторы пришли к выводу, что ПВ и АЧТВ не полезны для прогнозирования прогрессирования ПРК [5][6]. Однако одно недавнее ретроспективное многоцентровое исследование показало, что ПВ > 1,5 раза от нормы может предсказывать потребность в расширенном вмешательстве для контроля ПРК [7]. Действующие рекомендации указывают на необходимость использования ПВ и АЧТВ для решения вопроса о целесообразности трансфузии СЗП [8], хотя нет никаких доказательств, подтверждающих, что эта практика эффективна для лечения ПРК.
Во многих исследованиях концентрация фибриногена коррелирует с частотой и тяжестью кровотечения [4][6][7]. В ранее проведенном проспективном исследовании с участием 128 пациенток снижение уровня фибриногена плазмы во время ПРК было единственной переменной, независимо связанной с прогрессированием МАК: уровень фибриногена > 4 г/л имел отрицательное прогностическое значение в 79 % случаев для МАК, тогда как уровень фибриногена ≤ 2 г/л имел положительное прогностическое значение в 100 % случаев [5].
При ПРК фибриноген является первым фактором свертывания, уровень которого снижается. Для достижения гемостаза при МАК необходимо введение достаточного количества фибриногена для возвращения его к норме. Для устранения коагулопатии и поддержания нормальной работы системы гемостаза у пациентки с ПРК требуются значения фибриногена 3–4 г/л и параметра тромбоэластометрии А10 (максимальная плотность сгустка на 10-й минуте) на канале FIBTEM > 16 мм [9]. При получении таких параметров, скорее всего, не потребуется вводить дополнительные компоненты крови. Тест FIBTEM позволяет диагностировать дефицит фибриногена в течение 10 минут после отбора пробы крови, тогда как лабораторные измерения обычно занимают 30–50 минут [10]. FIBTEM – это ранний и быстродоступный биомаркер для прогнозирования прогрессирования МАК [11].
Что касается дефицита фибриногена, существует 3 варианта его коррекции: СЗП, криопреципитат и концентрат фибриногена. СЗП традиционно является лечением, используемым для восполнения фибриногена при ПРК. Недавние исследования рекомендовали раннее введение концентрата фибриногена или криопреципитата вместо СЗП, поскольку СЗП содержит более низкие концентрации фибриногена [4]. Трансфузия СЗП при массивном кровотечении приводит к дальнейшей гемодилюции фибриногена, чего не наблюдается при трансфузии криопреципитата. Европейские исследования показали, что использование концентрата фибриногена привело к сокращению использования продуктов крови [12].
Резкое истощение фибриногена во время ПРК в основном объясняется истощением факторов свертывания крови и их потреблением. Однако уровень фибриногена, по данным некоторых исследований, превышает пороговый уровень (2,0 г/л) в большинстве случаев ПРК [13]. Поэтому если удалось справиться с кровотечением, и мы получаем нормальные значения фибриногена, протромбинового индекса (ПТИ) и АЧТВ, нормальные значения времени свертывания (англ. clotting time, CT), времени образования сгустка (англ. clot formation time, CFT) и максимальной плотности сгустка (англ. maximum clot firmness, MCF), следует воздержаться от трансфузии СЗП. Математическое моделирование в недавних исследованиях также говорит о том, что использование СЗП без контроля системы коагуляции в динамике посредством вязкоупругих методов при акушерском кровотечении может снизить уровень фибриногена в плазме за счет разведения и усилить кровотечение [14].
Функция и адекватная для гемостаза активность тромбоцитов во время прогрессирования ПРК недостаточно хорошо описаны в литературе. Оценить активность тромбоцитов в рамках ТЭМ мы можем, зная параметр A10 на канале EXTEM (демонстрирует внешний путь свертывания и включает участие как тромбоцитов, так и фибриногена) и параметр А10 на канале FIBTEM (демонстрирует внешний путь без участия тромбоцитов). Разница между параметрами А10 на каналах EXTEM и FIBTEM была предложена в качестве параметра, называемого PLTEM, который связан с активностью тромбоцитов [12]. Однако при МАК, как уже отмечено выше, первым будет снижаться фибриноген, а выраженный дефицит активности тромбоцитов мы сможем увидеть либо при наличии изначальной тромбоцитопении, либо при достаточно большом объеме кровопотери.
Методы вязкоупругой коагуляции (ТЭМ и ТЭГ) обеспечивают быструю оценку системы гемостаза крови, т. е. профиль коагуляции можно оценить за 5–10 минут и в кратчайшие сроки определить алгоритм лечения кровотечения в рамках персонифицированного подхода. Стандартные тесты на коагуляцию также необходимы, но они занимают гораздо больше времени и не позволяют охарактеризовать полноту работы системы гемостаза в реальном времени [15]. Однако важно осуществлять отбор крови для оценки коагуляции всеми способами для того, чтобы стандартизировать параметры методов вязкоупругой коагуляции для совершенствования алгоритмов лечения ПРК под их руководством. Лабораторные тесты обычно проводятся на плазме крови и заканчиваются образованием первых нитей фибрина, тогда как мониторинг на основе ТЭМ/ТЭГ проводится на цельной крови и оценивает процесс от начала коагуляции до лизиса сгустка, включая оценку прочности и стабильности сгустка. Вязкоупругие методы позволяют более полно диагностировать характер развившейся коагулопатии и быстро оценить эффекты гемостатического вмешательства на коагуляцию [2].
Цель: обосновать дифференцированный подход к лечению акушерских коагулопатических кровотечений в зависимости от характера нарушений системы гемостаза.
Материалы и методы / Materials and Methods
Дизайн исследования / Study design
На базе СПб ГБУЗ РД № 6 им. проф. В.Ф. Снегирева проведено проспективное когортное исследование с участием 52 пациенток, родивших в период с 2021 по 2023 гг. Все случаи велись по протоколу контролируемой трансфузии, в основе которого лежит точечное воздействие на непосредственно поврежденные звенья системы гемостаза на момент кровотечения, используя метод ТЭМ.
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения: возраст ≥ 18 и ≤ 45 лет; кровотечения, связанные с нарушениями сокращения матки (гипотонические), с травмой родовых путей, с аномалиями прикрепления и расположения плаценты; женщины с исходными врожденными дефектами в системе гемостаза (иммунная тромбоцитопения, дефициты факторов свертывания) и приобретенными нарушениями в системе гемостаза (тромбоцитопения, преждевременная отслойка нормально расположенной плаценты, антенатальная гибель плода, септические состояния); подписанное информированное согласие.
Критерии исключения: возраст < 18 и > 45 лет; кровопотеря после родов менее 500 мл при родах через естественные родовые пути и менее 1000 мл при родах путем операции кесарева сечения; отказ от участия в исследовании.
Группы обследованных / Study groups
Пациентки были разделены на 3 группы в зависимости от объема кровопотери: группа 1 (n = 19) – кровопотеря до 1500 мл; группа 2 (n = 14) – кровопотеря 1500–1999 мл; группа 3 (n = 19) – кровопотеря 2000 мл и более.
Методы исследования / Study methods
У всех женщин, включенных в исследование, до введения компонентов и препаратов крови, транексамовой кислоты отбирали пробы крови и определяли показатели гемостаза: количество тромбоцитов, значения ПТИ, АЧТВ, уровень фибриногена по Клаусу, международное нормализованное отношение (МНО) и параметры ТЭМ, включающие CT, CFT, MCF, А10 на каналах EXTEM, FIBTEM и INTEM четырехканального компьютерного тромбоэластометра Rotem Delta (Tem Innovations GmbH, Германия) реактивами star-Tem, ex-Tem, fib-Tem, in-Tem (Tem Innovations GmbH, Германия).
Показатели системы гемостаза исследовали на коагулометре Sysmex CA-1500 (Sysmex, Япония) реактивами Helena BioSciences Europe (Великобритания). Количество тромбоцитов и уровень гемоглобина измеряли на гематологическом анализаторе Beckman Соultеr DxH 500 (Beckman, США).
Статистический анализ / Statistical analysis
Для систематизации полученных данных и их статистической обработки применяли пакет электронных таблиц Microsoft Office Excel 2019 (Microsoft, США) и программное обеспечение для статистических расчетов StatTech v. 4.2.6 (ООО «Статтех», Россия).
Количественные показатели, имеющие нормальное распределение, описывали с помощью средних арифметических величин (M) и стандартных отклонений (SD), границ 95 % доверительного интервала (ДИ). В случае отсутствия нормального распределения количественные данные описывали с помощью медианы (Me) и нижнего и верхнего квартилей [Q1–Q3]. Категориальные данные описывали с указанием абсолютных значений и процентных долей; 95 % ДИ для процентных долей рассчитывали по методу Клоппера–Пирсона. Сравнение процентных долей при анализе многопольных таблиц сопряженности выполняли с помощью критерия χ² Пирсона, апостериорные сравнения – с помощью критерия χ² Пирсона с поправкой Холма.
Для оценки диагностической значимости количественных признаков при прогнозировании определенного исхода применяли метод анализа ROC-кривых. Разделяющее значение количественного признака в точке cut-off определяли по наивысшему значению индекса Юдена. Достоверность различий расценивалась как значимая при p < 0,05.
Результаты / Results
Клинико-анамнестическая характеристика / Clinical and anamnestic characteristics
Различия в возрасте беременных и гестационном сроке родов между группами были статистически незначимы (табл. 1).
Таблица 1. Характеристика пациенток.
Table 1. Patients characteristics.
|
Показатель Parameter Ме [Q1–Q3] |
Объем кровопотери / Blood loss volume |
p |
||
|
< 1500 мл < 1500 ml n = 19 |
1500–1999 мл 1500–1999 ml n = 14 |
≤ 2000 мл ≥ 2000 ml n = 19 |
||
|
Возраст, лет Age, years |
30,0 [ 27,5–35,5] |
35,0 [ 33,3–35,5] |
31,0 [ 29,5–34,5] |
0,051 |
|
Гестационный срок родов, недель Gestational age of delivery, weeks |
38,0 [ 38,0–39,5] |
37,5 [ 34,3–39,0] |
39,0 [ 35,5–35,5] |
0,647 |
Причинами ПРК среди всех 52 пациенток, включенных в исследование, были преэклампсия у 10 (19,2 %) обследованных, тромбоцитопения – у 11 (21,2 %), предлежание плаценты – у 3 (5,8 %) беременных, низкомолекулярные гепарины при беременности получали 12 пациенток (23,1 %), рубец на матке после кесарева сечения и/или миомэктомии – у 10 (19,2 %) женщин, многоплодная беременность была у 3 пациенток (5,8 %), преждевременная отслойка нормально расположенной плаценты – у 7 (13,5 %).
Лабораторные данные / Laboratory data
Результаты параметров коагулологических тестов и ТЭМ, соответствующие уровню кровопотери, продемонстрированы в таблице 2. Анализ значений фибриногена и MCF на канале FIBTEM показал статистически значимые различия показателей между группами 1 и 3 (р < 0,001) и между группами 2 и 3 (p = 0,028).
Таблица 2. Соответствие параметров стандартных тестов на коагуляцию и тромбоэластометрии объему кровопотери.
Table 2. A relation between parameters of standard coagulation tests and thromboelastometry and blood loss volume.
|
Показатель Parameter |
Группа 1 / Group 1 n = 19 |
Группа 2 / Group 2 n = 14 |
Группа 3 / Group 3 n = 19 |
p |
|
Объем кровопотери Blood loss volume |
< 1500 мл / < 1500 ml |
1500–1999 мл / 1500–1999 ml |
≤ 2000 мл / ≥ 2000 ml |
|
|
M ± SD (95 % ДИ) / M ± SD (95 % CI) |
||||
|
Фибриноген, г/л Fibrinogen, g/L |
3,65 ± 1,07 (3,14–4,17) |
2,81 ± 0,76 (2,37–3,25) |
1,91 ± 0,96 (1,40–2,38) |
р1–2 > 0,05 р1–3 < 0,001 р2–3 = 0,028 |
|
MCF FIBTEM, мм MCF FIBTEM, mm |
19,95 ± 3,70 (18,16–21,73) |
17,43 ± 3,23 (15,56–19,29) |
12,16 ± 6,12 (9,21–15,11) |
р1–2 > 0,05 р1–3 < 0,001 р2–3 = 0,009 |
|
А10 FIBTEM, мм А10 FIBTEM, mm |
19,11 ± 3,31 (17,51–20,70) |
16,64 ± 3,00 (14,91–18,38) |
12,05 ± 5,80 (9,26–14,85) |
р1–2 > 0,05 р1–3 < 0,001 р2–3 = 0,017 |
|
Me [ Q1–Q3)] |
||||
|
АЧТВ, с APTT, s |
31,60 [ 27,00–38,00] |
37,45 [ 30,10–39,00] |
38,00 [ 37,10–47,00] |
р1–2 > 0,05 р1–3 = 0,023 р2–3 = 0,018 |
|
ПТИ, % PTI, % |
79,00 [ 72,80–81,80] |
74,10 [ 68,60–80,25] |
65,00 [ 53,00–74,50] |
р1–2 > 0,05 р1–3 < 0,001 р2–3 = 0,042 |
|
CT INTEM, мм CT INTEM, mm |
255,00 [ 230,00–281,00] |
278,50 [ 247,00–293,50] |
298,00 [ 278,25–320,75] |
р1–2 > 0,05 р1–3 = 0,083 р2–3 > 0,05 |
|
СFT INTEM, мм СFT INTEM, mm |
97,00 [ 73,00–128,00] |
124,50 [ 96,50–161,25] |
224,50 [ 168,25–428,25] |
р1–2 > 0,05 р1–3 < 0,001 р2–3 = 0,012 |
Примечание: MCF FIBTEM – максимальная плотность сгустка на канале FIBTEM; А10 FIBTEM – максимальная плотность сгустка на 10-й минуте исследования; АЧТВ – активированное частичное тромбопластиновое время; ПТИ – протромбиновый индекс; CT INTEM – время свертывания крови на канале INTEM; СFT INTEM – время образования сгустка на канале INTEM; 95 % ДИ – 95 % доверительный интервал.
Note: MCF FIBTEM – maximum clot density on the FIBTEM channel; A10 FIBTEM – maximum clot density at minute 10 of the study; APTT – activated partial thromboplastin time; PTI – prothrombin index; CT INTEM – blood clotting time on the INTEM channel; CFT INTEM – clot formation time on the INTEM channel; 95 % CI – 95 % confidence interval.
Уровень фибриногена после кровопотери в группах пациенток 1 и 2 продемонстрировал нормальные значения, не требующие его коррекции, составив 3,65 ± 1,07 г/л (95 % ДИ = 3,14–4,17) и 2,81 ± 0,76 г/л (95 % ДИ = 2,37–3,25) соответственно; статистически значимых различий между группами 1 и 2 выявлено не было. В группе 3 уровень фибриногена после кровопотери был значительно ниже, чем в группах 1 и 2, составляя 1,91 ± 0,96 г/л (95 % ДИ = 1,45–2,38; р < 0,05).
Одновременно с отбором крови для стандартных тестов на коагуляцию проводилось взятие крови в пробирку с цитратом натрия для оценки системы гемостаза методом ТЭМ.
Значения MCF на канале FIBTEM, где сгусток формируется только за счет фибриногена, в группах 1, 2, и 3 составили 19,95 ± 3,70 мм (95 % ДИ = 18,16–21,73), 17,43 ± 3,23 мм (95 % ДИ = 15,56–19,29) и 12,16 ± 6,12 мм (95 % ДИ = 9,21–15,11) соответственно. Значения показателей в группе статистически значимо различались между группами 1 и 3 (p < 0,001) и между группами 2 и 3 (р = 0,009).
При оценке связи уровня фибриногена с параметрами тромбоэластометрии MCF и А10 на канале FIBTEM были установлены высокой тесноты прямые связи, которые демонстрируют, что при снижении содержания фибриногена на момент кровотечения на 1,0 г/л следует ожидать уменьшения MCF на 3,802 мм (полученная модель объясняет 64,3 % наблюдаемой дисперсии) и уменьшения А10 на 3,497 мм (полученная модель объясняет 64,1 % наблюдаемой дисперсии) (рис. 1).
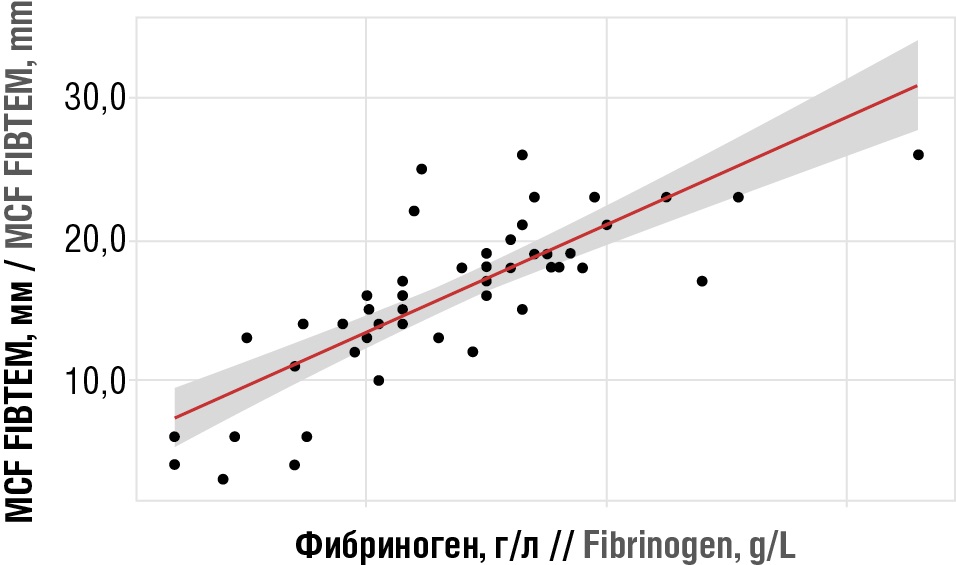
Рисунок 1. Высокой тесноты прямая связь между максимальной плотностью сгустка на канале FIBTEM (MCF FIBTEM) и уровнем фибриногена после родов на момент кровотечения: YFIBTEM MCF = 3,802X + 5,817 (rxy = 0,807).
Figure 1. High tightness direct relationship between maximum clot density on the FIBTEM channel (MCF FIBTEM) and the postpartum fibrinogen level at the time of bleeding: YFIBTEM MCF = 3.802X + 5.817 (rxy = 0.807).
При МАК именно фибриноген необходимо восполнить в первую очередь за счет трансфузии криопреципитата. Известно, что 2 дозы криопреципитата повышают уровень фибриногена примерно на 1,0 г/л, а целевой уровень фибриногена необходимо поддерживать на уровне не менее 2,0 г/л [16], и соответственно показатели MCF, A10 на канале FIBTEM должны составлять не менее 12 мм (рис. 2).
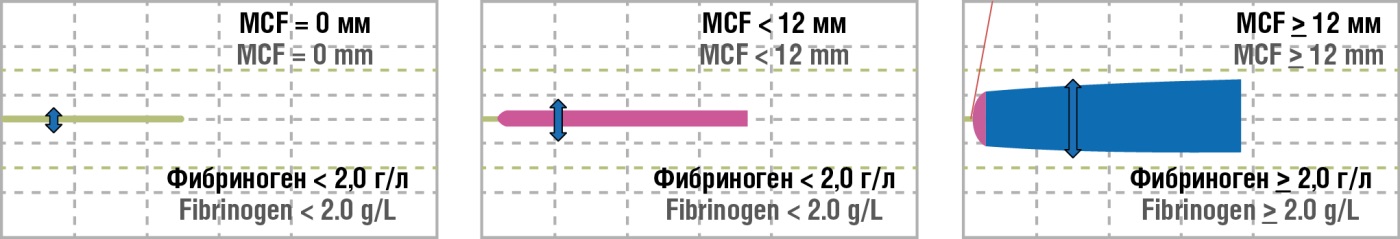
Рисунок 2. Тест FIBTEM в динамике на фоне терапии криопреципитатом.
Figure 2. Dynamic FIBTEM test data during cryoprecipitate therapy.
В нашем исследовании криопреципитат вводили пациенткам, у которых объем кровопотери достигал 2000 мл и более, различия показателей статистически значимы между группами 1 и 3 и между группами 2 и 3 (табл. 3).
Таблица 3. Потребность во введении препаратов и компонентов крови.
Table 3. A requirement for drugs and blood components administration.
|
Препараты и компоненты крови Blood products and components |
Группа 1 / Group 1 n = 19 |
Группа 2 / Group 2 n = 14 |
Группа 3 / Group 3 n = 19 |
р |
|
Свежезамороженная плазма Fresh frozen plasma |
8 (42,1) |
13 (92,9) |
19 (100,0) |
р1–2 = 0,05 р1–3 < 0,001 р2–3 < 0,001 |
|
Препараты протромбинового комплекса Prothrombin complex concentrates |
0 (0,0) |
1 (7,1) |
7 (36,8) |
р1–2 > 0,05 р1–3 = 0,01 р2–3 = 0,004 |
|
Криопреципитат Cryoprecipitate |
0 (0,0) |
0 (0,0) |
9 (47,0) |
р1–2 > 0,05 р1–3 = 0,001 р2–3 = 0,001 |
В группе пациенток с объемом кровопотери до 1500 мл (группа 1) АЧТВ составило 31,6 [ 27,00–38,00] секунд, что не потребовало в этой группе трансфузионной терапии. АЧТВ было повышено уже при объеме кровопотери 1500–1999 мл (группа 2) – 37,45 [ 30,10–39,00] секунд (различия показателей между 1 и 2 группами статистически незначимы) и значительно повышалось при кровопотере 2000 мл и более (группа 3) – 38,00 [ 37,10–47,00] секунд; значения показателя в группах 1 и 2 статистически значимо отличались (р1–3 = 0,023 и р2–3 = 0,018, соответственно) от его значений в группе 3 (рис. 3). ПТИ, в свою очередь, патологически снижался при кровопотере 2000 мл и более (группа 3), достигая 65,0 [ 53,0–74,5]%, статистически значимо отличаясь как от группы 1 (р < 0,001), так и от группы 2 (р = 0,042).

Рисунок 3. Анализ зависимости уровня активированного частичного тромбопластинового времени (АЧТВ) после родов на момент кровотечения с объемом кровопотери.
Примечание: *р < 0,05 – различия статистически значимы по сравнению с группой 1; #р < 0,05 – различия статистически значимы по сравнению с группой 2.
Figure 3. Analyzed relation between activated partial thromboplastin time (aPTT) level after childbirth at the time of bleeding and blood loss volume.
Note: *р < 0.05 – significant differences compared with group 1; #р < 0.05 – significant differences compared with group 2.
Изменение параметров тромбоэластометрии CT и CFT на канале INTEM при развившейся коагулопатии и после ее коррекции представлены на рисунке 4.
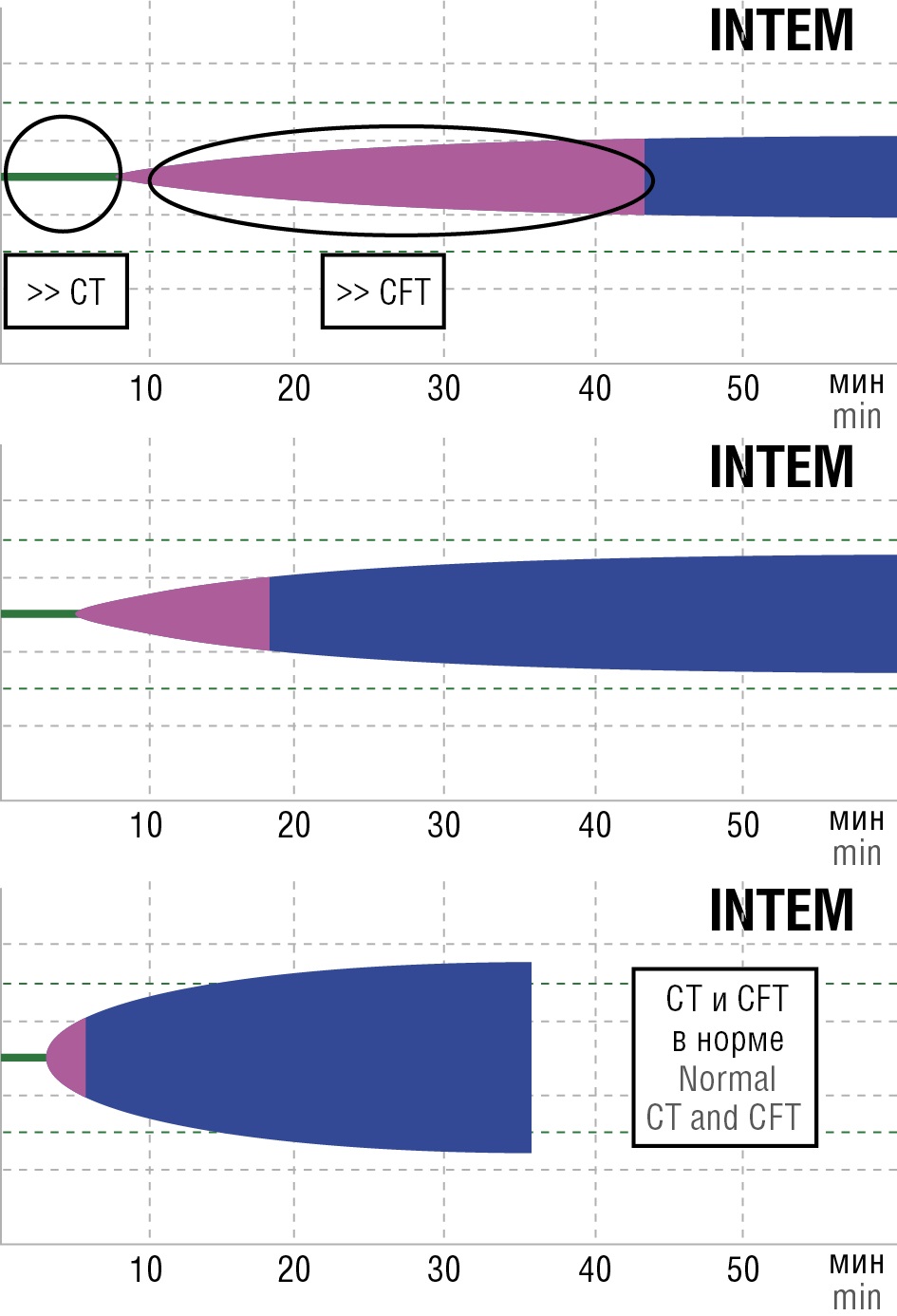
Рисунок 4. Параметры тромбоэластометрии при развившейся коагулопатии и в норме.
Примечание: СТ – время свертывания; CFT – время образования сгустка.
Figure 4. Thromboelastometry parameters in developed coagulopathy and in and normal settings.
Note: CT – clotting time; CFT – clot formation time.
Эта взаимосвязь нашла отражение в трансфузионной терапии. Необходимость в трансфузии СЗП возникала при АЧТВ более 35 секунд в 77 % случаев (среди всех пациенток), при СТ более 260 секунд – в 63 % случаев и при СFT более 110 секунд – в 63 % случаев; различия показателей статистически значимы при сравнении с показателями пациенток, которым не требовалось введение СЗП (р < 0,05). Потребность в плазмотрансфузии возрастала в зависимости от увеличения объема кровопотери (рис. 5).
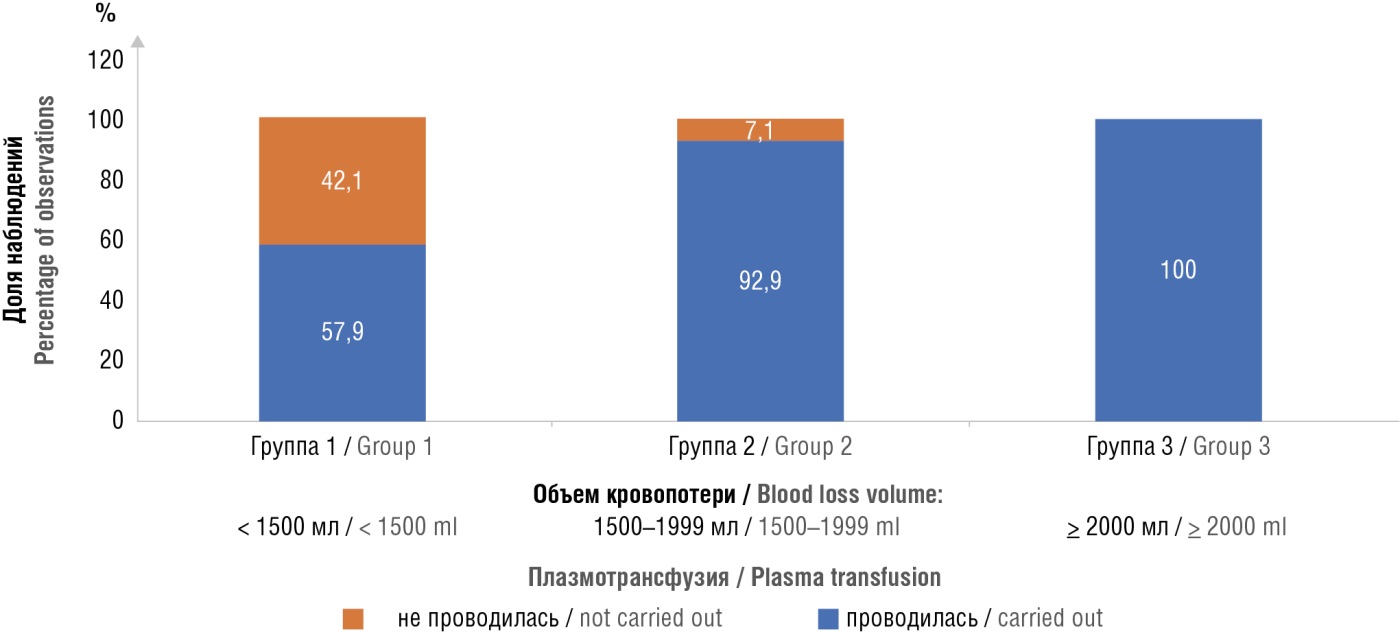
Рисунок 5. Анализ потребности в плазмотрансфузии после родов в зависимости от объема кровопотери.
Figure 5. Analysis of plasma transfusion requirements after childbirth depending on blood loss volume.
Необходимость в ППК возникала при АЧТВ более 35 секунд в 77 % случаев (среди всех пациенток), при СТ более 260 секунд – в 63 % случаев и при СFT более 110 секунд – в 63 % случаев, различия показателей статистически значимы при сравнении с показателями пациенток, которым не требовалось введение ППК (р < 0,05). ППК вводили в 15 % случаев среди всех обследуемых: в одном случае в группе пациенток с кровопотерей от 1500 до 2000 мл (группа 2) и в 7 случаях при кровопотере более 2000 мл (группа 3). В соответствии с полученными изменениями показателей гемостаза, потребность во введении ППК возникала в основном при кровопотере более 2000 мл (рис. 6).
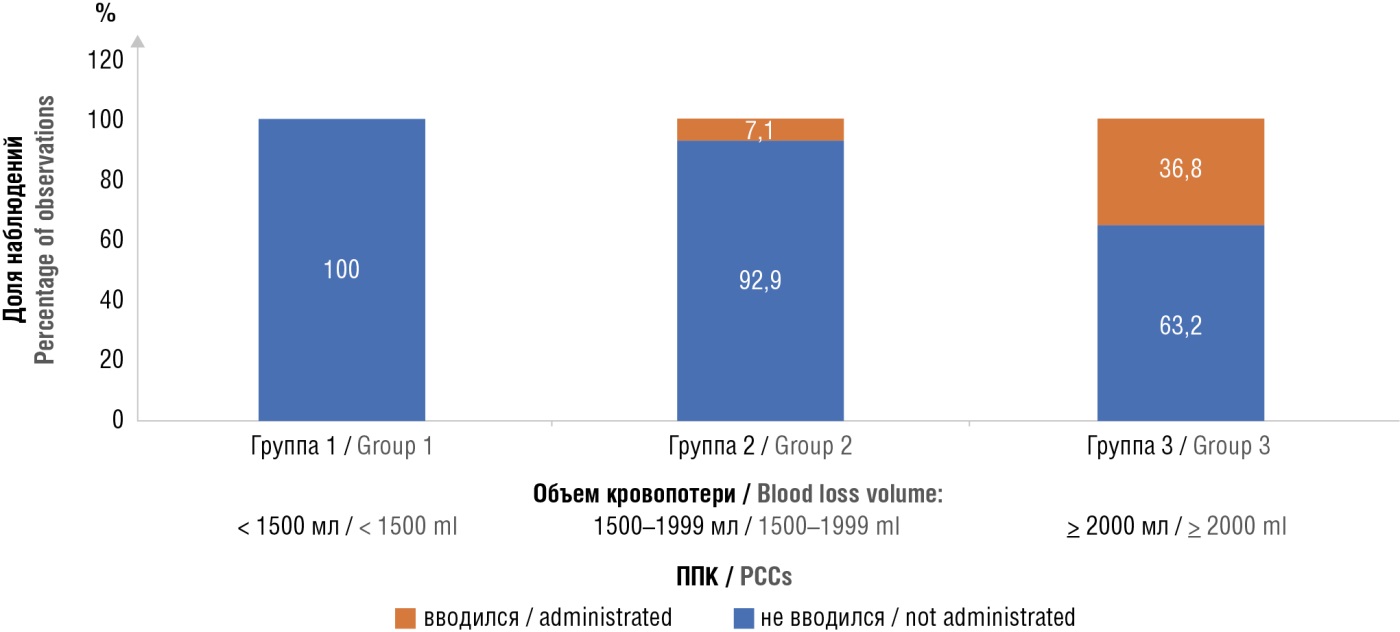
Рисунок 6. Анализ использования препаратов протромбинового комплекса (ППК) в зависимости от объема кровопотери.
Figure 6. Analysis of using prothrombin complex concentrates (PCCs) based on blood loss volume.
Шансы в необходимости введения ППК повышались при значении CT на канале INTEM свыше 280 секунд (точка cut-off), чувствительность и специфичность модели составили 100,0 и 81,5 % соответственно. Площадь под ROC-кривой составила 0,898 ± 0,107 (95 % ДИ = 0,688–1,000). Полученная модель была статистически значимой (p = 0,011).
Количество тромбоцитов составило во всех группах (117,89 ± 44,81)×10⁹/л на момент кровотечения, переливание тромбоконцентрата не потребовалось.
Благодаря протоколу контролируемой трансфузии, в группе женщин с объемом кровопотери до 1500 мл (группа 1) в 57,9 % случаев удалось обойтись без трансфузионной терапии, различия между группами 1 и 2, 1 и 3 статистически значимы (р < 0,05).
Алгоритм лечения коагулопатического послеродового кровотечения / Treatment algorithm for coagulopathic postpartum hemorrhage
Благодаря полученным данным, с учетом достоверно значимых корреляций между стандартными тестами коагуляции и параметрами ТЭМ, а также положительным корреляционным связям между объемом кровопотери, вводимыми препаратами и компонентами крови и вышеуказанными параметрами системы гемостаза, мы усовершенствовали алгоритм лечения коагулопатического ПРК на основе ранее созданных алгоритмов (рис. 7).
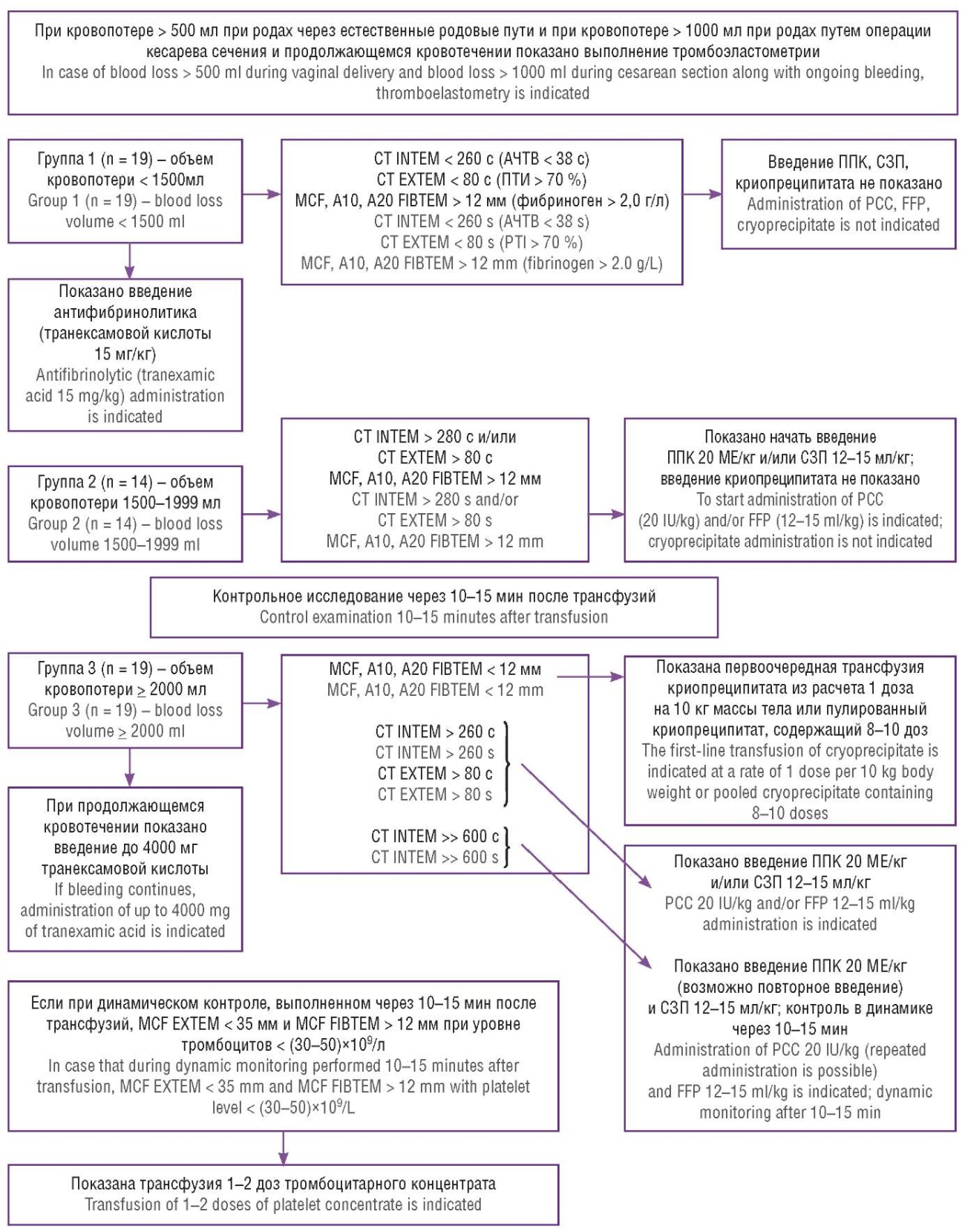
Рисунок 7. Алгоритм лечения коагулопатии при послепослеродовом кровотечении в зависимости от характера нарушений системы гемостаза под контролем вязкоэластических тестов.
Примечание: АЧТВ – активированное частичное тромбопластиновое время; ПТИ – протромбиновый индекс; ППК – препарат протромбинового комплекса; СЗП – свежезамороженная плазма.
Figure 7. Algorithm for treating coagulopathy in postpartum hemorrhage based on the nature of hemostasis disorders assessed by viscoelastic tests.
Note: APTT – activated partial thromboplastin time; PTI – prothrombin index; PСC – prothrombin complex concentrate; FFP – fresh frozen plasma.
Пациенткам из группы 1 с объемом кровопотери < 1500 мл во всех случаях вводили антифибринолитик – транексамовую кислоту из расчета 15 мг/кг с целью подавления фибринолиза и недопущения прогрессирования кровотечения. В этой группе пациенток не всегда требовалось введение препаратов крови и/или трансфузия компонентов крови, так как кровотечение было остановлено хирургическим путем, а по данным ТЭМ все параметры были в пределах нормальных значений и не указывали на наличие коагулопатии (с соответствующим подтверждением стандартными тестами на коагуляцию). Уровень фибриногена у пациенток группы 1 также всегда находился в пределах нормальных значений, т. е. более 2,0 г/л (FIBTEM > 12 мм), и соответственно трансфузия криопреципитата не требовалась. Максимальная плотность сгустка на канале EXTEM была во всех случаях у пациенток группы 1 выше 35 мм, что свидетельствует о стабильности сгустка как за счет фибриногена, так и тромбоцитарного звена. Поэтому трансфузия тромбоконцентрата не требовалась.
В группе 2 пациенток с объемом кровопотери 1500–1999 мл практически во всех случаях требовалось введение СЗП, что обосновывалось патологическим удлинением времени свертывания крови, которое возникло в результате потребления факторов свертывания, и была необходима их дотация. В одном случае дополнительно перед плазмотрансфузией вводился ППК с учетом данных ТЭМ, которые указывали на значительное удлинение времени свертывания крови у данной пациентки. Уровень фибриногена и максимальная плотность сгустка в этой группе также не снижались ниже критического порога, который бы мог указывать на вероятность прогрессирования коагулопатии, поэтому введение криопреципитата также не требовалось. Тромбоцитарное звено пациенток группы 2 также не страдало, и не требовало дополнительных трансфузий.
В группе 3 пациенток с объемом кровопотери 2000 мл и более во всех случаях требовалось введение СЗП, и в трети случаев перед начатом плазмотрансфузии вводился ППК, т. е. у пациенток со значительно удлиненным временем свертывания за счет потребившихся факторов. Введение криопреципитата потребовалось в половине случаев, т. е. у тех пациенток, у которых развилась вторичная коагулопатия, и уже критически потребился фибриноген – ниже 2,0 г/л, и параметр MCF на канале FIBTEM составил менее 12 мм. Введение СЗП вместо криопреципитата еще больше усугубит коагулопатию за счет разведения плазмы пациентки. Вероятнее всего после адекватного хирургического лечения и больших объемов плазмотрансфузий мы остановим кровотечение и справимся с коагулопатией, однако у таких пациенток чаще будут наблюдаться посттрансфузионные осложнения (трансфузионная циркуляторная перегрузка и/или связанное с трансфузией острое повреждение легких) и реакции, а также потребуются большие объемы как плазмотрансфузий, так и гемотрансфузий. Все вероятно возникшие осложнения будут удлинять время пребывания этих пациенток в палате интенсивной терапии и негативно влиять на качество их дальнейшей жизни. Введение тромбоконцентрата пациенткам группы 3 также не требовалось, что обосновывалось наибольшей вовлеченностью в коагулопатию факторов свертывания и в первую очередь фибриногена. Сохраненная активность и адекватная функция тромбоцитарного звена находила отражение на канале EXTEM, где MCF снижалась, но лишь за счет фибриногена (так как параллельно оценивая FIBTEM, мы всегда видели его снижение ниже критического уровня), а после коррекции гемостаза трансфузией криопреципитата мы в динамике наблюдали нормальные значения MCF как на канале EXTEM, так и на канале FIBTEM.
Обсуждение / Discussion
Принцип лечения кровотечения, основанный на трансфузии компонентов крови в определенных соотношениях, не корригирует коагулопатию и не уменьшает смертность среди больных с массивным кровотечением [16][17]. Применение алгоритма массивной трансфузии не останавливает кровотечение, оно просто позволяет выиграть время для выявления причин кровотечения (коагулопатия и/или хирургические причины) и проведения адекватных гемостатических вмешательств для остановки кровотечения. Некоторые учреждения используют гибридный подход, который заключается в том, что начинают с массивных трансфузий компонентов крови в определенных соотношениях до тех пор, пока не будут получены данные исследования системы гемостаза и не появится возможность проведения более эффективной целевой гемостатической терапии [18].
Трансфузию компонентов и препаратов крови следует проводить только в случае наличия коагулопатии [2]. Комитет по науке и стандартизации Международного общества по тромбозам и гемостазу по проблемам женского здоровья и диссеминированного внутрисосудистого свертывания (ДВС) рекомендовал не проводить трансфузии СЗП, если показатели гемостаза по результатам лабораторных методов и вязкоэластических тестов в норме, а также не рекомендуется криопреципитат или концентрат фибриногена без мониторинга его содержания в крови [19].
В исследовании, проведенном P.W. Collins с соавт., показано, что А5 (максимальная амплитуда плотности сгустка через 5 минут после CT) на канале FIBTEM является лучшим предиктором прогрессии послеродового кровотечения с суммарной кровопотерей более 2500 мл, чем плазменная концентрация фибриногена, определенная по методу Клауса. У женщин с прогрессирующим послеродовым кровотечением плазменная концентрация фибриногена и А5 на канале FIBTEM составили, соответственно, 2,1 [ 1,8–3,4] г/л и 12 [ 7–17] мм по сравнению с 3,9 [ 3,2–4,5] г/л и 19 [ 17–23] мм у женщин, у которых прогрессии кровотечения не было [20]. В нашем исследовании также удалось установить положительную корреляционную связь между уровнем фибриногена, максимальной амплитудой плотности сгустка через 10 минут после CT и максимальной плотностью сгустка, которые являются основными предикторами коагулопатии и играют ключевую роль в прогрессировании массивного кровотечения.
Также мы показали, что имеется положительная корреляционная связь между различными объемами кровопотери и уровнем фибриногена и MCF, однако не во всех случаях следует ориентироваться на объем кровопотери и начинать трансфузионную терапию. Так, по данным рандомизированных контролируемых исследований, превентивная терапия концентратом фибриногена ПРК при предполагаемой кровопотере > 1500 мл была неэффективной, поскольку средняя концентрация фибриногена плазмы составила 4,5 ± 1,2 г/л [21].
Уменьшение генерации тромбина редко является причиной послеродовых кровотечений, однако может возникать при продолжающемся кровотечении и гемодилюции. Об этом дефекте свидетельствует удлинение CT и CFT по данным ТЭМ и удлинение АЧТВ, соответственно, что позволит принять решение о необходимости введения ППК и/или трансфузии СЗП. В существующих алгоритмах говорится о том, что следует ориентироваться вначале на удлинение СТ на EXTEM, затем на CT на канале INTEM, и при удлинении первого параметра вводить ППК или СЗП (однако следует уточнить, что если уже начата трансфузия СЗП, то введение ППК уже нецелесообразно), а при удлинении второго параметра вводить СЗП или рекомбинантный активированный фактор свертывания VII [22][23]. В проведенном нами исследовании и в описании алгоритма действий одновременно учитывались СТ на каналах EXTEM и INTEM, что объясняется клеточной моделью, в которой внешний и внутренний пути работают вместе, образуя тромбин либо на поверхности поврежденного сосуда (внешний путь), либо на поверхности тромбоцитов (внутренний путь) [24]. Поэтому, когда происходит прогрессирование ПРК, страдают оба пути свертывания, и мы видим удлинение на обоих каналах ТЭМ.
Что касается тромбоцитарного звена гемостаза, в существующих зарубежных алгоритмах на основании ТЭМ говорится о показании к введению тромбоконцентрата в случае А5 < 35 мм на канале EXTEM и параллельно A5 > 12 мм на канале FIBTEM [23]. В нашем исследовании никому из обследованных пациенток введение тромбоконцентрата не потребовалось. А также снижение амплитуды MCF и А10 при прогрессирующем кровотечении всегда наблюдалось и на канале EXTEM и на канале FIBTEM, что еще раз указывает на наибольшую значимость фибриногена в генезе развития коагулопатии.
На основании полученных результатов нам удалось достигнуть цели исследования, и мы обосновали дифференцированный подход к лечению коагулопатии при акушерском кровотечении. Однако здесь не представлен сравнительный анализ лечения ПРК по протоколу массивной трансфузии и по алгоритму ТЭМ, а также характер исходов и осложнений МАК и трансфузионной терапии в зависимости от применяемого протокола.
Существует множество исследований, в том числе и наше, показывающие преимущества целенаправленного лечения ПРК по алгоритму ТЭМ, однако необходимы более масштабные исследования и метаанализы для систематизации данных и создания более совершенного алгоритма.
Заключение / Conclusion
Проведенный анализ позволил усовершенствовать алгоритм лечения акушерской коагулопатии, используя параметры ТЭМ, и выявить новые параметры, коррелирующие с лабораторными показателями и объемом кровопотери.
Алгоритм лечения коагулопатического акушерского кровотечения под контролем вязкоупругих методов более эффективен с точки зрения быстрого принятия решений, избежания чрезмерного переливания продуктов крови и связанных с этим осложнений, чем традиционная трансфузия компонентов крови на основе протокола массивной трансфузии.
Список литературы
1. Jokinen S., Kuitunen A., Uotila J., Yli-Hankala A. Thromboelastometry-guided treatment algorithm in postpartum haemorrhage: a randomised, controlled pilot trial. Br J Anaesth. 2023;130(2):165–74. https://doi.org/10.1016/j.bja.2022.10.031.
2. Solomon C., Collis R.E., Collins P.W. Haemostatic monitoring during postpartum haemorrhage and implications for management. Br J Anaesth. 2012;109(6):851–63. https://doi.org/10.1093/bja/aes361.
3. Prevention and management of postpartum haemorrhage: Green-top Guideline No. 52. BJOG. 2016;124(5):e106–е149. https://doi.org/10.1111/1471-0528.14178.
4. de Lloyd L., Bovington R., Kaye A. et al. Standard haemostatic tests following major obstetric haemorrhage. Int J Obstet Anesth. 2011;20(2):135–41. https://doi.org10.1016/j.ijoa.2010.12.002.
5. Charbit B., Mandelbrot L., Samain E. et al.; PPH Study Group. The decrease of fibrinogen is an early predictor of the severity of postpartum hemorrhage. J Thromb Haemost. 2007;5(2):266–73. https://doi.org/10.1111/j.1538-7836.2007.02297.x.
6. Simon L., Santi T.M., Sacquin P., Hamza J. Pre-anaesthetic assessment of coagulation abnormalities in obstetric patients: usefulness, timing and clinical implications. Br J Anaesth. 1997;78(6):678–83. https://doi.org/10.1093/bja/78.6.678.
7. Gayat E., Resche-Rigon M., Morel O. et al. Predictive factors of advanced interventional procedures in a multicentre severe postpartum haemorrhage study. Intensive Care Med. 2011;37(11):1816–1825. https://doi.org/10.1007/s00134-011-2315-0.
8. Клинические рекомендации – Послеродовое кровотечение – 2021-2022-2023 (16.01.2023). М.: Министерство здравоохранения Российской Федерации, 2023. 56 с. Режим доступа: http://disuria.ru/_ld/12/1271_kr21O67O72MZ.pdf. [Дата доступа: 15.08.2024].
9. Mallaiah S., Barclay P., Harrod I. et al. Introduction of an algorithm for ROTEM-guided fibrinogen concentrate administration in major obstetric haemorrhage. Anaesthesia. 2015;70(2):166–75. https://doi.org/10.1111/anae.12859.
10. Mu?oz M., Stensballe J., Ducloy-Bouthors A.S. et al. Patient blood management in obstetrics: prevention and treatment of postpartum haemorrhage. A NATA consensus statement. Blood Transfus. 2019;17(2):112–36. https://doi.org/10.2450/2019.0245-18.
11. Collins P.W., Lilley G., Bruynseels D. et al. Fibrin-based clot formation as an early and rapid biomarker for progression of postpartum hemorrhage: a prospective study. Blood. 2014;124(11):1727–36. https://doi.org/10.1182/blood-2014-04-567891.
12. Collins P.W., Cannings-John R., Bruynseels D. et al. Viscoelastometric-guided early fibrinogen concentrate replacement during postpartum haemorrhage: OBS2, a double-blind randomized controlled trial. Br J Anaesth. 2017;119(3):411–21. https://doi.org/10.1093/bja/aex181.
13. Liew-Spilger A.E., Sorg N.R., Brenner T.J. Viscoelastic hemostatic assays for postpartum hemorrhage. J Clin Med. 2021;10(17):3946. https://doi.org/10.3390/jcm10173946.
14. Khanna P., Sinha C., Singh A.K. et al. The role of point of care thromboelastography (TEG) and thromboelastometry (ROTEM) in management of Primary postpartum haemorrhage: A meta-analysis and systematic review. Saudi J Anaesth. 2023;17(1):23–32. https://doi.org/10.4103/sja.sja_529_22.
15. Huissoud C., Carrabin N., Audibert F. et al. Bedside assessment of fibrinogen level in postpartum haemorrhage by thrombelastometry. BJOG. 2009;116(8):1097–102. https://doi.org/10.1111/j.1471-0528.2009.02187.x.
16. McNamara H., Mallaiah S. Managing coagulopathy following PPH. Best Pract Res Clin Obstet Gynaecol. 2019;61:106–20. https://doi.org/10.1016/j.bpobgyn.2019.04.002.
17. Balvers K., van Dieren S., Baksaas-Aasen K. et al.; Targeted Action for Curing Trauma-Induced Coagulopathy (TACTIC) Collaborators. Combined effect of therapeutic strategies for bleeding injury on early survival, transfusion needs and correction of coagulopathy. Br J Surg. 2017;104(3):222–29. https://doi.org/10.1002/bjs.10330.
18. McQuilten Z.K., Crighton G., Brunskill S. et al. Optimal dose, timing and ratio of blood products in massive transfusion: results from a systematic review. Transfus Med Rev. 2018;32(1):6–15. https://doi.org/10.1016/j.tmrv.2017.06.003.
19. Winearls J., Reade M., Miles H. et al. Targeted coagulation management in severe trauma: the controversies and the evidence. Anesth Analg. 2016;123(4):910–24. https://doi.org/10.1213/ANE.0000000000001516.
20. Collins P., Abdul-Kadir R., Thachil J.; Subcommittees on Women's Health Issues in Thrombosis and Haemostasis and on Disseminated Intravascular Coagulation. Management of coagulopathy associated with postpartum hemorrhage: guidance from the SSC of the ISTH. J Thromb Haemost. 2016;14(1):205–10. https://doi.org/10.1111/jth.13174.
21. Wikkels A.J., Edwards H.M., Afshari A. et al.; FIB-PPH trial group. Pre-emptive treatment with fibrinogen concentrate for postpartum haemorrhage: randomized controlled trial. Br J Anaesth. 2015;114(4):623–33. https://doi.org/10.1093/bja/aeu444.
22. de Lange N.M., van Rheenen-Flach L.E., Lanc? M.D. et al. Peri-partum reference ranges for ROTEM(R) thromboelastometry. Br J Anaesth. 2014;112(5):852–9. https://doi.org/10.1093/bja/aet480.
23. Girlinger K., Pirez-Ferrer A., Dirkmann D. et al. The role of evidence-based algorithms for rotational thromboelastometry-guided bleeding management. Korean J Anesthesiol. 2019;72(4):297–322. https://doi.org/10.4097/kja.19169.
24. Katz D., Beilin Y. Disorders of coagulation in pregnancy. Br J Anaesth. 2015;115 Suppl 2:ii75–ii88. https://doi.org/10.1093/bja/aev374.
Об авторах
Т. А. СушкоРоссия
Сушко Татьяна Андреевна
192014 Санкт-Петербург, ул. Маяковского, д. 5
М. С. Зайнулина
Россия
Зайнулина Марина Сабировна, д.м.н., проф.
Scopus Author ID: 37076359000
WoS ResearcherID: B-5746-2018
192014 Санкт-Петербург, ул. Маяковского, д. 5
195271 Санкт-Петербург, Кондратьевский проспект, д. 72, лит. А
Что уже известно об этой теме?
► Первым фактором свертывания, снижающимся при кровотечении и приводящим к коагулопатии, является фибриноген. Уровень фибриногена при послеродовом кровотечении (ПРК) может с высокой долей вероятности спрогнозировать прогрессирование и тяжесть кровотечения.
► Восполнение уровня фибриногена посредством криопреципитата и его контроль при массивном акушерском кровотечении возможен только при использовании алгоритма на основе вязкоупругих тестов.
► Использование параметров тромбоэластометрии (ТЭМ) и знание их корреляции с коагулологическими тестами позволяет избегать необоснованных трансфузий.
Что нового дает статья?
► Связь параметров коагулологических тестов, параметров ТЭМ и объема кровопотери позволяет заведомо предположить необходимый план действий при ПРК.
► При объеме кровопотери до 2000 мл не всегда требуется трансфузионная терапия, при определенных потребностях можно обойтись препаратами протромбинового комплекса.
► Трансфузия тромбоконцентрата в случае кровотечения у акушерских пациенток требуется в крайне редких случаях.
Как это может повлиять на клиническую практику в обозримом будущем?
► Совершенствование алгоритма лечения массивного акушерского кровотечения с использованием параметров ТЭМ позволит в короткие сроки выявить или исключить дефекты в системе гемостаза и правильно его скорректировать.
► Целенаправленная терапия акушерских кровотечений позволит снизить количество необоснованных трансфузий и улучшить течение послеродового периода.
Рецензия
Для цитирования:
Сушко Т.А., Зайнулина М.С. Патогенетический подход к лечению коагулопатического кровотечения в акушерстве. Акушерство, Гинекология и Репродукция. 2025;19(2):216-229. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.557
For citation:
Sushko T.A., Zainulina M.S. Pathogenetic approach to the treatment of coagulopathic bleeding in obstetrics. Obstetrics, Gynecology and Reproduction. 2025;19(2):216-229. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.557

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































