Перейти к:
Прогнозирование возникновения миомы матки у женщин репродуктивного возраста с помощью нейронной сети
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.605
Аннотация
Цель: создать модель прогноза возникновения лейомиомы матки (ЛМ) на основе анализа факторов риска с помощью нейронной сети и оценить ее прогностические характеристики.
Материалы и методы. В период с 2022 г. по 2024 г. выполнено ретроспективное исследование «случай–контроль» 209 пациенток в возрасте 20–47 лет, среди которых были выделены 2 группы: группа 1 – 106 женщин с ЛМ, группа 2 – 103 пациентки без ЛМ. Проведена предварительная обработка данных с последующим количественным анализом взаимосвязи факторов риска с развитием ЛМ с помощью нейросетевого анализа. Для создания прогностической модели возникновения ЛМ применялся метод многослойного перцептрона.
Результаты. В ходе проведенного исследования программой было отобрано 12 факторов, имевших статистически значимые различия при сравнении 2 групп: индекс массы тела (ИМТ), возраст менархе, число абортов и самопроизвольных абортов, возраст первых родов, наличие артериальной гипертензии (АГ), доброкачественных образований яичников, экстракорпоральное оплодотворение в анамнезе, уровень антимюллерова гормона, количество беременностей, содержание холестерина и глюкозы в крови. Точность прогноза разработанной модели составила 92,3 %, чувствительность – 90,6 %, специфичность – 94,2 %. Прогностическая ценность подтверждена с помощью ROC-анализа – площадь под кривой составила 0,93 (95 % доверительный интервал = 0,91–0,94; р < 0,001), что доказывает перспективность данного метода для клинической практики. В число модифицируемых и потенциально-модифицируемых факторов вошли повышенный ИМТ, наличие АГ, доброкачественные новообразования яичников, содержание холестерина и глюкозы. Эти факторы представляются наиболее актуальными ввиду возможности оказать на них прямое или непрямое воздействие, что доказывает значимость превентивного подхода к данному заболеванию.
Заключение. Разработанная модель является эффективным инструментом прогноза возникновения ЛМ (точность 92,3 %), использование которой в клинической практике позволит изменить устоявшуюся парадигму радикального лечения на превентивный подход.
Ключевые слова
Для цитирования:
Зиганшин А.М., Дикке Г.Б., Янбарисова А.Р. Прогнозирование возникновения миомы матки у женщин репродуктивного возраста с помощью нейронной сети. Акушерство, Гинекология и Репродукция. 2025;19(2):180-191. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.605
For citation:
Ziganshin A.M., Dikke G.B., Yanbarisova A.R. A neural network for predicting occurrence of uterine fibroids in women of reproductive age. Obstetrics, Gynecology and Reproduction. 2025;19(2):180-191. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.605
Введение / Introduction
Лейомиома матки (ЛМ) занимает лидирующие позиции в структуре заболеваний женских половых органов, находясь на втором месте среди всех гинекологических заболеваний [1]. Распространенность ЛМ составляет от 20 до 77 %, а число диагностированных случаев – 40–60 % в возрасте от 20 до 35 лет и 70–80 % среди женщин старше 50 лет. Результаты исследования Global Breden of Disease, которое проводилось в период с 1990 г. по 2019 г. и охватило более 200 стран мира, показали увеличение количества случаев заболеваемости ЛМ с 5,8 млн в 1990 г. до 9,6 млн в 2017 г. [2]. При этом доля женщин с ЛМ, у которых есть клинические проявления (от одного или нескольких симптомов), варьирует в зависимости от ее размера и локализации узлов и по разным данным составляет в среднем до 60 % женщин [3–5], а у 53,7 % имеются симптомы достаточно серьезные, оказывающие влияние на трудоспособность [6]. Таким образом, рост числа случаев ЛМ и ее «омоложение» становится обременительным для пациентов и государства с точки зрения снижения качества жизни, производительности труда и стоимости лечения.
Важным аспектом являются механизмы влияния ЛМ на фертильность: каждая пятая женщина с ЛМ сталкивается с бесплодием, а среди пациенток с первичным бесплодием ЛМ обнаруживают у каждой третьей [7].
В настоящее время применяется множество органосохраняющих методов лечения. У женщин в возрасте до 40 лет с целью сохранения репродуктивной функции методом выбора является миомэктомия, частота которой колеблется в разных регионах от 15,8 до 86 %. При симптоматических ЛМ также может быть выполнена эмболизация маточных артерий (ЭМА), которая обеспечивает снижение объема менструальных кровотечений на 85–94 %, частоты дисменореи – у 77–79 % пациентов, уменьшение среднего объема матки – у 30–60 % женщин и улучшение качества жизни – у 95% [8][9]. Но А.Н. Стрижаков с соавт. (2011) подчеркивают стабильность ядра миоматозного узла при условии полной ишемии опухолевого образования [10]. Таким образом, и после консервативной миомэктомии и после ЭМА риск рецидивов ЛМ и последующих вмешательств является значительным – от 7 до 25 % женщинам требуется повторная операция в течение 2 лет после миомэктомии, от 15 до 32 % – после ЭМА [9][11].
Фармакотерапия при ЛМ тоже имеет свои особенности и в большей степени является лишь вспомогательным методом. Систематический обзор сообщает, что в исследованиях, в которых женщинам назначалась лекарственная терапия ЛМ в качестве альтернативы хирургическому лечению, 60 % пациенток перенесли операцию в течение 2 лет после этого [12]. А.Н. Стрижаков с соавт. (2011) в своей работе объясняют это формированием в миоме локальных независимых механизмов пролиферации опухоли [10]. Таким образом, ЛМ способна поддерживать свой потенциал к росту даже в отсутствие гормональной стимуляции. Сегодня активно исследуется эффективность применения селективного модулятора прогестероновых рецепторов (СМПР) в лечении ЛМ. Отечественные исследователи задаются вопросом вероятности рецидива и долгосрочной безопасности использования СМПР как альтернативы хирургическим методам [13]. К тому же многие из этих препаратов имеют значительный профиль побочных эффектов, который ограничивает продолжительность лечения; также метод финансово обременителен для пациента.
Таким образом, совокупность патогенетических механизмов развития ЛМ крайне снижает шансы успешного лечения заболевания с помощью любых консервативных и органосберегающих хирургических методов.
На сегодня единственным эффективным методом лечения ЛМ является тотальная гистерэктомия [14][15]. Согласно аналитическому обзору, выполненному B.J. Borah (2017), гистерэктомия была проведена у 82,2 % женщин с ЛМ в возрасте от 18 до 54 лет [16]. В Российской Федерации этот показатель составляет 50–70 % от общего числа заболеваний матки, из них 30 % приходится на пациенток репродуктивного возраста [6]. Несмотря на эффективность радикального лечения, оно имеет отдаленные последствия, и одна только гистерэктомия (без овариоэктомии) была связана с увеличением частоты сердечно-сосудистых заболеваний, пролапсов и ухудшением когнитивных функций, включая болезни Альцгеймера и Паркинсона [12]. По оценкам, в США ежегодные прямые затраты на гистерэктомию составляли от 0,78 до 3,5 млрд долларов, а затраты, связанные со снижением производительности труда, варьировались от 0,55 до 9,35 млрд долларов в год. Расходы на здравоохранение и связанные с ними косвенные издержки, такие как потеря денежного дохода из-за инвалидности и временного отсутствия на работе, создавали значительное социальное и экономическое бремя [17].
Сегодня наибольший интерес представляет изучение методов прогнозирования возникновения патологии и поиск точек приложения. Этот вопрос в современной научной литературе освещен недостаточно. Этиология и патогенез ЛМ много десятилетий являются предметом непрекращающихся дискуссий и интенсивных исследований. До настоящего времени проблема определения основы взаимосвязи между выделенными факторами риска и развитием ЛМ остается открытой [7]. Гормональные нарушения, генетическую предрасположенность рассматривают в качестве причин ЛМ, но точная этиология заболевания не установлена, методы прогнозирования отсутствуют, а число новых выявленных случаев не имеет тенденции к снижению [18].
Искусственный интеллект (ИИ) – революционная технология, которая может быть эффективно внедрена в область акушерства и гинекологии и в настоящее время позиционируется как важная часть клинической практики. Постепенно ИИ, медицинская информатика внедряются в медицину в качестве метода для диагностики заболеваний, обработки снимков, статистического анализа, прогнозирования заболеваний и осложнений. Данная инновация обладает большим потенциалом для применения в здравоохранении [19][20]. Работ по применению нейросетевого анализа в прогнозировании ЛМ в базах научных публикаций на момент написания данной работы нами не найдено.
Цель: создать модель прогноза возникновения ЛМ на основе анализа факторов риска с помощью нейронной сети и оценить ее прогностические характеристики.
Материалы и методы/ Materials and Methods
Дизайн исследования / Study design
В период с 2022 г. по 2024 г. на базе кафедры акушерства и гинекологии № 2 ФГБОУ ВО БГМУ Минздрава России и гинекологического отделения ГБУЗ «Республиканская клиническая больница имени Г.Г. Куватова» выполнено ретроспективное исследование 209 пациенток в возрасте 20–47 лет. Изучение причинно-следственной связи факторов риска с возникновением ЛМ осуществлялось с помощью аналитического исследования «случай–контроль». Сформированы 2 группы исследования: группа 1 (основная) – пациентки с ЛМ (n = 106); группа 2 (контрольная) – пациентки, чей гинекологический анамнез не был отягощен данным заболеванием (n = 103).
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения в основную группу: репродуктивный возраст; наличие миоматозных узлов; наличие информированного добровольного письменного согласия.
Критерии включения в контрольную группу: репродуктивный возраст; отсутствие миомы матки; наличие информированного добровольного письменного согласия.
Критерии исключения: перименопаузальный период; рак тела матки, шейки матки, яичников или молочной железы; беременность; лактация; кровотечение из влагалища неясной этиологии или по причинам, не связанным с ЛМ; аденомиоз; острые инфекционные заболевания; отказ от участия в исследовании.
Методы исследования / Study methods
В данной работе применялся комплексный подход, включающий социологические, клинические, лабораторные, инструментальные и современные статистические методы исследования. В клинические методы исследования вошли изучение особенностей анамнеза заболевания, клинических проявлений, наследственности, особенностей менструальной, половой и репродуктивной функции, наличие гинекологических и соматических заболеваний, профессиональных вредностей, образа жизни, измерение антропометрических данных (рост, масса тела). Результаты лабораторных и инструментальных исследований, внесенные в работу, были получены в ходе ежегодного медицинского осмотра и диспансеризации населения.
На основании оценки полученных результатов обследования пациенток определены следующие факторы риска: модифицируемые, немодифицируемые, потенциально модифицируемые. После предварительной обработки данных проведен количественный анализ степени влияния факторов риска.
Методы статистического анализа / Statistic alanalysis
Для статистической обработки данных применяли программу SPSS Statistics Version 25.0 (IBM, США). Оценку данных проводили с использованием метода описательной статистики и непараметрических критериев. Для проверки гипотезы о распределении параметров в двух группах пациенток применяли непараметрический критерий Колмогорова–Смирнова. Признаки выражали в виде абсолютных чисел (n), относительных величин (%), среднего арифметического (М), стандартного отклонения (SD), медианы (Ме) и межквартильного диапазона [Q1; Q3]. Сравнение выборок проводили с помощью U-критерия Манна–Уитни–Уилкоксона и критерия χ² Пирсона. Различия оценивали как значимые при вероятности ошибки р < 0,05. Оценивали разброс данных с помощью расчета 95 % доверительного интервала (ДИ).
Для разработки модели, позволяющей прогнозировать развитие ЛМ, использовали встроенный модуль Neural Networks программы SPSS Statistics Version 25.0 (IBM, США). В основе лежал метод многослойного перцептрона. Важность факторов определяли нейросетевым анализом данных. Выделенные параметры анализировали в программе для получения оценки вероятности развития ЛМ. Прогностическую ценность определяли с помощью ROC-анализа. Информативность модели оценивали путем определения специфичности и чувствительности.
Результаты / Results
Клинико-анамнестическая характеристика / Clinical and anamnestic characteristics
Проведен сравнительный анализ между группами «случай» и «контроль» на основании данных анамнеза, результатов клинических, лабораторных и инструментальных исследований (табл. 1). Медианный возраст пациенток группы 1 составил 40,0 [ 36,0; 45,0] лет, в группе 2 – 34,0 [ 31,0; 38,0] года (р < 0,001). Результаты не показали положительного влияния на возникновение ЛМ следующих факторов: места проживания, семейного положения, образования, физической активности, наличия вредных привычек (курение, употребление алкоголя). Ожирение у пациенток группы 1 было зафиксировано в 25,5 % случаев, тогда как в группе 2 – у 6,8 % пациенток (р < 0,001).
Таблица 1. Общая характеристика пациенток.
Table 1. General patients characteristics.
|
Показатель Parameter |
Группа 1 Group 1 n = 106 |
Группа 2 Group 1 n = 103 |
р |
|
Образование и социальный статус / Education and social status |
|||
|
Высшее, ученая степень, % / Higher, academic degree, % |
60,4 |
65,0 |
0,72 |
|
Средне-специальное, среднее, % / Secondary specialized, secondary, % |
39,6 |
34,9 |
|
|
Работает, % / Employed, % |
89,6 |
83,5 |
0,19 |
|
Домохозяйка, % / Housewife, % |
10,4 |
16,5 |
|
|
Семейное положение / Family status |
|||
|
Замужем, гражданский брак, % / Married, civil marriage, % |
88,7 |
86,4 |
0,92 |
|
Не замужем, разведена, % / Single, divorced, % |
11,3 |
13,6 |
|
|
Вредные привычки / Bad habits |
|||
|
Алкоголь, % / Alcohol, % |
8,5 |
4,9 |
0,29 |
|
Курение, % / Smoking, % |
9,4 |
7,8 |
0,67 |
|
Менструальная функция / Menstrual function |
|||
|
Менархе до 12 лет, % / Menarche before 12 years, % |
8,5 |
3,9 |
0,02 |
|
Менархе в 12 лет и старше, % / Menarche at 12 years and older, % |
91,5 |
96,1 |
|
|
Продолжительность менструаций 2 дня и менее, % / Duration of menstruation 2 days or less, % |
0,0 |
0,0 |
1,0 |
|
Продолжительность менструаций 9 дней и более, % / Duration of menstruation 9 days or more, % |
27,4 |
0 |
0,00 |
|
Менструальный цикл 23 дня и более, % / Menstrual cycle 23 days or less, % |
0,0 |
0,0 |
1,0 |
|
Менструальный цикл 39 дней и более, % / Menstrual cycle 39 days or more, % |
5,7 |
8,7 |
0,38 |
|
Объем менструаций 5 мл и менее, % / Menstrual flow volume 5 ml or less, % |
0,0 |
0,0 |
1,0 |
|
Объем менструаций 80 мл и более, % / Menstrual flow volume 80 ml or more, % |
40,6 |
6,8 |
0,00 |
|
Нерегулярный характер менструаций, % / Irregular menstruation, % |
5,7 |
8,7 |
0,38 |
|
Репродуктивная функция / Reproductive function |
|||
|
Первичное бесплодие, % / Primary infertility, % |
12,5 |
7,5 |
0,11 |
|
Вторичное бесплодие, % / Secondary infertility, % |
8,3 |
5,0 |
|
|
Аборты, % / Abortions, % |
44,3 |
18,4 |
< 0,001 |
|
Выкидыши, % / Miscarriages, % |
25,5 |
12,6 |
0,03 |
|
ЭКО в анамнезе, % / IVF history, % |
16,0 |
66,9 |
0,03 |
|
Контрацепция / Contraception |
|||
|
Не использовала, % / Not used, % |
53,8 |
43,7 |
0,07 |
|
Презерватив, % / Condom, % |
33 |
42,7 |
|
|
Комбинированные оральные контрацептивы, % / Combined oral contraceptives, % |
11,3 |
10,7 |
|
|
Внутриматочные контрацептивы, % / Intrauterine contraceptives, % |
0,0 |
2,9 |
|
|
Хирургическая стерилизация, % / Surgical sterilization, % |
1,9 |
0,0 |
|
|
Гинекологические заболевания в анамнезе / Gynecological diseases in history |
|||
|
Инфекции, передаваемые половым путем, % / Sexually transmitted infections, % |
2,8 |
1,9 |
0,67 |
|
Доброкачественные новообразования яичников, % / Benign ovarian neoplasms, % |
17,0 |
4,9 |
< 0,001 |
|
Соматические заболевания в анамнезе / Somatic diseases in history |
|||
|
Болезни сердечно-сосудистой системы, % / Cardiovascular diseases, % |
19,8 |
3,9 |
< 0,001 |
|
Заболевания щитовидной железы, % / Thyroid diseases, % |
5,7 |
5,8 |
0,96 |
|
Нарушения жирового обмена, % / Fat metabolism disorders, % |
25,5 |
6,8 |
< 0,001 |
Примечание: ЭКО – экстракорпоральное оплодотворение; разность показателей между группами оценивалась по критерию χ²; выделены значимые различия.
Note: IVF – in vitro fertilization; differences in inter-group parameters were assessed using the χ² criterion; significant differences are highlighted in bold.
Средний размер матки у пациенток группы 1 соответствовал 8,0 [ 7,0; 10,0] неделям беременности, возраст первичного выявления ЛМ – 34,5 [ 30,0; 41,0] года, длительность заболевания – 3,0 [ 1,0; 5,5] года, количество миоматозных узлов – 2,0 [ 1,0; 3,0], их размер составлял 34,0 [ 22,0; 49,0] мм.
Данные акушерско-гинекологического анамнеза и результаты лабораторных исследований представлены в таблице 2.
Таблица 2. Акушерско-гинекологический анамнез и результаты лабораторного исследования.
Table 2. Obstetric and gynecological history and laboratory test results.
|
Показатель Parameter |
Группа 1 / Group 1 n = 106 |
Группа 2 / Group 1 n = 103 |
р |
||
|
Me |
Q1; Q3 |
Me |
Q1; Q3 |
||
|
Акушерско-гинекологический анамнез / Obstetric and gynecological history |
|||||
|
Коитархе, лет / Coitarche, years |
19,0 |
18,0; 20,0 |
19,0 |
18,0; 19,0 |
0,531 |
|
Количество беременностей, n / Number of pregnancies, n |
3,0 |
1,0; 4,0 |
2,0 |
1,0; 2,0 |
0,001 |
|
Интергенетический интервал, лет / Intergenetic interval, years |
5,0 |
3,0; 7,0 |
4,0 |
3,0; 4,0 |
0,50 |
|
Возраст первых родов, лет / Age at first birth, years |
24,0 |
20,5; 27,0 |
25,0 |
23,0; 25,0 |
0,112 |
|
Масса тела плода при рождении, г / Fetal body weight at birth, g |
3450,0 |
3302,5; 3725,0 |
3540,0 |
3292,5; 3540,0 |
0,62 |
|
Анамнез бесплодия / Infertility history |
|||||
|
Стаж бесплодия, лет / Infertility duration, years |
7,0 |
6,0; 10,3 |
2,0 |
2,0; 2,0 |
< 0,001 |
|
Количество ЭКО, n / Number of IVFs, n |
2,0 |
1,0; 2,5 |
1,0 |
1,0; 1,0 |
0,11 |
|
Неудачные попытки ЭКО при переносе свежего эмбриона, n / Failed IVF attempts with fresh embryo transfer, n |
1,0 |
1,0; 2,0 |
1,0 |
1,0; 1,0 |
0,85 |
|
Неудачные попытки ЭКО при переносе свежего и криоэмбриона, n / Failed IVF attempts with fresh and cryoembryo transfer, n |
3,0 |
1,3; 7,5 |
2,0 |
1,0; 2,0 |
0,38 |
|
Результаты биохимического исследования крови / Biochemical blood test results |
|||||
|
Холестерин, ммоль/л / Cholesterol, mmol/L |
4,8 |
4,3; 5,6 |
4,3 |
3,9; 4,3 |
< 0,001 |
|
Глюкоза, ммоль/л / Glucose, mmol/L |
4,9 |
4,5; 5,3 |
4,6 |
4,3; 4,6 |
< 0,001 |
|
Гемоглобин, г/л / Hemoglobin, g/L |
121,0 |
101,5; 131,0 |
129,0 |
124,0; 129,0 |
< 0,001 |
|
Ферритин, мкг/л / Ferritin, μg/L |
27,0 |
21,0; 48,8 |
32,0 |
19,5; 32,0 |
0,49 |
|
Результаты гормонального исследования крови / Hormonal blood test results |
|||||
|
АМГ, нг/мл / AMG, ng/ml |
1,1 |
0,4; 1,8 |
1,8 |
0,9; 1,8 |
0,01 |
|
ФСГ, мМЕ/мл / FSH, mIU/ml |
8,0 |
6,3; 11,0 |
6,2 |
5,3; 6,2 |
0,03 |
|
ЛГ, мМЕ/мл / LH, mIU/ml |
8,2 |
3,5; 10,0 |
7,0 |
5,4; 7,0 |
0,72 |
|
ТТГ, мМЕ/мл / TSH, mIU/ml |
1,4 |
0,9; 2,8 |
1,7 |
1,2; 1,7 |
0,71 |
Примечание: ЭКО – экстракорпоральное оплодотворение; АМГ – антимюллеров гормон; ФСГ – фолликулостимулирующий гормон; ЛГ – лютеинизирующий гормон; ТТГ – тиреотропный гормон; разность показателей между группами оценивали с помощью U-критерия Манна–Уитни; выделены значимые различия.
Note: IVF – in vitro fertilization; AMH – anti-Müllerian hormone; FSH – follicle-stimulating hormone; LH – luteinizing hormone; TSH – thyroid-stimulating hormone; the difference in inter-group parameters was assessed using the Mann–Whitney U-test; significant differences are highlighted in bold.
Прогностическая модель возникновения лейомиомы матки / Prognostic model for emerging uterine leiomyoma
Для разработки прогностической модели возникновения ЛМ применяли метод многослойного перцептрона. Он представляет собой тип искусственной нейронной сети, формируемой из нескольких уровней искусственных нейронов, организованных минимум в 3 слоя. В этой архитектуре информация перемещается исключительно в одном направлении – от входного слоя к выходному. На выходном уровне располагаются нейроны, отвечающие за окончательный прогноз. Метод является одним из способов достижения более высоких показателей точности результатов. Увеличение количества слоев в сети способствует повышению точности результатов. При обработке информации входные данные передаются последовательно через каждый слой, формируя итог как результат разности между ответами.
Нейросетью отобраны 12 параметров, имевших статистически значимые различия при сравнении групп исследования – индекс массы тела (ИМТ), возраст менархе, число абортов и самопроизвольных выкидышей, возраст первых родов, артериальная гипертензия (АГ), наличие доброкачественных новообразований яичников, экстракорпоральное оплодотворение (ЭКО) в анамнезе, уровень антимюллерова гормона (АМГ), количество беременностей, содержание холестерина и глюкозы в крови. Число входных нейронов составило 36 единиц.
Для наибольшей точности прогноза (наличия или отсутствия ЛМ), помимо входного и выходного слоев, в архитектуру многослойного перцептрона было включено 2 скрытых слоя. Количество нейронов в них составило 7 и 5 соответственно. Сигмоидная функция активации была применена в обоих скрытых слоях и в выходном слое, что позволило преобразовать значения в диапазон (0; 1), что соответствует изначальному дизайну исследования. В качестве функции ошибки выступала сумма квадратов. Выходной слой содержал 2 целевые (зависимые) переменные (ЛМ есть/нет). Архитектура разработанной нейронной сети представлена на рисунке 1.
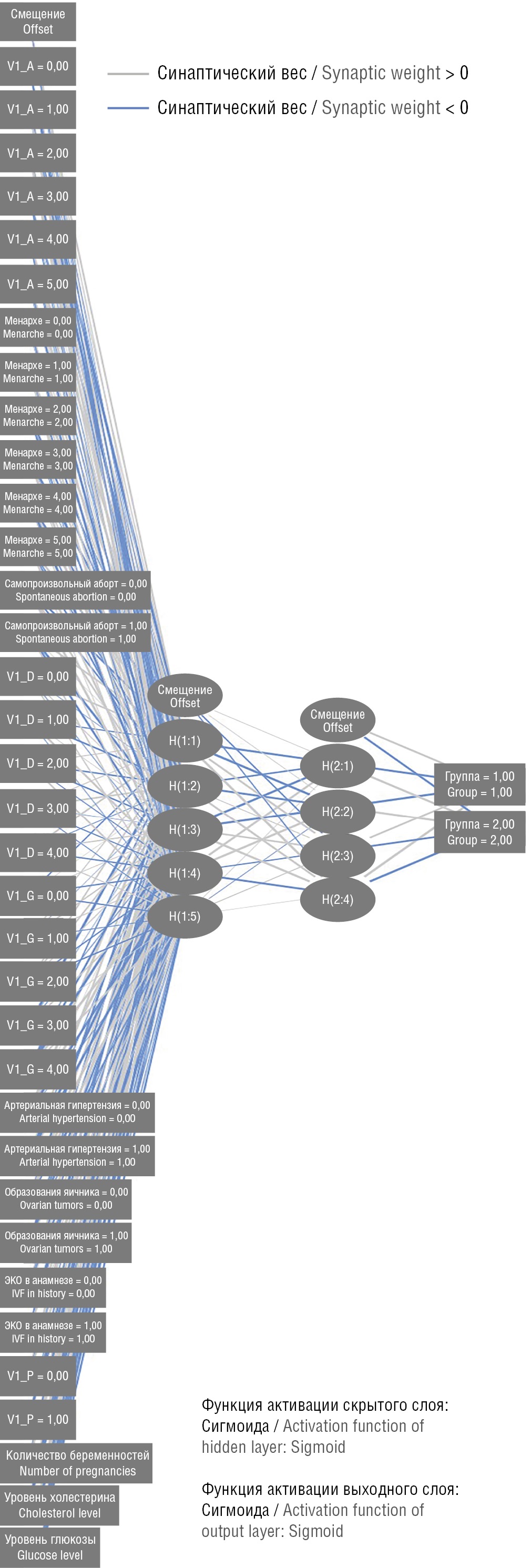
Рисунок 1. Архитектура нейронной сети многослойного перцептрона.
Примечание: V1_А = 0,00 – дефицит массы тела; V1_А = 1,00 – нормальная масса тела; V1_А = 2,00 – избыточная масса тела; V1_А = 3,00 – ожирение I степени; V1_А = 4,00 – ожирение II степени; V1_А = 5,00 – ожирение III степени; менархе = 0,00 – менархе в 10 лет; менархе = 1,00 – менархе в 11 лет; менархе = 2,00 – менархе в 12 лет; менархе = 3,00 – менархе в 13 лет; менархе = 4,00 – менархе в 14 лет; менархе = 5,00 – менархе в 16 лет; самопроизвольный аборт = 0,00 – отсутствие самопроизвольных абортов в анамнезе; самопроизвольный аборт = 1,00 – имеются самопроизвольные аборты в анамнезе; V1_D = 0,00 – отсутствие абортов в анамнезе; V1_D = 1,00 – 1 аборт в анамнезе; V1_D = 2,00 – 2 аборта в анамнезе; V1_D = 3,00 – 3 аборта в анамнезе; V1_D = 4,00 – 4–5 и более абортов в анамнезе; V1_G = 0,00 – отсутствуют роды в анамнезе; V1_G = 1,00 – первые роды произошли до 21 года; V1_G = 2,00 – первые роды в возрасте 21–25 лет; V1_G = 3,00 – первые роды в возрасте 26–30 лет; V1_G = 4,00 – первые роды в возрасте старше 30 лет; артериальная гипертензия = 0,00 – отсутствует артериальная гипертензия; артериальная гипертензия = 1,00 – имеется артериальная гипертензия; образования яичника = 0,00 – отсутствуют образования яичника; образования яичника = 1,00 – имеются образования яичника; ЭКО в анамнезе = 0,00 – отсутствует ЭКО в анамнезе; ЭКО в анамнезе = 1,00 – имеется ЭКО в анамнезе; V1_P = 0,00 – отсутствуют репродуктивные планы; V1_P = 1,00 – имеются репродуктивные планы, несмотря на истощение овариального резерва; Н – нейроны, входящие в скрытые слои; H(1:1) – первый нейрон первого скрытого слоя нейронной сети; H(1:2) – второй нейрон первого скрытого слоя нейронной сети; H(1:3) – третий нейрон первого скрытого слоя нейронной сети; H(1:4) – четвертый нейрон первого скрытого слоя нейронной сети; H(1:5) – пятый нейрон первого скрытого слоя нейронной сети; H(2:1) – первый нейрон второго скрытого слоя нейронной сети; H(2:2) – второй нейрон второго скрытого слоя нейронной сети; H(2:3) – третий нейрон второго скрытого слоя нейронной сети; H(2:4) – четвертый нейрон второго скрытого слоя нейронной сети.
Figure 1. Multilayer perceptron neural network architecture.
Note: V1_A = 0.00 – underweight; V1_A = 1.00 – normal weight; V1_A = 2.00 – overweight; V1_A = 3.00 – obesity grade I; V1_A = 4.00 – obesity grade II; V1_A = 5.00 – obesity grade III; menarche = 0.00 – menarche at 10 years; menarche = 1.00 – menarche at 11 years; menarche = 2.00 – menarche at 12 years; menarche = 3.00 – menarche at 13 years; menarche = 4.00 – menarche at 14 years; menarche = 5.00 – menarche at 16 years; spontaneous abortion = 0.00 – no history of spontaneous abortions; spontaneous abortion = 1.00 – history of spontaneous abortions; V1_D = 0.00 – no history of abortions; V1_D = 1.00 – history of 1 abortion; V1_D = 2.00 – history of 2 abortions; V1_D = 3.00 – history of 3 abortions; V1_D = 4.00 – history of 4–5 abortions or more; V1_G = 0.00 – no history of childbirth; V1_G = 1.00 – first birth occurred before age of 21 years; V1_G = 2.00 – first birth occurred at age of 21–25 years; V1_G = 3.00 – first birth occurred at age of 26–30 years; V1_G = 4.00 – first birth occurred at age of over 30 years; arterial hypertension = 0.00 – no arterial hypertension; arterial hypertension = 1.00 – arterial hypertension present; ovarian masses = 0.00 – no ovarian masses; ovarian masses = 1.00 – ovarian masses present; history of IVF = 0.00 – no history of IVF; history of IVF = 1.00 – history of IVF present; V1_P = 0.00 – no reproductive plans; V1_P = 1.00 – reproductive plans despite ovarian reserve depletion; H – neurons included in the hidden layers; H(1:1) – the first neuron of the first hidden layer of the neural network; H(1:2) – the second neuron of the first hidden layer of the neural network; H(1:3) – the third neuron of the first hidden layer of the neural network; H(1:4) – the fourth neuron of the first hidden layer of the neural network; H(1:5) – the fifth neuron of the first hidden layer of the neural network; H(2:1) – the first neuron of the second hidden layer of the neural network; H(2:2) – the second neuron of the second hidden layer of the neural network; H(2:3) – the third neuron of the second hidden layer of the neural network; H(2:4) – the fourth neuron of the second hidden layer of the neural network.
Анализ факторов риска возникновения лейомиомы матки / Analysis of risk factors for uterine leiomyoma development
Из 106 пациенток, которые имели ЛМ, результат расчета оказался положительным у 96 (90,6 %) пациенток, отрицательным – у 10 (9,4 %). Из 103 пациенток, которые не имели ЛМ, результат расчета оказался отрицательным у 97 (94,2 %) пациенток, положительным – у 6 (5,8 %). Точность прогноза разработанной модели составила 92,3 %, чувствительность – 90,6 %, специфичность – 94,2 %. Прогностическая ценность подтверждена с помощью ROC-анализа – площадь под кривой составила 0,93 (95 % ДИ = 0,91–0,94; р < 0,001) (рис. 2). Учитывая точность прогноза, превышающую 90 %, можно полагать, что разработанная нейронная сеть обладает достаточным функционалом.
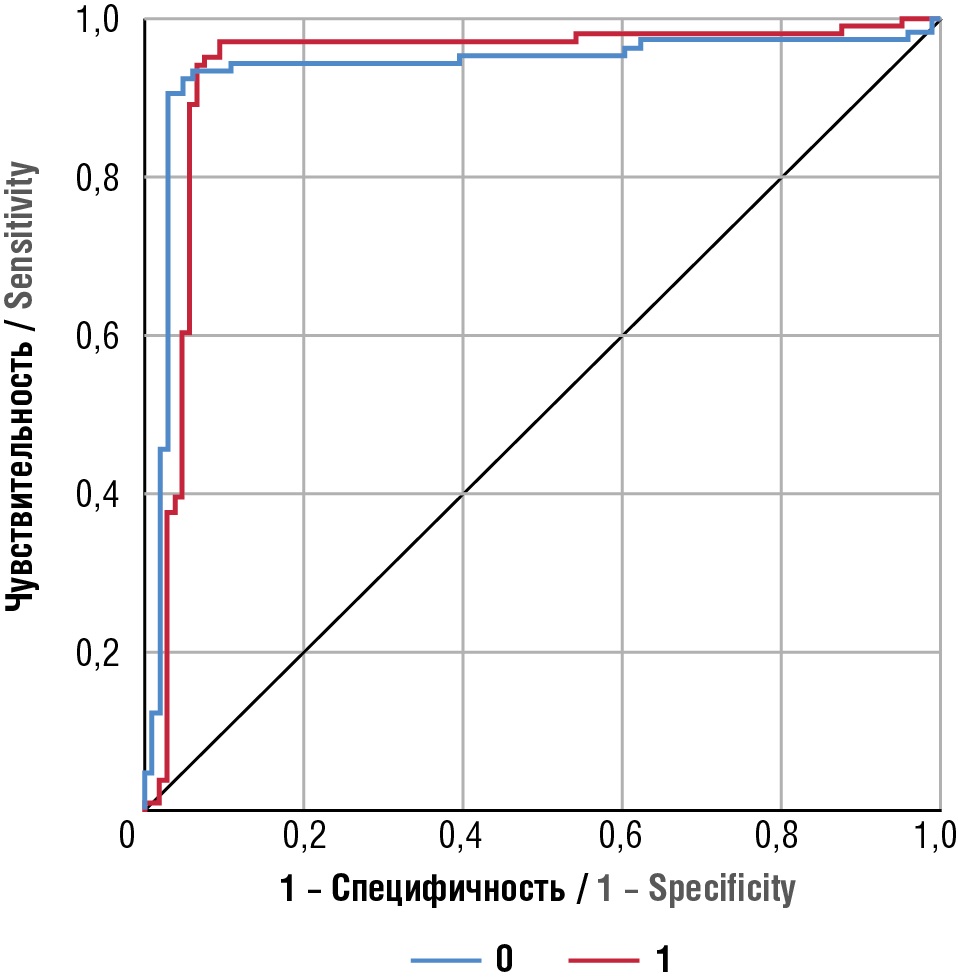
Рисунок 2. ROC-кривая, характеризующая взаимосвязь прогноза развития лейомиомы матки и факторов риска.
Примечание: ―0 – чувствительность (вероятность того, что результат теста будет положительным при наличии заболевания); ―1 – специфичность (вероятность того, что результат теста будет отрицательным при отсутствии заболевания).
Figure 2. ROC curve characterizing the relationship between the prognosis of uterine leiomyoma development and risk factors.
Note: ―0 – sensitivity (the probability that a test result will be positive in the presence of the disease); ―1 – specificity (the probability that a test result will be negative in the absence of the disease).
Важность факторов риска (независимых переменных) в прогнозировании ЛМ представлена на рисунке 3. Наиболее значимыми в структуре влияния на возникновение опухоли оказались уровни холестерина (15 %) и глюкозы (15 %), возраст первых родов (13 %), количество беременностей (11 %), повышенный ИМТ (9 %) и артериальная гипертензия (9 %). Обозначение доли влияния каждого фактора риска в общей системе позволит эффективно применять приемы управления рисками и персонализировать профилактические мероприятия.
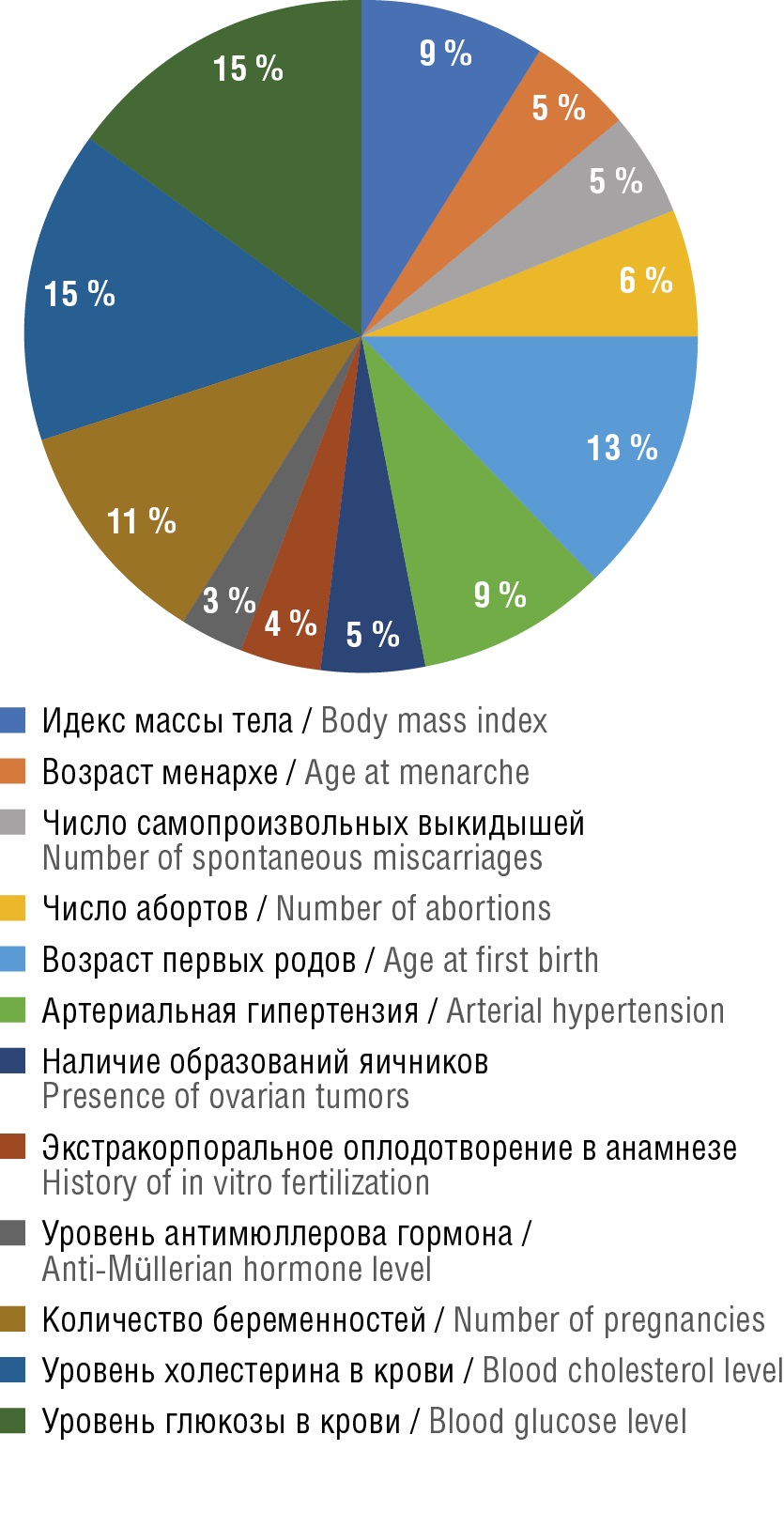
Рисунок 3. Важность факторов риска (независимых переменных) в структуре модели, позволяющей прогнозировать развитие лейомиомы матки.
Figure 3. The importance of risk factors (independent variables) in the structure of the model that allows predicting uterine fibroids development.
В ходе проведенного исследования из 63 исследованных факторов риска для нейросетевого анализа отобрано 36 параметров; программой многослойного перцептрона выделено 12 факторов, имевших статистически значимые различия при сравнении 2 групп исследования и являющиеся наиболее важными в прогнозировании ЛМ.
Немодифицируемыми факторами риска (НМФР), ассоциированными с ЛМ, оказались следующие: раннее менархе (≤ 12 лет): в группе 1 данный фактор наблюдался у 27,3 % женщин, в группе 2 – у 12,6 % (p = 0,02); возраст первых родов старше 30 лет – у 11,3 % против 1,9 % соответственно (р < 0,001); количество беременностей ≥ 3 – у 59,4 % против 27,1 % соответственно (р < 0,001); медицинских абортов – 2 и более аборта в группе 1 у 31,1 % женщин против 11,6 % в группе 2 (р < 0,001); самопроизвольных абортов – у 25,5 % против 12,6 % соответственно (р = 0,03); наличие ЭКО в анамнезе – у 16,0 % против 6,9 % соответственно (р = 0,03); снижение овариального резерва (уровень АМГ менее 1,2 нг/мл) – у 26,4 % против 12,6 % соответственно (р = 0,01).
Наибольший интерес представляли модифицируемые (МФР) и потенциально-модифицирумые факторы риска (ПМФР). Сюда вошли следующие факторы: повышенный ИМТ (≥ 25 кг/м²), который наблюдался у 52,9 % женщин группы 1 и у 30,1 % группы 2 (р < 0,001); наличие АГ у 19,8 % против 3,9 % соответственно (р < 0,001); доброкачественные новообразования яичников – у 17,0 % против 4,9 % соответственно (р < 0,001); содержание холестерина (≥ 4,8 ммоль/л) – у 50 % против 33 % соответственно (р < 0,001) и глюкозы (≥ 4,9 ммоль/л) – у 52,8 % против 26,2 % соответственно (р < 0,001).
Таким образом, из 12 выявленных факторов риска, выделенных нейросетевым анализом как наиболее значимые, 5 вошли в группу МФР и ПМФР. Эти факторы представляются наиболее актуальными ввиду возможности оказать на них прямое или непрямое воздействие, что доказывает значимость превентивного подхода к данному заболеванию
Обсуждение / Discussion
Несмотря на высокую распространенность ЛМ, доступные варианты медицинского лечения для женщин репродуктивного возраста ограничены. Сегодня требуется смена парадигмы подхода к заболеванию и разработка модели персонализированной как первичной, так и вторичной профилактики в зависимости от предполагаемых факторов риска [21]. В обзорной работе L.A. Wise и S.K. Laughlin-Tommaso (2016) указывается, что относительно немногие исследования выявили возможности первичной профилактики образования, результаты противоречивы, а большинство установленных факторов риска не могут быть изменены [22]. Основная проблема при изучении ЛМ заключается в том, что бóльшая часть опухолей бессимптомна, в результате чего упускается их ранняя диагностика; многие новообразования диагностируются лишь спустя годы от их возникновения, когда начинаются клинические проявления, что не позволяет адекватно использовать «окно возможности» для первичной профилактики [23].
Поиск МФР и точек приложения для профилактики ЛМ сегодня только начинается. В настоящее время не существует долгосрочного неинвазивного варианта лечения образований. Более глубокое понимание этиологии опухоли будет ключевым для разработки новых методов лечения и профилактики ЛМ [24]. Поэтому в настоящем исследовании, учитывая многообразие теорий патогенеза и развития опухоли, мы использовали нейросетевой анализ для выявления ключевых факторов риска. Точность прогноза разработанной модели составила 92,3 %, что доказывает перспективность данного метода для клинической практики. Такие технологии сегодня могут применяться в качестве инструмента скрининга с последующими стратегиями профилактики для женщин, подверженных риску развития ЛМ [25].
Заключение / Conclusion
Разработанная модель является эффективным инструментом прогноза возникновения лейомиомы матки (точность 92,3 %), использование которой в клинической практике позволит изменить устоявшуюся парадигму радикального лечения на превентивный подход.
Список литературы
1. Саноев Б.А., Ниёзова Г.Ш., Хикматова Н.И. Макро- и микроскопические проявления лейомиомы матки. Новый день в медицине. 2020;30(2):526–8.
2. Cheng L.-C., Li H.-Y., Gong Q.-Q. et al. Global, regional, and national burden of uterine fibroids in the last 30 years: Estimates from the 1990 to 2019 Global Burden of Disease Study. Front Med. 2022;9:1003605. https://doi.org/10.3389/fmed.2022.1003605.
3. Giuliani E., As-Sanie S., Marsh E.E. Epidemiology and management of uterine fibroids. Int J Gynaecol Obstet. 2020;149(1):3–9. https://doi.org/10.1002/ijgo.13102.
4. Адамян Л.В., Сонова М.М., Арсланян К.Н., Логинова О.Н. Современные аспекты комплексного лечения миомы матки. Лечащий врач. 2019;(3):46–50.
5. Navarro A., Bariani M.V., Yang Q., Al-Hendy A. Understanding the impact of uterine fibroids on human endometrium function. Front Cell Dev Biol. 2021;9:633180. https://doi.org/10.3389/fcell.2021.633180.
6. Аганезова Н.В., Аганезов С.С., Шило М.М. Миома матки: современные практические аспекты заболевания. Проблемы репродукции. 2022;28(4):97–105. https://doi.org/10.17116/repro20222804197.
7. Краснопольская К.В., Коган И.Ю. Миома матки и бесплодие: стратегии преодоления: руководство для врачей. М.: ГЭОТАР-Медиа, 2021. 144 с.
8. Don E.E., Mijatovic V., van Eekelen R., Huirne J.A.F. The effect of myomectomy on reproductive outcomes in patients with uterine fibroids: A retrospective cohort study. Reprod Biomed Online. 2022;45(5):970–8. https://doi.org/10.1016/j.rbmo.2022.05.025.
9. Gupta J.K., Sinha A.S., Lumsden M.A., Hickey M. Uterine artery embolization for symptomatic uterine fibroids. Cochrane Database Syst Rev. 2014;2014(12):CD005073. https://doi.org/10.1002/14651858.CD005073.pub4.
10. Стрижаков А.Н., Давыдов А.И., Пашков В.М., Лебедев В.А. Доброкачественные заболевания матки. М.: ГЭОТАР-Медиа, 2011. 288 с.
11. Штраус Дж.Ф., Барбьери Р.Л., Гарджуло А.Р. Репродуктивная эндокринология Йена и Джаффе. Физиология, патофизиология, клиника, диагностика и лечение. 8-е изд. М.: МИА, 2022. 1200 с.
12. Sohn G.S., Cho S., Kim Y.M. et al.; Working Group of Society of Uterine Leiomyoma. Current medical treatment of uterine fibroids. Obstet Gynecol Sci. 2018;61(2):192–201. https://doi.org/10.5468/ogs.2018.61.2.192.
13. Макацария А.Д., Воробьев А.В. Новейшие исследования и клинические практики в области гинекологии и перинатологии. Акушерство, Гинекология и Репродукция. 2024;18(5):620–4. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.583.
14. Клинические рекомендации – Миома матки – 2024-2025-2026 (25.09.2024). М.: Министерство здравоохранения Российской Федерации, 2024. 23 с. Режим доступа: http://disuria.ru/_ld/14/1468_kr24O34p1D39p0M.pdf. [Дата обращения: 03.12.2024].
15. Srinivas T., Lulseged B., Attari M.M.A. et al. Patient characteristics associated with embolization versus hysterectomy for uterine fibroids: a systematic review and meta-analysis. J Am Coll Radiol. 2024;21(5):729–39. https://doi.org/10.1016/j.jacr.2023.12.018.
16. Borah B.J., Yao X., Laughlin-Tommaso S.K. et al. Comparative effectiveness of uterine leiomyoma procedures using a large insurance claims database. Obstet Gynecol. 2017;130(5):1047–56. https://doi.org/10.1097/AOG.0000000000002331.
17. Yang J., Fan X., Gao J. et al. Cost effectiveness analysis of total laparoscopic hysterectomy versus total abdominal hysterectomy for uterine fibroids in Western China: a societal perspective. BMC Health Serv Res. 2022;22(1):252. https://doi.org/10.1186/s12913-022-07644-9.
18. Stewart E.A. Clinical practice. Uterine fibroids. N Engl J Med. 2015;372(17):1646–55. https://doi.org/10.1056/nejmcp1411029.
19. MacEachern S.J., Forkert N.D. Machine learning for precision medicine. Genome. 2020;64(4):416–25. https://doi.org/10.1139/gen-2020-0131.
20. Ratna M.B., Bhattacharya S., Abdulrahim B., McLernon D.J. A systematic review of the quality of clinical prediction models in in vitro fertilisation. Hum Reprod. 2020;35(1):100–16. https://doi.org/10.1093/humrep/dez258.
21. El Sabeh M., Borahay M. A. The future of uterine fibroid management: a more preventive and personalized paradigm. Reprod Sci. 2021;28(11):3285–8. https://doi.org/10.1007/s43032-021-00618-y.
22. Wise L.A., Laughlin-Tommaso S.K. Epidemiology of uterine fibroids: from menarche to menopause. Clin Obstet Gynecol. 2016;59(1):2–24. https://doi.org/10.1097/GRF.0000000000000164.
23. Harmon Q.E., Brasky T.M. Risk factors for uterine fibroids: time to build on what we have learned. Fertil Steril. 2020;114(4):755–6. https://doi.org/10.1016/j.fertnstert.2020.07.059.
24. Bajwa J., Munir U., Nori A. et al. Artificial intelligence in healthcare: transforming the practice of medicine. Future Healthc J. 2021;8(2):e188–e194. https://doi.org/10.7861/fhj.2021-0095.
25. Briganti G., Le Moine O. Artificial intelligence in medicine: today and tomorrow. Front Med. 2020;7:509744. https://doi.org/10.3389/fmed.2020.00027.
Об авторах
А. М. ЗиганшинРоссия
Зиганшин Айдар Миндиярович, д.м.н., проф.
450008, Уфа, ул. Ленина, д. 3
Г. Б. Дикке
Россия
Дикке Галина Борисовна, д.м.н., проф.
190013 Санкт-Петербург, Московский проспект, д. 22, лит. М
А. Р. Янбарисова
Россия
Янбарисова Алия Ринатовна
450008, Уфа, ул. Ленина, д. 3
Что уже известно об этой теме?
► Лейомиома матки (ЛМ) занимает лидирующие позиции в структуре заболеваний женских половых органов, находясь на втором месте среди всех гинекологических заболеваний.
► Сегодня требуется смена парадигмы подхода к заболеванию и разработка модели персонализированной как первичной, так и вторичной профилактики в зависимости от предполагаемых факторов риска.
► Нейросестевой анализ может стать перспективным инструментом для оптимизации медицинских процессов, что обуславливает его пользу и актуальность в здравоохранении.
Что нового дает статья?
► Описана модель прогноза возникновения ЛМ с помощью нейросетевого анализа факторов риска, где число входных нейронов составило 12 единиц; включено 2 скрытых слоя, содержащие 5 и 7 единиц, и 2 выходных нейрона (ЛМ есть/нет).
► Точность прогноза разработанной модели составила 92,3 %, чувствительность – 90,6 %, специфичность – 94,2 %, что доказывает перспективность данного метода для клинической практики.
► ROC-анализ, характеризующий информативность нейросетевого анализа данных в ранней диагностике ЛМ, подчеркивает прогностическую ценность метода: площадь под кривой = 0,93 (95 % доверительный интервал = 0,91–0,94; р < 0,001).
Как это может повлиять на клиническую практику в обозримом будущем?
► В перспективе разработанная модель может быть использована с целью раннего выявления ЛМ среди женщин, проходящих ежегодный скрининг, что позволит изменить устоявшуюся парадигму радикального лечения на превентивный подход.
► Более глубокое понимание этиологии опухоли будет ключевым для разработки новых методов лечения и профилактики ЛМ.
Рецензия
Для цитирования:
Зиганшин А.М., Дикке Г.Б., Янбарисова А.Р. Прогнозирование возникновения миомы матки у женщин репродуктивного возраста с помощью нейронной сети. Акушерство, Гинекология и Репродукция. 2025;19(2):180-191. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.605
For citation:
Ziganshin A.M., Dikke G.B., Yanbarisova A.R. A neural network for predicting occurrence of uterine fibroids in women of reproductive age. Obstetrics, Gynecology and Reproduction. 2025;19(2):180-191. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.605

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































