Перейти к:
Таксономическое разнообразие микробиомного кишечного ландшафта и его клиническое значение при привычном невынашивании беременности
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.620
Аннотация
Цель: изучение таксономического разнообразия микробиомного кишечного ландшафта во взаимосвязи с нейро-иммунно-гуморальными биомаркерами у пациенток с привычным невынашиванием беременности (ПНБ).
Материалы и методы. Проведено одномоментное сравнительное исследование с участием 55 беременных с ПНБ в анамнезе (основная группа) и 60 женщинами с физиологически протекающей беременностью (контрольная группа). Всем женщинам производили оценку сывороточных уровней фактора некроза опухоли альфа (англ. tumor necrosis factor-alpha, TNF-α), интерлейкина (англ. interleukin, IL) IL-17, кортизола и мелатонина с помощью твердофазного иммуноферментного анализа. Изучение таксономического состава кишечной микробиоты на уровне родов проводили методом секвенирования гена 16S рибосомальной РНК. Для оценки α-разнообразия сообщества использовали индексы Chao1, число обнаруженных таксонов (± SD; Sobs ) и показатель, демонстрирующий реальное количество таксонов (англ. Abundance Coverage Estimator, ACE).
Результаты. Зафиксировано значимое снижение α-разнообразия бактериального сообщества у пациенток с ПНБ по данным индекса Chao1 (p = 0,014). Установлено значимое уменьшение представленности родов Bifidоbасtеrium (р < 0,001), Lаchnоsрirа (р = 0,032), Rоsеburiа (р = 0,003), Сорrососсus (р = 0,012) на фоне повышения Ruminоcоссus (р < 0,001) и Кlеbsiеllа (р = 0,002) у женщин с ПНБ. Выявлена положительная корреляция между численностью бактерий Ruminococcus и уровнем TNF-α (r = 0,49; p = 0,003), отрицательная корреляция между количеством Bifidobacterium и IL-17 (r= –0,54; p = 0,001), численностью Lachnospira и содержанием кортизола (r = –0,46; p = 0,002), а также представленностью Coprococcus и уровнем мелатонина в сыворотке крови (r = –0,58; p = 0,028).
Заключение. Для пациенток с ПНБ характерны дисбиотические изменения микробиомного ландшафта. Обнаруженные статистически значимые корреляции некоторых представителей микробиоты с нейро-иммунно-гуморальными биомаркерами указывают на вовлеченность дисбиотических изменений кишечника в развитие иммунных нарушений и дисрегуляцию эпифизарно-гипофизарно-надпочечниковой оси, лежащих в основе патогенеза ПНБ.
Ключевые слова
Для цитирования:
Тормозова А.В., Эракаева А.А., Ибадуллаева Г.А., Галата А.С., Асиновская А.С., Кузюра Д.Э., Ефремова К.Н., Чос В.М., Сварник У.В., Дьяченко А.А., Мавлютова А.Н., Мукосий Л.А., Карпусь Ю.С., Пирожкова Е.Д., Альбекова Ф.А., Сорокина Л.Е. Таксономическое разнообразие микробиомного кишечного ландшафта и его клиническое значение при привычном невынашивании беременности. Акушерство, Гинекология и Репродукция. 2025;19(3):360-368. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.620
For citation:
Tormozova A.V., Erakaeva A.A., Ibadullaeva G.A., Galata A.S., Asinovskaya A.S., Kuzyura D.E., Efremova K.N., Chos V.M., Svarnik U.V., Dyachenko A.A., Mavlyutova A.N., Mukosiy L.A., Karpus Yu.S., Pirozhkova E.D., Albekova F.A., Sorokina L.E. Taxonomic diversity of the intestinal microbiome landscape and its clinical significance in recurrent pregnancy loss. Obstetrics, Gynecology and Reproduction. 2025;19(3):360-368. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.620
Введение / Introduction
Привычное невынашивание беременности (ПНБ) определяется как полиэтиологичное патологическое состояние, характеризующееся двумя и более эпизодами самопроизвольного прерывания беременности в сроках до 22 недель гестации, и представляет собой одну из наиболее серьезных проблем современного акушерства [1]. У 50 % пар повторяющиеся спонтанные потери беременности на ранних сроках обусловлены идиопатическими причинами [2]. Согласно данным литературы, центральным звеном патофизиологии ПНБ является нарушение материнской иммунной толерантности в ответ на интеграцию «полуаллогенных» плодовых тканей [3]. Проявления аллоиммунных нарушений включают в себя, прежде всего, аберрантное продуцирование цитокинов. В этом аспекте фокус внимания ученых направлен на изучение роли фактора нeкрозa опухоли aльфa (англ. tumоr nесrоsis fасtоr аlрhа, ТNF-α) [4] и интeрлeйкинa (англ. interleukin, IL) IL-17 [5], облaдающих проaпоптотической, провоспалительной aктивностью [6]. Уровни TNF-α и IL-17 являются независимыми прогностическими факторами ПНБ. Содержание указанных цитокинов отражает баланс субпопуляций Т-хелперов (англ. T-helper cells, Th) Th1/Th2/Th17 и регуляторных Т-клеток (англ. regulatory T-cells, Tregs) и ассоциировано с выраженностью прогестероновой активности [7][8].
Вместе с тем в последних научных публикациях активно обсуждается вовлеченность дисрегуляции эпифизарно-гипофизарно-надпочечниковой оси в формирование ПНБ [9].
Пациентки с ПНБ достоверно демонстрируют более высокие уровни сывороточного кортизола на фоне пониженного уровня мелатонина по сравнению с женщинами с физиологическим течением беременности [10–12]. В свою очередь, изменения кортизола и мелатонина могут оказывать влияние на секрецию прогестерона и простагландина, а также способствовать нарушению инвазии и повышению апоптотической активности трофобласта [13–15].
Дальнейшее развитие представлений о роли нейро-иммунно-гуморальных реакций в развитии репродуктивной патологии тесно связано с работами в сфере микробиологии. Микробиомный ландшафт, модулирующий активность иммунных и эндокринных клеток, способен оказывать влияние на нормальное течение беременности. Обнаружение изменений в таксономическом составе кишечной микрофлоры у женщин с ПНБ [16–18] явилось обоснованием для поиска взаимосвязи между дисбиозом кишечника и повторяющимися спонтанными потерями беременности.
Цель: изучение таксономического разнообразия микробиомного кишечного ландшафта во взаимосвязи с нейро-иммунно-гуморальными биомаркерами у пациенток с ПНБ.
Материалы и методы / Materials and Methods
Дизайн исследования / Study design
Проведено одномоментное сравнительное исследование. Включено 55 беременных с ПНБ в анамнезе (основная группа) и 60 женщин с физиологическим течением гестационного периода (контрольная группа), которые проходили наблюдение на базе ГБУЗ РК «Симферопольский клинический родильный дом № 1».
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения в основную группу: возраст беременной ≥ 18 и ≤ 40 лет; одноплодная маточная беременность; верифицированный диагноз ПНБ в анамнезе; подписанное добровольное согласие на участие.
Критерии включения в контрольную группу: возраст беременной ≥ 18 и ≤ 40 лет; одноплодная маточная беременность; физиологическое течение гестационного периода; неотягощенный акушерский анамнез; подписанное добровольное согласие на участие.
Критерии исключения: возраст беременной ≤ 18 и ≥ 40 лет; многоплодная беременность; внематочная беременность; самопроизвольный выкидыш в ходу (состояние, характеризующееся отслойкой плодного яйца от маточной стенки и его отторжением); использование донорской яйцеклетки; острые инфекционные и генетические заболевания; тяжелые формы соматической патологии; хронические заболевания органов пищеварительной системы в анамнезе; прием препаратов, оказывающих влияние на состав микрофлоры в предшествующие 3 месяца до начала исследования; отказ от участия.
Методы исследования / Study methods
Изучение таксономического разнообразия микробиомного кишечного ландшафта / Examining taxonomic diversity of the gut microbiome landscape
Для оценки качественного состава микробиоты кишечника проводили метатаксономический анализ методом секвенирования фрагментов генов 16S рибосомальной РНК (рРНК).
Биологический материал (образцы кала) после забора помещался в одноразовые пластиковые контейнеры. Выделение ДНК на сорбенте проводили с помощью набора реагентов «S-СОРБ» (Синтол, Россия). Для дальнейшего проведения метагеномного анализа проводилась амплификация V3-V4 региона гена 16S pPНK. Пробоподготовку осуществляли согласно протоколу с использованием реагентов Nехtеrа ХТ Indех Кit (Illuminа, CШA) с последующей загрузкой в проточную ячейку прибора МiSеq (Illumina, CШA).
Полученные прочтения обрабатывались с помощью пакета для анализа микробиомных данных DАDА2. Выравнивание полученных прочтений генов 16S рРНК и последующее таксономическое аннотирование проводилось с использованием базы Silvа SSU NR99.
Для оценки α-разнообразия сообщества использовали индексы Chao1, число обнаруженных таксонов (± SD; Sobs ) и показатель, демонстрирующий реальное количество таксонов (англ. Abundance Coverage Estimator, ACE).
Изучение нейро-иммунно-гуморальных биомаркеров / Assessing neuro-immune-humoral biomarkers
Уровень сывороточных нейро-иммунно-гуморальных биомаркеров определяли с помощью иммуноферментного анализа с использованием соответствующих наборов «Альфа-ФНО-ИФА-БЕСТ», «Интерлейкин-18-ИФА-БЕСТ», «Кортизол-ИФА-БЕСТ», «Металонин-ИФА-БЕСТ» (ЗАО Вектор-Бест, Россия) на анализаторе Labsystems Multiskan Ascent (Thermo Labsystems, Финляндия).
Методы статистического анализа / Statistic alanalysis
Обработка и анализ данных проводились с помощью статистического программного обеспечения Stаtistiса 6.0 (StаtSоft Inс., США). Для проверки гипотезы о нормальности распределения использовался критерий Шапиро–Уилка. При представлении количественных показателей учитывалась симметричность распределения: в случае нормального распределения указывалось среднее арифметическое со статистической ошибкой среднего (M ± m), при отличном от нормального – медиана с верхним и нижним квартилем (Me [Q1; Q3]).
Для сравнения двух групп применялся непараметрический U-критерий Манна–Уитни. Выявление корреляционных связей между переменными, включая их силу, направление и статистическую значимость, осуществлялось с помощью r-коэффициента Спирмена. Различия считались статистически значимыми при уровне p ≤ 0,05.
Результаты / Results
Все беременные, включенные в исследование, были сопоставимы по возрасту и антропометрическим данным (табл. 1).
Таблица 1. Клинико-анамнестическая характеристика пациенток.
Table 1. Clinical and anamnestic characteristics of patients.
|
Показатель Parameter |
Основная группа Main group n = 55 |
Контрольная группа Control group n = 60 |
р |
|
Возраст, годы, Me [Q1; Q3] / Age, years, Me [Q1; Q3] |
31,6 [ 26,9; 33,9] |
30,3 [ 25,9; 33,2] |
0,122 |
|
Индекс массы тела, кг/м², M ± m / Body mass index, kg/m², M ± m |
21,7 ± 0,4 |
20,6 ± 2,1 |
0,087 |
|
Количество выкидышей / Number of miscarriages |
|||
|
Два, n (%) / Two, n (%) |
34 (61,8) |
– |
– |
|
Три и более, n (%) / Three or more, n (%) |
21 (38,2) |
– |
– |
Изучение разнообразия микробиомного кишечного ландшафта позволило заключить о достоверном снижении α-разнообразия бактериального сообщества у пациенток с ПНБ по данным индекса Chao1 (p = 0,014). Показатели индексов ACE и Sobs в основной группе имели тенденцию к снижению, однако статистически значимых различий по сравнению с контролем (p > 0,05) установлено не было (рис. 1).
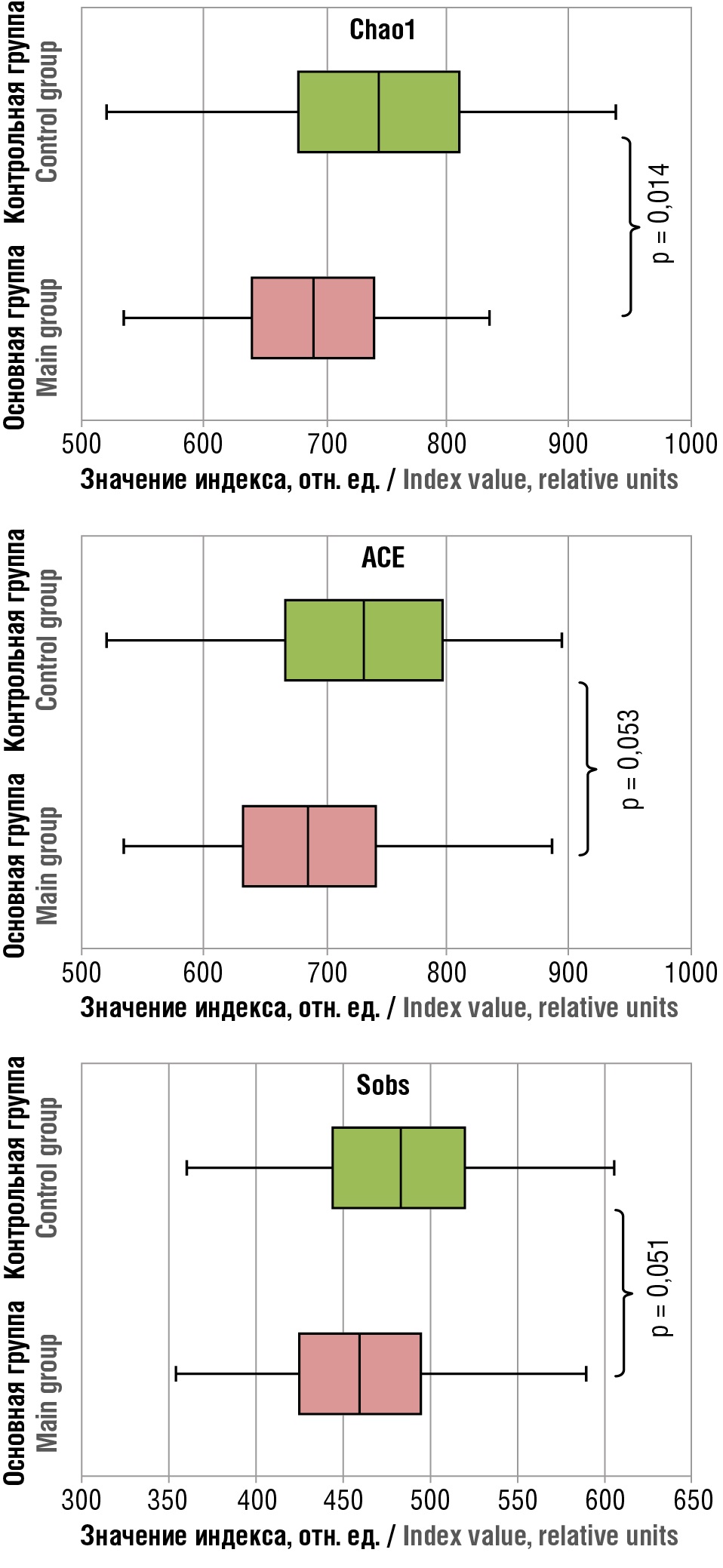
Рисунок 1. Оценка α-разнообразия микробиомного кишечного ландшафта.
Figure 1. Assessing α-diversity of the microbiome intestinal landscape.
Сравнительная оценка таксономического состава кишечной микробиоты позволила установить значимое уменьшение представленности родов Bifidоbасtеrium (р < 0,001), Lаchnоsрirа (р = 0,032), Rоsеburiа (р = 0,003), Сорrососсus (р = 0,012) на фоне повышения Ruminоcоссus (р < 0,001) и Кlеbsiеllа (р = 0,002) у женщин с ПНБ (рис. 2).
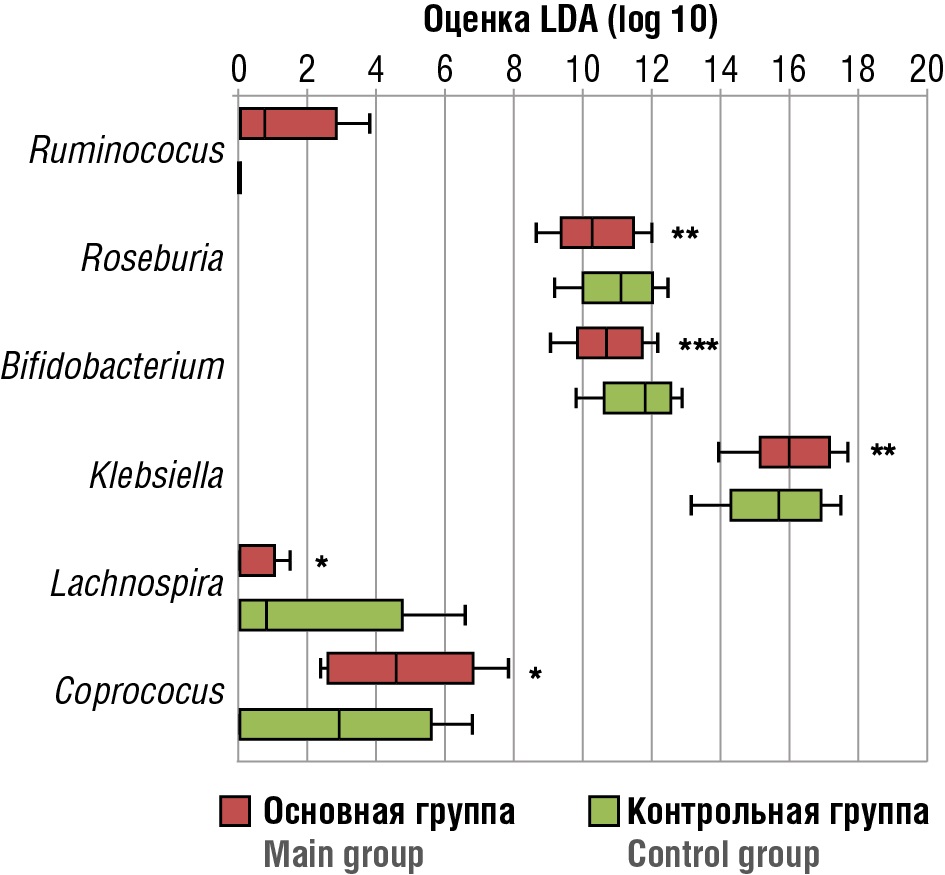
Рисунок 2. Родовой состав микробиоты кишечника (линейный дискриминантный анализ, LDA).
Примечание: *p < 0,05; **p = 0,01; ***p < 0,01 – значимость различий по сравнению с контрольной группой.
Figure 2. Generic intestinal microbiota composition (linear discriminant analysis, LDA).
Note: *p < 0.05; **p = 0.01; ***p < 0.01 – significance of differences compared to control group.
Результаты оценки системных нейро-иммунно-гуморальных биомаркеров представлены в таблице 2. Пациентки с ПНБ характеризовались достоверным повышением концентрации TNF-α и IL-17 в сыворотке крови по сравнению с группой контроля (р = 0,001 и р = 0,011, соответственно). Обращает на себя внимание также статистически значимое увеличение уровня сывороточного кортизола у беременных основной группы на фоне достоверного снижения мелатонина по отношению к группе пациенток с физиологическим течением гестационного периода (р < 0,001 и р = 0,002, соответственно).
Таблица 2. Значения нейро-иммунно-гуморальных биомаркеров в сыворотке крови.
Table 2. Quantitation of blood serum neuro-immune-humoral biomarkers.
|
Показатель Parameter M ± m |
Основная группа Main group n = 55 |
Контрольная группа Control group n = 60 |
р |
|
Фактор некроза опухоли альфа, пг/мл Tumor necrosis factor-alpha, pg/ml |
12,3 ± 2,3 |
6,1 ±1 ,4 |
0,001 |
|
Интерлейкин-17, пг/мл / Interleukin-17, pg/ml |
5,2 ± 1,2 |
2,6 ± 1,3 |
0,011 |
|
Кортизол, нмоль/л / Cortisol, nmol/L |
627,1 ±1 5,4 |
321,4 ± 33,2 |
< 0,001 |
|
Мелатонин, пг/мл / Melatonin, pg/ml |
18,1 ± 5,3 |
31,6 ± 8,4 |
0,002 |
Изучение взаимосвязи таксономического разнообразия микробиоты с сывороточными биомаркерами позволило установить значимые корреляции в группе пациенток с ПНБ. Установлена положительная корреляция между численностью бактерий Ruminоcоссus и уровнем TNF-α (r = 0,49; p = 0,003). Численность бактерий Bifidоbасtеrium имела отрицательную ассоциацию с уровнем IL-17 (r = –0,54; p = 0,001). Также удалось выявить отрицательную взаимосвязь между численностью бактерий Lаchnоsрirа и содержанием кортизола в сыворотке крови(r = –0,46; p = 0,002), а также количеством бактерий Coprococcus и уровнем мелатонина в сыворотке крови (r = –0,58; p = 0,028).
Обсуждение / Discussion
Известно, что ПНБ имеет полиэтиологический характер [1]. Между тем на сегодняшний день накоплено достаточное количество данных, указывающих на сопряженность повторяющихся спонтанных потерь беременности с нарушениями микрофлоры кишечника. Настоящее исследование также подтверждает результаты ранее опубликованных работ об изменении состава микробиоты кишечника у пациенток с ПНБ [16–18] и расширяет представления об особенностях таксономического состава микробиомного ландшафта у данной категории пациенток. Представленные нами данные достоверно демонстрируют уменьшение α-разнообразие бактериального сообщества, на что указывает более низкий индекс Chao1 у женщин основной группы.
Также в текущей работе нами отмечены дисбиотические изменения микробиомного ландшафта женщин с ПНБ, связанные со снижением численности представителей родов Bifidоbасtеrium, Lасhnоsрirа, Rоsеburiа, Сорrососсus на фоне повышения численности потенциальных патобионтов Ruminоcоссus и Кlеbsiеllа. Полученные результаты частично согласуются с имеющимися литературными данными. Так, Y. Cui с соавт. при сравнении родового состава микробиоты у пациенток с ПНБ указывают на снижение числа представителей Prevotella, Rоsеburiа, Lаchnоsрirа и увеличение Ruminоcоссus, Кlеbsiеllа [17]. В другом независимом исследовании научной группы Y. Liu с соавт. продемонстировано снижение количества бактерий родов Lаchnоsрirа, Rоsеburiа, Prevotella [18].
Теория о вовлеченности иммунных нарушений и дисрегуляции эпифизарно-гипофизарно-надпочечниковой оси в патогенез ПНБ нашла отражение и в нашем исследовании. В представленной работе пациентки основной группы характеризовались более высокими уровнями TNF-α, IL-17 и кортизола наряду со снижением содержания мелатонина в сыворотке крови. Интерес представляет факт ассоциированности численности бактериального сообщества с уровнями изученных биомаркеров при ПНБ.
Ранее Y. Liu с соавт. отмечали, что уменьшение бактериального разнообразия у женщин с ПНБ ассоциировано с повышением TNF-α и IL-17 в сыворотке крови [18]. В нашем исследовании обнаружена прямая корреляция между уровнем сывороточного TNF-α и численностью бактерий Ruminococcus. Объяснением полученной взаимосвязи могут выступать результаты исследования M.T. Henke с соавт., где авторы указывают, что представители рода Ruminococcus способны вызывать липополисахарид-индуцированное воспаление [19]. В результате лиганд-рецепторного взаимодействия липосахарида с толл-подобным рецептором 4 (англ. toll-like receptor 4, TLR4) происходит стимуляция выработки иммунными клетками провоспалительных цитокинов, включая TNF-α.
В свою очередь, уменьшение численности представителей рода Bifidоbасtеrium ассоциировано с усилением транскрипционной активности, опосредованной ядерным фактором NF-kB (англ. nuclear factor kappa-light-chain-enhancer of activated B cells), и интенсификацией экспрессии медиаторов воспаления, включая IL-17 [20]. В пользу этого утверждения может выступать полученная нами обратная корреляция между представленностью бактерий рода Bifidоbасtеrium и уровнем IL-17 в сыворотке крови.
Кроме того, в рамках текущей работы установлена обратная корреляционная взаимосвязь численности бактерий Lаchnоsрirа с уровнем кортизола. Принимая во внимание продуцирующий потенциал рода Lаchnоsрirа в отношении короткоцепочечных жирных кислот, представляется возможным вовлеченность этих бактерий в регуляцию активности гипоталамо-гипофизарно-надпочечниковой оси путем непосредственного влияния бутирата на нейроны медиальных отделов паравентрикулярных ядер гипоталамуса [21].
Также выявлена сопряженность численности бактерий Сорrососсus и уровня мелатонина, что согласуется с результатами ранее выполненных исследований в когортах пациентов с идиопатическим рeвмaтоидным aртритом [22] и сахарным диaбeтом [23].
Таким образом, полученные результаты исследования не только расширяют представления о фундаментальной роли изменений микробиоты кишечника при ПНБ, но и имеют потенциальное клиническое приложение. Интеграция анализа кишечной микробиоты с учетом акушерско-гинекологического анамнеза и соматического статуса в рутинную клиническую практику может способствовать более точному прогнозированию риска ПНБ. Также адекватная оценка таксономического разнообразия микробиомного ландшафта кишечника позволит своевременно начать проведение патогенетически обоснованных методов прегравидарной подготовки (в том числе путем коррекции количественного и качественного состава бактериального сообщества с использованием адекватной композиции пробиотиков) для улучшения исхода последующей беременности.
Ограничения исследования / Study limitations
Основными ограничениями текущего исследования выступают небольшие объемы выборок пациенток основной группы и здорового контроля. Учитывая, что полученная численность бактерий в обеих группах характеризовалось большим разбросом значений, следовательно, для формирования заключений, способных характеризовать генеральную совокупность пациенток с ПНБ, требуется бóльший объем выборки для исследования. Стоит отметить, что при проведении сравнительного анализа таксономического состава кишечной микрофлоры не представляется возможным в полной мере оценить такие конфаундеры, как диета, условия жизни, стресс, перенесенные инфекции, способные оказывать влияние на таксономическое разнообразие микробиомного ландшафта. Кроме того, выбранный метод cеквенирования гена 16S рРНК для изучения разнообразия микробиоты кишечника имеет ограничение в таксономической идентификации бактериального агента лишь до рода.
Заключение / Conclusion
Для пациенток с ПНБ характерны дисбиотические изменения микробиомного ландшафта, связанные со снижением численности представителей родов Bifidоbасtеrium, Lаchnоsрirа, Rоsеburiа, Сорrососсus на фоне повышения численности потенциальных патобионтов Ruminоcоссus и Кlеbsiеllа. Обнаруженные статистически значимые корреляции некоторых представителей микробиоты с нейро-иммунно-гуморальных биомаркерами указывают на вовлеченность дисбиотических изменений кишечника в развитие иммунных нарушений и дисрегуляцию эпифизарно-гипофизарно-надпочечниковой оси, лежащих в основе патогенеза ПНБ.
Список литературы
1. Клинические рекомендации – Выкидыш (самопроизвольный аборт) – 2021-2022-2023 (19.01.2023). М.: Министерство здравоохранения Российской Федерации, 2023. 25 с. Режим доступа: https://disuria.ru/_ld/12/1232_kr21O02O05MZ.pdf. [Дата обращения: 20.05.2024].
2. Полушкина Е.С., Шмаков Р.Г. Роль дидрогестерона в привычном невынашивании беменности. Медицинский совет. 2020;(3):74–7. https://doi.org/10.21518/2079-701X-2020-3-74-77.
3. Григушкина Е.В., Малышкина А.И., Сотникова Н.Ю. и др. Патогенетические аспекты привычного невынашивания беременности. Вестник Ивановской государственной медицинской академии. 2021;26(2):30–6. https://doi.org/10.52246/1606-8157_2021_26_2_30.
4. Dai F.-F., Hu M., Zhang Y.-W. et al. TNF-α/anti-TNF-α drugs and its effect on pregnancy outcomes. Expert Rev Mol Med. 2022;24:e26. https://doi.org/10.1017/erm.2022.18.
5. Saifi B., Rezaee S.A., Tajik N. et al. Th17 cells and related cytokines in unexplained recurrent spontaneous miscarriage at the implantation window. Reprod Biomed Online. 2014;29(4):481–9. https://doi.org/10.1016/j.rbmo.2014.06.008.
6. Piccinni M.P., Raghupathy R., Saito S., Szekeres-Bartho J. Cytokines, hormones and cellular regulatory mechanisms favoring successful reproduction. Front Immunol. 2021;12:717808. https://doi.org/10.3389/fimmu.2021.717808.
7. Yang S.-L, Tan H.-X., Niu T.-T. et al. Kynurenine promotes the cytotoxicity of NK cells through aryl hydrocarbon receptor in early pregnancy. J Reprod Immunol. 2021;143:103270. https://doi.org/10.1016/j.jri.2020.103270.
8. Sha J., Liu F., Zhai J. et al. Alteration of Th17 and Foxp3+ regulatory T cells in patients with unexplained recurrent spontaneous abortion before and after the therapy of hCG combined with immunoglobulin. Exp Ther Med. 2017;14(2):1114–18. https://doi.org/10.3892/etm.2017.4574.
9. Sheng J.A., Bales N.J., Myers S.A. et al. The hypothalamic-pituitary-adrenal axis: development, programming actions of hormones, and maternal-fetal interactions. Front Behav Neurosci. 2021;14:601939. https://doi.org/10.3389/fnbeh.2020.601939.
10. McCarthy R., Jungheim E.S, Fay J.C. et al. Riding the rhythm of melatonin through pregnancy to deliver on time. Front Endocrinol (Lausanne). 2019;13(10):616. https://doi.org/10.3389/fendo.2019.00616.
11. Nepomnaschy P.A., Welch K.B., McConnell D.S. et al. Cortisol levels and very early pregnancy loss in humans. Proc Natl Acad Sci U S A. 2006;103(10):3938–42. https://doi.org/10.1073/pnas.0511183103.
12. Palmer K.T., Bonzini M., Harris E.C. et al. Work activities and risk of prematurity, low birthweight and pre-eclampsia: an updated review with meta-analysis. Occup Environ Med. 2013;70(4):213–22. https://doi.org/10.1136/oemed-2012-101032.
13. Kisanga E.P., Tang Z., Guller S., Whirledge S. Glucocorticoid signaling regulates cell invasion and migration in the human first-trimester trophoblast cell line Sw.71. Am J Reprod Immunol. 2018;80(1):e12974. https://doi.org/10.1111/aji.12974.
14. Húngaro T.G.R., Gregnani M.F., Alves-Silva T. et al. Cortisol dose-dependently impairs migration and tube-like formation in a trophoblast cell line and modulates inflammatory and angiogenic genes. Biomedicines. 2021;9(8):980. https://doi.org/10.3390/biomedicines9080980.
15. Sandyk R., Anastasiadis P.G., Anninos P.A., Tsagas N. The pineal gland and spontaneous abortions: Implications for therapy with melatonin and magnetic field. Int J Neurosci. 1992;62(3–4):243–50. https://doi.org/10.3109/00207459108999775.
16. Jin M., Li D., Ji R. et al. Changes in gut microorganism in patients with positive immune antibody-associated recurrent abortion. Biomed Res Int. 2020;2020:4673250. https://doi.org/10.1155/2020/4673250.
17. Cui Y., Zou L., Ye Q. et al. Gut microbiota composition and functional prediction in recurrent spontaneous abortion. Research Square. 2021;1:1–22. https://doi.org/10.21203/rs.3.rs-906730/v1.
18. Liu Y., Chen H., Feng L., Zhang J. Interactions between gut microbiota and metabolites modulate cytokine network imbalances in women with unexplained miscarriage. NPJ Biofilms Microbiomes. 2021;7(1):24. https://doi.org/10.1038/s41522-021-00199-3.
19. Henke M.T, Kenny D.J., Cassilly C.D. et al. Ruminococcus gnavus, a member of the human gut microbiome associated with Crohn’s disease, produces an inflammatory polysaccharide. Proc Natl Acad Sci U S A. 2019;116(26):12672–7. https://doi.org/10.1073/pnas.1904099116.
20. Bromberg J.S., Hittle L, Xiong Y. et al. Gut microbiota-dependent modulation of innate immunity and lymph node remodeling affects cardiac allograft outcomes. JCI Insight. 2018;3(19):e121045. https://doi.org/10.1172/jci.insight.1210452672–12677.
21. Ziegler D.R., Herman J.P. Neurocircuitry of stress integration: anatomical pathways regulating the hypothalamo-pituitary-adrenocortical axis of the rat. Integr Comp Biol. 2002;42(3):541–51. https://doi.org/10.1093/icb/42.3.541.
22. Поросюк М.В., Клементьев Д.Д., Ходов Н.А. и др. Изменения микробиоты кишечника у больных ювенильным идиопатическим артритом. Вестник РГМУ. 2022;(6):13–9. https://doi.org/10.24075/vrgmu.2022.060.
23. Huang X., Qiu Y., Gao Y. et al. Gut microbiota mediate melatonin signalling in association with type 2 diabetes. Diabetologia. 2022;65(10):1627–41. https://doi.org/10.1007/s00125-022-05747-w.
Об авторах
А. В. ТормозоваРоссия
Тормозова Арина Викторовна
295051 Симферополь, бульвар Ленина, д. 5/7
А. А. Эракаева
Россия
Эракаева Альбина Аметовна
295051 Симферополь, бульвар Ленина, д. 5/7
Г. А. Ибадуллаева
Россия
Ибадуллаева Гульнар Азизовна
295051 Симферополь, бульвар Ленина, д. 5/7
А. С. Галата
Россия
Галата Анастасия Сергеевна
295051 Симферополь, бульвар Ленина, д. 5/7
А. С. Асиновская
Россия
Асиновская Александра Сергеевна
295051 Симферополь, бульвар Ленина, д. 5/7
Д. Э. Кузюра
Россия
Кузюра Диана Энверовна
295051 Симферополь, бульвар Ленина, д. 5/7
К. Н. Ефремова
Россия
Ефремова Кристина Николаевна
295051 Симферополь, бульвар Ленина, д. 5/7
В. М. Чос
Россия
Чос Валерия Максимовна
295051 Симферополь, бульвар Ленина, д. 5/7
У. В. Сварник
Россия
Сварник Ульяна Владимировна
295051 Симферополь, бульвар Ленина, д. 5/7
А. А. Дьяченко
Россия
Дьяченко Алина Александровна
295051 Симферополь, бульвар Ленина, д. 5/7
А. Н. Мавлютова
Россия
Мавлютова Айше Нариман кызы
295051 Симферополь, бульвар Ленина, д. 5/7
Л. А. Мукосий
Россия
Мукосий Людмила Андреевна
295051 Симферополь, бульвар Ленина, д. 5/7
Ю. С. Карпусь
Россия
Карпусь Юлия Сергеевна
295051 Симферополь, бульвар Ленина, д. 5/7
Е. Д. Пирожкова
Россия
Пирожкова Евгения Дмитриевна
117513 Москва, ул. Островитянова, д. 1
Ф. А. Альбекова
Россия
Альбекова Федире Айдэровна
295051 Симферополь, бульвар Ленина, д. 5/7
Л. Е. Сорокина
Россия
Сорокина Лея Евгеньевна
295051 Симферополь, бульвар Ленина, д. 5/7; 117997 Москва, ул. Академика Опарина, д. 4
Что уже известно об этой теме?
► Привычное невынашивание беременности (ПНБ) – одно из самых серьезных и социально значимых осложнений беременности.
► Центральными звеньями патогенеза ПНБ выступают иммунные нарушения и дисрегуляция эпифизарно-гипофизарно-надпочечниковой оси.
► Ранее проведенные исследования предоставляют убедительные доказательства изменений микробиоты кишечника у женщин с ПНБ.
Что нового дает статья?
► Показано, что для беременных с ПНБ в анамнезе характерно более низкое α-разнообразие бактериального сообщества.
► Уточнен характер таксономического состава микробиоты кишечника у пациенток с ПНБ на уровне родов.
► Установлены статистически значимые корреляции некоторых родов бактерий с системными уровнями нейро-иммунно-гуморальных биомаркеров.
Как это может повлиять на клиническую практику в обозримом будущем?
► Доказана роль дисбиоза кишечника как значимого фактора в патогенезе ПНБ.
► Прицельное воздействие на микробиоту кишечника может способствовать повышению эффективности терапевтических подходов в лечении ПНБ.
Рецензия
Для цитирования:
Тормозова А.В., Эракаева А.А., Ибадуллаева Г.А., Галата А.С., Асиновская А.С., Кузюра Д.Э., Ефремова К.Н., Чос В.М., Сварник У.В., Дьяченко А.А., Мавлютова А.Н., Мукосий Л.А., Карпусь Ю.С., Пирожкова Е.Д., Альбекова Ф.А., Сорокина Л.Е. Таксономическое разнообразие микробиомного кишечного ландшафта и его клиническое значение при привычном невынашивании беременности. Акушерство, Гинекология и Репродукция. 2025;19(3):360-368. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.620
For citation:
Tormozova A.V., Erakaeva A.A., Ibadullaeva G.A., Galata A.S., Asinovskaya A.S., Kuzyura D.E., Efremova K.N., Chos V.M., Svarnik U.V., Dyachenko A.A., Mavlyutova A.N., Mukosiy L.A., Karpus Yu.S., Pirozhkova E.D., Albekova F.A., Sorokina L.E. Taxonomic diversity of the intestinal microbiome landscape and its clinical significance in recurrent pregnancy loss. Obstetrics, Gynecology and Reproduction. 2025;19(3):360-368. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.620

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































