Перейти к:
Использование доплерографии глазных артерий в прогнозировании и ранней диагностике преэклампсии
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.609
Аннотация
Цель: изучить параметры кровотока у беременных в глазной артерии для прогнозирования развития преэклампсии (ПЭ) и сравнить прогностическую ценность их изменения с расчетным риском ПЭ при первом пренатальном скрининге.
Материалы и методы. Проведено проспективное когортное сравнительное исследование, в котором участвовали 80 беременных. Из них 40 имели высокий риск ПЭ по пренатальному скринингу I триместра (основная группа), а 40 – низкий риск (контрольная группа). Исследование параметров кровотока в глазной артерии (с учетом среднего показателя из двух исследуемых сосудов справа и слева) проводилось с 11 до 13⁺⁶ недель беременности с использованием доплерометрии. Оценивали пиковую систолическую скорость 1 (англ. pick systolic velocity 1, PSV1), пиковую систолическую скорость 2 (англ. pick systolic velocity 2, PSV2), индекс пульсации, индекс резистентности. Проводили анализ течения и исходов беременностей.
Результаты. В основной группе с высоким риском ПЭ 27 (67,5 %) пациенток имели нормальное течение беременности и родили в срок (38–40 недель). У остальных беременность протекала с гипертензивными нарушениями и ПЭ. Из 40 женщин основной группы у 25 (62,5 %) роды были вагинальными, а у 15 (37,5 %) – посредством операции кесарева сечения (КС), при этом у 13 (86,7 %) из них по показаниям, связанным с ПЭ и задержкой роста плода (ЗРП). В контрольной группе с низким риском ПЭ 38 (95 %) женщин также родили в срок, 31 (77,5 %) из них вагинально, а 9 (22,5 %) были родоразрешены операцией КС по показаниям, не связанными с ПЭ и ЗРП. Из 80 пациенток, включенных в исследование, ПЭ развилась у 10 (12,5 %): 2 случая (5,0 %) в контрольной группе с низким риском и 8 (20,0 %) в основной группе с высоким риском. Ранняя ПЭ (до 34 недель) была диагностирована у 2 пациенток (20,0 %) из 10, а поздняя (после 34 недель) – у 8 (80,0 %), что указывает на преобладание поздней формы (соотношение 1:4). Значения PSV1 в контрольной группе были выше, хотя различия не были значимыми. Индексы пульсации и резистентности также не выявили значимых различий. У пациенток с высоким риском ПЭ отношение PSV2/PSV1 было на 8,0 % выше по сравнению с группой низкого риска ПЭ, но эти различия были статистически незначимы (p > 0,05), а среди тех беременных, у кого развилась ПЭ, отношение PSV2/PSV1 было значимо выше (p < 0,001) по сравнению с группой без ПЭ.
Заключение. Результаты исследования свидетельствуют о важности оценки параметров кровотока в глазной артерии у беременных в рамках I пренатального скрининга как дополнительного показателя для прогнозирования ПЭ.
Ключевые слова
Для цитирования:
Мэлэк М.И., Игнатко И.В., Тимохина Е.В., Кузьмина Т.Е., Федюнина И.А., Самойлова Ю.А., Алиева Ф.Н., Григорьян И.С., Подсекаева С.А. Использование доплерографии глазных артерий в прогнозировании и ранней диагностике преэклампсии. Акушерство, Гинекология и Репродукция. 2025;19(3):341-350. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.609
For citation:
Melek M.I., Ignatko I.V., Timokhina E.V., Kuzmina T.E., Fedyunina I.A., Samoilova Yu.A., Alieva F.N., Grigoryan I.S., Podsekaeva S.A. Use of ophthalmic artery Doppler in preeclampsia prognosis and early diagnostics. Obstetrics, Gynecology and Reproduction. 2025;19(3):341-350. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.609
Введение / Introduction
Преэклампсия (ПЭ) – это осложнение процесса гестации, обусловленное полиорганной дисфункцией, поражающее от 1,5 до 16,7 % беременных в различных странах и приводящее к 60 тыс. случаев материнской смертности и более 500 тыс. преждевременных родов во всем мире каждый год. ПЭ характеризуется впервые возникшей гипертонией, которая обычно развивается после 20 недель беременности, и признаками дисфункции различных органов, так называемых органов-мишеней. Поражения органов-мишеней, возникающие в результате ПЭ, разнообразны и могут включать протеинурию, острое повреждение почек, дисфункцию печени, гемолиз, тромбоцитопению, реже – разрыв печени, судороги (эклампсию), отек легких, цереброваскулярные события (инсульт) и смерть [1][2].
За последние десятилетия было предпринято несколько попыток раскрыть патофизиологию ПЭ для понимания ее патогенеза и обеспечения разработки более точных методов ранней диагностики, эффективных методов профилактики и эффективных терапевтических подходов. Наше понимание ПЭ на данный момент значительно изменилось, отойдя от рассмотрения ее как единичного расстройства, характеризующегося исключительно гипертонией и протеинурией или симптомами другой органной дисфункции. Вместо этого теперь ПЭ признана синдромом с разнообразными клиническими проявлениями и лежащими в основе патофизиологическими механизмами, что еще более осложняет выработку единой стратификации риска [3][4].
На сегодняшний день доминирует концепция приоритетной роли патологии волн инвазии трофобласта и плацентарной ишемии в генезе гипертензивных гестационных нарушений, в том числе ПЭ [5]. Эндомиометральные сегменты конечных ветвей маточных артерий претерпевают частичную или неполноценную ангиотрансформацию, сохраняя рецепторный аппарат и контрактильную способность, что на фоне недостаточного прироста объемных гемодинамических показателей способствует повышению локального и суммарного периферического сопротивления [6].
Другие варианты плацента-ассоциированных заболеваний также имеют в основе указанные выше патофизиологические особенности [7]. Современные наблюдения указывают на возможную роль дисбаланса ангиогенных факторов в патогенезе ПЭ. В ходе обширных исследований были выявлены некоторые ангиогенные факторы, включая растворимую fms-подобную тирозинкиназу-1 (англ. soluble fms-like tyrosine kinase-1, sFlt-1), плацентарный фактор роста (англ. placental growth factor, PlGF) и растворимый эндоглин, которые могут быть потенциальными инструментами для прогнозирования раннего начала ПЭ. Однако ни один из этих тестов не обеспечивает достоверного прогноза ПЭ, и Для подтверждения их клинической полезности необходимы дальнейшие проспективные исследования [8].
После 20 недель беременности ПЭ приводит к серьезным осложнениям из-за системных нарушений функции эндотелия, выстилающего кровеносные сосуды. Тяжелая ПЭ может вызвать: отек головного мозга, судороги (эклампсия), печеночную, почечную и сердечно-сосудистую недостаточность [9].
Поскольку глазная артерия является прямым продолжением внутренней сонной артерии и имеет общие черты с внутричерепными артериями малого калибра как в эмбриогенезе, так и в функционировании, ультразвуковое исследование (УЗИ) глазной артерии можно считать неинвазивным методом исследования сосудов головного мозга [10]. Преимущества доплерографии глазной артерии (ДГА) включают легкость измерения с помощью стандартного ультразвукового оборудования и независимость от воздействия жировой ткани. Эти факторы делают ДГА подходящим инструментом как для скрининга и наблюдения за пациентами с риском ПЭ в условиях неограниченных ресурсов и технического оснащения, так и как дополнение к сформированным прогностическим программам [11].
Доплерография глазных артерий рассматривается как важный инструмент в диагностике ПЭ, поскольку патогенез этого состояния связан не только с плацентарным ложем, но также с сердечно-сосудистой и эндотелиальной адаптацией в период беременности, а также потерей автономии регуляции сосудистого тонуса церебрального ангиокомпартмента [12].
Глаз, как часть центральной нервной системы, отражает состояние микроциркуляции. Исследование кровотока в сосудах глаза и орбиты у беременных с гипертензией важно, поскольку у женщин с ПЭ часто наблюдаются зрительные нарушения, включая преэклампсическую ретинопатию. Ишемия сетчатки и гиперперфузия центральной артерии сетчатки могут усугубить зрительные нарушения при повышении артериального давления [13][14].
Цель: изучить параметры кровотока у беременных в глазной артерии для прогнозирования развития ПЭ и сравнить прогностическую ценность их изменения с расчетным риском ПЭ при первом пренатальном скрининге.
Материалы и методы/ Materials and Methods
Дизайн исследования / Study design
С апреля 2023 г. по март 2024 г. в ГБУЗ ГКБ им. С.С. Юдина ДЗМ (клиническая база кафедры акушерства, гинекологии и перинатологии Института клинической медицины имени Н.В. Склифосовского Сеченовского Университета) проведено проспективное когортное сравнительное исследование, в котором приняли участие 80 беременных. Из них 40 имели высокий риск развития ПЭ по данным биохимического скрининга (они были включены в основную группу) и 40 – низкий риск развития ПЭ (они составили контрольную группу).
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения: от 18 до 45 лет; спонтанная одноплодная беременность; отсутствие офтальмологических заболеваний; отсутствие тяжелого течения различных хронических соматических заболеваний; отсутствие аутоиммунных заболеваний; индекс массы тела (ИМТ) 18–35 кг/м²; проведение первого ультразвукового и пренатального скрининга (в диапазоне 11–13⁺⁶ недель беременности); подписанное информированное согласие.
Критерии исключения: возраст моложе 18 и старше 45 лет; беременность, наступившая в результате вспомогательных репродуктивных технологий; многоплодная беременность; наличие хронических заболеваний органа зрения; подтвержденная офтальмологическая патология; тяжелая соматическая патология, онкологические и аутоиммунные заболевания; ожирение III степени и морбидное ожирение; хромосомные заболевания плода, в том числе высокий риск их развития, согласно результатам первого ультразвукового и биохимического скрининга; отказ от участия в исследовании.
Методы исследования / Study methods
У всех пациенток проводили сбор акушерско-гинекологического анамнеза, анамнеза жизни и соматического, выясняли особенности гинекологической и общей заболеваемости, число беременностей, особенности их течения и исходы, включая количество и исходы родов. Выясняли хирургический анамнез, при наличии соматических заболеваний – особенности их лечения. Рассчитывали ИМТ.
Изучение показателей кровотока в a. ophthalmica осуществляли в сроки гестации от 11 недель до 13⁺⁶ недель (в рамках проведения первого пренатального скрининга) методом доплерометрии на УЗ-приборе GE Voluson E6 (GE Healthcare, General Electric, США) с использованием линейного датчика в режиме цветного доплеровского картирования. Исследование проводили в положении лежа после 5–7-минутного отдыха при закрытых веках в обеих глазных артериях пациенток. Линейный датчик с частотой 7,5 МГц помещали горизонтально на область верхнего века, не оказывая давления. Для идентификации глазной артерии, которая расположена выше и медиальнее гипоэхогенной полосы, соответствующей топографии зрительного нерва (n. opticus), использовали приставку цветного доплеровского картирования. При регистрации 3–5 одинаковых волновых форм спектра кровотока глазной артерии с помощью импульсно-волновой доплерографии выполняли измерение параметров кровотока (рис. 1).
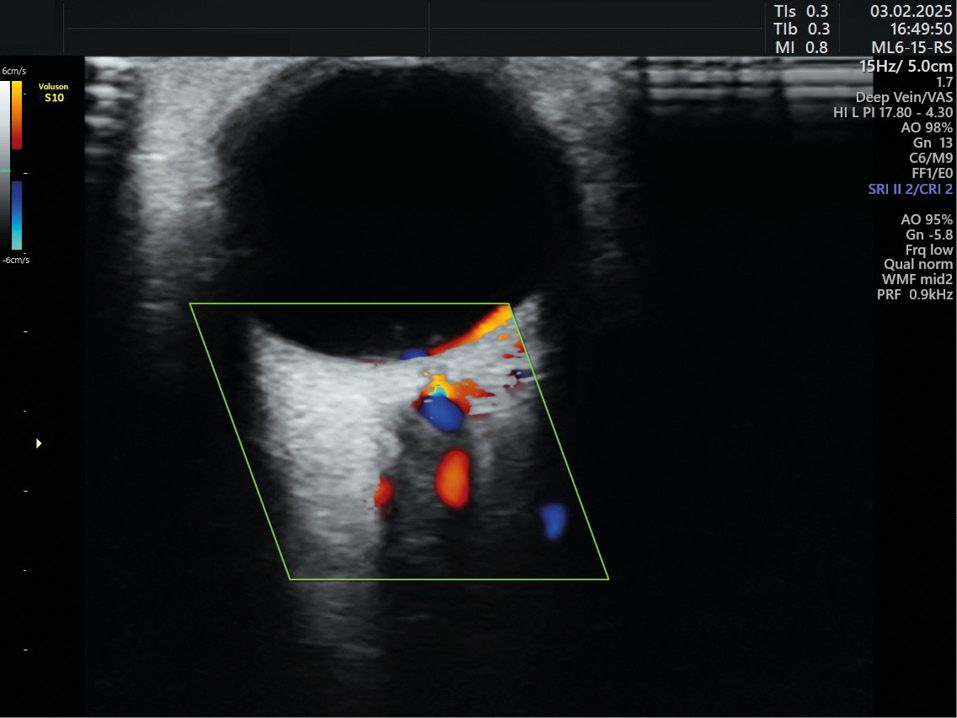
Рисунок 1. Кровоток в глазной артерии, режим цветного доплеровского картирования.
Figure 1. Ophthalmic artery blood flow, color Doppler imaging.
Систолический компонент кровотока в глазной артерии (a. ophthalmica) имеет 2 пика, вследствие чего измеряются первая пиковая систолическая скорость (англ. pick systolic velocity 1, PSV1), вторая пиковая систолическая скорость (англ. pick systolic velocity 2, PSV2), соотношение PSV2/PSV1, конечная диастолическая скорость (англ. end diastolic velocity, EDV), систоло-диастолическое отношение (S/D), пульсационный индекс (PI) и индекс резистентности (RI). PSV1, PI и RI рассчитывались автоматически при помощи аппарата, а PSV2 и соотношение PSV2/PSV1 измерялись вручную.
Статистические методы / Statistical analysis
Статистический анализ проводили с использованием программы StatTech v. 2.6.5 (ООО «Статтех», Россия). Для описания количественных данных c нормальным распределением использовали среднее арифметическое (М) и стандартное отклонение (SD); при описании признаков с распределением, отличным от нормального, использовали медиану и интерквартильный интервал (Me [Q1–Q3]). Величину порогового уровня значимости «p» принимали равной 0,05. Для попарного сравнения значений в группах использовали тест Манна–Уитни, различия значений в группах принимались статистически значимыми при p < 0,05. Корректировку значений статистической значимости при множественных сравнениях выполняли посредством поправки Бонферрони. Для оценки риска развития ПЭ был использован расчет относительного риска (англ. relative risk, RR) и 95 % доверительный интервал (ДИ).
Результаты / Results
В основной группе у 27 (67,5 %) пациенток беременность протекала без осложнений и завершилась своевременными родами на сроке 38–40 недель. У 25 (62,5 %) женщин основной группы роды были вагинальными, а у 15 (37,5 %) – путем операции кесарева сечения (КС), при этом у 13 (86,7 %) из них по показаниям, связанным с гипертензивными нарушениями и ПЭ.
В контрольной группе у 38 (95 %) пациенток беременность протекала без осложнений и завершилась своевременными родами на сроке 38–40 недель. У 31 (77,5 %) женщин контрольной группы роды были вагинальными, а у 9 (22,5 %) – путем КС по показаниям, не связанным с гипертензивными нарушениями.
В ходе исследования, проведенного на выборке из 80 пациенток, было установлено, что ПЭ манифестировала у 10 (12,5 %) из них (табл. 1). В частности, при пренатальном скрининге I триместра среди пациенток с низким риском ПЭ (n = 40, контрольная группа) наблюдалось 2 случая ПЭ (5 %), тогда как в группе с высоким риском (n = 40, основная группа) было 8 пациенток с ПЭ (20 %). У женщин, страдающих ПЭ, выявлен более старший возраст (p = 0,004), значимо более высокие значения ИМТ (p < 0,001) и случаи хронической артериальной гипертензии (ХАГ) (p < 0,001). Более того, ранняя ПЭ (развивающаяся до 34 недель) была среди всех обследованных беременных диагностирована у 2 пациенток из 10 (20 %), в то время как поздняя (развивающаяся после 34 недель беременности) – у 8 пациенток (80 %). Таким образом, соотношение между случаями ранней и поздней ПЭ составило 1:4, что подчеркивает преобладание поздней формы заболевания в данной выборке.
Таблица 1. Клинико-анамнестическая характеристика обследованных беременных в зависимости от манифестации преэклампсии (ПЭ).
Table 1. Clinical and anamnestic characteristics based on preeclampsia (РЕ) manifestation.
|
Характеристика Characteristics |
ПЭ не манифестировала PЕ not manifested n = 70 |
ПЭ манифестировала PЕ manifested n = 10 |
р |
|
Возраст, лет, М ± SD / Age, years, М ± SD |
26,0 ± 4,0 |
30,0 ± 2,8 |
0,004 |
|
Индекс массы тела, кг/м², М ± SD / Body mass index, kg/m², М ± SD |
24,32 ± 2,56 |
27,45 ± 2,82 |
0,001 |
|
Курение, n (%) / Smoking, n (%) |
8 (11,43) |
3 (30,0) |
0,136 |
|
Хроническая гипертензия, n (%) / Chronic hypertension, n (%) |
0 (0) |
3 (30,0) |
0,001 |
|
Сахарный диабет (вне беременности), n (%) Diabetes mellitus (out of pregnancy), n (%) |
0 (0) |
1 (10,0) |
0,125 |
|
Перенесенная преэклампсия, n (%) / History of preeclampsia, n (%) |
0 (0) |
1 (10,0) |
0,125 |
|
Паритет* / Parity*: |
|||
|
Нерожавшая, n (%) / Nulliparous, n (%) |
29/70 (41,4) |
4/6 (66,7) |
0,125 |
|
В анамнезе 1 роды, n (%) / History of one delivery, n (%) |
30/41 (73,2) |
3/4 (75,0) |
0,440 |
|
В анамнезе 2 родов, n (%) / History of two deliveries, n (%) |
10/41 (24,4) |
1/4 (25,0) |
0,208 |
|
В анамнезе 3 и более родов, n (%) History of three or more deliveries, n (%) |
1/41 (2,4) |
0/44 (0,0) |
0,692 |
Примечание: р – значимость различий между группами; выделены значимые различия; * процент рассчитан от числа рожавших женщин.
Note: p – significance of inter-group differences; significant differences are highlighted in bold; * percentage calculated from the number of parous women.
На основе анализа данных, касающихся риска ПЭ, можно выделить несколько важных аспектов для понимания и диагностики этого состояния. Рассматривались такие показатели, как PSV1, PSV2, PI, RI, соотношение систолического и диастолического давления, конечный диастолический объем и соотношение PSV2/PSV1 в группах с различным уровнем риска ПЭ (рис. 2).
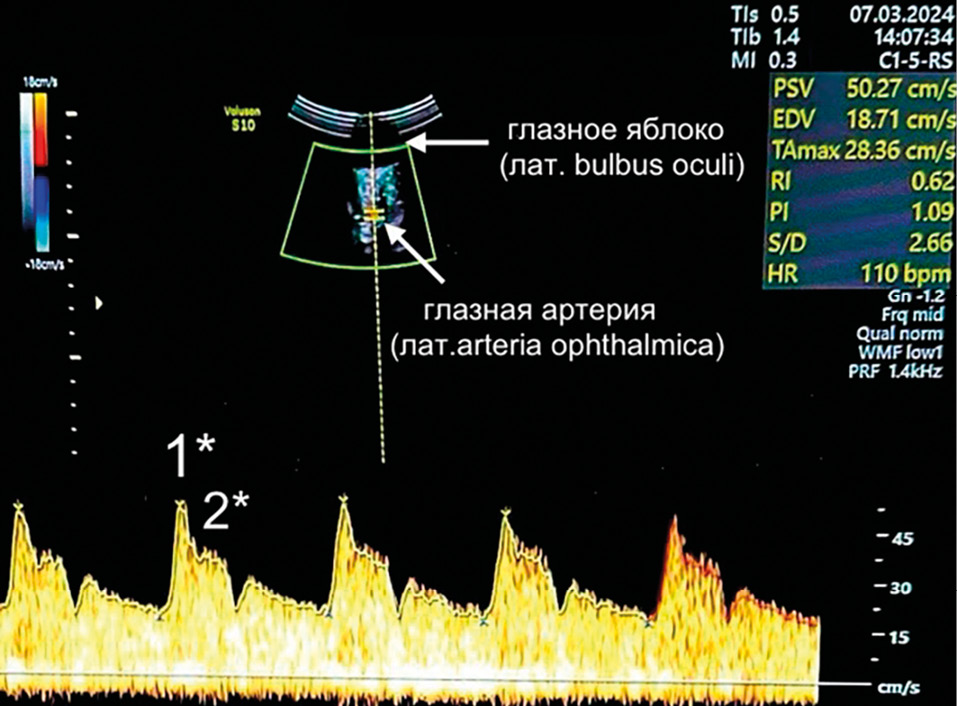
Рисунок 2. Спектр кровотока в глазной артерии беременной при проведении первого пренатального скрининга.
Примечание: 1* – первая пиковая скорость систолы; 2* – вторая пиковая скорость систолы.
Figure 2. Ophthalmic artery blood flow spectrum in a pregnant woman during prenatal screening 1.
Note: 1* – pick systolic velocity 1; 2* – pick systolic velocity 2.
На рисунке 2 представлена кривая скорости кровотока глазной артерии, полученная с применением доплеровской ультрасонографии. В нижней части представлена волновая форма, полученная с использованием импульсного доплера, которая демонстрирует первую (1*) и вторую (2*) пиковые скорости систолы.
Результаты анализа показали, что значения PSV1 в группе с низким риском ПЭ превышают аналогичные значения в группе с высоким риском ПЭ, хотя различия не являются значимыми (табл. 2).
Таблица 2. Показатели кровотока в глазной артерии у беременных с различным риском и при развившейся преэклампсии (ПЭ).
Table 2. Parameters of ophthalmic artery blood flow in pregnant women at varying preeclampsia (РЕ) development risks and with developed РЕ.
|
Показатель Parameter М ± SD |
Низкий риск ПЭ Low РЕ risk n = 40 |
Высокий риск ПЭ High РЕ risk n = 40 |
ПЭ PЕ n = 10 |
p |
|
PSV1 |
35,19 ± 9,84 |
31,43 ± 9,99 |
32,59 ± 11,03 |
0,769 |
|
PSV2 |
23,26 ± 6,69 |
22,97 ± 7,46 |
25,62 ± 8,40 |
0,862 |
|
PI |
1,77 ± 0,37 |
1,78 ± 0,44 |
1,41± 0,25 |
0,907 |
|
RI |
0,75 ± 0,14 |
0,77 ± 0,11 |
0,70 ± 0,17 |
0,596 |
|
S/D |
4,17 ± 0,63 |
4,33 ± 0,71 |
3,91 ± 1,18 |
0,776 |
|
EDV |
7,83 ± 1,91 |
7,09 ± 2,34 |
8,28 ± 1,88 |
0,101 |
|
PSV2/PSV1 |
0,68 ± 0,16 |
0,74 ± 0,13 |
0,91 ± 0,15 |
0,001 |
Примечание: PSV1 – пиковая систолическая скорость 1; PSV2 – пиковая систолическая скорость 2; PI – пульсационный индекс; RI – индекс резистентности; S/D – систоло-диастолическое отношение; EDV – конечная диастолическая скорость.
Note: PSV1 – peak systolic velocity 1; PSV2 – peak systolic velocity 2; PI – pulsatility index; RI – resistance index; S/D – systole-diastolic ratio; EDV – end diastolic velocity.
Показатели PSV2 также не выявили значимых различий. PI, RI и систоло-диастолическое отношение (S/D) в сроки проведения скрининга продемонстрировали схожие результаты между группами. Конечная диастолическая скорость у группы с низким риском оказалась немного выше, но также незначимо.
Особое внимание следует уделить соотношению PSV2/PSV1, которое показало значимые различия между группами и может играть важную роль в оценке риска ПЭ (табл. 3).
Таблица 3. Соотношение PSV2/PSV1 в зависимости от манифестации преэклампсии (ПЭ).
Table 3. PSV2/PSV1 ratio magnitude based on preeclampsia (РЕ) manifestation.
|
Категория Category |
Me |
Q1–Q3 |
n |
p |
|
Манифестация ПЭ РЕ manifestation |
0,91 |
0,88–0,91 |
10 |
< 0,001 |
|
Отсутствие ПЭ No PE |
0,61 |
0,55–0,73 |
70 |
У беременных, имеющих высокий риск ПЭ по результатам I пренатального скрининга, соотношение PSV2/PSV1 было на 8 % выше, чем в группе с низким риском ПЭ (рис. 3), но эти различия были статистически незначимы (p > 0,05).
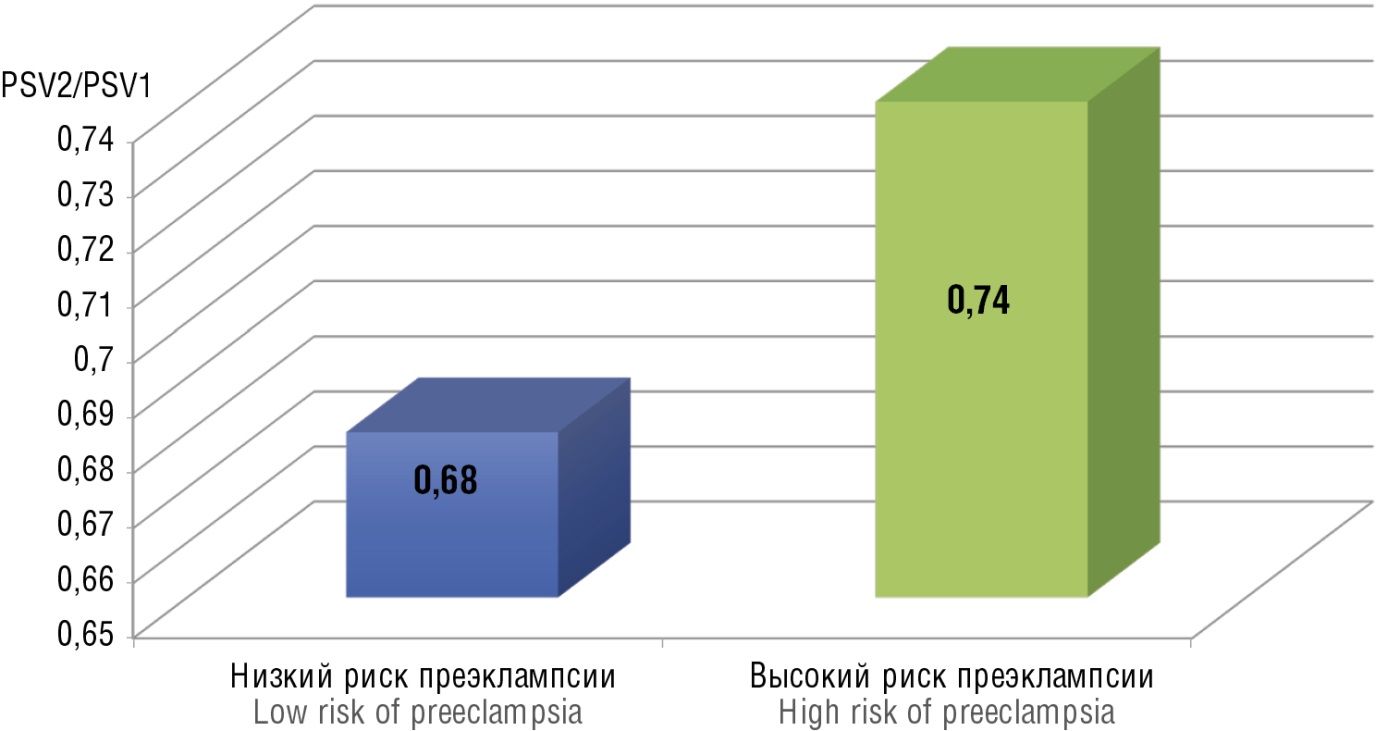
Рисунок 3. Значение PSV2/PSV1 в зависимости от степени риска развития преэклампсии (p > 0,05).
Figure 3. PSV2/PSV1 ratio magnitude based on degree of preeclampsia development risk (p > 0.05).
При оценке соотношения PSV2/PSV1 в зависимости от наличия или отсутствия ПЭ были установлены статистически значимые различия между пациентками с развившейся ПЭ и без нее (p < 0,001). Среди пациенток, у которых в дальнейшем развивалась та или иная форма ПЭ, соотношение PSV2/PSV1 было на 26 % выше (p < 0,001), чем в группе, в которой ПЭ не было на протяжении беременности (рис. 4).
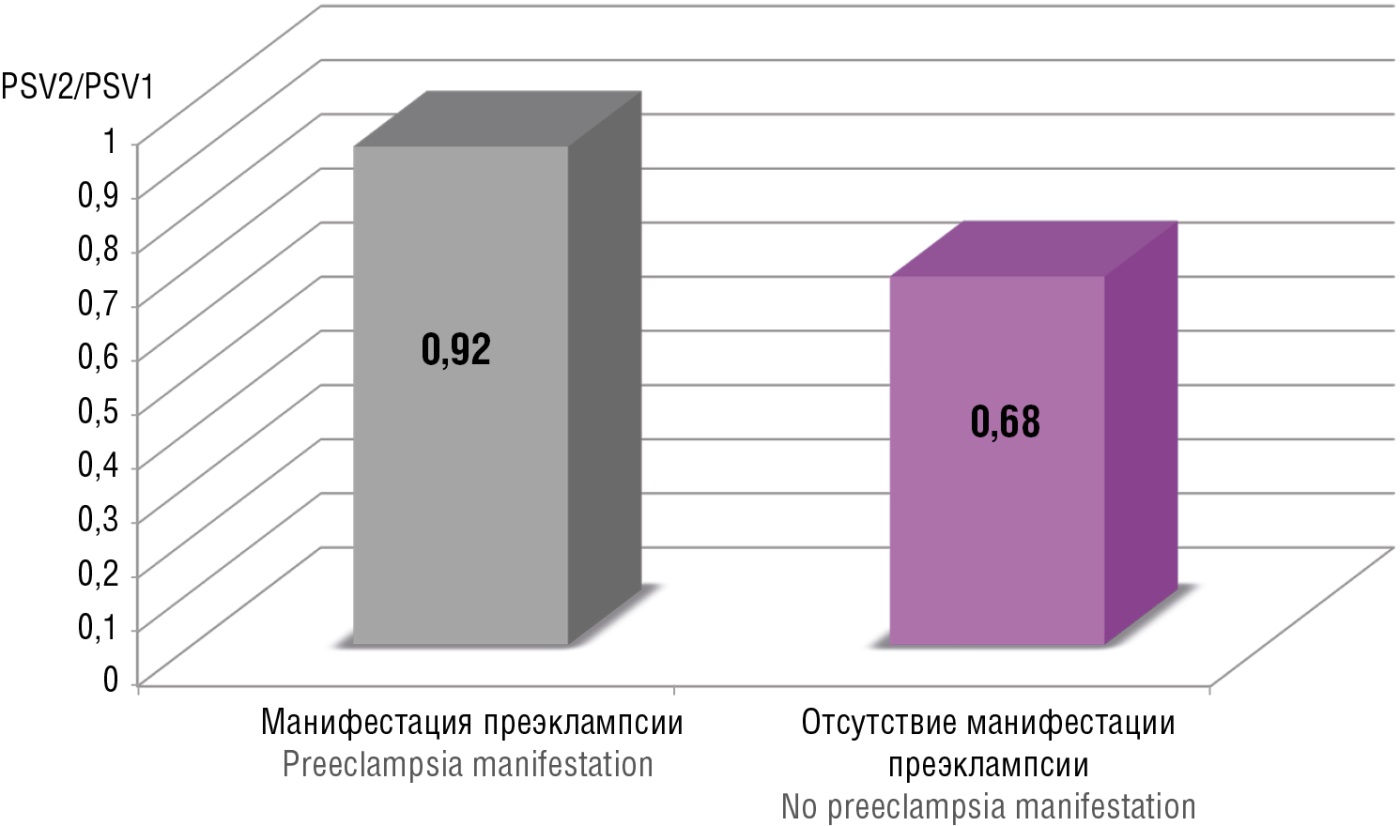
Рисунок 4. Значение PSV2/PSV1 в зависимости от манифестации преэклампсии (p < 0,001).
Figure 4. PSV2/PSV1 magnitude based on preeclampsia manifestation (p < 0.001).
Выявлено, что увеличение соотношения PSV2/PSV1 позволяет сделать предположение о высоком риске развития ПЭ. Нами был рассчитан риск развития ПЭ у пациенток с повышением соотношения PSV2/PSV1 более 0,9. Наши результаты показали, что у всех женщин с развившейся ПЭ значение PSV2/PSV1 было более 0,9, при этом у 3 женщин с данным значением ПЭ не развилась, но был высокий риск ПЭ по данным I пренатального скрининга (RR = 20,91; 95 % ДИ = 6,806–64,237), и пациенткам была назначена ацетилсалициловая кислота.
Обсуждение / Discussion
Доплерографическое исследование глазной артерии у беременных было впервые предложено T. Hata с соавт. в 1992 г. В рамках данного исследования было продемонстрировано, что пульсационный индекс существенно снижается при ПЭ [15]. Позднее были получены данные, указывающие на то, что снижение сопротивления кровотоку в мозговом кровообращении может предшествовать развитию ПЭ. В двух небольших проспективных исследованиях, в которых участвовало около 500 женщин, оценивали ценность доплерографии глазных артерий для прогнозирования ПЭ в I или II триместре; в одном из них было отмечено, что метод обладает прогностической ценностью [16], а в другом, что не обладает [17].
В одном из последних систематических обзоров, касающихся данного вопроса, были проанализированы 8 исследований, которые разделили результаты на легкую и тяжелую, а также раннюю и позднюю ПЭ, охватив 1425 беременных. Индексы пикового соотношения и PSV2 продемонстрировали наилучшие диагностические показатели, включая высокую чувствительность и специфичность, а также низкий уровень ложноположительных результатов. Индексы RI, PI и EDV также показали хорошие результаты и согласованность в разных исследованиях, но их показатели были несколько ниже [18].
В исследовании, включающем 2287 пациенток, 60 беременных (2,6 %) были с ПЭ, из которых 19 (0,8 %) были родоразрешены менее чем через 3 недели после оценки кровотока в глазных артериях. Использование соотношения PSV2/PSV1 значительно улучшило прогнозирование ПЭ как при родах в любом сроке после оценки, так и при родах менее чем через 3 недели, достигая 59,4 % и 86,7 % случаев гестационной гипертензии соответственно [19].
Исследование N. Kumari с соавт. (2023), обследовавших 80 беременных – 40 с нормальным артериальным давлением (АД) и 40 с ПЭ, выявило значительные различия в пульсационном индексе глазной артерии и конечной диастолической скорости в этом же сосуде (EDV), обратно коррелирующие со средним АД и сроком гестации [20]. Эти результаты помогают различать ПЭ и нормотонию на поздних сроках беременности, подчеркивая эффективность ультразвукового исследования как безопасного метода диагностики.
Исходя из представленных данных, нами была поставлена цель выявить значение исследования кровотока в глазной артерии в рамках первого пренатального скрининга наряду с клинико-анамнестической оценкой состояния беременной в отношении прогнозирования высокого риска развития ПЭ и ее манифестации. Гемодинамический профиль беременной определяется многими факторами, в частности, избыточной массой тела и нарушениями регуляции АД. При оценке общего анамнеза у обследованных нами выявлен значимо более старший возраст женщин, страдающих ПЭ (p = 0,004). При сравнении ИМТ у женщин высокого риска развития ПЭ были обнаружены более высокие его значения (p < 0,001). Результаты оценки общего анамнеза показали, что наличие ХАГ является фактором высокого риска развития ПЭ (p < 0,001). Полученные нами данные подчеркивают важность более старшего репродуктивного возраста, повышенного ИМТ и наличие ХАГ как ключевых факторов риска, способствующих возникновению ПЭ.
При оценке кровотока в a. ophthalmica с использованием показателей PSV1 и PSV2 изолированно не было выявлено значимых различий между группами женщин с низким и высоким риском ПЭ, что говорит о необходимости использования не абсолютных значений скоростей, а как и свидетельствуют другие исследования, их соотношения. Однако следует отметить, что даже абсолютные значения PSV1 и PSV2 уже в I триместре гестации выше в группе женщин с высоким риском ПЭ, хотя различия не являются значимыми. В дальнейшем, при включении исследования кровотока в глазной артерии в систему предикции ПЭ этот факт следует учитывать, но, вероятнее, изменения будут более очевидны в более поздние сроки гестации, на что и обращали внимание Н.В. Храмченко с соавт. [14]. Следует отметить, что в нашем исследовании уже в сроки 11–13⁺⁶ недель среди пациенток, у которых дальнейшем развивалась та или иная форма ПЭ, соотношение PSV2/PSV1 было на 26 % выше, чем в группе, в которой не было ПЭ на протяжении беременности. Полученные нами данные указывают на необходимость применения соотношения PSV2/PSV1 в общей системе прогнозирования ПЭ уже в рамках I пренатального скрининга, однако требуются дальнейшие исследования.
Таким образом, наши результаты подчеркивают определенную прогностическую значимость соотношения PSV2/PSV1 для диагностики и прогнозирования ПЭ, а также подчеркнули необходимость и потенциальную прогностическую и диагностическую значимость дальнейшего оценки показателей в глазной артерии, в том числе в разные сроки гестации. В дальнейшем полученные данные могут иметь значение не только в стратификации риска различных фенотипов ПЭ, но и в улучшении материнских и перинатальных исходов.
Заключение / Conclusion
Результаты данного исследования акцентируют внимание на необходимости более глубокого изучения факторов риска и ранних диагностических доступных маркеров, связанных с ПЭ, что, в свою очередь, может способствовать разработке более эффективных профилактических мер.
Соотношение PSV2/PSV1 глазной артерии матери в сочетании с другими маркерами представляет собой перспективный метод прогнозирования развития ПЭ. Исследования в области материнской гемодинамики продемонстрировали, что мониторинг данного соотношения может служить полезным инструментом для стратификации риска ПЭ у беременных. Показатель PSV2/PSV1 имеет прогностическую ценность и позволяет проводить более информативный скрининг ПЭ в I триместре беременности, что определяет возможность превенции как самой ПЭ, так и связанных с ней материнских и фетальных осложнений, а также досрочного родоразрешения.
Тем не менее для достижения более точного прогнозирования необходимо проведение дальнейших исследований, которые будут учитывать не только материнскую гемодинамику, но и широкий спектр других факторов риска. Такой комплексный подход позволит более эффективно идентифицировать группы женщин, подверженных риску ПЭ, и разработать индивидуализированные стратегии профилактики.
Список литературы
1. GBD 2015 Maternal Mortality Collaborators. Global, regional, and national levels of maternal mortality, 1990–2015: a systematic analysis for the Global Burden of Disease Study 2015. Lancet. 2016;388(10053):1775–812. https://doi.org/10.1016/S0140-6736(16)31470-2.
2. GBD 2015 Child Mortality Collaborators. Global, regional, national, and selected subnational levels of stillbirths, neonatal, infant, and under-5 mortality, 1980–2015: a systematic analysis for the Global Burden of Disease Study 2015. Lancet. 2016;388(10053):1725–774. https://doi.org/10.1016/S0140-6736(16)31575-6.
3. Rana S., Lemoine E., Granger J.P., Karumanchi S.A. Preeclampsia: pathophysiology, challenges, and perspectives. Circ Res. 2019;124(7):1094–112. https://doi.org/10.1161/CIRCRESAHA.118.313276.
4. Leal C.R.V., Botezelli H., Las Casas J.F.D.C. et al. Urinary biomarkers of preeclampsia: an update. Adv Clin Chem. 2025;124:197–211. https://doi.org/10.1016/bs.acc.2024.11.002.
5. Brown M.A., Magee L.A., Kenny L.C. et al. The hypertensive disorders of pregnancy: ISSHP classification, diagnosis & management recommendations for international practice. Pregnancy Hypertens. 2018;13:291–310. https://doi.org/10.1016/j.preghy.2018.05.004.
6. Стрижаков А.Н., Тимохина Е.В., Ибрагимова С.М. и др. Новые возможности дифференциального прогнозирования ранней и поздней преэклампсии. Акушерство, Гинекология и Репродукция. 2018;12(2):55–61. https://doi.org/10.17749/2313-7347.2018.12.2.055-061.
7. Staff A.C, Fjeldstad H.E., Fosheim I.K. et al. Failure of physiological transformation and spiral artery atherosis: their roles in preeclampsia. Am J Obstet Gynecol. 2022;226(2S):S895–S906. https://doi.org/10.1016/j.ajog.2020.09.026.
8. Staff A.C. The two-stage placental model of preeclampsia: an update. J Reprod Immunol. 2019;134–135:1–10. https://doi.org/10.1016/j.jri.2019.07.004.
9. Gestational Hypertension and Preeclampsia: ACOG Practice Bulletin, Number 222. Obstet Gynecol. 2020;135(6):e237–e260. https://doi.org/10.1097/AOG.0000000000003891.
10. Timokhina E., Strizhakov A., Ibragimova S. et al. Matrix metalloproteinases MMP-2 and MMP-9 occupy a new role in severe preeclampsia. J Pregnancy. 2020;2020:8369645. https://doi.org/10.1155/2020/8369645.
11. Dai X., Kang L., Ge H. Doppler parameters of ophthalmic artery in women with preeclampsia: a meta-analysis. J Clin Hypertens (Greenwich). 2023;25(1):5–12. https://doi.org/10.1111/jch.14611.
12. Hikima M.S., Adamu M.Y., Lawal Y. et al. Changes in opthalmic artery Doppler velocimetry in women with preeclampsia in Kano, Nigeria. Ann Afr Med. 2023;22(1):5–10. https://doi.org/10.4103/aam.aam_26_21.
13. Kalafat E., Thilaganathan B. Cardiovascular origins of preeclampsia. Curr Opin Obstet Gynecol. 2017;29(6):383–9. https://doi.org/10.1097/GCO.0000000000000419.
14. Храмченко Н.В., Воеводин С.М., Зарецкая Н.В., Андронова Н.В. Предикторы тяжелой преэклампсии в III триместре беременности по данным периорбитальной допплерометрии. Акушерство и гинекология. 2016;(4):44–8. https://doi.org/10.18565/aig.2016.4.44-48.
15. Hata T., Senoh D., Hata K., Kitao M. Ophthalmic artery velocimetry in pregnant women. Lancet. 1992;340(8812):182–3. https://doi.org/10.1016/0140-6736(92)93268-r.
16. Alves J.A.G., de Sousa P.C P., Holanda Moura S.B.M.E. et al. First-trimester maternal ophthalmic artery Doppler analysis for prediction of pre-eclampsia. Ultrasound Obstet Gynecol. 2014;44(4):411–8. https://doi.org/10.1002/uog.13338.
17. Matias D.S., Costa R.F., Matias B.S. et al. Predictive value of ophthalmic artery Doppler velocimetry in relation to development of pre-eclampsia. Ultrasound Obstet Gynecol. 2014;44(4):419–26. https://doi.org/10.1002/uog.13313.
18. Vaz de Melo P.F.M., Roever L., Mendonça T.M.S. et al. Ophthalmic artery Doppler in the complementary diagnosis of preeclampsia: a systematic review and meta-analysis. BMC Pregnancy Childbirth. 2023;23(1):343. https://doi.org/10.1186/s12884-023-05656-9.
19. Sarno M., Wright A., Vieira N. et al. Ophthalmic artery Doppler in combination with other biomarkers in prediction of pre-eclampsia at 35-37 weeks' gestation. Ultrasound Obstet Gynecol. 2021;57(4):600–6. https://doi.org/10.1002/uog.23517. Erratum in: Ultrasound Obstet Gynecol. 2022;59(3):407. https://doi.org/10.1002/uog.24878.
20. Kumari N., Ranjan R.K., Rai N. et al. A correlational study of ophthalmic artery Doppler parameters and maternal blood pressure in normotensive and pre-eclamptic pregnancies at a tertiary care hospital. Cureus. 2023;15(6):e40713. https://doi.org/10.7759/cureus.40713.
Об авторах
М. И. МэлэкРоссия
Мэлэк Мила Ислам кызы
119048 Москва, ул. Трубецкая, д. 8, стр. 2
И. В. Игнатко
Россия
Игнатко Ирина Владимировна - д.м.н., проф., член-корр. РАН. Scopus Author ID: 15118951800. WoS ResearcherID: ABA-6794-2021.
119048 Москва, ул. Трубецкая, д. 8, стр. 2
Е. В. Тимохина
Россия
Тимохина Елена Владимировна - д.м.н., проф. Scopus Author ID: 25958373500.
119048 Москва, ул. Трубецкая, д. 8, стр. 2
Т. Е. Кузьмина
Россия
Кузьмина Татьяна Евгеньевна - к.м.н. Scopus Author ID: 57194424476.
119048 Москва, ул. Трубецкая, д. 8, стр. 2
И. А. Федюнина
Россия
Федюнина Ирина Александровна - к.м.н. Scopus Author ID: 57191911688.
119048 Москва, ул. Трубецкая, д. 8, стр. 2
Ю. А. Самойлова
Россия
Самойлова Юлия Алексеевна - к.м.н.
119048 Москва, ул. Трубецкая, д. 8, стр. 2; 115446 Москва, Коломенский проезд, д. 4
Ф. Н. Алиева
Россия
Алиева Фатима Назимовна
119048 Москва, ул. Трубецкая, д. 8, стр. 2
И. С. Григорьян
Россия
Григорьян Ирина Сергеевна
119048 Москва, ул. Трубецкая, д. 8, стр. 2
С. А. Подсекаева
Россия
Подсекаева Снежана Александровна
119048 Москва, ул. Трубецкая, д. 8, стр. 2
Что уже известно об этой теме?
► Преэклампсия (ПЭ) является важной проблемой в акушерстве и гинекологии, поскольку представляет собой основную причину материнской и неонатальной заболеваемости и смертности.
► Даже при наличии факторов риска, таких как высокое артериальное давление и ожирение, не у всех беременных развивается ПЭ и ее осложнения. Это подчеркивает важность выявления дополнительных предрасполагающих факторов, которые могут значительно увеличить риск тяжелых форм ПЭ и требуют более тщательного мониторинга беременности.
Что нового дает статья?
► Выявленные значительные различия в возрасте, индексе массы тела, наличии хронической артериальной гипертензии и в нарушениях гемоциркуляции в глазной артерии, отражающей параметры церебрального кровотока беременной, подчеркивают роль указанных факторов как предикторов ПЭ.
► Соотношение пиковых систолических скоростей PSV2/PSV1 у пациенток с высоким риском показало свою потенциальную ценность для ранней оценки риска ПЭ.
Как это может повлиять на клиническую практику в обозримом будущем?
► Результаты данного исследования могут существенно, улучшить раннюю диагностику и управление рисками ПЭ. Внедрение доплерометрической оценки параметров кровотока в глазной артерии на ранних сроках беременности позволит более точно идентифицировать женщин с высоким риском ПЭ и обеспечит возможность своевременного вмешательства.
Рецензия
Для цитирования:
Мэлэк М.И., Игнатко И.В., Тимохина Е.В., Кузьмина Т.Е., Федюнина И.А., Самойлова Ю.А., Алиева Ф.Н., Григорьян И.С., Подсекаева С.А. Использование доплерографии глазных артерий в прогнозировании и ранней диагностике преэклампсии. Акушерство, Гинекология и Репродукция. 2025;19(3):341-350. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.609
For citation:
Melek M.I., Ignatko I.V., Timokhina E.V., Kuzmina T.E., Fedyunina I.A., Samoilova Yu.A., Alieva F.N., Grigoryan I.S., Podsekaeva S.A. Use of ophthalmic artery Doppler in preeclampsia prognosis and early diagnostics. Obstetrics, Gynecology and Reproduction. 2025;19(3):341-350. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.609

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































