Перейти к:
Липодерматосклероз как возможное осложнение хронической венозной недостаточности
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.567
Аннотация
Беременность и роды у женщин с варикозной болезнью (ВБ) обычно сопряжены с высоким риском развития тромботических, акушерских и плодовых осложнений. Одним из редко встречаемых осложнений хронической венозной недостаточности (ХВН), является липодерматосклероз (ЛДС). В статье представлен клинический случай развития ЛДС у беременной на поздних сроках гестации (35–36 недель) как осложнение имеющейся ВБ. Данный клинический случай представляет интерес по причине редкой встречаемости заболевания и демонстрирует сложность диагностики данной патологии, особенно у беременных. Необходимо совершенствование и повышение эффективности мультидисциплинарного подхода в плане диагностики редко встречающихся осложнений ВБ у беременных.
Ключевые слова
Для цитирования:
Блбулян А.К., Арустамян К.К., Манукян Л.К., Минасян С.А., Гомцян Г.А. Липодерматосклероз как возможное осложнение хронической венозной недостаточности. Акушерство, Гинекология и Репродукция. 2025;19(1):110-115. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.567
For citation:
Blbulyan A.K., Arustamyan K.K., Manukyan L.K., Minasyan S.A., Gomtsyan G.A. Lipodermatosclerosis as a potential complication of chronic venous insufficiency. Obstetrics, Gynecology and Reproduction. 2025;19(1):110-115. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.567
Введение / Introduction
Со времен Рудольфа Вирхова возникла уникальная возможность унифицирования общей патологии на клеточном уровне. Однако диалектика общего и частного, как это бывает в жизни, заставила нас больше заняться разработкой нозологий, что, безусловно, привнесло новый ракурс и новые результаты. Затем на передний план вышел синдромный подход. Наконец, в наше время пришла необходимость системного подхода, что является пока что высшим достижением медицины наших дней. С точки зрения системных эволюционных механизмов общая патология приобрела более интересные, порой неожиданные проявления. Например, процесс тромбовоспаления, который прекрасно объясняет всю палитру патогенетических механизмов сосудистой патологии. С этой точки зрения случай, который мы решили описать, является очередным проявлением системного воспалительного ответа, где пусковым механизмом выступает сосудистая система.
Априори одной из основополагающих причин многих патологий человеческого организма является прямохождение. Варикозная болезнь (ВБ) является в этом плане детерминированной патологией, почти перманентным спутником беременных, особенно при наличии отягощающих моментов. С каждой последующей беременностью вероятность развития, либо степень тяжести ВБ увеличивается. Гестационный варикоз и первичная ВБ часто сопряжены с угрозой прерывания беременности, эклампсией, плацентарными нарушениями, преждевременными родами и незапланированными оперативными пособиями [1]. При этом до 1–2 случаев на 1000 родов увеличивается частота развития венозной тромбоэмболии (ВТЭ), которая до настоящего времени остается одной из основных причин материнской смертности даже в экономически развитых странах. По данным ряда авторов, в большинстве случаев ВБ сочетается с варикозным расширением вен малого таза, которое чревато геморрагическими, гнойно-септическими и тромботическими осложнениями в перинатальном периоде [2][3].
Наиболее приемлемой классификацией оценки степени тяжести венозной недостаточности является международная система CEAP (англ. Clinical-Etiology-Anatomy-Pathophysiology). Она основана на клинических (C), этиологических (E), анатомических (A) и патофизиологических (P) критериях.
Согласно классификации CEAP, одной из редко встречающихся патологий, развивающейся как следствие хронических воспалительных заболеваний нижних конечностей на фоне хронической венозной недостаточности (ХВН), является липодерматосклероз (ЛДС).
Липодерматосклероз также называется склерозирующим панникулитом, является воспалительным заболеванием, характеризующимся гиперемией кожного покрова, развитием подкожного фиброза и индурацией кожи нижних конечностей; в популяции часто встречается у женщин [4]. В 1955 г. С. Hurries с соавт. опубликовали первый отчет о заболевании, описав клинические проявления этого состояния [5]. Однако до настоящего времени данная патология остается труднодиагностируемой.
Клинический случай / Clinical case
В Научно-исследовательский центр охраны здоровья матери и ребенка Минздрава Республики Армения поступила молодая первородящая женщина О., 20 лет, со сроком гестации 37 недель и 1 день. Беременная жаловалась на внезапно возникшие боли в нижних конечностях при ходьбе с тенденцией к усилению, отеки в области внутренней поверхности бедра и голени, более выраженные справа. Боль сопровождалась чувством жжения, зуда. В области отеков беременная отмечала участки покраснения и уплотнения. Жалобы у беременной впервые появились на сроке 36 недель.
При осмотре: кожный процесс был локализован в области внутренних поверхностей обеих бедер, больше слева и на голени левой ноги. Все очаги поражения были гиперемированы с синюшным оттенком с участками гиперпигментации. При пальпации в зоне гиперемии определялись очаги ярко выраженных подкожных уплотнений с четкими контурами в виде индураций (рис. 1А). На месте уплотнений отмечалось локальное повышение температуры. Беременная была обследована согласно принятому в клинике алгоритму исследований соответственно сроку гестации, были проведены многочисленные специфические анализы.
Был выставлен предварительный диагноз: Беременность 37 недель и 1 день. Состояние после экстракорпорального оплодотворения (ЭКО). Двойня. Варикозная болезнь. Двусторонний тромбофлебит нижних конечностей?
Были проведены консультации узких специалистов: терапевта, флеболога, дерматолога и гематолога. Беременная получила лечение с назначением антикоагулянтов из группы низкомолекулярных гепаринов, а также компрессионную терапию.
Беременная родоразрешена путем плановой операции кесарева сечения с рождением двух доношенных плодов с весом 2980 г и 2880 г, соответсвенно; по шкале Апгар новорожденные были оценены 8–9 баллов. Послеоперационный период протекал гладко, явления ЛДС в течение 6–7 дней регрессировали (рис. 1В) и к концу месяца прошли (рис. 1С). Родильница была выписана в удовлетворительном состоянии, получив возможность жить активной жизнью.
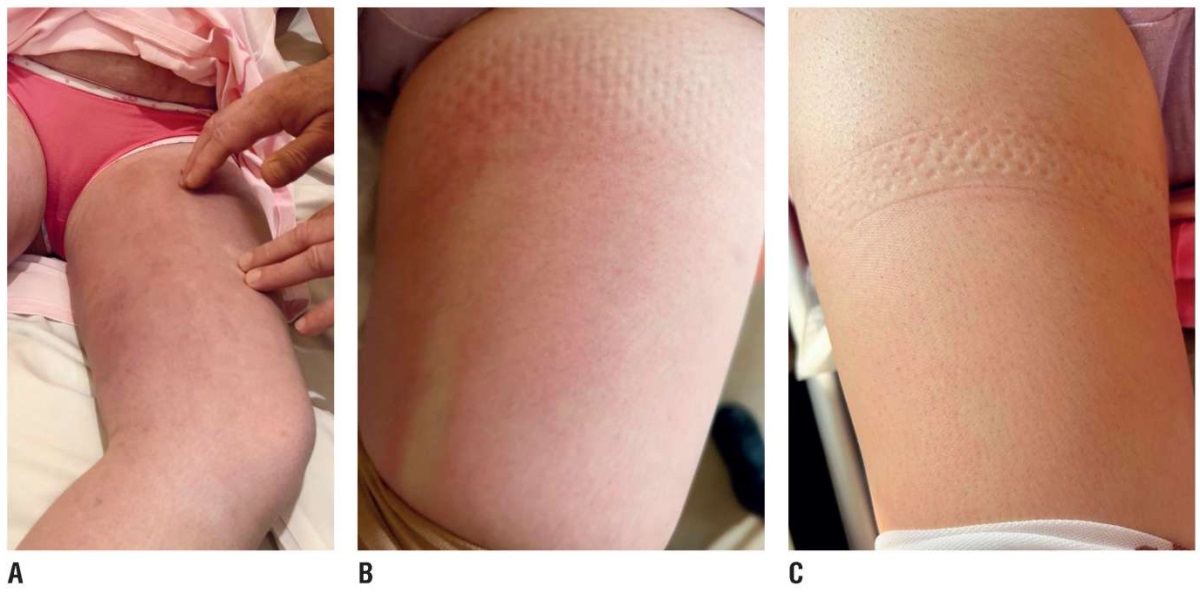
Рисунок 1. Пациентка О. А – клинические проявления липодерматосклероза в остром периоде; В – картина улучшения на фоне проводимой терапии; С – картина после лечения.
Figure 1. Patient O. A – clinical manifestations of lipodermatosclerosis in the acute period; B – therapy-related picture improvement; C – post-treatment picture.
Обсуждение / Discussion
В настоящее время существуют многочисленные теории патогенеза развития варикозного синдрома. Известно, что беременность представляет собой состояние гиперкоагуляции, обусловленное значительными изменениями параметров коагуляции и фибринолиза. Ситуация усугубляется прогрессирующим давлением на повздошные вены со стороны растущей матки.
Что касается изменений коагуляционного каскада при поздних сроках беременности, то на фоне значительного повышения I, II, VIII , IX и X факторов свертывания, повышения тромбоцитарной активности и уменьшения фибринолиза создаются предпосылки для тромботических осложнений [3]. Есть мнение, что каждая последующая беременность повышает риск развития тромбоэмболии [6].
Предрасполагающим фактором начала развития дегенеративно-дистрофических трансформаций венозной системы является избыточная продукция стероидных гормонов плацентарного генеза. Так, например, концентрация прогестерона возрастает к финалу беременности приблизительно в 250 раз. Стало известно также, что под влиянием этих изменений (вместе с релаксином) растяжимость вен увеличивается до 150 % [7].
Таким образом, повышение коагуляционного потенциала сыворотки крови, гормональные и механические факторы служат пусковыми механизмами развития и прогрессирования заболеваний вен во время беременности.
H. Sies в 1985 г. впервые сформулировал концепцию оксидативного стресса биологических структур [8]. При беременности наблюдается сверхэкспрессия маркеров оксидативного стресса, таких как кислород, азот, малоновый диальдегид, восстановленный глутатион, коэнзим Q10 крови [9–11].
Развитие венозной недостаточности нижних конечностей во время беременности также связано с эндотелиальным повреждением сосудов плаценты, проявляющимся повышенным окислительным стрессом в венозных стенках.
Данные последних лет [12–14] демонстрируют изменение концентрации воспалительных цитокинов и хемокинов в виде аномального пула при беременности с ХВН [15]. Повышение провоспалительных факторов приводит к тревожным последствиям исхода как для матери, так и для плода.
Если предположить, что хорион-децидуальная система представляет собой сложную сеть сигналов, где каждый компонент (молекулы, цитокины, клетки) является важнейшим ее регулятором, то нельзя отрицать, что вышеперечисленные провоспалительные изменения могут стать определяющими факторами развития венозной патологии в будущем [11]. Однозначно, исследования в данном направлении должны быть продолжены [10][14].
Особую и незаменимую роль играет функциональная работа клапанов, регулирующих венозный кровоток. Ключевая роль принадлежит икроножной мышце, нарушение работы которой приводит к венозному рефлюксу, отекам, ХВН, недостаточному заживлению язв на ногах и худшим прогнозам [16]. В нормальных условиях стенки вен по сравнению с артериями имеют большее содержание коллагена и меньшее количество гладкомышечных клеток. Это придает венам свойство пониженной эластичности с более высокой растяжимостью.
Таким образом, возвратный отток крови в большей степени зависит от состояния мышц и внутрисосудистых клапанов. В этом плане беременность с увеличением объема циркулирующей крови, метаболическими гормональными изменениями является несомненным фактором риска развития венозной недостаточности с большим процентом вероятности развития осложнений [17].
Исследования последних лет выявили также генетическую предрасположенность к развитию ВБ, связанную с ремоделированием сосудистой стенки и нарушением ее свойств, таких как растяжимость и эластичность [17][18].
В патогенезе ЛДС немаловажную роль играют и нарушения фибринолиза. Считается, что диффузия содержимого капилляров, включая фибриноген и другие воспалительные медиаторы, в подкожное пространство и дерму происходит также из-за повышенного давления в венозном кровообращении нижних конечностей.
Клинические проявления ЛДС могут значительно варьировать в зависимости от фазы заболевания.
Наиболее диагностируемая форма ЛДС – хроническая, которая проявляется индурацией и гиперпигментацией кожи, затрагивающей одну или обе нижние конечности с характерным видом «обратной шампанской бутылки». Помимо хронической формы ЛДС, у беременных может возникнуть и острая форма, часто ошибочно диагностируемая как целлюлит, узловатая эритема (erythema nodosum) и другие патологии. Острый ЛДС сопровождается сильными интенсивными болями.
Лечение основано на клинической картине, причем компрессионная терапия является основным методом лечения и для беременных. Следует отметить, что в случае острой формы ЛДС пациенты часто не могут переносить компрессионную терапию. В таких случаях рекомендуется использовать фибринолитическую терапию до тех пор, когда пациент сможет носить компрессионные чулки.
Дифференциальный диагноз ЛДС очень затруднен. Особенно это касается острой стадии, которую часто принимают за такие состояния, как узловатая эритема, тромбоз вен нижних конечностей, тромбофлебит, синдром Мей–Тернера, травматический жировой некроз и другие панникулиты [19][20].
Мы считаем, что в представленном случае наиболее трудной задачей явилась дифференциальная диагностика с синдромом Мей–Тернера, так как симптоматика и клинические проявления были схожи. Попробуем провести дифференциальную диагностику между ЛДС и синдромом Мей–Тернера.
Синдром Мей–Тернера – это синдром, который вызван компрессией левой общей подвздошной вены правой общей подвздошной артерией, в результате которой происходит нарушение оттока крови в малом тазу и в нижней конечности. На начальных стадиях возможно бессимптомное течение синдрома, что обусловлено анатомическими особенностями. В литературе описаны случаи бессимптомного сужения просвета левой подвздошной вены до 50 % у 20 % людей [6]. Однако для более поздних стадий синдрома, а также при беременности, сопровождающейся ХВН с признаками венозного застоя, характерны определенные симптомы. К ним относят: возникновение синего оттенка на коже нижних конечностей, отечность только левой ноги, боль при физической активности, образование варикозных узлов в области бедра и паха, проявления геморроя с прогрессированием процесса. При отсутствии лечения синдром характеризуется развитием тромбозов, что затрудняет диагностику данной патологии [21].
В данном случае некоторая схожесть симптомов была констатирована. Наличие целлюлита, перифокального воспаления и равномерного поражения обеих конечностей привело к окончательному диагнозу ЛДС. Консультируясь со специалистами разных направлений, совместно с флебологом мы пришли к заключению, что в данном конкретном случае у беременной развился ЛДС на фоне обострения венозной недостаточности.
Заключение / Conclusion
Прямохождение, как безусловно биологический прогресс, предрасположило Homo sapiens к ряду заболеваний, в том числе и к венозной недостаточности нижних конечностей. И если артериальное кровообращение саморегулируется эндотелиальными сигнальными системами, то венозная система снабжена множеством механизмов, как автономных, так и сочетанных, благодаря которым обеспечивается адекватный возврат сердечного выброса.
Беременность усугубляет нагрузки на венозную систему. В этом плане большой интерес представляет ЛДС как осложнение венозной недостаточности, которое протекает весьма своеобразно и требует мультидисциплинарного подхода. И вести таких больных необходимо, исходя из логики ведения венозной недостаточности.
При данной патологии в основе поражения лежит система воспаления. По большому счету, все 3 элиминационные системы – воспаление, иммунитет, гемостаз, функционирующие в определенной последовательности, перекрывают друг друга. Это одно из последних достижений фундаментальной науки. По нашему глубокому убеждению, система гемостаза играет первично-элиминирующую роль, что требует определенной методологической трансформации нашего мышления. Вот почему так важен скрупулезный анализ каждого клинического случая.
Через патологию познается норма. Такова диалектика познания в медицине.
Список литературы
1. Хрыщанович В.Я., Роговой Н.А., Скобелева Н.Я., Красько О.В. Эффективность компрессионной и флеботропной терапии варикозной болезни у беременных. Амбулаторная хирургия. 2023;20(1):94–104. https://doi.org/10.21518/akh2022-007.
2. Шульман С. Тромбоз вен малого таза, ассоциированный с беременностью. Акушерство, Гинекология и Репродукция. 2021;15(5):627–32. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2021.261.
3. Акиньшина С.В., Макацария А.Д., Бицадзе В.О., Андреева М.Д. Клиника, диагностика и профилактика венозных тромбоэмболических осложнений во время беременности. Акушерство, Гинекология и Репродукция. 2014;8(4):27–35.
4. Щава С.Н. Липодерматосклероз в практике дерматовенеролога (клинический случай), Саратовский научно-медицинский журнал. Приложение: Дерматовенерология. 2022;18(4):740–2.
5. Huriez C., Legache G., Desmons F. et al. Leg ulcers and trophic disorders of venous origin: data from the study of one thousand hospitalized patients with ulsers. Rev Prat. 1955;5(26):2703–21. (In French.).
6. Ortega M.A., Asunsolo A., Alvarez-Rocha M.J. et al. Remodelling of collagen fibres in the placentas of women with venous insufficiency during pregnancy. Histol Histopathol. 2018;33(6):567–76. https://doi.org/10.14670/HH-11-948.
7. Troiano N.H. Physiologic and hemodynamic changes during pregnancy. AACN Adv Crit Care. 2018;29(3):273–83. https://doi.org/10.4037/aacnacc2018911.
8. Sies H. Oxidative stress: introductory remarks. In: Oxidative Stress. Ed. H. Sies. London: Academic Press, 1985. 1–8. https://doi.org/10.1016/b978-0-12-642760-8.50005-3.
9. Ortega M.A., Romero B., Asunsolo A. et al. Pregnancy-associated venous insufficiency course with placental and systemic oxidative stress. J Cell Mol Med. 2020;24(7):4157–70. https://doi.org/10.1111/jcmm.15077.
10. Rodríguez-Mañas L., El-Assar M., Vallejo S. et al. Endothelial dysfunction in aged humans is related with oxidative stress and vascular inflammation. Aging Cell. 2009;8(3):226–38. https://doi.org/10.1111/j.1474-9726.2009.00466.x.
11. Biri A., Bozkurt N., Turp A. et al. Role of oxidative stress in intrauterine growth restriction. Gynecol Obstet Invest. 2007;64(4):187–92. https://doi.org/10.1159/000106488.
12. Yockey L.J., Iwasaki A. Interferons and proinflammatory cytokines in pregnancy and fetal development. Immunity. 2018;49(3):397–12. https://doi.org/10.1016/j.immuni.2018.07.017.
13. Uciechowski P., Dempke W.C.M. Interleukin-6: a masterplayer in the cytokine network. Oncology. 2020;98(3):131–7. https://doi.org/10.1159/000505099.
14. Ortega M.A., Gomez-Lahoz A.M., Sanchez-Trujillo L. et al. Chronic venous disease during pregnancy causes a systematic increase in maternal and fetal proinflammatory markers. Int J Mol Sci. 2022;23(16):8976. https://doi.org/10.3390/ijms23168976.
15. Li M., Wu Z.-M., Yang H., Huang S.J. NFκB and JNK/MAPK activation mediates the production of major macrophage- or dendritic cell-recruiting chemokine in human first trimester decidual cells in response to proinflammatory stimuli. J Clin Endocrinol Metab. 2011;96(8):2502–11. https://doi.org/10.1210/jc.2011-0055.
16. Amin T., Cohen H., Wong M. et al. The prevalence of incidental uterine venous plexus thrombosis in women attending a gynecology clinic. J Thromb Haemost. 2020;18(10):2557–65. https://doi.org/10.1111/jth.14989.
17. Ortega M., Fraile-Martínez O., García-Montero C. et al. Understanding chronic venous disease: A critical overview of its pathophysiology and medical management. J Clin Med. 2021;10(15):3239. https://doi.org/10.3390/jcm10153239.
18. Ortega M.A., Romero B., Asunsolo A. et al. Patients with incompetent valves in chronic venous insufficiency show increased systematic lipid peroxidation and cellular oxidative stress markers. Oxid Med Cell Longev. 2019;2019:5164576. https://doi.org/10.1155/2019/5164576.
19. Mei J.Y., Deshmukh U., Negi M. et al. May-Thurner syndrome in pregnancy: a multi-institutional case series and review of the literature. Am J Obstet Gynecol MFM. 2020;2(4):100240. https://doi.org/10.1016/j.ajogmf.2020.100240.
20. Lohr J.M., Bush R.L. Venous disease in women: epidemiology, manifestations, and treatment. J Vasc Surg. 2013;57(4 Suppl):37S–45S. https://doi.org/10.1016/j.jvs.2012.10.121.
21. Vlajinac H.D., Radak D.J., Marinkovic J.M., Maksimovic M.Z. Risk factors for chronic venous disease. Phlebology. 2012;27(8):416–22. https://doi.org/10.1258/phleb.2011.011091.
Об авторах
А. К. БлбулянАрмения
Армен Кимович Блбулян, д.м.н.
0002 Ереван, проспект Маштоца, д. 22
К. К. Арустамян
Армения
Арустамян Карине Кареновна, д.м.н.
0002 Ереван, проспект Маштоца, д. 22
Л. К. Манукян
Армения
Манукян Лусинэ Карленовна, к.м.н
0002 Ереван, проспект Маштоца, д. 22
С. А. Минасян
Россия
Минасян Софья Арамовна
0002 Ереван, проспект Маштоца, д. 22
Г. А. Гомцян
Россия
Гомцян Гаянэ Араратовна, к.м.н.
0002 Ереван, проспект Маштоца, д. 22
Рецензия
Для цитирования:
Блбулян А.К., Арустамян К.К., Манукян Л.К., Минасян С.А., Гомцян Г.А. Липодерматосклероз как возможное осложнение хронической венозной недостаточности. Акушерство, Гинекология и Репродукция. 2025;19(1):110-115. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.567
For citation:
Blbulyan A.K., Arustamyan K.K., Manukyan L.K., Minasyan S.A., Gomtsyan G.A. Lipodermatosclerosis as a potential complication of chronic venous insufficiency. Obstetrics, Gynecology and Reproduction. 2025;19(1):110-115. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.567

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































