Перейти к:
Снижение рисков плацента-ассоциированных осложнений при антифосфолипидном синдроме с использованием плазмафереза
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.584
Аннотация
Цель: изучить влияние плазмафереза (ПФ) на лечение антифосфолипидного синдрома (АФС) во время прегравидарной подготовки и беременности.
Материалы и методы. Проведено одноцентровое проспективное сравнительное неконтролируемое исследование. Обследовано 137 женщин в возрасте от 22 до 32 лет с диагнозом привычный выкидыш на фоне АФС. Основную группу составили 73 пациентки, которым на этапе прегравидарной подготовки был проведен курс ПФ, состоявший из 7 процедур; в группу сравнения вошли 64 пациентки, которым эфферентную терапию не проводили. Циркуляцию антифосфолипидных антител (АФА) определяли методом твердофазной иммунофлуоресценции. ПФ выполняли по прерывистой методике. В лабораторное исследование входило определение титров волчаночного антикоагулянта (ВА), антител к кардиолипину (англ. anti-cardiolipin antibodies, aCL), антител к β2-гликопротеину 1 (англ. anti-β2-glycoprotein 1 antibodies, anti-β2-GР1) и антител к аннексину V (англ. anti-annexin V antibodies, anti-ANX). Титры антител измеряли до и после проведения прегравидарной подготовки.
Результаты. После проведения ПФ было обнаружено снижение титров anti-β2-GР1 у пациенток основной группы на 66,6 % (р = 0,00001). У пациенток, которым была проведена стандартная терапия без применения ПФ, статистически значимых изменений по циркуляции anti-β2-GР1 отмечено не было. Частота выявления ВА в основной группе снизилась на 57,3 % (р = 0,042), в группе сравнения – на 10,9 % (р = 0,69).
Заключение. Частота выявления повышенного содержания АФА у женщин после проведения курса эфферентной терапии значительно снизилась, в то время как стандартная терапия не приводила к существенным положительным изменениям по данным показателям. Использование ПФ для достижения максимального эффекта целесообразнее в составе комплексной терапии.
Ключевые слова
Для цитирования:
Кунешко Н.Ф., Ким В.В., Ляднова Е.М., Меткина А.Р., Велиева М.Н., Лазарчук А.В., Бицадзе В.О., Третьякова М.В., Блинов Д.В. Снижение рисков плацента-ассоциированных осложнений при антифосфолипидном синдроме с использованием плазмафереза. Акушерство, Гинекология и Репродукция. 2025;19(1):47-58. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.584
For citation:
Kuneshko N.F., Kim V.V., Lyadnova E.M., Metkina A.R., Velieva M.N., Lazarchuk A.V., Bitsadze V.O., Tretyakova M.V., Blinov D.V. Plasmapheresis for lowering the risks of placenta-associated complications in antiphospholipid syndrome. Obstetrics, Gynecology and Reproduction. 2025;19(1):47-58. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.584
Введение / Introduction
Антифосфолипидный синдром (АФС) – это тромбовоспалительное заболевание, вызываемое циркулирующими аутоантителами, которые повреждают фосфолипиды клеточной поверхности и фосфолипид-связывающие белки. В результате повышается риск тромботических, аутоиммунных, воспалительных и акушерских осложнений [1]. К осложнениям беременности относят привычный выкидыш [2], различные плацента-ассоциированные осложнения, которые включают в себя, преэклампсию (ПЭ), эклампсию, преждевременную отслойку нормально расположенной плаценты (ПОНРП), преждевременный разрыв плодных оболочек (ПРПО), а также задержку роста плода (ЗРП) [3–4].
АФС можно определить как «первичный АФС», когда он развивается при отсутствии фоновой аутоиммунной патологии, или «вторичный АФС», когда он возникает в сочетании с другими аутоимунными заболеваниями, главным образом системной красной волчанкой (СКВ) [5]. Лабораторные критерии АФС включают обнаружение как критериальных, так и некритериальных антител. К критериальным антителам относятся волчаночный антикоагулянт (ВА), который наиболее тесно связан как с тромботическими явлениями, так и с неблагоприятными исходами беременности, IgG/IgM антитела к кардиолипину (англ. anti-cardiolipin antibodies, aCL), IgG/IgM антитела к β2-гликопротеину-1 (англ. anti-β2-glycoprotein 1 antibodies, anti-β2-GР1). Положительный средний или высокий титр антител (> 40 GPL/MPL) должен выявляться с интервалом не менее двух раз в 12 недель. К некритериальным антителам, которые также могут использоваться для диагностики АФС, относятся антитела IgA aCL, антитела к аннексину A2 и к аннексину A5, IgA anti-β2-GP1, антитела к комплексу виментин/кардиолипин, к фосфатидилэтаноламину, фосфатидилинозитолу, комплексу фосфатидил-протромбин и антитела к домену I β2-GP1 [6].
Мишенями ВА могут являться как β2-GР1, так и протромбин [7]. Большинство ВА повышают риск тромбообразования, что непосредственно влияет на организм матери, вызывая множественный тромбоз венозного или артериального происхождения [8]. Критериями тромботического АФС являются эпизоды артериального, венозного тромбоза или тромбоза мелких сосудов в любой ткани или органе, которые были подтверждены результатами гистопатологического исследования [9].
Патогенез АФС / APS pathogenesis
При АФС происходит ингибирование естественных антикоагулянтов и фибринолиза, активация эндотелиоцитов, тромбоцитов и моноцитов с прокоагулянтным действием антифосфолипидных антител (АФА). На мембранах клеток происходит разрушение защитного слоя антикоагулянта аннексина V, что приводит к нарушениям микроциркуляции, гемостаза и к патологии сосудистой стенки [10] (рис. 1). АФА также могут вызывать тромботические явления, индуцируя каскад комплемента, что в итоге приводит к снижению экспрессии фактора (F) Х за счет нарушения связывания β2-GР1 с FXI, тем самым увеличивая выработку тромбина и повышая риск тромбоза. Влияние каскада комплемента, активируемого альтернативным путем, продемонстрировано путем обнаружения повышенных уровней продуктов активации комплемента: компонента C5b-9 и фрагмента Bb в плазме крови у женщин с АФА и связи с неблагоприятным исходом беременности [11].
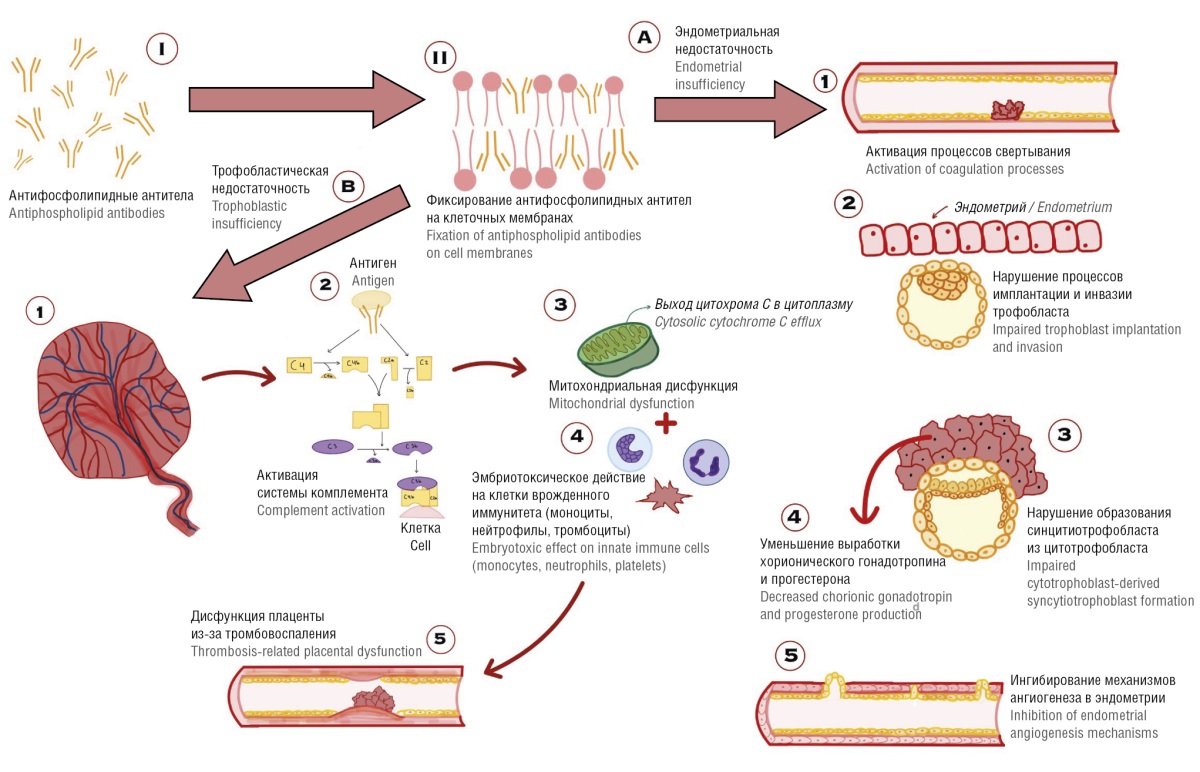
Рисунок 1. Патогенез акушерского антифосфолипидного синдрома [рисунок авторов].
Примечание: С2, С2a, C2b, C3, C3b, C4, C4A, C4b – компоненты системы комплемента.
Figure 1. Pathogenesis of obstetric antiphospholipid syndrome [drawn by authors].
Note: C2, C2a, C2b, C3, C3b, C4, C4A, C4b – complement components.
Продукты активации системы комплемента могут способствовать привлечению/активации лейкоцитов и высвобождению провоспалительных и антиангиогенных медиаторов, ответственных за повреждение плаценты. Отложение компонентов комплемента C4d и в некоторой степени C3d в доношенных плацентах было зарегистрировано у женщин с АФА в двух исследованиях, что дополнительно указывает на вклад активации комплемента в нарушение функции плаценты, опосредованное АФА [12–14].
Различные молекулярные механизмы могут лежать в основе двух клинических вариантов АФС – акушерского АФС (аАФС) и тромботического АФС (тАФС) [1]. При развитии аАФС основной мишенью АФА является плацента. Фиксация антител на клеточных мембранах приводит к появлению различных плацента-ассоциированных осложнений, патогенез которых заключается в активации процессов свертывания, нарушению имплантации и инвазии трофобласта, а также образованию синцитиотрофобласта [9]. Нарушение функционирования митохондрий при аАФС увеличивает риск развития ПЭ, что, в свою очередь, может привести к невынашиванию беременности [15]. Во время беременности АФА обладают выраженным тропизмом к плаценте, тем самым аутоантитела к фосфолипидам быстро интернализуются синцитиотрофобластом, где они вызывают набухание митохондрий, утечку внутренней митохондриальной мембраны и выброс цитохрома С в цитоплазму. В большинстве мононуклеарных клеток митохондриальная дисфункция и выброс цитохрома С в цитоплазму приводят к гибели клеток, однако в многоядерном синцитиотрофобласте это ведет к усиленному вытеснению опасных макропузырьков, которые впоследствии могут активировать эндотелиальные клетки [16].
При аАФС продукты активации комплемента и фактор некроза опухоли-альфа (англ. tumor necrosis factor-alpha, TNF-α) также способствуют потере плода. Предполагается, что по мере прогрессирования беременности поступление АФА в плаценту может вызывать Fс-зависимые воспалительные реакции за счет продуктов активации комплемента [17]. Fс-зависимые реакции обеспечиваются за счет Fс-рецепторов (Fc-receptors, FcRs) – семейства рецепторов, с которыми связываются специфичные Fc-фрагменты иммуноглобулина, которые контролируют гуморальный и врожденный иммунитет; они необходимы для адекватного реагирования на инфекции и профилактики хронического воспаления или аутоиммунных заболеваний. После их сшивания иммунными комплексами FсRs играют различные роли, такие как модуляция иммунного ответа высвобождающимися цитокинами или фагоцитоз [18].
При тАФС наиболее часто встречаются тромбозы глубоких вен нижних конечностей и церебральных артерий. Пациенты с тАФС также подвержены риску микрососудистого тромбоза кожи, глаз, сердца, легких, почек и других органов [19][20].
Помимо аАФС и тАФС, существует также тяжелая форма АФС, называемая катастрофическим АФС (КАФС), характеризующаяся распространенной тромботической микроангиопатией и полиорганной недостаточностью.
Влияние АФС на плацента-ассоциированные осложнения / The impact of APS on placenta-associated complications
Патогенез привычного выкидыша в I триместре, связанный с наличием АФА, отличается от патогенеза поздних акушерских осложнений. Прерывание беременности в I триместре чаще связано с прямым ингибирующим действием АФА на рост, плацентацию и непосредственно клетки трофобласта [21]. Поздние плацента-ассоциированные осложнения, включая ЗРП и мертворождение, чаще связаны с дисфункцией плаценты из-за тромботических и воспалительных изменений [17]. Дисфункция плаценты происходит из-за дефектов в процессах развития трофобласта, а именно, в пролиферации [22], инвазии, секреции хорионического гонадотропина человека (ХГЧ) [23], выработки ангиогенных факторов, таких как фактор роста эндотелия сосудов (англ. vascular endothelial growth factor, VEGF) [24], синцитиализации [25]. Существенным фактором патогенеза ПЭ является нарушение развития вневорсинчатых спиральных артерий, что приводит к снижению притока материнской крови к плаценте и гипоксическому повреждению, недостаточной доставке питательных веществ плоду, а также к высокой скорости кровотока и гипертензии; все эти факторы способствуют повреждению плаценты [26]. Также АФА могут оказывать прямое эмбриотоксическое действие на клетки врожденного иммунитета (нейтрофилы, моноциты и тромбоциты), на эндотелиальные клетки и клетки трофобласта, что в свою очередь приводит к нарушению роста и развития плода [27]. Тем не менее, по результатам проведенных исследований АФС на моделях мышей, было продемонстрировано решающее значение комплемента при потере беременности или развитии тромбоза, индуцированного АФА. Введение IgG от пациенток с АФС беременным мышам приводило к резорбции плода в 40 % случаев и снижению массы плода на 35 % по сравнению с мышами группы контроля [10].
Принципы лечения АФС / Principles of APS treatment
Для лечения АФС было предложено использование низких доз ацетилсалициловой кислоты (АСК) в качестве первичной профилактики тромбоза и для уменьшения риска развития ПЭ [28] и профилактической дозы низкомолекулярного гепарина (НМГ) [29]. В метаанализе, в который были включены женщины с привычным выкидышем, было продемонстрировано, что при использовании комбинации НМГ+АСК частота живорождения составила 74,3 %. В тоже время у женщин, получавших только АСК, частота живорождения была ниже и составила 55,9 % [30]. Также среди методов лечения в настоящее время могут использоваться статины – ингибиторы редуктазы 3-гидрокси-3-метилглутарил коэнзима А (ГМК-КоА-редуктазы) в качестве защиты от воспаления и тромбоза [31], гидроксихлорохин (используется для лечения СКВ, но также влияет на уменьшение размера тромба и его персистенцию), варфарин – антагонист витамина К (вторичная профилактика тромбоза) [32]. Гидроксихлорохин также может использоваться для профилактики осложнений во время беременности: по результатам ретроспективного многоцентрового когортного исследования, в котором приняли участие 30 пациенток с АФС, лечение гидроксихлорохином было связано с меньшим количеством выкидышей в I триместре (снизилось с 81 до 19 %; p < 0,05) и улучшением показателей живорождения до 78 % (p < 0,05) [33]. Также в качестве лечения рассматриваются блокаторы TNF-α, так как повышенный уровень TNF-α связан с плацентарным повреждением, вызванным АФА, повышенным риском повторной потери плода, гестационного сахарного диабета, гипертонических синдромов и ЗРП [34]. В исследовании 2019 г. оценивалась эффективность блокаторов TNF-α у АФА-позитивных женщин с рецидивирующими осложнениями беременности в анамнезе, несмотря на терапию НМГ и гидроксихлорохином [35].
В настоящее время перспективным методом лечения АФС является плазмаферез (ПФ). Терапевтический ПФ применяется для лечения широкого спектра патологий, включая аутоиммунные заболевания и тяжелые токсические состояния. Данная процедура способствует удалению неблагоприятных компонентов из плазмы, что в свою очередь приводит к улучшению состояния пациента. Кроме того, ПФ имеет эффект иммуномодуляции, которая возможна за счет активации ретикулоэндотелиальной системы и стимуляции клонов лимфоцитов. ПФ также приводит к минимизации рисков перегрузки системы кровообращения и обеспечивает эффективную терапию без серьезных побочных эффектов [36].
В литературе существует недостаточно данных относительно эффективности ПФ у женщин с АФС, особенно на этапе прегравидарной подготовки. Грамотная подготовка к беременности у пациенток с отягощенным соматическим анамнезом необходима для успешного зачатия и вынашивания беременности.
Цель: изучить влияние ПФ на лечение АФС во время прегравидарной подготовки и беременности.
Материалы и методы / Materials and Methods
Дизайн исследования / Study design
Проведено одноцентровое проспективное сравнительное неконтролируемое исследование. Обследовано 137 женщин с диагнозом привычный выкидыш на фоне АФС на клинической базе Сеченовского Университета – в Перинатальном центре ГБУЗ ГКБ № 67 им. Л.А. Ворохобова ДЗМ. Все пациентки получали «стандартную» терапию, в которую входили низкомолекулярные гепарины (надропарин кальция по 5000 ЕД 2 раза в день с интервалом 12 ч) и антиагреганты (ацетилсалициловая кислота 100 мг 1 раз в день). В основную группу исследования вошли 73 женщины, у которых в ходе прегравидарной подготовки в дополнение к «стандартной» терапии был осуществлен курс ПФ, включающий 7 процедур. В группу сравнения вошли 64 женщины, которым эфферентная терапия не была назначена. Оценка титров антител проводилась до начала лечения и после проведения 7 сеансов ПФ в основной группе. Все пациентки во время беременности наблюдались в женских консультациях ГБУЗ ГКБ № 67 им. Л.А. Ворохобова ДЗМ.
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения: возраст от 22 до 32 лет включительно; одноплодная беременность; привычный выкидыш на фоне АФС в анамнезе; отсутствие на момент начала исследования серьезных сопутствующих заболеваний, таких как инфекционные или хирургические патологии; отсутствие мутаций в генах, отвечающих за гемостаз; наличие подписанного информированного согласия об участии в исследовании.
Критерии исключения: возраст менее 22 или более 32 лет; наличие многоплодной беременности; наличие серьезных соматических заболеваний (например, сахарный диабет или синдром поликистозных яичников); наличие мутации Лейдена, мутаций генов протромбина, протеина C и протеина S и других мутаций в генах, отвечающих за гемостаз; низкая комплаентность; отказ от участия в исследовании.
Методы исследования / Study methods
Пациенткам основной группы во время прегравидарной подготовки проводили ПФ по прерывистой методике. Использовали аппарат «Гемос-ПФ» («Биотех-М», Россия). Перед сеансом выполняли премедикацию антигистаминными и гормональными препаратами. Сосудистый доступ осуществлялся посредством катетеризации локтевой вены. Во время одного сеанса ПФ среднее количество извлекаемой плазмы составляло 976,5 ± 112,3 мл. Для отбора проб крови использовали стерильные контейнеры, содержащие антикоагулянт «Гемакон». После этого материал центрифугировали на аппарате ОС-6М в течение 20 минут. Затем проводили трехкратное экстракорпоральное «отмывание» эритроцитов с использованием изотонического раствора хлорида натрия.
Циркуляцию АФА определяли методом твердофазной иммунофлуоресценции (Orgentec Diagnostika GmbH, Германия), основываясь на рекомендациях Международного общества по тромбозу и гемостазу. В качестве биоматериала использовалась венозная кровь, для определения наличия антител применяли анализатор Multiscan EX (Thermo Fisher Scientific, Китай). Средними титрами антител считали значения 20–40 GPL U/ml, высокими – более 40 GPL U/ml.
Статистический анализ / Statistical analysis
Обработка статистических данных проводилась с использованием программ Statistica 10.0 (StatSoft Inc., США) и Microsoft Excel (Microsoft Corporation, США). Данные представлены в формате медианы (Me) и интерквартильного диапазона [Q25; Q75]. Для сравнения частот применяли параметрический критерий корреляции Пирсона (критерий χ²). В тех случаях, когда ожидаемые частоты являлись менее 5, использовался точный двусторонний критерий Фишера. Уровень значимости был установлен на уровне p < 0,05.
Результаты / Results
Динамика уровня антифосфолипидных антител / Dynamics of antiphospholipid antibodies level
У пациенток основной группы после проведения ПФ было обнаружено уменьшение концентрации IgG anti-β2-GР1 на 65,88 % (р = 0,00001). В то же время у пациенток, которым проводили стандартную терапию без применения ПФ, снижение уровня IgG anti-β2-GР1 на 12,65 % было статистически незначимо (р = 0,23).
Частота выявления ВА в основной группе после курса ПФ снизилась на 57,29 % (р = 0,042), в группе сравнения – на 10,93% (р = 0,69), причем в группе сравнения снижение циркуляции ВА наблюдалось исключительно в тех случаях, когда его присутствие в крови было изолированным (табл. 1).
Таблица 1. Содержание антифосфолипидных антител до и после лечения.
Table 1. Antiphospholipid antibodies level before and after treatment.
|
Показатель / Parameter Ме [ Q25; Q75] |
Основная группа / Main group n = 73 |
Группа сравнения / Comparison group n = 64 |
||
|
До лечения Before treatment |
После лечения After treatment |
До лечения Before treatment |
После лечения After treatment |
|
|
IgG антитела к β2-гликопротеину 1, Ед/мл IgG anti-β2-glycoprotein 1 antibodies, U/ml |
17,0 [ 15,3; 18,2] |
5,8 [ 4,92; 6,9] |
16,6 [ 14,1; 17,8] |
14,5 [ 12,2; 15,7] |
|
IgM антитела к β2-гликопротеину 1, Ед/мл IgM anti-β2-glycoprotein 1 antibodies, U/ml |
12,5 [ 10,3; 14,5] |
7,7 [ 9,5; 9,0] |
11,4 [ 10,0; 13,5] |
9,4 [ 8,2; 11,07] |
|
IgG антитела к кардиолипину, Ед/мл IgG anti-cardiolipin antibodies, U/ml |
20,1 [ 18,6; 22,0] |
12,7 [ 11,8; 14,5] |
21,1 [ 18,7; 23,0] |
19,1 [ 17,0; 20,8] |
|
IgM антитела к кардиолипину, Ед/мл IgM anti-cardiolipin antibodies, U/ml |
4,2 [ 3,9; 6,9] |
3,73 [ 3,46; 6,14] |
5,1 [ 3,9; 5,9] |
6,8 [ 5,2; 7,91] |
|
Волчаночный антикоагулянт Lupus anticoagulant |
4,8 [ 2,9; 5,4] |
2,05 [ 1,4; 2,45] |
4,3 [ 4,1; 5,6] |
3,83 [ 3,6; 4,7] |
|
IgG антитела к аннексину V, Ед/мл IgG anti-annexin V antibodies, U/ml |
11,7 [ 10,1; 14,7] |
6,43 [ 5,3; 8,1] |
11,0 [ 10,0; 12,9] |
10,4 [ 9,2; 12,2] |
|
IgM антитела к аннексину V, Ед/мл IgM anti-annexin V antibodies, U/ml |
3,7 [ 2,1; 3,6] |
3,0 [ 1,9; 3,4] |
4,1 [ 3,0; 5,3] |
4,7 [ 3,4; 6,1] |
Примечание:  р < 0,05 – различия статистически значимы внутри группы по сравнению с исходом (до лечения); #р < 0,05 – различия статистически значимы между группами после лечения.
р < 0,05 – различия статистически значимы внутри группы по сравнению с исходом (до лечения); #р < 0,05 – различия статистически значимы между группами после лечения.
Note:  p < 0.05 – in-group differences are statistically significant compared to the outcome (before treatment); #p < 0.05 – inter-group differences are statistically significant after treatment.
p < 0.05 – in-group differences are statistically significant compared to the outcome (before treatment); #p < 0.05 – inter-group differences are statistically significant after treatment.
В целом, общая частота выявления всех АФА в основной группе после курса ПФ снижалась на 59,2 % (р = 0,0001), а в группе сравнения после стандартной терапии – на 14,95 % (р = 0,25). Частота выявления IgG aCL в основной группе снижалась на 36,82 % (р = 0,07), в группе сравнения – на 9,48 % (р = 0,69). Частота выявления IgG антител к аннексину V (англ. anti-annexin V antibodies, anti-ANX) в основной группе снизилась на 45,04 % (р = 0,06), в группе сравнения – на 5,45 % (р = 0,83).
В ряде случаев у пациенток группы сравнения на фоне стандартной терапии наблюдалась тенденция к увеличению циркуляции ряда АФА. Так, после терапии был выявлен рост титров IgM anti-ANX (на 14,53 %; р = 0,04) и IgМ aCL (на 33,33 %; р = 0,041).
Анализ исходов беременности / Analysis of pregnancy outcomes
В основной группе женщин лишь в одном случае (1,37 %) беременность закончилась самопроизвольным выкидышем в I триместре. Показатель эффективности лечения составил 98,65 %. В срок родили 49 (67,12 %) женщин в основной группе, преждевременное родоразрешение имело место у 23 (31,51 %) беременных. В группе сравнения беременность в 3 (4,69 %) случаях закончилась самопроизвольным прерыванием в I триместре, еще одна (1,56 %) беременность прервалась во II триместре. Таким образом, в группе сравнения родами закончилась беременность у 60 (93,75 %) женщин, при этом только у 35 (54,69 %) беременных роды произошли в сроке 37–40 недель, в остальных случаях роды были преждевременными, в том числе оперативным путем; среди показаний к оперативному родоразрешению лидировали ПЭ тяжелой степени, слабость родовой деятельности, нарастающая гипоксия и ЗРП.
Между частотой наступления беременности, частотой срочных родов и проведением ПФ не было выявлено статистической значимой разницы. Однако в группе сравнения (n = 20) по сравнению с основной группой (n = 11) отмечался повышенный риск развития плацентарной недостаточности во II триместре беременности (p < 0,05). Между другими осложнениями беременности не было выявлено статистически значимых различий (табл. 2).
Таблица 2. Исходы беременности после проведения прегравидарной подготовки.
Table 2. Pregnancy outcomes after pre-conception preparation.
|
Показатель / Parameter |
Основная группа / Main group n = 73 n (%) |
Группа сравнения / Comparison group n = 64 n (%) |
|
Самопроизвольный выкидыш |
1 (1,37) |
4 (6,25) |
|
Преждевременные роды |
23 (31,51) |
25 (39,06) |
|
Своевременные роды |
49 (67,12) |
35 (54,69) |
|
Плацентарная недостаточность, II триместр |
11 (15,07) |
20 (31,25) |
|
Плацентарная недостаточность, III триместр |
13 (17,81) |
13 (20,31) |
|
Преэклампсия |
16 (21,92) |
17 (26,56) |
|
Гипоксия плода |
6 (8,22) |
8 (12,50) |
|
Нарушение гемодинамики при токографии |
7 (9,59) |
7 (10,94) |
Примечание:  р < 0,05 – различия статистически значимы между группами.
р < 0,05 – различия статистически значимы между группами.
Note:  p < 0.05 – inter-group differences are statistically significant.
p < 0.05 – inter-group differences are statistically significant.
Обсуждение / Discussion
Вопрос применения ПФ у пациентов с АФС является не до конца изученным, доказательной базы по положительной корреляции ПФ и коррекции АФС не хватает. По некоторым данным, использование ПФ позволяет снизить уровень АФА в 3 и более раз [37]. Продемонстрированно существенное снижение уровня anti-β2-GР1и других АФА на фоне проведения ПФ. Данный метод терапии способствует улучшению реологических свойств крови, детоксикации, также отмечается повышение чувствительности к лекарственным средствам [38]. Кроме этого, вопросы эффективности и безопасности использования ПФ в лечении АФС, особенно у беременных или на прегравидарном этапе, требуют дополнительного научного изучения [39][40]. Тем не менее имеется ряд публикаций в отношении клинического опыта применения ПФ при КАФС. Это методика позволяла быстро удалить из циркулирующей крови пациентов большой объем АФА, что в ряде случаев способствовало стабилизации клинической картины и уменьшению тромботической активности [41][42].
В настоящее время для женщин с персистирующим АФС и привычным выкидышем предпочтительным методом лечения является использование НМГ и низких доз АСК. Эта терапевтическая стратегия высокоэффективна в снижении риска тромбообразования и профилактики акушерских осложнений. На настоящий момент не существует рандомизированных, проспективных или контролируемых клинических исследований, в которых изучалось бы эффективность ПФ при АФС [43]. В целом, ПФ дает уникальную возможность уменьшить состояние гиперкоагуляции, связанное с АФС путем прямого воздействия на АФА [44]. Наиболее подробное исследование о влиянии ПФ у беременных с АФС было проведено в 2021 г., критерием для включения в которое являлось обнаружение высоких титров АФА у женщин с историей потерь и других неблагоприятных исходов беременности [45]. В процессе исследования 75 пациенткам было проведено 327 сеансов ПФ: на этапе подготовки к беременности такое лечение получили 17 женщин, в I триместре – 11, во II триместре – 33, а в III триместре – 34. Все пациентки получали терапию низкими дозами АСК и НМГ, 15 (25,86 %) женщин также получали курсы внутривенных иммуноглобулинов в I и II триместрах. В результате 47 беременных были родоразрешены, у 10 женщин на момент исследования продолжалось течение беременности. Срочные роды произошли у 40 пациенток, у 23 женщин – через естественные родовые пути. Путем операции кесарева сечения (КС) родоразрешены 24 беременные. Преждевременные роды произошли в 7 случаях, все путем операции КС. Тяжелых акушерских осложнений при своевременных вагинальных родах не наблюдалось. Благоприятные исходы беременности наблюдались при использовании ПФ в комбинации с АСК и НМГ, хотя абсолютно исключить развитие акушерских осложнений не было возможно [45].
В нашем исследовании при применении сходного алгоритма сочетания антикоагулянтной терапии с ПФ были получены сходные результаты, однако мы в большей степени фокусировались на динамике титров АФА. Изменение содержания АФА на фоне применения ПФ и стандартного протокола профилактики тромбообразования позволяет утверждать о наличии иммунологических механизмов осложнений беременности, индуцированных коагулопатией.
Заключение / Conclusion
Частота выявления повышенных титров АФА у женщин после проведения курса ПФ значительно снизилась, в то время как стандартная терапия не приводила к существенным изменениям по данным показателям. Одним из ключевых факторов, выявленных в результате проведенного исследования, является снижение с помощью ПФ титра АФА. Однако использование ПФ для достижения максимального эффекта целесообразнее в составе комплексной терапии. Применение комплекса терапевтических методов, включая антиагреганты, антикоагулянты и ПФ, а также динамическое наблюдение и мониторинг лабораторных показателей, своевременное выявление и коррекция осложнений способствовали успешному завершению беременности в 98,6 % случаев.
Список литературы
1. Knight J.S., Branch D.W., Ortel T.L. Antiphospholipid syndrome: advances in diagnosis, pathogenesis, and management. BMJ. 2023;380:e069717. https://doi.org/10.1136/bmj-2021-069717.
2. Xu J., Chen D., Duan X. et al. The association between antiphospholipid antibodies and late fetal loss: a systematic review and meta-analysis. Acta Obstet Gynecol Scand. 2019;98(12):1523–33. https://doi.org/10.1111/aogs.13665.
3. Xu J., Chen D., Tian Y. et al. Antiphospholipid antibodies increase the risk of fetal growth restriction: a systematic meta-analysis. Int J Clin Pract. 2022;2022:4308470. https://doi.org/10.1155/2022/4308470.
4. Alijotas-Reig J., Esteve-Valverde E., Anunciación-Llunell A. et al. Pathogenesis, diagnosis and management of obstetric antiphospholipid syndrome: a comprehensive review. J Clin Med. 2022;11(3):675. https://doi.org/10.3390/jcm11030675.
5. Pons-Estel G.J., Andreoli L., Scanzi F. et al. The antiphospholipid syndrome in patients with systemic lupus erythematosus. J Autoimmun. 2017;76:10–20. https://doi.org/10.1016/j.jaut.2016.10.004.
6. Pignatelli P., Ettorre E., Menichelli D. et al. Seronegative antiphospholipid syndrome: refining the value of "non-criteria" antibodies for diagnosis and clinical management. Haematologica. 2020;105(3):562–72. https://doi.org/10.3324/haematol.2019.221945.
7. Petri M. Antiphospholipid syndrome. Transl Res. 2020;225:70–81. https://doi.org/10.1016/j.trsl.2020.04.006.
8. Navarro-Carpentieri D., Del Carmen Castillo-Hernandez M., Majluf-Cruz K. et al. Impact of classical risk factors for arterial or venous thrombosis in patients with antiphospholipid syndrome. Clin Appl Thromb Hemost. 2018;24(5):834–40. https://doi.org/10.1177/1076029617727859.
9. Antovic A., Sennström M., Bremme K., Svenungsson E. Obstetric antiphospholipid syndrome. Lupus Sci Med. 2018;5(1):e000197. https://doi.org/10.1136/lupus-2016-000197.
10. Chaturvedi S., Braunstein E.M., Brodsky R.A. Antiphospholipid syndrome: complement activation, complement gene mutations, and therapeutic implications. J Thromb Haemost. 2021;19(3):607–16. https://doi.org/10.1111/jth.15082.
11. Kim M.Y., Guerra M.M., Kaplowitz E. et al. Complement activation predicts adverse pregnancy outcome in patients with systemic lupus erythematosus and/or antiphospholipid antibodies. Ann Rheum Dis. 2018;77(4):549–55. https://doi.org/10.1136/annrheumdis-2017-212224.
12. Cohen D., Buurma A., Goemaere N.N. et al. Classical complement activation as a footprint for murine and human antiphospholipid antibodyinduced fetal loss. J Pathol. 2011;225(4):502–11. https://doi.org/10.1002/path.2893.
13. Shamonki J.M., Salmon J.E., Hyjek E., Baergen R.N. Excessive complement activation is associated with placental injury in patients with antiphospholipid antibodies. Am J Obstet Gynecol. 2007;196(2):167.e1–5. https://doi.org/10.1016/j.ajog.2006.10.879.
14. Tedesco F., Borghi M.O., Gerosa M. et al. Pathogenic role of complement in antiphospholipid syndrome and therapeutic implications. Front Immunol. 2018;9:1388. https://doi.org/10.3389/fimmu.2018.01388.
15. Tong M., Johansson C., Xiao F. et al. Antiphospholipid antibodies increase the levels of mitochondrial DNA in placental extracellular vesicles: Alarmin-g for preeclampsia. Sci Rep. 2017;7(1):16556. https://doi.org/10.1038/s41598-017-16448-5.
16. Pantham P., Viall C.A., Chen Q. et al. Antiphospholipid antibodies bind syncytiotrophoblast mitochondria and alter the proteome of extruded syncytial nuclear aggregates. Placenta. 2015;36(12):1463–73. https://doi.org/10.1016/j.placenta.2015.10.006.
17. Cole M.A., Gerber G.F., Chaturvedi S. Complement biomarkers in the antiphospholipid syndrome – approaches to quantification and implications for clinical management. Clin Immunol. 2023;257:109828. https://doi.org/10.1016/j.clim.2023.109828.
18. Mkaddem S.B., Benhamou M., Monteiro R.C. Understanding Fc receptor involvement in inflammatory diseases: from mechanisms to new therapeutic tools. Front Immunol. 2019;10:811. https://doi.org/10.3389/fimmu.2019.00811.
19. Sevim E., Zisa D., Andrade D et al.; APS ACTION Investigators. Characteristics of patients with antiphospholipid antibody positivity in the APS ACTION International Clinical Database and repository. Arthritis Care Res. 2022;74(2):324–35. https://doi.org/10.1002/acr.24468.
20. Cervera R., Serrano R., Pons-Estel G.J. et al.; Euro-Phospholipid Project Group (European Forum on Antiphospholipid Antibodies). Morbidity and mortality in the antiphospholipid syndrome during a 10-year period: a multicentre prospective study of 1000 patients. Ann Rheum Dis. 2015;74(6):1011–8. https://doi.org/10.1136/annrheumdis-2013-204838.
21. Tong M., Viall C.A., Chamley L.W. Antiphospholipid antibodies and the placenta: a systematic review of their in vitro effects and modulation by treatment. Hum Reprod Update. 2015;21(1):97–118. https://doi.org/10.1093/humupd/dmu049.
22. Chamley L.W., Duncalf A.M., Mitchell M.D., Johnson P.M. Action of anticardiolipin and antibodies to beta2-glycoprotein-I on trophoblast proliferation as a mechanism for fetal death. Lancet. 1998;352(9133):1037–8. https://doi.org/10.1016/s0140-6736(05)60080-3.
23. Di Simone N., Meroni P.L., de Papa N. et al. Antiphospholipid antibodies affect trophoblast gonadotropin secretion and invasiveness by binding directly and through adhered beta2-glycoprotein I. Arthritis Rheum. 2000;43(1):140–50. https://doi.org/10.1002/1529-0131(200001)43:13.0.CO;2-P.
24. Carroll T.Y., Mulla M.J., Han C.S. et al. Modulation of trophoblast angiogenic factor secretion by antiphospholipid antibodies is not reversed by heparin. Am J Reprod Immunol. 2011;66(4):286–96. https://doi.org/10.1111/j.1600-0897.2011.01007.x.
25. Marchetti T., Ruffatti A., Wuillemin C. et al. Hydroxychloroquine restores trophoblast fusion affected by antiphospholipid antibodies. J Thromb Haemost. 2014;12(6):910–20. https://doi.org/10.1111/jth.12570.
26. Viall C.A., Chamley L.W. Histopathology in the placentae of women with antiphospholipid antibodies: a systematic review of the literature. Autoimmun Rev. 2015;14(5):446–71. https://doi.org/10.1016/j.autrev.2015.01.008.
27. Simopoulou M., Sfakianoudis K., Maziotis E. et al. The impact of autoantibodies on IVF treatment and outcome: a systematic review. Int J Mol Sci. 2019;20(4):892. https://doi.org/10.3390/ijms20040892.
28. Rolnik D.L., Nicolaides K.H., Poon L.C. Prevention of preeclampsia with aspirin. Am J Obstet Gynecol. 2022;226(2S):S1108-S1119. https://doi.org/10.1016/j.ajog.2020.08.045.
29. Sammaritano L.R. Antiphospholipid syndrome. Best Pract Res Clin Rheumatol. 2020;34(1):101463. https://doi.org/10.1016/j.berh.2019.101463.
30. Naru T., Khan R.S., Ali R. Pregnancy outcome in women with antiphospholipid syndrome on low-dose aspirin and heparin: a retrospective study. East Mediterr Health J. 2010;16(3):308–12.
31. Ambati A., Knight J.S., Zuo Y. Antiphospholipid syndrome management: a 2023 update and practical algorithm-based approach. Curr Opin Rheumatol. 2023;35(3):149–60. https://doi.org/10.1097/BOR.0000000000000932.
32. Pengo V., Denas G., Zoppellaro G. et al. Rivaroxaban vs warfarin in highrisk patients with antiphospholipid syndrome. Blood. 2018;132(13):1365– 71. https://doi.org/10.1182/blood-2018-04-848333.
33. Schreiber K., Hunt B.J. Managing antiphospholipid syndrome in pregnancy. Thromb Res. 2019;181 Suppl 1:S41–S46. https://doi.org/10.1016/S0049-3848(19)30366-4.
34. Moreli J.B., Cirino Ruocco A.M., Vernini J.M. et al. Interleukin 10 and tumor necrosis factor-alpha in pregnancy: aspects of interest in clinical obstetrics. ISRN Obstet Gynecol. 2012;2012:230742. https://doi.org/10.5402/2012/230742.
35. Alijotas-Reig J., Esteve-Valverde E., Llurba E., Gris J.M. Treatment of refractory poor aPL-related obstetric outcomes with TNF-alpha blockers: maternal-fetal outcomes in a series of 18 cases. Semin Arthritis Rheum. 2019;49(2):314–8. https://doi.org/10.1016/j.semarthrit.2019.02.006.
36. Altobelli C., Anastasio P., Cerrone A. et al. Therapeutic plasmapheresis: a revision of literature. Kidney Blood Press Res. 2023;48(1):6678. https://doi.org/10.1159/000528556.
37. Кравченко Е.Н., Гончарова А.А. Корреляционные связи между показателями активности свертывающей системы крови и содержанием антифосфолипидных антител у женщин с невынашиванием беременности. Гинекология. 2019;21(5):53–8. https://doi.org/10.26442/20795696.2019.5.190668.
38. Кунешко Н.Ф., Долгих В.Т., Ершов А.В., Карпицкая С.А. Влияние плазмафереза на иммунологические показатели у пациенток с привычным невынашиванием беременности на фоне антифосфолипидного синдрома. Вестник СурГУ. Медицина. 2022;(3):68–73. https://doi.org/10.34822/2304-9448-2022-3.
39. El-Haieg D.O., Zanati M.F., El-Foual F.M. Plasmapheresis and pregnancy outcome in patients with antiphospholipid syndrome. Int J Gynaecol Obstet. 2007;99(3):236–41. https://doi.org/10.1016/j.ijgo.2007.05.045.
40. Ruffatti A., Marson P., Pengo V. et al. Plasma exchange in the management of high risk pregnant patients with primary antiphospholipid syndrome. A report of 9 cases and a review of the literature. Autoimmun Rev. 2007;6(3):196–202. https://doi.org/10.1016/j.autrev.2006.11.002.
41. Tektonidou M.G., Andreoli L., Limper M. et al. EULAR recommendations for the management of antiphospholipid syndrome in adults. Ann Rheum Dis. 2019;78(10):1296–304. https://doi.org/10.1136/annrheumdis-2019-215213.
42. Santacruz J.C., Mantilla M.J., Rueda I. et al. Obstetric antiphospholipid syndrome from the perspective of a rheumatologist. Cureus. 2022;14(1):e21090. https://doi.org/10.7759/cureus.21090.
43. Hasan H., Surjancev I., Arnason J.A. et al. Corticosteroids, plasmapheresis, argatroban, rituximab, and sirolimus provided clinical benefit for catastrophic antiphospholipid syndrome in a patient with a history of heparin-induced thrombocytopenia. Case Rep Rheumatol. 2023;2023:3226278. https://doi.org/10.1155/2023/3226278.
44. Arias E.J., Bruck B., Vellimana A.K. et al. Plasmapheresis for management of antiphospholipid syndrome in the neurosurgical patient. Oper Neurosurg. 2019;16(4):E124–E129. https://doi.org/10.1093/ons/opy135.
45. Еремеева Д.Р., Зайнулина М.С., Долгова Ю.С. и др. Использование плазмафереза в лечении пациенток с неблагоприятными исходами беременностей в анамнезе и наличием антифосфолипидных антител. Акушерство, Гинекология и Репродукция. 2021;15(1):22–31. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2021.105.
Об авторах
Н. Ф. КунешкоРоссия
Кунешко Нарт Фарук, к.м.н.
143003 Московская область, Одинцово, ул. Маршала Бирюзова, д. 3б
В. В. Ким
Россия
Ким Виктор Валерьевич
127006 Москва, ул. Долгоруковская, д. 4
Е. М. Ляднова
Россия
Ляднова Елизавета Михайловна
119991 Москва, ул. Трубецкая, д. 8, стр. 2
А. Р. Меткина
Россия
Меткина Анастасия Романовна
119991 Москва, ул. Трубецкая, д. 8, стр. 2
М. Н. Велиева
Россия
Велиева Мадина Намиг кызы
119991 Москва, ул. Трубецкая, д. 8, стр. 2
А. В. Лазарчук
Россия
Арина Владимировна Лазарчук
119991 Москва, ул. Трубецкая, д. 8, стр. 2
В. О. Бицадзе
Россия
Бицадзе Виктория Омаровна, д.м.н., проф., профессор РАН
Scopus Author ID: 6506003478
WoS ResearcherID: F-8409-2017
119991 Москва, ул. Трубецкая, д. 8, стр. 2
М. В. Третьякова
Россия
Третьякова Мария Владимировна, к.м.н.
119991 Москва, ул. Трубецкая, д. 8, стр. 2
Д. В. Блинов
Россия
Блинов Дмитрий Владиславович, к.м.н.
Scopus Author ID: 6701744871
WoS ResearcherID: E-8906-2017
101000 Москва, Лялин переулок, д. 11–13/1; 123056 Москва, 2-я Брестская ул., д. 5, с. 1–1а; 141551 Московская область, деревня Голубое, Родниковая ул., стр. 6, к. 1
Что уже известно об этой теме?
► Антифосфолипидный синдром (АФС) – это заболевание, связанное с циркуляцией антифосфосфолипидных антител (АФА), которые приводят к тромбовоспалению и осложнениям беременности: преэклампсии, плацентарной недостаточности, привычному выкидышу, задержке роста плода и др.
► В патогенезе АФС важную роль играет активация системы комплемента, что способствует высвобождению провоспалительных и антиангиогенных медиаторов и нарушению образования плаценты.
► «Золотым стандартом» лечения АФС является применение низкомолекулярных гепаринов и низких доз ацетилсалициловой кислоты. Однако в литературе имется мало данных, которые свидетельствуют об эффективности использования плазмафереза (ПФ).
Что нового дает статья?
► Проведение курса ПФ при прегравидарной подготовке приводит к снижению циркулирующих АФА у пациенток с АФС.
► В основной группе 98,65 % беременностей закончились родами, что свидетельствует об эффективности прегравидарной подготовки у пациенток с АФС.
Как это может повлиять на клиническую практику в обозримом будущем?
► Дополнительное применение ПФ во время прегравидарной подготовки приводит к снижению уровней циркулирующих АФА и повышению вероятности благоприятного исхода беременности.
Рецензия
Для цитирования:
Кунешко Н.Ф., Ким В.В., Ляднова Е.М., Меткина А.Р., Велиева М.Н., Лазарчук А.В., Бицадзе В.О., Третьякова М.В., Блинов Д.В. Снижение рисков плацента-ассоциированных осложнений при антифосфолипидном синдроме с использованием плазмафереза. Акушерство, Гинекология и Репродукция. 2025;19(1):47-58. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.584
For citation:
Kuneshko N.F., Kim V.V., Lyadnova E.M., Metkina A.R., Velieva M.N., Lazarchuk A.V., Bitsadze V.O., Tretyakova M.V., Blinov D.V. Plasmapheresis for lowering the risks of placenta-associated complications in antiphospholipid syndrome. Obstetrics, Gynecology and Reproduction. 2025;19(1):47-58. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2025.584

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































