Перейти к:
COVID-19 и системные тромботические синдромы
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.590
Аннотация
COVID-19 является одним из грозных заболеваний текущего десятилетия, значительно повлиявшее на общую заболеваемость, смертность, качество здоровья и жизни населения планеты. Среди множества осложнений, наблюдаемых у пациентов с новой коронавирусной инфекцией, пожалуй, главное место в структуре постковидных ранних и поздних осложнений занимают тромбозы. Отмечена значимая роль микротромбозов, диссеминированного внутрисосудистого свертывания, тромботических ангиопатий в патогенезе COVID-19. Накопленные данные клинических исследований и представленные экспертные мнения позволили установить значимость связи «иммунотромбоз–нетоз–тромбовоспаление» в патологических эффектах, вызванных вирусом SARS-CoV-2, а также раскрыть механизмы формирования тромботических синдромов, опосредованных антикоагулянтной терапией и вакцинацией. Полученные сведения об особенностях нарушений системы гемостаза позволяют продвинуться в понимании отдаленных последствий среди пациентов, перенесших COVID-19.
Ключевые слова
Для цитирования:
Макацария А.Д. COVID-19 и системные тромботические синдромы. Акушерство, Гинекология и Репродукция. 2024;18(6):908-918. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.590
For citation:
Makatsariya A.D. COVID-19 and systemic thrombotic syndromes. Obstetrics, Gynecology and Reproduction. 2024;18(6):908-918. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.590
Актуальность тромботических осложнений при COVID-19 / Importance of thrombotic complications in COVID-19
Согласно данным Всемирной организации здравоохранения (ВОЗ) за 2024 г., с начала пандемии COVID-19 было зарегистрировано более 750 млн случаев заболевания новой короновирусной инфекцией (НКИ) [1]. Являясь одним из грозных заболеваний текущего десятилетия, COVID-19 значительно повлиял на общую заболеваемость, смертность, качество здоровья и жизни населения планеты. Известно о существенных и частых осложнениях течения данного заболевания. У пациентов нередко наблюдают нарушения со стороны иммунной системы, зачастую представленные лимфопенией, развитием воспалительного процесса, аутоиммунными процессами, респираторными патологиями, например, пневмонией и формированием фиброзов в местах пораженной ткани. Однако, пожалуй, главное место в структуре постковидных ранних и поздних осложнений занимают тромбозы [2].
При COVID-19 тромбозы представлены, как правило, венозными и артериальными макротромбозами, тромбоэмболией легочной артерии (ТЭЛА) с и без венозного тромбоза глубоких вен (ТГВ), тромбозами микроциркуляторного русла или тромбозами, ассоциированными с экстракорпоральной мембранной оксигенацией. По данным мировой литературы, у пациентов с COVID-19 частота тромботических осложнений колеблется от 60 до 80 % [3]. Несмотря на то что смертность при COVID-19 в основном связана с тяжелой легочной недостаточностью и тромбозом, надо отметить, что легочная недостаточность во многом обусловлена локальным тромбозом сосудов легких в результате коагулопатии, индуцированной поражением легких вирусом SARS-CoV-2 [4].
Микротромбозы у пациентов с COVID-19 / Microthrombosis in patients with COVID-19
Уже в начале пандемии ставился вопрос о важности дифференциального диагноза между первичным тромбозом легких и ТЭЛА без ТГВ у пациентов с тяжелым COVID-19 [5]. Помимо клинических проявлений первичного тромбоза легких и признаков интерстициального воспаления, были получены гистопатологические данные, свидетельствующие о наличии микротромбов в альвеолярных перегородках. Так, у погибших пациентов наблюдали интерстициальную и периваскулярную лимфоцитарную пневмонию с мультифокальным эндотелиитом. Данные изменения сопровождались наличием микротромбов в межальвеолярных перегородках, на что указывали расширенные альвеолярные стенки с множественными фибринозными микротромбами в альвеолярных капиллярах (рис. 1). Во внутриальвеолярном пространстве наблюдали экстравазированные эритроциты и рыхлую сеть из фибрина [6].
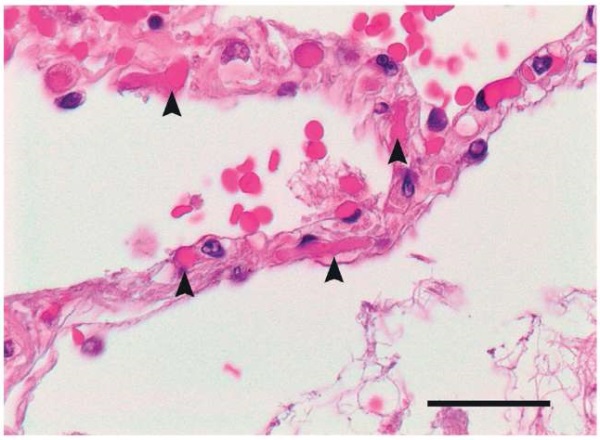
Рисунок 1. Микрофотография межальвеолярной перегородки погибшего пациента с COVID-19 [6].
Примечание: стрелками обозначены участки с фибринозными микротромбами; черная линия внизу справа – масштабная линейка, соответствующая 50 мкм.
Figure 1. Microimage of the interalveolar septum in a deceased COVID-19 patient [6].
Note: arrows indicate areas with fibrinous microthrombi; bottom right – black line depicts a scale bar corresponding to 50 µm.
В большинстве своем патоморфологические изменения в легочной ткани у погибших пациентов с COVID-19 соотносятся с типовой картиной течения острого респираторного дистресс-синдрома (ОРДС) среди погибших пациентов с гриппом A (H1N1). Однако отмечен ряд характерных сосудистых изменений у пациентов с НКИ: тяжелые эндотелиальные повреждения, распространенный тромбоз с микроангиопатией, образование новых сосудов преимущественно за счет механизма инвагинационного ангиогенеза [6].
Сканирующая электронная микроскопия позволила сравнить состояние сосудов в альвеолярном сплетении у здоровых людей (рис. 2А) и пациентов с COVID-19. Оценка ультраструктурных изменений в сосудах у пациентов с COVID-19 выявила нарушение микроваскулярной архитектоники (рис. 2B). Отмечена утрата четко видимой иерархии сосудов в альвеолярном сплетении, что является результатом образования новых кровеносных сосудов в результате инвагинационного ангиогенеза. Наблюдаются инвагинальные столбы (рис. 2С), ультраструктурные деструктивные изменения эндотелиальных клеток и наличие SARS-CoV-2 (рис. 2D) [6].
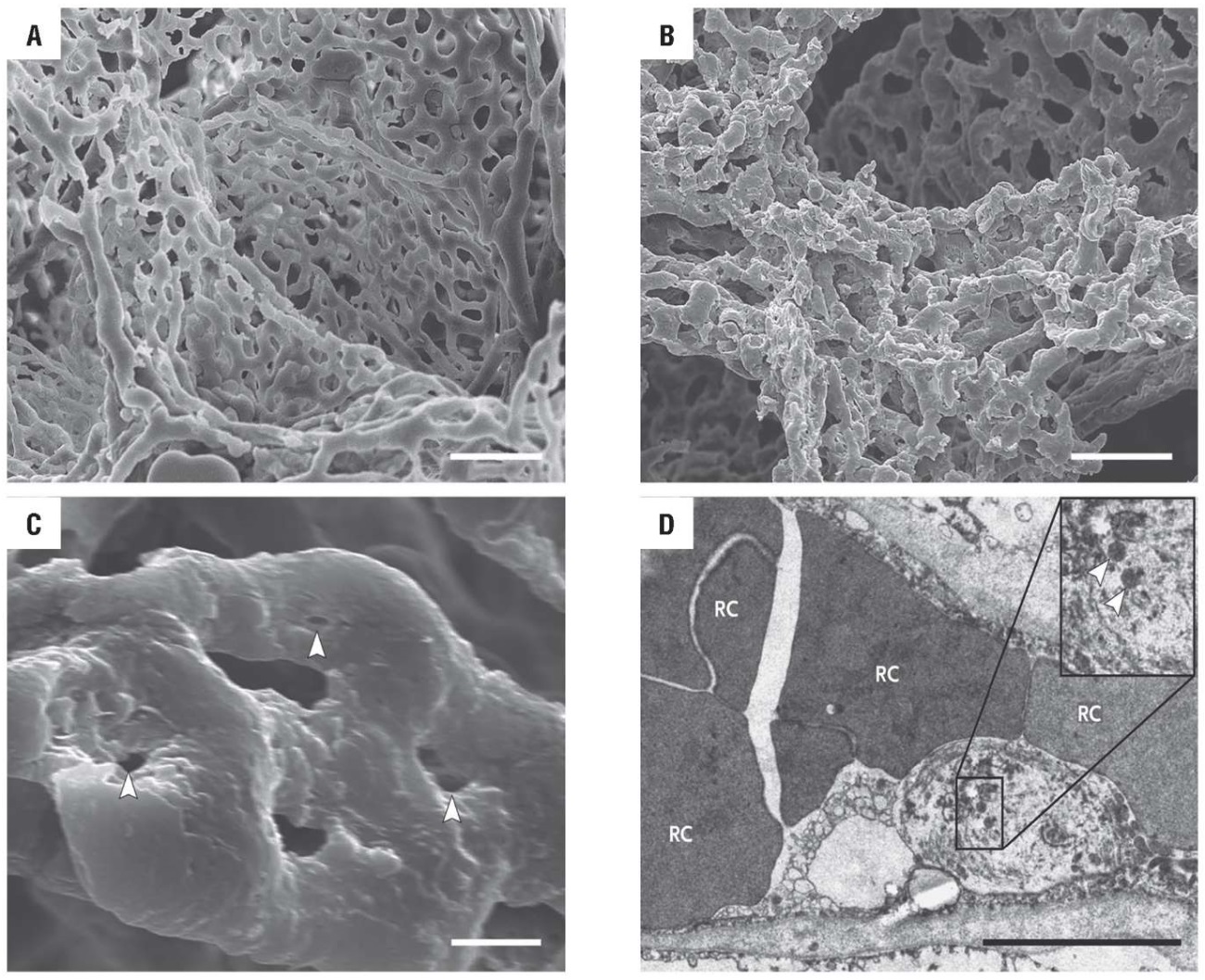
Рисунок 2. Микрофотографии на ультраструктурном уровне состояния сосудов в альвеолярном сплетении у здоровых людей (А) и морфологических изменений в сосудах у погибших пациентов с COVID-19 (В, С, D) [6].
Примечание: белые стрелки на рисунке С – место локализации инвагинальных столбов; белые стрелки на рисунке D – место локализации вирионов SARS-CoV-2; RC – эритроциты; линия внизу справа – масштабная линейка, соответствующая 5 мкм.
Figure 2. Microimages at the ultrastructural level of vessels in the alveolar plexus in healthy people (A) and vessel morphological changes in deceased COVID-19 patients (B, C, D) [6].
Note: white arrows in figure C depict the localization of intussusceptive pillar; white arrows in figure D depict the localization of SARS-CoV-2 virions; RC – red blood cells; bottom right – black line depicts a scale bar corresponding to 50 µm.
Роль диссеминированного внутрисосудистого свертывания при тяжелых формах COVID-19 / The role of disseminated intravascular coagulation in severe COVID-19
Развитие нарушений в системе гемостаза у пациентов с НКИ затрагивает многие пути патогенетических процессов: активацию тромбоцитов, внешний и внутренний путь свертывания крови, подавление фибринолиза с развитием диссеминированного внутрисосудистого свертывания (ДВС), тромботические микроангиопатии (ТМА), включая локальное внутрисосудистое свертывание крови в легких. Клинические проявления включают венозные и артериальные тромбозы, в том числе с атипичной локализацией и развитием полиорганной недостаточности (ПОН), что может напоминать картину катастрофического антифосфолипидного синдрома (КАФС) или гепарин-индуцированной тромбоцитопении (ГИТ) и тромбоза в силу системного распространенного тромбоза, который по аналогии с «цитокиновым штормом» получил название «тромботического шторма» [7].
Хотя SARS-CoV-2 – это в первую очередь респираторный вирус, COVID-19 – это скорее системное заболевание, и оно сопровождается поражением многих органов. Основные COVID-ассоциированные тромботические синдромы можно условно разделить на обусловленные патогенетическими процессами заболевания и на опосредованные применяемой терапией. Так, ДВС-синдром, ТМА и реже антифосфолипидный синдром (АФС) и КАФС при COVID-19 связаны непосредственно с течением заболевания. В свою очередь, применяемая терапия данного заболевания может быть причиной возникновения гепарин-индуцированных либо вакцин-индуцированных тромбоцитопений и тромбозов.
Еще в начале пандемии мы придерживались точки зрения, что как и другие тяжелые инфекции, COVID-19 вызывает гематологические нарушения, такие как ДВС или сепсис-индуцированная коагулопатия вследствие системного воспаления. Первая работа, посвященная ДВС при COVID-19, была опубликована нами в 2020 г. К сожалению, игнорирование нарушений гемостаза в патогенезе тяжелых форм заболевания, отсутствие антикоагулянтной терапии в начале пандемии и крен в сторону исключительно искусственной вентиляции легких (ИВЛ) сослужили плохую службу и стали причиной большого количества смертей [8].
При тяжелых формах COVID-19 имеет место практически одновременная активация и взаимодействие клеточных и молекулярных компонентов защиты хозяина, участвующих в патогенезе ДВС-синдрома. Данные компоненты представлены активацией плазменного звена с потреблением естественных антикоагулянтов, тяжелой эндотелиальной дисфункцией, активацией комплемента и тромбоцитов, плохо контролируемым воспалением и нетозом, нарушением фибринолиза в рамках дисфункциональной микроциркуляции, характеризующейся распространенной эндотелиопатией [9].
Несмотря на разнообразные клинические проявления, начиная от тромбоокклюзионных повреждений и заканчивая геморрагическим диатезом, этиология ДВС обычно включает чрезмерную активацию свертывания крови и дисрегуляцию функции антикоагулянтов и фибринолиза. Инициация свертывания крови следует за внутрисосудистой экспрессией тканевого фактора (англ. tissue factor, TF) или активацией контактного пути в ответ на патоген-ассоциированные или полученные от хозяина, ассоциированные с повреждением молекулярные паттерны. Процесс далее усиливается через воспалительные и иммунотромботические механизмы. Потребление антикоагулянтов и нарушение эндотелиального гомеостаза снижают регуляторный контроль и вызывают диссеминированный микрососудистый тромбоз [9].
Несмотря на гетерогенную клиническую картину – от бессимптомной до легкой, тромботической или геморрагической – по своей сути ДВС-синдром следует за воздействием или выработкой прокоагулянтов, недостаточно сбалансированных эндогенными антикоагулянтными и фибринолитическими механизмами (рис. 3) [10].
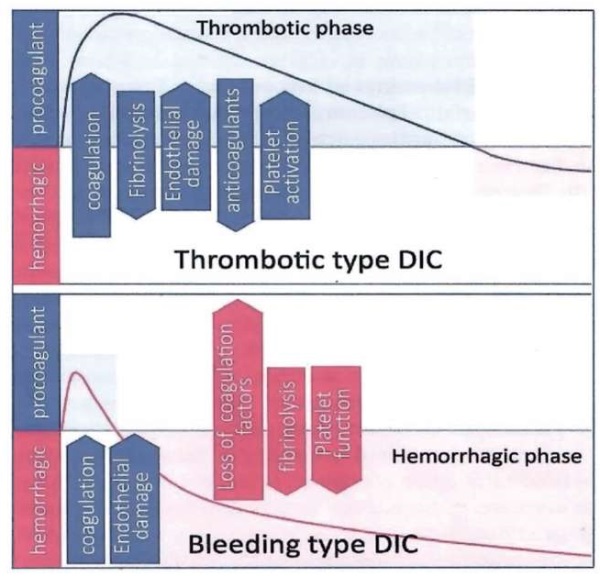
Рисунок 3. Тромботический и геморрагический типы диссеминированного внутрисосудистого свертывания [10].
Figure 3. Thrombotic and hemorrhagic types of disseminated intravascular coagulation [10].
Чрезмерная активация тромбина приводит к протеолитическому превращению фибриногена и внутрисосудистому образованию фибрина. Если скорость потребления факторов свертывания превышает скорость их синтеза, развивается коагулопатия потребления, которая в сочетании с тромбоцитопенией прогнозирует повышенный риск кровотечения. Внутрисосудистое фибринообразование уравновешивается плазмин-опосредованным фибринолизом, что приводит к увеличению продуктов распада фибрина (D-димеров) в кровотоке. Когда фибринолиз не может компенсировать чрезмерную коагулопатию, обструктивное микротромбообразование может привести к гипоперфузии и гипоксии периферических органов с развитием ПОН [10].
Микрососудистый тромбоз и кровотечение являются основными причинами ПОН, при этом легкие и почки наиболее чувствительны к коагулопатической дисфункции. Клиническое развитие ДВС у пациентов связано с ухудшением заболеваемости и повышением смертности независимо от основной патологии. Это касается и тяжелых форм COVID-19, поэтому своевременное распознавание ДВС имеет решающее значение для снижения патологического бремени. Из-за разнообразия триггеров и патогенных механизмов, приводящих к ДВС-синдрому, диагностика основана на алгоритмах, которые количественно оценивают гемостатический дисбаланс, тромбоцитопению и конверсию фибриногена.
Поскольку современная диагностика в первую очередь оценивает явные проявления коагулопатии потребления, существует острая необходимость в лучшем распознавании неявных проявлений ДВС, пред-ДВС или хронического ДВС.
Тромботическая микроангиопатия и роль ADAMTS-13 при COVID-19 / Thrombotic microangiopathy and ADAMTS-13 role in COVID-19
В основе микроциркуляторных нарушений в результате цитокинового и тромботического шторма нередко лежит развитие ТМА, которая объединяет гетерогенные по природе клинические состояния, характеризующиеся артериолярными и капиллярными тромбозами с развитием гемолитической анемии, тромбоцитопении и ишемических повреждений органов вплоть до ПОН.
ТМА нередко ставит диагностические и клинические проблемы при неотложных и жизнеугрожающих состояниях в медицине. Типичным клиническим проявлением ТМА является полиорганная дисфункция. В некоторых случаях наблюдаются так называемые атипичные проявления, такие как злокачественная артериальная гипертензия, неврологические расстройства и HELLP-синдром при беременности.
Происхождение ТМА может быть различным, но одним из важнейших факторов является дефицит металлопротеиназы ADAMTS-13, который вызывает неадекватный протеолиз мультимеров фактора фон Виллебранда (англ. von Willebrand factor, vWF), обладающих высокой способностью активировать тромбоциты. В условиях SARS-CoV-2-опосредованного цитокинового шторма и поражения эндотелия происходит потребление ADAMTS-13 избыточным количеством высокомолекулярного vWF и накопление ультра-высокомолекулярных мультимеров, которые в комплексе с адгезированными и агрегированными тромбоцитами вызывают тромбоз микроциркуляции и органную недостаточность (рис. 4). Понимание патофизиологии тромботической тромбоцитопенической пурпуры (ТТП), в основе которой лежит дефицит ADAMTS-13, позволило понять важную роль ADAMTS-13 в других TMA и тромботических расстройствах, сопровождающихся эндотелиальной дисфункцией, таких как ишемический инсульт и ишемическая болезнь сердца [11–13].
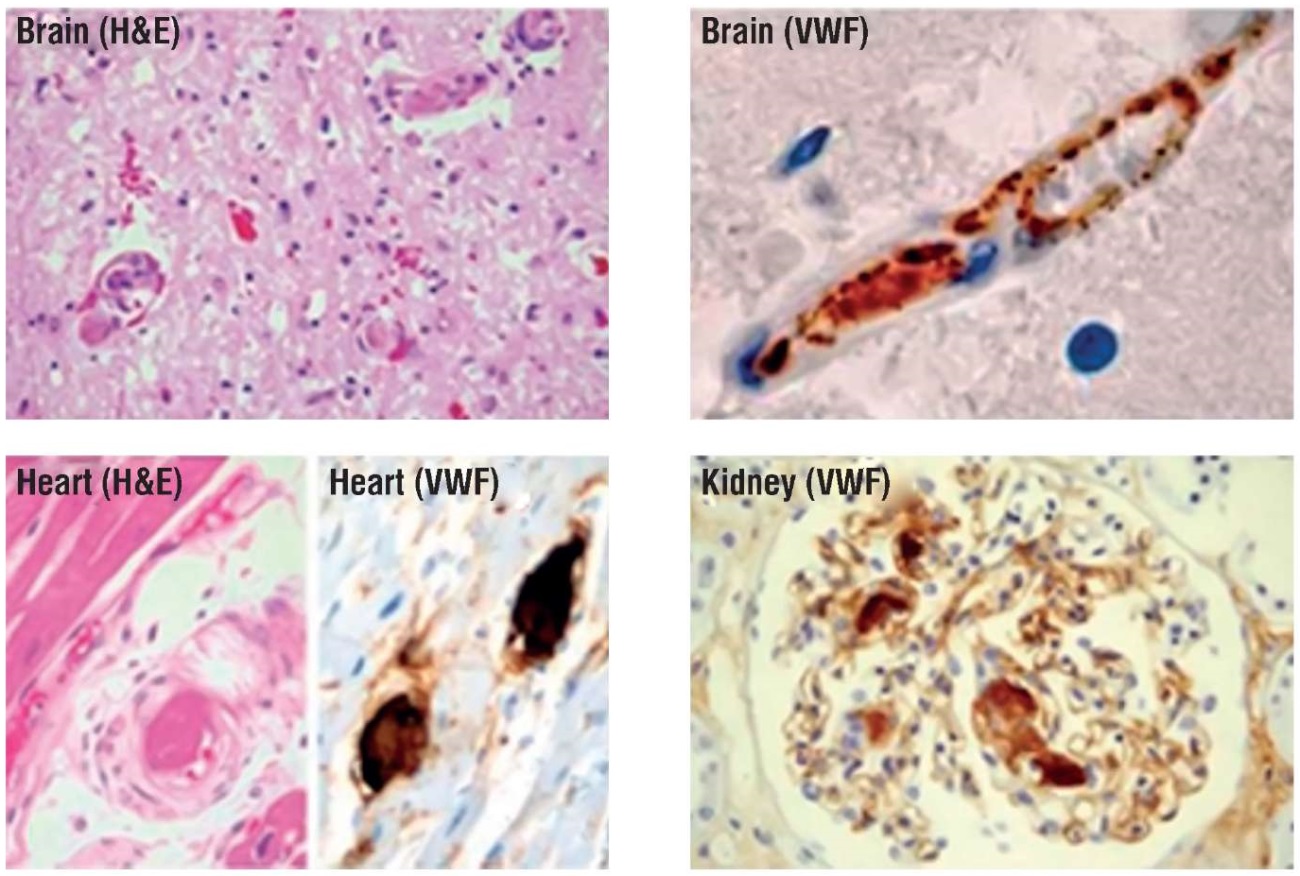
Рисунок 4. Тромбы, содержащие фактор фон Виллебранда [13].
Figure 4. Von Willebrand factor-containing blood clots [13].
В рамках гранта Российской академии наук нами было проведено исследование «COVID-19, тромбовоспаление и тромбоэмболизм», целью которого было оценить роль параметров гемостаза и биологических маркеров воспаления в патогенезе тяжелых форм COVID-19. Наряду с другими показателями системы гемостаза, была проанализированы активность ADAMTS-13, концентрация vWF и маркер нетоза – активность миелопероксидазы (МПО). При анализе полученных данных, vWF и активность МПО показали достаточно строгую порог-зависимую корреляцию с исходами у пациентов в отделении реанимации и интенсивной терапии, что еще раз подтверждает ведущую роль воспаления, поражения эндотелия и микроангиопатии при тяжелых формах COVID-19 и предиктивное значение указанных биомаркеров. При этом активность МПО продемонстрировала даже превосходящее vWF предиктивное значение [14].
Таким образом, путем проведения многофакторного анализа было показано, что повышенные уровни активности МПО и vWF являются независимыми предикторами низкой выживаемости у пациентов с тяжелым COVID-19, требующих ИВЛ [15].
Тромботический шторм и иммунотромбоз при COVID-19 / Thrombotic storm and immunothrombosis in COVID-19
Основные патологические эффекты, вызванные вирусом SARS-CoV-2, связаны с активацией моноцитов, макрофагов, нейтрофилов, системы комплемента и дисфункцией эндотелия, что в итоге приводит к цитокиновому и тромботическому шторму. Тромботический шторм – феномен, который по аналогии с катастрофическим АФС характеризуется множественными тромбозами, развивающимися в течение короткого периода времени, но без циркуляции высоких уровней антифосфолипидных антител (АФА) [16].
P. Libbi и D.I. Simon (2001) указали на взаимосвязь между локальным тромбозом и воспалением [17]. Позднее J.F. Tanguay с соавт. (2004) ввели термин «тромбовоспаление» для описания взаимодействия между тромбоцитами и нейтрофилами в контексте артериального рестеноза внутри стента в проведенном клиническом исследовании [18]. В последующем исследовании P. Blair с соавт. (2009) был выявлен механизм активации тромбовоспаления, связанный с толл-подобными рецепторами (англ. toll-like receptors, TLR) [19]. Сегодня уже не вызывает сомнений тот факт, что эндотелиальная дисфункция, тромбовоспаление и иммунотромбоз – ключевые патогенетические механизмы COVID-19.
Физиологический иммунотромбоз представляет процесс микрокоагуляции, который не приводит к неблагоприятным клиническим исходам, а наоборот, помогает иммобилизовать вторгающиеся патогены или чужеродные «опасные» структуры для последующего обезвреживания или удаления иммунными клетками. Однако чрезмерные воспалительные реакции вызывают коагулопатические нарушения и тромбозы, подчеркивая тонко сбалансированное взаимодействие между иммунной системой и системой гемостаза (рис. 5) [20].
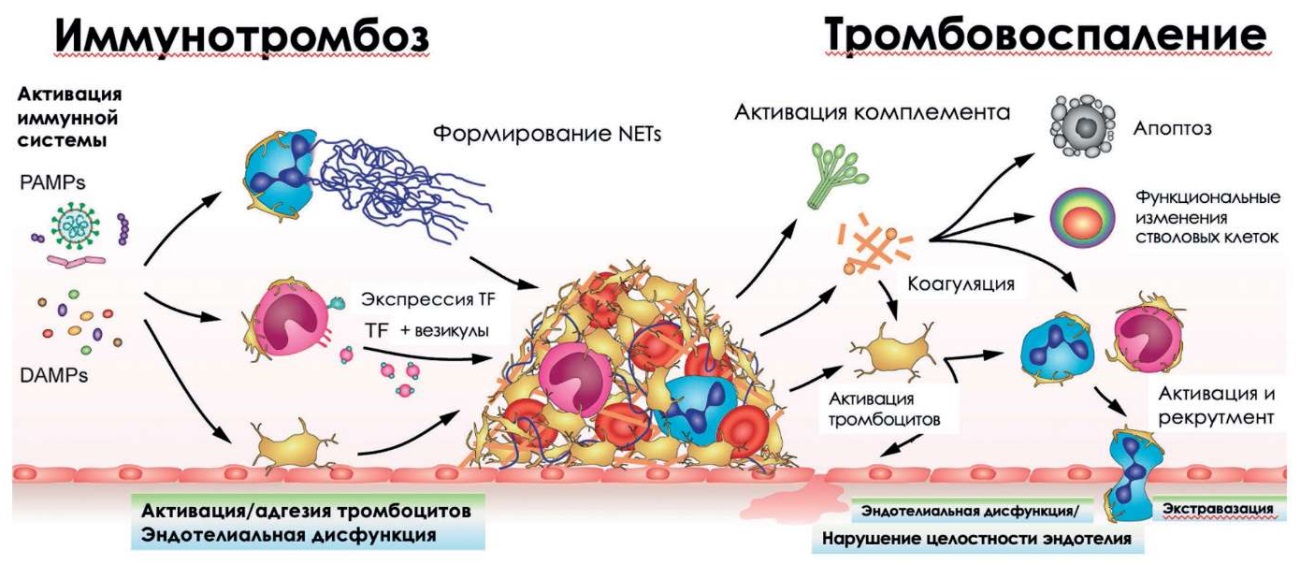
Рисунок 5. Взаимосвязь между иммунотромбозом и тромбовоспалением [20].
Примечание: PAMPs – патоген-ассоциированные молекулярные паттерны; DAMPs – молекулярные паттерны, ассоциированные с повреждениями; NETs – внеклеточные ловушки нейтрофилов; TF – тканевой фактор.
Figure 5. The relationship between immunothrombosis and thromboinflammation [20].
Note: PAMPs – pathogen-associated molecular patterns; DAMPs – damage-associated molecular patterns; NETs – neutrophil extracellular traps; TF – tissue factor.
Инфекции, вызванные патоген-ассоциированными молекулярными паттернами (англ. pathogen-associated molecular patterns, PAMPs), например, при вирусной или бактериальной инфекции, и стерильные воспалительные заболевания, вызванные молекулярными паттернами, ассоциированными с повреждением (англ. damage-associated molecular patterns, DAMPs), например, при гемолитической болезни, ишемии/реперфузионном повреждении, могут привести к тромбовоспалительным состояниям. Активация иммунной системы PAMPs или DAMPs и вызывает нерегулируемую активацию факторов свертывания, тромбоцитов, эндотелиальных клеток и системы комплемента. Эти процессы приводят к поверхностной экспрессии P-селектина на тромбоцитах и эндотелии и облегчают привлечение лейкоцитов. Повышенная экспрессия TF в моноцитах и высвобождение лейкоцитарных внеклеточных везикул, содержащих TF, инициируют коагуляционный каскад [20].
Тромбин и другие протеазы каскада коагуляции, включая фактор Xa и фактор VIIa, не только опосредуют генерацию фибрина, но также регулируют клеточные функции, которые влияют на гемостатические и воспалительные процессы. Протеазы могут активировать PAR-рецепторы (англ. protease-activated receptors, PARs), которые находятся в большом количестве на поверхности тромбоцитов, лейкоцитов и эндотелия. После активации PAR-рецепторы способны стимулировать сложные внутриклеточные сигнальные пути, приводя к активации тромбоцитов, эндотелиальной экспрессии маркеров адгезии и провоспалительных цитокинов, снижению выработки оксида азота, способствуя эндотелиальной дисфункции и вызывая провоспалительные и проапоптотические реакции [20].
Нетоз при COVID-19 / NETosis in COVID-19
Однако не только экспрессия тромбоцитарных факторов моноцитами или эндотелиальными клетками несет прокоагулянтный потенциал, но и внеклеточная ДНК, высвобождаемая в виде внеклеточных ловушек нейтрофилов (англ. neutrophil extracellular traps, NETs), может инициировать каскад коагуляции через контактный путь, который представляет собой еще один важнейший механизм иммунотромбоза. Следует отметить, что тромбоциты не только активируются иммунотромбозом, но также могут инициировать эти процессы. Например, связывание тромбоцитов с нейтрофилами представляет собой пороговый переключатель для образования NETs.
Формирование NETs во время инфекции служит двум целям: с одной стороны, NETs захватывают и убивают бактерии и обеспечивают платформу, где лейкоциты могут действовать более эффективно. С другой стороны, NETs также служат сильным протромботическим и прокоагулянтным стимулом, предоставляя отрицательно заряженную поверхность, которая захватывает факторы коагуляции и тромбоциты. Цитруллинированные гистоны и иммобилизованный vWF на поверхности NETs активируют тромбоциты, тогда как отрицательно заряженная ДНК может вызвать активацию каскада коагуляции через фактор XIIa – индуцированную генерацию тромбина. Кроме того, нейтрофильная эластаза на NETs инактивирует антикоагулянтные механизмы посредством расщепления тромбомодулина и ингибитора пути тканевого фактора (англ. tissue factor pathway inhibitor, TFPI). Фактор XIIa, управляемый NETs, способствует тромбовоспалению, связанному с COVID-19, а ингибирование фактора XIIa, как было показано, снижает уровни NETs, интерлейкина (англ. interleukin, IL) IL-6 и активацию комплемента в модели сепсиса.
Эти процессы не только определяют судьбу локальной микросреды, где они приводят к микротромбам и окклюзии сосудов, но также имеют системные долгосрочные эффекты за пределами ишемических событий и впоследствии могут вызывать состояние иммуносупрессии.
Помимо перечисленных ранее протромботических эффектов NETs, они могут стать причиной ТМА в условиях системного воспалительного ответа и через прямое ингибирование естественных антикоагулянтных свойств ADAMTS-13.
Ряд аутоиммунных заболеваний и синдромов, включая АФС, сопровождаются активацией нетоза. Более того, пациенты с циркуляцией АФА демонстрируют высокую резистентность к профибринолитической активности антикоагулянтов [21].
Тромботические синдромы, опосредованные терапией COVID-19 / Thrombotic syndromes mediated by COVID-19 therapy
Фармацевтические компании отреагировали на пандемию COVID-19 с беспрецедентной скоростью, создав вакцины на основе аденовируса и на основе мРНК. Однако к марту 2021 г. появились сигналы о небезопасности вакцин, использующих векторы на основе аденовируса, в том числе у ранее здоровых реципиентов, у которых развились тяжелые тромбозы (чаще церебральных и/или спланхнических сосудов) и тромбоцитопения, как правило, на второй неделе после первоначальной вакцинации. Случаи вакцин-индуцированных тромбозов были зарегистрированы после введения аденовирус-векторных вакцин различного происхождения, подтверждая, что это осложнение является эффектом, независящим от страны-производителя. Оценки частоты вакцин-индуцированных тромбозов варьируют от 3,2 до 16,1 случаев. Есть серьезные подозрения, что страны с низким и средним уровнем дохода могут иметь заниженные данные, поскольку в Азии, Африке и Латинской Америке было зарегистрировано всего несколько десятков случаев вакцин-индуцированных тромбозов. Потенциальное «недораспознавание» вызывает беспокойство, поскольку раннее выявление и начало лечения могут снизить смертность почти на 90 %.
По аналогии с ГИТ, данный синдром был назван вакцин-индуцированной иммунной тромботической тромбоцитопенией (англ. vaccine-induced immune thrombotic thrombocytopenia, VITT) и был предметом бурного обсуждения в 2021 г.; было опубликовано несколько национальных и международных руководств по диагностике и лечению, которые были обновлены ВОЗ в 2023 г. Группа экспертов-гематологов Великобритании разработала диагностические критерии для VITT [22]:
- появление симптомов через 5–30 дней после вакцинации от COVID-19 (или до 42 дней в случае изолированного тромбоза глубоких вен/легочной эмболии);
- наличие тромбоза;
- тромбоцитопения (количество тромбоцитов < 150 × 10⁹/л);
- D-димер > 4000 мкг/мл;
- позитивные антитела к PF4 (anti-PF4), определенные иммуноферментным методом.
Надо сказать, что тромбоцитарному фактору 4 (англ. platelet factor 4, PF4) принадлежит главная роль как в формировании уже давно известной ГИТ, так и в патогенезе недавно открытого феномена VITT.
Фактор тромбоцитов 4 – небольшой цитокин, принадлежащий к семейству хемокинов CXC, также известный как хемокиновый лиганд 4 (англ. chemokine (C-X-C motif) ligand 4, CXCL4). Этот хемокин высвобождается из альфа-гранул активированных тромбоцитов во время агрегации тромбоцитов и связывается с высокой степенью сродства с гепарином и другими гликозаминогликанами.
Основная физиологическая роль PF4, по-видимому, заключается в нейтрализации гепариноподобных молекул на эндотелиальной поверхности кровеносных сосудов, тем самым подавляя локальную активность антитромбина и способствуя коагуляции. PF4 представляет собой высококатионный тетрамерный белок. Связывание отрицательно заряженного гепарина с положительно заряженным PF4 может нейтрализовать заряд PF4, позволяя тетрамерам PF4 приближаться друг к другу, что является ключевым требованием для формирования многомолекулярных комплексов PF4/гепарин. Нейтрализуя отрицательно заряженные боковые цепи гепарансульфата на поверхности тромбоцитов и эндотелиальных клеток, PF4 способствует агрегации тромбоцитов с образованием тромба. Прямая активация тромбоцитов иммунными комплексами, содержащими PF4, является ключевым патогенетическим механизмом ГИТ. В результате связывания гепарина с PF4 образуются ультрабольшие комплексы PF4/гепарин с антигенными свойствами, что способствует продукции антител IgG к комплексам PF4/гепарин [23].
Антигенные сайты на PF4, которые поддерживают антитела к PF4 с гепарин-независимой реактивностью, отличаются от сайтов с гепарин-зависимой реактивностью и могут напоминать те, которые наблюдаются с антителами при VITT (рис. 6) [24].
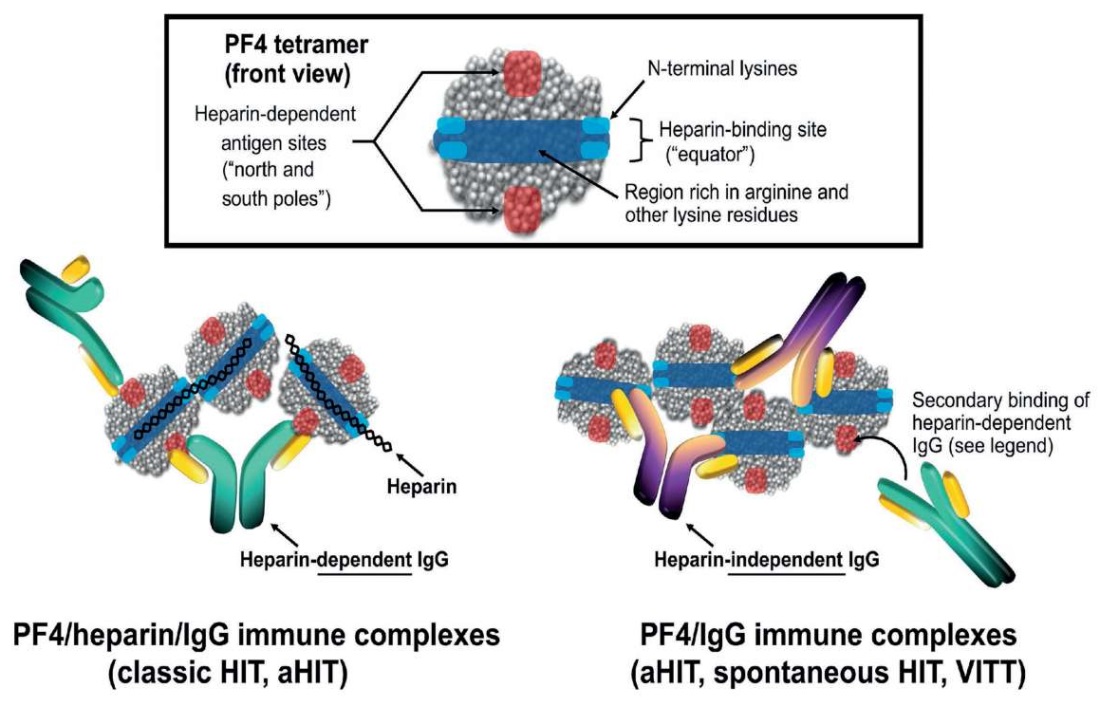
Рисунок 6. Гепарин-зависимые и гепарин-независимые антигенные сайты на поверхности фактора тромбоцитов 4 [24].
Примечание: PF4 – тромбоцитарный фактор 4, HIT – гепарин-индуцированная тромбоцитопения; aHIT – аутоиммунная гепарин-индуцированная тромбоцитопения; VITT – вакцин-индуцированная иммунная тромботическая тромбоцитопения.
Figure 6. Heparin-dependent and heparin-independent antigenic sites on platelet factor 4 surface [24].
Note: PF4 – platelet factor 4; HIT – heparin-induced thrombocytopenia; aHIT – autoimmune heparin-induced thrombocytopenia; VITT – vaccine-induced immune thrombotic thrombocytopenia.
Анти-PF4 антитела, выявленные у пациентов с VITT, связываются с другим эпитопом, чем антитела к PF4, обнаруженные у пациентов с ГИТ. Анти-PF4 антитела при VITT распознают аминокислоты, которые также имеют отношение к связыванию гепарина с PF4. Это имеет большое значение для лечения VITT. Поскольку гепарин часто ингибирует связывание антител VITT, он может действовать как антидот, блокируя связывание антитела/антигена [23].
Иммунные комплексы, состоящие из PF4 и гепарин-независимых антител, активирующих тромбоциты, обнаружены в сыворотке пациентов со спонтанной ГИТ и VITT. Кроме того, близкое сближение тетрамеров PF4 с гепарин-независимыми антителами также может привести к образованию гепарин-зависимых антигенов (несмотря на отсутствие гепарина), распознаваемых гепарин-зависимыми антителами. Пациенты с ГИТ обычно имеют как гепарин-зависимые, так и гепарин-независимые антитела. Оба типа образованных сверхбольших иммунных комплексов связываются с поверхностями тромбоцитов через рецепторы тромбоцитов FcγIIa.
Все аденовирус-векторные вакцины против SARS-CoV-2 связываются с PF4 с большим сродством. Капсид аденовирусного вектора имеет сильную электроотрицательную поверхность, взаимодействующую электростатически с положительно заряженным PF4.
К примеру, оксфордская вакцина содержит большее, чем другие, количество примесей, связанных с подготовкой вакцины (в виде человеческих белков, образующихся в процессе производства), которые могут способствовать образованию комплексов с PF4 и, возможно, более высокой частоте иммунного ответа против PF4.
Был предложен двухэтапный механизм патогенеза VITT: вскоре после вакцинации (дни 1–2) неоантигены генерируются путем взаимодействия положительно заряженного PF4 с отрицательно заряженной вирусной ДНК или другими компонентами вакцины, проникшими в кровообращение, образуя антигенные комплексы, которые связываются с поверхностями тромбоцитов.
Комплексы «тромбоциты–PF4–компонент вакцины» затем транспортируются в селезенку, где они фагоцитируются макрофагами, вызывающими активацию В-клеток, усиленную воспалительными сопутствующими сигналами, вызванными контаминантами вакцинных белков (иммунологический «сигнал опасности»). Позже (дни 5–20) у некоторых реципиентов вакцины активированные В-клетки вырабатывают высокие титры аутоантител против PF4, которые активируют связывание тромбоцитов с рецептором FcγRIIA. Перекрестное взаимодействие PF4, активированных тромбоцитов и антител VITT активирует нейтрофилы, что приводит к образованию NETs и тромбозу.
Активация иммунных тромбоцитов при ГИТ опосредуется взаимодействием Fc-фрагмента IgG с рецептором FcγRIIA на поверхности тромбоцитов. Патогенез ГИТ включает циркулирующие комплексы PF4/гепарин/антитело, которые связываются с рецептором FcγRIIA на тромбоцитах и других клетках крови, несущих Fc-рецепторы, таких как моноциты и нейтрофилы. Активация FcγRIIA вызывает активацию тромбоцитов, что приводит к секреции содержимого их цитоплазматических гранул и образованию прокоагулянтных микрочастиц.
Кроме того, взаимодействие тромбоцитов и нейтрофилов, вызванное антителами ГИТ, может активировать сосудистый эндотелий. Иммунные комплексы PF4/гепарин напрямую активируют эндотелиальные клетки без участия рецептора FcγRIIA, вызывая повышенную экспрессию молекул адгезии, таких как P- и E-селектины, и высвобождение vWF.
Сочетание прямой активации тромбоцитов иммунными комплексами через рецептор FcγRIIA и активации, опосредованной моноцитами и, вероятно, тромбином, полученным из эндотелиальных клеток, увеличивает экспрессию фосфатидилсерина на поверхности тромбоцитов и связывание фактора Xa с тромбоцитами. Эти последствия приводят к повышенному образованию тромбина, что увеличивает риск тромботических окклюзий сосудов.
Длительный COVID / Long-COVID
Длительный COVID – это чрезвычайная ситуация в области общественного здравоохранения, затрагивающая миллионы людей во всем мире и характеризующаяся гетерогенными симптомами во многих системах органов. Уже появились доказательства, связывающие тромбовоспаление с постострыми последствиями COVID-19. Исследования выявили сохранение сосудистого повреждения с повышенными циркулирующими маркерами эндотелиальной дисфункции, нарушения коагуляции с повышенной способностью к генерации тромбина. Фенотип нейтрофилов напоминает острый COVID-19 с повышенной активацией и образованием NETs. Это гиперкоагуляционное состояние, в свою очередь, может привести к микрососудистому тромбозу, о чем свидетельствуют микросгустки и повышенный уровень D-димера в кровотоке, а также нарушения перфузии в легких и мозге у пациентов с длительным COVID. Кроме того, у выживших после COVID-19 наблюдается повышенная частота артериальных и венозных тромботических событий [25].
Обсуждается как минимум 3 важные, потенциально взаимосвязанные гипотезы, которые могут способствовать тромбовоспалению при длительном COVID:
- длительные структурные изменения, в первую очередь эндотелиальное повреждение, вызванное во время первичной инфекции;
- постоянный вирусный резервуар;
- иммунопатология, вызванная ошибками в функционировании иммунной системы.
Заключение / Conclusion
Спустя практически 5 лет от начала пандемии COVID-19 медицинское сообщество значительно продвинулось в понимании как основных патогенетических звеньев заболевания, так и ряда тонких механизмов развития осложнений.
Ранее игнорируемая роль тромботических синдромов при COVID-19 стала ключевой в прогнозе исхода заболевания, ранних и поздних постковидных осложнений. Данному продвижению способствовали многочисленные клинические исследования, посвященные изучению механизмов и особенностей формирования микротромбозов, ДВС-синдрома, тромботической микроангиопатии. Отдельное внимание уделяется развитию тромботических синдромов, связанных с вакцинацией и применением гепарина. Ряд исследований указывают на существенную роль иммунотромбоза в развитии нежелательных лекарственных реакций.
Сейчас внимание медицинского сообщества направлено на такое явление, как длительный COVID, при котором отмечают схожие нарушения со стороны системы гемостаза. Тем не менее тонкие механизмы патогенеза данного состояния остаются предметом изучения фундаментальной и клинической медицины.
Список литературы
1. WHO Health Emergencies Programme. Number of COVID-19 cases reported to WHO (cumulative total). WHO COVID-19 dashboard. World Health Organization, 2024. Режим доступа: https://data.who.int/dashboards/covid19/cases. [Дата обращения: 25.11.2024].
2. Leung T.Y.M., Chan A.Y.L., Chan E.W. et al. Short- and potential long-term adverse health outcomes of COVID-19: a rapid review. Emerg Microbes Infect. 2020;9(1):2190-9. https://doi.org/10.1080/22221751.2020.1825914.
3. Jenner W.J., Kanji R., Mirsadraee S. et al. Thrombotic complications in 2928 patients with COVID-19 treated in intensive care: a systematic review. J Thromb Thrombolysis. 2021;51(3):595-607. https://doi.org/10.1007/s11239-021-02394-7.
4. Lillicrap D., Morrissey J.H. 2020 - Year of COVID-19. J Thromb Haemost. 2020;18(9):2081. https://doi.org/10.1111/jth.15041.
5. Cattaneo M., Bertinato E.M., Birocchi S. et al. Pulmonary embolism or pulmonary thrombosis in COVID-19? Is the recommendation to use high-dose heparin for thromboprophylaxis justified? Thromb Haemost. 2020;120(8):1230-2. https://doi.org/10.1055/s-0040-1712097.
6. Ackermann M., Verleden S.E., Kuehnel M. et al. Pulmonary vascular endothelialitis, thrombosis, and angiogenesis in Covid-19. N Engl J Med. 2020;383(2):120-8. https://doi.org/10.1056/NEJMoa2015432.
7. Макацария А.Д., Бицадзе В.О., Хизроева Д.Х. Катастрофический антифосфолипидный синдром и тромботический "шторм". Сибирский медицинский журнал. 2010;25(4-2):118-23.
8. Макацария А.Д., Григорьева К.Н., Мингалимов М.А. и др. Коронавирусная инфекция (COVID-19) и синдром диссеминированного внутрисосудистого свертывания. Акушерство, Гинекология и Репродукция. 2020;14(2):123-31. https://doi.org/10.17749/2313-7347.132.
9. Popescu N.I., Lupu C., Lupu F. Disseminated intravascular coagulation and its immune mechanisms. Blood. 2022;139(13):1973-86. https://doi.org/10.1182/blood.2020007208.
10. Iba T., Levi M., Thachil J., Levy J.H. Disseminated intravascular coagulation: the past, present, and future considerations. Semin Thromb Hemost. 2022;48(8):978-87. https://doi.org/10.1055/s-0042-1756300.
11. Makatsariya A.D., Slukhanchuk E.V., Bitsadze V.O. et al. Thrombotic microangiopathy, DIC-syndrome and COVID-19: link with pregnancy prothrombotic state. J Matern Fetal Neonatal Med. 2022;35(13):2536-44. https://doi.org/10.1080/14767058.2020.1786811.
12. Wyrick-Glatzel J. Thrombotic thrombocytopenic purpura and ADAMTS-13: new insights into pathogenesis, diagnosis, and therapy. Laboratory Medicine. 2004;35(12):733-9. https://doi.org/10.1309/77KRKLJW0EA75T2R.
13. Tsai H.M. Pathophysiology of thrombotic thrombocytopenic purpura. Int J Hematol. 2010;91(1):1-19. https://doi.org/10.1007/s12185-009-0476-1.
14. Макацария А.Д., Хизроева Д.Х., Шенфельд И. и др. Фактор фон Виллебранда и миелопероксидаза как лабораторные предикторы выживаемости при тяжелом течении COVID-19. Вестник Российской академии медицинских наук. 2022;77(3):189-98. https://doi.org/10.15690/vramn2094.
15. Бицадзе В.О., Хизроева Д.Х., Гри Ж.-К. и др. Патогенетическое и прогностическое значение воспаления и нарушений в оси ADAMTS-13/vWF у больных тяжелой формой COVID-19. Акушерство, Гинекология и Репродукция. 2022;16(3):228-43. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.327.
16. Ortel T.L., Kitchens C.S., Erkan D. et al. Clinical causes and treatment of the thrombotic storm. Expert Rev Hematol. 2012;5(6):653-9. https://doi.org/10.1586/ehm.12.56.
17. Libby P., Simon D.I. Inflammation and thrombosis: the clot thickens. Circulation. 2001;103(13):1718-20. https://doi.org/10.1161/01.cir.103.13.1718.
18. Tanguay J.F., Geoffroy P., Dorval J.F., Sirois M.G. Percutaneous endoluminal arterial cryoenergy improves vascular remodelling after angioplasty. Thromb Haemost. 2004;92(5):1114-21. https://doi.org/10.1160/TH04-06-0336.
19. Blair P., Rex S., Vitseva O. et al. Stimulation of Toll-like receptor 2 in human platelets induces a thromboinflammatory response through activation of phosphoinositide 3-kinase. Circ Res. 2009;104(3):346-54. https://doi.org/10.1161/CIRCRESAHA.108.185785.
20. Schrottmaier W.C., Assinger A. The concept of thromboinflammation. Hamostaseologie. 2024;44(1):21-30. https://doi.org/10.1055/a-2178-6491.
21. Ammollo C.T., Semeraro F., Bison E. et al. Patients with antiphospholipid syndrome display a marked resistance to the profibrinolytic activity of anticoagulants. ISTH Academy, December 2, 2024. Режим доступа: https://academy.isth.org/isth/2020/milan/297022/mario.colucci.patients.with.antiphospholipid.syndrome.display.a.marked.html?f=listing%3D0%2Abrowseby%3D8%2Asortby%3D1%2Asearch%3Dammollo. [Дата обращения: 25.11.2024].
22. Pavord S., Hunt B.J., Horner D. et al.; Guideline Committee. Vaccine induced immune thrombocytopenia and thrombosis: summary of NICE guidance. BMJ. 2021;375:n2195. https://doi.org/10.1136/bmj.n2195.
23. Warkentin T. Anti-PF4 antibody-mediated thrombosis disorders: HIT, aHIT, SpHIT. ISTH Academy, December 3, 2024. Режим доступа: https://academy.isth.org/isth/2024/isth-2024-congress/4137061/theodore.28ted29.warkentin.anti-pf4.antibody-mediated.thrombosis.disorders.hit.html?f=menu%3D3%2Abrowseby%3D8%2Asortby%3D2%2Amedia%3D1%2Atopic%3D21415. [Дата обращения: 25.11.2024].
24. Warkentin T.E. Platelet-activating anti-PF4 disorders: An overview. Semin Hematol. 2022;59(2):59-71. https://doi.org/10.1053/j.seminhematol.2022.02.005.
25. Nicolai L., Kaiser R., Stark K. Thromboinflammation in long COVID - the elusive key to postinfection sequelae? J Thromb Haemost. 2023;21(8):2020-31. https://doi.org/10.1016/j.jtha.2023.04.039.
Об авторе
А. Д. МакацарияРоссия
Макацария Александр Давидович, д.м.н., проф., академик РАН
119991 Москва, Трубецкая ул., д. 8, стр. 2
Scopus Author ID: 57222220144. WoS ResearcherID: M-5660-2016
Рецензия
Для цитирования:
Макацария А.Д. COVID-19 и системные тромботические синдромы. Акушерство, Гинекология и Репродукция. 2024;18(6):908-918. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.590
For citation:
Makatsariya A.D. COVID-19 and systemic thrombotic syndromes. Obstetrics, Gynecology and Reproduction. 2024;18(6):908-918. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.590

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































