Перейти к:
Химиотерапия и нарушения гемостаза
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.579
Аннотация
Онкологические пациенты находятся в зоне риска артериальных и венозных тромбозов на фоне проведения курсов химиотерапии (ХТ) как в процессе проведения, так и по ее окончании. Патогенетическими путями реализации протромботического риска являются активация внешних и внутренних путей коагуляции, снижение уровня антикоагулянтов, активация тромбоцитов, блок фибринолиза и др. Химиотерапевтические агенты обладают прямой цитотоксичностью, а также опосредованной, подавляя клеточные процессы, необходимые для пролиферации опухолевых клеток. Цитотоксичность ХТ направлена как на опухолевые, так и на здоровые клетки организма. Современные таргетные препараты, обладающие улучшенной селективностью в отношении опухолевых клеток, также связаны с риском тромбоза. Низкомолекулярные гепарины, эффективно снижающие риск венозной тромбоэмболии, до настоящего времени официально не рекомендованы для рутинного использования на фоне ХТ. В данной статье рассмотрены протромботические эффекты различных противоопухолевых агентов. Более глубокое понимание механизмов в дальнейшем позволит разработать новые стратегии профилактики и лечения этих грозных осложнений.
Для цитирования:
Слуханчук Е.В., Бицадзе В.О., Солопова А.Г., Хизроева Д.Х., Григорьева К.Н., Гашимова Н.Р., Макацария Н.А., Блинов Д.В., Галкин В.Н., Шатилина А.Ю., Ляднова Е.М., Шульга Н.А., Тогузаева Л.Т., Моркос С., Гри Ж., Элалами И., Геротзиафас Г., Макацария А.Д. Химиотерапия и нарушения гемостаза. Акушерство, Гинекология и Репродукция. 2024;18(6):835-846. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.579
For citation:
Slukhanchuk E.V., Bitsadze V.O., Solopova A.G., Khizroeva J.Kh., Grigoreva K.N., Gashimova N.R., Makatsariya N.A., Blinov D.V., Galkin V.N., Shatilina A.Yu., Lyadnova E.M., Shulga N.A., Toguzaeva L.T., Morkos S., Gris J., Elalamy I., Gerotziafas G., Makatsariya A.D. Chemotherapy and hemostasis disorders. Obstetrics, Gynecology and Reproduction. 2024;18(6):835-846. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.579
Введение / Introduction
Клинические исследования убедительно подтверждают роль противоопухолевой химиотерапии (ХТ) в повышении тромботического риска у онкологических пациентов. ХТ увеличивает риск тромбоза глубоких вен (ТГВ) в 6 раз и рецидивирующего ТГВ в 2 раза [1]. Многие современные препараты для ХТ, антиангиогенные препараты при использовании по отдельности имеют низкий тромботический риск, при этом в комбинации с другими препаратами для ХТ становятся протромбогенными. Экспериментальные данные свидетельствуют о том, что ХТ может непосредственно или опосредованно способствовать экспрессии тканевого фактора (англ. tissue factor, TF) в макрофагах, моноцитах и эндотелиальных клетках. Помимо этого, протромбогенные эффекты ХТ обусловлены снижением содержания протеинов С и S при одновременном повышении концентраций фибриногена, фактора фон Виллебранда (англ. von Willebrand factor, vWF) и фактора (F) VIII. Достаточное количество исследований продемонстрировали активацию гемостаза у онкологических пациентов на фоне ХТ, при этом патогенетические механизмы этих изменений до сих пор до конца не изучены. В настоящее время нет единого мнения о прогностическом значении конкретных маркеров активации гемостаза или других показателей в отношении тромботического риска ХТ у онкологического пациента.
Системная терапия и венозная тромбоэмболия / Systemic therapy and venous thromboembolism
В популяционном контролируемом исследовании тромботических осложнений длительностью 15 лет было показано, что у пациентов на фоне ХТ тромботический риск (отношение шансов (англ. odds ratio, OR) = 6,5; 95 % доверительный интервал (ДИ) = 2,1–20,2) значительно выше, чем у онкологических пациентов без ХТ (OR = 4,1; 95 % ДИ = 1,9–8,5) [2]. Другое исследование продемонстрировало, что пациенты, получившие неоадъювантную ХТ, имели повышенный риск развития венозной тромбоэмболии (ВТЭ) (OR = 2,2; относительный риск (англ. relative risk, RR) = 2,2; 95 % ДИ = 1,8–2,6) по сравнению с пациентами без ХТ [3]. Относительный риск (RR = 2,4; 95 % ДИ = 1,7–3,3) был также повышен у пациентов на фоне ХТ с метастатическими формами заболеваний. В проспективном наблюдательном многоцентровом исследовании с участием пациентов на фоне ХТ с различными локализациями опухолей у 1,93 % пациентов была выявлена ВТЭ. Заболеваемость при этом варьировала в зависимости от локализации процесса [4].
На ранних стадиях рака молочной железы (РМЖ) в отсутствие адъювантной ХТ риск тромботических осложнений достаточно низкий, на фоне приема тамоксифена он значительно растет [5]. При РМЖ на фоне адъювантной ХТ при сочетанном приеме тамоксифена тромботические осложнения встречались в 4 раза чаще, чем у пациенток только на гормонотерапии (4,2–9,6 % против 1,0–1,6 %) [6]. По данным ретроспективного исследования, тромботические осложнения чаще отмечались у пациенток, получающих адъювантную ХТ в течение 6 нед после операции (2,1 % против 0,8 %) по сравнению с пациентками, ее не получающими [7]. ХТ у пациентов с прогрессией опухоли и наличием метастазов значительно увеличивает риск ВТЭ. У пациенток при РМЖ IV стадии, получающих ХТ, частота тромботических осложнений составляет 17 % [8]. Патогенетическая связь между системной ХТ и тромбозом выявлена при лимфоме [9], раке яичников [10], предстательной железы [11], глиоме и раке мочевого пузыря [12].
Антиангиогенные и цитокиномодулирующие агенты, такие как SU5416, талидомид и леналидомид, также повышают риск тромбоза, особенно в сочетании с ХТ [13][14]. Из 19 пациентов, получавших гемцитабин, цисплатин, SU5416, молекулу, подавляющую автофосфорилирование рецептора фактора роста эндотелия сосудов (англ. vascular endothelial growth factor, VEGF), у 8 пациентов развились тромботические осложнения [12]. Тромбоэмболические события наблюдались при использовании изолированно SU5416 значительно реже. У 3 пациентов в этом исследовании было отмечено повышение таких маркеров активации гемостаза, как протромбиновые фрагменты 1+2 (F1+2) и тромбин-антитромбиновые комплексы (TAT), как до начала терапии, так и на 8-й, 18-й и 21-й дни от начала терапии [12]. Концентрация комплексов TAT и F1+2 к 8-му дню значительно повысилась у всех пациентов и оставалась повышенной до 18-го дня. У двух из трех пациентов развились тромбоэмболические осложнения.
Талидомид в виде монотерапии или в комбинации с другими препаратами приводит к развитию ВТЭ [15]. В качестве монотерапии при множественной миеломе частота ВТЭ составляет 3–4 % [16]. При сочетании талидомида с дексаметазоном или с другими химиотерапевтическими препаратами частота ВТЭ повышается до 9–58 % [17]. Аналогичная высокая заболеваемость ВТЭ отмечена и при использовании талидомида в сочетании с препаратами для ХТ при других злокачественных опухолях [18]. Леналидомид также повышает риск развития тромботических осложнений с частотой 4 %, в сочетании с дексаметазоном эта частота увеличивается до 19 % [19].
Несмотря на большое количество данных о том, что системная ХТ способствует развитию венозного и артериального тромбозов у онкологических пациентов, нет окончательного представления о патогенетических механизмах, лежащих в их основе. Кроме того, тромботический риск на фоне ХТ зависит от конкретной схемы лечения, типа злокачественной опухоли и ее характеристик, стадии заболевания и других факторов риска, сопутствующей патологии.
Патогенез тромбоза на фоне химиотерапии / Pathogenesis of thrombosis during chemotherapy
Достоверный анализ патогенетического влияния препаратов для ХТ затруднен в связи с невозможностью в полной мере оценить исходное состояние гемостаза у пациента, в том числе наличие приобретенной и врожденной тромбофилии и других факторов. Затрудняет анализ и применение различных препаратов и схем лечения (рис. 1). К протромбогенным эффектам ХТ относятся повреждение эндотелия, активация тромбоцитов [20], повышение активности TF, рост концентрации фосфатидилсерина, микрочастиц [21] и внеклеточной ДНК [22], а также подавление фибринолиза, блок звена естественных антикоагулянтов и др. (рис. 2). ХТ активирует внутриклеточные сигнальные пути, которые способствуют выработке провоспалительных медиаторов; они повреждают эндотелий с последующей его активацией. Прямое токсическое влияние препаратов для ХТ снижает чувствительность эндотелия к простациклину. За повреждением эндотелия следует рост концентрации vWF, селектинов и молекул адгезии [23][24]. Лейкоциты мигрируют под контролем селектинов, интегринов и других молекул адгезии и фиксируются в участках повреждения к эндотелию [25]. Р-селектин повышает экспрессию TF моноцитами. После взаимодействия P-селектина с его рецептором на поверхности лейкоцитов, P-селектин-гликопротеиновым лигандом 1 (англ. P-selectin glycoprotein ligand-1, PSGL-1), лейкоциты выделяют прокоагулянтные субстанции, а также происходит привлечение нейтрофилов и макрофагов [26][27] (рис. 1).

Рисунок 1. Потенциальные механизмы патогенеза тромбоза на фоне химиотерапии [рисунок авторов].
Примечание: ТМА – тромботическая микроангиопатия; TF – тканевой фактор.
Figure 1. Putative mechanisms of thrombosis pathogenesis during chemotherapy [drawn by authors].
Note: TMA – thrombotic microangiopathy; TF – tissue factor.
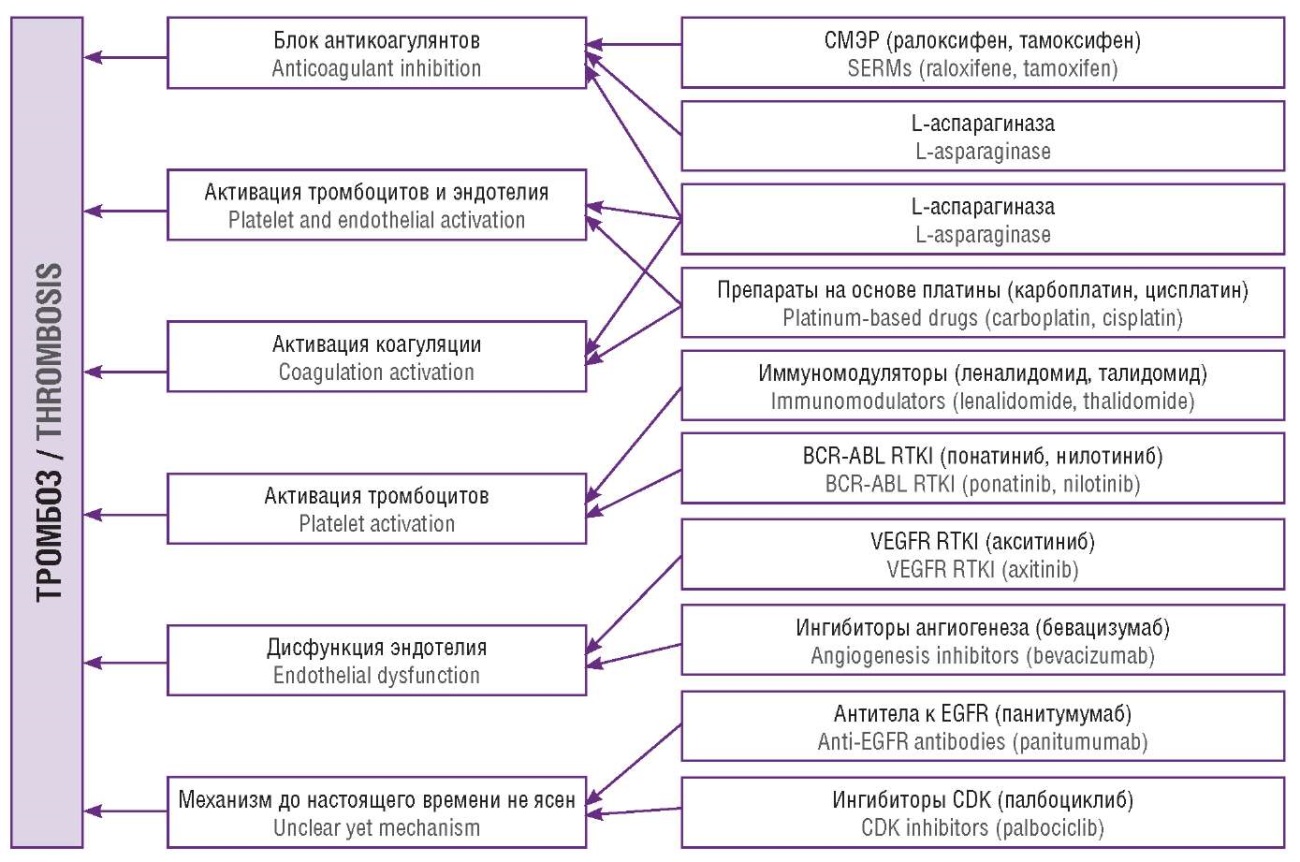
Рисунок 2. Ведущие механизмы протромбогенного действия наиболее используемых групп химиотерапевтических агентов [рисунок авторов].
Примечание: СМЭР – селективные модуляторы эстрогеновых рецепторов; BCR-ABL RTKI – ингибитор рецепторов тирозин-киназы; VEGFR RTKI – ингибитор рецептора тирозинкиназы рецепторов сосудисто-эпителиального фактора роста; EGFR – рецептор эпидермального фактора роста; CDK – циклинзависимая киназа.
Figure 2. Most common groups of chemotherapeutic agents and relevant leading mechanisms of prothrombogenic action [drawn by authors].
Note: SERMs – selective estrogen receptor modulators; BCR-ABL RTK – breakpoint cluster region protein-tyrosine kinase protein ABL1 receptor Tyrosine Kinase Inhibitors; VEGFR RTKI – vascular endothelial growth factor receptor receptor tyrosine kinase inhibitor; EGFR – epidermal growth factor receptor; CDK – cyclin-dependent kinase.
Повреждение эндотелия влияет на концентрацию и активность металлопротеиназы ADAMTS-13 (англ. a disintegrin and metalloproteinase with thrombospondin type 1 motif, member 13) и vWF, способствуя развитию феномена тромботической микроангиопатии (ТМА) при раке. Эффект от накопления химиотерапевтического препарата приводит к тому, что через несколько месяцев от начала терапии пациенты на фоне ремиссии по основному заболеванию могут умирать от ТМА; летальность при этом может достигать 72 % [28].
На фоне использования ингибиторов тирозинкиназы (ТКИ) и VEGF могут развиться аГУС-подобные (атипичный гемолитико-уремический синдром, аГУС) синдромы [29–31]. В норме VEGF снижает сосудистый тонус путем активации клетками эндотелия выработки оксида азота и простагландина. Подавление VEGF препаратами для ХТ приводит к ангиоспазму и росту артериального давления [32], появлению эндотелия в микроциркуляторном русле. На этом фоне в гломерулах почек нарушается клубочковая фильтрация, что ведет к почечной недостаточности [33][34]. Более эффективным терапевтическим подходом, чем прекращение использования препаратов и плазмозамещение, как оказалось, является применение ингибиторов комплемента, что свидетельствует о его патогенетической роли [35].
Феномен ТМА у онкологических пациентов описан при использовании митомицина С, описаны случаи острого некардиогенного отека легких и синдрома дыхательной недостаточности как проявлений ТМА. Прием препарата сопровождался признаками активации эндотелия, ростом концентрации тканевого активатора плазминогена (англ. tissue plasminogen activator, tPA), тромбомодулина и ингибитора активатора плазминогена-1 (англ. plasminogen activator inhibitor-1, PAI-1) [36–38].
Прием гемцитабина также сопряжен с эпизодами ТМА у онкологических пациентов. Одной из возможных причин является накопление токсичности [39]. Клинически ТМА в этом случае проявляется почечной недостаточностью, микрогематурией и протеинурией, системной гипертензией [40]. При гистологическом исследовании биоптата почек выявляются отложения компонента С3 комплемента, некроз эндотелиальных клеток, гранулярные отложения, утолщение стенок капилляров и фибриновые сгустки крови в микроциркуляторном русле. В качестве терапии также демонстрируют эффективность ингибиторы комплемента [41].
Нейтрофилы, ассоциированные с опухолью и являющиеся неотъемлемой частью ее микроокружения, выделяют цитокины и хемокины, благодаря чему обеспечивают выживание клеток опухоли и снижают эффективность ХТ [42]. При легкой нейтропении, вызванной ХТ, эффект лечения достоверно лучше [43], что ранее рассматривалась как совпадение. Роль нейтрофилов в формировании резистентности к ХТ вызывает интерес к нетозу как ее механизму [44][45]. Количество циркулирующей ДНК является маркером эффективности противоопухолевой терапии [46][47]. ХТ сопряжена с ростом концентрации циркулирующей ДНК и гиперкоагуляцией. При опухолях легкого концентрация ДНК в плазме крови повышена как исходно, так и в большей степени после курсов ХТ [47–49]. При этом по своим характеристикам внеклеточная ДНК (вкДНК) при раке сходна с ДНК внеклеточных ловушек нейтрофилов (англ. neutrophil extracellular traps, NETs). Рост концентрации вкДНК, источником которой могут быть нейтрофилы, сопряжен с развитием химиорезистентности [49]. При этом лучший ответ на терапию имеет место в случае более низкой концентрации вкДНК и гистонов у пациентов с немелкоклеточным раком легкого III и IV стадий [50][51].
Маркеры активации гемостаза в мониторинге тромботического риска на фоне химиотерапии / Hemostasis activation markers in thrombotic risk monitoring during chemotherapy
Исследования показали рост на фоне системной ХТ концентрации таких маркеров активации гемостаза, как ТАТ, F1+2, фибрионопептид А и D-димер [52]. Концентрацию фибринопептида в плазме изучали у пациентов с различными локализациями опухолей с наличием метастазов до и после ХТ [53][54]. Среди используемых препаратов были доксорубицин, метотрексат, винкристин и триметрексат. Рост показателя отмечался в среднем в течение 45 мин после использования препаратов. Также было показано, что предотвратить данный рост показателя можно одновременным введением 5000 единиц нефракционированного гепарина [54].
В другом исследовании оценивалась активация системы гемостаза у пациентов с неходжкинской лимфомой на фоне протокола COP-BLAM (циклофосфамид, винкристин, преднизон, блеомицин, доксорубицин и прокарбазин) и менее интенсивного протокола COP. Концентрации TAT и F1+2 росли через 4 ч после инфузии в протоколе COP-BLAM. В протоколе COP концентрация маркеров также росла, но не достигала статистической значимости [55].
В основе быстрой активации гемостаза на фоне ХТ лежит быстрый рост концентрации функционально активного TF и активация эндотелия. Исследования in vitro показали, что на фоне паклитаксела происходит тромбин-инициированная экспрессия TF клетками эндотелия [56]. Данный процесс, возможно, является результатом активации паклитакселом c-Jun фрагмента NH2-киназы [56]. Непосредственная токсичность в отношении эндотелиальных клеток была обнаружена для блеомицина. Применение блеомицина приводило к вакуолизации и некрозу клеток эндотелия в легких по данным гистологического исследования у мышей [57]. Различные противоопухолевые препараты приводят к повреждению эндотелия с экспонированием субэндотелиального матрикса с последующим привлечением тромбоцитов и адгезии тромбоцитов на субэндотелии. TF субэндотелия также активно участвует в запуске реакций коагуляции. На фоне прямого токсического влияния ХТ на эндотелий происходит активация тромбоцитов, что коррелирует с ростом концентрации интерлейкина-1 (англ. interleukin, IL) в плазме крови, который, как известно, является индуктором экспрессии TF моноцитами и эндотелием [58].
Активация клеток эндотелия на фоне ХТ приводит к повышению концентраций vWF и FVIII [59]. При тромботических осложнениях на фоне приема блеомицина, виндезина и цисплатина у пациентов с опухолями головы и шеи отмечалось повышение концентрации vWF [60]. Аналогичные результаты продемонстрированы у пациентов с опухолями яичек, получавших цисплатин и блеомицин [61]. Повышение уровня vWF в плазме крови онкологических пациентов на фоне ХТ может быть результатом как непосредственной активации эндотелия, так и опосредованной активации эндотелия провоспалительными цитокинами, концентрация которых также растет на фоне ХТ. У пациентов, получающих ХТ при РМЖ и раке легких, отмечено повышение концентрации IL-6 в плазме по сравнению с исходной до лечения [62]. Микроангиопатическая тромбоцитопения была отмечена при использовании таких препаратов как митомицин С и гемцитабин. Сверхбольшие мультимеры vWF выявлены у пациентов на фоне ХТ и циклоспорина с ТМА [63].
В исследованиях сообщается о снижении концентрации протеина С на фоне ХТ [64]. Циклофосфамид, метотрексат и 5-фторурацил к 8-му дню терапии при РМЖ приводят к снижению концентрации и активности протеинов С и S [65]. На этом фоне статистически значимо снизилась активность FVII, что свидетельствует об активном потреблении ингибиторов коагуляции и вторичной активации гемостаза. На фоне снижения активности протеина С отмечен рост концентрации фибринопептида А [66]. В настоящее время не до конца понятно, является ли снижение концентрации и активности протеина С результатом повышенного потребления за счет увеличения генерации тромбина, или это состояние индуцированно ХТ.
L-аспарагиназа является важным противоопухолевым препаратом, используемым при лечении острого лимфобластного лейкоза. Ее уникальный биологический эффект основан на снижении количества L-аспарагина в плазме крови. L-аспарагин – незаменимая аминокислота, необходимая для синтеза белка и роста клеток. L-аспарагиназа также подавляет белок-синтезирующую функцию печени, что приводит к снижению концентрации факторов свертывания и антикоагулянтов, включая фибриноген, плазминоген, антитромбин, белки C и S и др. [67]. На фоне использования препарата растет частота тромботических осложнений у детей и взрослых [67]. Большинство тромботических событий происходит в течение одной-двух недель после начала терапии, что совпадает с пиком снижения концентрации природных антикоагулянтов. Снижение концентрации антитромбина в плазме коррелировало с повышением маркеров активации гемостаза, включая фибринопептид А, TAT и фрагменты F1+2.
Иммунотерапия, наряду с ХТ и гормональной терапией, также продемонстрировала свои протромбогенные свойства. Леналидомид и талидомид в сочетании с дексаметазоном обладают выраженным протромбогенным действием. Механизм его до конца не ясен. Допускают возможное развитие эндотелиотоксичности, приобретенной резистентности к протеину С, а также дисрегуляцию катепсина G, активатора тромбоцитов [28] (табл. 1).
Таблица 1. Маркеры тромбогенности химиотерапии.
Table 1. Markers of chemotherapy-related thrombogenic activity.
|
Маркер / Marker |
Динамика маркера Marker dynamics |
Источник Reference |
|
Фибринопептид А / Fibrinopeptide A |
Рост / Increase |
52, 53, 54, 66 |
|
Фрагменты протромбина F1+2 / Prothrombin fragments F1+2 |
Рост / Increase |
52, 55 |
|
Резистентность к активированному протеину С (АРС-резистентность) / Activated protein C resistance (APC-R) |
Появление / Emergence |
64, 65, 66 |
|
Фактор фон Виллебранда / von Willebrand factor |
Рост / Increase |
59, 60, 61, 63 |
|
ADAMTS-13 |
Снижение / Decrease |
28 |
|
Фибриноген / Fibrinogen |
Рост / Increase |
67 |
|
Фактор VIII / Factor VIII |
Рост / Increase |
59 |
|
Антитромбин / Antithrombin |
Снижение / Decrease |
67 |
|
Протеин С / Protein С |
Снижение / Decrease |
64, 65, 67 |
|
Протеин S / Protein S |
Снижение / Decrease |
65, 67 |
|
D-димер / D-dimer |
Рост / Increase |
52, 55 |
|
Интерлейкин-1 / Interleukin-1 |
Рост / Increase |
61 |
|
Интерлейкин-6 / Interleukin-6 |
Рост / Increase |
62 |
|
Тромбин-антитромбиновые комплексы / Thrombin-antithrombin complexes |
Рост / Increase |
55 |
Заключение / Conclusion
Несмотря на то, что тип опухоли и стадия развития заболевания являются основными определяющими характеристиками риска тромботических осложнений, огромная роль в риске тромбоза отводится виду используемого химиотерапевтического агента. Риск тромботических осложнений выше у пациентов, проходящих лечение по многокомпонентным схемам, где могут иметь место синергические эффекты. Рутинная тромбопрофилактика до сих пор не рекомендуется для онкологических пациентов на фоне ХТ в большинстве клинических рекомендаций; однако она все же может быть предложена пациентам с высоким риском. Протромбогенное действие препаратов для ХТ диктует необходимость рассматривать вопрос об одновременном планировании противотромботической профилактики. Благодаря лучшему пониманию механизмов, которые управляют тромбозом, связанным с ХТ, возможна разработка оптимальных схемы антикоагулянтной терапии, которые минимизируют тромботический риск и риск кровотечения. Налицо необходимость разработки и внедрения прогностической модели стратификации риска тромбоза у пациентов на ХТ с последующей оценкой необходимости профилактической антикоагуляции, а также проведение рандомизированных контролируемых испытаний профилактической антикоагуляции во время ХТ.
Список литературы
1. Elyamany G., Alzahrani A.M., Bukhary E. Cancer-associated thrombosis: an overview. Clin Med Insights Oncol. 2014;8:129-37. https://doi.org/10.4137/cmo.s18991.
2. Heit J.A., Silverstein M.D., Mohr D.N. et al. Risk factors for deep vein thrombosis and pulmonary embolism: a population-based case-control study. Arch Intern Med. 2000;160(6):809-15. https://doi.org/10.1001archinte.160.6.809.
3. Blom J.W., Vanderschoot J., Oostindier M. et al. Incidence of venous thrombosis in a large cohort of 66 329 cancer patients: results of a record linkage study. J Thromb Haemost. 2006;4(3):529-35. https://doi.org/10.1111/j.1538-7836.2006.01804.x.
4. Khorana A.A., Francis C.W., Culakova E., Lyman G.H. Risk factors for chemotherapy-associated venous thromboembolism in a prospective observational study. Cancer. 2005;104(12):2822-9. https://doi.org/10.1002/cncr.21496.
5. Duggan C., Marriott K., Edwards R., Cuzick J. Inherited and acquired risk factors for venous thromboembolic disease among women taking tamoxifen to prevent breast cancer. J Clin Oncol. 2003;21(19):3588-93. https://doi.org/10.1200/JCO.2003.10.111.
6. Fisher B., Dignam J., Emir B. al. Tamoxifen and chemotherapy for lymph node-negative, estrogen receptor-positive breast cancer. J Natl Cancer Inst. 1997;89(22):1673-82. https://doi.org/10.1093/jnci/89.22.1673.
7. Clahsen P.C., Van de Velde C., Julien J.-P. et al. Thromboembolic complications after perioperative chemotherapy in women with early breast cancer: a European Organization for Research and Treatment of Cancer Breast Cancer Cooperative Group study. J Clin Oncol. 1994;12(6):1266-71. https://doi.org/10.1200/JCO.1994.12.6.1266.
8. Goodnough L.T., Saito H., Manni A. et al. Increased incidence of thromboembolism in stage IV breast cancer patients treated with a five-drug chemotherapy regimen. Cancer. 1984;54(7):1264-8. https://doi.org/10.1002/1097-0142(19841001)54:7<1264::aid-cncr2820540706>3.0.co;2-r.
9. Cantwell B., Carmichael J., Ghani S.E., Harris A.L. Thromboses and thromboemboli in patients with lymphoma during cytotoxic chemotherapy. BMJ. 1988;297(6642):179-80. https://doi.org/10.1136/bmj.297.6642.179.
10. Rickles F.R., Levine M.N. Epidemiology of thrombosis in cancer. Acta Haematol. 2001;106(1-2):6-12. https://doi.org/10.1159/000046583.
11. Lubiniecki G.M., Berlin J.A., Weinstein R.B., Vaughn D.J. Thromboembolic events with estramustine phosphate-based chemotherapy in patients with hormone-refractory prostate carcinoma: results of a meta-analysis. Cancer. 2004;101(12):2755-9. https://doi.org/10.1002/cncr.20673.
12. Kuenen B.C., Rosen L., Smit E.F. et al. Dose-finding and pharmacokinetic study of cisplatin, gemcitabine, and SU5416 in patients with solid tumors. J Clin Oncol. 2002;20(6):1657-67. https://doi.org/10.1200/JCO.2002.20.6.1657.
13. Palumbo A., Bertola A., Musto P. et al. Oral melphalan, prednisone, and thalidomide for newly diagnosed patients with myeloma. Cancer. 2005;104(7):1428-33. https://doi.org/10.1002/cncr.21342.
14. Wang M., Dimopoulos M.A., Chen C. et al. Lenalidomide plus dexamethasone is more effective than dexamethasone alone in patients with relapsed or refractory multiple myeloma regardless of prior thalidomide exposure. Blood. 2008;112(12):4445-51. https://doi.org/10.1182/blood-2008-02-141614.
15. Rajkumar S.V., Blood E., Vesole D. et al. Phase III clinical trial of thalidomide plus dexamethasone compared with dexamethasone alone in newly diagnosed multiple myeloma: a clinical trial coordinated by the Eastern Cooperative Oncology Group. J Clin Oncol. 2006;24(3):431-6. https://doi.org/10.1200/JCO.2005.03.0221.
16. Glasmacher A., Hahn C., Hoffmann F. M, et al. A systematic review of phase-II trials of thalidomide monotherapy in patients with relapsed or refractory multiple myeloma. Br J Haematol. 2006;132(5):584-93. https://doi.org/10.1111/j.1365-2141.2005.05914.x.
17. Lee C.-K., Barlogie B., Munshi N. et al. DTPACE: an effective, novel combination chemotherapy with thalidomide for previously treated patients with myeloma. J Clin Oncol. 2003;21(14):2732-9. https://doi.org/10.1200/JCO.2003.01.055.
18. Steurer M., Sudmeier I., Stauder R., Gastl G. Thromboembolic events in patients with myelodysplastic syndrome receiving thalidomide in combination with darbepoietin-alpha. Br J Haematol. 2003;121(1):101-3. https://doi.org/10.1046/j.1365-2141.2003.04252.x.
19. Palladini G., Russo P., Milani P. et al. A phase II trial of cyclophosphamide, lenalidomide and dexamethasone in previously treated patients with AL amyloidosis. Haematologica. 2013;98(3):433-6. https://doi.org/10.3324/haematol.2012.073593.
20. van Es N., Sturk A., Middeldorp S., Nieuwland R. Effects of cancer on platelets. Semin Oncol. 2014;41(3):311-8. https://doi.org/10.1053/j.seminoncol.2014.04.015.
21. Thaler J., Pabinger I., Sperr W.R., Ay C. Clinical evidence for a link between microparticle-associated tissue factor activity and overt disseminated intravascular coagulation in patients with acute myelocytic leukemia. Thromb Res. 2014;133(3):303-5. https://doi.org/10.1016/j.thromres.2013.12.029.
22. Swystun L.L., Mukherjee S., Liaw P.C. Breast cancer chemotherapy induces the release of cell-free DNA, a novel procoagulant stimulus. J Thromb Haemost. 2011;9(11):2313-21. https://doi.org/10.1111/j.1538-7836.2011.04465.x.
23. Kirwan C.C., Mccollum C.N., McDowell G., Byrne G. Investigation of proposed mechanisms of chemotherapy-induced venous thromboembolism: endothelial cell activation and procoagulant release due to apoptosis. Clin Appl Thromb Hemost. 2015;21(5):420-7. https://doi.org/10.1177/1076029615575071.
24. Chen L., Deng H., Cui H. et al. Inflammatory responses and inflammation-associated diseases in organs. Oncotarget. 2018;9(6):7204-18. https://doi.org/10.18632/oncotarget.23208.
25. Mo J., Zhang D., Yang R. Expression of P-selectin, VCAM-1, and PSGL-1 in traumatic deep venous thrombosis. Int J Clin Exp Pathol. 2016;9(3):3403-9.
26. Feng Y., Li X., Xiao J. et al. ADAMTS13: more than a regulator of thrombosis. Int J Hematol. 2016;104(5):534-9. https://doi.org/10.1007/s12185-016-2091-2.
27. Бицадзе В.О., Слуханчук Е.В., Хизроева Д.Х. и др. Внеклеточные ловушки нейтрофилов (NETs) в патогенезе тромбоза и тромбовоспа-лительных заболеваний. Вестник Российской академии медицинских наук. 2021;76(1):75-85. https://doi.org/10.15690/vramn1395.
28. Izzedine H., Isnard-Bagnis C., Launay-Vacher V. Gemcitabine-induced thrombotic microangiopathy: a systematic review. Nephrol Dial Transplant. 2006;21(11):3038-45. https://doi.org/10.1093/ndt/gfl507.
29. Ohtsu H., Dempsey P.J., Eguchi S. ADAMs as mediators of EGF receptor transactivation by G protein-coupled receptors. Am J Physiol Cell Physiol. 2006;291(1):C1-C10. https://doi.org/10.1152/ajpcell.00620.2005.
30. Choi M.K., Hong J.Y., Jang J.H., Lim H.Y. TTP-HUS associated with sunitinib. Cancer Res Treat. 2008;40(4):211-3. https://doi.org/10.4143/crt.2008.40.4.211.
31. Ojeda-Uribe M., Merieau S., Guillon M. et al. Secondary thrombotic microangiopathy in two patients with Philadelphia-positive hematological malignancies treated with imatinib mesylate. J Oncol Pharm Pract. 2016;22(2):361-70. https://doi.org/10.1177/1078155214568580.
32. Biss T., Avery P., Williams M. et al. The VKORC1 and CYP2C9 genotypes are associated with over-anticoagulation during initiation of warfarin therapy in children. J Thromb Haemost. 2013;11(2):373-5. https://doi.org/10.1111/jth.12072.
33. Terrell D., Williams L., Vesely S. et al. The incidence of thrombotic thrombocytopenic purpura-hemolytic uremic syndrome: all patients, idiopathic patients, and patients with severe ADAMTS-13 deficiency. J Thromb Haemost. 2005;3(7):1432-6. https://doi.org/10.1111/j.1538-7836.2005.01436.x.
34. Okano E., Ko S., Kanehiro H. et al. ADAMTS13 activity decreases after hepatectomy, reflecting a postoperative liver dysfunction. Hepatogastroenterology. 2010;57(98):316-20.
35. Liu L., Choi H., Bernardo A. et al. Platelet-derived VWF-cleaving metalloprotease ADAMTS-13. J Thromb Haemost. 2005;3(11):2536-44. https://doi.org/10.1111/j.1538-7836.2005.01561.x.
36. Sato N., Tasaki T., Noguchi H. et al.The pathological challenge of establishing a precise diagnosis for pulmonary tumour thrombotic microangiopathy: identification of new diagnostic criteria. Histopathology. 2019;74(6):892-901. https://doi.org/10.1111/his.13813.
37. Turner N.A., Nolasco L., Ruggeri Z.M., Moake J.L. Endothelial cell ADAMTS-13 and VWF: production, release, and VWF string cleavage. Blood. 2009;114(24):5102-11. https://doi.org/10.1182/blood-2009-07-231597.
38. Van Es N., Le Gal G., Otten H.-M. et al. Screening for occult cancer in patients with unprovoked venous thromboembolism: a systematic review and meta-analysis of individual patient data. Ann Intern Med. 2017;167(6):410-7. https://doi.org/10.7326/M17-0868.
39. Lee M., Rodansky E.S., Smith J.K., Rodgers G.M. ADAMTS13 promotes angiogenesis and modulates VEGF-induced angiogenesis. Microvas Res. 2012;84(2):109-15. https://doi.org/10.1016/j.mvr.2012.05.004.
40. Feys H., Liu F., Dong N. et al. ADAMTS-13 plasma level determination uncovers antigen absence in acquired thrombotic thrombocytopenic purpura and ethnic differences. J Thromb Haemost. 2006;4(5):955-62. https://doi.org/10.1111/j.1538-7836.2006.01833.x.
41. Kearon C., Akl E.A., Ornelas J. et al. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016;149(2):315-52. https://doi.org/10.1016/j.chest.2015.11.026.
42. Hedrick C.C., Malanchi I. Neutrophils in cancer: heterogeneous and multifaceted. Nat Rev Immunol. 2022;22(3):173-87. https://doi.org/10.1038/s41577-021-00571-6.
43. Kan M., Imaoka H., Watanabe K. et al. Chemotherapy-induced neutropenia as a prognostic factor in patients with pancreatic cancer treated with gemcitabine plus nab-paclitaxel: a retrospective cohort study. Cancer Chemother Pharmacol. 2020;86(2):203-10. https://doi.org/10.1007/s00280-020-04110-3.
44. Kasi P.M., Grothey A. Chemotherapy-induced neutropenia as a prognostic and predictive marker of outcomes in solid-tumor patients. Drugs. 2018;78:737-45. https://doi.org/10.1007/s40265-018-0909-3.
45. Zhang Y., Guoqiang L., Sun M., Lu X. Targeting and exploitation of tumor-associated neutrophils to enhance immunotherapy and drug delivery for cancer treatment. Cancer Biol Med. 2020;17(1):32—43. https://doi.org/10.20892/j.issn.2095-3941.2019.0372.
46. Schwarzenbach H., Hoon D.S., Pantel K. Cell-free nucleic acids as biomarkers in cancer patients. Nat Rev Cancer. 2011;11(6):426—37. https://doi.org/10.1038/nrc3066.
47. Lee Y.J., Yoon K.-A., Han J.-Y. et al. Circulating cell-free DNA in plasma of never smokers with advanced lung adenocarcinoma receiving gefitinib or standard chemotherapy as first-line therapy circulating DNA in prognosis of advanced NSCLC. Clin Cancer Res. 2011;17(15):5179—87. https://doi.org/10.1158/1078-0432.CCR-11-0400.
48. Слуханчук Е.В., Бицадзе В.О., Солопова А.Г. и др. Маркеры внеклеточных ловушек нейтрофилов у женщин со злокачественными новообразованиями репродуктивной системы, получавших хирургическое лечение и адъювантную терапию. Акушерство, Гинекология и Репродукция. 2023;17(4):420-32. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.432.
49. Demers M., Wagner D.D.. Neutrophil extracellular traps: A new link to cancer-associated thrombosis and potential implications for tumor progression. Oncoimmunology. 2013;2(2):e22946. https://doi.org/10.4161/onci.22946.
50. Holdenrieder S., Stieber P., von Pawel J. et al. Circulating nucleosomes predict the response to chemotherapy in patients with advanced non-small cell lung cancer. Clin Cancer Res. 2004;10(18 Pt 1):5981—7. https://doi.org/10.1158/1078-0432.CCR-04-0625.
51. Fuchs T.A., Kremer Hovinga J.A., Schatzberg D. et al. Circulating DNA and myeloperoxidase indicate disease activity in patients with thrombotic microangiopathies. Blood. 2012;120(6):1157-64. https://doi.org/10.1182/blood-2012-02-412197.
52. Elmoamly S., Mattar M., Yacoub M.F., Afif A. Can biomarkers of coagulation, platelet activation, and inflammation predict venous thromboembolism in patients with haematological malignancies? Acta Haematol. 2019;141(4):245-53. https://doi.org/10.1159/000496914.
53. Marconi S., Croce M., Chiorino G. et al. A circulating risk score, based on combined expression of exo-miR-130a-3p and fibrinopeptide a, as predictive biomarker of relapse in resectable non-small cell lung cancer patients. Cancers. 2022;14(14):3412. https://doi.org/10.3390/cancers14143412.
54. Edwards R.L., Klaus M., Matthews E. et al. Heparin abolishes the chemotherapy-induced increase in plasma fibrinopeptide A levels. Am J Med. 1990;89(1):25-8. https://doi.org/10.1016/0002-9343(90)90093-s.
55. Zurborn K.H., Gram J., Glander K. et al. Influence of cytostatic treatment on the coagulation system and fibrinolysis in patients with non-Hodgkin's lymphomas and acute leukemias. Eur J Haematol. 1991;47(1):55-9.
56. Stahli B.E., Camici G.G., Steffel J. et al. Paclitaxel enhances thrombin-induced endothelial tissue factor expression via c-Jun terminal NH2 kinase activation. Circ Res. 2006;99(2):149-55. https://doi.org/10.1161/01.RES.0000233379.92010.fd.
57. Adamson I.Y., Bowden D.H. The pathogenesis of bleomycin-induced pulmonary fibrosis in mice. Am J Pathol. 1974;77(2):185-97.
58. Bertomeu M., Gallo S., Lauri D. et al. Chemotherapy enhances endothelial cell reactivity to platelets. Clin Exp Metastasis. 1990;8(6):511-8. https://doi.org/10.1007/BF00135874.
59. Sobierajska K., Ciszewski W.M., Sacewicz-Hofman I., Niewiarowska J. Endothelial cells in the tumor microenvironment. Adv Exp Med Biol. 2020;1234:71-86. https://doi.org/10.1007/978-3-030-37184-5_6.
60. Li C.-X., He Q., Wang Z.-Y. et al. Risk assessment of venous thromboembolism in head and neck cancer patients and its establishment of a prediction model. Head Neck. 2023;45(10):2515-24. https://doi.org/10.1002/hed.27475.
61. van der Schoot G.G.F., Ormel H.L., Westerink N.-D.L. et al. Physical exercise in patients with testicular cancer treated with bleomycin, etoposide and cisplatin chemotherapy: pulmonary and vascular endothelial function—an exploratory analysis. J Cancer Res Clin Oncol. 2023;149(19):17467-78. https://doi.org/10.1007/s00432-023-05469-5.
62. Hamza M.S., Mousa S.A. Cancer-associated thrombosis: risk factors, molecular mechanisms, future management. Clin Appl Thromb Hemost. 2020;26:1076029620954282. https://doi.org/10.1177/1076029620954282.
63. Aklilu A.M., Shirali A.C. Chemotherapy-associated thrombotic microangiopathy. Kidney360. 2023;4(3):409-22. https://doi.org/10.34067/KID.0000000000000061.
64. Prandoni P., Campello E., editors. Venous thromboembolism in cancer patients undergoing chemotherapy: risk factors and prevention. Semin Thromb Hemost. 2021;47(8):914-9. https://doi.org/10.1055/s-0040-1718927.
65. Yang V., Gouveia M.J., Santos J. et al. Breast cancer: insights in disease and influence of drug methotrexate. RSC Med Chem. 2020;11(6):646-64. https://doi.org/10.1039/d0md00051e.
66. Sulimai N.H., Brown J., Lominadze D. Fibrinogen, fibrinogen-like 1 and fibrinogen-like 2 proteins, and their effects. Biomedicines. 2022;10(7):1712. https://doi.org/10.3390/biomedicines10071712.
67. Fulcher J., Carrier M. Thromboembolism prophylaxis during L-asparaginase therapy in acute lymphoblastic leukemia-time to reconsider current approaches? Thromb Res. 2020;188:100-2. https://doi.org/10.1016/j.thromres.2020.02.015.
Об авторах
Е. В. СлуханчукРоссия
Слуханчук Екатерина Викторовна, к.м.н.
119991 Москва, ул. Трубецкая, д. 8, стр. 2
В. О. Бицадзе
Россия
Бицадзе Виктория Омаровна, д.м.н., проф., профессор РАН
119991 Москва, ул. Трубецкая, д. 8, стр. 2
Scopus Author ID: 6506003478. WoS ResearcherID: F-8409-2017
А. Г. Солопова
Россия
Солопова Антонина Григорьевна, д.м.н., проф.
119991 Москва, ул. Трубецкая, д. 8, стр. 2
Scopus Author ID: 6505479504. WoS ResearcherID: Q-1385-2015
Д. Х. Хизроева
Россия
Хизроева Джамиля Хизриевна, д.м.н., профессор
119991 Москва, ул. Трубецкая, д. 8, стр. 2
Scopus Author ID: 57194547147. WoS ResearcherID: F-8384-2017
К. Н. Григорьева
Россия
Григорьева Кристина Николаевна
119991 Москва, ул. Трубецкая, д. 8, стр. 2
Н. Р. Гашимова
Россия
Гашимова Нилуфар Рамиль кызы
119991 Москва, ул. Трубецкая, д. 8, стр. 2
Н. А. Макацария
Россия
Макацария Наталия Александровна, к.м.н.
119991 Москва, ул. Трубецкая, д. 8, стр. 2
WoS ResearcherID: F-8406-2017
Д. В. Блинов
Россия
Блинов Дмитрий Владиславович, к.м.н.
119991 Москва, ул. Трубецкая, д. 8, стр. 2
123056 Москва, 2-я Брестская ул., д. 5, с. 1—1а
141551 Московская область, деревня Голубое, Родниковая ул., стр. 6 к. 1
Scopus Author ID: 6701744871. WoS ResearcherID: E-8906-2017
В. Н. Галкин
Россия
Галкин Всеволод Николаевич, д.м.н., проф.
115446 Москва, Коломенский проезд, д. 4
А. Ю. Шатилина
Россия
Шатилина Анастасия Юрьевна
119991 Москва, ул. Трубецкая, д. 8, стр. 2
Е. М. Ляднова
Россия
Ляднова Елизавета Михайловна
119991 Москва, ул. Трубецкая, д. 8, стр. 2
Н. А. Шульга
Россия
Шульга Наталия Александровна
Москва 119234, Ленинские горы, д. 1
Л. Т. Тогузаева
Россия
Тогузаева Лейля Тахировна
117997 Москва, ул. Академика Опарина, д. 4
С. Моркос
Объединенные Арабские Эмираты
Моркос Саймон, д.м.н., проф.
Дубай, Хадаэк Мухаммед Бин Рашид, Эль-Барша
Ж.-К. Гри
Россия
Гри Жан-Кристоф, д.м.н., проф.
119991 Москва, ул. Трубецкая, д. 8, стр. 2
Франция, 34090 Монпелье, ул. Огюста Бруссоне, д. 163
Scopus Author ID: 7005114260. WoS ResearcherID: AAA-2923-2019
И. Элалами
Россия
Элалами Исмаил, д.м.н., проф.
119991 Москва, ул. Трубецкая, д. 8, стр. 2
Франция, 75006 Париж, Улица медицинского факультета, д. 12
Франция, 75020 Париж, Китайская улица, д. 4
Scopus Author ID: 7003652413. WoS ResearcherID: AAC-9695-2019
Г. Геротзиафас
Россия
Геротзиафас Григориос, д.м.н., проф.
119991 Москва, ул. Трубецкая, д. 8, стр. 2
Франция, 75006 Париж, Улица медицинского факультета, д. 12
Франция, 75020 Париж, Китайская улица, д. 4
А. Д. Макацария
Россия
Макацария Александр Давидович, д.м.н., проф., академик РАН
119991 Москва, ул. Трубецкая, д. 8, стр. 2
Scopus Author ID: 57222220144. WoS ResearcherID: M-5660-2016
Что уже известно об этой теме?
► Химиотерапия (ХТ) увеличивает риск тромбоза глубоких вен (ТГВ) в 6 раз и рецидивирующего ТГВ в 2 раза. Исследования последних лет доказали роль противоопухолевой ХТ в повышении тромботического риска у онкологических пациентов.
► Анализ патогенеза тромбоза на фоне ХТ затруднен в связи с применением различных комбинаций препаратов и схем лечения, а также невозможностью полноценно оценить исходное состояние гемостаза у пациента, в том числе наличие приобретенной и врожденной тромбофилии и других факторов.
► Несмотря на большое количество данных о том, что системная ХТ способствует развитию венозного и артериального тромбозов у онкологических пациентов, нет окончательного представления о патогенетических механизмах, лежащих в их основе.
Что нового дает статья?
► В данной статье проведен анализ механизмов протромбогенного действия основных, используемых в настоящее время препаратов для ХТ. Подробно изложены все варианты патогенетических путей реализации эффектов, что дает возможность моделировать варианты стратегий, противодействующих тромбозу.
Как это может повлиять на клиническую практику в обозримом будущем?
► Протромбогенное действие препаратов для ХТ диктует необходимость рассматривать вопрос об одновременном планировании противотромботической профилактики. Благодаря лучшему пониманию механизмов, которые управляют тромбозом, связанным с ХТ, возможна разработка оптимальных схем антикоагулянтной терапии, которые минимизируют тромботический риск и риск кровотечения.
► Налицо необходимость разработки и внедрения прогностической модели стратификации риска тромбоза у пациентов на ХТ с последующей оценкой необходимости профилактической антикоагуляции, а также проведение рандомизированных контролируемых испытаний профилактической антикоагуляции во время ХТ.
Рецензия
Для цитирования:
Слуханчук Е.В., Бицадзе В.О., Солопова А.Г., Хизроева Д.Х., Григорьева К.Н., Гашимова Н.Р., Макацария Н.А., Блинов Д.В., Галкин В.Н., Шатилина А.Ю., Ляднова Е.М., Шульга Н.А., Тогузаева Л.Т., Моркос С., Гри Ж., Элалами И., Геротзиафас Г., Макацария А.Д. Химиотерапия и нарушения гемостаза. Акушерство, Гинекология и Репродукция. 2024;18(6):835-846. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.579
For citation:
Slukhanchuk E.V., Bitsadze V.O., Solopova A.G., Khizroeva J.Kh., Grigoreva K.N., Gashimova N.R., Makatsariya N.A., Blinov D.V., Galkin V.N., Shatilina A.Yu., Lyadnova E.M., Shulga N.A., Toguzaeva L.T., Morkos S., Gris J., Elalamy I., Gerotziafas G., Makatsariya A.D. Chemotherapy and hemostasis disorders. Obstetrics, Gynecology and Reproduction. 2024;18(6):835-846. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.579

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































