Перейти к:
Взаимосвязь клинико-анамнестических данных и уровня внеклеточной фетальной ДНК, определенного в рамках неинвазивного пренатального скрининга с помощью полупроводникого секвенирования
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.546
Аннотация
Введение. В настоящее время технология неинвазивного пренатального скрининга (НИПС) широко используется для определения риска хромосомных аномалий плода. Точность НИПС зависит от процента внеклеточной фетальной ДНК (вкфДНК) относительно всей внеклеточной ДНК (вкДНК) в плазме крови беременной (плодной или фетальной фракции вкДНК, ФФ). Несмотря на многочисленные исследования, до сих пор нет единого мнения о факторах, влияющих на ФФ.
Цель: исследование связи ФФ с клинико-анамнестическими параметрами беременной, особенностями течения беременности и ее исходов с помощью разработанной НИПС-технологии.
Материалы и методы. Выполнено проспективное наблюдательное исследование. В работе использованы образцы плазмы от 5459 женщин с одноплодной беременностью сроком более 9 недель. НИПС проводили с использованием полупроводникого секвенирования с последующей биоинформатической обработкой данных, включая определение ФФ, согласно ранее разработанному оригинальному алгоритму.
Результаты. Медиана уровня вкфДНК составила 11,7 [9,47–14,01] %. Показано, что ФФ зависит от типа пробирки для сбора крови (p < 0,05). Установлено, что ФФ снижается с увеличением возраста и индекса массы тела беременной и увеличивается с увеличением срока беременности и биохимических показателей раннего пренатального скрининга (РПС) – ассоциированного с беременностью протеина-А плазмы (англ. pregnancy-associated plasma protein-A, РАРР-А) и свободной бета-субъединицы хорионического гонадотропина человека (β-ХГЧ) (p < 0,05). Показано, что ФФ у беременных с трисомией 18 ниже, чем в норме (p < 0,05). Выявлено повышение ФФ у беременных с врожденными пороками развития у плода по данным ультразвукового исследования (p < 0,05). Не обнаружено связи ФФ со способом наступления беременности, ультразвуковыми показателями РПС (толщиной воротникового пространства, копчико-теменным размером, ультразвуковыми маркерами хромосомных аномалий), нарушениями по половым хромосомам, трисомиями по хромосомам 13 и 21 у плода, а также с осложнениями беременности – преэклампсией, гестационным сахарным диабетом, преждевременными родами и задержкой развития плода (p > 0,05).
Заключение. Выявленные закономерности важно учитывать при назначении НИПС и интерпретации его результатов.
Ключевые слова
Для цитирования:
Вашукова Е.С., Тарасенко О.А., Мальцева А.Р., Попова А.К., Пачулия О.В., Беспалова О.Н., Глотов А.С. Взаимосвязь клинико-анамнестических данных и уровня внеклеточной фетальной ДНК, определенного в рамках неинвазивного пренатального скрининга с помощью полупроводникого секвенирования. Акушерство, Гинекология и Репродукция. 2024;18(6):820-834. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.546
For citation:
Vashukova E.S., Tarasenko O.A., Maltseva A.R., Popova A.K., Pachuliia O.V., Bespalova O.N., Glotov A.S. The relationship between clinical-anamnestic data and cell-free fetal DNA level assessed by semiconductor sequencing within non-invasive prenatal testing. Obstetrics, Gynecology and Reproduction. 2024;18(6):820-834. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.546
Введение / Introduction
В настоящее время для исключения риска хромосомных аномалий плода широко используется технология неинвазивного пренатального скрининга (НИПС) [1]. НИПС позволяет выявлять хромосомные патологии плода путем анализа внеклеточной ДНК (вкДНК), циркулирующей в плазме крови беременной. В кровотоке беременных, наряду с собственной вкДНК, также присутствует вкДНК плодного происхождения (или фетальная ДНК, вкфДНК), которая попадает туда преимущественно в результате апоптоза клеток трофобласта [2], что позволяет с высокой точностью определять риск хромосомных аномалий (ХА) у плода [1]. После родов вкфДНК быстро исчезает из плазмы крови беременной [3].
Для исследования молекул вкДНК, циркулирующих в крови беременных, может быть использован весь арсенал молекулярно-генетических методов. Однако самым оптимальным подходом является применение технологии высокопроизводительного секвенирования [4]. В процессе анализа молекулы ДНК беременной и плода невозможно физически разделить, в связи с этим ключевым показателем качества и точности НИПС становится процент вкфДНК относительно всей вкДНК беременной – плодная или фетальная фракция вкДНК (ФФ).
Внеклеточную фетальную ДНК можно обнаружить уже на 4-й недели беременности, ее доля постепенно растет с увеличением срока гестации. Необходимый для детекции уровень вкфДНК появляется к 6–7-й неделе беременности и достигает оптимальных значений на 9–10-й неделе, когда составляет 5–20 % от всей вкДНК в крови беременной [3]. Оптимальным для расчета риска ХА является уровень вкфДНК не менее 3,5–4,0 % при одноплодной беременности [1]. При более низком уровне ФФ точность расчета риска ХА может значительно снижаться, возможны ложные результаты [1].
К настоящему времени проведено большое количество исследований, направленных на поиск факторов, которые могут влиять на ФФ [5]. Однако имеющиеся в современной литературе данные неоднозначны. Уровень вкфДНК может зависеть от методов исследования вкДНК [5]. В случае высокопроизводительного секвенирования важными параметрами становятся технология секвенирования и методы биоинформатики [5].
В 2018 г. в ФГБНУ НИИ АГиР им. Д.О. Отта в сотрудничестве с российской компанией ООО «НИПТ» был разработан оригинальный вариант НИПС на основе технологии полупроводникового секвенирования [6]. На сегодняшний день с его помощью проанализировано более 5000 образцов [7], однако детального исследования ФФ пока не проводилось.
Цель: исследование связи ФФ с клинико-анамнестическими параметрами беременной, особенностями течения беременности и ее исходов с помощью разработанной НИПС-технологии.
Материалы и методы / Materials and Methods
Дизайн исследования / Study design
В период с декабря 2019 г. по май 2022 г. на базе ФГБНУ НИИ АГиР им. Д.О. Отта (Санкт-Петербург) выполнено проспективное наблюдательное исследование, включавшее 5459 женщин, которым был выполнен НИПС. Исследовали связи между ФФ и клинико-анамнестическими данными. Все женщины подписали добровольное информированное согласие на использование результатов НИПС в научно-исследовательских целях.
В ходе работы у обследованных беременных были собраны клинико-анамнестические данные, включая возраст, индекс массы тела (ИМТ), срок и способ наступления беременности, показатели раннего пренатального скрининга (РПС) – содержание ассоциированного с беременностью протеина-А плазмы (англ. pregnancy-associated plasma protein-A, РАРР-А) и свободной бета-субъединицы хорионического гонадотропина человека (β-ХГЧ), данные ультразвукового исследования (УЗИ), наличие врожденных пороков развития (ВПР) и ХА у плода (ребенка), а также развитие осложнений беременности. В случае высокого риска ХА у плода по результатам НИПС были собраны сведения о результатах инвазивной пренатальной диагностики или о результатах кариотипирования материала плода после завершения беременности. В исследовании учитывали также тип пробирки для сбора крови и время транспортировки образцов.
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения: одноплодная беременность; срок беременности более 9 недель; результат НИПС получен после первичного исследования; информированное согласие на участие в исследовании.
Критерии исключения: уровень ФФ менее 4,0 % после первичного исследования; сомнительный результат НИПС после первичного исследования, образцы не прошли контроль качества после первичного поступления в лабораторию; отказ от участия в исследовании.
Группы обследованных / Study groups
Для исследования зависимости ФФ от возраста были сформированы 5 групп. Больше всего женщин было в возрастной группе от 30 до 34 лет – 1611/5459 (29,5 %) и от 35 до 39 лет – 1736/5459 (31,8 %). Наименьшую группу составили женщины до 24 лет – 289/5459 (5,3 %). В группу от 25 до 29 лет вошли 846/5459 (15,5 %) женщин, в группу 40 лет и старше – 977/5459 (17,9 %) обследованных.
Для выявления связи между ФФ и ИМТ женщины были разделены на 5 групп: 235/5459 (4,3 %) беременных были отнесены к группе «ИМТ < 18,5 кг/м²», 3319/5459 (60,8 %) – к группе «ИМТ от 18,5 до 24,9 кг/м²», 1299/5459 (23,8 %) – к группе «ИМТ от 25,0 до 29,9 кг/м²», 442/5459 (8,1 %) – к группе «ИМТ от 30,0 до 34,9 кг/м²», 164/5459 (3,0%) – к группе «ИМТ > 35 кг/м²».
Также было проведено деление в зависимости от способа наступления беременности. У большинства женщин – у 5026/5459 (92,1 %) беременность наступила естественным путем. У 433/5459 (7,9 %) женщин беременность наступила в результате экстракорпорального оплодотворения (ЭКО): в 346/5459 (6,3 %) случаях была использована яйцеклетка пациентки и в 87/5459 (1,6 %) случаях – донорская яйцеклетка.
В зависимости от срока беременности женщины были распределены по 4 группам. При вступлении в исследование большинство беременных были на сроке от 12 до 16 недель – 3232/5459 (59,2 %). На сроке до 12 недель тест сдали 737/5459 (13,5 %) женщин, от 16 до 20 недель – 993/5459 (18,2 %) женщин, на сроке 20 и более недель – 496/5459 (9,1 %) пациенток.
Для оценки связи ФФ с показателями РПС была сформирована подгруппа из 1618 женщин, которые сдали кровь для НИПС на сроке беременности от 11 до 14 недель и предоставили результаты РПС.
Согласно результатам НИПС, у 5231/5459 (95,8 %) пациенток был низкий риск ХА плода; 228/5459 (4,2 %) женщин имели высокий риск – 187/228 (82,0 %) случаев частых ХА и 41/228 (18,0 %) случай редких ХА. В 198 случаях с высоким риском ХА у плода были получены результаты цитогенетического исследования материала плода. Был обнаружен один ложноотрицательный результат. Для частых ХА выявлено 10 случаев ложноположительных результатов НИПС. Цитогенетические исследования для редких ХА были выполнены только для 11 женщин, а результаты НИПС подтвердились в 6 случаях, что недостаточно для сравнительного анализа ФФ. Образцы с ложными результатами НИПС и с высоким риском редких хромосомных патологий были исключены из дальнейшего анализа. Таким образом, были сформированы группы с трисомией по хромосоме 21 (n = 131), трисомией по хромосоме 18 (n = 17), трисомией по хромосоме 13 (n = 14), патологиями по половым хромосомам (n = 15) и группа с низким риском по результатам НИПС (группа сравнения; n = 5230).
Для оценки связи ФФ с ВПР у плода была сформирована группа из 616 женщин с низким риском НИПС, сдавших кровь во II триместре. У плодов 58 беременных из этой группы были обнаружены ВПР согласно результатам УЗИ. Среди последних были врожденные пороки сердца (33/58; 56,9 %), передней брюшной стенки (7/58; 12,1 %), мочевыделительной системы (6/58; 10,3 %), конечностей (4/58; 6,9 %) желудочного-кишечного тракта (4/58; 6,9 %), лица (3/58; 5,2 %) и легких (1/58; 1,7 %). Группу сравнения составили 558 женщин, которым был выполнен НИПС в связи с их обеспокоенностью состоянием плода. У всех этих женщин был низкий риск ХА по результатам РПС, отсутствовали УЗ-маркеры ХА и ВПР у плода в I и II триместрах.
Для анализа влияния осложнений беременности на ФФ среди женщин с низким риском по результатам НИПС случайным образом были отобраны 635 женщин, у которых собирали информацию о течении беременности и сопутствующих осложнениях. У 45 из них эту информацию получить не удалось, поэтому они были исключены из исследования.
Методы исследования / Study methods
Перед проведением НИПС все женщины проходили УЗИ для подтверждения прогрессирования беременности. Для НИПС использовали плазму крови. Кровь собирали в пробирки с этилендиаминтетрауксусной кислотой (ЭДТА) при возможности хранения не более 4 ч, либо в пробирки с консервантом – пробирки Streck (Streck Cell-Free DNA Blood Collection Tube; Streck, США) или в пробирки GBM (GradBioMed stabilization cell-free DNA, GBM scf-DNA; ООО ГрадБиоМед, Россия) в случае длительного хранения. У 1292/5459 (23,7 %) женщин кровь была собрана в пробирки с ЭДТА, у 2056/5459 (37,6 %) – в пробирки Streck, а у 2111/5459 (38,7 %) – в пробирки GBM.
Получение плазмы крови, выделение вкДНК и полногеномное секвенирование на приборе Ion GeneStudio S5 (Thermo Fisher Scientific Inc., США) проводили как описано ранее [6][7]. Биоинформатическую обработку данных, включая определение ФФ, осуществляли по ранее разработанному оригинальному алгоритму [6].
Статистический анализ / Statistical analysis
Для статистической обработки данных использовали программы GraphPad Prism version 20.109 (GraphPad Software, США) и Jamovi version 2.2.5 (The Jamovi project, Австралия). Для качественных признаков расчитывали их долю (%). Значимость различий между группами по качественным признакам оценивали с помощью двустороннего точного критерия Фишера. Проверку количественных признаков на нормальность проводили при помощи критерия Шапиро–Уилка. Все переменные имели распределение, отличное от нормального, поэтому для них определяли медиану (Me), нижний квартиль (Q1) и верхний квартиль (Q3). Корреляционный анализ проводили с использованием критерия (r) Спирмена. Для множественных сравнений по количественным переменным использовали непараметрический критерий Краскела–Уоллиса и тест Данна для попарного сравнения. Для всех тестов статистически значимыми считали различия при р < 0,05.
Результаты / Results
Характеристика 5459 беременных, включенных в исследование, представлена в таблице 1.
Таблица 1. Характеристика беременных, проходивших неинвазивный пренатальный скрининг.
Table 1. Pregnant women characteristics before non-invasive prenatal screening.
|
Параметр / Parameter |
Me [ Q1–Q3] |
|
Возраст, лет Age, years |
34,0 [ 30,00–38,00] |
|
Срок беременности, недель гестации Gestational age, weeks |
14,0 [ 13,00–16,00] |
|
Индекс массы тела, кг/м² Body mass index, kg/m² |
23,2 [ 20,97–26,40] |
|
Фетальная фракция внеклеточной ДНК, % Cell-free DNA fetal fraction, % |
11,7 [ 9,47–14,01] |
Медиана срока беременности на момент взятия крови составила 14 (от 9/10 до 35/36) недель, медиана возраста – 34 [15–49] года. ИМТ беременных варьировал от 15,70 до 51,42 кг/м² (Ме = 23,2 кг/м²). Уровень вкфДНК находился в диапазоне от 4,04 до 39,13 % (Ме = 11,7 %). Для детального анализа ФФ рассмотрены следующие факторы.
Тип пробирки для сбора крови и время транспортировки / Blood collection tube type and transportation time
Медиана ФФ для пробирок с ЭДТА составила 11,9 [ 9,73–14,32] %, для пробирок GBM – 12,0 [ 9,79–14,36] %, статистически значимых различий не обнаружено (p = 0,8784). В тоже время медиана ФФ для пробирок Streck составила 11,1 [ 9,01–13,50] % и оказалась ниже, чем для пробирок с ЭДТА (p < 0,0001) и GBM (p < 0,0001) (рис. 1).
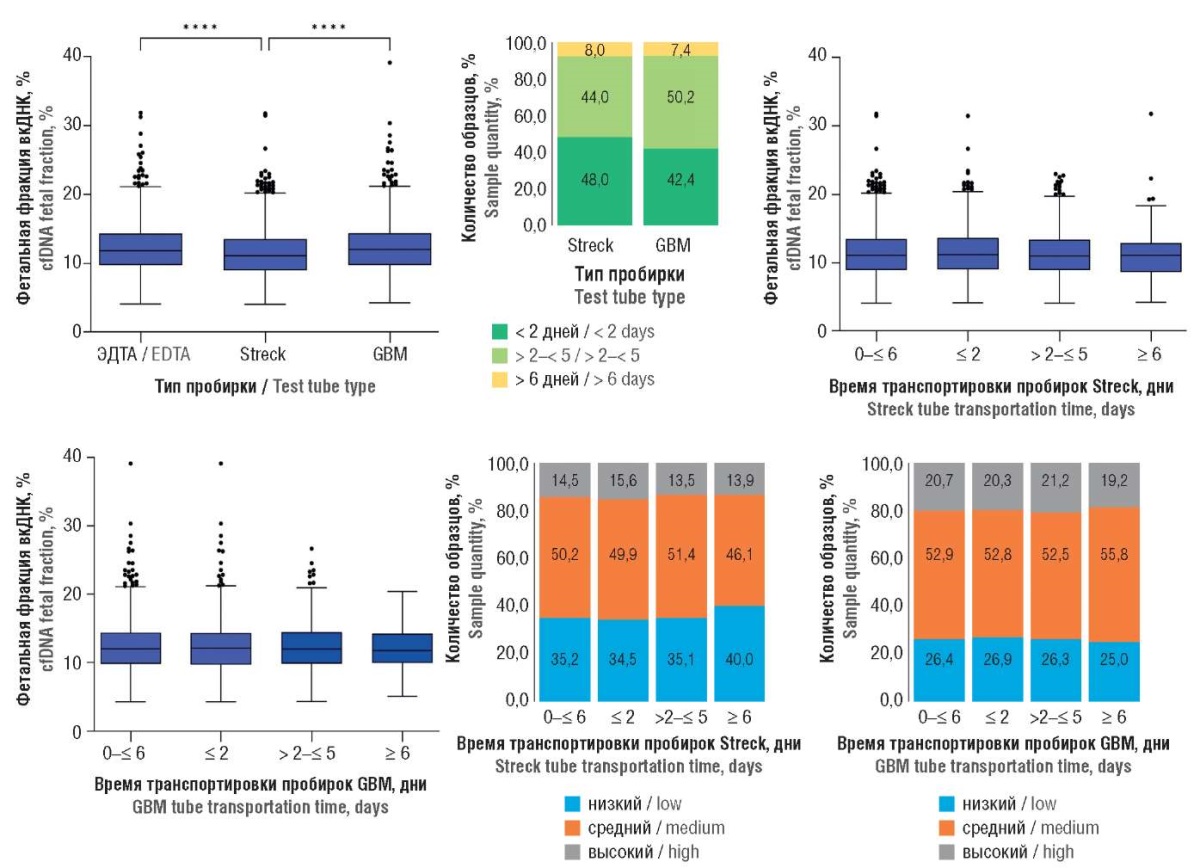
Рисунок 1. Фетальная фракция внеклеточной ДНК (вкДНК) в плазме крови беременных в зависимости от типа пробирки для сбора крови и времени транспортировки пробирок, количество образцов в зависимости от времени транспортировки, а также количество образцов с низким (< 10,0 %), средним (≥ 10,0 % < 15,0 %) и высоким (≥ 15,0 %) содержанием фетальной вкДНК для каждого периода времени транспортировки.
Примечание: ****p < 0,0001 – значимость различий при сравнении групп; ЭДТА – пробирки с этилендиаминтетрауксусной кислотой; Streck – пробирки Streck; GBM – пробирки GradBioMed.
Figure 1. Plasma cell-free DNA (cfDNA) fetal fraction in pregnant women depending on blood collection tube type, transportation time for each tube type, number of samples according to transportation time, and number of samples with low (< 10.0%), medium (≥ 10.0 < 15.0 %) and high (≥ 15.0 %) cffDNA level for each time period.
Note: ****p < 0.0001 – inter-group significant differences; EDTA – ethylenediaminetetraacetic acid-containing tubes; Streck – Streck tubes; GBM – GradBioMed tubes.
Образцы, собранные в пробирки Streck и GBM, были получены из разных регионов России и доставлялись в лабораторию в течение 1–14 дней, что позволило провести анализ связи ФФ со временем транспортировки. Для обоих типов пробирок не было обнаружено различий в медианных значениях ФФ в зависимости от времени транспортировки (p > 0,05). Однако для пробирок Streck отмечена тенденция к увеличению числа случаев с более низким содержанием вкфДНК со временем, для пробирок GBM такой зависимости не наблюдалось (p > 0,05) (рис. 1).
В результате анализа образцов с нерезультативным НИПС после первичного исследования установлено, что наименьшее количество случаев было для пробирок с ЭДТА (10/1292; 0,77 %), наибольшее количество – для пробирок Streck (55/2056; 2,68 %) (p = 0,0002). В пробирки GBM было собрано 36/2111 (1,7 %) образцов (p = 0,0355 и p = 0,0467 vs. пробирок ЭДТА и Streck, соответственно).
Возраст беременных / Pregnant woman age
При оценке ФФ наблюдалось постепенное снижение этого показателя с увеличением возраста беременной (сила связи коэффициента корреляции очень слабая: –0,049; p = 0,0003). Статистически значимые различия выявлены между группами от 25 до 29 лет и более 40 лет. Медиана ФФ в группе старше 40 лет (11,3 [ 9,23–13,72] %) была ниже, чем в группе от 25 до 29 лет: 12,00 [ 9,66–14,59] % (p = 0,0035) (рис. 2).
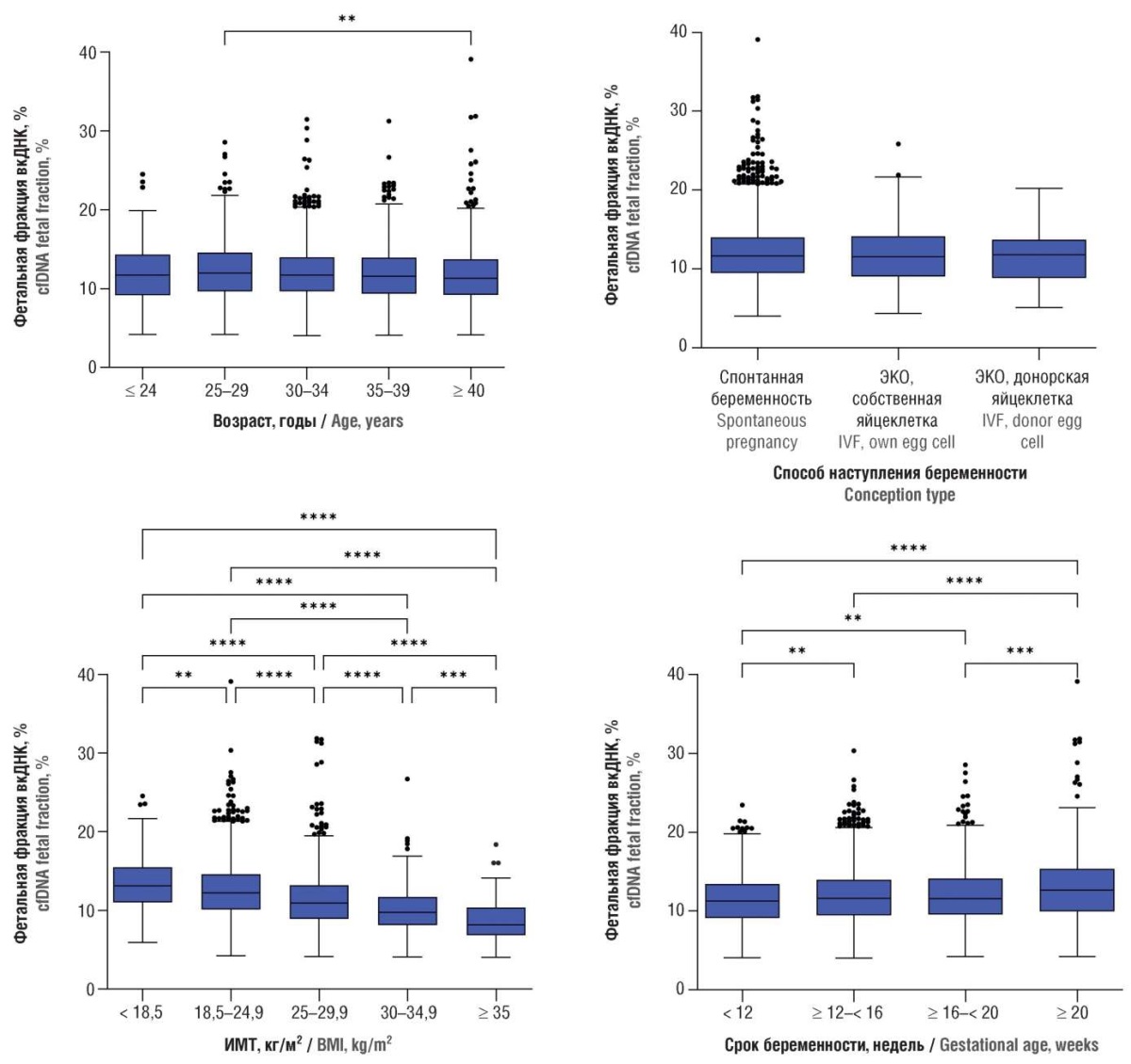
Рисунок 2. Фетальная фракция внеклеточной ДНК (вкДНК) в плазме крови беременных в зависимости от возраста, индекса массы тела (ИМТ) беременной, способа наступления и срока беременности.
Примечание: **p < 0,01, ***p < 0,001, ****p < 0,0001 – значимость различий при сравнении групп; ЭКО – экстракорпоральное оплодотворение.
Figure 2. Plasma cell-free DNA (cfDNA) fetal fraction in pregnant women depending on age, body mass index (BMI), conception type and gestational age.
Note: **p < 0.01, ***p < 0.001, ****p < 0.0001 – inter-group significant differences; IVF – in vitro fertilization.
Индекс массы тела беременных / Body mass index in pregnant women
По мере увеличения ИМТ наблюдалось постепенное снижение ФФ от 13,1 [ 11,02–15,49] % в группе женщин с ИМТ < 18,5 кг/м² до 8,2 [ 6,87–10,37] % в группе женщин с ИМТ > 35 кг/м². Статистически значимые различия (p < 0,005) были обнаружены при попарном сравнении всех групп (рис. 2). Корреляционный анализ показал умеренную отрицательную связь между ФФ и ИМТ (коэффициент корреляции (r) = –0,301; p < 0,0001).
Способ наступления беременности / Conception method
Установлено, что группы женщин, у которых беременность наступила естественным путем, в результате использования ЭКО с собственной или донорской яйцеклеткой, сопоставимы (p > 0,05) по содержанию вкфДНК (рис. 2).
Срок беременности / Gestational age
При оценке ФФ обнаружено, что наименьшие значения были у женщин со сроком беременности до 12 недель – 11,2 [ 9,12–13,43] %, а наибольшие – со сроком беременности 20 и более недель – 12,7 [ 9,96–15,35] % (p < 0,0001). Также установлено, что ФФ ниже в группе со сроком беременности до 12 недель по сравнению с группами ≥ 12 < 16 недель (11,6 [9,46–13,97] %; p = 0,0031) и ≥ 16 < 20 недель (11,6 [ 9,57–14,12] %; p = 0,0045), в то время как ФФ в группе 20 и более недель была выше, чем в группах ≥ 12 < 16 недель (p< 0,0001) и ≥ 16 < 20 недель (p = 0,0002). В целом, наблюдалась общая тенденция к увеличению ФФ с увеличением срока беременности (сила связи коэффициента корреляции очень слабая: 0,081; p < 0,0001) (рис. 2).
Показатели раннего пренатального скрининга / Early рrenatal screening parameters
Количественные показатели РПС приведены в таблице 2.
Таблица 2. Показатели раннего пренатального скрининга и фетальная фракция (n = 1618).
Table 2. Parameters of first trimester screening (n = 1618).
|
Параметр / Parameter |
Me [ Q1–Q3] |
|
Ассоциированный с беременностью протеин-А плазмы, МоМ / Pregnancy-associated plasma protein-A, МоМ |
0,6 [ 0,40–1,00] |
|
Свободная бета-субъединица хорионического гонадотропина человека, МоМ / Free beta-subunit of human chorionic gonadotropin, MoM |
1,5 [ 0,90–2,50] |
|
Толщина воротникового пространства, мм / Nuchal translucency thickness, mm |
1,70 [ 1,50–2,00] |
|
Копчико-теменной размер, мм / Coccygeal-parietal size, mm |
60,4 [ 54,70–66,85] |
|
Фетальная фракция, % / Fetal fraction, % |
11,5 [ 9,31–13,84] |
Примечание: МоМ – значение, кратное медиане, показатель того, насколько индивидуальный результат теста отклоняется от медианы.
Note: МоМ – multiple of median, an indicator of how individual test result deviates from the median.
Согласно результатам РПС, 502/1618 (31,0%) женщины имели высокий риск ХА у плода (≥ 1:100), у 825/1618 (51,0 %) женщин был отмечен промежуточный риск (1:101–1:1000), и у 291/1618 (18,0 %) пациентки риск анеуплоидии был ниже, чем в популяции (≤ 1:1000). В 343/1618 (21,2 %) случаях при проведении РПС были выявлены УЗ-маркеры ХА у плода.
При анализе ФФ установлено, что наименьшие значения были у женщин с высоким риском ХА согласно результатам РПС – 11,2 [ 9,13–13,55] %, а наибольшие – у пациенток с низким риском ХА у плода по результатам РПС – 12,3 [ 10,10–14,48] % (p = 0,0001). В подгруппе с риском 1:101–1:1000 по результатам РПС были промежуточные значения ФФ – 11,7 [ 9,44–13,97] %, различия статистически значимы (p = 0,0385) по сравнению с группой с высоким риском ХА у плода по результатам РПС (рис. 3).
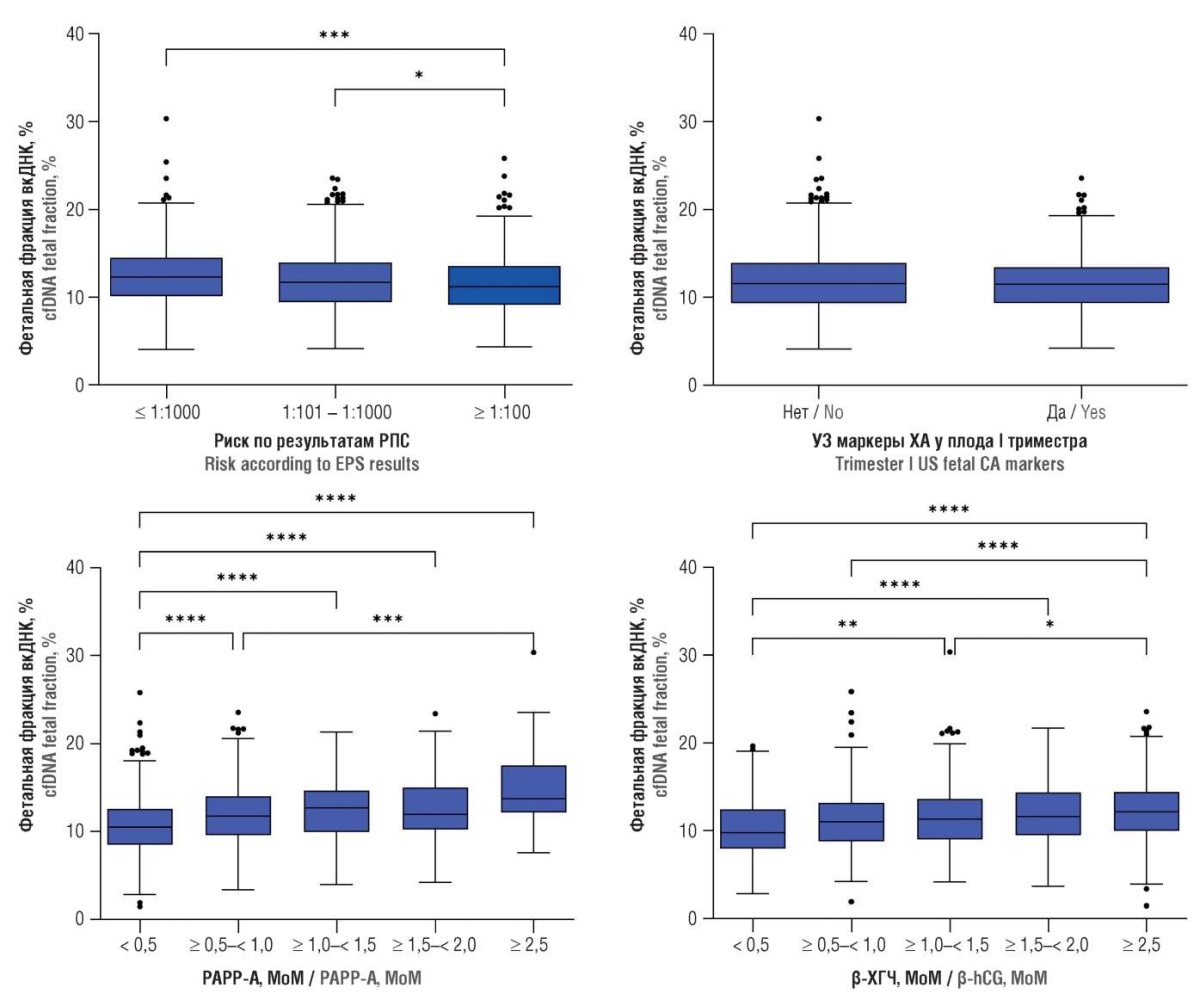
Рисунок 3. Фетальная фракция внеклеточной ДНК (вкДНК) в плазме крови беременных в зависимости от результатов раннего пренатального скрининга (РПС), значений ассоциированного с беременностью протеина-А плазмы (PAPP-A) и cвободной бета-субъединицы хорионического гонадотропина человека (β-ХГЧ), а также от наличия ультразвуковых (УЗ) маркеров хромосомных аномалий (ХА) у плода.
Примечание: *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001 – значимость различий при сравнении групп; МоМ – значение, кратное медиане, показатель того, насколько индивидуальный результат теста отклоняется от медианы.
Figure 3. Plasma cell-free DNA (cfDNA) fetal fraction in pregnant women depending on early prenatal screening (EPS) results, pregnancy-associated plasma protein-A (PAPP-A) and free beta-subunit of human chorionic gonadotropin (β-hCG) level as well as ultrasound (US) fetal chromosomal abnormality (CA) markers.
Note: *p < 0.05, **р < 0.01, *** p < 0.001, ****p < 0.0001 – inter-group significant differences; МоМ – multiple of median, an indicator of how individual test result deviates from the median.
В зависимости от показателей РАРР-А и β-ХГЧ были сформированы 6 подгрупп женщин, у которых значения этих показателей были менее 0,5 МоМ (англ. multiple of median), от 0,5 до 2,5 МоМ с шагом 0,5 МоМ и с более 2,5 МоМ. Установлено, что ФФ постепенно возрастает по мере увеличения обоих показателей. На рисунке 3 отмечены пары подгрупп, для которых получены статистически значимые различия. Корреляционный анализ показал слабую положительную связь ФФ с увеличением значений для РАРР-А и β-ХГЧ (r = 0,239 и 0,176; p < 0,0001 для обоих). Однако анализ данных УЗИ не выявил связи между ФФ и толщиной воротникового пространства (ТВП) (r = 0,017; p = 0,4810) или копчико-теменным размером (КТР) (r = 0,072; p = 0,1250), и разницы в содержании вкфДНК в зависимости от наличия УЗ-маркеров обнаружено не было(p > 0,05) (рис. 3).
Хромосомные аномалии у плода / Fetal chromosomal abnormalities
Анализ ФФ показал, что группы с низким риском ХА, с трисомией 21 и аномалиями по половым хромосомам не отличались между собой (p > 0,05), в то время как медиана ФФ в группе с трисомией 18 составила 8,0 [ 7,42–12,02] % и была ниже, чем в группе сравнения – 11,7 [ 9,47–14,01] % (p = 0,0260) и в группе с трисомией 21 – 11,7 [ 9,53–14,14] % (p = 0,0393). Также наблюдалась тенденция к снижению ФФ в группе с трисомией 13 (9,58 [ 6,70–11,82] %), однако различия с другими группами не были значимыми (p > 0,05) (рис. 4).
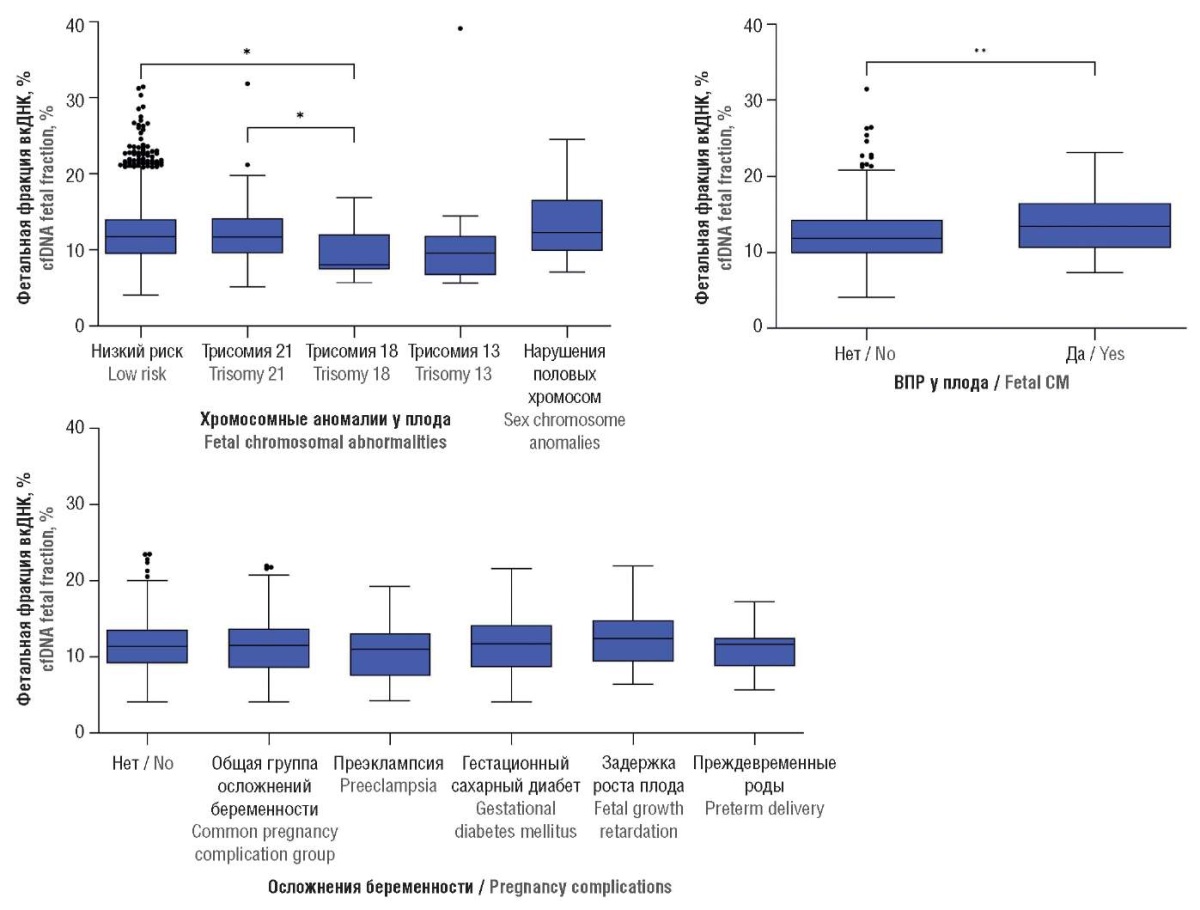
Рисунок 4. Фетальная фракция внеклеточной ДНК (вкДНК) в плазме крови беременных в зависимости от наличия хромосомных аномалий (ХА) и врожденных пороков развития (ВПР) у плода, а также осложнений беременности у женщины.
Примечание: *p < 0,05, **p < 0,01 – значимость различий между группами.
Figure 4. Plasma cell-free DNA (cfDNA) fetal fraction in pregnant women depending on fetal chromosomal abnormalities (CA) and congenital malformations (CM) as well as maternal pregnancy complications.
Note: *p < 0.05, **p < 0.01 – inter-group significant differences.
Врожденные пороки развития у плода / Fetal congenital malformations
Анализ показал, что ФФ у беременных с ВПР плода (13,4 [ 10,63–16,51] %) выше (p = 0,0081) по сравнению с женщинами, обеспокоенными состоянием плода (11,9 [ 9,91–14,32] %) (рис. 4).
Осложнения беременности / Pregnancy complications
У 590 женщин были собраны сведения об исходах беременности после завершения беременности родами, а также было получено фенотипическое подтверждение отсутствия ХА у их новорожденных. Согласно собранным данным, беременность протекала без осложнений у 388/590 (65,8 %) женщин, у 202/590 (34,2 %) женщин были диагностированы различные осложнения беременности, включая преэклампсию (59/590; 10,0 %), гестационный сахарный диабет (83/590; 14,1 %), задержку развития плода (35/590; 5,9 %), преждевременные роды (25/590; 4,2 %).
Сравнительный анализ показал, что общая группа с осложнениями беременности, подгруппы с преэклампсией, гестационным сахарным диабетом, задержкой развития плода и преждевременными родами, а также группа сравнения не различались (p = 0,2001) по уровню ФФ (рис. 4).
Обсуждение / Discussion
С момента обнаружения вкфДНК в крови беременных в 1997 г. накоплен большой материал, посвященный исследованию факторов, влияющих на ФФ [5]. Тем не менее существует необходимость дальнейших исследований этой проблемы. В данной работе представлены результаты исследования связи некоторых из факторов с содержанием вкфДНК при использовании технологии НИПС, разработанной в ФГБНУ НИИ АГиР им. Д.О. Отта.
В настоящее время факторы, влияющие на содержание вкфДНК, условно делят на экспериментальные, материнские и фетоплацентарные [5].
Среди экспериментальных факторов особое место занимает тип пробирки для сбора крови. Один из наиболее оптимальных и экономически выгодных вариантов для НИПС – использование пробирок с ЭДТА. Такие пробирки обеспечивают защиту вкДНК от контаминации геномной ДНК только в течение первых 6 ч хранения. Для длительного хранения образцов используются пробирки со специальным консервантом, предотвращающим разрушение клеток крови [8]. Согласно данным литературы, наиболее часто используемыми пробирками такого типа для НИПС являются пробирки Streck от американской компании Streck (США). Имеются исследования, посвященные сравнению ФФ в пробирках ЭДТА и Streck. В одних исследованиях не обнаружено различий в содержании вкфДНК [9][10]; в других же показано, что образцы в пробирках Streck имеют более высокие значения ФФ по сравнению с пробирками, содержащими только ЭДТА [11]. Нами, напротив, показано, что содержание вкфДНК в пробирках Streck ниже, чем в пробирках ЭДТА. Также отмечена тенденция к увеличению количества образцов с более низким содержанием вкфДНК со временем транспортировки пробирок Streck. Вероятно, длительная транспортировка (хранение) приводит к разрушению лейкоцитов крови, высвобождению дополнительной порции фрагментов вкДНК самой беременной, и, как следствие, к снижению ФФ.
Отечественным аналогом зарубежных пробирок с консервантом являются пробирки GBM ООО «ГрадБиоМед», Россия. В нашей работе впервые представлены данные об использовании этих пробирок для НИПС. Значения ФФ для пробирок GBM не отличались от таковых для пробирок ЭДТА и были выше, чем для пробирок Streck. Также в отличие от Streck, для GBM не наблюдалась зависимость ФФ от времени транспортировки, и было меньшее случаев, когда НИПС не дал результатов после первичного исследования. В целом, полученные результаты указывают на высокую стабильность пробирок GBM, что позволяет рекомендовать их к использованию для НИПС.
Наиболее исследованными из материнских факторов являются возраст, ИМТ беременной и способ наступления беременности [5]. В нашей работе выявлена отрицательная корреляция между ФФ и возрастом беременной, что совпадает с результатами других исследований [12–15]. В научной литературе есть предположения, что снижение ФФ с возрастом беременной может быть связано с повышенным риском осложнений беременности у более возрастных женщин. Например, при таких состояниях, как гестационная гипертензия или преэклампсия может увеличиваться количество вкДНК самой беременной, что приводит к снижению ФФ [15]. Тем не менее другие ученые не обнаружили связи между ФФ и возрастом женщины [16][17]. Это несоответствие указывает на необходимость дальнейших исследований для выяснения механизмов, лежащих в основе данной связи.
Как правило, исследователи, сообщают, что уровень вкфДНК снижается с увеличением ИМТ женщины [14][18–20]; мы также выявили эту закономерность. Многие авторы сходятся во мнении, что это связано с большим объемом циркулирующей крови беременной и одновременно с увеличенным содержанием вкДНК самой беременной из-за избыточного распада адипоцитов [21]. В нашем предыдущем исследовании 66,7 % образцов с низкой ФФ (менее 4,0 %) принадлежали женщинам с ИМТ более 30 кг/м² [7]. Эти данные подтверждают выводы других исследователей, что высокий ИМТ может быть причиной неудачного НИПС и должен учитываться при назначении теста [1].
В ряде работ утверждается, что уровень ФФ может зависеть от способа наступления беременности [20][22][23]. T.J. Lee с соавт. показали, что уровень ФФ снижен при беременности, наступившей в результате ЭКО, независимо от того, использовалась собственная или донорская яйцеклетка. Причины этого снижения ФФ могут быть связаны с недостаточной плацентацией из-за худшей HLA-совместимости между беременной и плодом при использовании донорской яйцеклетки, меньшей массой плаценты, более выраженной дисфункции эндотелия и наличием бесплодия [22]. Однако другие исследования не выявили различий в уровне вкфДНК между спонтанной беременностью и беременностью, наступившей после ЭКО [24][25]. Мы также не обнаружили различий в уровне ФФ в зависимости от способа наступления беременности. Таким образом, вопрос о влиянии способа зачатия на уровень вкфДНК остается открытым для дальнейших исследований.
Сегодня существуют разные точки зрения относительно связи ФФ с фетоплацентарными факторами. Имеются данные о положительной корреляции доли вкфДНК со сроком беременности [13][19][26]. Согласно результатам нашей работы, имеется тенденция к увеличению ФФ с увеличением срока беременности. При этом наименьшие значения ФФ характерны для женщин со сроком беременности до 12 недель, а наибольшие – для обследуемых со сроком беременности 20 недель и более. Вместе с тем различия между группами ≥ 12 < 16 недель и ≥ 16 < 20 незначительны. Похожие результаты были получены и в других работах, согласно которым во II триместре снижается скорость роста ФФ [27][28]. Например, в работе S.L. Kinnings с соавт. показано, что с 10-й по 12,5-й недели беременности ФФ увеличивается на 0,440 % в неделю, в то время как между 12,5-й и 20-й неделями беременности она увеличивается только на 0,083 %, а начиная с 20-й недели, доля плода растет со скоростью 0,821 % [27]. Снижение скорости роста ФФ во II триместре, вероятно, происходит за счет увеличения массы тела беременной [28]. Однако есть работы, в которых не найдена связь ФФ со сроком беременности [14].
В нашей работе выявлена положительная корреляция между ФФ и уровнями биохимических показателей РПС – PAPP-A и β-ХГЧ, что совпадает с наблюдениями других авторов [12][14][29][30]. РАРР-А и β-ХГЧ являются белками плацентарного происхождения, попадающими в кровоток беременной [31]. Уровень этих белков и содержание вкфДНК зависят от общих факторов, таких как количество клеток трофобласта [24] и площадь контакта крови беременной с плацентой [31], что, вероятно, объясняет их связь. Показано, что высокое содержание РАРР-А и β-ХГЧ ассоциировано с большей массой плаценты [32].
В единичных работах предпринимались попытки сравнительного анализа ФФ в зависимости от результатов РПС, но не было выявлено различий между группами высокого, промежуточного и низкого риска ХА у плода [16][17]. По нашим данным, имеет место повышение ФФ в ряду низкий–промежуточный–высокий риск хромосомных патологий по результатам РПС. Однако мы не обнаружили ассоциации ФФ с ТВП, КТР и УЗ-маркерами I триместра, поэтому можно предположить, что связь ФФ с риском РПС обусловлена корреляцией с PAPP-A и β-ХГЧ, которую важно учитывать при проведении НИПС, так как невысокие уровни биохимических показателей могут служить маркерами низкой ФФ и отсутствия результата теста.
В научной литературе обсуждается возможность использования уровня вкфДНК в качестве маркера ХА у плода [5]. Большинство авторов сообщают о снижении уровня вкфДНК при трисомиях 13 и 18 [33][34], в то время как связь с трисомией 21 остается неоднозначной [33][35–37]. Согласно нашим данным, уровень вкфДНК не зависит от трисомии 21 и значимо снижается в случае трисомии 18. Также мы обнаружили тенденцию к снижению ФФ при трисомии 13. Низкие уровни ФФ, возможно, вызваны уменьшением массы плаценты, что характерно для трисомий 13 и 18 [35][38][39]. С другой стороны, беременность с трисомией 21 сопровождается более высокой массой плаценты [5], что, вероятно, объясняет отсутствие связи с ФФ. Описанные закономерности могут быть одной из причин более высокой точности НИПС при выявлении трисомии 21 по сравнению с трисомиями 18 и 13.
Только в 3 публикациях в рамках НИПС обсуждается ассоциация между ФФ и ВПР у плода. В одном исследовании показано, что у женщин с низкой ФФ частота ВПР у плода выше, чем в популяции [40]. Однако 2 других исследования не обнаружили связи между ВПР у плода и уровнем вкфДНК [41] или их частотой при низкой ФФ [42]. По нашим данным, беременные с ВПР у плода имеют более высокие значения ФФ, чем женщины, обеспокоенные состоянием плода. Причины изменения ФФ в случае ВПР у плода пока неизвестны. Однако повышение уровня вкфДНК происходит за 2 недели до появления клинических признаков плацентарной недостаточности [43], которая является одним из факторов риска развития ВПР у плода [44].
В последние годы предпринимались многочисленные попытки использовать ФФ в качестве предиктора патологических состояний при беременности. В ряде публикаций сообщается, что изменения уровня ФФ в случае гестационных осложнений незначительны [45], в то время как в других исследованиях выявлены существенные изменения (повышение или снижение) ФФ при преэклампсии, гестационном сахарном диабете, преждевременных родах и задержке роста плода [14][45]. В нашем исследовании не обнаружено связи между уровнем вкфДНК и развитием этих осложнений беременности. Отсутствие ассоциаций, скорее всего, связано с «пилотным» характером нашего исследования. Согласно данным литературы, в случае осложнений беременности уровень ФФ может меняться в определенные сроки беременности и зависеть от клинической формы патологий [45]. Вероятно, в будущем после увеличения выборок имеет смысл провести исследование ФФ с учетом срока беременности и клинических форм патологий.
Ограничения исследования / Study limitations
Результаты настоящей работы во многом совпадают с данными литературы, однако проведенное исследование имеет ряд ограничений. Не были учтены такие факторы, как прием лекарств, этническая принадлежность, количество плодов, фоновые заболевания женщин и другие, которые по данным литературы ассоциированы с ФФ. Из-за малого размера выборок не были проанализированы редкие ХА у плода, клинические формы осложнений беременности, тип ВПР у плода, не был проведен многофакторный анализ. Также для некоторых показателей сравниваемые выборки существенно отличались по размеру. Эти ограничения обуславливают необходимость дальнейших исследований для накопления знаний о факторах, влияющих на ФФ, что будет способствовать выяснению процессов высвобождения вкфДНК и усовершенствованию методов пренатального ДНК-скрининга.
Заключение / Conclusion
Внеклеточная ДНК, циркулирующая в крови беременных, является предметом активных исследований. Несмотря на обширные исследования, факторы, влияющие на содержание вкфДНК, изучены недостаточно. Вместе с тем снижение ФФ может привести к снижению чувствительности и специфичности НИПС. Используя технологию полупроводникового секвенирования, мы показали, что ФФ зависит от типа пробирки для сбора крови. Кроме того, выявили связь ФФ с возрастом и ИМТ беременной, а также со сроком беременности. Установили ассоциацию ФФ с биохимическими показателями РПС и трисомией по хромосоме 18 у плода. Продемонстрировали, что уровень вкфДНК выше в плазме крови женщин, у плодов которых есть ВПР по данным УЗИ. Показали, что содержание вкДНК не зависит от способа наступления беременности, ТВП и КТР плода, наличия у плода УЗ-маркеров ХА первого триместра, трисомий по хромосомам 13 и 21, аномалий по половым хромосомам, а также не связано с развитием наиболее распространенных осложнений беременности. Стоит отметить, что каждый из выявленных факторов вносит небольшой вклад в изменение ФФ, тем не менее обнаруженные закономерности могут быть важны при назначении НИПС и интерпретации его результатов.
Список литературы
1. Сухих Г.Т., Трофимов Д.Ю., Барков И.Ю. и др. Методические рекомендации «Проведение неинвазивного пренатального ДНК-скрининга анеуплоидий плода по крови матери (НИПС) методом высокопроизводительного секвенирования». Акушерство и гинекология. 2024;3(Приложение):4–24. https://doi.org/10.18565/aig.2024.51.
2. Faas B.H., De Ligt J., Janssen I. et al. Non-invasive prenatal diagnosis of fetal aneuploidies using massively parallel sequencing by ligation and evidence that cell-free fetal DNA in the maternal plasma originates from cytotrophoblastic cells. Expert Opin Biol Ther. 2012;12 Suppl 1:S19–26. https://doi.org/10.1517/14712598.2012.670632.
3. Lo Y.M., Zhang J., Leung T.N. et al. Rapid clearance of fetal DNA from maternal plasma. Am J Hum Genet. 1999;64(1):218–24. https://doi.org/10.1086/302205.
4. Rather R.A., Saha S.C. Reappraisal of evolving methods in non-invasive prenatal screening: Discovery, biology and clinical utility. Heliyon. 2023;9(3):e13923. https://doi.org/10.1016/j.heliyon.2023.e13923.
5. Deng C., Liu S. Factors Affecting the fetal fraction in noninvasive prenatal screening: a review. Front Pediatr. 2022;10:812781. https://doi.org/10.3389/fped.2022.812781.
6. Козюлина П.Ю., Вашукова Е.С., Глотов А.С. и др. Способ неинвазивного пренатального скрининга анеуплоидий плода. Патент РФ RU 2712175 C1. 24.01.2020. Бюл. № 3. 16 с. Режим доступа: https://patents.s3.yandex.net/RU2712175C1_20200124.pdf. [Дата обращения: 20.05.2024].
7. Тарасенко О.А., Вашукова Е.С., Козюлина П.Ю. и др. Опыт применения высокопроизводительного секвенирования (NGS) для проведения неинвазивного пренатального скрининга анеуплоидий плода на базе ФГБНУ «НИИ АГиР им. Д.О. Отта». Акушерство и гинекология. 2022;(10):37–49. https://doi.org/10.18565/aig.2022.10.37-49.
8. Кондрацкая В.А., Покровская М.С., Долудин Ю.В. и др. Влияние преаналитических переменных на качество внеклеточной ДНК. Биобанкирование материала для выделения внеклеточной ДНК. Кардиоваскулярная терапия и профилактика. 2021;20(8):3114. https://doi.org/10.15829/1728-8800-2021-3114.
9. Hidestrand M., Stokowski R., Song K.et al. Influence of temperature during transportation on cell-free DNA analysis. Fetal Diagn Ther. 2012;31(2):122–8. https://doi.org/10.1159/000335020.
10. Medina Diaz I., Nocon A., Mehnert D.H. Performance of streck cfDNA blood collection tubes for liquid biopsy testing. PLoS One. 2016;11(11):e0166354. https://doi.org/10.1371/journal.pone.0166354.
11. Sillence K.A., Roberts L.A., Hollands H.J. et al. Fetal sex and RHD genotyping with digital PCR demonstrates greater sensitivity than realtime PCR. Clin Chem. 2015;61(11):1399–407. https://doi.org/10.1373/clinchem.2015.239137.
12. Revello R., Sarno L., Ispas A. et al. Screening for trisomies by cell-free DNA testing of maternal blood: consequences of a failed result. Ultrasound Obstet Gynecol. 2016;47(6):698–704. https://doi.org/10.1002/uog.15851.
13. Hou Y., Yang J., Qi Y.et al. Factors affecting cell-free DNA fetal fraction: statistical analysis of 13,661 maternal plasmas for non-invasive prenatal screening. Hum Genomics. 2019;13(1):62. https://doi.org/10.1186/s40246-019-0244-0.
14. Кудрявцева Е.В., Ковалев В.В., Дектярев А.А. Фетальная фракция freeDNA: клинико-диагностические параллели. Уральский медицинский журнал. 2021;20(1):30–5. https://doi.org/10.52420/2071-5943-2021-20-1-30-35.
15. Deng C., Liu J., Liu S. et al. Maternal and fetal factors influencing fetal fraction: A retrospective analysis of 153,306 pregnant women undergoing noninvasive prenatal screening. Front Pediatr. 2023;11:1066178. https://doi.org/10.3389/fped.2023.1066178.
16. Brar H., Wang E., Struble C. et al. The fetal fraction of cell-free DNA in maternal plasma is not affected by a priori risk of fetal trisomy. J Matern Fetal Neonatal Med. 2013;26(2):143–5. https://doi.org/10.3109/14767058.2012.722731.
17. Hudecova I., Sahota D., Heung M.M. et al. Maternal plasma fetal DNA fractions in pregnancies with low and high risks for fetal chromosomal aneuploidies. PLoS One. 2014;9(2):e88484. https://doi.org/10.1371/journal.pone.0088484.
18. Qiao L., Zhang Q., Liang Y.et al. Sequencing of short cfDNA fragments in NIPT improves fetal fraction with higher maternal BMI and early gestational age. Am J Transl Res. 2019;11(7):4450–9.
19. Guo F.-F., Yang J.-X., Huang Y.-L. et al. Association between fetal fraction at the second trimester and subsequent spontaneous preterm birth. Prenat Diagn. 2019;39(13):1191–7. https://doi.org/10.1002/pd.5566.
20. Talbot A.L., Ambye L., Hartwig T.S. et al. Fetal fraction of cell-free DNA in pregnancies after fresh or frozen embryo transfer following assisted reproductive technologies. Hum Reprod. 2020;35(6):1267–75. https://doi.org/10.1093/humrep/deaa110.
21. Haghiac M., Vora N.L., Basu S. et al. Increased death of adipose cells, a path to release cell-free DNA into systemic circulation of obese women. Obesity (Silver Spring). 2012;20(11):2213–9. https://doi.org/10.1038/oby.2012.138.
22. Lee T.J., Rolnik D.L., Menezes M.A. et al. Cell-free fetal DNA testing in singleton IVF conceptions. Hum Reprod. 2018;33(4):572–8. https://doi.org/10.1093/humrep/dey033.
23. Quezada M.S., Francisco C., Dumitrascu-Biris D. et al. Fetal fraction of cell-free DNA in maternal plasma in the prediction of spontaneous preterm delivery. Ultrasound Obstet Gynecol. 2015;45(1):101–5. https://doi.org/10.1002/uog.14666.
24. Poon L.C., Musci T., Song K. et al. Maternal plasma cell-free fetal and maternal DNA at 11-13 weeks' gestation: relation to fetal and maternal characteristics and pregnancy outcomes. Fetal Diagn Ther. 2013;33(4):215–23. https://doi.org/10.1159/000346806.
25. Lambert-Messerlian G., Kloza E.M., Williams J. et al. Maternal plasma DNA testing for aneuploidy in pregnancies achieved by assisted reproductive technologies. Genet Med. 2014;16(5):419–22. https://doi.org/10.1038/gim.2013.149.
26. Qiao L., Yu B., Liang Y. et al. Sequencing shorter cfDNA fragments improves the fetal DNA fraction in noninvasive prenatal testing. Am J Obstet Gynecol. 2019;221(4):345.e1–345.e11. https://doi.org/10.1016/j.ajog.2019.05.023.
27. Kinnings S.L., Geis J.A., Almasri E. et al. Factors affecting levels of circulating cell-free fetal DNA in maternal plasma and their implications for noninvasive prenatal testing. Prenat Diagn. 2015;35(8):816–22. https://doi.org/10.1002/pd.4625.
28. Song Y., Zhou X., Huang S. et al. Quantitation of fetal DNA fraction in maternal plasma using circulating single molecule amplification and re-sequencing technology (cSMART). Clin Chim Acta. 2016;456:151–6. https://doi.org/10.1016/j.cca.2016.03.005.
29. Scott F.P., Menezes M., Palma-Dias R. et al. Factors affecting cell-free DNA fetal fraction and the consequences for test accuracy. J Matern Fetal Neonatal Med. 2018;31(14):1865–72. https://doi.org/10.1080/14767058.2017.1330881.
30. Miltoft C.B., Rode L., Ekelund C.K. et al. Contingent first-trimester screening for aneuploidies with cell-free DNA in a Danish clinical setting. Ultrasound Obstet Gynecol. 2018;51(4):470–9. https://doi.org/10.1002/uog.17562.
31. Manokhina I., Singh T.K., Robinson W.P. Cell-free placental DNA in maternal plasma in relation to placental health and function. Fetal Diagn Ther. 2017;41(4):258–64. https://doi.org/10.1159/000448707.
32. Metzenbauer M., Hafner E., Hoefinger D. et al. Three-dimensional ultrasound measurement of the placental volume in early pregnancy: method and correlation with biochemical placenta parameters. Placenta. 2001;22(6):602–5. https://doi.org/10.1053/plac.2001.0684.
33. Palomaki G.E., Kloza E.M., Lambert-Messerlian G.M. et al. Circulating cell free DNA testing: are some test failures informative? Prenat Diagn. 2015;35(3):289–93. https://doi.org/10.1097/01.ogx.0000470818.76451.
34. Suzumori N., Ebara T., Yamada T. et al. Fetal cell-free DNA fraction in maternal plasma is affected by fetal trisomy. J Hum Genet. 2016;61(7):647–52. https://doi.org/10.1038/jhg.2016.25.
35. Rava R.P., Srinivasan A., Sehnert A.J. et al. Circulating fetal cell-free DNA fractions differ in autosomal aneuploidies and monosomy X. Clin Chem. 2014;60:243–50. https://doi.org/10.1373/clinchem.2013.207951.
36. Krishna I., Badell M., Loucks T.L. et al. Adverse perinatal outcomes are more frequent in pregnancies with a low fetal fraction result on noninvasive prenatal testing. Prenat Diagn. 2016;36(3):210–5. https://doi.org/10.1002/pd.4779.
37. Кудрявцева Е.В., Ковалев В.В., Канивец И.В. и др. Free-DNA плода: опыт популяционного скрининга хромосомной патологии в России. Вопросы гинекологии, акушерства и перинатологии. 2019;18(3):46–51. https://doi.org/10.20953/1726-1678-2019-3-46-51.
38. Arizawa M., Nakayama M. Pathological analysis of the placenta in trisomies 21, 18 and 13. Nihon SankaFujinka Gakkai Zasshi. 1992;44(1):9–13. [In Japanese].
39. Chen C.P. Placental abnormalities and preeclampsia in trisomy 13 pregnancies. Taiwan J Obstet Gynecol. 2009;48(1):3–8. https://doi.org/10.1016/S1028-4559(09)60028-0.
40. Becking E.C., Wirjosoekarto S.A.M., Scheffer P.G. et al. Low fetal fraction in cell-free DNA testing is associated with adverse pregnancy outcome: Analysis of a subcohort of the TRIDENT-2 study. Prenat Diagn. 2021;41(10):1296–304. https://doi.org/10.1002/pd.6034.
41. Becking E.C., Scheffer P.G., Henrichs J. et al. Fetal fraction of cell-free DNA in noninvasive prenatal testing and adverse pregnancy outcomes: a nationwide retrospective cohort study of 56,110 pregnant women. Am J Obstet Gynecol. 2023;S0002-9378(23)02128-2. https://doi.org/10.1016/j.ajog.2023.12.008.
42. Bardi F., Bet B.B., Pajkrt E. et al. Additional value of advanced ultrasonography in pregnancies with two inconclusive cell-free DNA draws. Prenat Diagn. 2022;42(11):1358–67. https://doi.org/10.1002/pd.6238.
43. Парсаданян Н.Г., Шубина Е.С., Тетруашвили Н.К. и др. Уровень свободной эмбриональной ДНК у пациентки с привычным выкидышем и тяжелой плацентарной недостаточностью. Акушерство и гинекология. 2015;(4):90–4.
44. Reus A.D., Stephenson M.D., van Dunné F.M. et al. Chorionic villous vascularization related to phenotype and genotype in first trimester miscarriages in a recurrent pregnancy loss cohort. Hum Reprod. 2013;28(4):916–23. https://doi.org/10.1093/humrep/det025.
45. Грачева М.И., Кан Н.Е., Красный А.М. Роль внеклеточной фетальной ДНК в ранней диагностике осложнений беременности. Акушерство и гинекология. 2016;(10):5–10. https://doi.org/10.18565/aig.2016.10.5-10.
Об авторах
Е. С. ВашуковаРоссия
Вашукова Елена Сергеевна, к.б.н.
199034 Санкт-Петербург, Менделеевская линия, д. 3
О. А. Тарасенко
Россия
Тарасенко Ольга Александровна, к.б.н.
199034 Санкт-Петербург, Менделеевская линия, д. 3
А. Р. Мальцева
Россия
Мальцева Анастасия Романовна
199034 Санкт-Петербург, Менделеевская линия, д. 3
А. К. Попова
Россия
Попова Анастасия Константиновна
199034 Санкт-Петербург, Менделеевская линия, д. 3
О. В. Пачулия
Россия
Пачулия Ольга Владимировна, к.м.н.
199034 Санкт-Петербург, Менделеевская линия, д. 3
О. Н. Беспалова
Россия
Беспалова Олеся Николаевна, д.м.н.
199034 Санкт-Петербург, Менделеевская линия, д. 3
А. С. Глотов
Россия
Глотов Андрей Сергеевич, д.б.н.
199034 Санкт-Петербург, Менделеевская линия, д. 3
Что уже известно об этой теме?
► Неинвазивный пренатальный скрининг (НИПС) хромосомных аномалий у плода является одним из самых информативных и безопасных методов пренатальной диагностики. Ключевым показателем качества и точности НИПС служит уровень внеклеточной фетальной ДНК (вкфДНК).
► В настоящее время основной тенденцией является поиск клинических, анамнестических, и биохимических факторов, которые могут влиять на уровень вкфДНК, с целью повышения диагностической эффективности теста НИПС.
► Наиболее эффективным методом выполнения НИПС является применение различных технологий высокопроизводительного секвенирования.
Что нового дает статья?
► При использовании технологии полупроводникового секвенирования уровень вкфДНК зависит от типа пробирки для сбора крови, возраста и индекса массы беременной, срока беременности, биохимических показателей раннего пренатального скрининга, наличия трисомии 18 у плода.
► Уровень вкфДНК повышается у беременных с врожденными пороками развития у плода по данным ультразвукового исследования.
► Такие факторы, как способ наступления беременности, ультразвуковые показатели раннего пренатального скрининга, нарушения по половым хромосомам, трисомиями по хромосомам 13 и 21 у плода, распространенные осложнения беременности не влияют на уровень вкфДНК.
Как это может повлиять на клиническую практику в обозримом будущем?
► Полученные результаты расширят знания о процессах высвобождения вкфДНК в плазму крови беременных, помогут врачам в интерпретации результатов НИПС и будут способствовать усовершенствованию методов НИПС.
Рецензия
Для цитирования:
Вашукова Е.С., Тарасенко О.А., Мальцева А.Р., Попова А.К., Пачулия О.В., Беспалова О.Н., Глотов А.С. Взаимосвязь клинико-анамнестических данных и уровня внеклеточной фетальной ДНК, определенного в рамках неинвазивного пренатального скрининга с помощью полупроводникого секвенирования. Акушерство, Гинекология и Репродукция. 2024;18(6):820-834. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.546
For citation:
Vashukova E.S., Tarasenko O.A., Maltseva A.R., Popova A.K., Pachuliia O.V., Bespalova O.N., Glotov A.S. The relationship between clinical-anamnestic data and cell-free fetal DNA level assessed by semiconductor sequencing within non-invasive prenatal testing. Obstetrics, Gynecology and Reproduction. 2024;18(6):820-834. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.546

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































