Перейти к:
Состояние материнского кишечного микробиома и его влияние на развитие синдрома идиопатической поздней задержки роста плода
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.547
Аннотация
Цель: изучить состав микробиома прямой кишки беременных и оценить его возможное влияние на развитие синдрома идиопатической поздней задержки роста плода (ЗРП).
Материалы и методы. Проведен анализ течения беременности и родов 80 беременных. Основную группу составили 40 беременных с ЗРП, контрольную группу – 40 здоровых беременных. Анализ микробиоты кишечника у 53 беременных (25 беременных с поздней ЗРП и 28 здоровых беременных) проведен с использованием секвенирования азотистых оснований в генах 16S рибосомальной РНК (рРНК).
Результаты. Анализ микробиомного состава кишечника беременных в исследуемых группах выявил значительные различия, имеющие клиническое значение. В частности, увеличение пропорции Clostridiales Ruminococcaceae Oscillospira на 1,0 % коррелировало с приростом массы тела новорожденных на 331,7 г; повышение уровня Coriobacteriales Coriobacteriaceae Collinsella на 1,0 % ассоциировалось со снижением массы тела новорожденных на 476,2 г. Отношение Firmicutes к Bacteroides составило 2,0 в основной группе и 3,6 в контрольной группе (р = 0,02), что может свидетельствовать о микробиологическом дисбиозе с возможными патофизиологическими последствиями. Установлена значимая связь между повышенным уровнем лейкоцитов (при отсутствии других проявлений воспалительных процессов) и вероятностью развития синдрома ЗРП. При лейкоцитозе ≥ 11,05×109/л риск ЗРП прогнозируется с чувствительностью 60,6 % и специфичностью 79,2 %.Также скорость оседания эритроцитов ≥ 41,5 мм/час ассоциировалась с повышенным риском ЗРП, демонстрируя чувствительность 85,7 % и специфичность 70,6 %.
Заключение. Дисбиоз кишечника, вероятно, играет роль в формировании поздней идиопатической ЗРП. Уменьшение соотношения Firmicutes/Bacteroides, а также преобладание Actinobacteria отрицательно коррелируют с массой плода при рождении.
Ключевые слова
Для цитирования:
Железова М.Е., Бектур Б.К., Мальцева Л.И., Шарипова Р.И., Шакирзянова Д.Б. Состояние материнского кишечного микробиома и его влияние на развитие синдрома идиопатической поздней задержки роста плода. Акушерство, Гинекология и Репродукция. 2024;18(6):788-799. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.547
For citation:
Zhelezova M.E., Bektur B.К., Maltseva L.I., Sharipova R.I., Shakirzyanova D.B. Maternal gut microbiome and its impact on developing idiopathic late fetal growth retardation. Obstetrics, Gynecology and Reproduction. 2024;18(6):788-799. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.547
Введение / Introduction
Задержка роста плода (ЗРП) представляет собой сложную проблему, которая играет центральную роль в перинатологии. Это состояние не только связано с повышением уровня перинатальной смертности, но и значительно увеличивает частоту неонатальных осложнений. Эпидемиологические исследования демонстрируют, что частота случаев ЗРП варьирует от 5 до 10 % при отягощении акушерского и гинекологического анамнеза, а при осложненном течении беременности встречается в 10–25 % случаев [1]. Согласно американской статистике, ЗРП является второй по значимости причиной младенческой смертности [2]. Статистические данные делают проблему актуальной для дальнейшего изучения. Также важно отметить, что патофизиологические механизмы ЗРП ведут к большому количеству перинатальных осложнений, включая такие серьезные состояния, как внутрижелудочковое кровоизлияние [3], транзиторная гипогликемия [4], некротизирующий энтероколит [5], а также респираторный дистресс-синдром [6] и др. Новорожденные, у которых была диагностирована ЗРП, сталкиваются с существенно повышенным риском развития различных сердечно-сосудистых и метаболических заболеваний в зрелом возрасте. Среди таких заболеваний выделяются артериальная гипертензия, ожирение и сахарный диабет 2-го типа [7]. Более того, мужчины, родившиеся с ЗРП, могут быть более подвержены мигренозным головным болям и головным болям напряжения [8].
Задержка роста плода остается одной из малоизученных патологий в акушерстве, и вопросы патогенеза, профилактики и лечения поздней ЗРП до сих пор остаются открытыми. Изучение поздней идиопатической ЗРП является важным аспектом современной перинатальной медицины, поскольку позволяет лучше понять ее причины, последствия и разработать эффективные стратегии диагностики, профилактики и лечения. Роль микробиома матери в развитии акушерских осложнений все еще изучается и становится совершенно очевидной. Влияние микробиоты матери на патогенез акушерских осложнений продолжает активно исследоваться и приобретает все более очевидное значение. Современные научные данные выявили значимые различия между микробиотами беременных с нормальной массой плода и тех, у кого диагностирована ЗРП [9][10]. Этот новаторский подход к изучению предполагаемых патофизиологических механизмов формирования поздней ЗРП открывает новые горизонты в данной области. Ряд акушерских осложнений, включая преэклампсию [11], гестационный диабет [12], преждевременные роды и угрозу невынашивания беременности [13], уже ассоциированы с изменениями в составе микробиоты матери. Особый интерес в развитии материнских и перинатальных осложнений вызывает изучение кишечного микробиома и его изменений во время беременности. Известно, что микробиом кишечника человека содержит 500–1500 микроорганизмов, включая бактерии, грибы, вирусы и археи и 3 млн генотипов. Соотношение микробных клеток к клеткам человека составляет 10:1, а соотношение генотипов – 100:1 [14]. Несмотря на то что сегодня достигнут существенный прогресс в понимании того, как кишечная микробиота влияет на функции хозяина после рождения и в дальнейшем, мало что известно о том, как ключевые игроки материнской кишечной микробиоты могут влиять на фетоплацентарный рост.
Цель: изучить состав микробиома прямой кишки беременных и оценить его возможное влияние на развитие синдрома идиопатической поздней ЗРП.
Материалы и методы / Materials and Methods
Дизайн исследования / Study design
На базе акушерского отделения университетской клиники ФГАОУ ВО К(П)ФУ (МСЧ К(П)ФУ) проведено исследование, охватывающее период с декабря 2018 г. по июнь 2022 г. В рамках исследования было проанализировано течение беременности и родов у 80 пациенток, из которых 40 женщин вошли в основную группу, а 40 – в контрольную.
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения в основную группу: беременные с поздней ЗРП (диагноз основывался на клинических рекомендациях [1]); доношенный срок беременности; письменное информированное согласие на участие в исследовании.
Критерии включения в контрольную группу: здоровые беременные; письменное информированное согласие на участие в исследовании.
Критерии исключения: возраст менее 18 лет; ранняя и поздняя преэклампсия; многоплодная беременность; преждевременные роды; пороки развития плода; отказ участвовать в исследовании.
Методы исследования / Study methods
На этапе дородовой госпитализации на сроках от 37 до 41,6 недели беременности в отделении патологии беременных проводили всесторонний анализ течения беременности, основанный на данных материнского паспорта и анамнеза. Выполняли расчет индекса массы тела (ИМТ), а также осуществляли отбор проб венозной крови натощак для проведения общего анализа крови с определением лейкоцитарной формулы и скорости оседания эритроцитов (СОЭ). Дополнительно исследовали содержание С-реактивного белка (СРБ). Ультразвуковое исследование плода (УЗИ), включая фетометрию и доплерометрию, проводили на аппарате Samsung Medison HM 70 (Samsung Electronics, Южная Корея).
Все пациентки предоставляли фекальные образцы после 37-й недели беременности. Биологический материал собирался в стерильные пробирки, замораживался и транспортировался в лабораторию (не позднее 40–60 минут от момента сбора) для дальнейшего анализа. Образцы оставались замороженными до выделения ДНК. Анализ кишечной микробиоты проводили методом секвенирования генов 16S рибосомальной РНК (рРНК) у 53 беременных: 25 женщин с ЗРП (основная группа) и 28 беременных без поздней ЗРП (контрольная группа). Материал ДНК выделяли при помощи Fast DNA SPIN. Далее ДНК была амплифицирована с помощью полимеразной цепной реакции для области V3–V4 и дополнительно секвенирована в режиме парного считывания 300 п.н. на платформе MiSeq (Illumina, США). Полученные считывания обрабатывали и анализировали с использованием методов операционных таксономических единиц (ОТЕ) на программном обеспечении QIIME версии 1.9. После удаления данных низкого качества и химерных последовательностей оставшиеся высококачественные данные были сгруппированы в ОТЕ с 97-процентным порогом сходства и подвергнуты таксономической аннотации с помощью последней версии базы данных Greengenes v.13.8. (https://greengenes.lbl.gov/Download/).
Методы статистического анализа / Statistic alanalysis
Для статистической обработки данных использовали программное обеспечение IBM SPSS Statistics версии 27 для Windows (IBM, США). Оценку нормальности распределения проводили с использованием критерия Шапиро–Уилка. В случае нормального распределения рассчитывали средние арифметические значения (M) и стандартные отклонения (SD). Для сравнительного анализа использовали t-критерий Стьюдента для независимых выборок, а для данных, распределение которых отличалось от нормального, применяли U-критерий Манна–Уитни. Для непараметрических данных рассчитывали медианы (Me) и межквартильные интервалы [Q1; Q3] как меру разброса данных. Корреляционный анализ выполняли с использованием коэффициента корреляции Пирсона (rxy) для параметрических данных и коэффициента корреляции Спирмена для непараметрических данных. Также вычисляли 95 % доверительные интервалы (ДИ) и отношение шансов (англ. odds ratio, OR), применяли анализ рабочей характеристики приемника (англ. receiver operating characteristic, ROC), а также разрабатывали прогностическую модель с применением метода множественной линейной регрессии. Статистическую значимость оценивали при установленном уровне р ≤ 0,05.
Результаты / Results
Клинико-анамнестическая характеристика / Clinical and anamnestic characteristics
Сравниваемые группы были сопоставимы по ряду характеристик, включая социальный статус, возраст и семейное положение. Средний возраст беременных в основной группе составил 30,5 ± 6,0 лет (95 % ДИ = 24,5–36,5), в контрольной группе – 28,5 ± 4,9 года (95 % ДИ = 23,6–33,4), статистически значимых различий между группами не выявлено (р = 0,420).
При сравнении ИМТ до беременности получили следующие статистически значимые различия (р = 0,02): у женщин основной группы показатель составил 22,5 [ 19,5; 24,3], у женщин контрольной группы – 26,9 [ 24; 28]. Как известно, сниженный ИМТ у женщины является значимым предиктором риска формирования ЗРП [1]. При сравнении частоты ЗРП в зависимости от курения до беременности были получены незначимые различия (р = 0,251). Все обследованные беременные отрицали курение во время беременности. При анализе паритета родов было обнаружено, что поздняя ЗРП чаще встречалась у первородящих женщин (р = 0,019).
Анализ соматического статуса женщин в сравниваемых группах не выявил статистически значимых различий в общей частоте заболеваемости (р = 0,589). Однако при более детализированном рассмотрении структура патологий продемонстрировала определенные особенности. Пациентки основной группы почти вдвое чаще (43,7 % против 21,4 %; р = 0,001) страдали хроническими заболеваниями желудочно-кишечного тракта (ЖКТ), среди которых преобладал гастрит, характеризующийся частыми обострениями, происходящими не менее двух раз в год. Анализ показал, что наличие хронического гастрита заметно увеличивает риск развития ЗРП, повышая его более чем в 3 раза (OR = 3,1 ± 0,4; 95 % ДИ = 1,48–6,69).
Сравниваемые группы были сопоставимы по гинекологическому анамнезу – кольпит (р = 0,356), цервицит (р = 0,726), миома тела матки (р = 0,564), функциональные кисты яичников (р = 0,566), бесплодие I (р = 0,661) и акушерскому анамнезу – артифициальное прерывание беременности (р = 0,706), ранний выкидыш (р = 0,559), неразвивающаяся беременность (р = 0,307), преждевременные роды (р = 0,579).
Течение настоящей беременности / The course of the current pregnancy
Течение настоящей беременности у женщин сравниваемых групп демонстрировало определенные особенности. Хотя частота осложнений в I и III триместрах была сопоставимой, включая острые респираторные вирусные инфекции (15,0 % в основной и 12,5 % в контрольной группе; р = 0,536) и угрозу прерывания беременности (10,0 и 12,5 % соответственно; р = 0,541), анализ течения II триместра выявил статистически значимые различия.
Согласно данным материнского паспорта, значительное различие между группами наблюдалось по частоте инфекционно-воспалительных заболеваний урогенитального тракта. Например, санация неспецифического кольпита была проведена у 12 (30,0 %) пациенток основной группы, а цервицит был диагностирован и пролечен у 6 (15,0 %) женщин; в контрольной группе аналогичные воспалительные заболевания влагалища и шейки матки не выявлялись. Бессимптомная бактериурия была обнаружена у 30,0 % женщин основной группы и только у 10,0 % в контрольной (t = 4,2; р = 0,003). Анемия осложняла течение II триместра у 10 (25,0 %) женщин основной группы, в то время как в контрольной группе этот показатель составил всего 2 (5,0 %) случая (t = 2,5; р = 0,003). Примечательно, что воспалительные заболевания нижних отделов половых путей, а также манифестация инфекций мочевой системы чаще всего проявлялись на сроках 28–32 недели гестации. Вероятно, эти временные рамки являются критическими для развития нарушений трансплацентарного переноса кислорода и питательных веществ, что в конечном итоге может способствовать развитию поздней ЗРП. Исследования на животных демонстрируют, что воспаление у матери в середине беременности способствует снижению роста скелетных мышц и функций миобластов плода [15].
Одним из маркеров нарушения работы фетоплацентарного комплекса является развитие маловодия; в нашем исследовании маловодие было диагностировано только у 6 (15,0 %) беременных основной группы.
Анализ воспалительных маркеров / Analysis of inflammatory markers
В нашем предыдущем исследовании мы предположили, что одним из механизмов развития поздней идиопатической ЗРП является формирование провоспалительной среды в плацентарном комплексе, обусловленной преобладанием грамотрицательной флоры в таких локусах, как полость рта матери, желудок и собственно плацента [16].
Учитывая нашу гипотезу о влиянии воспалительных процессов на развитие идиопатической ЗРП, нами был проведен анализ ряда ключевых воспалительных маркеров. В качестве биомаркеров были изучены показатели общего анализа крови, включая количество лейкоцитов и СОЭ, а также уровень СРБ. Результаты показали, что в III триместре у беременных с ЗРП уровень лейкоцитов был повышен и составил (11,1 ± 2,4)×10⁹/л (95 % ДИ = (8,7–13,5)×10⁹) по сравнению с контрольной группой, где этот показатель равнялся (9,7 ± 2,2)×10⁹/л (95 % ДИ = (7,5–11,9)×10⁹). Площадь под ROC-кривой (рис. 1), которая соответствует взаимосвязи прогноза ЗРП с уровнем лейкоцитов крови беременных в III триместре, составила 0,743 ± 0,065 (95 % ДИ = 0,617–0,870). Высчитанная модель статистически значимая (р = 0,002). Значение лейкоцитов в точке cut-off равно 11,05×10⁹/л. При значении лейкоцитов, равном или превышающем данный уровень, прогнозировался риск поздней ЗРП с чувствительностью 60,6 % и специфичностью 79,2 %.
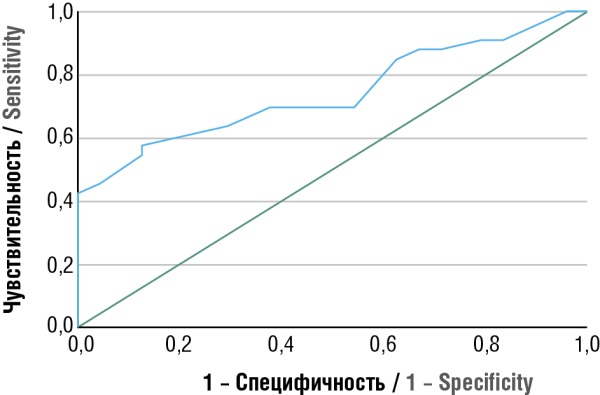
Рисунок 1. ROC-кривая, характеризующая взаимосвязь прогноза задержки роста плода от количества лейкоцитов крови в III триместре беременности.
Figure 1. ROC curve characterizing a relationship between the prognosis of fetal growth retardation and blood leukocyte count in the third trimester of pregnancy.
При анализе значений СОЭ в III триместре беременности получили следующие данные. У женщин основной группы показатель составил 44 [ 34,5; 45,5], у женщин контрольной группы – 26 [ 22,0; 41,5]. Площадь под ROC-кривой (рис. 2), которая соответствует взаимосвязи прогноза ЗРП с уровнем СОЭ беременных в III триместре, составила 0,897 ± 0,062 (95 % ДИ = 0,776–1,000). Данная модель была статистически значимой (р = 0,001). Значение СОЭ в точке cut-off было равно 41,5 мм/час. При уровне СОЭ, равном или превышающем данный уровень, прогнозировался риск ЗРП с чувствительностью 85,7 % и специфичностью 70,6 %.
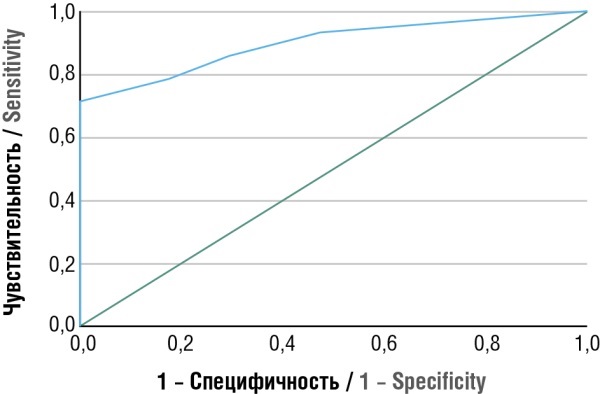
Рисунок 2. ROC-кривая, характеризующая взаимосвязь прогноза задержки роста плода от скорости оседания эритроцитов в III триместре беременности.
Figure 2. ROC curve characterizing a relationship between the prognosis of fetal growth retardation and erythrocyte sedimentation rate in the third trimester of pregnancy.
При сравнении значений СРБ в III триместре беременности статистически значимых различий между группами не было выявлено (р = 0,629).
Таким образом, два из трех показателей с высокой долей чувствительности и специфичности могут служить дополнительными диагностическими маркерами формирующейся поздней идиопатической ЗРП у женщин без других очагов воспаления и показателем гравидограммы, не соответствующем гестационному сроку. Кроме того, мы не исключаем, что повышенный уровень воспалительных маркеров является следствием дисбиотических процессов кишечника у беременных основной группы.
Исходы беременности / Pregnancy outcomes
Одним из основных критериев включения в исследование для пациенток обеих групп являлся доношенный срок беременности. Средняя продолжительность беременности в контрольной группе составила 39,1 ± 1,2 недели, тогда как в основной группе роды чаще происходили на 37,5 ± 0,7 неделе (t = 6,1; р < 0,001). Значительное количество беременностей в основной группе (47,5 %) завершилось операцией кесарева сечения, что было обусловлено острым дистрессом плода. В контрольной группе оперативное родоразрешение понадобилось 4 (10,0 %) пациенткам (t = 6,0; р = 0,012); показаниями к родоразрешению были аномалии сократительной деятельности матки у 3 (7,5 %) женщин и клинически узкий таз у 1 (2,5 %) женщины.
Средняя масса тела новорожденных в основной группе составила 2386,49 ± 485,89 г (95 % ДИ = 1900,6–2872,38), тогда как в контрольной группе этот параметр был существенно выше, достигнув 3497,26 ± 374,96 г (95 % ДИ = 3122,30–3872,22; t = 7,16; p = 0,004).
Ранний неонатальный период у новорожденных в группе с ЗРП сопровождался множеством осложнений. Из 40 новорожденных 8 (20,0 %) были с признаками внутриутробной инфекции (ВУИ), тогда как в контрольной группе такие случаи отсутствовали (Z = 3,063; p = 0,002). Среди новорожденных из основной группы частота внутрижелудочковых кровоизлияний составила 12,5 % (n = 5), синдрома дыхательных расстройств – 7,5 % (n = 3). В контрольной группе данных осложнений не было. Частота встречаемости неонатальной желтухи в основной группе составила 30,0 %, в контрольной группе – 35,0 %, разница была статистически незначимой (р = 0,08). В связи с более длительным периодом адаптации новорожденных с ЗРП средний койко-день в основной группе был практически на 2 суток дольше (5,94 ± 0,82 дней), чем у детей из контрольной группы (4,26 ± 0,59 дня; t = 6,49; p < 0,001).
Анализ микробиоты кишечника матери и корреляционные связи с массой тела новорожденного / Analysis of maternal gut microbiota and correlations with newborn body weight
Анализ микробиоты кишечника показал существенные различия между группами, которые заключались как в количественном соотношении филумов, так и в разнообразии представленных родов и видов. В составе микробиома прямой кишки у женщин основной группы преобладали представители Firmicutes и Proteobacteria, каждая из которых составляла по 35,0 %. Доля Bacteroides составляла 17,0 %, а Actinobacteria – 4,3 %. Остальные 8,7 % были представлены менее распространенными бактериями, такими как Cyanobacteria, Verrucomicrobia, Lentisphaerae, Fusobacteria и др. В микробиоме прямой кишки женщин контрольной группы основными представителями на уровне филума были Firmicutes (58,0 %), Proteobacteria (25,0 %), Bacteroidetes (16,0 %), остальные бактериальные сообщества (Verrucomicrobia, Cyanobacteria, Fusobacteria, Actinobacteria и др.) были представлены в доле менее 1,0 %, что не считается значимым при оценке состава микробиома исследуемого локуса.
Согласно данным многочисленных исследований, соотношение Firmicutes/Bacteroides применяется как важный индикатор кишечного дисбиоза. Важно отметить, что представители филума Firmicutes, такие как Clostridium leptum и Faecalibacterium prausnitzii, которые синтезируют бутират, выполняют иммуномодулирующие и противовоспалительные функции и являются основным источником энергии для эпителиоцитов толстой кишки. И уменьшение количества бутиратпродуцирующих бактерий из филума Firmicutes ассоциировано с активацией воспалительного ответа, что способствует развитию таких патологических состояний, как колит, синдром раздраженного кишечника, болезнь Крона и язвенный колит.
Соотношение Firmicutes/Bacteroides варьирует в пределах 4–10, и его уменьшение может указывать на наличие воспалительного процесса [17]. В нашем исследовании выявлено, что в основной группе это соотношение составило 2,0, тогда как в контрольной группе оно достигло 3,6 (р = 0,02). Особое внимание привлекли представители филума Firmicutes, такие как Clostridiales Lachnospiraceae Ruminococcustorques, Clostridiales Tissierellaceae Parvimonas, Clostridiales Tissierellaceae WAL1855D, Lactobacillales Streptococcaceae Lactococcus, которые были обнаружены исключительно в контрольной группе. Указанные роды бактерий являются представителями здоровой микробиоты кишечника, а некоторые представители, в частности, Lactobacillales Streptococcaceae Lactococcus обладают выраженными противовоспалительными свойствами. При оценке корреляций между массой тела новорожденных и количеством основных представителей микробиома прямой кишки у их матерей были установлены статистически значимые связи.
Кроме того, нами был выявлен прямой и статистически значимый (р = 0,013) корреляционный коэффициент (rxy = 0,442) между количеством бактерий из семейства Clostridiales Ruminococcaceae Oscillospira и массой тела новорожденного, что подчеркивает потенциальную роль этих микроорганизмов в формировании массы тела при рождении. По результату составленной регрессионной модели было определено, что бактерия благоприятно влияет на массу плода, а именно, увеличение на 1,0 % Clostridiales Ruminococcaceae Oscillospira приводит к увеличению массы тела новорожденного на 331,7 г. Согласно степени объяснения, модель учитывает 19,6 % факторов, влияющих на массу тела новорожденных. Это высокий показатель, поскольку значения от 10,0 % уже считаются клинически значимыми. Например, численность представителей семейства Clostridiales Ruminococcaceae Oscillospira в основной группе была представлена лишь в 4,0 % наблюдений, тогда как в контрольной группе – в 18,0 %, что свидетельствует о статистически значимых различиях (р < 0,05). Эти данные указывают на возможное влияние изменений в микробиоме на развитие ЗРП.
Также была выявлена статистически значимая (р = 0,04) обратная корреляция умеренной силы по шкале Чеддока (rxy = –0,371) между представителем филума Actinobacteria – Coriobacteriales Coriobacteriaceae Collinsella – и массой тела новорожденного, что указывает на возможное негативное влияние данного микроорганизма на пренатальное развитие. Нами была разработана регрессионная модель, которая позволяет оценить зависимость массы тела новорожденного от процентного содержания Coriobacteriales Coriobacteriaceae Collinsella в прямой кишке беременных в III триместре беременности:
Yвес нр. = 3036,5–476,2×ХCollin,
где Yвес нр. – масса тела новорожденного в г, ХCollin – процент содержания Coriobacteriales Coriobacteriaceae Collinsella.
Согласно значениям коэффициентов регрессии, повышение уровня Coriobacteriales Coriobacteriaceae Collinsella на 1,0 % ассоциируется со снижением массы тела новорожденного на 476,2 г.
На сегодняшний день установлено, что численность бактерий, принадлежащих к порядку Actinomycetales (класс Actinobacteria), в ЖКТ человека относительно мала. Их концентрация в фекальных образцах, как правило, не превышает диапазона 10²–10³ клеток на грамм. Однако, несмотря на их относительно низкую численность, представители Actinomycetales обладают широким спектром метаболической активности; эти бактерии участвуют в образовании метаболитов, таких как лактат, сукцинат и формиат, избыточное накопление которых связано с повышением воспалительных и гипоксических повреждений тканей.
Бактерии рода Actinomyces, рассматриваемые как потенциальные патобионты, могут вызывать актиномикоз – инфекционное заболевание, характеризующееся образованием воспалительных инфильтратов, и представляет собой значительную патологическую нагрузку на организм, особенно в случаях, когда эти инфильтраты содержат большое количество многоядерных лейкоцитов, макрофагов и плазматических клеток, поскольку эти изменения могут приводить к деструктивным процессам в тканях [18]. Следует отметить, что представители порядка Actinomycetales в изоляции редко ассоциируются с развитием кишечных заболеваний, их увеличение может негативно сказываться на иммунном статусе организма [18].
Стоит подчеркнуть, что процентное содержание Actinobacteria в исследованном микробиоме у женщин контрольной группы было менее 1,0 %, тогда как в основной группе доля этих бактерий составила более 4,0 %. Вероятно, именно баланс микроогранизмов, составляющих микробиоту кишечника, является одним из ведущих факторов, определяющих оптимальный набор массы плода во время беременности. Присутствие Coriobacteriales Coriobacteriaceae Collinsella оказалось ассоциировано с рядом осложнений беременности и неонатального периода. Из 8 новорожденных с признаками ВУИ у 4 (50,0 %) в фекальном микробиоме матерей был выявлен данный род бактерий. Более того, Coriobacteriales Coriobacteriaceae Collinsella присутствовала у всех беременных, родивших детей с синдромом дыхательных расстройств, что еще больше подчеркивает их потенциальную роль в патогенезе этих состояний. Важно отметить, что указанные осложнения отсутствовали у новорожденных из контрольной группы. Кроме того, было установлено, что новорожденные основной группы статистически значимо реже получали оценку 5 баллов по шкале Апгар на первой минуте жизни по сравнению с новорожденными из контрольной группы: 30,0 % против 70,0 % соответственно (p = 0,004). Интересным является также связь между наличием маловодия и присутствием Coriobacteriales Coriobacteriaceae Collinsella в микробиоте матери. Эта связь по шкале Чеддока оценивается как умеренная (r = 0,321; t = 2,091; p = 0,03). Содержание грамотрицательных Proteobacteria в кишечнике беременных из основной группы было 35,0 %, в контрольной группе – 25,0 %, что имело статистически значимую разницу (р = 0,003) и имело тесную связь с цервицитом, смешанным вагинитом у пациенток из основной группы. Влияние дисбиоза кишечника на формирование воспалительных заболеваний нижних отделов генитального тракта женщины в настоящее время считается доказанным [19].
Микробиом прямой кишки пациенток основной группы представлен на рисунке 3, женщин контрольной группы – на рисунке 4.
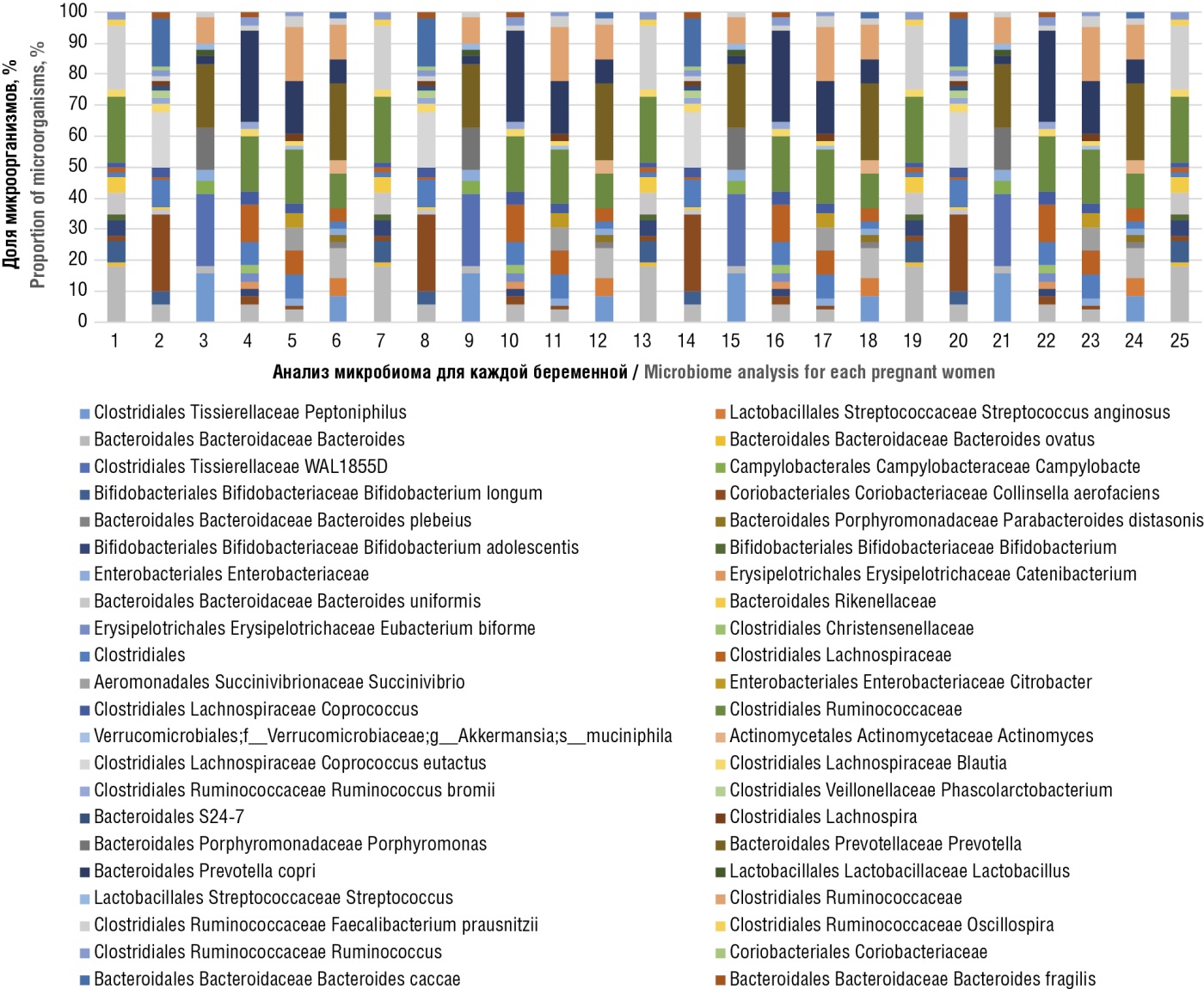
Рисунок 3. Микробиом прямой кишки у каждой из 25 беременных основной группы.
Figure 3. Rectal microbiome in each of 25 pregnant women in main group.
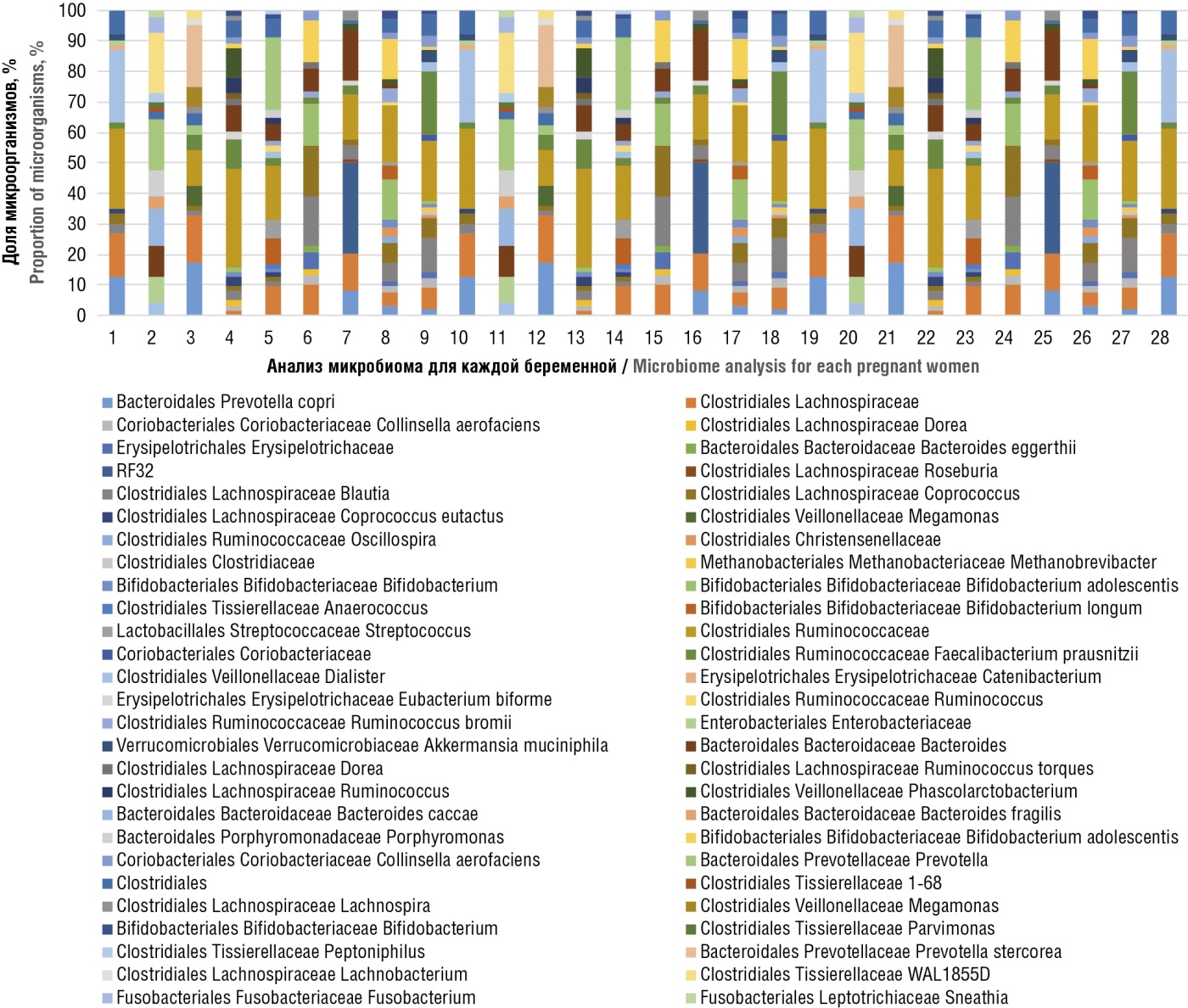
Рисунок 4. Микробиом прямой кишки у каждой из 28 беременных контрольной группы.
Figure 4. Rectal microbiome in each of 28 pregnant women in control group.
Обсуждение / Discussion
Основные изменения, которые происходят в организме беременной, направлены на обеспечение быстрого роста плода, его поддержку и питание. На протяжении всей беременности состав микробиома кишечника находится под влиянием эндокринной, иммунной систем и регулярно наблюдаемых метаболических изменений. Существуют данные, что иммунная модуляция, происходящая во время беременности и необходимая для предотвращения иммунологического отторжения плода, оказывает значительное влияние на изменения состава кишечной микробиоты [20]. Среди выявленных изменений отмечено повышение уровня представителей типа Firmicutes, рода Bifidobacterium и бактерий, способных перерабатывать муцин, таких как Akkermansia. Эти изменения связаны с повышенной потребностью организма в извлечении и сохранении энергии во время беременности, что также может влиять на метаболические процессы матери и плода. Важно подчеркнуть, что общий микробиом материнского кишечника в значительной степени обусловлен внешними факторами, включая пищевое поведение до и во время беременности, ИМТ, наличие сопутствующих заболеваний, а также применение лекарственных препаратов во время беременности [14]. Исследования показывают, что нарушения микробиоты матери, как кишечной, так и оральной, могут создавать неблагоприятные условия для роста и развития плода и приводить к нарушению снабжения ресурсами, вызванным воспалением и/или гипоксией, напрямую или косвенно влияющим на плаценту. Дисбиоз кишечника приводит к усилению его проницаемости, что в свою очередь способствует проникновению бактерий в кровеносную и лимфатическую системы и вызывает структурные и функциональные изменения плаценты через специфические метаболиты [21]. Установлено, что преобладание филума Firmicutes в микробиоте связано с увеличением таких метаболитов, как гинкоглид С и додекановая кислота, которые демонстрируют положительную корреляцию с массой тела новорожденного при рождении. Большое количество бактерий Proteobacteria и Bacteroides служат маркером кишечного дисбиоза, так как в кишечнике человека они приводят к усиленной выработке аллантоина, который является продуктом распада мочевой кислоты и отрицательно коррелирует с массой плода [22]. Несколько дальнейших исследований на животных продемонстрировали положительное влияние добавок короткоцепочечных жирных кислот (КЦЖ) на развивающуюся плаценту, включая увеличение размера плаценты, улучшение спиральных артерий и снижение маркеров воспаления [23]. Это подчеркивает потенциальную необходимость поддержания соответствующих уровней КЦЖ, таких как бутират и пропионат, в течение всего гестационного периода. Одним из наиболее значимых продуцентов бутирата являются Firmicutes [22]. Эти результаты согласуются с данными нашего исследования. В частности, у здоровых беременных содержание филума Firmicutes было существенно выше (р = 0,03). Более того, установлена положительная корреляция между присутствием представителей рода Clostridiales Ruminococcaceae Oscillospira и массой плода при рождении, что свидетельствует об адекватном трансплацентарном транспорте питательных веществ и оксигенации плода.
Немало исследований убедительно доказывают связь воспалительной среды с плацентарной ишемией и, как следствие, развитием синдрома ЗРП [24][25]. Нашим вторым открытием стало подтверждение воспалительных изменений в кишечнике у пациенток основной группы, в частности, уменьшение соотношения Ficmicutes/Bacteroides, а также преобладание Actinobacteria, отрицательно коррелирующей с массой плода при рождении. Статистически значимое повышение таких маркеров воспаления, как уровень лейкоцитов и СОЭ в общем анализе крови без других источников воспаления свидетельствует о повышенном уровне воспаления у беременных с ЗРП, что вероятно является следствием дисбиоза кишечной микробиоты.
Таким образом, кишечный дисбиоз, который проявляется значительными нарушениями в синтезе и транспорте питательных веществ, а также хроническими воспалительными процессами, наряду с преобладанием грамотрицательной микрофлоры в ротовой полости, желудке и плаценте, может выступать одним из ключевых факторов, способствующих развитию поздней идиопатической ЗРП. Коррекция этих изменений представляется перспективной стратегией для профилактики данного осложнения и достижения благоприятного перинатального исхода у данной категории беременных.
Ограничения исследования / Study limitations
Настоящее исследование имеет ряд ограничений, включая небольшой размер выборки как в основной, так и в контрольной группах, что может влиять на статистическую мощность. Увеличение размера выборки позволило бы получить больше информации. Кроме того, ограничением является отсутствие подробной информации о пищевых привычках участников исследования
Заключение / Conclusion
Полученные результаты подчеркивают важность раннего выявления и профилактики хронических заболеваний у беременных, а также необходимость усиленного мониторинга на критических сроках 28–32 недели беременности. Интеграция анализа кишечной микробиоты и учета соматического статуса в рутинную клиническую практику может способствовать более точному прогнозированию риска поздней ЗРП и оказывать своевременную помощь беременным, что в конечном итоге улучшит перинатальные исходы. Необходимы дополнительные многоцентровые исследования для подтверждения роли кишечного микробиома в патогенезе поздней ЗРП. Эти данные могут стать основой для разработки инновационных подходов к профилактике и терапии поздней ЗРП.
Список литературы
1. Клинические рекомендации – Недостаточный рост плода, требующий предоставления медицинской помощи матери (задержка роста плода) – 2022-2023-2024 (14.02.2022). М.: Министерство здравоохранения Россиийской Федерации, 2022. 47 с. Режим доступа: https://cr.minzdrav.gov.ru/recomend/722_1. [Дата обращения: 14.07.2024].
2. Centers for Disease Control and Prevention (CDC). World Health Organization, 2021. Режим доступа: https://www.who.int/teams/regulation-prequalification/regulation-and-safety/pharmacovigilance/networks/vaccine-safety-net/vsn-members/centers-for-disease-controland-prevention. [Дата обращения: 14.07.2024].
3. MacLeod R., Paulson J.N., Okalany N. et al. Intraventricular haemorrhage in a Ugandan cohort of low-birth weight neonates: the IVHU study. BMC Pediatr. 2021;21(1):12. https://doi.org/10.1186/s12887-020-02464-4.
4. Dinu M., Stancioi-Cismaru A.F., Gheonea M. et al. Intrauterine growth restriction – prediction and peripartum data on hospital care. Medicina. 2023;59(4):773. https://doi.org/10.3390/medicina59040773.
5. Kaplina A., Kononova S., Zaikova E. et al. Necrotizing enterocolitis: the role of hypoxia, gut microbiome, and microbial metabolites. Int J Mol Sci. 2023;24(3):2471. https://doi.org/10.3390/ijms24032471.
6. Fernandez-Rodriguez B., de Alba C., Galindo A. et al. Obstetric and pediatric growth charts for the detection of late-onset fetal growth restriction and neonatal adverse outcomes. J Perinat Med. 2020;49(2):216–24. https://doi.org/10.1515/jpm-2020-0210.
7. Ross M.G., Beall M.H. Adult sequelae of intrauterine growth restriction. Semin Perinatol. 2008;32(3):213–8. https://doi.org/10.1053/j.semperi.2007.11.005.
8. Børte S., Winsvold B.S., Stensland S.Ø. et al. The effect of fetal growth restriction on the development of migraine and tension-type headache in adulthood. The HUNT Study. PLoS One. 2017;12(4):e0175908. https://doi.org/10.1371/journal.pone.0175908.
9. Hu J., Benny P., Wang M. et al. Intrauterine growth restriction is associated with unique features of the reproductive microbiome. Reprod Sci. 2021;28(3):828–37. https://doi.org/10.1007/s43032-020-00374-5.
10. Tu X., Duan C., Lin B. et al. Characteristics of the gut microbiota in pregnant women with fetal growth restriction. BMC Pregnancy Childbirth. 2022;22(1):297. https://doi.org/10.1186/s12884-022-04635-w.
11. Miao T., Yu Y., Sun J. et al. Decrease in abundance of bacteria of the genus Bifidobacterium in gut microbiota may be related to pre-eclampsia progression in women from East China. Food Nutr Res. 2021;65. https://doi.org/10.29219/fnr.V65.5781.
12. Li G., Yin P., Chu S. et al. Correlation analysis between FGR and gut microbial composition in late pregnancy. J Diabetes Res. 2021;2021:8892849. https://doi.org/10.1155/2021/8892849.
13. Kyono K., Hashimoto T., Nagai Y., Sakuraba Y. Analysis of endometrial microbiota by 16S ribosomal RNA gene sequencing among infertile patients: a single-center pilot study. Reprod Med Biol. 2018;17(3):297–306. https://doi.org/10.1002/rmb2.12105.
14. Yao Y., Cai X., Chen C. et al. The role of microbiomes in pregnant women and offspring: research progress of recent years. Front Pharmacol. 2020;11:643. https://doi.org/10.3389/fphar.2020.00643.
15. Cadaret C.N., Posont R.J., Beede K.A. et al. Maternal inflammation at midgestation impairs subsequent fetal myoblast function and skeletal muscle growth in rats, resulting in intrauterine growth restriction at term. Transl Anim Sci. 2019;3(2):txz037. https://doi.org/10.1093/tas/txz037.
16. Железова М.Е., Бектур Б.K., Мальцева Л.И. и др. Значение материнского микробиома в развитии поздней задержки роста плода. Практическая медицина. 2022;20(5):34–9. https://doi.org/10.32000/2072-1757-2022-5-34-39.
17. Sokol H., Seksik P., Furet J.P. et al. Low counts of Faecalibacterium prausnitzii in colitis microbiota. Inflamm Bowel Dis. 2009;15(8):1183–9. https://doi.org/10.1002/ibd.20903.
18. Дудун А.А., Бонарцев А.П., Жаркова И.Г., Воинова В.В. Роль кишечной микробиоты в лечении различных заболеваний и антибактериальные препараты нового поколения. Учебно-методическое пособие. М.: Мир науки, 2020. 129 с. Режим доступа: https://izd-mn.com/PDF/17MNNPU20.pdf. [Дата обращения: 14.07.2024].
19. Mizgier М., Jarzabek-Bielecka G., Mruczyk K., Kedzia W. The role of diet and probiotics in prevention and treatment of bacterial vaginosis and vulvovaginal candidiasis in adolescent girls and non-pregnant women. Ginekol Pol. 2020;91(7):412–6. https://doi.org/10.5603/GP.2020.0070.
20. Gorczyca K., Obuchowska A., Kimber-Trojnar Ż. et al. Changes in the gut microbiome and pathologies in pregnancy. Int J Environ Res Public Health. 2022;19(16):9961. https://doi.org/10.3390/ijerph19169961.
21. Koren O., Goodrich J.K., Cullender T.C. et al. Host remodeling of the gut microbiome and metabolic changes during pregnancy. Cell. 2012;150(3):470–80. https://doi.org/10.1016/j.cell.2012.07.008.
22. Zixin T., Yun Ch., Fang H. et al. Alterations in the gut microbiome and metabolisms in pregnancies with fetal growth restriction. Microbiol Spectr. 2023;11(3):e00076-23. https://doi.org/10.1128/spectrum.00076-23.
23. Jin J., Gao L., Zou X. et al. Gut dysbiosis promotes preeclampsia by regulating macrophages and trophoblasts. Circ Res. 2022;131(6):492–506. https://doi.org/10.1161/CIRCRESAHA.122.320771.
24. Salafia C.M., Ernst L.M., Pezzullo J.C. et al. The very low birthweight infant: maternal complications leading to preterm birth, placental lesions, and intrauterine growth. Am J Perinatol. 1995;12(2):106–10. https://doi.org/10.1055/s-2007-994417.
25. Marcorelles P. Placental features in intrauterine growth retardation. J Gynecol Obstet Biol Reprod. 2013;42(8):996–1007. (In French). https://doi.org/10.1016/j.jgyn.2013.09.021.
Об авторах
М. Е. ЖелезоваРоссия
Железова Мария Евгеньевна, д.м.н., проф.
420012 Казань, ул. Карла Маркса, д. 74
Б. К. Бектур
Россия
Бектур Бегимай кызы
420110 Казань, ул. Братьев Касимовых, д. 40а
Л. И. Мальцева
Россия
Мальцева Лариса Ивановна, д.м.н., проф
Казань 420015, ул. Бутлерова, д. 36
Р. И. Шарипова
Россия
Шарипова Резеда Ильнуровна, к.м.н.
420012 Казань, ул. Карла Маркса, д. 74
Д. Б. Шакирзянова
Россия
Шакирзянова Дана Булатовна
420012 Казань, ул. Карла Маркса, д. 74
Что уже известно об этой теме?
► Поздняя задержка роста плода (ЗРП) до сих пор остается одной из малоизученных патологий, и вопросы патогенеза, профилактики и лечения поздней ЗРП остаются без ответа.
► ЗРП является причиной перинатальных и отсроченных во взрослом возрасте осложнений.
Что нового дает статья?
► Выявлены значимые ассоциации между кишечным микробиомом беременных и массой плода при рождении.
► Построена регрессионная модель, которая позволяет оценить зависимость массы тела новорожденного от процента содержания Coriobacteriales Coriobacteriaceae Collinsella в прямой кишке беременных.
► Выявлено, что воспалительные заболевания нижних отделов половых путей и манифестация мочевой инфекции чаще происходят на сроках 28–32 недели, что может быть критическим периодом для развития поздней ЗРП.
Как это может повлиять на клиническую практику в обозримом будущем?
► Мониторинг и управление воспалительными процессами на основе анализа кишечного микробиома и маркеров воспаления могут снизить риск развития осложнений, связанных с ЗРП.
► Усиление мониторинга и профилактики инфекционно-воспалительных заболеваний у беременных на сроках 28–32 недели может снизить риск развития поздней ЗРП.
► Персонализированный подход к коррекции материнского микробиома может стать новым направлением в профилактике и лечении перинатальных осложнений, что может улучшить исходы беременности.
Рецензия
Для цитирования:
Железова М.Е., Бектур Б.К., Мальцева Л.И., Шарипова Р.И., Шакирзянова Д.Б. Состояние материнского кишечного микробиома и его влияние на развитие синдрома идиопатической поздней задержки роста плода. Акушерство, Гинекология и Репродукция. 2024;18(6):788-799. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.547
For citation:
Zhelezova M.E., Bektur B.К., Maltseva L.I., Sharipova R.I., Shakirzyanova D.B. Maternal gut microbiome and its impact on developing idiopathic late fetal growth retardation. Obstetrics, Gynecology and Reproduction. 2024;18(6):788-799. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.547

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































