Перейти к:
Современное состояние вопроса placenta accreta spectrum: перспективы органосохраняющего лечения
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.571
Аннотация
Введение. Предпочтительным термином, одобренным большинством международных организаций, для определения аномальной плацентации всех степеней инвазии является placenta accreta spectrum (PAS). PAS – это серьезная проблема, которая встречается у одной женщины из 272 рожениц. На сегодняшний день общепринятой мировой практикой ведения PAS является перипартальная гистерэктомия, однако этот подход связан с высоким уровнем материнской смертности и невозможностью беременности в будущем.
Цель: проанализировать литературные данные, посвященные имеющимся методам диагностики и ведения PAS с акцентом на органосохраняющее лечение, включая оценку его рисков и преимуществ по сравнению с другими методами, а также перспективы для пациенток.
Материалы и методы. Поиск научных работ проводился в базах данных еLibrary, PubMed и Google Scholar до августа 2024 г. Для поиска использовались следующие поисковые термины на русском и английском языках: «placenta accreta spectrum», «PAS», «PAS и органосохраняющее лечение», «PAS и перипартальная гистерэктомия», «PAS и органосохраняющее ведение», «PAS and organ-preserving treatment», «PAS and peripartum hysterectomy», «PAS and organ-preserving management». Отбор статей осуществлялся в соответствии с рекомендациями PRISMA. В итоге в обзор были включены 75 публикаций.
Результаты. Органосохраняющее лечение PAS является разумной альтернативой перипартальной гистерэктомии, так как обеспечивает лучшие результаты с меньшим риском для здоровья матери. Стоит отметить, что каждый из этих методов имеет свои уникальные особенности. Так, органосохраняющее лечение может потребовать больше времени для достижения желаемого результата, но при этом оно может снизить риск осложнений и улучшить качество жизни женщины в долгосрочной перспективе. В то же время перипартальная гистерэктомия может быть более эффективной в краткосрочной перспективе, но она сопряжена с более высоким риском осложнений.
Заключение. Врач должен предоставить женщине всю необходимую информацию о рисках и преимуществах каждого метода, а также помочь ей принять обоснованное решение на основе ее индивидуальных потребностей и предпочтений. Органосохраняющее лечение PAS, способствуя сохранению фертильности, обеспечивает более высокое качество жизни с меньшим риском для здоровья матери. В конечном итоге, выбор между перипартальной гистерэктомией и органосохраняющим лечением зависит от конкретной ситуации и состояния здоровья женщины.
Ключевые слова
Для цитирования:
Воронина М.Д., Долгиев Д.А., Долгиева Р.А., Мироваева А.С., Гараева З.Ф., Иванова Ю.К., Сарапульцев И.В., Турдиева Е.И., Раков В.А., Куклина В.К., Манелов А.Е., Халилова К.Х. Современное состояние вопроса placenta accreta spectrum: перспективы органосохраняющего лечения. Акушерство, Гинекология и Репродукция. 2025;19(1):82-96. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.571
For citation:
Voronina M.D., Dolgiev D.A., Dolgieva R.A., Mirovaeva A.S., Garaeva Z.F., Ivanova Yu.K., Sarapultsev I.V., Turdieva E.I., Rakov V.A., Kuklina V.K., Manelov A.E., Khalilova K.Kh. Current state of the placenta accreta spectrum issue: prospects for organ-preserving treatment. Obstetrics, Gynecology and Reproduction. 2025;19(1):82-96. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.571
Введение / Introduction
Предпочтительным термином, одобренным большинством международных организаций, для определения аномальной плацентации всех степеней инвазии является placenta accreta spectrum (PAS) [1]. PAS – это серьезная проблема, которая встречается у одной женщины из 272 рожениц [2]. При нормальной беременности плодное яйцо прикрепляется к стенке матки. Ворсинки хориона, которые окружают плодное яйцо, должны прикрепиться к специальной оболочке внутри матки; если эта оболочка повреждена, то ворсинки могут прикрепиться неправильно. В таком случае говорят о патологическом прикреплении плаценты. Ворсинки могут прикрепиться слишком плотно к верхнему слою оболочки или даже проникнуть глубже, что приводит к приращению плаценты [3]. Рост числа случаев кесарева сечения (КС) привел к увеличению частоты PAS [4][5]. На сегодняшний день общепринятой мировой практикой ведения PAS является перипартальная гистерэктомия. Однако этот подход связан с высоким уровнем материнской смертности и невозможностью планирования беременности в будущем [1]. Существуют альтернативные методы, которые позволяют сохранить матку и снизить риск осложнений. Эти методы становятся все более популярными в мировой акушерской практике.
Цель: проанализировать литературные данные, посвященные имеющимся методам диагностики и ведения PAS с акцентом на органосохраняющее лечение, включая оценку его рисков и преимуществ по сравнению с другими методами, а также перспективы для пациенток.
Материалы и методы / Materials and Methods
Поиск научных работ проводился в базах данных еLibrary, PubMed и Google Scholar до августа 2024 г. Отбор публикаций осуществлялся согласно рекомендациям PRISMA. Все авторы независимо друг от друга занимались поиском публикаций, а в случае возникновения разногласий принимали решение путем консенсуса. Для поиска использовались следующие ключевые слова и их сочетания на русском и английском языках: «placenta accreta spectrum», «PAS», «PAS и органосохраняющее лечение», «PAS и перипартальная гистерэктомия», «PAS и органосохраняющее ведение», «PAS and organ-preserving treatment», «PAS and peripartum hysterectomy», «PAS and organ-preserving management». В результате поиска было найдено 5132 статьи. На этапе скрининга проводилась оценка приемлемости исследований по следующим критериям включения: исследование опубликовано на русском или английском языке; исследование опубликовано в рецензируемом научном издании; исследование является обзором литературы, описанием клинического случая или оригинальным исследованием с участием людей; в исследовании описываются особенности органосохраняющего лечение PAS, его сравнение с другими методами ведения и/или исходы. В итоге в обзор были включены 75 публикаций. На рисунке 1 представлена блок-схема PRISMA с подробным алгоритмом поиска исследований.
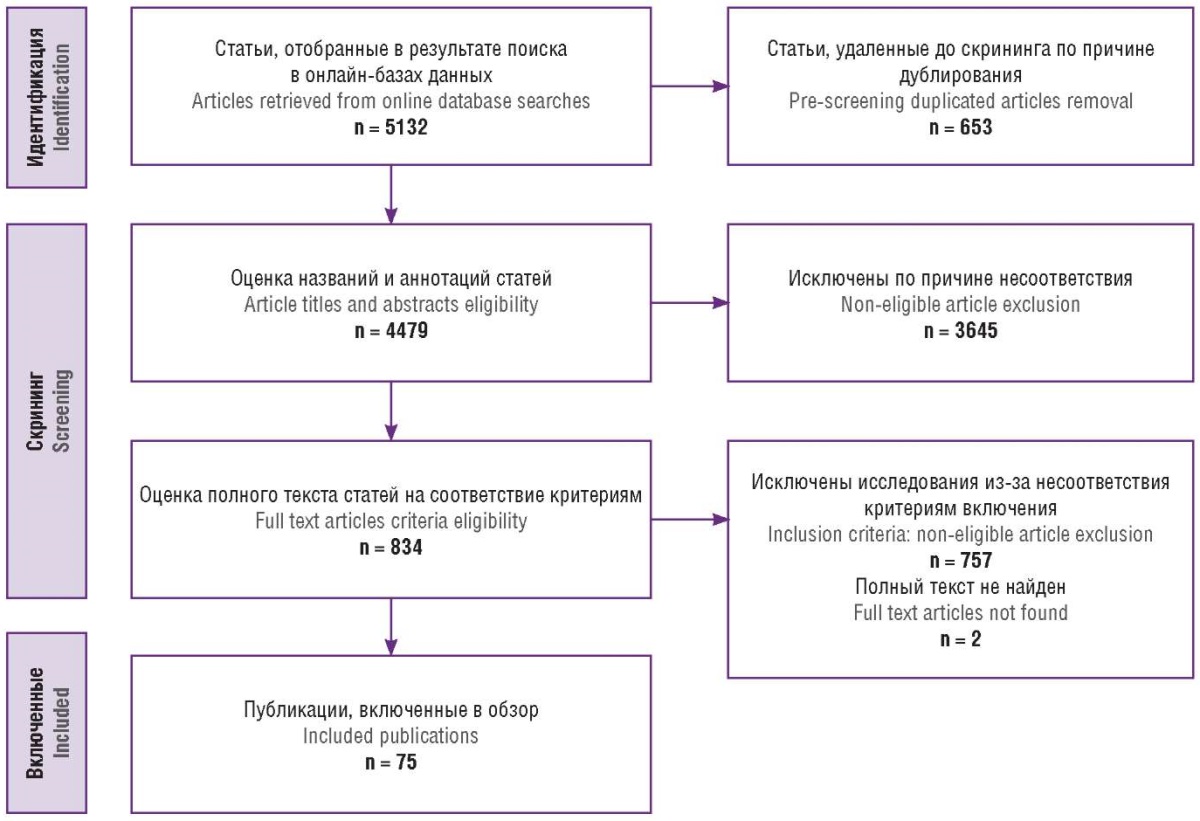
Рисунок 1. Блок-схема PRISMA.
Figure 1. PRISMA flow diagram.
Результаты / Results
Классификация PAS / PAS classification
Гистологически диагноз PAS может быть подтвержден только при гистерэктомии или биопсиимиометрии, и это традиционно считается «золотым стандартом» диагностики [6]. PAS диагностируется по потере децидуального слоя между ворсинчатой тканью и миометрием [1][3]. Гистологический диагноз PAS подразделяется на степени с увеличением глубины инвазии.
В случае сохранения матки патологоанатомическое исследование плаценты может использоваться в качестве метода диагностики, однако оно не является окончательным [7][8]. В связи с растущим внедрением методов лечения PAS с сохранением матки Международная федерация акушерства и гинекологии (англ. International Federation of Gynecology and Obstetrics, FIGO) разработала клиническую классификацию PAS для использования во время родов, когда невозможно получить результаты гистологического исследования [9]. Клиническая система оценки FIGO, аналогично гистологической, предполагает увеличение глубины инвазии плаценты при более высоких степенях.
Первая степень: PAS (accreta) характеризуется невозможностью извлечения плаценты с помощью мягкого вытяжения или ручной экстракции во время естественных родов или КС.
Вторая степень: PAS (increta) характеризуется выпячиванием плацентарного ложа и гиперваскуляризацией серозной оболочки или выворотом матки с мягким вытяжением.
Третья степень: PAS (percreta) характеризуется вышеуказанными признаками и визуализацией плацентарной ткани в серозной оболочке (3a), мочевом пузыре (3b) и широкой связке, боковых стенках таза или других органах малого таза (3c).
Антенатальная диагностика PAS / PAS antenatal diagnosis
Антенатальная диагностика позволила модифицировать тактику ведения PAS и улучшить результаты родоразрешений [10]. По последним данным, частота выявления PAS с предлежанием плаценты и без него составляет 74 и 40 % соответственно [11][12].
Двухмерное ультразвуковое трансабдоминальное или трансвагинальное исследование с использованием оттенков серого и цветного доплеровского картирования (англ. color doppler imaging, CDI), является рекомендуемым методом первой линии для антенатальной диагностики PAS [13]. Классические ультразвуковые признаки PAS включают потерю нормальной маточно-плацентарной границы (прозрачная зона), крайнее истончение нижележащего миометрия и сосудистые изменения в плаценте (лакуны) и плацентарном ложе (гиперваскуляризация) [14]. Было высказано предположение, что аномальное утолщение плаценты в нижнем сегменте (между шейкой матки и верхней частью мочевого пузыря) является простым и объективным признаком PAS [15].
Магнитно-резонансная томография (МРТ) может быть использована для антенатальной диагностики PAS. Диагностические признаки включают наличие выпячивания матки, неоднородную интенсивность сигнала в плаценте, темные внутриплацентарные полосы на Т2-взвешенных изображениях (Т2-ВИ), аномальную васкуляризацию плаценты, очаговые нарушения в стенке миометрия, деформацию мочевого пузыря и инвазию плаценты в близлежащие органы [16].
Метаанализ 20 исследований, в которых приняли участие 1080 беременных, показал, что антенатальная МРТ обладает превосходной диагностической точностью при определении глубины инвазии плаценты [16]. Чувствительность для определения accreta, increta и percreta составила 94,4, 100,0 и 86,5 % соответственно. Однако эти данные были получены в основном из исследований, в которых МРТ выполнялась после ультразвукового подтвержения PAS [16]. Другие ограничения включали небольшое количество включенных исследований, их ретроспективный дизайн, неоднородность изученных МРТ-признаков и срок беременности. Крупное ретроспективное исследование, включавшее более 500 пациенток с PAS, показало, что МРТ не дает дополнительной диагностической информации по сравнению с ультразвуковым исследованием (УЗИ) [17]. По-видимому, диагностическая точность МРТ и УЗИ при PAS может быть сходной, а различия в точности зависят от наличия или отсутствия предлежания плаценты и истончения рубца на матке [17][18]. Вопрос о том, когда проводить МРТ для визуализации PAS, остается открытым ввиду отсутствия опубликованных рандомизированных исследований.
Методы ведения PAS / PAS management
Перипартальная гистерэктомия / Peripartal hysterectomy
Перипартальная гистерэктомия на сроке 34–35 недель в настоящее время считается оптимальной стратегией ведения PAS, используемой более чем в 90 % случаев [19–21]. Гистеротомия проводится в стороне от плаценты, и после рождения ребенка плацента остается на месте, пока операция не будет завершена. Не следует предпринимать попыток удаления плаценты, поскольку они связаны со значительно большей кровопотерей [22].
Перипартальная гистерэктомия значительно снизила материнскую смертность, связанную с PAS, с 7 % в начале 1990-х годов до менее чем 1 % за 3 десятилетия [22–24]. Однако перипартальная гистерэктомия связана со значительной материнской заболеваемостью, включая послеродовые кровотечения, массивные переливания крови, травмы мочевыводящих путей и госпитализацию в отделение интенсивной терапии [25]. Было продемонстрировано, что при перипартальной гистерэктомии частота переливаний, требующих 4 или более единиц крови, повторного оперативного вмешательства, преднамеренной или непреднамеренной цистотомии и госпитализации в отделение интенсивной терапии, составила 42–70 %, 4–15 %, 17–23 % и 28–65 % соответственно [26–29]. Органосохраняющее лечение PAS является альтернативной стратегией, позволяющей избежать осложнений, ассоциированных с перипартальной гистерэктомией.
Органосохраняющее лечение PAS / Organ-preserving PAS treatment
Термин «органосохраняющее лечение PAS» может использоваться в широком смысле, охватывая любую стратегию, направленную на сохранение матки. Категориями лечения PAS, позволяющими сохранить матку, являются резекция-реконструкция матки и отсроченная интервальная гистерэктомия. Органосохраняющий подход имеет аналогичное перипартальной гистерэктомии начало, с теми же сроками и подготовкой к родам, но меняется после родов, когда матка ушивается и остается в малом тазу. В послеродовой период кровоснабжение матки и плаценты со временем существенно снижается. Если плацента остается in situ, то нарушается фетоплацентарное кровообращение, и уровень β-хорионического гонадотропина человека становится неопределяемым. Плацентарный некроз развивается медленно и способствует естественному отделению от матки и прилегающих органов, устраняя необходимость в перипартальной гистерэктомии [30]. Вопрос о том, рассасывается ли плацента, растворяется или отделяется по частям, четко не определен. Поэтому мы будем использовать термин «рассасывание плаценты» для описания этого малоизученного процесса. Однако могут возникнуть осложнения, включая кровотечения, коагулопатию и инфекционный процесс.
Благодаря тому, что органосохраняющее лечение изучалось, по крайней мере, с 1940 г. [31], международное внимание оно привлекло в 2020 г., когда было представлено крупное проспективное многоцентровое исследование, в котором сравнивались исходы у матерей после органосохраняющего лечения и перипартальной гистерэктомии с использованием метода взвешивания по шкале склонности [32]. В этом исследовании (ACCRETA) 86 беременным было проведено органосохраняющее лечение, а 62 – перипартальная гистерэктомия [33]. В течение 6 мес после родов органосохраняющее лечение привело к снижению частоты переливания более 4 единиц эритроцитарной массы (16 % против 59 %; скорректированный коэффициент риска (ОР) = 0,3; 95 % доверительный интервал (ДИ) = 0,2–0,5) по сравнению с группой пациенток, перенесших гистерэктомию [33]. Органосохраняющее лечение также было связано с более низкой частотой гистерэктомии (22 % против 100 %; р < 0,001), предполагаемой кровопотерей, превышающей 3000 мл (11 % против 46 %; ОР = 0,3; 95 % ДИ = 0,2–0,5), переливанием любых препаратов крови (38 % против 87 %; ОР = 0,5; 95 % ДИ = 0,3–0,6), повреждением соседних органов (5 % против 13 %; ОР = 0,3; 95 % ДИ = 0,1–0,8) и тяжелой материнской заболеваемостью, не связанной с кровотечением (6 % против 16 %; ОР = 0,4; 95 % ДИ = 0,2–0,9), по сравнению с пациентками, перенесшими гистерэктомию [33]. Важно отметить, что при органосохраняющем лечении отмечали некоторые осложнения. Артериальная эмболизация применялась чаще в группе органосохраняющего лечения, чем в группе перипартальной гистерэктомии (24 % против 3 %; ОР = 12,1; 95 % ДИ = 3,8–38,4) [33]. Более высокие показатели эндометрита (11 % против 0 %; р = 0,02) и повторной госпитализации в течение 6 мес (29 % против 3 %; ОР = 12,1; 95 % ДИ = 3,9–37,4) также наблюдались при органосохраняющем лечении [33]. В случаях повторной госпитализации общими показаниями были инфекция (67 %) и аномальное кровотечение (25 %) [34]. У женщин, которым потребовалась отсроченная гистерэктомия, среднее время после родов составило 51 день (межквартильный интервал [IQR] = 44–63 дня), при этом наиболее распространенной этиологией было кровотечение [34]. Аналогичные результаты были получены в 2 ретроспективных когортных исследованиях, сравнивающих перипартальную гистерэктомию с органосохраняющим лечением в Канаде (n = 10 с органосохраняющим лечением) и Турции (n = 15 с органосохраняющим лечением) [35][36].
Необходимо с осторожностью интерпретировать выявленные различия, поскольку медикаментозное и хирургическое лечение в группах различалось в отношении методики наложения лигатур на сосуды, маточных компрессионных швов, антибиотиков и утеротонических средств [33]. Эти различия в дополнительных методах лечения подчеркивают сложность анализа и прогнозирования результатов, несмотря на то, что лечение в соответствии с протоколом является согласованным и оптимальным.
Родоразрешение / Delivery
Органосохраняющий подход к ведению PAS начинается с разреза брюшной полости, который может быть поперечным или вертикальным, но должен обеспечивать проведение гистеротомии вдали от плаценты и достаточную экспозицию органов малого таза для возможной гистерэктомии. После извлечения плода пуповина перевязывается рядом с местом прикрепления к плаценте. Если нет клинических признаков PAS, можно осторожно потянуть пуповину, чтобы оценить возможность самопроизвольного отделения плаценты. Если отделения не происходит, проводится ушивание операционной раны. Это основная процедура органосохраняющего лечения PAS. Однако было предложено много дополнительных методов. Для большинства из них доказательств эффективности недостаточно, что требует дальнейшего изучения. Нет убедительных доказательств за или против применения утеротоников, эмболизации маточных артерий (ЭМА), длительной антибиотикопрофилактики или профилактики венозной тромбоэмболии [30][37]. Следует отметить, что клинические рекомендации не рекомендуют использовать метотрексат из-за одного случая материнской смерти, связанной с его приемом, и отсутствия теоретической пользы [19][38].
Послеродовой период / Postpartum period
Основной стратегией ведения беременности в послеродовом периоде является выжидательная тактика без вмешательства. Большинству пациенток гистерэктомия не потребуется, но у некоторых пациенток могут возникнуть осложнения легкой и умеренной степени тяжести. В исследовании PACCRETA 27 % пациенток, получавших органосохраняющее лечение, были повторно госпитализированы после родов в среднем через 51 день (IQR = 20–75 дней) [33]. В первые дни наибольший риск представляет кровотечение, которое можно профилактировать с помощью ЭМА. Тем не менее ЭМА может усилить боль и привести к некрозу матки и эндометриту. Общее соотношение риска и пользы от ЭМА не определено, но предварительные данные могут свидетельствовать о более быстром рассасывании плаценты [39]. Эффективность пролонгированной антибиотикопрофилактики также неясна.
В первые 2 мес после родов размер плаценты и кровоток существенно не уменьшатся [40]. Следовательно, женщины должны быть проинформированы об ожидаемых и предупреждающих признаках и симптомах в послеродовой период. Ожидаемые результаты после органосохраняющего лечения включают легкие или умеренные сокращения матки, умеренную боль в области живота и таза, выделения из влагалища и маточное кровотечение, не превышающее по интенсивности менструацию. У большинства пациенток в дополнение к кровянистым выделениям из влагалища наблюдаются усиливающееся и ослабевающее кровотечение с выделением некоторых сгустков или фрагментов ткани. К симптомам, требующим немедленной медицинской помощи, относятся повышение температуры тела, сильная боль в животе и области таза, неприятные выделения из влагалища и обильное маточное кровотечение.
В ретроспективном многоцентровом когортном исследовании естественная инволюция плаценты произошла в среднем через 13,5 нед (диапазон: 4–60 нед) после родов в 75 % случаев, которые не требовали дополнительных вмешательств [41]. Согласно более свежим, проспективным данным, полное рассасывание плаценты может занять больше времени при среднем наибольшем диаметре плацентарной ткани 71 мм (IQR = 37–108 мм) через 1–2 мес после родов и 34 мм (IQR = 17–60 мм) через 3–6 мес после родов [33]. Согласно данным B.L. Pineles с соавт., среднее время до разрешения проблемы составляет 18 нед (диапазон: 5–25 нед) [40]. В случаях задержки инволюции плаценты может быть рассмотрена возможность гистероскопической резекции, хотя оптимальные показания и сроки неизвестны. В одном исследовании гистероскопическая резекция или выскабливание для удаления оставшейся плаценты были выполнены в среднем через 20 нед (диапазон: 2–45 нед) после родов, при этом диагноз PAS был подтвержден при гистологическом исследовании образцов [42]. Однако гистероскопическую резекцию следует использовать не для ускорения процесса рассасывания плаценты, а только для удаления тканей, которые остаются у пациенток без патологических симптомов. Рекомендации по половому акту не основаны на фактических данных, хотя некоторые врачи рекомендуют воздержание или использование презервативов до полного рассасывания плаценты для профилактики инфекции. Повседневная жизнь и физические упражнения не требуют ограничений.
Лечение осложнений / Complications treatment
Подробной информации об осложнениях, связанных с органосохраняющим лечением PAS, действительно недостаточно. Основные аспекты, которые требуют более детального изучения включают частоту осложнений и их тип, факторы риска, методы профилактики и лечения осложнений, а также долгорочные последствия. Массивное кровотечение встречается относительно редко и требует проведения экстренной гистерэктомии [43]. Боль является довольно частым симптомом, и хотя она различается по степени тяжести, она может привести к необходимости гистерэктомии. Лечение должно включать стандартные послеоперационные методы обезболивания. Синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром) является уникальным осложнением. ДВС-синдром при органосохраняющем лечении PAS протекает вяло и не требует срочного лечения в отличие от острого ДВС-синдрома, вызванного кровотечением [44]. Симптомы ДВС-синдрома включают сильное маточное кровотечение или ярко-красную кровь. В противном случае признаки коагулопатии могут быть выявлены только при лабораторных исследованиях. Лабораторные признаки ДВС-синдрома характеризуются низким содержанием тромбоцитов отдельно или в сочетании с низким содержанием фибриногена и в большей степени коррелируют с хроническим ДВС-синдромом, отмечаемым у взрослых со злокачественными новообразованиями. Диагностические критерии ДВС-синдрома были опубликованы Международным обществом по тромбозам и гемостазу (англ. International Society on Thrombosis and Haemostasis, ISTH) в 2001 г., но подверглись критике из-за низкой чувствительности [45][46]. Учитывая повышение уровня фибриногена во время беременности и отсутствие нормативных данных о параметрах свертывания крови у лиц, проходящих органосохраняющее лечение PAS, уровень тромбоцитов < 150×10/⁹л или фибриногена < 2,0 мг/л считается отклонением от нормы. При появлении симптомов повышенной кровоточивости и гипофибриногенемии < 2,0 мг/л рекомендуется переливание плазмы, криопреципитата или концентрата фибриногена, хотя лечение легких симптомов или лабораторных отклонений само по себе является спорным [40].
Эндометрит является одной из наиболее распространенных причин гистерэктомии после органосохраняющего лечения PAS. Эндометрит, связанный с задержкой плаценты, может быть идентичен острому послеродовому эндометриту с повышением температуры, болезненностью матки и лейкоцитозом или похож на хронический эндометрит, не связанный с беременностью, только с болезненностью матки [47]. Таким образом, необходим высокий уровень настороженности в отношении эндометрита. В случае неэффективности применения пероральных антибиотиков следует провести госпитализацию для внутривенного введения антибиотиков. Гистерэктомия может быть необходима, если инфекция прогрессирует или не поддается медикаментозному лечению [40][48]. При возникновения каких-либо осложнений органосохраняющего лечения PAS пациенткам необходимо предлагать проведение гистерэктомии в качестве окончательного метода лечения.
Перспективы беременных с PAS / Prospects for PAS pregnant women
В конечном счете, перипартальная гистерэктомия приводит к потере детородного потенциала, и некоторые женщины сообщают о длительном и болезненном восстановлении после родов [49]. Потеря фертильности была связана с понижением самооценки и социального статуса [50][51]. Диагноз PAS вызывает значительный стресс и беспокойство у многих беременных [52]. Перипартальная гистерэктомия и органосохраняющее лечение PAS имеют как свои преимущества, так и недостатки для пациенток. Женщины которым диагностируют PAS, описывают первоначальный шок и отсутствие информации о данном заболевании, что указывает на необходимость лучшего информирования беременных, находящихся в группе риска, на ранних сроках беременности [53].
Некоторым женщинам с PAS может потребоваться самостоятельность в выборе стратегии ведения заболевания. Родоразрешение с сопутствущей перипартальной гистерэктомией ассоциировано с родовыми травмами, посттравматическим стрессовым расстройством и депрессией, связанными с потерей фертильности и последующими негативными последствиями для отношений с партнером [52][54][55]. Эти последствия могут проявляться в виде различных травм, разобщенности и потери либидо. Полуструктурированное опросное исследование, в котором приняли участие 17 женщин с диагнозом PAS, показало, что эмоциональный стресс, ощущение беспомощности, неуверенности во время беременности и измененный опыт родов способствуют возникновению родовой травмы [52].
Нередко большинству пациенток говорят, что перипартальная гистерэктомия является единственным правильным способом ведения PAS. H.C. Bartels с соавт. в ходе опроса 347 пациенток с PAS в анамнезе подчеркнули, что женщины хотят принимать участие в принятии решений, связанных с лечением, и данный выбор является критически важным элементом для беременных с PAS [56].
Необходимо учитывать что, у пациенток есть предпочтения, связанные с их ценностями и образом жизни. Органосохраняющее лечение PAS дает возможность избежать серьезной операции и сохранить фертильность в будущем. Однако частое послеродовое наблюдение в течение нескольких месяцев, даже без осложнений, может быть болезненным, неудобным, отнимающим много времени и вызывающим беспокойство у женщины и ее семьи [57]. Совместное принятие решений с беременной имеет важное значение, даже если по медицинским или логистическим соображениям предпочтительна одна из стратегий.
Принятие решения о выборе метода ведения PAS / A decision-making on the choice of PAS management method
Есть 2 основные причины, по которым органосохраняющее лечение предпочтительнее перипартальной гистерэктомии. Во-первых, беременная желает в будущем иметь детей или сохранить матку. Во-вторых, инвазия плаценты настолько серьезна, что проведение перипартальной гистерэктомии считается исключительно опасным. Однако существует множество факторов, влияющих на определение соответствующей стратегии ведения, и ни одно из двух предыдущих соображений не может быть применимо. Врачу необходимо провести беседу с пациенктой и ознакомить ее с возможными вариантами лечения, в том числе обсудить возможности стационара и удобство каждого подхода. Для беременных, проживающих на большом расстоянии от стационара третьего уровня, органосохраняющее лечение может оказаться более сложным. В случае если в ближайшем лечебном учреждении к месту проживания пациенки нет банка крови или рентгенохирургического отделения, пациентка может переехать ближе к стационару третьего уровня на 1–2 мес послеродового ведения после органосохраняющее лечения. Для пациенток, которые ожидают трудностей с послеродовым наблюдением, перипартальная гистерэктомия является окончательным методом лечения, который обычно не требует длительного наблюдения. Поэтому этот вариант может быть предпочтительным. Объективные факторы, такие как возраст беременной или ее паритет, менее важны, чем ее желания. Важные факторы, такие как качество жизни, переносимость возможных чрезвычайных обстоятельств, сексуальная функция и психологический статус должны обсуждаться с использованием подхода, ориентированного на пациента, при планировании хирургического вмешательства [6][34]. Лица, планирующие органосохраняющее лечение, должны быть детально информированы относительно возможности перехода к перипартальной гистерэктомии во время родоразрешения или в послеродовом периоде в случае возникновения осложнений. Независимо от индивидуальных предпочтений и демографических особенностей, перипартальная гистерэктомия рекомендуется женщинам с сильной болью, выраженным кровотечением, коагулопатией или нестабильностью гемодинамики в предродовой период.
Существуют разногласия относительно того, следует ли рекомендовать органосохраняющее лечение в случаях placenta percreta. В этих случаях материнская заболеваемость при перипартальной гистерэктомии является значительной из-за плотной, инвазивной и аберрантной сосудистой сети артериовенозных анастомозов, обусловленной плацентарными ангиогенными факторами. Неоваскуляризация затрудняет гемостаз и визуализацию при отделении матки от ее ножек и мочевого пузыря. Некоторые эксперты утверждают, что предлежание плаценты – это единственный случай, когда органосохраняющее лечение будет успешным, поскольку самопроизвольное отделение плаценты не приведет к послеродовому кровотечению. Однако многочисленные исследования показали, что органосохраняющее лечение с меньшей вероятностью будет успешным при большей тяжести PAS. Например, в нескольких описаниях клинических случаев успешное сохранение матки при органосохраняющем лечении было достигнуто у 14–56 % пациенток с placenta percreta, что ниже, чем у пациенток с менее тяжелым PAS [41][58–60]. Материнская заболеваемость при placenta percreta выше по сравнению с менее тяжелыми формами PAS, но это проявляется как при перипартальной гистерэктомии, так и при органосохраняющем лечении [24][33][61]. Ни в одном исследовании не проводилось прямого сравнения гистерэктомии с органосохраняющим лечением по ключевым отличиям, которые указывают на увеличение материнской заболеваемости и смертности при placenta percreta по сравнению с placenta accreta [62]. Таким образом, беременные с placenta percreta должны быть проинформированы о том, что неизвестно, является ли органосохраняющее лечение более безопасным, чем гистерэктомия. Однако независимо от выбранной стратегии лечения, следует учитывать тяжесть заболевания и его последствия.
Планирование родоразрешения при PAS / Delivery planning in PAS
Результаты родоразрешения у пациенток с PAS лучше, если беременность ведет мультидисциплинарная команда [63][64]. Необходимые ресурсы и команда специалистов описаны в работе G.D. Fitzgerald с соавт. [65]. Роды и послеродовой уход при органосохраняющем лечении PAS требуют тех же ресурсов, что и плановая гистерэктомия. Медицинские центры, не располагающие ресурсами для оказания помощи лицам с PAS, должны обеспечить маршутизацию в центры акушерской помощи, оснащенные соответствующими ресурсами, при возникновении проблем [55, 66]. При возникновении критических ситуаций должны быть доступны службы неотложной медицинской помощи для оперативной транспортировки беременных с PAS, нуждающихся в своевременном обследовании и лечении в дородовой и послеродовой периоды [67]. Если стационар не предлагает органосохраняющего лечения PAS, женщины, желающие воспользоваться этой стратегией, должны быть направлены в специализированные центры.
На сегодняшний день нет опубликованных данных о каких-либо потенциальных рисках или преимуществах грудного вскармливания при органосохраняющем лечении PAS. Следует приложить все усилия, чтобы ограничить разлучение матери и младенца. Когда мать и младенец физически разлучены, дистанционное общение может обеспечить ограниченный опыт сближения и предотвратить послеродовую депрессию [65].
PAS, впервые диагностированный в родах / In-labor newly-diagnosed PAS
Когда врач сталкивается с неожиданным PAS во время родов в условиях стационара I–II уровня, органосохраняющее лечение может быть наиболее оптимальным вариантом. В этом случае наличие и обильность кровотечений, а также стабильность состояния беременной диктуют необходимость проведения органосохраняющего лечения. Блок-схема, приведенная в работе B.D. Einerson с соавт., предлагает единственную стратегию принятия решений в отношении неожиданного PAS, диагностированного при родах [6]. Если состояние пациентки нестабильно или у нее сильное кровотечение, необходимо немедленно выполнить перипартальную гистерэктомию. Однако если у пациента стабильная гемодинамика и нет сильного кровотечения, плаценту можно сохранить. Впоследствии пациент может быть доставлен в специализированный центр для дальнейшего лечения.
Исходы беременности после органосохраняющего лечения PAS / Pregnancy outcomes after organ-preserving PAS treatment
Показатели фертильности у лиц с PAS, по-видимому, не изменяются после органосохраняющего лечения. По данным нескольких когортных исследований, 83–89 % пациенток, планировавших повторную беременность после органосохраняющего лечения PAS, смогли забеременетьв среднем через 17,3 мес (диапазон: 2–48 мес) [34][68–70]. После зачатия все беременности, сохранившиеся после I триместра, заканчивались рождением здорового ребенка через 34 нед беременности [68]. Однако в некоторых исследованиях использовались дополнительные стратегии лечения, которые включали ЭМА, введение метотрексата, гистероскопическую резекцию сохранившихся тканей и реконструкцию матки. Эти вмешательства затрудняют оценку истинных показателей фертильности, если рассматривать только органосохраняющее лечение. Кроме того, небольшие ретроспективные исследования, которые основаны на приверженности и вовлеченности ограниченного количества пациенток, при оценке показателей фертильности могут быть подвержены ошибкам. На сегодняшний день отсутствуют данные для определения необходимости дополнительных вмешательств с целью оптимизации сохранения фертильности после органосохраняющего лечения.
В двух небольших когортных исследованиях риск рецидива PAS после органосохраняющего лечения оценивался в пределах 22–29 % у пациенток, беременность которых закончилась родами после 34 нед [68][70]. Этот риск может быть выше по сравнению с пациентками, перенесшими резекцию-реконструкцию матки во время родов, с частотой рецидивов 5–23 % [71–75]. Однако на эти результаты также могут влиять вышеописанные ограничения при оценке коэффициента фертильности.
Заключение / Conclusion
Перипартальная гистерэктомия ассоциируется со значительной материнской заболеваемостью, что делает ее потенциально опасной для здоровья женщины. Поэтому органосохраняющее лечение PAS является разумной альтернативой, так как обеспечивает лучшие результаты с меньшим риском для здоровья матери. Ресурсы, необходимые для проведения перипартальной гистерэктомии и органосохраняющего лечения, схожи. Однако каждый из этих методов имеет свои уникальные риски и преимущества. Например, органосохраняющее лечение может потребовать больше времени для достижения желаемого результата, но при этом оно может снизить риск осложнений и улучшить качество жизни женщины в долгосрочной перспективе благодаря сохранению фертильности. В то же время перипартальная гистерэктомия может быть более эффективной в краткосрочной перспективе, но она сопряжена с более высоким риском осложнений. Врач должен предоставить женщине всю необходимую информацию о рисках и преимуществах каждого метода, а также помочь ей принять обоснованное решение на основе ее индивидуальных потребностей и предпочтений. В конечном итоге, выбор между перипартальной гистерэктомией и органосохраняющим лечением зависит от конкретной ситуации и состояния здоровья женщины. Важно, чтобы женщина получила всю необходимую информацию и поддержку, чтобы она могла принять информированное решение о своем лечении.
Список литературы
1. Сюндюкова Е.Г., Чуланова Ю.С., Сашенков С.Л. и др. Предлежание и врастание плаценты: вопросы диагностики и акушерской тактики. Российский вестник акушера-гинеколога. 2022;22(3):12–20. https://doi.org/10.17116/rosakush20222203112.
2. Mogos M.F., Salemi J.L., Ashley M. et al. Recent trends in placenta accreta in the United States and its impact on maternal-fetal morbidity and healthcare-associated costs, 1998–2011. J Matern Fetal Neonatal Med. 2016;29(7):1077–82. https://doi.org/10.3109/14767058.2015.1034103.
3. Барановская Е.И. Этиология и диагностика placenta accreta. Российский вестник акушера-гинеколога. 2020;20(3):24–8. https://doi.org/10.17116/rosakush20202003124.
4. Лебеденко Е.Ю., Беспалая А.В., Феоктистова Т.Е., Рымашевский М.А. Анализ мировых трендов уровня кесарева сечения с использованием классификации Робсона. Медицинский вестник Юга России. 2021;12(2):16–21. https://doi.org/10.21886/2219-8075-2021-12-2-16-21.
5. Silver R.M., Branch D.W. Placenta accreta spectrum. N Engl J Med. 2018;378(16):1529–36. https://doi.org/10.1056/NEJMcp1709324.
6. Einerson B.D., Gilner J.B., Zuckerwise L.C. Placenta accreta spectrum. Obstet Gynecol. 2023;142(1):31–50. https://doi.org/10.1097/AOG.0000000000005229.
7. Ernst L.M., Linn R.L., Minturn L., Miller E.S. Placental pathologic associations with morbidly adherent placenta: potential insights into pathogenesis. Pediatr Dev Pathol. 2017;20(5):387–93. https://doi.org/10.1177/1093526617698600.
8. Jauniaux E., Bhide A., Kennedy A. et al.; FIGO Placenta Accreta Diagnosis and Management Expert Consensus Panel. FIGO consensus guidelines on placenta accreta spectrum disorders: Prenatal diagnosis and screening. Int J Gynaecol Obstet. 2018;140(3):274–80. https://doi.org/10.1002/ijgo.12408.
9. Jauniaux E., Ayres-de-Campos D., Langhoff-Roos J. et al. FIGO Placenta Accreta Diagnosis and Management Expert Consensus Panel. FIGO classification for the clinical diagnosis of placenta accreta spectrum disorders. Int J Gynaecol Obstet. 2019;146(1):20–4. https://doi.org/10.1002/ijgo.12761.
10. Yu F.N.Y., Leung K.Y. Antenatal diagnosis of placenta accreta spectrum (PAS) disorders. Best Pract Res Clin Obstet Gynaecol. 2021;72:13–24. https://doi.org/10.1016/j.bpobgyn.2020.06.010.
11. Carusi D.A., Fox K.A., Lyell D.J. et al. Placenta accreta spectrum without placenta previa. Obstet Gynecol. 2020;136(3):458–65. https://doi.org/10.1097/AOG.0000000000003970.
12. Sugai S., Yamawaki K., Sekizuka T. et al. Pathologically diagnosed placenta accreta spectrum without placenta previa: a systematic review and meta-analysis. Am J Obstet Gynecol MFM. 2023;5(8):101027. https://doi.org/10.1016/j.ajogmf.2023.101027.
13. Committee on Obstetric Practice. Committee opinion no. 529: placenta accreta. Obstet Gynecol. 2012;120(1):207–11. https://doi.org/10.1097/AOG.0b013e318262e340.
14. Jauniaux E., Collins S., Burton G.J. Placenta accreta spectrum: pathophysiology and evidence-based anatomy for prenatal ultrasound imaging. Am J Obstet Gynecol. 2018;218(1):75–87. https://doi.org/10.1016/j.ajog.2017.05.067.
15. Laoreti A., Thilaganathan B., Agten A.K. et al. Placental thickness in the lower uterine segment and invasive placentation: Will the promise live up? Acta Obstet Gynecol Scand. 2019;98(2):266. https://doi.org/10.1111/aogs.13460.
16. Familiari A., Liberati M., Lim P. et al. Diagnostic accuracy of magnetic resonance imaging in detecting the severity of abnormal invasive placenta: a systematic review and meta-analysis. Acta Obstet Gynecol Scand. 2018;97(5):507–20. https://doi.org/10.1111/aogs.13258.
17. Palacios-Jaraquemada J.M., Bruno C.H., Martín E. MRI in the diagnosis and surgical management of abnormal placentation. Acta Obstet Gynecol Scand. 2013;92(4):392–7. https://doi.org/10.1111/j.1600-0412.2012.01527.x.
18. D'Antonio F., Palacios-Jaraquemada J., Lim P.S. et al. Counseling in fetal medicine: evidence-based answers to clinical questions on morbidly adherent placenta. Ultrasound Obstet Gynecol. 2016;47(3):290–301. https://doi.org/10.1002/uog.14950.
19. Collins S.L., Alemdar B., van Beekhuizen H.J. et al.; International Society for Abnormally Invasive Placenta (IS-AIP). Evidence-based guidelines for the management of abnormally invasive placenta: recommendations from the International Society for Abnormally Invasive Placenta. Am J Obstet Gynecol. 2019;220(6):511–26. https://doi.org/10.1016/j.ajog.2019.02.054.
20. Allen L., Jauniaux E., Hobson S. et al. FIGO Placenta Accreta Diagnosis and Management Expert Consensus Panel. FIGO consensus guidelines on placenta accreta spectrum disorders: Nonconservative surgical management. Int J Gynaecol Obstet. 2018;140(3):281–90. https://doi.org/10.1002/ijgo.12409.
21. Jauniaux E., Bhide A. Prenatal ultrasound diagnosis and outcome of placenta previa accreta after cesarean delivery: a systematic review and meta-analysis. Am J Obstet Gynecol. 2017;217(1):27–36. https://doi.org/10.1016/j.ajog.2017.02.050.
22. Fitzpatrick K.E., Sellers S., Spark P. et al. The management and outcomes of placenta accreta, increta, and percreta in the UK: a population-based descriptive study. BJOG. 2014;121(1):62–70. https://doi.org/10.1111/1471-0528.12405.
23. Nieto-Calvache A.J., Palacios-Jaraquemada J.M., Osanan G. et al. Latin American group for the study of placenta accreta spectrum. Lack of experience is a main cause of maternal death in placenta accreta spectrum patients. Acta Obstet Gynecol Scand. 2021;100(8):1445–53. https://doi.org/10.1111/aogs.14163.
24. Overton E., Wen T., Friedman A.M. et al. Outcomes associated with peripartum hysterectomy in the setting of placenta accreta spectrum disorder. Am J Obstet Gynecol MFM. 2023;5(12):101–174. https://doi.org/10.1016/j.ajogmf.2023.101174.
25. Bailit J.L., Grobman W.A., Rice M.M. et al.; Eunice Kennedy Shriver National Institute of Child Health and Human Development (NICHD) Maternal-Fetal Medicine Units (MFMU) Network. Morbidly adherent placenta treatments and outcomes. Obstet Gynecol. 2015;125(3):683–9. https://doi.org/10.1097/AOG.0000000000000680.
26. Angstmann T., Gard G., Harrington T. et al. Surgical management of placenta accreta: a cohort series and suggested approach. Am J Obstet Gynecol. 2010;202(1):38.e1-9. https://doi.org/10.1016/j.ajog.2009.08.037.
27. Shamshirsaz A.A., Fox K.A., Salmanian B. et al. Maternal morbidity in patients with morbidly adherent placenta treated with and without a standardized multidisciplinary approach. Am J Obstet Gynecol. 2015;212(2):218.1–9. https://doi.org/10.1016/j.ajog.2014.08.019.
28. Eller A.G., Porter T.F., Soisson P., Silver R.M. Optimal management strategies for placenta accreta. BJOG. 2009;116(5):648–54. https://doi.org/10.1111/j.1471-0528.2008.02037.x.
29. Warshak C.R., Ramos G.A., Eskander R. et al. Effect of predelivery diagnosis in 99 consecutive cases of placenta accreta. Obstet Gynecol. 2010;115(1):65–9. https://doi.org/10.1097/AOG.0b013e3181c4f12a.
30. Sentilhes L., Kayem G., Mattuizzi A. Conservative approach: Intentional retention of the placenta. Best Pract Res Clin Obstet Gynaecol. 2021;72:52–66. https://doi.org/10.1016/j.bpobgyn.2020.07.010.
31. Schumann E.A. Pathology of the third stage of labor with especial reference to the placental element. Med Rec Ann. 1940;151:381–4.
32. Sentilhes L., Deneux-Tharaux C., Seco A., Kayem G. 4: Conservative management versus cesarean hysterectomy for placenta accreta spectrum; the PACCRETA prospective population-based study. Am J Obstet Gynecol. 2020;222(1):S3–S4.
33. Sentilhes L., Seco A., Azria E. et al.; PACCRETA Study Group. Conservative management or cesarean hysterectomy for placenta accreta spectrum: the PACCRETA prospective study. Am J Obstet Gynecol. 2022;226(6):839.e1– 839.e24. https://doi.org/10.1016/j.ajog.2021.12.013.
34. Sentilhes L., Seco A., Kayem G., Deneux-Tharaux C. Postdischarge outcomes of readmitted women included in the PACCRETA study. Am J Obstet Gynecol. 2022;227(5):795–8. https://doi.org/10.1016/j.ajog.2022.06.042.
35. Amsalem H., Kingdom J.C.P., Farine D. et al. Planned caesarean hysterectomy versus "conserving" caesarean section in patients with placenta accreta. J Obstet Gynaecol Can. 2011;33(10):1005–10. https://doi.org/10.1016/S1701-2163(16)35049-6.
36. Kutuk M.S., Ak M., Ozgun M.T. Leaving the placenta in situ versus conservative and radical surgery in the treatment of placenta accreta spectrum disorders. Int J Gynaecol Obstet. 2018;140(3):338–44. https://doi.org/10.1002/ijgo.12308.
37. Bouvier A., Sentilhes L., Thouveny F. et al. Planned caesarean in the interventional radiology cath lab to enable immediate uterine artery embolization for the conservative treatment of placenta accreta. Clin Radiol. 2012;67(11):1089–94. https://doi.org/10.1016/j.crad.2012.04.001.
38. Sentilhes L., Kayem G., Chandraharan E. et al; FIGO Placenta Accreta Diagnosis and Management Expert Consensus Panel. FIGO consensus guidelines on placenta accreta spectrum disorders: Conservative management. Int J Gynaecol Obstet. 2018;140(3):291–8. https://doi.org/10.1002/ijgo.12410.
39. Soyer P., Sirol M., Fargeaudou Y. et al. Placental vascularity and resorption delay after conservative management of invasive placenta: MR imaging evaluation. Eur Radiol. 2013;23(1):262–71. https://doi.org/10.1007/s00330-012-2573-4.
40. Pineles B.L., Coselli J., Ghorayeb T. et al. Leaving the placenta in situ in placenta accreta spectrum disorders: a single-center case series. Am J Perinatol. 2024;41(S 01):е420–е429. https://doi.org/10.1055/a-1885-1942.
41. Sentilhes L., Ambroselli C., Kayem G. et al. Maternal outcome after conservative treatment of placenta accreta. Obstet Gynecol. 2010;115(3):526–34. https://doi.org/10.1097/AOG.0b013e3181d066d4.
42. Legendre G., Zoulovits F.J., Kinn J. et al. Conservative management of placenta accreta: hysteroscopic resection of retained tissues. J Minim Invasive Gynecol. 2014;21(5):910–3. https://doi.org/10.1016/j.jmig.2014.04.004.
43. Барановская Е.И. Предотвращение массивного кровотечения при placenta accreta. Российский вестник акушера-гинеколога. 2021;21(1):84–7. https://doi.org/10.17116/rosakush20212101184.
44. Куликов И.А., Доброхотова Ю.Э., Артемьева К.А. и др. Современный взгляд на тактику лечения беременных с патологическим прикреплением и предлежанием плаценты (обзор литературы). Проблемы репродукции. 2023;29(2):42–50. https://doi.org/10.17116/repro20232902142.
45. Taylor F.B., Toh C.H., Hoots W.K. et al.; Scientific Subcommittee on Disseminated Intravascular Coagulation (DIC) of the International Society on Thrombosis and Haemostasis (ISTH). Towards definition, clinical and laboratory criteria, and a scoring system for disseminated intravascular coagulation. Thromb Haemost. 2001;86(5):1327–30.
46. Asakura H., Takahashi H., Uchiyama T. et al.; DIC subcommittee of the Japanese Society on Thrombosis and Hemostasis. Proposal for new diagnostic criteria for DIC from the Japanese Society on Thrombosis and Hemostasis. Thromb J. 2016;14:42. https://doi.org/10.1186/s12959-016-0117-x.
47. Singh N., Sethi A. Endometritis – diagnosis, treatment and its impact on fertility – a scoping review. JBRA Assist Reprod. 2022;26(3):538–46. https://doi.org/10.5935/1518-0557.20220015.
48. Калинкина О.Б., Тезиков Ю.В., Липатов И.С. и др. Опыт органосохраняющей тактики ведения при врастании плаценты. Медико-фармацевтический журнал "Пульс". 2023;25(6):37–42. https://doi.org/10.26787/nydha-2686-6838-2023-25-6-37-42.
49. Grover B., Einerson B.D., Keenan K.D. et al. Patient-reported health outcomes and quality of life after peripartum hysterectomy for placenta accreta spectrum. Am J Perinatol. 2022;39(3):281–7. https://doi.org/10.1055/s-0040-1715465.
50. Sentilhes L., Kayem G., Silver R.M. Conservative management of placenta accreta spectrum. Clin Obstet Gynecol. 2018;61(4):783–94. https://doi.org/10.1097/GRF.0000000000000395.
51. Dahl C.M., Turok D., Heuser C.C. et al. Strategies for obstetricians and gynecologists to advance reproductive autonomy in a post-Roe landscape. Am J Obstet Gynecol. 2024;230(2):226–34. https://doi.org/10.1016/j.ajog.2023.07.055.
52. Einerson B.D., Watt M.H., Sartori B. et al. Lived experiences of patients with placenta accreta spectrum in Utah: a qualitative study of semistructured interviews. BMJ Open. 2021;11(11):e052766. https://doi.org/10.1136/bmjopen-2021-052766.
53. Bartels H.C., Horsch A., Cooney N. et al. Living with a diagnosis of Placenta Accreta Spectrum: Mothers' and Fathers' experience of the antenatal journey and the birth. PLoS One. 2023;18(5):e0286082. https://doi.org/10.1371/journal.pone.0286082.
54. Bartels H.C., Horsch A., Cooney N. et al. Living beyond placenta accreta spectrum: parent's experience of the postnatal journey and recommendations for an integrated care pathway. BMC Pregnancy Childbirth. 2022;22(1):397. https://doi.org/10.1186/s12884-022-04726-8.
55. Shainker S.A., Cornely R.M., Astake R., Hacker M.R. Patient perception of care, outcomes, and consequences from placenta accreta spectrum: a survey-based study. Am J Perinatol. 2024;41(S 01):е486–е493. https://doi.org/10.1055/a-1905-5079.
56. Bartels H.C., Lalor J.G., Walsh D. et al. Anesthesia and postpartum pain management for placenta accreta spectrum: the patient perspective and recommendations for care. Int J Gynaecol Obstet. 2024;164(3):992–1000. https://doi.org/10.1002/ijgo.15125.
57. Abi Habib P., Goetzinger K., Turan O.M. Placenta accreta spectrum conservative management and coagulopathy: case series and systematic review. Ultrasound Obstet Gynecol. 2024;63(6):731–7. https://doi.org/10.1002/uog.27547.
58. Marcellin L., Delorme P., Bonnet M.P. et al. Placenta percreta is associated with more frequent severe maternal morbidity than placenta accreta. Am J Obstet Gynecol. 2018;219(2):193.e1–193.e9. https://doi.org/10.1016/j.ajog.2018.04.049.
59. Pather S., Strockyj S., Richards A. et al. Maternal outcome after conservative management of placenta percreta at caesarean section: a report of three cases and a review of the literature. Aust N Z J Obstet Gynaecol. 2014;54(1):84–7. https://doi.org/10.1111/ajo.12149.
60. Clausen C., Lönn L., Langhoff-Roos J. Management of placenta percreta: a review of published cases. Acta Obstet Gynecol Scand. 2014;93(2):138– 43. https://doi.org/10.1111/aogs.12295.
61. Youssefzadeh A.C., Matsuzaki S., Mandelbaum R.S. et al. Trends, characteristics, and outcomes of conservative management for placenta percreta. Arch Gynecol Obstet. 2022;306(3):913–20. https://doi.org/10.1007/s00404-021-06384-1.
62. Sentilhes L., Kayem G., Deneux-Tharaux C. Conservative management or cesarean hysterectomy for placenta percreta? A subgroup analysis of the PACCRETA study is needed. Am J Obstet Gynecol. 2022;227(1):117–8. https://doi.org/10.1016/j.ajog.2022.01.029.
63. Shamshirsaz A.A., Fox K.A., Erfani H. et al. Multidisciplinary team learning in the management of the morbidly adherent placenta: outcome improvements over time. Am J Obstet Gynecol. 2017;216(6):612.e1– 612.e5. https://doi.org/10.1016/j.ajog.2017.02.016.
64. Erfani H., Fox K.A., Clark S.L. et al. Maternal outcomes in unexpected placenta accreta spectrum disorders: single-center experience with a multidisciplinary team. Am J Obstet Gynecol. 2019;221(4):337.e1–337.e5. https://doi.org/10.1016/j.ajog.2019.05.035.
65. Fitzgerald G.D., Newton J.M., Atasi L. et al. Pan-American Society for Placenta Accreta Spectrum. Placenta accreta spectrum care infrastructure: an evidence-based review of needed resources supporting placenta accreta spectrum care. Am J Obstet Gynecol MFM. 2024;6(1):101229. https://doi.org/10.1016/j.ajogmf.2023.101229.
66. Silver R.M., Fox K.A., Barton J.R. et al. Center of excellence for placenta accreta. Am J Obstet Gynecol. 2015;212(5):561–8. https://doi.org/10.1016/j.ajog.2014.11.018.
67. Nawrocki P.S., Levy M., Tang N. et al. Interfacility transport of the pregnant patient: a 5-year retrospective review of a Single Critical Care Transport Program. Prehosp Emerg Care. 2019;23(3):377–84. https://doi.org/10.1080/10903127.2018.1519005.
68. Sentilhes L., Kayem G., Ambroselli C. et al. Fertility and pregnancy outcomes following conservative treatment for placenta accreta. Hum Reprod. 2010;25(11):2803–10. https://doi.org/10.1093/humrep/deq239.
69. Salomon L.J., de Tayrac R., Castaigne-Meary V. et al. Fertility and pregnancy outcome following pelvic arterial embolization for severe postpartum haemorrhage. A cohort study. Hum Reprod. 2003;18(4):849–52. https://doi.org/10.1093/humrep/deg168.
70. Provansal M., Courbiere B., Agostini A. et al. Fertility and obstetric outcome after conservative management of placenta accreta. Int J Gynaecol Obstet. 2010;109(2):147–50. https://doi.org/10.1016/j.ijgo.2009.12.011.
71. Zhao H., Liu C., Fu H. et al. Subsequent pregnancy outcomes and risk factors following conservative treatment for placenta accreta spectrum: a retrospective cohort study. Am J Obstet Gynecol MFM. 2023;5(12):101189. https://doi.org/10.1016/j.ajogmf.2023.101189.
72. Kabiri D., Hants Y., Shanwetter N. et al. Outcomes of subsequent pregnancies after conservative treatment for placenta accreta. Int J Gynaecol Obstet. 2014;127(2):206–10. https://doi.org/10.1016/j.ijgo.2014.05.013.
73. Baldwin H.J., Nippita T.A., Torvaldsen S. et al. Outcomes of subsequent births after placenta accreta spectrum. Obstet Gynecol. 2020;136(4):745– 55. https://doi.org/10.1097/AOG.0000000000004051.
74. Roeca C., Little S.E., Carusi D.A. Pathologically diagnosed placenta accreta and hemorrhagic morbidity in a subsequent pregnancy. Obstet Gynecol. 2017;129(2):321–6. https://doi.org/10.1097/AOG.0000000000001843.
75. Javinani A., Qaderi S., Hessami K. et al. Delivery outcomes in the subsequent pregnancy following the conservative management of placenta accreta spectrum disorder: a systematic review and metaanalysis. Am J Obstet Gynecol. 2024;230(5):485–492.e7. https://doi.org/10.1016/j.ajog.2023.10.047.
Об авторах
М. Д. ВоронинаРоссия
Воронина Марьяна Дмитриевна
344022 Ростов-на-Дону, Нахичеванский переулок, д. 29
Д. А. Долгиев
Россия
Долгиев Джамалейл Алиханович
344022 Ростов-на-Дону, Нахичеванский переулок, д. 29
Р. А. Долгиева
Россия
Долгиева Раисхан Алихановна
344022 Ростов-на-Дону, Нахичеванский переулок, д. 29
А. С. Мироваева
Россия
Мироваева Анастасия Сергеевна
344022 Ростов-на-Дону, Нахичеванский переулок, д. 29
З. Ф. Гараева
Россия
Гараева Залия Фаритовна
426056 Ижевск, ул. Коммунаров, д. 281
Ю. К. Иванова
Россия
Иванова Юлия Константиновна
197022 Санкт-Петербург, ул. Льва Толстого, д. 6–8
И. В. Сарапульцев
Россия
Сарапульцев Илья Владимирович
610027 Киров, ул. Карла Маркса, д. 112
Е. И. Турдиева
Россия
Турдиева Елизавета Игоревна
344022 Ростов-на-Дону, Нахичеванский переулок, д. 29
В. А. Раков
Россия
Раков Владимир Андреевич
191015, Санкт-Петербург, ул. Кирочная, д. 41
В. К. Куклина
Россия
Куклина Вероника Константиновна
191015, Санкт-Петербург, ул. Кирочная, д. 41
А. Е. Манелов
Россия
Манелов Александр Евгеньевич
191015, Санкт-Петербург, ул. Кирочная, д. 41
К. Х. Халилова
Россия
Халилова Кифаят Хаял кызы
443099 Самара, ул. Чапаевская, д. 89
Что уже известно об этой теме?
► В настоящее время основным методом лечения placenta accrete spectrum (PAS) является перипартальная гистерэктомия, которая характеризуется высокой частотой после-
операционных осложнений и невозможностью планирования беременности.
► Акушеры-гинекологи все чаще обращаются к альтернативным методам лечения PAS, которые позволяют сохранить матку и снизить риск осложнений, обеспечивая женщинам возможность иметь детей в будущем.
► Методами лечения PAS, позволяющими сохранить матку, являются резекция-реконструкция матки и отсроченная интервальная гистерэктомия.
Что нового дает статья?
► Органосохраняющее лечение требует больше времени, но снижает риск осложнений и улучшает качество жизни женщины в будущем. Перипартальная гистерэктомия эффективна в краткосрочной перспективе, но связана с более высоким риском осложнений.
► Органосохраняющее лечение PAS позволяет избежать серьезной операции и сохранить возможность иметь детей в будущем, однако длительное послеродовое наблюдение может быть болезненным и неудобным. Важно, чтобы беременная участвовала в принятии решений, даже если по медицинским или логистическим причинам предпочтительна одна из стратегий.
► Показатели фертильности у лиц с PAS не изменяются после органосохраняющего лечения. По данным исследований, 83–89 % пациенток смогли забеременеть в среднем через 17,3 месяца. Все беременности, сохранившиеся после I триместра, заканчивались рождением здорового ребенка.
Как это может повлиять на клиническую практику в обозримом будущем?
► Органосохраняющее лечение PAS позволяет сохранить фертильность женщины, что крайне важно в условиях современной демографической ситуации.
► Органосохраняющее лечение может потребовать больше времени для достижения желаемого результата, но при этом оно может снизить риск осложнений и улучшить качество жизни женщины в долгосрочной перспективе. В то же время перипартальная гистерэктомия может быть более эффективной в краткосрочной перспективе, но она сопряжена с более высоким риском осложнений.
► Возможность сохранения матки с плацентой in situ и последующего органосохраняющего ведения позволяет подходить к лечению индивидуально, учитывая желания и потребности каждой пациентки.
Рецензия
Для цитирования:
Воронина М.Д., Долгиев Д.А., Долгиева Р.А., Мироваева А.С., Гараева З.Ф., Иванова Ю.К., Сарапульцев И.В., Турдиева Е.И., Раков В.А., Куклина В.К., Манелов А.Е., Халилова К.Х. Современное состояние вопроса placenta accreta spectrum: перспективы органосохраняющего лечения. Акушерство, Гинекология и Репродукция. 2025;19(1):82-96. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.571
For citation:
Voronina M.D., Dolgiev D.A., Dolgieva R.A., Mirovaeva A.S., Garaeva Z.F., Ivanova Yu.K., Sarapultsev I.V., Turdieva E.I., Rakov V.A., Kuklina V.K., Manelov A.E., Khalilova K.Kh. Current state of the placenta accreta spectrum issue: prospects for organ-preserving treatment. Obstetrics, Gynecology and Reproduction. 2025;19(1):82-96. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.571

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































