Перейти к:
Влияние факторов окружающей среды на репродуктивное здоровье женщины
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.564
Аннотация
Введение. Окружающая среда, несомненно, влияет на физиологические процессы в организме человека, и это влияние может быть как благоприятным, так и вредным. С 2011 по 2021 гг. в России количество случаев женского бесплодия увеличилось на треть, и в 2021 г. этот показатель достиг 789,1 случая на 100 тыс. женщин.
Цель: оценить влияние факторов окружающей среды, в том числе химических веществ, нарушающих работу эндокринной системы (англ. endocrine disrupting chemicals, EDC) на репродуктивное здоровье женщин на основании анализа данных литературы.
Материалы и методы. Поиск исследований проводили по базам данных научной литературы до апреля 2024 г. В результате поиска было обнаружено 5732 статей в базе данных PubMed/MEDLINE, 6587 в Googl eScholar и 2350 в eLibrary. Публикации отбирали в соответствии с рекомендациями PRISMA. В обзор было включено 90 публикаций.
Результаты. Экспериментальные и эпидемиологические исследования, посвященные изучению фертильности, показали, что такие факторы окружающей среды, как климат, температура, сезонность, радиация, загрязнение воздуха, характер питания и энергетический баланс, рабочая среда, вредные привычки (например, курение), EDC (пластификаторы, тяжелые металлы, парабены, пестициды, промышленные химикаты и их побочные продукты, лекарства, перфторохимикаты, антибактериальные средства) могут быть связаны с нарушением репродуктивной функции женщин.
Заключение. Факторы окружающей среды, включая EDC, имеют значительное влияние на репродуктивное здоровье женщин и могут негативно сказываться на фертильности. Основные выводы текущих исследований подтверждают необходимость повышения осведомленности о рисках, связанных с воздействием химических веществ на организм.
Ключевые слова
Для цитирования:
Жирнов И.А., Назмиева К.А., Хабибуллина А.И., Ильясова Л.А., Саидмурсалова Н.С., Демишева Р.Р., Алихаджиева П.Е., Солтагереева А.Х., Головня А.А., Кахрамонова А.В., Джалилов И.М., Галимова У.У. Влияние факторов окружающей среды на репродуктивное здоровье женщины. Акушерство, Гинекология и Репродукция. 2024;18(6):858-873. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.564
For citation:
Zhirnov I.A., Nazmieva K.A., Khabibullina A.I., Ilyasova L.A., Saidmursalova N.S., Demisheva R.R., Alikhadzhieva P.E., Soltagereeva A.Kh., Golovnya A.A., Kakhramonova A.V., Dzhalilov I.M., Galimova U.U. The influence of environmental factors on woman's reproductive health. Obstetrics, Gynecology and Reproduction. 2024;18(6):858-873. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.564
Введение / Introduction
Факторы окружающей среды, безусловно, оказывают воздействие на физиологию человека, данное воздействие может быть как положительным, так и отрицательным. К факторам окружающей среды относятся климат, температура, время года, радиация, загрязняющие вещества в воде, воздухе и почве, рабочая среда, факторы питания, химические вещества, нарушающие работу эндокринной системы (англ. еndocrine disrupting chemicals, EDC), а также алкоголь, табак и наркотики. Факторы окружающей среды не только влияют на биологические функции человека, но и формируют социальную и поведенческую среду [1].
Значительное число химических веществ, обнаруживаемых в окружающей среде, обладают свойствами, нарушающими работу эндокринной системы. Согласно определению Всемирной организации здравоохранения, EDC – это экзогенное вещество или смесь, которые изменяют функцию эндокринной системы и, следовательно, вызывают неблагоприятные последствия для здоровья интактного организма, его потомства или (суб) популяций [2]. Кроме того, многие вещества, которые никогда не были признаны EDC, могут действовать аналогичным образом. EDC проявляют разрушительную активность как сами по себе, так и в составе смеси, оказывая влияние на гормональные сигнальные пути. Их активность проявляется через связывание с рецепторами. Там они действуют антагонистическим или агонистическим образом (ингибируя или стимулируя их, соответственно). Кроме того, они нарушают работу ферментов, вызывают окислительный стресс, а также эпигенетические и даже трансгенерационные изменения. Как у мужчин, так и у женщин была выявлена отрицательная корреляция между уровнями EDC в окружающей среде и репродуктивной функцией [3][4]. Большинство имеющихся на сегодняшний день исследований были сосредоточены на таких категориях EDC, как тяжелые металлы (кадмий, свинец, ртуть, мышьяк), пластификаторы (бисфенолы, фталаты), пестициды, парабены, промышленные химикаты и их побочные продукты (например, бромированные антипирены, полихлорированные дифенилы, диоксины), антибактериальные средства (триклозан), перфторохимикаты и медикаменты (диэтилстильбэстрол).
На протяжении многих лет уровень бесплодия в разных частях мира оценивался в диапазоне от 8 до 18 %, при этом чаще встречалось вторичное бесплодие. Но согласно результатам метаанализа, проведенного в 2022 г. на основе 32 исследований с низким риском систематической ошибки и участием 124 556 женщин, общий уровень женского бесплодия составил 46,3 %. При этом первичное бесплодие оказалось более распространенным (51,5 %), чем вторичное (48,5 %) [5]. С 2011 по 2021 гг. в России количество случаев женского бесплодия увеличилось на треть. В 2021 г. этот показатель достиг 789,1 случая на 100 тыс. женщин [6]. Из-за бесплодия (как женского, так и мужского) суммарные потери потенциальных рождений составляют от 17 до 21 % [6]. Бесплодие у женщин считается фактором риска развития рака молочной железы, эндометрия и яичников, а также увеличения распространенности метаболического синдрома, неблагоприятных сердечно-сосудистых событий и смерти [4]. Диагноз идиопатического бесплодия ставится, когда причина не выявлена после завершения стандартных исследований фертильности. На его долю приходится почти 40 % случаев женского бесплодия и от 8 до 28 % случаев бесплодия в супружеских парах. Частота идиопатического бесплодия, о которой сообщалось, варьируется в зависимости от возраста и критериев отбора в исследуемой популяции [7]. За последние годы были получены данные, свидетельствующие о том, что многие случаи идиопатического бесплодия связаны с EDC или прямым и/или косвенным воздействием факторов окружающей среды [8][9].
Цель: оценить влияние факторов окружающей среды, в том числе химических веществ, нарушающих работу эндокринной системы (EDC), на репродуктивное здоровье женщин на основании анализа данных литературы.
Материалы и методы / Materials and Methods
Поиск исследований проводился по базам данных eLibrary, PubMed/MEDLINE, а также Google Scholar до апреля 2024 г. Для поиска исследований были использованы следующие ключевые слова, а также их сочетания на русском и английском языках: «экологические факторы», «окружающая среда», «алкоголь», «табак», «кофеин», «расстройства пищевого поведения», «загрязнение воздуха», «высокая температура», «ожирение», «низкая температура», «репродуктивное здоровье женщины», «химические вещества, разрушающие эндокринную систему», «экстракорпоральное оплодотворение», «репродукция», «бесплодие», «нарушение созревания яйцеклеток», «ановуляция», «нарушение транспортировки эмбрионов и неудачная имплантация», «эпигенетика», «environmental factors», «environment», «alcohol», «tobacco», «caffeine», «eating disorders», «air pollutant», «hot temperature», «obesity», «cold temperature», «EDC and female fertility», «in vitro fertilization», «reproduction», «infertility», «disrupted oocyte maturation», «anovulation», «deranged embryo transportation and implantation failure», «epigenetic». Помимо анализа результатов поиска в соответствующих базах данных, вручную анализировали списки литературы соответствующих обзоров и статей, включенных в уже отобранные исследования. Идентификация исследований основывалась на тексте, аннотации, ключевых словах и названии. Автоматические оповещения, установленные на вышеуказанные ключевые слова, выявляли недавно опубликованные исследования. Публикации отбирали в соответствии с рекомендациями PRISMA. Все авторы независимо друг от друга проводили поиск публикаций, в случае возникновения разногласий разрешали их путем консенсуса.
В результате поиска было обнаружено 5732 статей в базе данных PubMed/MEDLINE, 6587 в Google Scholar и 2350 в Elibrary. На первом этапе исключали дубликаты, на этапе скрининга аннотации и названия обнаруженных исследований оценивали на соответствие теме настоящего обзора. На следующем этапе проводилась оценка приемлемости на предмет соответствия следующим критериям включения: исследование опубликовано на русском или английском языке; исследование опубликовано в рецензируемом научном издании; исследование проводилось на людях, животных или in vitro; иссследование является обзором литературы или оригинальным и включает вышеуказанные ключевые слова; в исследовании описаны изменения в органах женской репродуктивной системы или репродуктивные результаты после воздействия факторов внешней среды, включая EDC. В конечном итоге в обзор было включено 90 исследований, подробный алгоритм поиска представлен на рисунке 1.
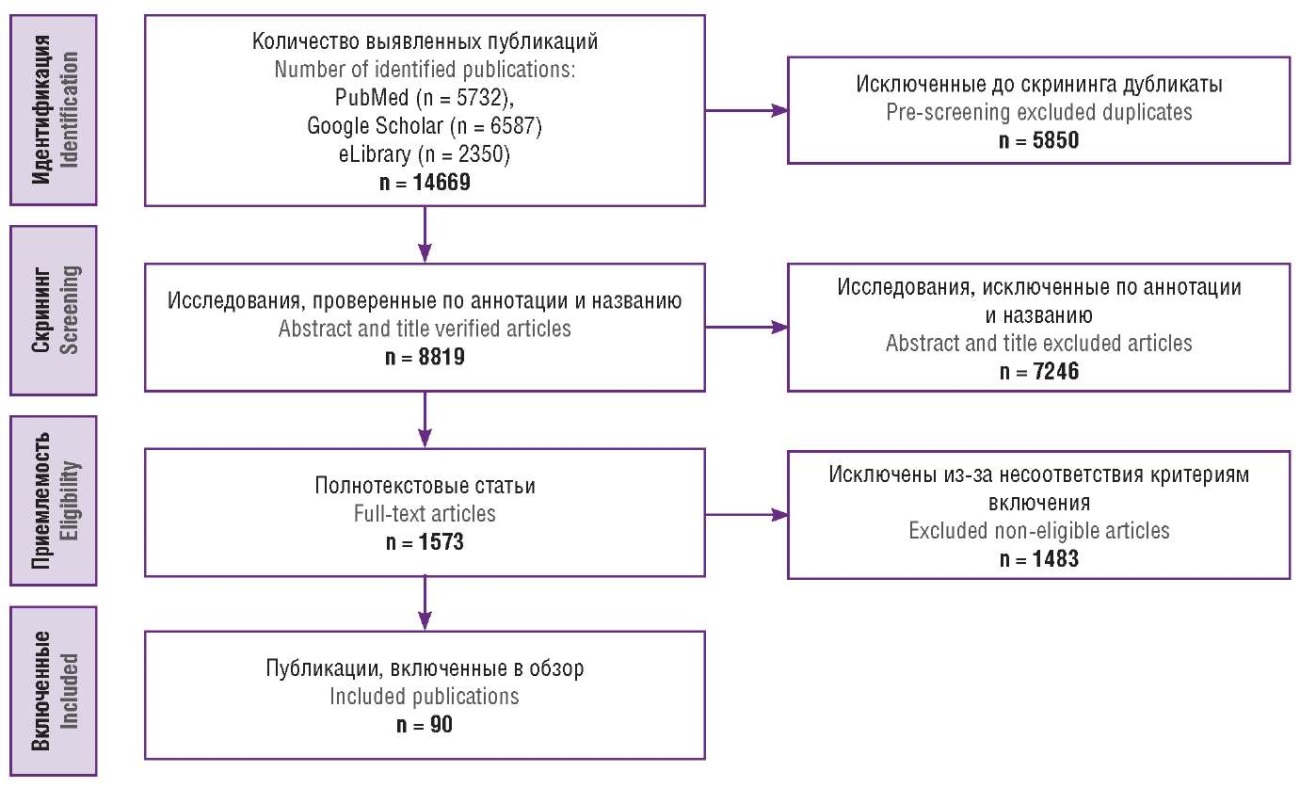
Рисунок 1. Алгоритм поиска публикаций.
Figure 1. Publication search algorithm.
Результаты / Results
Нарушение женского репродуктивного здоровья в результате воздействия факторов окружающей среды / Disorders of female reproductive system due to environmental factors
Исследования на животных / Animal studies
Воздействие бисфенола А (англ. bisphenol A, BPA) на мышей в раннем возрасте снижает способность яйцеклеток к оплодотворению в более позднем возрасте. Более конкретно, BPA снижал частоту оплодотворения яйцеклеток, независимо от используемого метода оплодотворения: естественного или экстракорпорального оплодотворения (ЭКО) [10]. С другой стороны, воздействие бисфенола на эмбрионы самок мышей внутриутробно отрицательно сказалось на их фертильности (снижение частоты наступления беременности), а также на индексе фертильности эмбрионов самок мышей следующего поколения (поколение F3), возможно, за счет эпигенетических модификаций [11]. У мышей линии CD-1 при гестационном воздействии ди-(2-этилгексил) фталата (англ. di(2-ethylhexyl) phthalate, DEHP) в дозах 20 и 200 мкг/кг в день, которое отражает уровень профессионального облучения человека, индекс фертильности потомства женского пола (поколение F1) снижался. Однако это не повлияло на индекс фертильности последующего поколения самок мышей. Воздействие DEHP в дозе 500 мг/кг/день на потомство было обратно пропорционально индексу беременности у самок мышей поколения F2. Во всех трех поколениях самок мышей (F1, F2 и F3) отмечалось нарушение эстрального цикла, а также ускорение начала и прогрессирования полового созревания [12]. Что касается пестицидов, то непрямое воздействие на самок крыс повышенной дозы смеси фосфорорганических пестицидов (ФП) в период внутриутробного развития приводило к снижению частоты наступления беременности и живорождения [13]. Воздействие диэтилстильбэстрола (англ. diethylstilbestrol, DES), синтетического эстрогена, который обычно назначают в качестве лекарственного средства для профилактики невынашивания беременности, на рацион самок мышей в перипубертатный или постменопаузальный периоды препятствует имплантации эмбриона, что в конечном итоге снижает фертильность [14].
Исследования женщин / Women’s studies
Метаанализ 22 исследований, проведенный с целью оценки влияния сезонности на фертильность женщин, показал, что повышение температуры окружающей среды во время родов в разных географических зонах повлияло на показатели фертильности (суммарный коэффициент рождаемости и относительный риск рождения ребенка) как положительно, так и отрицательно в дальнейшей жизни [15]. Интересно, что большая высота над уровнем моря и повышенная влажность (оцениваемая по среднему уровню осадков) во время родов имели положительную корреляцию с вышеуказанными показателями фертильности. Следует отметить, что у женщин, живущих в радиусе 0,5 км от высоковольтных линий электропередач, по сравнению с женщинами, живущими на расстоянии более 1,0 км от этих линий, электромагнитное излучение вызывало почти в 4,5 раза больший риск идиопатического бесплодия [6]. В систематическом обзоре, который включал 11 исследований, авторы изучили влияние загрязняющих веществ в воздухе на успешное зачатие. Таким образом, концентрация диоксида серы (SO2) имела отрицательную корреляцию с частотой зачатия после первой попытки, в то время как воздействие повышенных уровней транспортных загрязняющих веществ (их оценка основывалась на близости жилых домов к крупным автомагистралям) отрицательно коррелировала с успешным зачатием в течение 1 года после первой попытки [16].
Следует отметить, что чрезмерные физические нагрузки также связаны с повышенным риском бесплодия из-за нарушений менструального цикла, независимо от степени ожирения [17]. Однако сообщалось о восстановлении овуляции после умеренных физических нагрузок и/или снижения массы тела у женщин с ожирением. Нарушение овуляторной функции было обнаружено у женщин, которые потребляли меньше моно- или полиненасыщенных жирных кислот (ПНЖК) по сравнению с трансжирными кислотами [18]. Это явление было объяснено усилением воспалительной активности и резистентностью к инсулину. Потребление повышенного количества животного белка связано с овуляторным бесплодием. С другой стороны, потребление белка растительного происхождения обеспечивает защиту от овуляторной дисфункции, вероятно, из-за повышения чувствительности к инсулину [19]. Так, среди 2145 женщин в Испании наибольшая приверженность средиземноморской диете была связана со снижением риска нарушения зачатия на 44 % по сравнению с женщинами, которые имели наименьшую приверженность этой диете [20]. Наконец, воздействие конечных продуктов повышенного гликирования (англ. advanced glycation end-products, AGEs), возникающее в результате употребления продуктов с высокой степенью обработки (фаст-фуд), обратно пропорционально влияет на функцию яичников. Действительно, внутриутробное отложение AGEs вызывает воспаление, развитие окислительного стресса, резистентность к инсулину и последующую овуляторную дисфункцию [21].
Что касается продолжительности рабочего дня, то работа в течение более 52 ч в неделю была связана с бесплодием у корейских женщин моложе 40 лет [22]. У бесплодных женщин были обнаружены значительно более высокие концентрации BPA в сыворотке крови по сравнению с контрольной группой с нормальной фертильностью [23]. Повышенные концентрации свинца (Pb) в сыворотке крови среди женщин в Бангладеш имели положительную корреляцию с повышенным риском идиопатического бесплодия [7]. Концентрация кадмия (Cd), измеренная в биоптатах эндометрия, взятых в период с 20-го по 24-й день менструального цикла (период ожидаемой имплантации), была значительно выше у женщин с идиопатическим бесплодием по сравнению с фертильными женщинами. Токсичность кадмия для репродуктивной системы была обусловлена такими механизмами, как нарушение овуляции, ингибирование стероидогенеза, дисфункция эндометрия и неудачная имплантация [8]. Концентрация парабенов в моче (этил- и метилпарабенов) у женщин до зачатия была связана с отрицательными показателями зачатия в течение 1 года наблюдения (снижение плодовитости пар на 34 %) в общей популяции [24]. Что касается промышленных химикатов и побочных продуктов, авторы обнаружили линейную зависимость между концентрациями в сыворотке крови соединений полихлорированных бифенилов (ПХБ) с низким содержанием хлора и риском ановуляции [25]. В исследовании Seveso Women's Health Study 10-кратное увеличение концентрации 2,3,7,8-тетрахлордибензодиоксина (ТХДД) в сыворотке крови женщин было связано примерно с 2-кратным увеличением риска бесплодия [26]. Пренатальное воздействие DES у 4653 женщин было связано с повышенным совокупным риском бесплодия в течение их репродуктивной жизни [27]. В ходе исследований было показано, что многие из наиболее изученных EDC, такие как Pb, DEHP, BPA, ПХБ, парабены и триклозан, изменяют функциональность и состав кишечной микробиоты. Эти изменения могут нарушать женскую фертильность через механизмы, влияющие на метаболизм эстрогенов, микробиоту половых путей или иммунную систему, способствуя возникновению патологий, которые включают синдром поликистозных яичников, эндометриоз и преждевременную недостаточность яичников [28].
Токсичность EDC для женской репродуктивной системы / EDC toxicity to female reproductive system
Токсичность EDC для яйцеклеток, фолликулов и яичников / EDC toxicity to oocytes, follicles and ovaries
Нарушение фолликулогенеза, изменение экспрессии генов, участвующих в стероидогенезе, а также генов, регулирующих клеточный цикл, апоптоз и пролиферацию, наблюдались in vitro в фолликулах яичников мышей, получавших BPA [29]. Воздействие фторированного BPA (ВРАF), гомолога BPA, который был произведен в качестве заменителя BPA, было связано с нарушением созревания яйцеклетки и эпигенетическими изменениями. Более конкретно, в эксперименте in vitro воздействие BPAF на ооциты мыши в течение 14 ч ингибировало их созревание, что отражалось в снижении скорости экструзии первого полярного тельца при всех дозировках BPAF. Обработка 100 мкм BPAF в течение 12 ч влияла на модификацию гистонов, вызывая окислительный стресс, повреждение ДНК и нарушения внешнего вида веретена деления [30].
Влияние курения табака на женскую фертильность изучалось на животных моделях, которые вдыхали табачный дым через нос, либо находились в закрытом задымленном пространстве (имитируя активное или пассивное курение, соответственно). Впоследствии курение имело положительную корреляцию с уменьшением объема яичников и количества примордиальных фолликулов, а также с усилением окислительного повреждения яичников. Повышенная апоптотическая активность или повышенная аутофагия были продемонстрированы в случаях вдыхания табачного дыма через нос или в условиях пассивного курения, соответственно [31–33].
Аналогичным образом, воздействие высоких доз BPAF (90 мг/кг/сут) с пищей на экспериментальную мышиную модель эндометриоза приводило к нарушению стероидогенеза яичников и эстрального цикла. В том же эксперименте воздействие как BPA, так и BPAF в широком диапазоне доз (3, 30 или 90 мг/кг/сут) приводило к увеличению числа атретированных яйцеклеток [34]. В случае, когда крысы в течение 28 дней подвергались воздействию мышьяка (As) через загрязненную питьевую воду в концентрациях, обычно встречающихся в питьевой воде Западной Бенгалии в Индии, наблюдалась токсичность для яичников, а также снижение массы яичников, количества фолликулов, диаметра матки и увеличение атрезии фолликулов, истончение миометрия и эндометрия [35]. В противном случае, когда новорожденные крысы подвергались воздействию различных доз бутил-, метил- или пропилпарабена, ранняя фаза фолликулогенеза подавлялась, и экспрессия генов, участвующих в стероидогенезе, нарушалась, в то время как воздействие различных доз парабена на крыс в перипубертатном периоде приводило к уменьшению количества желтых тел в яичниках и истончению фолликулярного эпителия, а также к увеличению частоты обнаружения кистозных фолликулов. У животных, получавших бутил-, изобутил-, пропил- и изопропилпарабены наблюдалась гипертрофия миометрия [36][37]. Введение крысам бутилпарабена на протяжении всей беременности и лактации, по-видимому, не влияло на функцию и развитие яичников у самок потомства [38][39]. Однако, когда крысы получали бутилпарабен во время беременности и в период лактации, наблюдалось уменьшение аногенитального расстояния и массы яичников в препубертатном периоде [38]. Экспериментальные исследования показывают, что ряд пестицидов может отрицательно влиять на фолликулогенез и функцию яичников. У крыс линии Вистар, получавших смесь пестицида процимидона и DEHP в пренатальный период, а также в период лактации, наблюдалось увеличение числа первичных фолликулов в период предпубертатного созревания, что, возможно, отражает ускоренную потерю их фолликулярных резервов. Введение аллетрина, пиретроидного инсектицида, белым самкам крыс линии Вистар с 6-го дня беременности до родов отрицательно влияло на рост фолликулов самок в предпубертатном периоде, вызывая окислительный стресс и апоптоз, связанный с аутофагией [40][41]. У грызунов метоксихлор и глифосат были связаны с увеличением частоты атрезии фолликулов, в то время как метоксихлор, бета-циперметрин и глифосат были связаны с нарушением роста фолликулов [42][43]. Глифосат влияет на стероидогенез яичников и вызывает окислительный стресс [43–45]. Перинатальное воздействие на самок крыс антиандрогенных пестицидов линурона, диметоморфа и имазалила приводило к изменению экспрессии генов яичников, что ассоциировалось с задержкой созревания фолликулов и их пополнением в период предпубертатного периода [46]. Введение мышам DES приводило к нарушению созревания фолликулов яичников и увеличению числа атретичных антральных фолликулов [47]. N. Roy с соавт. описали, что в яичниках грызунов, получавших ТХДД, наблюдалось уменьшение количества антральных фолликулов, нарушение экспрессии генов, связанных со стероидогенезом, и дефекты овуляции [48]. В исследованиях, проведенных in vitro, воздействие на фолликулярные клетки повышенных концентраций дибутилфталата (ДБФ) приводило к нарушению роста, снижению жизнеспособности, нарушению регуляции клеточного цикла и дефектному стероидогенезу [49][50]. В исследовании in vivo мышей в течение 28 дней подвергали воздействию повышенных концентраций мелкодисперсных преимущественно твердых частиц диаметром 2,5 мкм (particulate matters, PM2.5) путем интратрахеального введения. По результатам исследования наблюдался ускоренный апоптоз яйцеклеток и гранулоцитов. Сообщалось о повышении частоты митохондриальной дисфункции в яйцеклетках, а также снижении скорости образования бластоцист и плохом качестве эмбрионов у мышей, подвергшихся воздействию средних и высоких доз PM2.5 [51].
Токсичность EDC для фаллопиевых труб / EDC toxicity to fallopian tubes
Существует ограниченное количество данных о влиянии EDC и других факторов окружающей среды на морфологию и функцию маточных труб. У мышей, подвергшихся внутриутробному воздействию BPA в дозах, соответствующих диапазону уровней воздействия на человека, в возрасте 16–18 мес повышается риск развития кист яичников или цистаденом, пролиферативных поражений маточных труб и матки (включая предраковые); при раннем воздействии (в течение первых 3 дней беременности) это может привести к снижению скорости развития бластоцист и задержке транспортировки эмбрионов по яйцеводу [52][53].
Токсичность EDC для эндометрия / EDC toxicity to the endometrium
У грызунов, получавших различные дозы BPA в раннем пренатальном или постнатальном периоде, количество имплантаций сократилось. Более того, у мышей, получавших BPA после отлучения от груди, наблюдалось снижение экспрессии молекул, участвующих в сигнальном пути, который регулирует восприимчивость матки и опосредован прогестероном [53–56]. Воздействие BPA или комбинации бисфенола с триклозаном на ранних сроках беременности мышей приводило к отсутствию мест имплантации или уменьшению их количества, соответственно [57]. У крыс развилась гиперплазия эндометрия, когда они непосредственно подверглись воздействию повышенных доз смеси ФП, в то время как у их потомства женского пола наблюдалось увеличение массы матки [13]. Исследования на животных свидетельствуют о том, что хроническое воздействие ПХБ, содержащихся в промышленных химикатах и побочных продуктах, увеличивает риск хронического воспаления матки, а также заболеваемость плоскоклеточным раком [58]. У крыс воздействие ТХДД имело положительную корреляцию с развитием воспаления и поражений матки, в то время как у мышей – с неудачей имплантации [58][59].
Биомаркеры снижения децидуализации (пролактин и активность протеинкиназ) были обнаружены в питательных средах для стромальных клеток эндометрия, культивируемых в течение 9 дней с пестицидами – перфтороктановым сульфонатом (ПФОС), гексахлорбензолом (ГХБ) и 4,4'-дихлордифенилдихлорэтаном (4,4-ДДЭ). Клетки эндометрия были собраны после гистерэктомии во время пролиферативной фазы менструального цикла у здоровых женщин. Снижение концентрации пролактина также наблюдалось после воздействия BPA [60]. Кроме того, ТХДД может негативно влиять на функцию эндометрия. В совместной культуре клеток трофобласта и эндометрия инкубация с ТХДД приводила к подавлению имплантации через ариловый углеводородный рецептор [61].
Влияние факторов окружающей среды на эффективность вспомогательных репродуктивных технологий / Impact of environmental factors on the effectiveness of assisted reproductive technologies
Общие положения / Background
Сезонность может существенно повлиять на результаты ЭКО. Так, было установлено, что показатели оплодотворяемости и качества эмбрионов класса А являются самыми высокими весной и самыми низкими осенью [62]. Что касается влияния загрязнителей воздуха на исходы беременности у женщин, проходящих ЭКО, то было показано, что воздействие содержащихся в воздухе PM2.5 отрицательно влияет на частоту зачатия, в то время как снижение живорождаемости было связано с воздействием озона (O3) или диоксида азота (NO2) [16]. У женщин, проходящих терапию бесплодия с использованием вспомогательных репродуктивных технологий (ВРТ), ожирение или избыточная масса тела были связаны с нарушением качества яйцеклеток и овуляции, а также с нарушением восприимчивости эндометрия [63].
Что касается влияния диеты на женскую фертильность, то у женщин, которые прошли ЭКО по поводу бесплодия и придерживались средиземноморской диеты, вероятность наступления беременности была на 40 % выше, чем у тех, кто этого не делал, что было связано с увеличением потребления витамина В6 и растительных масел [64]. В последующем исследовании, проведенном в Греции, приверженность средиземноморской диете у женщин моложе 35 лет, не страдающих ожирением, но не у женщин старше 35 лет, которым было предложено ЭКО, была связана с повышенной вероятностью клинической беременности и живорождения [65]. Наконец, в китайском исследовании повышенная приверженность женщин, перенесших ЭКО, средиземноморской диете привела к значительному увеличению выхода эмбрионов, но не к увеличению частоты имплантации или клинической беременности [66].
У женщин, получавших лечение методами ВРТ, не было выявлено убедительной взаимосвязи между курением и фертильностью. Так, некоторые исследования показали, что курение связано со снижением выхода яйцеклеток и качества эмбрионов, снижением уровня беременности и живорождения, в то время как в других исследованиях не было обнаружено никакой связи с какими-либо измеряемыми показателями фертильности [67–70]. В исследованиях, изучавших влияние определенных EDC, отрицательное или нейтральное влияние на частоту оплодотворения было связано с повышением концентрации BPA в моче у женщин, получавших терапию методами ВРТ [71][72]. Сообщалось, что у бесплодных женщин концентрация BPA в сыворотке крови была повышена, в то время как концентрация BPA в сыворотке и фолликулярной жидкости у женщин с идиопатическим бесплодием, перенесших интрацитоплазматическую инъекцию сперматозоидов (ИКСИ), отрицательно коррелировала с качеством эмбрионов, снижением частоты наступления беременности и живорождения [9][22]. Однако в США у женщин, проходивших ЭКО в рамках исследования EARTH (англ. Environment and Reproductive Health) с 2006 по 2017 гг., не было обнаружено никакой связи между концентрациями парабенов, ВРА и фталатов в моче и каким-либо влиянием на фертильность. Однако повышенные концентрации DEHP были обратно пропорционально связаны с успешной имплантацией, наступлением беременности или живорождением, авторы изучали данные за первую половину периода исследования (2006–2012 гг.), когда воздействие EDC было повышенным [73]. У женщин, проходивших процедуру ЭКО, не сообщалось о какой-либо взаимосвязи между результатами ВРТ и концентрацией ртути (Hg) в волосах или с концентрацией парабенов в моче [74][75]. Концентрация ПХБ в фолликулярной жидкости была отрицательно связана с результатами ЭКО, такими как реакция на стимуляцию яичников, овариальный резерв, частота оплодотворения, качество эмбрионов, имплантация и живорождение [76]. Наконец, у женщин, проходивших процедуру ЭКО, более высокая концентрация триклозана в моче коррелировала со снижением качества формирования эмбрионов и частоты имплантации [77].
Токсичность EDC для яйцеклеток / EDC toxicity to oocytes
Что касается эффекта EDC при использовании методов ВРТ у человека, то повышенные концентрации BPA в моче были связаны с уменьшением количества яйцеклеток в метафазе II или извлеченных яйцеклеток и более низкими концентрациями эстрадиола на пике [71]. С другой стороны, концентрация неконъюгированного BPA в сыворотке крови не влияла на созревание яйцеклеток, однако это отрицательно сказалось на оплодотворении яйцеклеток [78]. Результаты эпидемиологических исследований у женщин, перенесших ЭКО, противоречивы; в одном исследовании не сообщалось о каком-либо влиянии на количество извлеченных яйцеклеток после воздействия фталатов [79], в то время как в исследовании EARTH, проводившемся с 2004 по 2012 гг., самые высокие квартильные концентрации DEHP в моче отрицательно коррелировали с выходом и количеством зрелых яйцеклеток [80]. В группе шведских женщин, проходивших терапию бесплодия методами ВРТ, более высокие концентрации общего количества метаболитов DEHP в фолликулярной жидкости были связаны с меньшим индексом чувствительности яичников (количество извлеченных яйцеклеток/общее количество используемых доз фолликулостимулирующего гормона или человеческого менопаузального гонадотропина), а у эстонских женщин, проходящих терапию методами ВРТ, более высокие концентрации метилпарабена в фолликулярной жидкости были ассоциированы с меньшим индексом чувствительности яичников [81]. У женщин из Италии, проживающих в Таранто, высокоразвитом промышленном городе, концентрация тяжелых металлов, включая хром (Cr) и Pb, в фолликулярной жидкости была выше. У этих женщин значительно уменьшилось количество извлеченных зрелых яйцеклеток, снизилась экспрессия ароматазы и снизился уровень эстрадиола. По мнению авторов, нарушение фолликулогенеза, вероятно, было достигнуто с помощью механизма, опосредованного ариловыми углеводородными рецепторами [82]. Интересно, что концентрация триклозана в моче была связана с увеличением исходного количества антральных фолликулов и извлеченных яйцеклеток у женщин, проходящих терапию методами ВРТ [77].
Токсическое влияние EDC на имплантацию / EDC toxic effects on implantation
Беременные мыши, которым подкожно вводили повышенные дозы BPA, демонстрировали нарушения имплантации [56]. У женщин, проходивших процедуру ЭКО, концентрация BPA в моче была обратно пропорциональна успешности имплантации [83]. Что касается триклозана, то частота имплантации была значительно снижена (27,6 %) у женщин с концентрацией триклозана в моче (на уровне/или выше медианы) по сравнению с частотой имплантации (50 %), о которой сообщалось у женщин с концентрацией триклозана в моче ниже медианы [77].
Трансгенерационные нарушения / Transgenerational disorders
Трансгенерационные нарушения — это изменения, которые передаются от одного поколения к другому и могут влиять на здоровье и физиологические характеристики последующих поколений. EDC могут влиять на другие поколения, которые не подвергались их непосредственному воздействию, вызывая эпигенетические изменения. Такие изменения (например, метилирование ДНК, некодирующие РНК, модификация гистонов) могут привести к изменению экспрессии важнейших генов, участвующих в репродуктивном процессе, таких как гены, участвующие в стероидогенезе или фолликулогенезе.
Воздействие на бычьи кумулюсные клетки, кумулюсно-яйцеклеточные комплексы и оплодотворенные эмбрионы минимальной дозой BPA в отношении побочных эффектов приводило к значительным изменениям экспрессии микроРНК, которые участвуют в эпигенетической регуляции созревания яйцеклеток и раннего развития эмбрионов [84]. Введение 0, 5, 20 или 50 мкг/кг/сут BPA самкам мышей линии CD-1 (поколение F0) с 11-го дня беременности до рождения изменяло экспрессию генов яичников (участвующих в стероидогенезе, апоптозе, антиоксидантной защите и т. д.) и негативно повлияло на индекс фертильности поколения F3 [11][85]. Интересно, что воздействие на поколение F0 самок мышей CD-1 DEHP в дозе 0,05 или 5,0 мг/кг/сут с момента зачатия до отлучения от груди способствовало фолликулогенезу в поколении F3 [86]. Однако у самок мышей в поколениях F2 и F3 наблюдалось увеличение времени наступления беременности, когда поколение F0 подвергалось воздействию смеси фталатов (DEHP, ДБФ, диэтилфталат, бензилбутилфталат, диизононилфталат, диизобутилфталат) с 10-го дня беременности до рождения [87]. Кроме того, уменьшение количества примордиальных фолликулов наблюдалось в поколении крыс F3 Sprague-Dawley, когда их предки подвергались воздействию изолированных соединений или смесей EDC (таких как пестициды винклозолин и перметрин) [88]. Кроме того, наследственное воздействие 10 мкг/кг ТХДД приводило к снижению фертильности у поколения мышей F3 [89].
При исследовании репродуктивной функции 759 женщин, родившихся в третьем поколении от женщин, получавших DES во время беременности, прямого влияния на фертильность не наблюдалось. Однако риск аномалий или аплазии матки (синдром Майера-Рокитанского-Кустера-Хаузера) был значительно увеличен [90].
Заключение / Conclusion
Таким образом, экспериментальные и клинико-эпидемиологические исследования, посвященные изучению фертильности, показали, что такие факторы окружающей среды, как климат, температура, сезонность, радиация, загрязнение воздуха, характер питания и энергетический баланс, рабочая среда, вредные привычки (например, курение), EDC (пластификаторы, тяжелые металлы, парабены, пестициды, промышленные химикаты и их побочные продукты, лекарства, перфторохимикаты, антибактериальные средства) могут быть связаны с нарушением репродуктивной функции.
Сочетание повышенного количества осадков и большой высоты над уровнем моря во время родов может положительно сказаться на женской фертильности. Воздействие электромагнитных полей увеличивает распространенность идиопатического бесплодия, о чем свидетельствуют исследования с участием людей. Экспериментальные исследования на животных указывают на неблагоприятное воздействие загрязнителей воздуха на функцию яйцеклеток и качество эмбрионов, в то время как у людей данные свидетельствуют о положительной корреляции между бесплодием и воздействием транспортных выбросов. Воздействие PM2.5 отрицательно влияет на женскую фертильность при терапии бесплодия методами ВРТ, в то время как концентрация SO2 отрицательно связана со спонтанным зачатием. Считается, что частое употребление трансжирных кислот, животных белков и продуктов с высокой степенью переработки способствует формированию бесплодия у людей, в основном вызывая овуляторную дисфункцию. Диета, богатая растительными белками, а также средиземноморская диета оказывают протективное действие в отношении женского бесплодия. В свою очередь, избыточная масса тела матери негативно влияет на качество яйцеклеток и восприимчивость эндометрия. Однако изменения в образе жизни, такие как снижение избыточной масса тела и умеренные физические нагрузки повышают потенциал фертильности, восстанавливая овуляцию у женщин с ожирением. Что касается влияния курения на женскую фертильность, то в исследованиях на животных сообщалось о токсическом воздействии табачного дыма на яичники, которое, возможно, вызвано повышенным окислительным стрессом. Однако результаты исследований на людях оказались противоречивыми.
Воздействие BPA и BPAF имеет пагубные последствия для жизнеспособности фолликулов яичников, их функции и созревания. Согласно исследованиям на животных, BPA нарушает микрофлору кишечника, вызывает поражения яичников и матки, ухудшает транспортировку эмбрионов через яйцевод и имплантацию, а также снижает потенциал фертильности (частоту наступления беременности и индекс фертильности) у последующих поколений (как подвергшихся, так и не подвергшихся воздействию EDC), вероятно, через эпигенетические механизмы. У женщин, проходящих терапию бесплодия с использованием методов ВРТ, BPA оказывает отрицательное влияние на фертильность, уменьшая количество извлеченных яйцеклеток, снижая качество эмбрионов и шансы на успешную имплантацию. В исследованиях in vitro было показано, что фталаты нарушают фолликулогенез, стероидогенез и регуляцию клеточного цикла, в то время как исследования на животных связывают их с изменениями в микробиоте кишечника, а также эпигенетическими модификациями, ассоциированными с негативными репродуктивными последствиями в следующих поколениях. Наконец, у людей фталаты негативно влияют на результаты ЭКО, снижая выход яйцеклеток, а также вероятность успешной имплантации и наступления беременности.
Что касается Pb, Cd, As и Cr, то исследования на животных указывают на повышенную частоту атрезии фолликулов и изменения микробиоты кишечника. У людей тяжелые металлы связаны с повышенным риском бесплодия при нормальной беременности и снижением извлечения яйцеклеток при искусственном оплодотворении. У животных парабены оказывают токсическое воздействие на яичники и нарушают микрофлору кишечника, в то время как у людей они приводят к уменьшению количества антральных фолликулов. Что касается влияния пестицидов на женскую фертильность, то экспериментальные исследования указывают на неблагоприятное воздействие на стероидогенез, рост и развитие фолликулов, а также на нарушение процесса децидуализации. Воздействие пестицидов снижает вероятность беременности и живорождения. Исследования предполагают эпигенетическое воздействие на фертильность. ТХДД подавляет имплантацию в лабораторных условиях и в экспериментах на животных. В свою очередь, ПХБ могут негативно влиять на микрофлору кишечника, а воздействие как ТХДД, так и ПХБ связано с нарушением овуляции и развитием воспалительынх процессов в матке. У людей ТХДД ассоциируется с повышенным уровнем бесплодия при нормальной беременности и при искусственной инсеминации, также его влияние может распространяться на показатели фертильности в разных поколениях. У животных и людей воздействие DES было связано с нарушением общей фертильности и, в частности, с нарушением имплантации эмбрионов и созревания фолликулов яичников. Воздействие DES вызывает эпигенетические изменения. Исследования, проведенные на людях, показали, что после применения триклозана увеличивается выход яйцеклеток и количество антральных фолликулов, в то время как частота зачатия и имплантации снижается.
В целом, противоречивые результаты представленных в обзоре исследований могут быть объяснены различиями в их конструктивных характеристиках. Действительно, следующие параметры могут способствовать получению противоречивых результатов: степень, время или способ воздействия; размер выборки; генетическое разнообразие исследуемых популяций; тип исследуемых биологических матриц; синергетические или смешивающие эффекты факторов окружающей среды, отличные от изученных, и т. д. Использование в исследованиях на животных сверхфизиологических доз, не соответствующих обычным уровням воздействия на человека, значительно усугубляет эти расхождения и затрудняет получение достоверных выводов. Тщательно спланированные исследования (в основном когортные и контрольные) необходимы для изучения воздействия различных факторов окружающей среды на репродуктивную функцию человека, чтобы раскрыть механизм их действия, подтвердить данные, полученные в ходе предыдущих пилотных исследований, и определить концентрации, связанные с отсутствием побочных эффектов. Впоследствии внедрение национальных и международных нормативных актов могло бы способствовать ограничению воздействия вредных веществ на людей, способствуя, таким образом, повышению фертильности, а также защите будущих поколений от негативных последствий для репродуктивного здоровья.
Список литературы
1. Ди Ренцо Д.К. Нутриенты и токсичные вещества окружающей среды: влияние на функцию плаценты и развитие плода. Акушерство, Гинекология и Репродукция. 2024;18(1):112–24. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.487.
2. Silva A.B.P., Carreiró F., Ramos F., Sanches-Silva A. The role of endocrine disruptors in female infertility. Mol Biol Rep. 2023;50(8):7069–88. https://doi.org/10.1007/s11033-023-08583-2.
3. Салтанова И.В., Пигарова Е.А. Эндокринные дисрапторы – химические вещества, нарушающие функции эндокринной системы: рассказ о бисфеноле А. Ожирение и метаболизм. 2013;10(3):55–7.
4. Carson S.A., Kallen A.N. Diagnosis and management of infertility: A review. JAMA. 2021;326(1):65–76. https://doi.org/10.1001/jama.2021.4788.
5. Nik Hazlina N.H., Norhayati M.N., Shaiful Bahari I. et al. Worldwide prevalence, risk factors and psychological impact of infertility among women: a systematic review and meta-analysis. BMJ Open. 2022;12(3):e057132. https://doi.org/10.1136/bmjopen-2021-057132.
6. Савина А.А., Землянова Е.В., Фейгинова С.И. Потери потенциальных рождений в г. Москве за счет женского и мужского бесплодия. Здоровье мегаполиса. 2022;3(3):39–45.
7. Gelbaya T.A., Potdar N., Jeve Y.B., Nardo L.G. Definition and epidemiology of unexplained infertility. Obstet Gynecol Surv. 2014;69(2):109–15. https://doi.org/10.1097/OGX.0000000000000043.
8. Кузнецов К.О., Ишбаев Ч.Р., Хисматов М.А. и др. Влияние диизононилфталата на репродуктивную функцию человека и в эксперименте. Проблемы репродукции. 2022;28(5):55–64. https://doi.org/10.17116/repro20222805155.
9. Yenigül N.N., Dilbaz S., Dilbaz B. et al. The effect of plastic bottled water consumption on outcomes of ICSI cycles undertaken for unexplained infertility. Reprod Biomed Online. 2021;43(1):91–9. https://doi.org/10.1016/j.rbmo.2021.04.010.
10. Moore-Ambriz T.R., Acuña-Hernández D.G., Ramos-Robles B. et al. Exposure to bisphenol A in young adult mice does not alter ovulation but does alter the fertilization ability of oocytes. Toxicol Appl Pharmacol. 2015;289(3):507–14. https://doi.org/10.1016/j.taap.2015.10.010.
11. Ziv-Gal A., Wang W., Zhou C., Flaws J.A. The effects of in utero bisphenol A exposure on reproductive capacity in several generations of mice. Toxicol Appl Pharmacol. 2015;284(3):354–62. https://doi.org/10.1016/j.taap.2015.03.003.
12. Rattan S., Brehm E., Gao L., Flaws J.A. Di(2-Ethylhexyl) Phthalate exposure during prenatal development causes adverse transgenerational effects on female fertility in mice. Toxicol Sci. 2018;163(2):420–9. https://doi.org/10.1093/toxsci/kfy042.
13. Yu Y., Yang Y., Zhao X. et al. Exposure to the mixture of organophosphorus pesticides is embryotoxic and teratogenic on gestational rats during the sensitive period. Environ Toxicol. 2017;32(1):139–46. https://doi.org/10.1002/tox.22219.
14. Johansson H.K.L., Christiansen S., Draskau M.K. et al. Classical toxicity endpoints in female rats are insensitive to the human endocrine disruptors diethylstilbestrol and ketoconazole. Reprod Toxicol. 2021;101:9–17. https://doi.org/10.1016/j.reprotox.2021.01.003.
15. Boland M.R., Fieder M., John L.H. et al. Female reproductive performance and maternal birth month: A comprehensive meta-analysis exploring multiple seasonal mechanisms. Sci Rep. 2020;10(1):555. https://doi.org/10.1038/s41598-019-57377-9.
16. Conforti A., Mascia M., Cioffi G. et al. Air pollution and female fertility: a systematic review of literature. Reprod Biol Endocrinol. 2018;16(1):117. https://doi.org/10.1186/s12958-018-0433-z.
17. Witkoś J., Błażejewski G., Gierach M. The Low Energy Availability in Females Questionnaire (LEAF-Q) as a useful tool to identify female triathletes at risk for menstrual disorders related to low energy availability. Nutrients. 2023;15(3):650. https://doi.org/10.3390/nu15030650.
18. Jurczewska J., Szostak-Węgierek D. The influence of diet on ovulation disorders in women – a narrative review. Nutrients. 2022;14(8):1556. https://doi.org/10.3390/nu14081556.
19. Kim K., Yisahak S.F., Nobles C.J. et al. Low intake of vegetable protein is associated with altered ovulatory function among healthy women of reproductive age. J Clin Endocrinol Metab. 2021;106(7):e2600–e2612. https://doi.org/10.1210/clinem/dgab179.
20. Toledo E., Lopez-del Burgo C., Ruiz-Zambrana A. et al. Dietary patterns and difficulty conceiving: a nested case-control study. Fertil Steril. 2011;96(5):1149–53. https://doi.org/10.1016/j.fertnstert.2011.08.034.
21. Rutkowska A.Z., Diamanti-Kandarakis E. Polycystic ovary syndrome and environmental toxins. Fertil Steril. 20165;106(4):948–58. https://doi.org/10.1016/j.fertnstert.2016.08.031.
22. Ahn J., Lee S.H., Park M.Y. et al. The association between long working hours and infertility. Saf Health Work. 2021;12(4):517–21. https://doi.org/10.1016/j.shaw.2021.07.005.
23. Caserta D., Bordi G., Ciardo F. et al. The influence of endocrine disruptors in a selected population of infertile women. Gynecol Endocrinol. 2013;29(5):444–7. https://doi.org/10.3109/09513590.2012.758702.
24. Smarr M.M., Sundaram R., Honda M. et al. Urinary concentrations of parabens and other antimicrobial chemicals and their association with couples' fecundity. Environ Health Perspect. 2017;125(4):730–6. https://doi.org/10.1289/EHP189.
25. Gallo M.V., Ravenscroft J., Carpenter D.O., Frye C., Akwesasne Task Force On The Environment, Cook B., Schell L.M. Endocrine disrupting chemicals and ovulation: Is there a relationship? Environ Res. 2016;151:410–8. https://doi.org/10.1016/j.envres.2016.08.007.
26. Eskenazi B., Warner M., Marks A.R. et al. Serum dioxin concentrations and time to pregnancy. Epidemiology. 2010;21(2):224–31. https://doi.org/10.1097/EDE.0b013e3181cb8b95.
27. Hoover R.N., Hyer M., Pfeiffer R.M. et al. Adverse health outcomes in women exposed in utero to diethylstilbestrol. N Engl J Med. 2011;365(14):1304–14. https://doi.org/10.1056/NEJMoa1013961.
28. Fabozzi G., Rebuzzini P., Cimadomo D. et al. Endocrine-disrupting chemicals, Gut microbiota, and human (in)fertility – it is time to consider the triad. Cells. 2022;11(21):3335. https://doi.org/10.3390/cells11213335.
29. Ziv-Gal A., Flaws J.A. Evidence for bisphenol A-induced female infertility: a review (2007-2016). Fertil Steril. 2016;106(4):827–56. https://doi.org/10.1016/j.fertnstert.2016.06.027.
30. Ding Z.M., Jiao X.F., Wu D. et al. Bisphenol AF negatively affects oocyte maturation of mouse in vitro through increasing oxidative stress and DNA damage. Chem Biol Interact. 2017;278:222–9. https://doi.org/10.1016/j.cbi.2017.10.030.
31. Gannon A.M., Stämpfli M.R., Foster W.G. Cigarette smoke exposure leads to follicle loss via an alternative ovarian cell death pathway in a mouse model. Toxicol Sci. 2012;125(1):274–84. https://doi.org/10.1093/toxsci/kfr279.
32. Zhan S., Huang J. Effects of cigarette smoking on preimplantation embryo development. Adv Exp Med Biol. 2021;1300:137–50. https://doi.org/10.1007/978-981-33-4187-6_6.
33. Sobinoff A.P., Beckett E.L., Jarnicki A.G et al. Scrambled and fried: cigarette smoke exposure causes antral follicle destruction and oocyte dysfunction through oxidative stress. Toxicol Appl Pharmacol. 2013;271(2):156–67. https://doi.org/10.1016/j.taap.2013.05.009.
34. Jones R.L., Lang S.A., Kendziorski J.A. et al. Use of a mouse model of experimentally induced endometriosis to evaluate and compare the effects of bisphenol A and bisphenol AF exposure. Environ Health Perspect. 2018;126(12):127004. https://doi.org/10.1289/EHP3802.
35. Dash M., Dey A., Chattopadhyay S. Mitigation of arsenic driven utero-ovarian malfunction and changes of apoptotic gene expression by dietary NAC. Ecotoxicol Environ Saf. 2020;199:110675. https://doi.org/10.1016/j.ecoenv.2020.110675.
36. Gal A., Gedye K., Craig Z.R., Ziv-Gal A. Propylparaben inhibits mouse cultured antral follicle growth, alters steroidogenesis, and upregulates levels of cell-cycle and apoptosis regulators. Reprod Toxicol. 2019;89:100–6. https://doi.org/10.1016/j.reprotox.2019.07.009.
37. Bae J.S., Lee J.D., Song S.W. et al. Thirteen-week subcutaneous repeated dose toxicity study of butylparaben and its toxicokinetics in rats. Arch Toxicol. 2021;95(6):2037–50. https://doi.org/10.1007/s00204-021-03037-9.
38. Boberg J., Axelstad M., Svingen T. et al. Multiple endocrine disrupting effects in rats perinatally exposed to butylparaben. Toxicol Sci. 2016;152(1):244–56. https://doi.org/10.1093/toxsci/kfw079.
39. Guerra M.T., Sanabria M., Cagliarani S.V. et al. Long-term effects of in utero and lactational exposure to butyl paraben in female rats. Environ Toxicol. 2017;32(3):776–88. https://doi.org/10.1002/tox.22277.
40. Jalouli M., Mofti A., Elnakady Y.A. et al. Allethrin promotes apoptosis and autophagy associated with the oxidative stress-related PI3K/AKT/mTOR signaling pathway in developing rat ovaries. Int J Mol Sci. 2022;23(12):6397. https://doi.org/10.3390/ijms23126397.
41. Boberg J., Johansson H.K.L., Franssen D. et al. Perinatal exposure to known endocrine disrupters alters ovarian development and systemic steroid hormone profile in rats. Toxicology. 2021;458:152821. https://doi.org/10.1016/j.tox.2021.152821.
42. Paulose T., Tannenbaum L.V., Borgeest C., Flaws J.A. Methoxychlor-induced ovarian follicle toxicity in mice: dose and exposure duration-dependent effects. Birth Defects Res B Dev Reprod Toxicol. 2012;95(3):219–24. https://doi.org/10.1002/bdrb.21007.
43. Ren X., Li R., Liu J. et al. Effects of glyphosate on the ovarian function of pregnant mice, the secretion of hormones and the sex ratio of their fetuses. Environ Pollut. 2018;243(Pt B):833–41. https://doi.org/10.1016/j.envpol.2018.09.049.
44. Meling D.D., Warner G.R., Szumski J.R. et al. The effects of a phthalate metabolite mixture on antral follicle growth and sex steroid synthesis in mice. Toxicol Appl Pharmacol. 2020;388:114875. https://doi.org/10.1016/j.taap.2019.114875.
45. Zhou Y.J., Wang X.D., Xiao S. et al. Exposure to beta-cypermethrin impairs the reproductive function of female mice. Regul Toxicol Pharmacol. 2018;95:385–94. https://doi.org/10.1016/j.yrtph.2018.04.015.
46. Boberg J., Johansson H.K.L., Franssen D. et al. Exposure to the pesticides linuron, dimethomorph and imazalil alters steroid hormone profiles and gene expression in developing rat ovaries. Toxicol Lett. 2023;373:114–22. https://doi.org/10.1016/j.toxlet.2022.11.010.
47. Jaroenporn S., Malaivijitnond S., Wattanasirmkit K. et al. Assessment of fertility and reproductive toxicity in adult female mice after long-term exposure to Pueraria mirifica herb. J Reprod Dev. 2007;53(5):995–1005. https://doi.org/10.1262/jrd.18151.
48. Roy N., Mascolo E., Lazzaretti C. et al. Endocrine disruption of the follicle-stimulating hormone receptor signaling during the human antral follicle growth. Front Endocrinol. 2021;12:791763. https://doi.org/10.3389/fendo.2021.791763.
49. Rasmussen L.M., Sen N., Vera J.C. et al. Effects of in vitro exposure to dibutyl phthalate, mono-butyl phthalate, and acetyl tributyl citrate on ovarian antral follicle growth and viability. Biol Reprod. 2017;96(5):1105–17. https://doi.org/10.1095/biolreprod.116.144691.
50. Adir M., Combelles C.M.H., Mansur A. et al. Dibutyl phthalate impairs steroidogenesis and a subset of LH-dependent genes in cultured human mural granulosa cell in vitro. Reprod Toxicol. 2017;69:13–8. https://doi.org/10.1016/j.reprotox.2016.12.007.
51. Holman R.R., Bethel M.A., Chan J.C. et al.; ACE Study Group. Rationale for and design of the Acarbose Cardiovascular Evaluation (ACE) trial. Am Heart J. 2014;168(1):23–9.e2. https://doi.org/10.1016/j.ahj.2014.03.021.
52. Vyas A.K., Veiga-Lopez A., Ye W. et al. Developmental programming: Sex-specific programming of growth upon prenatal bisphenol A exposure. J Appl Toxicol. 2019;39(11):1516–31. https://doi.org/10.1002/jat.3836.
53. Pan X., Wang X., Sun Y. et al. Inhibitory effects of preimplantation exposure to bisphenol - A on blastocyst development and implantation. Int J Clin Exp Med. 2015;8(6):8720–9.
54. Li Q., Davila J., Kannan A. et al. Chronic exposure to bisphenol A affects uterine function during early pregnancy in mice. Endocrinology. 2016;157(5):1764–74. https://doi.org/10.1210/en.2015-2031.
55. Varayoud J., Ramos J.G., Bosquiazzo V.L. et al. Neonatal exposure to bisphenol A alters rat uterine implantation-associated gene expression and reduces the number of implantation sites. Endocrinology. 2011;152(3):1101–11. https://doi.org/10.1210/en.2009-1037.
56. Fahrenkopf A., Wagner C.K. Bisphenol A (BPA) induces progesterone receptor expression in an estrogen receptor α-dependent manner in perinatal brain. Neurotoxicol Teratol. 2020;78:106864. https://doi.org/10.1016/j.ntt.2020.106864.
57. Crawford B.R., Decatanzaro D. Disruption of blastocyst implantation by triclosan in mice: impacts of repeated and acute doses and combination with bisphenol-A. Reprod Toxicol. 2012;34(4):607–13. https://doi.org/10.1016/j.reprotox.2012.09.008.
58. Yoshizawa K., Brix A.E., Sells D.M. et al. Reproductive lesions in female Harlan Sprague-Dawley rats following two-year oral treatment with dioxin and dioxin-like compounds. Toxicol Pathol. 2009;37(7):921–37. https://doi.org/10.1177/0192623309351721.
59. Li B., Liu H.Y., Dai L.J. et al. The early embryo loss caused by 2,3,7,8-tetrachlorodibenzo-p-dioxin may be related to the accumulation of this compound in the uterus. Reprod Toxicol. 2006;21(3):301–6. https://doi.org/10.1016/j.reprotox.2005.09.008.
60. Lavogina D., Visser N., Samuel K. et al. Endocrine disrupting chemicals interfere with decidualization of human primary endometrial stromal cells in vitro. Front Endocrinol. 2022;13:903505. https://doi.org/10.3389/fendo.2022.903505.
61. Tsang H., Cheung T.Y., Kodithuwakku S.P et al. 2,3,7,8-Tetrachlorodibenzo-p-dioxin (TCDD) suppresses spheroids attachment on endometrial epithelial cells through the down-regulation of the Wnt-signaling pathway. Reprod Toxicol. 2012;33(1):60–6. https://doi.org/10.1016/j.reprotox.2011.11.002.
62. Zhao M., Zhang H., Waters T.H.B. et al. The effects of daily meteorological perturbation on pregnancy outcome: follow-up of a cohort of young women undergoing IVF treatment. Environ Health. 2019;18(1):103. https://doi.org/10.1186/s12940-019-0538-7.
63. Goldman R.H., Farland L.V., Thomas A.M. et al. The combined impact of maternal age and body mass index on cumulative live birth following in vitro fertilization. Am J Obstet Gynecol. 2019;221(6):617.e1–617.e13. https://doi.org/10.1016/j.ajog.2019.05.043.
64. Vujkovic M., de Vries J.H., Lindemans J. et al. The preconception Mediterranean dietary pattern in couples undergoing in vitro fertilization/intracytoplasmic sperm injection treatment increases the chance of pregnancy. Fertil Steril. 2010;94(6):2096–101. https://doi.org/10.1016/j.fertnstert.2009.12.079.
65. Karayiannis D., Kontogianni M.D., Mendorou C. et al. Adherence to the Mediterranean diet and IVF success rate among non-obese women attempting fertility. Hum Reprod. 2018;33(3):494–502. https://doi.org/10.1093/humrep/dey003.
66. Sun H., Lin Y., Lin D. et al. Mediterranean diet improves embryo yield in IVF: a prospective cohort study. Reprod Biol Endocrinol. 2019;17(1):73. https://doi.org/10.1186/s12958-019-0520-9.
67. Benedict M.D., Missmer S.A., Vahratian A. et al. Secondhand tobacco smoke exposure is associated with increased risk of failed implantation and reduced IVF success. Hum Reprod. 2011;26(9):2525–31. https://doi.org/10.1093/humrep/der226.
68. Еникеев Д.А., Идрисова Л.Т., Еникеев О.А. и др. Сравнение опасности и токсичности табачных сигарет, электронных систем доставки никотина и систем нагревания табака (IQOS) (обзор). Патогенез. 2019;17(3):25–33. https://doi.org/10.25557/2310-0435.2019.03.25-33.
69. Frappier J., Martinaud A., Barberet J. et al. Effect of paternal smoking on pre-implantation embryonic development: a prospective cohort study. Reprod Fertil Dev. 2022;34(15):971–9.
70. Thaker R., Mishra V., Gor M. et al. The role of stimulation protocol, number of oocytes retrieved with respect to follicular fluid oxidative stress and IVF outcome. Hum Fertil. 2020;23(1):23–31. https://doi.org/10.1080/14647273.2018.1551630.
71. Ehrlich S., Williams P.L., Missmer S.A. et al. Urinary bisphenol A concentrations and early reproductive health outcomes among women undergoing IVF. Hum Reprod. 2012;27(12):3583–92. https://doi.org/10.1093/humrep/des328.
72. Mínguez-Alarcón L., Gaskins A.J., Chiu Y.H. et al.; EARTH Study Team. Urinary bisphenol A concentrations and association with in vitro fertilization outcomes among women from a fertility clinic. Hum Reprod. 2015;30(9):2120–8. https://doi.org/10.1093/humrep/dev183.
73. Mínguez-Alarcón L., Messerlian C., Bellavia A. et al.; Earth Study Team. Urinary concentrations of bisphenol A, parabens and phthalate metabolite mixtures in relation to reproductive success among women undergoing in vitro fertilization. Environ Int. 2019;126:355–62. https://doi.org/10.1016/j.envint.2019.02.025.
74. Wright D.L., Afeiche M.C., Ehrlich S. et al. Hair mercury concentrations and in vitro fertilization (IVF) outcomes among women from a fertility clinic. Reprod Toxicol. 2015;51:125–32. https://doi.org/10.1016/j.reprotox.2015.01.003.
75. Mínguez-Alarcón L., Chiu Y.H., Messerlian C. et al.; EARTH Study Team. Urinary paraben concentrations and in vitro fertilization outcomes among women from a fertility clinic. Fertil Steril. 2016;105(3):714–21. https://doi.org/10.1016/j.fertnstert.2015.11.021.
76. Bloom M.S., Fujimoto V.Y., Storm R. et al. Persistent organic pollutants (POPs) in human follicular fluid and in vitro fertilization outcomes, a pilot study. Reprod Toxicol. 2017;67:165–73. https://doi.org/10.1016/j.reprotox.2017.01.004.
77. Hua R., Zhou Y., Wu B. et al. Urinary triclosan concentrations and early outcomes of in vitro fertilization-embryo transfer. Reproduction. 2017;153(3):319–25. https://doi.org/10.1530/REP-16-0501.
78. Yang L., Baumann C., De La Fuente R., Viveiros M.M. Mechanisms underlying disruption of oocyte spindle stability by bisphenol compounds. Reproduction. 2020;159(4):383–96. https://doi.org/10.1530/REP-19-0494.
79. Du Y.-Y., Fang Y.-L., Wang Y.-X. et al. Follicular fluid and urinary concentrations of phthalate metabolites among infertile women and associations with in vitro fertilization parameters. Reprod Toxicol. 2016;61:142–50. https://doi.org/10.1016/j.reprotox.2016.04.005.
80. Hauser R., Gaskins A.J., Souter I. et al.; EARTH Study Team. Urinary phthalate metabolite concentrations and reproductive outcomes among women undergoing in vitro fertilization: results from the EARTH Study. Environ Health Perspect. 2016;124(6):831–9. https://doi.org/10.1289/ehp.1509760.
81. Bellavia A., Zou R., Björvang R.D. et al. Association between chemical mixtures and female fertility in women undergoing assisted reproduction in Sweden and Estonia. Environ Res. 2023;216(Pt 1):114447. https://doi.org/10.1016/j.envres.2022.114447.
82. Cavallini A., Lippolis C., Vacca M. et al. The effects of chronic lifelong activation of the AHR pathway by industrial chemical pollutants on female human reproduction. PLoS One. 2016;11(3):e0152181. https://doi.org/10.1371/journal.pone.0152181.
83. Shen J., Kang Q., Mao Y. et al. Urinary bisphenol A concentration is correlated with poorer oocyte retrieval and embryo implantation outcomes in patients with tubal factor infertility undergoing in vitro fertilisation. Ecotoxicol Environ Saf. 2020;187:109816. https://doi.org/10.1016/j.ecoenv.2019.109816.
84. Sabry R., Saleh A.C., Stalker L. et al. Effects of bisphenol A and bisphenol S on microRNA expression during bovine (Bos taurus) oocyte maturation and early embryo development. Reprod Toxicol. 2021;99:96–108. https://doi.org/10.1016/j.reprotox.2020.12.001.
85. Berger A., Ziv-Gal A., Cudiamat J. et al. The effects of in utero bisphenol A exposure on the ovaries in multiple generations of mice. Reprod Toxicol. 2016;60:39–52. https://doi.org/10.1016/j.reprotox.2015.12.004.
86. Pocar P., Fiandanese N., Berrini A. et al. Maternal exposure to di(2-ethylhexyl)phthalate (DEHP) promotes the transgenerational inheritance of adult-onset reproductive dysfunctions through the female germline in mice. Toxicol Appl Pharmacol. 2017;322:113–21. https://doi.org/10.1016/j.taap.2017.03.008.
87. Zhou C., Gao L., Flaws J.A. Exposure to an environmentally relevant phthalate mixture causes transgenerational effects on female reproduction in mice. Endocrinology. 2017;158(6):1739–54. https://doi.org/10.1210/en.2017-00100.
88. Nilsson E., Larsen G., Manikkam M. et al. Environmentally induced epigenetic transgenerational inheritance of ovarian disease. PLoS One. 2012;7(5):e36129. https://doi.org/10.1371/journal.pone.0036129.
89. Bruner-Tran K.L., Ding T., Yeoman K.B. et al. Developmental exposure of mice to dioxin promotes transgenerational testicular inflammation and an increased risk of preterm birth in unexposed mating partners. PLoS One. 2014;9(8):e105084. https://doi.org/10.1371/journal.pone.0105084.
90. Wautier A., Tournaire M., Devouche E. et al. Genital tract and reproductive characteristics in daughters of women and men prenatally exposed to diethylstilbestrol (DES). Therapie. 2020;75(5):439–48. https://doi.org/10.1016/j.therap.2019.10.004.
Об авторах
И. А. ЖирновРоссия
Жирнов Игорь Александрович
620028 Екатеринбург, ул. Репина, д. 3
К. А. Назмиева
Россия
Назмиева Ксения Александровна
450008, Уфа, ул. Ленина, д. 3
А. И. Хабибуллина
Россия
Хабибуллина Айгуль Ильнуровна
450008, Уфа, ул. Ленина, д. 3
Л. А. Ильясова
Россия
Ильясова Лейсан Альфритовна
450008, Уфа, ул. Ленина, д. 3
Н. С. Саидмурсалова
Россия
Саидмурсалова Нилуфар Сайфуллоевна
450008, Уфа, ул. Ленина, д. 3
Р. Р. Демишева
Россия
Демишева Раяна Рамзановна
364024 Грозный, ул. А. Шерипова, д. 32
П. Е. Алихаджиева
Россия
Алихаджиева Петимат Ерагиевна
364024 Грозный, ул. А. Шерипова, д. 32
А. Х. Солтагереева
Россия
Солтагереева Аяна Хусайновна
364024 Грозный, ул. А. Шерипова, д. 32
А. А. Головня
Россия
Головня Алина Андреевна
450008, Уфа, ул. Ленина, д. 3
А. В. Кахрамонова
Россия
Кахрамонова Анна Владимировна
450008, Уфа, ул. Ленина, д. 3
И. М. Джалилов
Россия
Джалилов Икромджон Мухамаджонович
450008, Уфа, ул. Ленина, д. 3
У. У. Галимова
Россия
Галимова Умакусум Учаровна
410012 Саратов, ул. Большая Казачья, д. 112
Что уже известно об этой теме?
► Значительное число химических веществ, обнаруживаемых в окружающей среде, обладают свойствами, нарушающими работу эндокринной системы (англ. endocrine disrupting chemicals, EDC).
► Многие случаи идиопатического бесплодия связаны с EDC или прямым и/или косвенным воздействием факторов окружающей среды.
► Как у мужчин, так и у женщин была выявлена отрицательная корреляция между уровнями EDC и репродуктивной функцией.
Что нового дает статья?
► Длительное нахождение в условиях повышенного количества осадков и большой высоты над уровнем моря во время родов может положительно сказаться на женской фертильности. Воздействие электромагнитных полей увеличивает распространенность идиопатического бесплодия.
► Воздействие тяжелых металлов связано с повышенным риском бесплодия при нормальной беременности и снижением количества извлеченных яйцеклеток при искусственном оплодотворении, а воздействие пестицидов снижает вероятность беременности и живорождения.
► Воздействие бисфенола А (BPA) и фторированного BPA (BPAF) имеет пагубные последствия для жизнеспособности фолликулов яичников, их функции и созревания, способствуя уменьшению количества извлеченных яйцеклеток, снижению качества эмбрионов и шансов на успешную имплантацию.
Как это может повлиять на клиническую практику в обозримом будущем?
► Понимание того, какие именно факторы окружающей среды могут негативно влиять на фертильность и развитие плода, поможет создать рекомендации по снижению воздействия этих факторов на организм женщины.
► Врачи смогут учитывать не только генетические и физиологические особенности пациенток, но и влияние окружающей среды на их здоровье. Это может привести к разработке новых методов лечения и реабилитации, направленных на восстановление репродуктивного здоровья женщины.
► Понимание влияния окружающей среды на репродуктивное здоровье женщин может способствовать созданию более здоровой и безопасной среды обитания. Это включает в себя разработку и внедрение экологических стандартов.
Рецензия
Для цитирования:
Жирнов И.А., Назмиева К.А., Хабибуллина А.И., Ильясова Л.А., Саидмурсалова Н.С., Демишева Р.Р., Алихаджиева П.Е., Солтагереева А.Х., Головня А.А., Кахрамонова А.В., Джалилов И.М., Галимова У.У. Влияние факторов окружающей среды на репродуктивное здоровье женщины. Акушерство, Гинекология и Репродукция. 2024;18(6):858-873. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.564
For citation:
Zhirnov I.A., Nazmieva K.A., Khabibullina A.I., Ilyasova L.A., Saidmursalova N.S., Demisheva R.R., Alikhadzhieva P.E., Soltagereeva A.Kh., Golovnya A.A., Kakhramonova A.V., Dzhalilov I.M., Galimova U.U. The influence of environmental factors on woman's reproductive health. Obstetrics, Gynecology and Reproduction. 2024;18(6):858-873. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.564

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































