Перейти к:
Оценка эффективности профилактики плацента-ассоциированных осложнений у пациенток с отягощенным акушерским анамнезом и циркуляцией антифосфолипидных антител
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.479
Аннотация
Введение. Роль носительства антифосфолипидных антител (АФА) в патогенезе невынашивания беременности является одной из наиболее обсуждаемых в последние годы проблем. На сегодняшний день не существует единого терапевтического подхода к иммунотерапии антифосфолипидного синдрома (АФС) при беременности. Внутривенные иммуноглобулины (ВВИГ) стали препаратами выбора при лечении данной патологии у беременных.
Цель: оценить эффективность профилактики плацента-ассоциированных осложнений (ПАО) у пациенток с привычным невынашиванием и циркуляцией АФА.
Материалы и методы. Проведено проспективное исследование, проанализированы течение беременности и исходы у 150 пациенток, имевших диагностические титры АФА и отягощенный акушерско-гинекологический анамнез. Все беременные получали терапию ацетилсалициловой кислотой (АСК) в дозе 100-150 мг и низкомолекулярными гепаринами (НМГ). Помимо комбинации НМГ и АСК, 126 (84,0 %) беременных получали курсы ВВИГ, которые проводились в сроках 6-8, 12-14, а также в 22-24 нед беременности.
Результаты. Такие осложнения гестации, как хроническая плацентарная недостаточность, нарушения гемодинамики, задержка роста плода, гестационная артериальная гипертензия, умеренная преэклампсия (ПЭ) достоверно чаще встречались у пациенток, которые не получали ВВИГ при беременности. Стоит отметить, что развитие тяжелых акушерских осложнений, таких как тяжелая ПЭ, преждевременная отслойка нормально расположенной плаценты, массивная кровопотеря, антенатальная гибель плода не наблюдались ни в одном случае. Ни у одной пациентки не развились венозные тромбоэмболические осложнения при беременности и в послеродовом периоде. В результате сравнения относительной площади экспрессии аннексина V, CD 34+, кисспептина (англ. KiSS-peptine) и его рецепторов KiSS1R были выявлены статистически значимые различия. Относительная площадь экспрессии антикоагулянтного протеина аннексина V была в 2,3 раза выше у пациенток, получавших ВВИГ при беременности; эндотелиального маркера CD34+ - в 4 раза выше, KiSS-peptine - в 2,3 раза, а его рецепторов KiSS1R - в 5,4 раза выше в плацентах женщин, которым проводилась терапия ВВИГ с ранних сроков беременности.
Заключение. С целью оценки эффективности профилактики ПАО у пациенток с привычным невынашиванием и циркуляцией АФА можно использовать определение относительной площади экспрессии антикоагулянтного протеина аннексина V, эндотелиального маркера CD 34+, KiSS-peptine и его рецепторов KiSS1R в плаценте.
Ключевые слова
Для цитирования:
Еремеева Д.Р., Зайнулина М.С. Оценка эффективности профилактики плацента-ассоциированных осложнений у пациенток с отягощенным акушерским анамнезом и циркуляцией антифосфолипидных антител. Акушерство, Гинекология и Репродукция. 2024;18(4):475-491. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.479
For citation:
Eremeeva D.R., Zainulina M.S. Assessing the effectiveness of preventing placenta-associated complications in patients with burdened obstetric history and circulating antiphospholipid antibodies. Obstetrics, Gynecology and Reproduction. 2024;18(4):475-491. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.479
Введение / Introduction
В последние годы в медицинской науке активно обсуждается вопрос о влиянии аутоиммунных антител против фосфолипидов (АФА) на патогенез невынашивания беременности. Эта проблема привлекает внимание клиницистов и исследователей из-за возрастающего количества доказательств, указывающих на значительную роль АФА в развитии репродуктивных нарушений. В контексте патогенетической модели невынашивания беременности носительство АФА ассоциируется с повышенным риском формирования тромботических условий в плаценте, что может привести к нарушению плацентарного кровотока и, как следствие, к неблагоприятным исходам беременности. Обсуждение этой проблемы подчеркивает необходимость дальнейших исследований для определения точного механизма влияния АФА на процессы имплантации и плацентации, а также для разработки эффективных стратегий профилактики и лечения невынашивания беременности у женщин с аутоиммунными нарушениями.
АФА представляют собой разнообразную группу аутоиммунных антител, целенаправленно связывающихся с фосфолипидными структурами на клеточных мембранах, а также с фосфолипид-белковыми комплексами и белками, участвующими в процессе коагуляции крови [1]. Присутствие данных антител коррелирует с развитием специфического клинического комплекса, известного как антифосфолипидный синдром (АФС), который характеризуется сочетанием определённых клинических и лабораторных маркеров. В частности, АФС проявляется наличием АФА в контексте артериальных и венозных тромбозов, патологии беременности, включая потерю плода, иммунную тромбоцитопению, а также неврологические нарушения [2]. Клинические последствия циркуляции АФА в системе кровообращения могут варьировать от асимптоматического носительства до критических состояний, угрожающих жизни, в зависимости от характеристик поражённых сосудов, включая их диаметр, количество и тип [3][4]. Особое внимание в последние 10 лет уделяется пересмотру патогенетических механизмов и диагностических методик АФС, что подчёркивает динамичность исследований в данной области медицины.
Международные критерии, утвержденные на Сиднейском консенсусном семинаре (Sydney Consensus Workshop) в 2006 г., представляют собой фундаментальный стандарт в диагностике АФС [3]. Эти критерии обеспечивают унифицированный подход к идентификации и классификации АФС, устанавливая четкие лабораторные и клинические параметры для подтверждения диагноза. Принятие этих стандартов значительно улучшило точность и согласованность в диагностике АФС на международном уровне, позволяя клиницистам эффективно выявлять и управлять состоянием, тем самым улучшая исходы для пациентов. Важность этих критериев не уменьшается с течением времени, подчеркивая их значимость в постоянно развивающемся поле медицинских исследований и клинической практике.
Роль антифосфолипидных антител в генезе невынашивания беременности / The role of antiphospholipid antibodies in developing miscarriage
В контексте первичного АФС клиническая статистика выявляет значительные репродуктивные риски для женщин. Плацентарная недостаточность диагностируется примерно у 11 % беременных, страдающих этим состоянием, преждевременные роды (ПР) регистрируются у 28 % женщин, внутриутробная гибель плода является трагическим исходом для 7 % беременностей в данной группе, отражая критическое влияние аутоиммунных нарушений на жизнеспособность плода. Преэклампсия (ПЭ) развивается в 2–8 % случаев, демонстрируя риск серьезных осложнений, угрожающих здоровью как матери, так и плода [4][5]. Риски осложненного течения беременности значительно возрастают в ситуации, когда АФС вторичен, т. е. имеет место аутоиммунное заболевание, например, системная красная волчанка (СКВ). Вероятность ПР в такой ситуации составляет от 32 до 65 %, а риск ПЭ – 32–50 % [6]. Частота же привычного невынашивания при АФС, согласно различным источникам, колеблется от 7 до 42 % [4][7–11]. Также АФС играет важную роль в патогенезе тромбоэмболических осложнений (ТЭО), которые имеют высокий процент смертности. При беременности чаще всего имеет место тромбоз глубоких вен (ТГВ) нижних конечностей, нередко протекающий без очевидных клинических проявлений, первым симптомом которого является тромбоэмболия легочной артерии (ТЭЛА), достаточно часто встречаются транзиторные ишемические атаки и острое нарушение мозгового кровообращения [4]. Рецидивы ТЭО характерны для АФС при отсутствии адекватной терапии, подчеркивая критическую необходимость в своевременной и целенаправленной медицинской интервенции. В течение десятилетнего периода вероятность повторных ТЭО у пациентов с АФС может достигать 50 % [12], что свидетельствует о высоком риске этих потенциально жизнеугрожающих состояний. Ежегодный риск таких событий оценивается в 29 % [13]. Эти данные обосновывают необходимость активного и продолжительного мониторинга пациентов с АФС, а также агрессивного подхода к профилактике тромбозов, включая антикоагулянтную терапию, для снижения риска рецидивов и улучшения качества жизни пациентов. АФА могут индуцировать повреждение клеток как непосредственно, так и косвенно через взаимодействие с плазменными белками, такими как β2-гликопротеин 1 (англ. β2-glycoprotein 1, β2-GР1), аннексин V и протромбин. Косвенное повреждение клеток происходит за счет формирования иммунных комплексов, которые влияют на функциональность и целостность клеточных мембран, в то время как прямое повреждение обусловлено иммунолитическим воздействием комплексов антиген-антитело, образующихся на поверхности клеток. Этот процесс является манифестацией гиперчувствительности второго типа. Иммунный цитолиз может осуществляться двумя основными механизмами: через антителозависимую клеточную цитотоксичность, при которой агентами лизиса выступают естественные киллеры – NK-клетки (англ. natural killer) и макрофаги, а также посредством активации комплементарной системы. Активация комплемента приводит к последовательной каскадной реакции, которая усиливает цитолитический эффект и способствует уничтожению целевых клеток. Оба пути являются ключевыми в патогенезе аутоиммунных реакций, ассоциированных с АФС, подчеркивая значимость АФА в развитии и прогрессировании этого состояния [14].
Длительное время преобладала точка зрения, что тромбообразование в системе мать–плацента является ключевым патогенетическим фактором развития осложнений беременности у женщин с АФС [15]. Тем не менее одним лишь тромбозом и повышенной коагуляцией объяснить гистологические изменения в плаценте, обнаруживаемые при патологоанатомическом анализе, невозможно. Исследования, в которых культивировали эндометриальные клетки в присутствии АФА из сыворотки женщин с АФС, демонстрируют, что наличие поликлональных β2-GР1 приводит к снижению продукции сосудистого эндотелиального фактора роста (англ. vascular endothelial growth factor, VEGF), что, в свою очередь, замедляет ангиогенез в эндометрии [16].
Экспериментальные данные по культивации трофобластных клеток плаценты от женщин с нормальным течением беременности в условиях воздействия АФА, выделенных из сыворотки женщин с АФС, указывают на ингибирование дифференцировки синцитиотрофобласта и уменьшение секреции хорионического гонадотропина человека (βХГЧ) [16]. Обнаружено, что АФА влияют на экспрессию адгезионных молекул трофобластом, снижая активность α1-интегрина и VE-кадгерина, а также стимулируя экспрессию α5-интегрина и Е-кадгерина [17]. Указанные механизмы повреждения могут нарушать процесс имплантации и ограничивать глубину децидуальной инвазии клеток трофобласта, влияя на ангиогенез в клетках эндометрия [18]. Эти нарушения могут стать причиной невынашивания беременности и при ее сохранении способствовать развитию поздних акушерских осложнений [19]. В акушерстве существует целый ряд состояний, обозначенных термином плацента-ассоциированные осложнения (ПАО), которые имеют в своей основе нарушения имплантации и плацентации. Это и задержка роста плода (ЗРП), и ранняя ПЭ, и антенатальная гибель плода, и повторяющиеся кровотечения из-за отслойки плаценты, определённые случаи экстремально ранних и ранних ПР. Как известно, в большинстве случаев при неподтвержденной этиологии и несвоевременном устранении нарушений возможно повторное развитие выше перечисленных осложнений. Более всего это относится к женщинам, которые имели неоднократные потери и/или потерю плода во II триместре беременности [20].
Профилактика плацента-ассоциированных заболеваний / Prevention of placenta-associated diseases
Возникает необходимость разработки системы профилактики и прогнозирования, которая могла бы предотвратить развитие ПАО. Не вызывает сомнений, что она является очень актуальной. К сожалению, в настоящее время, несмотря на применение различных методов профилактики и лечения, не удалось снизить частоту развития ПЭ и ЗРП. Данное обстоятельство объясняет стремление ученых создать эффективную модель прогнозирования, выявить факторы риска, которые способствуют развитию ПАО на ранних сроках беременности, и выделить группу женщин с высоким риском с целью принятия своевременных мер для профилактики [21].
Малые дозы ацетилсалициловой кислоты (АСК) являются стандартом для предотвращения рецидивов потерь плода. Их следует принимать в течение беременности, а также в течение 6 мес после родов.
Сегодня не существует единого терапевтического подхода к иммунотерапии АФС при беременности. До 1990 г. в качестве иммуносупрессивных препаратов использовались глюкокортикоиды. Применение этой группы лекарственных средств основано на их противовоспалительной активности, способности снижать титры АФА. В 1989 г. M.D. Lockshin с соавт. представили результаты исследований, указывающие на отсутствие эффективности кортикостероидной терапии, в частности преднизолона, для женщин, страдающих от невынашивания беременности на фоне АФС [22]. Эти данные подчеркивают, что применение кортикостероидов не только не способствует улучшению исходов беременности у данной категории пациенток, но и может нести дополнительные риски как для здоровья матери, так и для развивающегося плода. Проблематика использования кортикостероидов в контексте АФС и невынашивания обусловлена потенциальными побочными эффектами, включая повышенный риск инфекций, нарушения в развитии плода и проблемы с гликемическим контролем у матери. Эти выводы акцентируют внимание на необходимости тщательного подхода к выбору стратегий лечения для женщин с АФС, стремясь к оптимизации исходов беременности при минимизации рисков. Наличие большого числа неблагоприятных эффектов глюкокортикоидов направило исследователей на изучение иммуномодулирующих методов, в частности, использование внутривенных иммуноглобулинов (ВВИГ).
Инициирование применения ВВИГ в терапевтическом протоколе ведения беременных, страдающих АФС, было впервые задокументировано в исследовании, проведенном L.O. Carreras с соавт. в 1988 г. [23]. С тех пор ВВИГ эволюционировали в препараты первой линии не только для управления акушерскими аспектами АФС, но и для лечения внутриутробных инфекций, включая цитомегаловирус [24]. Эта эволюция подчеркивает значительный прогресс в понимании и подходах к лечению АФС при беременности, уточняя роль ВВИГ как центрального элемента в стратегии уменьшения рисков и улучшения исходов для матери и плода при наличии иммунных нарушений.
Внутривенные иммуноглобулины демонстрируют сложный многоуровневый механизм действия, особенно при заболеваниях, где ключевую роль играют аутоантитела. Эффективность высоких доз ВВИГ в этих случаях связывают с насыщением человеческого неонатального рецептора Fc-фрагментов IgG (англ. neonatal fragment crystallizable (Fc) receptor, FcRn), что приводит к ускоренному катаболизму антител, в том числе аутоантител [25]. ВВИГ оказывают защитное действие на эндотелий сосудов, предохраняя его от разнообразных неблагоприятных воздействий и предотвращая развитие состояний, способствующих тромбообразованию. Применение высоких доз ВВИГ позволяет достичь значительной концентрации препарата в кровотоке, что ведет к подавлению процессов, стимулирующих коагуляцию и воспаление в эндотелиальных клетках. Снижение экспрессии факторов адгезии, таких как Р-селектин и молекула межклеточной адгезии 1 (англ. intercellular adhesion molecule 1, ICAM-1), способствует уменьшению проникновения лейкоцитов в ткани, тем самым препятствуя прогрессированию патологических изменений, которые могут увеличить тромбогенность сосудистой стенки [5]. Эти механизмы действия подчеркивают важную роль ВВИГ в модуляции иммунных реакций и предотвращении ТЭО.
Научное сообщество продолжает вести дискуссии относительно точных механизмов, лежащих в основе действия ВВИГ, особенно в контексте их иммуномодулирующего эффекта, который до настоящего времени остается недостаточно изученным. В официальных инструкциях по применению ВВИГ АФС не указан среди прямых показаний к терапии данными препаратами. Это обусловлено тем, что исследования, специфически направленные на оценку влияния ВВИГ на течение АФС, не предоставили данных, подтверждающих их однозначную эффективность в контексте данного аутоиммунного расстройства. Таким образом, вопросы о применении ВВИГ в лечении АФС и о механизмах их действия остаются предметом научных исследований и клинических обсуждений. Несмотря на это, за последние 10 лет ВВИГ широко применяются при беременности у женщин с АФС, в том числе в составе сочетанной терапии с низкомолекулярными гепаринами (НМГ) и малыми дозами АСК в случаях невосприимчивого к стандартной терапии АФС, при катастрофических формах АФС [26–29].
Результаты анализа литературы свидетельствуют о том, что ВВИГ могут использоваться не только при терапии заболеваний, связанных с иммунодефицитом различной этиологии. Также эта группа препаратов может использоваться в качестве иммуномодуляторов с высокой эффективностью, учитывая их воздействие на разные компоненты иммунной системы, защитный эффект, снижение воспаления, обусловленного иммунным ответом, обеспечение аутотолерантности. ВВИГ имеют широкий спектр применения, включая использование при аутоиммунных заболеваниях. В этой связи применение ВВИГ в акушерской практике имеет особую значимость, они помогают предотвратить неблагоприятный исход беременности у пациенток с носительством высоких титров АФА [30].
Цель: оценить эффективность профилактики ПАО у пациенток с привычным невынашиванием и циркуляцией АФА.
Материалы и методы / Materials and Methods
Дизайн исследования / Study design
В период с 2019 по 2021 гг. в СПб ГБУЗ РД № 6 им. проф. В.Ф. Снегирева было осуществлено проспективное клиническое исследование, в ходе которого анализировались течение и исходы беременности у 150 пациенток с высокими диагностическими титрами АФА и сложным акушерско-гинекологическим анамнезом.
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения: женщины с высокими титрами АФА, имеющие в анамнезе случаи потерь беременности и другие неблагоприятные исходы предыдущих беременностей, а также подписавшие информированное согласие на участие в исследовании.
Критерии исключения: наличие у пациенток серьезных сопутствующих экстрагенитальных заболеваний (например, почечная и печеночная недостаточность, сахарный диабет первого типа), аномалий развития половых органов, хромосомных аномалий, а также отказ от участия в исследовании.
Медикаментозная терапия / Medication
Всем участницам исследования назначалась терапия, включающая АСК в дозировке 100–150 мг и НМГ – эноксапарин натрия. Дозировка эноксапарина натрия определялась в зависимости от массы тела: 0,4 мл при массе от 60 до 90 кг и 0,6 мл при массе тела свыше 90 кг. Терапия АСК продолжалась до 34 нед беременности, а НМГ – при беременности и после родоразрешения в течение 6 нед. Комбинация НМГ с АСК рассматривалась как основа профилактики тромбоэмболических осложнений.
Помимо комбинации НМГ и АСК, 126 (84,0 %) беременных получали курсы ВВИГ, которые проводились в сроках 6–8, 12–14, а также в 22–24 нед беременности. Лечебный курс включал в себя 3 инфузии 5 % раствора нормального человеческого иммуноглобулина, каждая объемом 100 мл. Интервал между введениями составлял 2 дня.
Этические аспекты / Ethical aspects
Применение описанных профилактических мер осуществлялось вне рамок зарегистрированных показаний («off-label») и одобрялось только после рассмотрения на врачебной комиссии и получения письменного информированного согласия от пациентки. Одобрение данной практики было подкреплено решением локального этического комитета, вынесенным 27 декабря 2019 г. в протоколе № 9 заседания Ученого Совета лечебного факультета ФГБОУ ВО ПСПбГМУ им. И.П. Павлова Минздрава России. Все процедуры, выполненные в данном исследовании, соответствовали этическим стандартам Хельсинской декларации 1964 г. и ее последующим изменениям и сопоставимым нормам этики.
Методы исследования / Study methods
Комплексный клинико-анамнестический анализ состояния пациенток охватывал детальную оценку предъявляемых жалоб, а также тщательное изучение акушерско-гинекологической и соматической истории заболеваний. В рамках исследования были проведены физикальные и специализированные гинекологические осмотры для всесторонней оценки состояния здоровья женщин.
Комплексное клинико-лабораторное обследование пациенток охватывало проведение клинического и биохимического анализа крови, а также выполнение обширного коагулологического профиля. Данный профиль включал определение уровня фибриногена, измерение активированного частичного тромбопластинового времени (АЧТВ), протромбинового индекса, антитромбина III (АТ-III), международного нормализованного отношения (МНО), а также анализ содержания в крови D-димера, гомоцистеина, АФА и волчаночного антикоагулянта (ВА).
Для расширенной коагулограммы использовался коагулометр модели ACL-200 производства компании Instrumentation Laboratory (Испания) с реактивами HemosIL (Италия). Определение АФА классов IgM и IgG, включая антитела к β2-GР1, кардиолипину, протромбину, аннексину V, проводилось методом иммуноферментного анализа (ELISA) с использованием ридера Bio-Rad 680 от Bio-Rad (США). Для выявления ВА применялся коагулометр DiaMed-CD4 от DiaMed (Швейцария).
В рамках инструментального обследования проводилось ультразвуковое исследование, включавшее фетометрию для оценки параметров роста плода и доплерометрическое исследование для анализа кровотока. Оценка кровотока осуществлялась по ключевым показателям: систоло-диастолическому отношению, индексу резистентности и пульсационному индексу, что позволяло детально изучить гемодинамику в указанных сосудистых системах и выявить возможные нарушения.
Гистологическое исследование было проведено в патологоанатомических отделениях ФГБНУ НИИ АГиР им. Д.О. Отта и СПб ГБУЗ «Городское патологоанатомическое бюро». Для анализа использовали фрагменты плаценты размером 0,7×0,7 см, которые фиксировали в 10 % нейтральном формалине в течение суток. Обработка образцов производилась в автоматическом гистопроцессоре Leica TP1020 для биологических тканей, заливка в парафин выполнялась с использованием модульной системы TES 99 (Medite). Срезы тканей толщиной 3–4 мкм располагали на предметных стеклах и окрашивали гематоксилином и эозином. Готовые микропрепараты покрывали монтирующей средой и закрывали покровным стеклом. Микроскопическая оценка включала анализ строения виллезного дерева плаценты, наличие хронической плацентарной недостаточности, циркуляторное русло, интервиллезное пространство, строение хориальной и базальной пластинок, а также воспалительные изменения.
Иммуногистохимическое исследование было выполнено в лабораторных условиях в ФГБНУ НИИ АГиР им. Д.О. Отта. Использовались парафиновые срезы тканей толщиной 5 мкм, которые размещали на предметных стеклах, обработанных поли-L-лизином для улучшения адгезии образца. Для проведения иммуногистохимического анализа применялся стандартный одноэтапный метод, включающий демаскировку антигенов в 0,01 М цитратном буфере. Для визуализации результатов использовался комплект Abcam Mouse and Rabbit Specific HRP Plus (ABC) Detection IHC Kit (RTU), предназначенный для специфического обнаружения антител к мышам и кроликам. Исследование охватывало анализ экспрессии аннексина V, кисспептина (англ. KiSS-peptine) и его рецептора KiSS1R, CD34+ и VEGF. Антитела использовались в соответствии со стандартными протоколами производителя. Оценка результатов проводилась по микрофотографиям, сделанным с помощью микроскопа Olympus BX46 и программы «CellSens 47 Entry», исключая области с дефектами ткани или окрашивания. Фотодокументация иммуногистохимических срезов выполнялась с использованием микроскопического увеличения в 400 раз. Параметры съемки включали экспозицию 1/38 секунды при максимально возможной чувствительности камеры. Размер полученных изображений составлял 2080×1544 пикселей, сохранение производилось в формате JPEG. Для количественного анализа экспрессии антигенов использовалась программа «Videotest Morphology 5.2», которая позволяла оценивать оптическую плотность и относительную площадь экспрессии, обеспечивая точную и объективную оценку результатов исследования.
Статистический анализ / Statistical analysis
Статистический анализ данных был выполнен с использованием программного обеспечения StatTech версии 3.1.1, разработанного ООО «Статтех» (Россия). Для проверки соответствия количественных данных нормальному распределению использовался критерий Шапиро–Уилка при объеме выборки менее 50 наблюдений и критерий Колмогорова–Смирнова при объеме выборки свыше 50 наблюдений. Параметрические данные, соответствующие нормальному распределению, представлялись через средние арифметические значения (M) и стандартные отклонения (SD), а также через 95 % доверительные интервалы (95 % ДИ). Категориальные переменные описывались с использованием абсолютных и процентных значений.
Сравнение двух групп по количественным переменным с нормальным распределением при равенстве дисперсий проводилось с применением t-критерия Стьюдента, а при различии дисперсий – с использованием t-критерия Уэлча.
Для оценки диагностической значимости количественных переменных в прогнозировании определенных исходов применялся анализ ROC-кривых. Оптимальное разделяющее значение количественного признака (cut-off) определялось по максимальному значению индекса Юдена. Различия между группами считались статистически значимыми при уровне значимости p < 0,05.
Результаты / Results
Клинико-анамнестическая характеристика обследованных / Clinical and anamnestic characteristics of patients examined
Средний возраст пациенток составил 32,99 ± 4,83 лет, средняя масса тела – 64 ± 9 кг; первородящих пациенток было 79 (52,7 %), повторнородящих – 71 (47,3 %). У всех (100 %) пациенток имелись потери беременности в анамнезе: неразвивающаяся беременность определена у 58 (71,8 %) женщин; самопроизвольный выкидыш до 12 нед произошел у 50 (33,3 %); антенатальная гибель плода в предыдущую беременность наблюдалась у 17 (11,3 %) пациенток; у 5 (3,3 %) беременных в анамнезе имелась преждевременная отслойка нормально расположенной плаценты (ПОНРП) – 2 случая при сроке 23 нед, в 25, 28 и 35 нед гестации; тяжелая ПЭ в анамнезе была у 14 (9,3 %) пациенток; у 31 (20,7 %) женщины беременность наступила в результате экстракорпорального оплодотворения (ЭКО); неудачи ЭКО имелись в анамнезе у 33 (22,0 %) пациенток; в 3 (2,0 %) случаях отмечалась беременность дихориальной диамниотической двойней.
На рисунке 1 представлена соматическая патология обследованных пациенток.
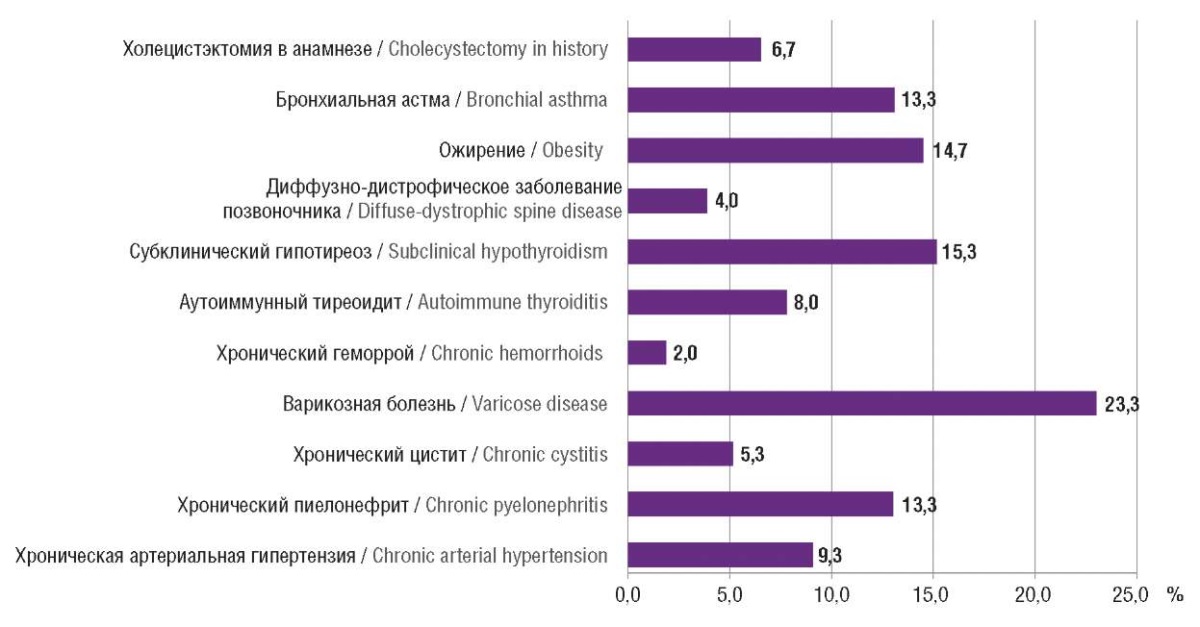
Рисунок 1. Структура соматической патологии.
Figure 1. Pattern of patient somatic pathologies.
У 16 (10,7 %) пациенток выявлена наследственная тромбофилия: в 7 (4,7 %) случаях определялась гетерозиготная мутация фактора (F) II, у 8 (5,3 %) женщин – гетерозиготная мутация FV Leiden. Приобретенная тромбофилия встречалась гораздо чаще: 38,3 % беременных имели высокие титры АФА, у 60,3 % женщин определялся повышенный титр ВА, у 57,0 % пациенток выявлено повышенное содержание гомоцистеина в крови. На рисунке 2 отображено наличие наследственной или приобретенной тромбофилии.
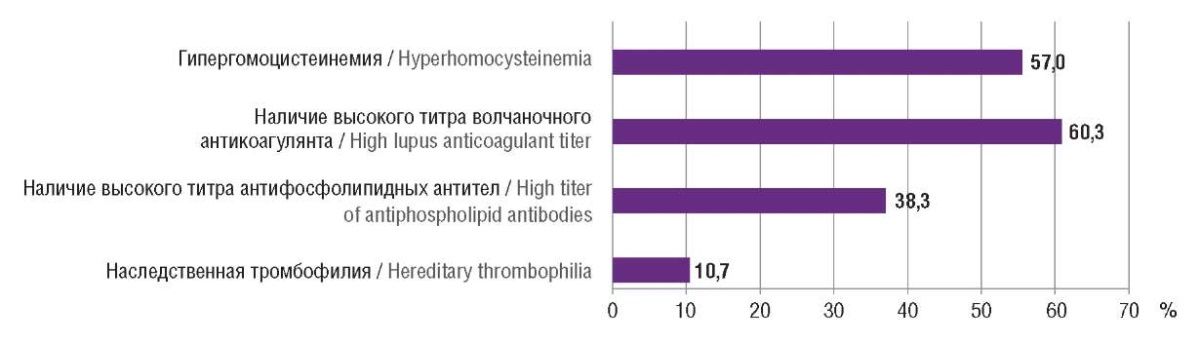
Рисунок 2. Структура тромбофилий.
Figure 2. Thrombophilia pattern.
Осложнения беременности / Pregnancy complications
В течение беременности отмечались следующие осложнения: достаточно часто встречалась угроза выкидыша на раннем сроке – у 73,9 % пациенток; угрожающие ПР наблюдались в 47,8 % случаях; диагноз истмико-цервикальной недостаточности определен у 10,6 % женщин, из них у 4,3 % установлен акушерский разгрузочный пессарий и в 4,3 % наложен шов на шейку матки. Инфекция мочевыводящих путей выявлена у 30,4 % беременных, цервицит – у 48,9 %, проведение антибактериальной терапии потребовалось 22,0 % пациенткам. Гестационный сахарный диабет осложнил течение беременности у 17,3 % пациенток, причем в 4,3 % случаях потребовалась инсулинотерапия. Хроническая плацентарная недостаточность выявлена у 38 (25,9 %) пациенток, нарушения гемодинамики I степени были обнаружены у 24 (16,3 %) беременных; нарушения гемодинамики III степени имели место в 2 (1,4 %) случаях; гипотрофия плода выявлена у 21 (14,3 %) женщины. У 13 (8,8 %) пациенток установлен диагноз гестационной артериальной гипертензии, развитие умеренной ПЭ было зафиксировано у 7 (4,7 %) беременных.
Исходы беременности / Pregnancy outcomes
Родоразрешено 147 (98,0 %) женщин, у трех (2,0 %) пациенток была диагностирована неразвивающаяся беременность на сроке 8/9 недель. Кариотипирование абортного материала во всех трех случаях выявило наличие хромосомных аномалий у плодов.
Срочными родами закончилась беременность у подавляющего большинства женщин – 135 (91,8 %), причем естественные роды отмечены в 59 (40,1 %) случаях, оперативное родоразрешение – у 88 (59,9 %) пациенток. Средняя масса тела новорожденных в исследовании составила 3169,99 ± 538,51 г, а средний рост достиг 50,11 ± 2,65 см. Оценка по шкале Апгар показала средний результат 7,92 ± 0,34 балла. В процессе родоразрешения через естественные родовые пути средняя кровопотеря составила 280,17 ± 48,16 мл, тогда как при проведении операции кесарева сечения средняя кровопотеря увеличилась до 507,22 ± 128,98 мл. В послеродовом периоде у трех родильниц (2,0 %) была диагностирована субинволюция матки.
Заслуживает внимания тот факт, что в исследуемой выборке не было зафиксировано случаев развития тяжелых акушерских осложнений, таких как тяжелая ПЭ, ПОНРП, массивная кровопотеря или антенатальная гибель плода. Кроме того, ни у одной из пациенток не развились венозные ТЭО ни во время беременности, ни в послеродовом периоде.
За время наблюдения не было отмечено жалоб по поводу каких-либо субъективных или объективных признаков, связанных с побочным действием принимаемых препаратов (аллергические проявления, геморрагии, кожный зуд, боль и дискомфорт в месте введения).
Результаты лабораторных исследований / Laboratory results
Повышенный уровень гомоцистеина был выявлен у 86 (57,0 %) пациенток, средний его уровень составил 8,2 ± 2,0 мкмоль/л.
Тромбоцитопения отмечалась у 20 (13,3 %) беременных, количество тромбоцитов у которых колебалось от 110×10⁹/л до 150×10⁹/л при среднем уровене (135 ± 11)×10⁹/л и не явилось противопоказанием для назначения НМГ, либо поводом для их отмены.
В таблице 1 отражена динамика показателей коагулограммы на протяжении беременности. Отмечалось статистически значимое изменение всех исследованных параметров с увеличением срока беременности, кроме уровня естественного антикоагулянта АТ-III.
Таблица 1. Динамика коагулологических показателей на протяжении беременности (M ± SD).
Table 1. Dynamics of coagulation parameters during pregnancy (M ± SD).
|
Показатель Parameter |
Триместр / Trimester |
р |
||
|
I |
II |
III |
||
|
Протромбиновый индекс, % Prothrombin index, % |
95,10 ± 14,30 |
100,18 ± 15,29 |
102,03 ± 17,31 |
pI–II < 0,001 pI–III < 0,001 |
|
Международное нормализованное отношение International normalized ratio |
1,05 ± 0,10 |
1,03 ± 0,14 |
1,02 ± 0,10 |
pI–III = 0,005 |
|
Активированное частичное тромбопластиновое время, с Activated partial thromboplastin time, s |
30,73 ± 4,26 |
29,37 ± 4,53 |
28,97 ± 3,80 |
pI–II = 0,004 pI–III < 0,001 |
|
Фибриноген, г/л Fibrinogen, g/L |
3,69 ± 0,73 |
4,13 ± 0,88 |
4,56 ± 0,75 |
pI–II < 0,001 pI–III < 0,001 pII–III < 0,001 |
|
Тромбиновое время, с Thrombin time, s |
16,14 ± 2,68 |
16,67 ± 3,47 |
15,41 ± 2,90 |
pI–II < 0,033 pI–III < 0,033 pII–III < 0,033 |
|
Антитромбин III, % Antithrombin III, % |
95,90 ± 7,38 |
94,47 ± 9,40 |
93,94 ± 9,15 |
pI–II = 0,142 pI–III = 0,142 pII–III = 0,142 |
|
D-димер, нг/мл D-dimer, ng/ml |
344,07 ± 366,23 |
467,60 ± 74,59 |
654,59 ± 445,89 |
pI–II = 0,006 pI–III < 0,001 pII–III < 0,001 |
Примечание: выделены статистически значимые различия.
Note: significant differences are highlighted.
Рассмотрим результаты обследования на содержание в крови АФА. В I триместре антитела к кардиолипину в высоких титрах определены у 11 (7,3 %) пациенток, средний уровень составил 6,438 ± 14,134 Ед/мл, повышенный уровень антител к β2-GР1 определен у 24 (16,0 %) беременных (средний уровень – 20,455 ± 46,421 Ед/мл). Также у 24 (16,0 %) женщин отмечалось повышение титров антител к аннексину V, средний уровень составил 3,844 ± 4,130 Ед/мл. Увеличение титров антител к фосфатидилсерину выявлено у 9 (6,0 %) пациенток, их средний уровень определен в 5,819 ± 7,906 Ед/мл. В I триместре повышение ВА установлено у 90 (60,3 %) беременных, средний уровень составил 1,24 ± 0,18.
При оценке уровня АФА в разных триместрах беременности (на фоне проводимой терапии) значимо снижался титр антител к аннексину V, β2-GР1 и фосфатидилсерину. В таблице 2 отражена динамика уровней АФА у пациенток на протяжении беременности.
Таблица 2. Титры антифосфолипидных антител на протяжении беременности (M ± SD).
Table 2. Antiphospholipid antibody titers during pregnancy (M ± SD).
|
Показатель Parameter |
Триместр / Trimester |
р |
||
|
I |
II |
III |
||
|
Антитела к кардиолипину, Ед/мл Anti-cardiolipin antibodies, U/ml |
6,438 ± 14,134 |
5,935 ± 12,172 |
5,099 ± 8,917 |
pI–II = 0,225 pI–III = 0,225 pII–III = 0,225 |
|
Антитела к аннексину V, Ед/мл Annexin V antibodies, U/ml |
3,844 ± 4,130 |
3,286 ± 2,415 |
2,984 ± 2,577 |
pI–II = 0,032 pI–III = 0,050 pII–III = 0,032 |
|
Антитела к β2-гликопротеину 1, Ед/мл Anti-β2-glycoprotein 1 antibodies, U/ml |
20,455 ± 46,421 |
19,731 ± 44,229 |
17,326 ± 40,081 |
pI–II = 0,032 pI–III = 0,032 pII–III = 0,032 |
|
Антитела к фосфатидилсерину, Ед/мл Anti-phosphatidylserine antibodies, U/ml |
5,819 ± 7,906 |
5,095 ± 7,002 |
4,186 ± 6,482 |
pI–II = 0,010 pI–III = 0,010 pII–III = 0,010 |
|
Волчаночный антикоагулянт Lupus anticoagulant |
1,24 ± 0,18 |
1,26 ± 0,25 |
1,25 ± 0,23 |
pI–II = 0,713 pI–III = 0,713 pII–III = 0,713 |
Примечание: выделены статистически значимые различия.
Note: significant differences are highlighted.
Анализ исходов беременности / Analysis of pregnancy outcomes
Из 150 беременных, наблюдавшихся в СПб ГБУЗ РД № 6 им. проф. В.Ф. Снегирева, родоразрешено 147 (98,0 %) женщин, у 3 (2,0 %) пациенток диагностирована неразвивающаяся беременность при сроке 8/9 нед, по результатам кариотипирования абортного материала обнаружена хромосомная аномалия плодов (во всех 3 случаях).
Проанализированы исходы беременностей в зависимости от наличия или отсутствия терапии ВВИГ. Полученные результаты представлены в таблице 3.
Таблица 3. Исходы беременности в зависимости от применения или отсутствия
терапии внутривенными иммуноглобулинами (ВВИГ).
Table 3. Pregnancy outcomes driven by intravenous immunoglobulin (IVIG) therapy.
|
Показатель Parameter |
Категория Category |
M ± SD |
n |
p |
|
Масса тела плода, г Fetal body weight, g |
Без терапии ВВИГ / Without IVIG therapy |
2655,00 ± 496,73 |
24 |
< 0,001 |
|
Применение ВВИГ / IVIG аpplication |
3270,47 ± 488,03 |
123 |
||
|
Длина, см Length, cm |
Без терапии ВВИГ / Without IVIG therapy |
47,46 ± 2,69 |
24 |
< 0,001 |
|
Применение ВВИГ / IVIG аpplication |
50,62 ± 2,33 |
123 |
||
|
Оценка по шкале Апгар, балл Apgar, score |
Без терапии ВВИГ / Without IVIG therapy |
7,71 ± 0,46 |
24 |
0,017 |
|
Применение ВВИГ / IVIG аpplication |
7,96 ± 0,30 |
123 |
Примечание: выделены статистически значимые различия.
Note: significant differences are highlighted.
При сопоставлении массы и длины плода, оценки по шкале Апгар в зависимости от применения ВВИГ при беременности установлены статистически значимые различия (p < 0,001; p < 0,001; p = 0,017 соответственно).
Проведен анализ осложнений в зависимости от применения или отсутствия терапии ВВИГ при беременности (табл. 4).
Таблица 4. Осложнения беременности в зависимости от применения или отсутствия
терапии внутривенными иммуноглобулинами (ВВИГ).
Table 4. Pregnancy complications driven by intravenous immunoglobulin (IVIG) therapy.
|
Осложнения беременности Pregnancy complications |
Без терапии ВВИГ Without IVIG therapy % |
Применение ВВИГ IVIG аpplication % |
p |
|
Гестационная артериальная гипертензия / Gestational hypertension |
37,5 |
3,2 |
< 0,001 |
|
Умеренная преэклампсия / Moderate preeclampsia |
16,7 |
2,4 |
0,013 |
|
Хроническая плацентарная недостаточность Chronic placental insufficiency |
70,8 |
17,1 |
< 0,001 |
|
Гипотрофия плода / Fetal hypotrophy |
58,3 |
5,7 |
< 0,001 |
|
Нарушения гемодинамики I степени / Hemodynamic disorders, degree I |
33,3 |
13,0 |
< 0,001 |
|
Нарушения гемодинамики III степени / Hemodynamic disorders, degree III |
8,3 |
0 |
< 0,001 |
Примечание: выделены статистически значимые различия.
Note: significant differences are highlighted.
Исходя из полученных данных, такие осложнения гестации, как хроническая плацентарная недостаточность, нарушения гемодинамики, гипотрофия плода, гестационная артериальная гипертензия, умеренная ПЭ достоверно чаще встречались у пациенток, которые не получали ВВИГ при беременности.
Шансы возникновения гестационной артериальной гипертензии в группе применения ВВИГ были ниже в 18,3 раза по сравнению с группой без терапии ВВИГ (ОШ = 0,055; 95 % ДИ = 0,015–0,199), умеренной ПЭ – ниже в 8,2 раза (ОШ = 0,122; 95 % ДИ = 0,025–0,586), хронической плацентарной недостаточности – ниже в 11,8 раза (ОШ = 0,085; 95 % ДИ = 0,031–0,230), гипотрофии плода – ниже в 23,2 раза (ОШ = 0,043; 95 % ДИ = 0,014–0,131); во всех случаях различия шансов были статистически значимыми.
Всем пациенткам проводилось гистологическое исследование последа; помимо этого, 24 плаценты дополнительно были направлены на иммуногистохимическое исследование.
Результаты гистологического исследования плацент пациенток приведены в таблице 5, при анализе были выявлены статистически значимые различия (p < 0,001). В группе применения ВВИГ частота встречаемости хронической плацентарной недостаточности была достоверно ниже, а в большинстве случаев гистологически подтвержден нормопластический тип строения плаценты (рис. 3).
Таблица 5. Гистологическое исследование плацент.
Table 5. Placental histology examination.
|
Категория Category |
Без терапии ВВИГ Without IVIG therapy % |
Применение ВВИГ IVIG аpplication % |
p |
|
Нормопластический тип строения плаценты Normoplastic type of placenta structure |
9,1 |
65,3 |
< 0,001 < 0,001 < 0,001 < 0,001 |
|
ХПН, компенсированная стадия CPI, compensated stage |
27,3 |
30,7 |
|
|
ХПН, субкомпенсированная стадия CPI, subcompensated stage |
2,6 |
18,2 |
|
|
ХПН с острой декомпенсацией CPI with acute decompensation |
45,5 |
1,3 |
Примечание: ВВИГ – внутривенные иммуноглобулины;
ХПН – хроническая плацентарная недостаточность;
выделены статистически значимые различия.
Note: IVIG – intravenous immunoglobulins; CPI – chronic placental insufficiency;
significant differences are highlighted.
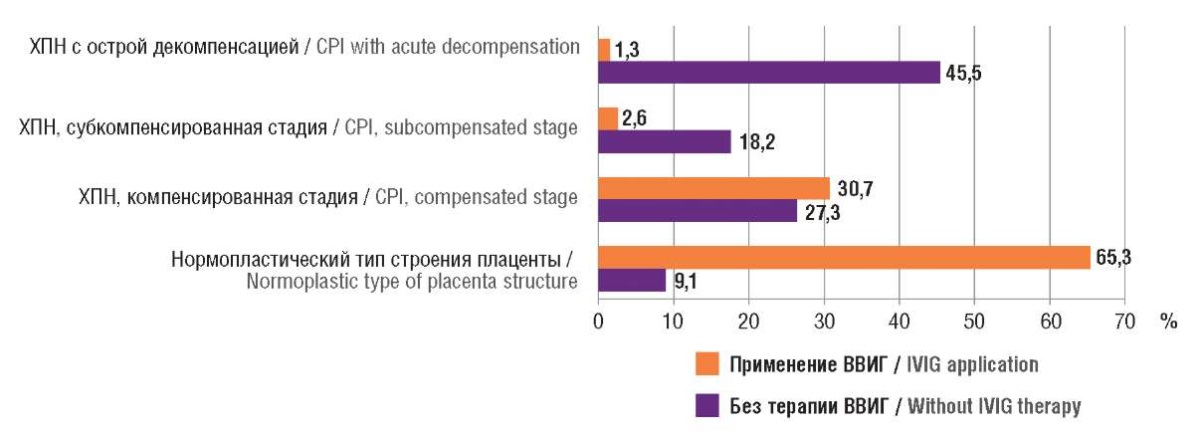
Рисунок 3. Структура гистологического исследования плацент.
Примечание: ВВИГ – внутривенные иммуноглобулины;
ХПН – хроническая плацентарная недостаточность.
Figure 3. Pattern of placenta histology examination.
Note: CPI – chronic placental insufficiency; IVIG – intravenous immunoglobulins.
В рамках иммуногистохимического исследования была проведена как количественная, так и качественная оценка экспрессии ряда ключевых белков, важных для понимания механизмов влияния АФА на ткани. Исследование включало анализ следующих маркеров:
- аннексин V – антикоагулянтный протеин, играющий важную роль в поддержании антикоагулянтных свойств клеточных мембран и предотвращении тромбоза;
- CD34+ – эндотелиальный маркер, используемый для идентификации и количественной оценки эндотелиальных клеток в сосудистых структурах;
- KiSS-peptin и его рецепторы KiSS1R – пептид и соответствующие рецепторы, которые участвуют в регуляции репродуктивной системы и могут влиять на плацентарное кровоснабжение;
- сосудистый эндотелиальный фактор роста (VEGF-A) – ключевой фактор, стимулирующий ангиогенез и эндотелиальный рост, критически важный для формирования и функционирования плаценты.
Эти параметры были выбраны для детального изучения взаимосвязи между присутствием АФА и изменениями в плаценте, которые могут привести к нарушениям в развитии беременности и возникновению осложнений.
Проведен анализ экспрессии указанных маркеров в плаценте в зависимости от применения ВВИГ при беременности (табл. 6).
Таблица 6. Экспрессия в плаценте в зависимости от применения или отсутствия
терапии внутривенными иммуноглобулинами (ВВИГ).
Table 6. Placental expression driven by intravenous immunoglobulin (IVIG) therapy.
|
Показатель Parameter |
Категория Category |
M ± SD |
n |
p |
|
Относительная площадь экспрессии аннексина V, % Relative annexin V expression area, % |
Без терапии ВВИГ / Without IVIG therapy |
20,571 ± 2,749 |
8 |
< 0,001 |
|
Применение ВВИГ / IVIG аpplication |
46,950 ± 9,126 |
17 |
||
|
Относительная площадь экспрессии CD 34+, % Relative CD34+expression area, % |
Без терапии ВВИГ / Without IVIG therapy |
4,136 ± 1,217 |
8 |
< 0,001 |
|
Применение ВВИГ / IVIG аpplication |
16,835 ± 3,402 |
17 |
||
|
Относительная площадь экспрессии KiSS-peptine, % Relative KiSS-peptine expression area, % |
Без терапии ВВИГ / Without IVIG therapy |
16,623 ± 4,305 |
8 |
< 0,001 |
|
Применение ВВИГ / IVIG аpplication |
37,891 ± 9,161 |
17 |
||
|
Относительная площадь экспрессии KiSS1R, % Relative KiSS1R expression area, % |
Без терапии ВВИГ / Without IVIG therapy |
5,589 ± 4,387 |
8 |
< 0,001 |
|
Применение ВВИГ / IVIG аpplication |
30,161 ± 7,193 |
17 |
||
|
Относительная площадь экспрессии VEGF, % Relative VEGF expression area, % |
Без терапии ВВИГ / Without IVIG therapy |
22,458 ± 9,022 |
8 |
0,352 |
|
Применение ВВИГ / IVIG аpplication |
19,930 ± 4,447 |
17 |
Примечание: VEGF – сосудистый эндотелиальный фактор роста;
выделены статистически значимые различия.
Note: VEGF – vascular endothelium growth factor;
significant differences are highlighted.
В результате сравнения относительной площади экспрессии аннексина V, CD 34+, KiSS-peptine и его рецепторов KiSS1R были выявлены статистически значимые различия. Анализ иммуногистохимических данных показал, что относительная площадь экспрессии антикоагулянтного протеина аннексина V в плацентах женщин, получавших терапию ВВИГ во время беременности, была в 2,3 раза выше по сравнению с группой пациенток, которые ВВИГ не получали. Экспрессия эндотелиального маркера CD34+ увеличилась в 4 раза, что указывает на значительное повышение эндотелиальной активности и возможно улучшение ангиогенеза в плаценте. Экспрессия кисспептина (KiSS-peptine) и его рецепторов KiSS1R также значительно возросла (в 2,3 и 5,4 раза соответственно), что может свидетельствовать о улучшении регуляции плацентарного кровоснабжения и взаимодействия трофобласта с эндометрием.
Эти результаты подчеркивают потенциальную эффективность ВВИГ как средства для улучшения плацентарной функции и предотвращения осложнений беременности у женщин с высоким риском, включая тех, кто имеет АФА. Таким образом, можно говорить, что исследование плаценты иммуногистохимическим методом с определением относительной площади экспрессии антикоагулянтного протеина аннексина V, эндотелиального маркера CD 34+, KiSS-peptine и его рецепторов KiSS1R можно использовать как высокоэффективный метод контроля эффективности терапии ВВИГ.
Обсуждение / Discussion
Внутривенное введение иммуноглобулинов рутинно применялось в клинической практике более 60 лет, первоначально эти препараты использовались в качестве заместительной терапии при иммунодефицитных состояниях. Современные методы лечения некоторых заболеваний включают применение ВВИГ, хотя их использование в большинстве случаев не соответствует указанным в инструкции терапевтическим показаниям [31].
Наиболее неблагоприятные эффекты АФС проявляются во время беременности, частота невынашивания беременности достигает 80–90 % [26][32]. Некоторые отчеты по клиническим случаям, а также рандомизированные исследования подтвердили положительный эффект ВВИГ во время беременности. Однако результаты противоречивы. ВВИГ наиболее часто используются при акушерском АФС, где назначение ВВИГ направлено на предотвращение акушерских осложнений, в основном привычного невынашивания беременности. Н. Valensise с соавт. сообщили о лечении 14 женщин с АФС с повторными спонтанными абортами в анамнезе с помощью 0,5 г/кг ВВИГ в течение 2 дней подряд, начиная с 5-й недели беременности и повторяя каждые 4 нед до 33–й недели, с отличным положительным эффектом [33]. Точно также A.L. Clark с соавт. сообщили о частоте живорождения 84 % у 15 женщин с АФС, получавших ежемесячное введение ВВИГ наряду с низкими дозами АСК, подкожным введением гепарина и стероидов. Более того, авторы сообщили о значительном снижении уровня антител к кардиолипину при 7 беременностях [34]. N. Watanabe с соавт. также подтвердили преимущества терапии ВВИГ (5-дневный курс по 0,4 мг/кг с 6–7 нед гестации) у беременных с АФС в сочетании с инъекциями нефракционированного гепарина, низкими дозами АСК и преднизолоном. Никаких кровотечений или тромботических осложнений не было зарегистрировано, и все 3 пациентки родили живых детей [28].
Однако большинство исследований ВВИГ во время беременности являются обсервационными, а не рандомизированными. Пилотное исследование лечения ВВИГ у женщин с АФС и тремя или более самопроизвольными выкидышами в I триместре показало, что применение ВВИГ в дозе 0,3 мг/кг сразу после регистрации беременности с интервалом в 3 нед до 16–17-й недели гестации привело к 31 из 34 успешных беременностей [35]. В 1998 г. G. Sher с соавт. продемонстрировали, что ВВИГ улучшали рождаемость у женщин с циркуляцией АФА, беременность у которых наступила после ЭКО, лечение проводилось в комбинации с НМГ и АСК [15]. Рандомизированное двойное слепое плацебо-контролируемое пилотное исследование, проведенное D.W. Branch с соавт., показало отличные акушерские исходы [36]. Впоследствии E. Vaquero с соавт. в своем проспективном двуцентровом исследовании сообщили о меньшем количестве случаев гестационной гипертензии и гестационного диабета в группе, получавшей ВВИГ, по сравнению с пациентками, получавшими преднизолон плюс низкие дозы АСК, с эквивалентными показателями живорождения [37]. Исследование, проведенное в 2002 г., показало благоприятные исходы для плода у женщин с АФС, получавших ВВИГ в комбинации с АСК и гепарином и неответивших на стандартные схемы [38]. Другие исследования представили противоположные результаты: большее количество живорождений в группе беременных с АФС, получавших стандартную антикоагулянтную терапию [39][40], или отсутствие существенных различий между женщинами, получавшими ВВИГ, и женщинами, получавшими стандартное лечение [41]. В двух других работах показаны многообещающие результаты и превосходство комплексного лечения, включая ВВИГ, у женщин с АФС для снижения частоты осложнений беременности, хотя и без различий в количестве спонтанных абортов [42][43].
По данным ряда авторов, на данный момент терапию ВВИГ при акушерском АФС следует применять для отдельных пациентов, когда нет эффекта от традиционного лечения, при наличии других аутоиммунных состояний, инфекций, в случае противопоказаний к применению антикоагулянтов [42].
Иммунорегуляторные эффекты ВВИГ при аутоиммунных и воспалительных заболеваниях зависят от различных механизмов, некоторые из которых до сих пор неясны. Иммуномодулирующий потенциал ВВИГ у пациентов с различными иммуноопосредованными, воспалительными и аутоиммунными заболеваниями является следствием ряда сложных механизмов. Предполагается, что ВВИГ воздействуют более чем на одно звено иммунной системы, при этом мишенями являются многие врожденные и адаптивные иммунные пути. Кроме того, было продемонстрировано множество неиммунологических эффектов. Доступные исследования, включая отчеты о случаях, серии случаев, наблюдательные исследования, рандомизированные контролируемые испытания, систематические обзоры и метаанализы, подтвердили эффективность и безопасность введения ВВИГ у пациентов с отдельными аутоиммунными, иммуноопосредованными, воспалительными состояниями, а также у беременных с привычным невынашиванием и циркуляцией АФА.
Заключение / Conclusion
Сложной задачей для врача-клинициста является ведение беременных с циркуляцией АФА. У данного контингента женщин вероятность возникновения акушерских осложнений высока на всех сроках гестации. Применение стандартной терапии (низкие дозы АСК в сочетании с НМГ), а также лекарственных средств других групп (глюкокортикостероиды, гидроксихлорохин) часто не позволяет добиться положительного исхода беременности. В ходе нашего исследования было установлено, что применение ВВИГ в сочетании с АСК и НМГ позволило достичь высокой частоты благоприятных исходов беременности, но при этом мы не смогли полностью исключить возникновение осложненного течения беременности.
С целью оценки эффективности профилактики ПАО у пациенток с привычным невынашиванием и циркуляцией АФА можно использовать определение относительной площади экспрессии антикоагулянтного протеина аннексина V, эндотелиального маркера CD 34+, KiSS-peptine и его рецепторов KiSS1R в плаценте.
Список литературы
1. Решетняк Т.М. Антифосфолипидный синдром: диагностика и клинические проявления (лекция). Научно-практическая ревматология. 2014;52(1):56-71. https://doi.org/10.14412/1995-4484-2014-56-71.
2. Макацария А.Д., Бицадзе В.О., Хизроева Д.Х. и др. Патогенетическое значение антифосфолипидных антител. Практическая медицина. 2012;(5):9-21.
3. Miyakis S., Lockshin M.D., Atsumi T. et al. International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS). J Thromb Haemost. 2006;4(2):295-306. https://doi.org/10.1111/j.1538-7836.2006.01753.x.
4. Cervera R., Khamashta M.A., Shoenfeld Y. et al. Morbidity and mortality in the antiphospholipid syndrome during a 5-year period: a multicentre prospective study of 1000 patients. Ann Rheum Dis. 2009;68(9):1428-32. https://doi.org/10.1136/ard.2008.093179.
5. Costedoat-Chalumeau N., Guettrot-Imbert G., Leguern V. et al. Pregnancy and antiphospholipid syndrome. La Rev Med Interne. 2012;33(4):209-16. (In French). https://doi.org/10.1016/j.revmed.2012.01.003.
6. Branch D.W., Khamashta M.A. Antiphospholipid syndrome: obstetric diagnosis, management, and controversies. Obstet Gynecol. 2003;101(6):1333-44. https://doi.org/10.1016/s0029-7844(03)00363-6.
7. Сидельникова В.М. Подготовка и ведение беременности у женщин с привычным невынашиванием: методические пособия и клинические протоколы. М.: МЕДпресс-информ, 2011. 224 с.
8. Шаповалова Е.А. Привычное невынашивание беременности при наличии циркулирующих антифосфолипидных антител (клиника, диагностика, лечение): Автореф. дис.... канд. мед. наук. СПб, 2001.
9. Branch D.W., Silver R.M., Porter T.F. Obstetric antiphospholipid syndrome: current uncertainties should guide our way. Lupus. 2010;19(4):446-52. https://doi.org/10.1177/0961203310361490.
10. Ernest J.M., Marshburn P.B., Kutteh W.H. Obstetric antiphospholipid syndrome: an update on pathophysiology and management. Semin Reprod Med. 2011;29(6):522-39. https://doi.org/10.1055/s-0031-1293206.
11. Kultech W.H., Rote N.S., Silver R. Antiphospholipid antibodies and reproduction: the anti phospholipid antibodiy syndrome. Am J Reprod Immunol. 1999;41(2):133-52. https://doi.org/10.1111/j.1600-0897.1999.tb00087.x.
12. Kim E., Do T., Peacock K., Takundwa P.T. Recommended therapeutic INR range for patients with antiphospholipid syndrome on warfarin anticoagulation: is moderate-intensity (INR 2.0-3.0) or high-intensity (INR 3.1-4.0) better for reducing risk of recurrent thromboembolic events? Cureus. 2016;8(9):765-70. https://doi.org/10.7759/cureus.765.
13. Khamashta M., Taraborelli M., Sciascia S., Tincani A. Antiphospholipid syndrome. Best Prac Res Clin Rheumatol. 2016;30(1):133-48. https://doi.org/10.1016/J.BERH.2016.04.002.
14. Ярилин А.А. Иммунология. М.: ГЭОТАР-Медиа, 2010. 752 c.
15. Sher G., Matzner W., Feinman M. et al. The selective use of heparin/ aspirin therapy, alone or in combination with intravenous immunoglobulin G, in the management of antiphospholipid antibody-positive women undergoing in vitro fertilization. Am J Reprod Immunol. 1998;40(2):74-82. https://doi.org/10.1111/j.1600-0897.1998.tb00394.x.
16. Di Simone N., Di Nicuolo F., D'Ippolito S. et al. Antiphospholipid antibodies affect human endometrial angiogenesis. Biol Reprod. 2010;83(2):212-19. https://doi.org/10.1095/biolreprod.110.083410.
17. Di Simone N., Castellani R., Caliandro D., Caruso A. Antiphospholid antibodies regulate the expression of trophoblast cell adhesion molecules. Fertil Steril. 2002;77(4):805-11. https://doi.org/10.1016/s0015-0282(01)03258-7.
18. D'Ippolito S., Meroni P.L., Koike T. et al. Obstetric antiphospholipid syndrome: a recent classification for an old defined disorder. Autoimmun Rev. 2014;13(9):901-8. https://doi.org/10.1016/j.autrev.2014.05.004.
19. Макацария А.Д., Бицадзе В.О., Смирнова Л.М. Тромбогеморрагические осложнения в акушерско-гинекологической практике. М.: МИА, 2011. 1050 c.
20. Микаелян А.Г., Марей М.В., Булатова Ю.С. и др. Исследование взаимосвязи состава микровезикул крови беременных с последующими плацента-ассоциированными осложнениями. Доктор.Ру. 2022;21(5):6-12. https://doi.org/10.31550/1727-2378-2022-21-5-6-12.
21. Минаева Е.А., Шмаков Р.Г. Факторы риска и профилактика плацента-ассоциированных заболеваний. Гинекология. 22021;23(3):236-40. https://doi.org/10.26442/20795696.2021.3.200960.
22. Lockshin M.D., Druzin M.L., Qamar T. Prednisone does not prevent recurrent fetal death in women with antiphospholipid antibody. Am J Obstet Gynecol. 11989;160(2):439-43. https://doi.org/10.1016/0002-9378(89)90468-7.
23. Carreras L.O., Perez G.N., Vega H.R., Casavilla F. Lupus anticoagulant and recurrent fetal loss: successful treatment with gammaglobulin. Lancet. 1988;332(8607):393-94. https://doi.org/10.1016/S0140-6736(88)92858-9.
24. Nigro G., Adler S.P., La Torre R., Best A.M. Passive immunization during pregnancy for congenital cytomegalovirus infection. N Engl J Med. 2005;353(13):1350-62. https://doi.org/10.1542/peds.2006-0900KKKK.
25. Кривонос М.И., Зайнулина М.С., Чепанов С.В. и др. Клинико-иммунологические аспекты ведения женщин с неудачами ВРТ. Журнал акушерства и женских болезней. 2014;5(63):89-95. https://doi.org/10.17816/JOWD63589-95.
26. Alijotas-Reig J. Treatment of refractory obstetric antiphospholipid syndrome: The state of the art and new trends in the therapeutic management. Lupus. 2013;22(1):6-17. https://doi.org/10.1177/0961203312465782.
27. Ruffatti A., Favaro M., Hoxha A. et al. Apheresis and intravenous immunoglobulins used in addition to conventional therapy to treat high-risk pregnant antiphospholipid antibody syndrome patients. A prospective study. J Reprod Immunol. 2016;115:14-9. https://doi.org/10.1016/j.jri.2016.03.004.
28. Watanabe N., Yamaguchi K., Motomura K. et al. Combination therapy with anticoagulants, corticosteroids and intravenous immunoglobulin for women with severe obstetric antiphospholipid syndrome. Clin Exp Rheumatol. 2014;32(2):299-300. https://doi.org/10.1086/660146.
29. Tenti S., Cheleschi S., Guidelli G.M. et al. Intravenous immunoglobulins and antiphospholipid syndrome: How, when and why? A review of the literature. Autoimmun Rev. 2016;15(3):226-35. https://doi.org/10.1016/j.autrev.2015.11.009.
30. Сельков С.А., Соколов Д.И., Чепанов С.В. Иммунорегуляторные эффекты иммуноглобулинов для внутривенного введения. Медицинская иммунология. 2013;15(1):5-12.
31. Velikova T., Sekulovski M., Bogdanova S. et al. Intravenous immunoglobulins as immunomodulators in autoimmune diseases and reproductive medicine. Antibodies. 2023;1(12):1-24. https://doi.org/10.3390/antib12010020.
32. Carp H.J.A., Asherson R.A., Shoenfeld Y. Intravenous immunoglobulin in pregnancies complicated by the antiphospholipid syndrome: what is its role? J Clin Rheumatol. 2001;7(5):291-94. https://doi.org/10.1097/00124743-200110000-000074.
33. Valensise H., Vaquero E., De Carolis C. et al. Normal fetal growth in women with antiphospholipid syndrome treated with high-dose intravenous immunoglobulin (IVIG). Prenat Diagn. 1995;15(6):509-17. https://doi.org/10.1002/pd.1970150603.
34. Clark A.L., Branch D.W., Silver R.M. et al. Pregnancy complicated by the antiphospholipid syndrome: Outcomes with intravenous immunoglobulin therapy. Obstet Gynecol. 11999;93(3):437-41. https://doi.org/10.1016/S0029-7844(98)00437-2.
35. Marzusch K., Dietl J., Klein R. et al. Recurrent first trimester spontaneous abortion associated with antiphospholipid antibodies: A pilot study of treatment with intravenous immunoglobulin. Acta Obstet Gynecol Scand. 1996;75(10):922-26. https://doi.org/10.3109/00016349609055029.
36. Branch D.W., Peaceman A.M., Druzin M. et al. A multicenter , placebo-controlled pilot study of intravenous immune globulin treatment of antiphospholipid syndrome during pregnancy Am J Obstet Gynecol. 2000;182(1):122-27. https://doi.org/10.1016/S0002-9378(00)70500-X.
37. Vaquero E., Lazzarin N., Valensise H. et al. Pregnancy outcome in recurrent spontaneous abortion associated with antiphospholipid antibodies: A comparative study of intravenous immunoglobulin versus prednisone plus low-dose aspirin. Am J Reprod Immunol. 2001;45(3):174-79. https://doi.org/10.1111/j.8755-8920.2001.450309.x.
38. Diejomaoh M.F., Al-Azemi M.M., Bandar A. et al. A favorable outcome of pregnancies in women with primary and secondary recurrent pregnancy loss associated with antiphospholipid syndrome. Arch Gynecol Obstet. 2002;266(2):61-6. https://doi.org/10.1007/s004040100179.
39. Jeremie K., Pervulov M., Gojnie M. et al. Comparison of two therapeutic protocols in patients with antiphospholipid antibodies and recurrent miscariages. VojnosanitPregl. 2005;62(6):435-39. https://doi.org/10.2298/vsp0506435j.
40. Triolo G., Ferrante A., Ciccia F. et al. Randomized study of subcutaneous low molecular weight heparin plus aspirin versus intravenous immunoglobulin in the treatment of recurrent fetal loss associated with antiphospholipid antibodies. Arthritis Rheum. 2003;48(3):728-31. https://doi.org/10.1002/art.10957.
41. Dendrinos S., Sakkas E., Makrakis E. Low-molecular-weight heparin versus intravenous immunoglobulin for recurrent abortion associated with antiphospholipid antibody syndrome. Int J Gynecol Obstet. 2009;104(3):223-25. https://doi.org/10.1016/j.ijgo.2008.11.010.
42. Xiao J., Xiong J., Zhu F., He L. Effect of prednisone, aspirin, low molecular weight heparin and intravenous immunoglobulin on outcome of pregnancy in women with antiphospholipid syndrome. Exp Ther Med. 2013;5(139):287-91. https://doi.org/10.3892/etm.2012.743.
43. Heilmann L., Schorch M., Hahn T. et al. Pregnancy outcome in women with antiphospholipid antibodies: Report on a retrospective study. Semin Thromb Hemost. 2008;34(8):794-802. https://doi.org/10.1055/s-0029-114526.
Об авторах
Д. Р. ЕремееваРоссия
Еремеева Дина Рустемовна - к.м.н.
197022 Санкт-Петербург, ул. Льва Толстого, д. 6/8; 192014 Санкт-Петербург, ул. Маяковского, д. 5
М. С. Зайнулина
Россия
Зайнулина Марина Сабировна - д.м.н., проф.
197022 Санкт-Петербург, ул. Льва Толстого, д. 6/8; 192014 Санкт-Петербург, ул. Маяковского, д. 5
Scopus Author ID 37076359000; WoS ResearcherID B-5746-2018
Что уже известно об этой теме?
► В генезе осложненного течения беременности высока роль носительства антифосфолипидных антител (АФА). Частота привычного невынашивания, согласно различным источникам, колеблется от 7 до 42 %. Также наличие высоких титров АФА играет важную роль в патогенезе тромбоэмболических осложнений, которые имеют высокий процент смертности.
► Возникает необходимость разработки системы профилактики и прогнозирования, которая могла бы предотвратить развитие плацента-ассоциированных осложнений. Это очень актуальная задача. К сожалению, в настоящее время, несмотря на применение различных методов профилактики и лечения, не удалось снизить частоту развития пре-
эклампсии и задержки роста плода.
Что нового дает статья?
► Применение внутривенных иммуноглобулинов (ВВИГ) в сочетании с ацетилсалициловой кислотой (АСК) и низкомолекулярными гепаринами (НМГ) позволило достичь высокой частоты благоприятных исходов беременности
► При анализе результатов гистологического исследования плацент женщин были выявлены статистически значимые различия. В группе применения ВВИГ частота встречаемости плацентарной недостаточности была достоверно ниже, а в большинстве случаев гистологически подтвержден нормопластический тип строения плаценты.
► В результате сравнения относительной площади экспрессии аннексина V, CD 34+, кисспептина (KiSS-peptine) и его рецепторов KiSS1R были выявлены статистически значимые различия. Относительная площадь экспрессии антикоагулянтного протеина аннексина V была в 2,3 раза выше у пациенток, получавших ВВИГ при беременности; эндотелиального маркера CD34+ – в 4 раза выше, KiSS-peptine – в 2,3 раза, а его рецепторов KiSS1R – в 5,4 раза выше в плацентах женщин, которым проводилась терапия ВВИГ с ранних сроков беременности.
Как это может повлиять на клиническую практику в обозримом будущем?
► Исследование плаценты иммуногистохимическим методом с определением относительной площади экспрессии антикоагулянтного протеина аннексина V, эндотелиального маркера CD 34+, KiSS-peptine и его рецепторов KiSS1R можно использовать как высокоэффективный метод контроля эффективности терапии ВВИГ.
► Применение ВВИГ в сочетании с АСК и НМГ позволит улучшить исходы беременностей у пациенток с носительством АФА и репродуктивными потерями в анамнезе.
Рецензия
Для цитирования:
Еремеева Д.Р., Зайнулина М.С. Оценка эффективности профилактики плацента-ассоциированных осложнений у пациенток с отягощенным акушерским анамнезом и циркуляцией антифосфолипидных антител. Акушерство, Гинекология и Репродукция. 2024;18(4):475-491. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.479
For citation:
Eremeeva D.R., Zainulina M.S. Assessing the effectiveness of preventing placenta-associated complications in patients with burdened obstetric history and circulating antiphospholipid antibodies. Obstetrics, Gynecology and Reproduction. 2024;18(4):475-491. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.479

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































