Перейти к:
Иммунологическое тестирование при женском бесплодии: современный взгляд на проблему
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.532
Аннотация
Введение. По разным оценкам, в России бесплодны от 10 до 20 % людей репродуктивного возраста. Изменения в иммунной системе играют ключевую роль в этиологии и лечении различных форм бесплодия. Активное внедрение иммунологического тестирования в клиническую практику потенциально может улучшить результаты диагностики и лечения бесплодия.
Цель: проанализировать современные литературные данные, посвященные иммунологическому тестированию при женском бесплодии, а также оценить его потенциальную роль в диагностике и лечении бесплодия.
Материалы и методы. Проведен поиск публикаций в электронных базах данных PubMed и еLibrary. Для поиска использовались следующие ключевые слова и их сочетания на русском и английском языке: «бесплодие», «иммунология», «иммунная система», «иммунологическое тестирование», «диагностика», «лечение», «infertility», «immunology», «immune system», «immunological testing», «diagnostics», «treatment». Статьи оценивали в соответствии с рекомендациями PRISMA. В конечном итоге в обзор было включено 88 публикаций.
Результаты. Тестирование на антифосфолипидные антитела (АФА) может быть полезно для женщин, проходящих терапию с использованием вспомогательных репродуктивных технологий (ВРТ), так как эти антитела повышают риск осложнений беременности и тромботических рисков, связанных со стимуляцией яичников; однако исследования влияния АФА на исходы экстракорпорального оплодотворения (ЭКО) дают неоднозначные результаты. Наличие антитиреоидных антител (ATA) может быть связано с бесплодием, поэтому их оценка действительно важна для определения тактики лечения. Существует предположение, что антинуклеарные антитела (АНА) могут влиять на репродуктивную функцию, нарушая развитие клеток трофобласта и препятствуя транскрипции РНК, что может привести к снижению репродуктивного успеха. Исследования показали, что у пациенток с положительным результатом на АНА наблюдается более низкая частота наступления беременности и более высокий уровень выкидышей после процедуры ЭКО. Вирус герпеса человека 6-го типа (ВГЧ-6) оказывает влияние на фертильность женщин и нередко является причиной самопроизвольного прерывания беременности. Белок 6 В-клеточной лимфомы (англ. B-cell lymphoma protein 6, BCL-6) может служить важным прогностическим биомаркером для выявления лиц с эндометриозом и связанными с ним нарушениями репродуктивной функции. Оценка децидуализации эндометрия может стать полезным инструментом для определения готовности к имплантации эндометрия и предоставления возможностей для проведения целенаправленных терапевтических вмешательств. Вопрос тестирования на NK-клетки у пациентов, проходящих обследование по поводу бесплодия, остаётся дискуссионным из-за сложностей стандартизации рекомендаций по тестированию.
Заключение. На сегодняшний день имеется ограниченное количество достоверных данных, посвященных роли различных иммунологических тестов в диагностике и лечении бесплодия. За исключением тестирования на АФА у пациенток с привычным невынашиванием беременности, а также на тиреотропный гормон (ТТГ) и антитела к тиреопероксидазе (TPOAb) у пациенток, проходящих терапию с использованием различных видов ВРТ, остальные иммунологические тесты имеют скудные данные для обоснования их рутинного использования в клинической практике. Основными ограничениями существующих исследований являются небольшая выборка, а также неоднородность критериев включения, групп пациентов и методов исследования.
Для цитирования:
Конкина А.В., Бликян Л.А., Алейникова Д.Э., Абубакаров И.Р., Джуманьязова А.С., Абрамьян А.В., Гафурова Л.Г., Лобко Д.А., Позоян А.А., Тхагапсова К.М., Голубева М.С., Шванова Е.Е., Рыжов Е.О. Иммунологическое тестирование при женском бесплодии: современный взгляд на проблему. Акушерство, Гинекология и Репродукция. 2024;18(4):547-562. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.532
For citation:
Konkina A.V., Blikyan L.A., Aleynikova D.E., Abubakarov I.R., Dzhumanyazova A.S., Abramian A.V., Gafurova L.G., Lobko D.A., Pozoyan A.A., Thagapsova K.M., Golubeva M.S., Shvanova E.E., Ryzhov E.O. Immunological testing for female infertility: a modern view on the problem. Obstetrics, Gynecology and Reproduction. 2024;18(4):547-562. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.532
Введение / Introduction
Бесплодие – это заболевание, которое характеризуется невозможностью достичь беременности после 12 мес регулярной половой жизни без контрацепции. Оно может быть вызвано нарушениями репродуктивной функции у одного или обоих партнёров [1]. В последние годы в России наблюдается устойчивая естественная убыль населения. По данным Росстата за 2020 г., рождаемость в Российской Федерации снизилась на 5,4 %, а естественная убыль населения составила 265 565 человек [2]. По разным оценкам, в России бесплодны от 10 до 20 % людей репродуктивного возраста, при этом у большинства из них проблемы с зачатием вызваны сочетанием женских и мужских факторов бесплодия [3].
На сегодняшний день активно растет интерес к изучению роли иммунологии в формировании бесплодия. Хорошо известно, что иммунная система играет важную роль в репродуктивной функции женщины, начиная от имплантации и заканчивая поддержанием беременности [4]. Изменения в иммунной системе играют ключевую роль в этиологии и лечении различных форм бесплодия, включая общее бесплодие, идиопатическое бесплодие (ИБ), привычное невынашивание беременности (ПНБ) и повторные неудачи имплантации (ПНИ). В случае если причина бесплодия не выявляется после стандартного обследования, ставится диагноз ИБ. В эту категорию попадает до 30 % супружеских пар [5]. ПНБ определяется как последовательная потеря 2 или более беременностей до наступления возраста жизнеспособности плода. Его распространенность варьируется от возраста женщины и достигает 50 % у женщин старше 40 лет [6]. Несмотря на большое количество исследований, на сегодняшний день не существует общепринятого определения ПНИ, но обычно под ним понимается отсутствие имплантации после многократного переноса эмбрионов. Эта проблема затрагивает примерно 10 % пар, проходящих процедуру экстракорпорального оплодотворения (ЭКО) [7][8].
Репродуктивные иммунологические нарушения, как считается, довольно распространены среди пациентов с ИБ, ПНБ и ПНИ. Тем не менее репродуктивная иммунология не является полностью устоявшейся и признанной дисциплиной.
Цель: проанализировать современные литературные данные, посвященные иммунологическому тестированию при женском бесплодии, а также оценить его потенциальную роль в диагностике и лечении бесплодия.
Материалы и методы / Materials and Methods
Проведен поиск публикаций в электронных базах данных PubMed и еLibrary. Для поиска использовались следующие ключевые слова и их сочетания на русском и английском языке: «бесплодие», «иммунология», «иммунная система», «иммунологическое тестирование», «диагностика», «лечение», «infertility», «immunology», «immune system», «immunological testing», «diagnostics», «treatment». Статьи оценивали в соответствии с рекомендациями PRISMA.
На этапе идентификации авторами исключались дублирующие публикации; на этапе скрининга оценивались названия и аннотации выявленных публикаций на предмет соответствия тематике настоящего обзора, также на этом этапе исключались краткие сообщения в редакции научных журналов и тезисы. На приемлемость оценивали полнотекстовые версии рукописей, исключая публикации, несоответствующие критериям включения. Критерии включения: язык публикации русский или английский; в статье рассматривается определенный метод иммунологического тестирования в диагностике и/или лечении бесплодия; исследования проведено на людях. В конечном итоге в обзор было включено 88 исследований, блок-схема отбора публикаций представлена на рисунке 1.
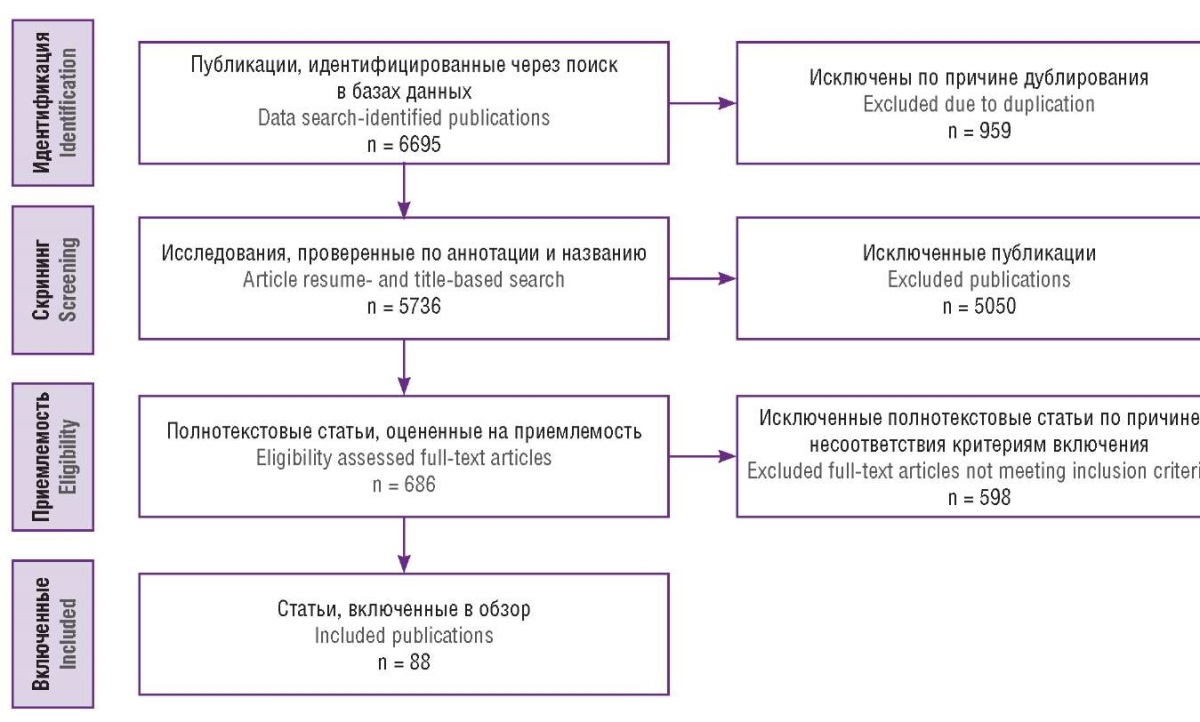
Рисунок 1. Схема отбора публикаций.
Figure 1. Publication selection scheme.
Результаты и обсуждение / Results and Discussion
Варианты иммунологического тестирования / Immunological testing options
Антифосфолипидные антитела / Antiphospholipid antibodies
Антифосфолипидные антитела (АФА) представляют собой группу антител против мембранных фосфолипидов и фосфолипидсвязывающих белков и включают волчаночный антикоагулянт (англ. lupus anticoagulant, LA), антикардиолипиновые антитела (англ. anticardiolipin antibodies, aCL) и антитела к β2-гликопротеину 1 (англ. anti-β2-glycoprotein 1 antibodies, aβ2-GP1) [9]. В отличие от других аутоантител, механизмы, посредством которых АФА приводят к неблагоприятным репродуктивным исходам, достаточно хорошо изучены. Установлено, что АФА усиливают апоптоз клеток трофобласта и вызывают нарушения в их развитии [10]. Исследование, проведённое в 2022 г., выявило значительное снижение уровня Т-лимфоцитов у женщин с антифосфолипидным синдромом (АФС). Это может быть связано с недостаточной децидуализацией эндометрия, необходимой для контролируемой инвазии эмбрионов. Недостаточная децидуализация может проявляться как нарушение имплантации и невынашивание беременности [11].
В ретроспективном обсервационном исследовании, проведенном F. Del Porto с соавт., было выявлено, что около 8 % женщин с ИБ имеют стойкий положительный результат на АФА, в то время как среди населения в целом этот показатель составляет примерно 2 %. Это позволяет предположить, что аутоантитела могут оказывать влияние на зачатие. В ходе исследования было установлено, что 55 % бесплодных пациенток с АФА имели в анамнезе повторные неудачи применения вспомогательных репродуктивных технологий (ВРТ). Авторы исследования пришли к выводу, что учитывая осложнения беременности и тромботические риски, связанные со стимуляцией яичников, тестирование на АФА может быть полезным инструментом для женщин, проходящих терапию с использованием ВРТ [12]. Что касается ПНИ, H. Motak-Pochrzest и А. Malinowski обнаружили повышение уровней aCL IgG, IgM и aβ2-GP1 IgG у пациенток с ПНИ по сравнению с пациентками, имеющими успешную беременность после ЭКО. Однако различия не были статистически значимыми [13].
Исследования влияния АФА на исходы ЭКО дали неоднозначные результаты.
Одно проспективное когортное исследование с участием 193 женщин, проходящих первый цикл ЭКО, показало, что среди них 5,9 % имели АФА. Исследование выявило сходную клиническую частоту наступления беременности, частоту продолжающихся беременностей и частоту выкидышей в группах АФА+ и АФА– [14]. Систематический обзор 2019 г., который включал 10 исследований, показал, что наличие АФА, по-видимому, не влияет ни на текущую беременность/живорождение, ни на клиническую частоту наступления беременности [15]. Однако большинство исследований показывают, что пациенты с АФА имеют худшие репродуктивные результаты. Исследование, проведённое в 2022 г., определило, что у женщин с АФА было меньше качественных эмбрионов, яйцеклеток метафазы II (MII), а также отмечалось меньшее образование бластоцист, снижение частоты имплантации, клинической беременности и живорождения [16].
Проспективное когортное исследование с участием 1720 женщин, проходящих первый цикл ЭКО/ИКСИ (интрацитоплазматическая инъекция сперматозоида), показало, что aCL IgG были в значительной степени связаны с более высокой частотой невынашивания беременности и более низкими показателями живорождения, aCL IgM – с более высокой частотой невынашивания беременности, aβ2-GP1 IgG – с более низкой частотой имплантации и наступления клинической беременности; взаимосвязи между aβ2-GP1 IgM и результатами ЭКО/ИКСИ выявлено не было. Авторы пришли к выводу, что АФА следует регулярно оценивать у женщин, проходящих первые циклы ЭКО/ИКСИ, учитывая их негативное влияние на результаты ВРТ [17].
Метаанализ, проведённый R. Gao с соавт. в 2021 г., который включал 23 исследования, показал, что у женщин, которым не удалось провести процедуру ЭКО/ИКСИ, показатель АФА+ был выше, чем у тех, кому эта процедура удалась. У женщин с АФА+ частота невынашивания беременности была выше, чем у пациенток с АФА–; однако различий в биохимических показателях, клинической частоте наступления беременности или живорождении не наблюдалось [18]. Авторы исследования сделали вывод, что тестирование на АФА при планировании ЭКО/ИКСИ может быть полезным для выявления пациенток с повышенным риском осложнений во время беременности. Несмотря на полученные данные, ни одна крупная медицинская организация, занимающаяся проблемами бесплодия, не рекомендует проводить тестирование на АФА у пациенток, проходящих ВРТ. Кроме того, авторы не рекомендуют использовать преимплантационное генетическое тестирование на анеуплоидии (ПГТ-А) у пациенток, проходящих ВРТ. Тем не менее в клинической практике большинство центров репродуктологии поощряют использование ПГТ-А, но не АФА-тестирование.
Рекомендации по тестированию на АФА у пациенток с ПНБ стали более чёткими. И в рекомендациях Американского общества репродуктивной медицины (англ. American Society for Reproductive Medicine, ASRM) за 2012 г. и в рекомендациях Европейского общества репродукции человека и эмбриологии (англ. European Society of Human Reproduction and Embryolog, ESHRE) за 2017 г. рекомендуется проводить тестирование на ВА и aCL. Кроме того, ASRM рекомендует проводить тестирование на aβ2-GP1, в то время как ESHRE считает эту связь менее значимой [19][20]. В российских клинических рекомендациях данные по тестированию на АФА отсутствуют.
Антитиреоидные антитела / Antithyroid antibodies
Хорошо известно, что для нормальной менструальной функции и поддержания беременности необходима адекватная выработка гормонов щитовидной железы. Эти гормоны играют ключевую роль в имплантации и раннем развитии плода. Однако роль аутоиммунного тиреоидита (АИТ), определяемого наличием антитиреоидных антител (ATA), направленных против тиреоидной пероксидазы (TPOAb) и тиреоглобулина (TgAb), при отсутствии явной дисфункции щитовидной железы остаётся предметом споров [21]. АИТ может служить маркером общего иммунного дисбаланса, влияющего на оплодотворение, имплантацию и поддержание беременности. Вероятно, существует определённое иммунологическое воздействие на яичники и матку [21][22].
Недавние исследования были направлены на то, чтобы лучше понять патофизиологию АИТ и исходы беременности. В одном исследовании для анализа фолликулярной жидкости 61 пациентки, перенёсшей ЭКО, была использована метаболомика. В том числе были исследованы 38 женщин с ATA+ и 23 с АТА– (контрольная группа). В ходе исследования было выявлено 15 метаболитов с более высокими концентрациями в образцах фолликулярной жидкости у пациенток с АТА+. Эти метаболиты были связаны с 5 путями регуляции функции яичников, что указывает на потенциальный механизм связи с бесплодием [23]. В исследовании, проведенном J. Xie c соавт., использовалось секвенирование одноклеточной РНК для изучения иммунных клеток в образцах эндометрия у пациенток с ИБ с АИТ по сравнению с пациентками без АИТ. Исследование выявило различия в составе и путях экспрессии генов в 2 группах пациенток. Это позволяет предположить, что иммунный дисбаланс в эндометрии может повлиять на имплантацию эмбриона [24].
Существует множество исследований, посвящённых влиянию АИТ на результаты ВРТ, однако их результаты противоречивы. В проспективном когортном исследовании, включавшем 1720 пациенток, проходивших первый цикл ЭКО/ИКСИ, приняли участие 214 (12,4 %) женщин с TPOAb+ и 235 (13,7 %) женщин с TgAb+. Частота имплантаций была ниже в группе TPOAb+, но статистически незначима; также авторы не выявили различий в исходах беременности [17]. Проведённый в 2019 г. метаанализ, оценивающий влияние АИТ на результаты ЭКО, показал, что у пациенток с ATA+ не было различий в частоте биохимической беременности; более низкая частота наступления клинической беременности наблюдалась в 3 из 14 исследований, более высокая частота невынашивания беременности – только в 1 из 11 исследований, и отсутствие различий в показателе живорождения/продолжающейся беременности. Авторы пришли к выводу, что АИТ у женщин с эутиреозом не коррелирует с худшими исходами ВРТ [15]. Эти результаты согласуются с метаанализом, проведённым в 2020 г., который также не установил различий в результатах ВРТ у женщин с АИТ и без него [25]. Однако эти результаты противоречат 2 более ранним метаанализам, которые выявили более высокие показатели выкидышей у женщин с эутиреозом и АИТ [26][27].
В одном из метаанализов, проведённых в 2023 г., изучалась взаимосвязь между успехом ВРТ и наличием TPOAb у пациенток с эутиреозом. Авторы обнаружили, что у пациенток с эутиреозом и уровнем TPOAb свыше 100 МЕ/мл значительно чаще наблюдались случаи невынашивания беременности и реже наступали роды. Это указывает на то, что высокий уровень TPOAb негативно влияет на исход беременности при проведении ВРТ даже у пациенток с эутиреозом [28].
Исследования, посвящённые оценке влияния АИТ на фертильность, сталкиваются с ограничениями, связанными с неоднородностью выборки, структурой исследования, причинами бесплодия, видом ВРТ, ограничениями приёма тиреотропного гормона (ТТГ) и выбором препаратов для лечения АИТ у пациентов с эутиреозом. Будущие исследования должны включать большие проспективные когорты и фокусироваться на пересадке эуплоидных эмбрионов женщинам старше 35 лет, поскольку анеуплоидия эмбриона оказывает наибольшее влияние на результаты. Американская ассоциация щитовидной железы (англ. American Thyroid Association, АТА) рекомендует женщинам с бесплодием или невынашиванием беременности в анамнезе пройти проверку уровня ТТГ как только беременность подтверждена, с дополнительной оценкой TPOAb, если уровень ТТГ превышает 2,5 мМЕ/л [29]. Женщины, проходящие ВРТ, должны пройти всеобщий скрининг на ТТГ и TPOAb с оценкой TgAb, если уровень ТТГ > 2,5 мМЕ/л и TPOAb отрицательный [16]. Российские клинические руководства по женскому бесплодию также рекомендуют оценивать ТТГ и TPOAb для уточнения причины бесплодия и при обнаружении отклонений направить пациентку на ультразвуковое исследование щитовидной железы [30].
Антинуклеарные антитела / Antinuclear antibodies
Антинуклеарные антитела (АНА) представляют собой группу аутоантител, которые распознают различные компоненты клеточного ядра. Эти антитела играют ключевую роль в развитии ряда аутоиммунных заболеваний, таких как системная красная волчанка, ревматоидный артрит и синдром Шегрена [15][31].
Существуют предположения о механизмах, через которые АНА могут влиять на репродуктивную функцию. Одним из возможных механизмов является нарушение развития клеток трофобласта, что может приводить к тромбозу плаценты и, как следствие, к снижению репродуктивного успеха. Также предполагается, что АНА могут препятствовать транскрипции РНК, что в свою очередь может вызвать нарушения репликации ДНК и потерю эмбриона [31][32].
В исследовании, проведенном M. Molazadeh с соавт., была обнаружена значительно более высокая частота выявления АНА у пациенток с ПНБ по сравнению со здоровой контрольной группой (13,2 % против 0,9 %; p < 0,0001) [33]. Другое исследование, посвящённое оценке АНА при ЭКО-переносе эмбрионов (англ. еmbryo transfer, ET), выявило значительно более низкие доли яйцеклеток MII, зигот, скорость расщепления, количество и пропорцию доступных эмбрионов, а также количество и пропорцию высококачественных эмбрионов у бесплодных женщин, которые имели положительный результат на наличие AНA. Результаты исследования также продемонстрировали более низкие показатели имплантации и беременности у этих пациенток, что позволяет предположить, что наличие АНА существенно влияет на развитие яйцеклеток и эмбрионов и таким образом снижает частоту имплантации и наступления беременности у пациенток, проходящих ЭКО [34].
Более поздние исследования изучали влияние АНА на фолликулярную жидкость, которая, вероятно, влияет на развитие яйцеклеток до стадии эмбриона [31]. Исследование с участием 380 пациенток, перенёсших ЭКО-ET, показало, что у пациенток с АНА+ фолликулярной жидкостью было самое низкое количество извлечённых яйцеклеток, оплодотворений и высококачественных эмбрионов, а также самый низкий процент наступления клинической беременности и самый высокий процент самопроизвольных абортов [35]. Ещё одно исследование обнаружило более низкие показатели пролиферации цитотрофобласта в группе АНА+ при более высоких показателях апоптоза, что указывает на возможный механизм ухудшения репродуктивных результатов [31].
В последние годы было проведено несколько исследований и метаанализов, направленных на изучение роли АНА у пациентов, проходящих процедуру ЭКО. Проспективное когортное исследование, охватившее данные 1720 пациенток, проходивших первый цикл ЭКО/ИКСИ, не установило существенных различий в исходах беременности между пациентками с положительным результатом на АНА (AНA+) и пациентками с отрицательным результатом (AНA–) [17]. В ходе метаанализа, проведённого в 2023 г. среди женщин с положительным и отрицательным результатом на АНА, проходивших ЭКО/ИКСИ, был зарегистрирован более низкий уровень имплантации, определена более низкая частота наступления беременности и более высокий уровень выкидышей среди женщин с положительным результатом на АНА. Исследование также продемонстрировало более высокую распространённость АНА-позитивности среди женщин с ПНБ [36].
Исследования, посвящённые изучению роли АНА в развитии бесплодия, позволяют выявить возможные механизмы негативного влияния АНА на репродуктивные показатели. Предполагается, что у женщин с АНА репродуктивные показатели могут ухудшаться. Будущие исследования в этой области должны быть направлены на изучение влияния конкретных подтипов АНА. Тем не менее, поскольку наличие АНА не определяет чёткий вариант лечения, целесообразность проведения тестирования остаётся предметом дискуссии.
Вирус герпеса человека 6-го типа / Human herpes virus type 6
Вирус герпеса человека 6-го типа (ВГЧ-6) связан с рядом воспалительных заболеваний, включая рассеянный склероз, тиреоидит Хашимото, энцефалит и экзантему [37–39]. Считается, что ВГЧ-6 влияет на иммунную регуляцию, вызывая апоптоз CD4-Т-лимфоцитов, уничтожая естественные клетки-киллеры (NK-клетки) и блокируя созревание макрофагов [40]. Особенно важно влияние ВГЧ-6 на фертильность у женщин. В одном из ключевых исследований было обнаружено, что 43 % эпителиальных клеток эндометрия у женщин с ИБ были положительны на ВГЧ-6, в то время как у женщин контрольной группы, у которых была хотя бы одна успешная беременность, положительных клеток обнаружено не было [39]. В группе пациенток с ИБ была высокая вирусная нагрузка ДНК ВГЧ-6, однако в стромальных клетках или моноядерных клетках периферической крови интегрированной ДНК обнаружено не было, что позволяет предположить, что диагноз может быть установлен только с помощью биопсии эндометрия. Эти же авторы смогли показать прямое воздействие ВГЧ-6 на эндометрий, продемонстрировав более высокие показатели цитотоксической активации эндометриальных NK-клеток (англ. endometrial NK-cells, eNK-cells) и более низкие показатели CD4+ CD25+ CD127dim/-регуляторных Т-клеток у женщин с бесплодием по сравнению с контрольной группой [40].
Инфекция, вызванная ВГЧ-6, также может быть причиной самопроизвольного прерывания беременности. Первые исследования, проведённые в 1992 г., показали наличие антигенов ВГЧ-6 в тканях плаценты после выкидыша. Впоследствии аналогичные результаты были получены и в других исследованиях [41–43]. H. Miura с соавт. выяснили, что наследование хромосомно интегрированного ВГЧ-6 от матери значительно увеличивает риск двух и более самопроизвольных абортов (отношение шансов (ОШ) = 6,41), тогда как наследование вируса от отца не оказывает такого влияния [44].
В настоящее время не существует стандартизированного подхода к тестированию на ВГЧ-6 у пациенток с ИБ и ПНБ. Также отсутствуют клинические исследования, направленные на изучение исходов беременности после излечения от инфекции, вызванной ВГЧ-6. Тем не менее C.B. Coulam с соавт. предположили, что лечение инфекции ВГЧ-6 у пациенток с ПНБ и/или ИБ может потенциально повысить шансы на успешную беременность более чем на 40 % [45].
Белок 6 В-клеточной лимфомы / B-сell lymphoma 6 protein
Белок 6 В-клеточной лимфомы (англ. B-сell lymphoma 6 protein, BCL-6) представляет собой протоонкоген, который участвует в регуляции клеточной пролиферации и апоптоза [46]. Активация и регуляция BCL-6 происходит через сигнальный преобразователь и активатор транскрипции 3 (англ. signal transducer and activator of transcription 3, STAT3), что приводит к увеличению экспрессии цитокинов – интерлейкинов (англ. interleukin, IL) IL-1, IL-16 и IL-18 [47][48]. Этот процесс стимулирует развитие провоспалительного состояния, характерного для таких заболеваний, как эндометриоз, который является независимым фактором риска бесплодия. Кроме того, BCL-6 взаимодействует с сиртуином-1 (англ. sirtuin 1, SIRT1), формируя комплекс, который способствует повышению резистентности к прогестерону [47–49]. Прогестерон играет важную роль в подготовке эндометрия к имплантации и обеспечении прикрепления эмбриона. Повышение резистентности к прогестерону через описанный механизм может негативно сказаться на исходах беременности, увеличивая риск преждевременных родов и неудачной имплантации.
Белок BCL-6 может служить важным прогностическим биомаркером для выявления лиц с эндометриозом и связанными с ним нарушениями репродуктивной функции, включая ИБ. Исследования показывают, что при диагностике эндометриоза с помощью биопсии эндометрия положительное прогностическое значение BCL-6 достигает 96 % [50]. Также BCL-6 используется как независимый маркер для лиц с ИБ, при этом распространённость повышения уровня BCL-6 среди них составляет 75,3–80,0 % [47][48]. Проспективное когортное исследование, проведенное L.D. Almquist c соавт., выявило, что у женщин с низкой экспрессией BCL-6 в ткани эндометрия значительно чаще наступала беременность (р = 0,0004) и живорождение (ОШ = 0,19; р = 0,0002) [51]. C.E. Likes с соавт. обнаружили, что женщины с эндометриозом и повышенным уровнем BCL-6 имели более высокую частоту выкидышей и более низкую частоту имплантации [52]. Тем не менее для подтверждения эффективности использования оценки BCL-6 у лиц с бесплодием и подозрением на эндометриоз требуются дополнительные исследования.
Оценка децидуализации эндометрия / Assessment of endometrial decidualization
Недавно были проведены исследования, направленные на оценку эффективности комбинированного тестирования различных маркеров на уровне эндометрия для прогнозирования бесплодия и исходов беременности. В одном из недавних исследований оценивались факторы, связанные с децидуализацией эндометрия. Целью было сравнение паттернов экспрессии генов у женщин, страдающих ИБ и ПНБ [53]. Используя секвенирование нового поколения, а именно, метод целевого секвенирования рибонуклеиновых кислот, исследователи смогли идентифицировать ключевые молекулы, участвующие как в экспрессии факторов иммунной регуляции (IL-15, GZMB), так и в передаче сигналов прогестерона, а также в гомеостазе эндометрия – FOXO1 (англ. forkhead box protein O1), SGK1 (англ. serine/threonine-protein kinase), SCNN1A (англ. sensitive sodium channel subunit alpha), SCL2A1 (англ. solute carrier family 2 member 1) [54–57]. Затем была разработана кумулятивная система оценки, получившая название «Шкала децидуализации эндометрия» (англ. Endometrial Decidualization Score, EDS). За каждый ген, экспрессия которого находилась в пределах нормы, присваивался один балл. Исследователи выяснили, что у 89 % пациентов контрольной группы показатель EDS был больше 5, что указывает на преимущественно нормальную экспрессию генов. В то же время у пациентов с ПНБ или ИБ такое же количество баллов наблюдалось всего у 24 % пациентов. Показатели децидуализации были значительно ниже в группах ПНБ и ИБ по сравнению с контролем (в обеих группах p < 0,001). Значение EDS менее 4 предсказывало нарушение децидуализации с чувствительностью 76 % (95 % доверительный интервал (ДИ) = 61–88 %) и специфичностью 89 % (95 % ДИ = 65–99 %).
EDS может стать полезным инструментом для определения готовности к имплантации эндометрия и предоставления возможностей для проведения целенаправленных терапевтических вмешательств. Например, имеются данные, что применение глюкокортикоидов перед процедурой ЭКО может улучшить его результаты у пациентов с повышенным уровнем SGK1 (мишень глюкокортикоидов) по сравнению с пациентами, у которых уровень SGK1 в норме [56]. Однако для подтверждения эффективности EDS и оценки эффективности подобных таргетных методов лечения необходимы дальнейшие исследования.
Оценка иммунного профиля эндометрия / Assessment of endometrium immune profile
Оценка иммунного профиля эндометрия (англ. endometrial immune profiling, EIP) является комплексным исследованием и включает оценку маркеров, участвующих в процессе переключения с адаптивного (Th1) на врождённый (Th2) иммунитет в фазу «имлантационного окна» под управлением eNK-клеток [58–61]. Такими биомаркерами являются: соотношение IL-18/TWEAK (англ. tumor necrosis factor-like weak inducer of apoptosis; фактор некроза опухоли-подобный слабый индуктор апоптоза), которое отражает цитотоксический и ангиогенный баланс в эндометрии; соотношение IL-15/Fn-14 (англ. fibroblast growth factor-inducible 14; индуцируемый фактор роста фибробластов 14) отражает активацию и созревание eNK-клеток; CD56+ отражает уровень и мобилизацию eNK-клеток.
На сегодняшний день выделяют 4 типа иммунного профиля эндометрия: регулируемая иммунная активация, характерная для фертильных женщин; гиперактивация иммунитета (высокий уровень IL-18/TWEAK, IL-15/Fn-14 и/или CD56+); недостаточная активация иммунитета (низкий уровень IL-15/Fn-14 указывает на незрелость еNK-клеток, низкое количество CD56+ указывает на отсутствие мобилизации еNK-клеток и/или низкое соотношение IL-18/TWEAK); смешанный профиль (высокое соотношение IL-18/TWEAK указывает на избыток цитокинов Th1 с низким соотношением IL-15/Fn-14, свидетельствующим о незрелых еNK-клетках). Было проведено множество исследований, в которых оценивалась эффективность EIP у людей, страдающих бесплодием [59][60][62]. Результаты показали, что у пациентов с нарушением иммунного профиля, получавших таргетную терапию (например, низкомолекулярный гепарин, внутривенное введение интралипидов или кортикостероидов), частота наступления беременности была значительно выше по сравнению с пациентами без нарушения иммунного профиля (р = 0,002) [60]. В последующем когортном исследовании пациентов с ПНБ или ИБ частота живорождения была в 2 раза выше у пациентов с нарушением иммунной регуляции, получавших таргетную терапию, по сравнению с контрольной группой, получавшей традиционное лечение (30,5 % против 16,6 %; ОШ = 2,2; 95 % ДИ = 1,27–3,83; р = 0,004) [62]. У этих пациенток также была значительно более низкая частота невынашивания беременности (17,9 % против 43,2 %; ОШ = 0,29; 95 % ДИ = 0,12–0,71; р = 0,005). Несмотря на то что полученные результаты являются многообещающими, необходимы дополнительные исследования для подтверждения роли EIP в персонализации терапии.
Естественные киллеры / Natural killers
NK-клетки играют ключевую роль в иммунном ответе организма на беременность. CD56+ NK-клетки являются основными иммунными клетками, обнаруживаемыми в матке на ранних сроках беременности [63]. Их количество уменьшается на протяжении всей беременности вплоть до полного отсутствия на поздних сроках, поскольку организм воспринимает плод как генетически чужеродный [64][65]. Предполагается, что NK-клетки влияют на имплантацию и плацентацию, стимулируя ангиогенез децидуальной оболочки [65]. Однако повышенные уровни или активность еNK-клеток могут привести к иммунологическому отторжению плода. Таким образом, еNK-клетки оказывают значительное влияние на переносимость беременности и могут стать причиной бесплодия при нарушении их функционирования. Патогенез преэклампсии также связан с тем, что NK-клетки распознают полиморфные антигены гистосовместимости на трофобластах плода [66].
Было проведено несколько исследований, посвящённых роли NK-клеток в процессах имплантации, плацентации и переносимости беременности. Проспективное когортное исследование, проведенное Z. Shojaei с соавт., с участием 192 пациенток, перенёсших процедуру ЭКО, показало, что у пациенток, у которых не произошла успешная имплантация эмбриона, в день переноса эмбриона были статистически более высокие уровни NK-клеток периферической крови и эндометрия, чем у пациенток, у которых процедура ЭКО привела к успешной имплантации [67]. Исследование «случай-контроль», проведенное A. Azargoon с соавт., в котором приняли участие 75 женщин, показало, что у пациенток с ИБ были более высокие уровни периферических CD56+ NK-клеток, а у пациенток с ПНБ и бесплодием – более высокие уровни CD69, маркера клеточной активации NK-клеток, по сравнению с контрольной группой [68]. Кроме того, у пациенток с эндометриозом, страдающих бесплодием, отмечалась более низкая коэкспрессия CD56 на стволовых клетках CD34+, предшественниках еNK-клеток, по сравнению с другими пациентками с эндометриозом без бесплодия. Это позволяет предположить, что фундаментальные различия в клетках-предшественниках еNK могут быть причиной бесплодия [69]. Другое недавнее исследование, проведённое с участием 256 пациенток с ПНБ, ПНИ, ИБ и/или эндометриозом, выявило более низкую вероятность беременности (корреляция –0,203; p = 0,01) у пациенток с аномальными еNK-клетками [70].
Несмотря на проведённые исследования, вопрос тестирования на еNK-клетки и периферические NK-клетки у пациентов, проходящих обследование по поводу бесплодия, остаётся дискуссионным [71]. Сложности стандартизации рекомендаций по тестированию связаны с естественными колебаниями уровней NK-клеток у здоровых людей, инвазивным характером оценки и отсутствием общепринятых критериев для определения «аномальных» уровней NK-клеток, которые могли бы вызвать бесплодие [72]. Важно учитывать, что цитотоксичность периферических NK-клеток может проявляться даже при нормальных уровнях, и предыдущие исследования показали эффективность в выявлении пациенток с ПНБ, которым могла бы быть полезна иммуномодулирующая терапия с использованием этих анализов [73]. Ретроспективное когортное исследование, проведённое в 2021 г. с участием 197 пациентов с ПНБ, показало, что пациентки, которым проводилась иммунотерапия, снижающая уровень NK-клеток в периферической крови, имели более высокие показатели живорождаемости за цикл переноса эмбрионов. Это позволяет предположить, что NK-клетки являются потенциальным маркером для диагностики и лечения бесплодия [74].
Эндометриальные NK-клетки играют значимую роль в процессе имплантации. В частности, они вырабатывают цитокины, которые способствуют формированию иммунной толерантности материнского организма к тканям эмбриона и стимулируют рост плаценты [75]. Были проведены исследования, направленные на оценку уровня NK-клеток у женщин с бесплодием; однако большинство из них сосредоточено на изучении периферических NK-клеток, а не эндометриальных, которые, вероятно, имеют большее значение для исходов беременности и процедур ЭКО.
По данной теме было проведено 2 систематических обзора, в обоих был сделан вывод, что уровень NK-клеток ни в периферической крови, ни в эндометрии сам по себе не может точно прогнозировать исход беременности или частоту выкидышей [76][77]. Тем не менее время проведения биопсии эндометрия для определения уровня еNK-клеток может быть ключевым в понимании этого расхождения. Недавнее когортное исследование показало значимые различия в количестве еNK-клеток, выявленных у одних и тех же участников в разных циклах, причём различия достигали 100 % увеличения или уменьшения между двумя образцами, взятыми у одного и того же человека [78]. Эти различия могут быть обусловлены временем отбора проб в рамках цикла, глубиной или местоположением пробы, а также влиянием предыдущего цикла.
Таким образом, влияние уровня еNK-клеток на беременность и исходы ЭКО требует дальнейших исследований, в идеале с акцентом на понимание различий между циклами. Основная идея заключается в том, что критическим временем тестирования является момент имплантации; однако исследования популяций иммунных клеток в эндометрии, где происходит зачатие на ранних стадиях, могут так и не стать доступными.
Оценка соотношения Th1/Th2 / Th1/Th2 ratio
Th1 и Th2 – это 2 типа Т-хелперов, которые играют важную роль в модуляции адаптивного иммунного ответа [78]. Клетки Th1 продуцируют интерферон гамма (англ. interferon gamma, IFN-γ) и цитокин IL-10, которые участвуют в клеточном иммунитете, а клетки Th2 продуцируют цитокины IL-4, IL-5 и IL-13, которые участвуют в гуморальном иммунитете. Ранние исследования продемонстрировали, что успешная беременность, как спонтанная, так и с использованием ВРТ, характеризуется преобладающей активностью Th2, а неудачная беременность связана с аномально высокой активностью Th1 [79][80]. Большее соотношение Th1/Th2 наблюдалось у пациенток с ПНБ, ПНИ, преждевременными родами и преэклампсией, которые, как полагают, возникают в результате потери толерантности плода.
Перекрёстное исследование, проведенное K. Kuroda с соавт., показало, что высокое соотношение Th1/Th2, определяемое как одно стандартное отклонение, превышающее среднее соотношение Th1/Th2 у фертильных женщин, было связано с более чем 4 неудачными циклами имплантации и более чем 2 потерями беременности [81]. Однако ретроспективное исследование 75 женщин, проходивших ЭКО/ИКСИ, установило, что лечение женщин с повышенным уровнем Th1-цитокинов (IFN-γ и IL-10) не привело к статистически значимому улучшению частоты имплантации, беременности, родов или живорождения на один эмбрион [82]. Другое исследование продемонстрировало, что лечение циклоспорином пациенток с ПНИ и высоким соотношением Th1/Th2, перенесших пересадку эмбрионов, увеличивало шансы на успешное живорождение за счёт снижения частоты Th1, соотношения Th1/Th2, экспрессии мРНК T-bet (англ. T-box expressed in T-cells; T-box, экспрессируемый в Т-клетках), IFN-γ и уровней секреции фактора некроза опухоли альфа (англ. tumor necrosis factor-alpha, TNF-α) [83]. Таким образом, оптимизация соотношения Th1/Th2 с помощью иммуносупрессивной терапии может быть эффективным терапевтическим вмешательством для пациентов с подтверждённым увеличением Th1. Однако необходимы более масштабные исследования для дальнейшего выяснения роли дисбаланса соотношения Th1/Th2 и бесплодия, прежде чем будут даны рекомендации относительно рутинного тестирования.
Th17/регуляторные Т-клетки / Th17/regulatory T cells
Клетки Th17 – это ещё один тип Т-хелперов, которые продуцируют IL-17, IL-21 и IL-22 и участвуют во внеклеточном иммунитете и воспалении при аутоиммунных заболеваниях [84]. Регуляторные Т-клетки (англ. regulatory T cells, Treg) работают над балансированием Th17-клеток путём поддержания периферической толерантности, предотвращая атаку иммунной системой хозяина [85]. Количество Treg-клеток в матке увеличивается во время беременности, что обеспечивает иммунную устойчивость плода. Было обнаружено, что количество клеток Th17 увеличивается в матке пациенток с ПНБ [78].
Исследование, проведённое с участием 155 женщин, включая беременных и небеременных пациенток с ПНБ в анамнезе и контрольную группу, показало, что у пациенток с ПНБ не было нормального увеличения количества периферических Treg-клеток и определялось повышенное соотношение Th17/Treg в децидуальной оболочке [86]. Другое наблюдательное исследование, в котором приняли участие 40 женщин с ПНБ после ЭКО и 50 здоровых женщин, установило, что у пациенток с ПНБ были более высокие уровни Th17 и истощённых Treg-клеток, а также более низкие уровни здоровых Treg-клеток [87].
Полезность тестирования также может быть подтверждена исследованиями, которые демонстрируют преимущества восстановления баланса соотношения Th17/Treg. Исследование, проведённое с участием 19 пациенток с ПНИ и 25 женщин с нормальной фертильностью, выявило, что соотношение Th17/Treg было выше у пациенток с ПНИ. После лечения преднизолоном у пациенток с ПНИ улучшилось отношение к Treg-клеткам (р < 0,01), и у 4 пациенток были успешные роды [88]. Несмотря на многообещающие предварительные результаты, на сегодняшний день доступен крайне небольшой объём исследований, изучающих соотношение Th17/Treg и бесплодие, что требует дальнейшего изучения роли Th17/Treg в терапии бесплодия.
Заключение / Conclusion
На сегодняшний день имеется ограниченное количество достоверных данных, посвященных роли различных иммунологических тестов в диагностике и лечении бесплодия. За исключением тестирования на АФА у пациенток с ПНБ, а также ТТГ и TPOAb у пациенток, проходящих терапию с использованием различных методов ВРТ, остальные иммунологические тесты не имеют доказанной эффективности для обоснования их рутинного использования в клинической практике. Основными ограничениями существующих исследований являются небольшая выборка, а также неоднородность критериев включения, групп пациентов и методов исследования. Более того, на рынке регулярно появляются новые тесты, реклама которых осуществляется через массовые источники информации, контроль и отслеживание которых затруднены, что приводит к повышенному спросу среди пациентов. В связи с этим крайне важно проводить тщательные исследования перед широким внедрением новых иммунологических тестов.
Список литературы
1. Корнеева И.Е., Назаренко Т.А., Перминова С.Г. и др. Медико-социальные факторы бесплодия в России. Акушерство и гинекология. 2023;(3):65-72. https://doi.org/10.18565/aig.2022.279.
2. Федеральная служба государственной статистики. Режим доступа: https://rosstat.gov.ru/folder/313/document/94975. [Дата обращения 13.04.2024].
3. Савина А.А., Фейгинова С.И., Кураева В.М., Армашевская О.В. Проблема несопоставимости уровней заболеваемости мужским и женским бесплодием взрослого населения в Российской Федерации. Социальные аспекты здоровья населения. 2020;(4):7. https://doi.org/10.21045/2071-5021-2020-66-4-7.
4. Цахилова С.Г., Кузнецов В.П., Хмельницкая А.В. и др. Влияние иммунного статуса матери на развитие плода и здоровье новорожденного (обзор литературы). Проблемы репродукции. 2016;22(6):38—43. https://doi.org/10.17116/repro201622638-43.
5. Practice Committee of the American Society for Reproductive Medicine. Evidence-based treatments for couples with unexplained infertility: a guideline. FertilSteril. 2020;113(2):305—22. https://doi.org/10.1016/j.fertnstert.2019.10.014.
6. Шабанова А.А., Шитова М.С. Привычное невынашивание беременности - современный взгляд на проблему. Столыпинский вестник. 2022;(3):1192-203.
7. Ma J., Gao W., Li D. Recurrent implantation failure: a comprehensive summary from etiology to treatment. Front Endocrinol (Lausanne). 2023;13:1061766. https://doi.org/10.3389/fendo.2022.1061766.
8. Митюрина Е.В., Перминова С.Г., Амян Т.С. Причины повторных неудач имплантации в программе экстракорпорального оплодотворения. Акушерство и гинекология. 2016;(11):34-40. https://doi.org/10.18565/aig.2016.11.34-40.
9. Ткаченко О.Ю., Лапин С.В., Шмонин А.А. и др. Анализ спектра анти-фосфолипидных антител у пациентов с тромбозами и привычным невынашиванием беременности. Медицинская иммунология. 2018;20(5):753-62. https://doi.org/10.15789/1563-0625-2018-5-753-762.
10. Багдасарова Ю.С., Зайнулина М.С., Николаева М.Г. Осложнения и исходы беременности у пациенток с носительством антифосфолипидных антител при различных методах лечения. Акушерство, Гинекология и Репродукция. 2023;17(2):176-87. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.414.
11. Krivonos M.I., Khizroeva J. Kh., Zainulina M.S. et al. The role of lymphocytic cells in infertility and reproductive failures in women with antiphospholipid antibodies. J Matern Fetal Neonatal Med. 2022;35(5):871-7. https://doi.org/10.1080/14767058.2020.1732343.
12. Del Porto F., Ferrero S., Cifani N. et al. Antiphospholipid antibodies and idiopathic infertility. Lupus. 2022;31(3):347-53. https://doi.org/10.1177/09612033221076735.
13. Motak-Pochrzest H., Malinowski A. Does autoimmunity play a role in the risk of implantation failures? Neuro Endocrinol Lett. 2018;38(8):575-8.
14. Hong Y.H., Kim S.J., Moon K.Y. et al. Impact of presence of antiphospholipid antibodies on in vitro fertilization outcome. Obstet Gynecol Sci. 2018;61(3):359-66. https://doi.org/10.5468/ogs.2018.61.3.359.
15. Simopoulou M., Sfakianoudis K., Maziotis E. et al. The impact of autoantibodies on IVF treatment and outcome: a systematic review. Int J Mol Sci. 2019;20(4):892. https://doi.org/10.3390/ijms20040892.
16. Wu L., Fang X., Lu F. et al. Anticardiolipin and/or anti-p2-glycoprotein-I antibodies are associated with adverse IVF outcomes. Front Immunol. 2022;13:986893. https://doi.org/10.3389/fimmu.2022.986893.
17. Chen X., Mo M.-L., Huang C.-Y. et al. Association of serum autoantibodies with pregnancy outcome of patients undergoing first IVF/ICSI treatment: a prospective cohort study. J Reprod Immunol. 2017;122:14-20. https://doi.org/10.1016/j.jri.2017.08.002.
18. Gao R., Zeng R., Qing P. et al. Antiphospholipid antibodies and pregnancy outcome of assisted reproductive treatment: a systematic review and meta-analysis. Am J Reprod Immunol. 2021;86(4):e13470. https://doi.org/10.1111/aji.13470.
19. Practice Committee of the American Society for Reproductive Medicine. Evaluation and treatment of recurrent pregnancy loss: a committee opinion. Fertil Steril. 2012;98(5):1103-11. https://doi.org/10.1016/j.fertnstert.2012.06.048.
20. ESHRE Guideline Group on RPL; Atik R.B., Christiansen O.B., Elson J. et al. ESHRE guideline: recurrent pregnancy loss. Hum Reprod Open. 2018;2018(2):hoy004. https://doi.org/10.1093/hropen/hoy004.
21. Платонова Н.М., Маколина Н.П., Рыбакова А.А., Трошина Е.А. Аутоиммунный тиреоидит и беременность: изменения в современных лечебно-диагностических парадигмах. Проблемы репродукции. 2020;26(1):29-38. https://doi.org/10.17116/repro20202601129.
22. Zhu Q., Xu Q.-H., Xie T. et al. Recent insights into the impact of immune dysfunction on reproduction in autoimmune thyroiditis. Clin Immunol. 2021;224:108663. https://doi.org/10.1016/j.clim.2020.108663.
23. Bastos D.C.D.S., Chiamolera M.I., Silva R.E. et al. Metabolomic analysis of follicular fluid from women with Hashimoto thyroiditis. Sci Rep. 2003;13(1):12497. https://doi.org/10.1038/s41598-023-39514-7.
24. Xie J., Gu A., He H. et al. Autoimmune thyroid disease disrupts immune homeostasis in the endometrium of unexplained infertility women - a single-cell RNA transcriptome study during the implantation window. Front Endocrinol (Lausanne). 2023;14:1185147. https://doi.org/10.3389/fendo.2023.1185147.
25. Venables A., Wong W., Way M., Homer H.A. Thyroid autoimmunity and IVF/ICSI outcomes in euthyroid women: a systematic review and metaanalysis. Reprod Biol Endocrinol. 2020;18(1):120. https://doi.org/10.1186/s12958-020-00671-3.
26. Toulis K.A., Goulis D.G., Venetis C.A. et al. Risk of spontaneous miscarriage in euthyroid women with thyroid autoimmunity undergoing IVF: a meta-analysis. Eur J Endocrinol. 2010;162(4):643-52. https://doi.org/10.1530/EJE-09-0850.
27. Busnelli A., Paffoni A., Fedele L., Somigliana E. The impact of thyroid autoimmunity on IVF/ICSI outcome: a systematic review and metaanalysis. Hum Reprod Update. 2016;22(6):775-90. https://doi.org/10.1093/humupd/dmw019.
28. Zhang S., Yang M., Li T. et al. High level of thyroid peroxidase antibodies as a detrimental risk of pregnancy outcomes in euthyroid women undergoing ART: a meta-analysis. Mol Reprod Dev. 2023;90(4):218-26. https://doi.org/10.1002/mrd.23677.
29. Alexander E.K., Pearce E.N., Brent G.A. et al. 2017 Guidelines of the American Thyroid Association for the Diagnosis and Management of Thyroid Disease During Pregnancy and the Postpartum. Thyroid. 2017;27(3):315-89. https://doi.org/10.1089/thy.2016.0457.
30. Клинические рекомендации - Женское бесплодие - 2021-2022-2023 (24.06.2021). М.: Министерство здравоохранения Российской Федерации, 2021. 50 с. Режим доступа: https://moniiag.ru/wp-content/uploads/2019/07/Klinicheskie-rekomendatsii.-ZHenskoe-besplodie.pdf. [Дата обращения: 13.04.2024].
31. Wu S., Zhang L., Liu X. et al. Antinuclear antibodies in follicular fluid may be a risk factor in vitro fertilization and embryo transfer. Am J Reprod Immunol. 2022;88(1):e13560. https://doi.org/10.1111/aji.13560.
32. Chighizola C.B., Pregnolato F., Raschi E. et al. Antiphospholipid antibodies and infertility: a gene expression study in decidual stromal cells. Isr Med Assoc J. 2016;18(3-4):146-9.
33. Molazadeh M., Karimzadeh H., Azizi M.R. Prevalence and clinical significance of antinuclear antibodies in Iranian women with unexplained recurrent miscarriage. Iran J Reprod Med. 2014;12(3):221-6.
34. Ying Y., Zhong Y., Zhou C. et al. Antinuclear antibodies predicts a poor IVF-ET outcome: impaired egg and embryo development and reduced pregnancy rate. Immunol Invest. 2012;41(5):458-68. https://doi.org/10.3109/08820139.2012.660266.
35. Li Y., Wang Y., Lan Y. et al. Antinuclear antibodies in follicular fluid may reduce efficacy of in vitro fertilization and embryo transfer by invading endometrium and granular cells. Am J Reprod Immunol. 2020;84(4):e13289. https://doi.org/10.1111/aji.13289.
36. Ticconi C., Inversetti A., Logruosso E. et al. Antinuclear antibodies positivity in women in reproductive age: from infertility to adverse obstetrical outcomes - a meta-analysis. J Reprod Immunol. 2023;155:103794. https://doi.org/10.1016/j.jri.2022.103794.
37. Железникова Г.Ф., Скрипченко Н.В., Иванова Г.П. и др. Герпес-вирусы и рассеянный склероз. Журнал неврологии и психиатрии имени С.С. Корсакова. 2016;116(9):133-43. https://doi.org/10.17116/jnevro201611691133-143.
38. Тян Н.С., Голева О.В., Бабаченко И.В. Клинико-этиологические аспекты бета-герпес-вирусной инфекции человека 6: обзор литературы. Журнал инфектологии. 2022;14(2):55-64. https://doi.org/10.22625/2072-6732-2022-14-2-55-64.
39. Marci R., Gentili V., Bortolotti D. et al. Presence of HHV-6A in endometrial epithelial cells from women with primary unexplained infertility. PLoS One. 2016;11(7):e0158304. https://doi.org/10.1371/journal
40. Bortolotti D., Gentili V., Rotola A. et al. HHV-6A infection of endometrial epithelial cells affects immune profile and trophoblast invasion. Am J Reprod Immunol. 2019;82(4):e13174. https://doi.org/10.1111/aji.13174.
41. Ando Y., Kakimoto K., Ekuni Y., Ichijo M. HHV-6 infection during pregnancy and spontaneous abortion. Lancet. 1992;340(8830):1289. https://doi.org/10.1016/0140-6736(92)92990-w.
42. Drago F., Broccolo F., Zaccaria E. et al. Pregnancy outcome in patients with pityriasis rosea. J Am Acad Dermatol. 2008;58(5 Suppl 1):S78-83. https://doi.org/10.1016/j.jaad.2007.05.030.
43. Drago F., Broccolo F., Javor S. et al. Evidence of human herpesvirus-6 and -7 reactivation in miscarrying women with pityriasis rosea. J Am Acad Dermatol. 2014;71(1):198-9. https://doi.org/10.1016/j.jaad.2014.02.023.
44. Miura H., Kawamura Y., Ohye T. et al. Inherited chromosomally integrated human herpes virus 6 is a risk factor for spontaneous abortion. J Infect Dis. 2021;223(10):1717-23. https://doi.org/10.1093/infdis/jiaa606.
45. Coulam C.B., Bilal M., Salazar Garcia M.D. et al. Prevalence of HHV-6 in endometrium from women with recurrent implantation failure. Am J Reprod Immunol. 2018;80(1):e12862. https://doi.org/10.1111/aji.12862.
46. Klimczak A.M., Herlihy N.S., Scott C.S. et al. B-cell lymphoma 6 expression is not associated with live birth in a normal responder in vitro fertilization population. Fertil Steril. 2022;117(2):351-8. https://doi.org/10.1016/j.fertnstert.2021.09.036.
47. Louwen F., Kreis N.N., Ritter A. et al. BCL6, a key oncogene, in the placenta, pre-eclampsia and endometriosis. Hum Reprod Update. 2022;28(6):890-909. https://doi.org/10.1093/humupd/dmac027.
48. Matsuzaki S., Pouly J.L., Canis M. Persistent activation of signal transducer and activator of transcription 3 via interleukin-6 trans-signaling is involved in fibrosis of endometriosis. Hum Reprod. 2022;37(7):1489-504. https://doi.org/10.1093/humrep/deac098.
49. Lin S.C., Li Y.H., Wu M.H. et al. Suppression of COUP-TFII by proinflammatory cytokines contributes to the pathogenesis of endometriosis. J Clin Endocrinol Metab. 2014;99(3):427-37. https://doi.org/10.1210/jc.2013-3717.
50. Nezhat C., Rambhatla A., Miranda-Silva C. et al. BCL-6 overexpression as a predictor for endometriosis in patients undergoing in vitro fertilization. JSLS. 2020;24(4):e2020.00064. https://doi.org/10.4293/JSLS.2020.
51. Almquist L.D., Likes C.E., Stone B. et al. Endometrial BCL6 testing for the prediction of in vitro fertilization outcomes: a cohort study. Fertil Steril. 2017;108(6):1063-9. https://doi.org/10.1016/j.fertnstert.2017.09.017.
52. Likes C.E., Cooper L.J., Efird J. et al. Medical or surgical treatment before embryo transfer improves outcomes in women with abnormal endometrial BCL6 expression. J Assist Reprod Genet. 2019;36(3):483-90. https://doi.org/10.1007/s10815-018-1388-x.
53. Dambaeva S., Bilal M., Schneiderman S. et al. Decidualization score identifies an endometrial dysregulation in samples from women with recurrent pregnancy losses and unexplained infertility. F S Rep. 2020;2(1):95-103. https://doi.org/10.1016/j.xfre.2020.12.
54. Vrhovac Madunic I., Karin-Kujundzic V., Madunic J. et al. Endometrial glucose transporters in health and disease. Front Cell Dev Biol. 2021;9:703671. https://doi.org/10.3389/fcell.2021.703671.
55. von Wolff M., Ursel S., Hahn U. et al. Glucose transporter proteins (GLUT) in human endometrium: expression, regulation, and function throughout the menstrual cycle and in early pregnancy. J Clin Endocrinol Metab. 2003;88(8):3885-92. https://doi.org/10.1210/jc.2002-021890.
56. Salker M.S., Christian M., Steel J.H. et al. Deregulation of the serum- and glucocorticoid-inducible kinase SGK1 in the endometrium causes reproductive failure. Nat Med. 2011;17(11):1509-13. https://doi.org/10.1038/nm.2498.
57. Ruan Y.C., Guo J.H., Liu X. et al. Activation of the epithelial Na. channel triggers prostaglandin E(2) release and production required for embryo implantation. Nat Med. 2012;18(7):1112-7. https://doi.org/10.1038/nm.2771.
58. Колесникова Н.В., Филиппов Е.Ф. Иммунологические аспекты бесплодия при хроническом эндометрите. РМЖ. Медицинское обозрение. 2024;8(3):155-62. https://doi.org/10.32364/2587-6821-2024-8-3-6.
59. Lédée N., Petitbarat M., Prat-Ellenberg L. et al. The uterine immune profile: a method for individualizing the management of women who have failed to implant an embryo after IVF/ICSI. J Reprod Immunol. 2020;142:103207. https://doi.org/10.1016/j.jri.2020.103207.
60. Lédée N., Prat-Ellenberg L., Chevrier L. et al. Uterine immune profiling for increasing live birth rate: a one-to-one matched cohort study. J Reprod Immunol. 2017;119:23-30. https://doi.org/10.1016/j.jri.2016.11.007.
61. Tamura I., Doi-Tanaka Y., Takasaki A. et al. High incidence of decidualization failure in infertile women. Reprod Med Biol. 2024;23(1):e12580. https://doi.org/10.1002/rmb2.12580.
62. Lédée N., Petitbarat M., Prat-Ellenberg L. et al. Endometrial immune profiling: a method to design personalized care in assisted reproductive medicine. Front Immunol. 2020;4(11):1032. https://doi.org/10.3389/fimmu.2020.01032.
63. Михайлова В.А., Белякова К.Л., Сельков С.А., Соколов Д.И. Особенности дифференцировки NK-клеток: CD56dim и CD56bright NK-клетки во время и вне беременности. Медицинская иммунология. 2017;19(1):19-26. https://doi.org/10.15789/1563-0625-2017-1-19-26.
64. АгнаеваА.О., Беспалова О.Н., Соколов Д.И. и др. Роль естественных киллеров (NK-клеток) в репродуктивных потерях. Журнал акушерства и женских болезней. 2017;66(3):143-56. https://doi.org/10.17816/JOWD663143-156.
65. Hao F., Zhou X., Jin L. Natural killer cells: functional differences in recurrent spontaneous abortion. Biol Reprod. 2020;102(3):524-31. https://doi.org/10.1093/biolre/ioz203.
66. Yang X., Yang Y., Yuan Y. et al. The roles of uterine natural killer (NK) cells and KIR/HLA-C combination in the development of preeclampsia: a systematic review. Biomed Res Int. 2020;2020:4808072. https://doi.org/10.1155/2020/4808072.
67. Shojaei Z., Jafarpour R., Mehdizadeh S. et al. Functional prominence of natural killer cells and natural killer T cells in pregnancy and infertility: a comprehensive review and update. Pathol Res Pract. 2022;238:154062. https://doi.org/10.1016/j.prp.2022.154062.
68. Azargoon A., Mirrasouli Y., Barough M.S. et al. The state of peripheral blood natural killer cells and cytotoxicity in women with recurrent pregnancy loss and unexplained infertility. Int J Fertil Steril. 2019;13(1):12-7. https://doi.org/10.22074/ijfs.2019.5503.
69. Glover L.E., Crosby D., Thiruchelvam U. et al. Uterine natural killer cell progenitor populations predict successful implantation in women with endometriosis-associated infertility. Am J Reprod Immunol. 2018;79(3). https://doi.org/10.1111/aji.12817.
70. Lapides L., Klein M., Belusakova V. et al. Uterine natural killer cells in the context of implantation: immunohistochemical analysis of endometrial samples from women with habitual abortion and recurrent implantation failure. Physiol Res. 2022;71(6):99. https://doi.org/10.33549/physiolres.935012.
71. Ali S.B., Jeelall Y., Pennell C.E. et al. The role of immunological testing and intervention in reproductive medicine: A fertile collaboration? Am J Reprod Immunol. 2018;79(3). https://doi.org/10.1111/aji.12784.
72. Cavalcante M.B., da Silva P.H.A., Carvalho T.R. et al. Peripheral blood natural killer cell cytotoxicity in recurrent miscarriage: a systematic review and meta-analysis. J Reprod Immunol. 2023;158:103956. https://doi.org/10.1016/j.jri.2023.103956.
73. Sung N., Khan S.A., Yiu M.E. et al. Reproductive outcomes of women with recurrent pregnancy losses and repeated implantation failures are significantly improved with immunomodulatory treatment. J Reprod Immunol. 2021;148:103369. https://doi.org/10.1016/j.jri.2021.103369.
74. Saito S., Nakashima A., Shima T., Ito M. Th1/Th2/Th17 and regulatory T-cell paradigm in pregnancy. Am J Reprod Immunol. 2010;63(6):601-10. https://doi.org/10.1111/j.1600-0897.2010.00852.x.
75. Акпербекова И.С., Аюпова Ф.М., Саиджалилова Д.Д. и др. Роль и значение маточных естественных киллеров в течении здоровой беременности (обзор литературы). Проблемы репродукции. 2020;26(6):15-25. https://doi.org/10.17116/repro20202606115.
76. Seshadri S., Sunkara S.K. Natural killer cells in female infertility and recurrent miscarriage: a systematic review and meta-analysis. Hum Reprod Update. 2014;20(3):429-38. https://doi.org/10.1093/humupd/dmt056.
77. Tang A.W., Alfirevic Z., Quenby S. Natural killer cells and pregnancy outcomes in women with recurrent miscarriage and infertility: a systematic review. Hum Reprod. 2011;26(8):1971-80. https://doi.org/10.1093/humrep/der164.
78. Mariee N., Tuckerman E., Ali A. et al. The observer and cycle-to-cycle variability in the measurement of uterine natural killer cells by immunohistochemistry. J Reprod Immunol. 2012;95(1-2):93-100. https://doi.org/10.1016/j.jri.2012.05.001.
79. Raghupathy R., Makhseed M.A., Azizieh F. et al. Maternal Th1-and Th2-type reactivity to placental antigens in normal human pregnancy and unexplained recurrent spontaneous abortions. Cell Immunol. 1999;196(2):122-30. https://doi.org/10.1006/cimm.1999.1532.
80. Kwak-Kim J.Y., Chung-Bang H.S., Ng S.C. et al. Increased T helper 1 cytokine responses by circulating T cells are present in women with recurrent pregnancy losses and in infertile women with multiple implantation failures after IVF. Hum Reprod. 2003;18(4):767-73. https://doi.org/10.1093/humrep/deg156.
81. Kuroda K., Horikawa T., Moriyama A. et al. Therapeutic efficacy of the optimization of thyroid function, thrombophilia, immunity and uterine milieu (OPTIMUM) treatment strategy on pregnancy outcomes after single euploid blastocyst transfer in advanced age women with recurrent reproductive failure. Reprod Med Biol. 2023;22(1):e12554. https://doi.org/10.1002/rmb2.12554.
82. Winger E.E., Reed J.L., Ashoush S. et al. Degree of TNF-a/IL-10 cytokine elevation correlates with IVF success rates in women undergoing treatment with Adalimumab (Humira) and IVIG. Am J Reprod Immunol. 2011;65(6):610-8. https://doi.org/10.1111/j.1600-0897.2010.00946.x.
83. Azizi R., Ahmadi M., Danaii S. et al. Cyclosporine A improves pregnancy outcomes in women with recurrent pregnancy loss and elevated Th1/Th2 ratio. J Cell Physiol. 2019;234(10):19039-47. https://doi.org/10.1002/jcp.28543.
84. Korn T., Bettelli E., Oukka M., Kuchroo V.K. IL-17 and Th17 cells. Annu Rev Immunol. 2009;27:485-517. https://doi.org/10.1146/annurev.immunol.021908.132710.
85. Vignali D.A., Collison L.W., Workman C.J. How regulatory T cells work. Nat Rev Immunol. 2008;8(7):523-32. https://doi.org/10.1038/nri2343.
86. Qian J., Zhang N., Lin J. et al. Distinct pattern of Th17/Treg cells in pregnant women with a history of unexplained recurrent spontaneous abortion. Biosci Trends. 2018;12(2):157-67. https://doi.org/10.5582/bst.2018.01012.
87. Ghaebi M., Abdolmohammadi-Vahid S., Ahmadi M. et al. T cell subsets in peripheral blood of women with recurrent implantation failure. J Reprod Immunol. 2019;131:21-9. https://doi.org/10.1016/j.jri.2018.11.002.
88. Huang Q., Wu H., Li M. et al. Prednisone improves pregnancy outcome in repeated implantation failure by enhance regulatory T cells bias. J Reprod Immunol. 2021;143:103245. https://doi.org/10.1016/j.jri.2020.103245.
Об авторах
А. В. КонкинаRussian Federation
Конкина Анастасия Владимировна.
355017 Ставрополь, ул. Мира, д. 310
Л. А. Бликян
Russian Federation
Бликян Лилит Ашотовна.
355017 Ставрополь, ул. Мира, д. 310
Д. Э. Алейникова
Russian Federation
Алейникова Дарья Эдуардовна.
356800 Буденновск, проспект Калинина, д. 2
И. Р. Абубакаров
Russian Federation
Абубакаров Изнаур Русланович.
355017 Ставрополь, ул. Мира, д. 310
А. С. Джуманьязова
Russian Federation
Джуманьязова Аида Султан-Муратовна.
355017 Ставрополь, ул. Мира, д. 310
А. В. Абрамьян
Russian Federation
Абрамьян Александра Вячеславовна.
355017 Ставрополь, ул. Мира, д. 310
Л. Г. Гафурова
Russian Federation
Гафурова Лиана Гамидовна.
355017 Ставрополь, ул. Мира, д. 310
Д. А. Лобко
Russian Federation
Лобко Дарья Артемовна.
355017 Ставрополь, ул. Мира, д. 310
А. А. Позоян
Russian Federation
Позоян Анна Айрапетовна.
355017 Ставрополь, ул. Мира, д. 310
К. М. Тхагапсова
Russian Federation
Тхагапсова Камила Муратовна.
355017 Ставрополь, ул. Мира, д. 310
М. С. Голубева
Russian Federation
Голубева Майя Сергеевна.
197022 Санкт-Петербург, ул. Льва Толстого, д. 6–8
Е. Е. Шванова
Russian Federation
Шванова Евгения Евгеньевна.
390026 Рязань, ул. Высоковольтная, д. 9
Е. О. Рыжов
Russian Federation
Рыжов Евгений Олегович.
295051 Симферополь, бульвар Ленина, д. 5/7
Что уже известно об этой теме?
► Иммунная система играет важную роль в репродуктивной функции женщины, начиная от имплантации и заканчивая поддержанием беременности. Изменения в иммунной системе играют ключевую роль в этиологии и лечении различных форм бесплодия, включая общее бесплодие, идиопатическое бесплодие (ИБ), привычное невынашивание беременности (ПНБ) и повторные неудачи имплантации (ПНИ).
► Репродуктивные иммунологические нарушения, как считается, довольно распространены среди пациентов с ИБ, ПНБ и ПНИ. Тем не менее репродуктивная иммунология не является полностью устоявшейся и признанной дисциплиной.
Что нового дает статья?
► Иммунологические тесты могут играть важную роль в диагностике и лечении бесплодия. Тем не менее доказанную эффективность имеет только тестирование на антифосфолипидные антитела (АФА), тиреотропный гормон (ТТГ) и антитела к тиреопероксидазе (TPOAb).
► АФА достоверно связаны со снижением качественных эмбрионов, яйцеклеток метафазы II, бластоцист, а также со снижением частоты имплантации, клинической беременности и живорождения. Наличие АФА негативно влияет на результаты вспомогательных репродуктивных технологий (ВРТ). Таким образом, необходимо проводить иммунологическое тестирование на АФА при выборе методов терапии бесплодия.
► Высокий уровень антител против TPOAb негативно влияет на исход беременности при проведении ВРТ даже у пациенток с эутиреозом.
Как это может повлиять на клиническую практику в обозримом будущем?
► Иммунологическое тестирование потенциально может быть эффективным инструментом в определении причины бесплодия и невынашивания беременности, выявляя нарушения в иммунной системе. Это позволит врачам назначать более целенаправленное и эффективное лечение.
► На основе результатов иммунологических тестов в будущем возможна разработка индивидуальных планов лечения, что увеличит шансы на успешное зачатие и вынашивание беременности.
► Выявление и коррекция иммунных нарушений до беременности позволит снизить риск невынашивания и других осложнений, связанных с нарушениями иммунной системы.
Рецензия
Для цитирования:
Конкина А.В., Бликян Л.А., Алейникова Д.Э., Абубакаров И.Р., Джуманьязова А.С., Абрамьян А.В., Гафурова Л.Г., Лобко Д.А., Позоян А.А., Тхагапсова К.М., Голубева М.С., Шванова Е.Е., Рыжов Е.О. Иммунологическое тестирование при женском бесплодии: современный взгляд на проблему. Акушерство, Гинекология и Репродукция. 2024;18(4):547-562. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.532
For citation:
Konkina A.V., Blikyan L.A., Aleynikova D.E., Abubakarov I.R., Dzhumanyazova A.S., Abramian A.V., Gafurova L.G., Lobko D.A., Pozoyan A.A., Thagapsova K.M., Golubeva M.S., Shvanova E.E., Ryzhov E.O. Immunological testing for female infertility: a modern view on the problem. Obstetrics, Gynecology and Reproduction. 2024;18(4):547-562. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.532
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































