Перейти к:
Септический шок в акушерстве: роль эфферентных методик в удалении эндотоксина при грамотрицательном сепсисе
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.509
Аннотация
Цель: оценка сорбционной способности различных устройств по удалению эндотоксина в модели пациента с септическим шоком в эксперименте in vitro.
Материалы и методы. Для оценки адсорбции эндотоксина был проведен эксперимент in vitro методом циркуляции раствора эндотоксина в бычьей сыворотке в замкнутом контуре. Для эксперимента были выбраны следующие колонки: Toraymyxin PMX-20R (РМ Х), Alteco® LPS Adsorber, Эфферон ЛПС, Toray Filtryzer BK-2.1U. В предварительно промытую физиологическим раствором колонку последовательно вносили дозы липополисахарида (ЛПС), соответствующие тяжести септического процесса. Первую дозу ЛПС в количестве 12,5 мкг вносили в колбу, содержащую 1500 мл (1,5 л) фетальной бычьей сыворотки, на 120-й минуте в сыворотку добавляли вторую дозу ЛПС в количестве 37,5 мкг. Образцы сыворотки собирали до начала эксперимента, а также через 30, 60, 120 (перед внесением второй дозы) мин, на 120-й (после внесения второй дозы), 150-й и 240-й минуте после начала циркуляции. Измерение ЛПС проводили путем смешивания подготовленного образца сыворотки с ЛАЛ-реагентом в соотношении 1:1 в измерительной пробирке.
Результаты. Все колонки могут снизить уровень эндотоксина ниже значений 12,5 мкг и даже 50 мкг, хотя ни одно устройство не показало способности снизить содержание ЛПС с «закритических» 50 мкг до «критических» 12,5 мкг. Но при этом способность колонки Toraymyxin PMX-20R оказалась в 5-13 раз больше, чем у остальных изделий. Этот результат позволяет утверждать, что при удалении эндотоксина в сходных условиях колонка Toraymyxin PMX-20R будет иметь более существенный запас сорбционной емкости и, следовательно, большие возможности для снижения риска прогрессирования септического шока.
Заключение. Выполненное исследование дает представление о том, достаточно ли сорбционной емкости для удаления эндотоксина у протестированных картриджей при начальной (12,5 мкг) нагрузке, соответствующей началу синдрома системного воспалительного ответа у типичного пациента, а также насколько картридж может снизить нагрузку эндотоксином при тяжёлом септическом шоке с общей нагрузкой ЛПС до 50 мкг.
Для цитирования:
Баялиева А.Ж., Давыдова В.Р. Септический шок в акушерстве: роль эфферентных методик в удалении эндотоксина при грамотрицательном сепсисе. Акушерство, Гинекология и Репродукция. 2024;18(4):504-513. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.509
For citation:
Bayalieva A.Zh., Davydova V.R. Septic shock in obstetrics: the role of efferent techniques for endotoxin removal in Gram-negative sepsis. Obstetrics, Gynecology and Reproduction. 2024;18(4):504-513. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.509
Введение / Introduction
Сепсис и септический шок являются серьезными проблемами здравоохранения, ежегодно затрагивающими миллионы людей во всем мире и приводящими к высокой летальности: каждый третий случай сепсиса является летальным [1]. Уровень смертности среди неакушерского населения составляет 28,6 %. В США дают следующую статистику по материнскому сепсису: встречаясь в 0,04% родов, сепсис является четвертой по значимости причиной материнской смертности, и 23% всех смертей приходится на долю материнского сепсиса. По современным данным, 63 % материнской смертности от сепсиса можно предотвратить [2].
Материнский сепсис – это опасное для жизни состояние, определяемое как дисфункция органов в результате инфекции, которая может возникнуть во время беременности, родов, после аборта или в послеродовом периоде. Существующие критерии диагностики материнского сепсиса и септического шока могут снизить вероятность возникновения сепсиса, но отсутствие единого мнения о том, когда проявляющие симптомы еще являются физиологическими адаптациями при беременности, а когда данные симптомы уже являются патологическими, могут задержать и диагностику и лечение. Всемирная организация здравоохранения рекомендует придерживаться при лечении сепсиса основных клинических рекомендации, принятых «Surviving sepsis company», с учетом особенностей конкретного региона или больницы по количеству случаев акушерского сепсиса. Для снижения тяжелой заболеваемости и смертности от акушерского сепсиса большую роль играют раннее выявление, своевременная оценка и соответствующее лечение материнского сепсиса [2].
Сепсис у матери может проявляться множественными и разнообразными симптомами, такими как летаргия, озноб, общее недомогание, сыпь, боль в нижней части живота или таза, лохии воспалительного характера, схватки, выделение жидкости из влагалища с неприятным запахом или изменением цвета и нагрубание молочных желез. Признаки материнского сепсиса включают лихорадку или гипотермию, тахикардию, гипотонию, болезненность матки при пальпации, преждевременные роды или преждевременное излитие околоплодных вод, измененный психический статус и дисфункцию органов-мишеней.
Хотя не существует стандартизированных критериев диагностики материнского сепсиса, изменения жизненно важных функций являются ранним индикатором инфекции. Однако эти ранние изменения жизненно важных функций могут быть расценены как нормальные физиологические изменения при беременности, такие как увеличение частоты сердечных сокращений и снижение артериального давления [3][4]. Основные трудности распознавания акушерского сепсиса связаны с отсутствием очевидного источника инфекции.
Одновременно с наличием инфекции, такие внешние воздействия, как общая кровопотеря в родах, объём вводимых растворов и препаратов, а также некоторые виды анестезии могут изменить течение инфекционного процесса и клиническую картину заболевания в целом.
Выделяют факторы риска развития акушерского сепсиса, среди которых факторы самой пациентки, а также акушерские факторы риска. Сопутствующие патологии со стороны пациентки: избыточная масса тела, различные степени ожирения, иммунодепрессивная терапия, различные нарушения иммунитета в целом, анемия различной этиологии, нарушение толерантности к глюкозе, вагинальные выделения, отягощенный анамнез за счет инфекций органов малого таза, инфекции, вызванные стрептококками группы А и В, возраст более 35 лет, неблагополучное социально-экономическое положение, хроническая сердечная недостаточность (особенно застойная форма), хроническая почечная недостаточность, хроническая печеночная недостаточность, системная красная волчанка. К акушерским факторам риска относятся оперативное родоразрешение путем кесарева сечения, части плодных оболочек, которые могут стать источником инфекции, длительный разрыв плодных оболочек, многоплодная беременность, различные инвазивные процедуры, применяемые для стимуляции родовой деятельности, такие как амниоцентез, раневые гематомы в послеродовом периоде, а также разрывы промежности [5].
Инструменты прикроватной оценки развития сепсиса, такие как быстрая оценка органной недостаточности, связанной с сепсисом (англ. quick Sepsis-related Organ Failure Assessment, qSOFA), доступны для прогнозирования смертности у пациенток с подозрением на сепсис и в настоящее время часто используются у неакушерских пациенток. Однако эти прикроватные инструменты, в том числе qSOFA, не валидизированы для использования у акушерских пациентов [6][7].
Выделяют 3 метода оценки, учитывающие особенности беременности (табл. 1): модифицированная система раннего акушерского предупреждения (англ. Modified Obstetric Early Warning Scoring System, MOEWS), оценка «Сепсис в акушерстве» (англ. Sepsis in Obstetrics Score, S.O.S.) и акушерская модифицированная быстрая шкала SOFA (англ. obstetric modified quick Sequential [Sepsis-Related] Organ Failure Assessment, omqSOFA) [8–10].
Таблица 1. Характеристика основных оценочных шкал,
применяемых для оценки акушерского сепсиса.
Table 1. Characteristics of the main assessment scales for evaluation of obstetric sepsis.
|
Шкала Scale |
Оцениваемые параметры Estimated parameters |
Преимущества Advantages |
Недостатки Disadvantages |
|
MOEWS |
Частота сердечных сокращений, частота дыхательных движений, насыщение крови кислородом, систолическое артериальное давление, температура тела, уровень сознания Heart rate, respiratory rate, blood oxygen saturation, systolic blood pressure, body temperature, level of consciousness |
Простой прикроватный инструмент для оценки акушерского сепсиса A simple bedside tool for assessing obstetric sepsis |
Широкие пороговые значения нормы и отклонения. Шкала валидизирована для хориоамнионита, позволяет выявить тяжелый сепсис. Необходимость вторичного тестирования для выявления истинно положительных результатов. Низкая специфичность; высокая прогностическая ценность Wide threshold range for normal and deviation values. The scale was validated for chorioamnionitis and can detect severe sepsis. Requires secondary testing to identify true positive results. Low specificity; high predictive value |
|
omqSOFA |
Частота дыхательных движений, систолическое артериальное давление, уровень сознания Respiratory rate, systolic blood pressure, level of consciousness |
Простой прикроватный инструмент для оценки акушерского сепсиса, используются только клинические данные, быстрая диагностика Simple bedside tool for assessing obstetric sepsis, solely based on clinical data, rapid diagnostics |
Изменение психического статуса – всегда признак сепсиса у акушерских пациенток. Необходимость вторичного тестирования Change in mental status is always a sign of sepsis in obstetric patients. Requires secondary testing |
|
S.O.S. |
Частота сердечных сокращений, частота дыхательных движений насыщение крови кислородом, систолическое артериальное давление, температура тела, количество лейкоцитов, наличие нейтрофильного сдвига, уровень лактата Heart rate, respiratory rate, blood oxygen saturation, systolic blood pressure, body temperature, leukocyte count, neutrophil shift, lactate level |
Быстро исключает потребность в отделении интенсивной терапии. Не использует измененное психическое состояние в качестве критерия Allows to rapidly exclude a need for intensive care unit. Not includes assessment of altered mental state as criteria |
Сложная система оценки с множеством переменных. Требуются лабораторные данные, что может задержать диагностику Complex rating system with numerous variables. Requires laboratory data able to delay diagnostics |
Системы оценки MOEWS и omqSOFA стратифицируют уровень риска на основе изменений жизненно важных показателей и психического статуса, тогда как система S.O.S. использует изменения показателей жизнедеятельности и лабораторные показатели. MOEWS – это простой прикроватный инструмент, но он валидизирован только для выявления хориоамнионита и имеет широкие пороговые значения в формате и точности. Система подсчета баллов представляет собой проверенный показатель, специфичный для беременности, для прогнозирования при поступлении в отделение интенсивной терапии [2]. В структуре материнского сепсиса выделяют следующие периоды в зависимости от времени заражения: дородовое, интранатальное и послеродовое. Подобное деление позволяет выявить причину и возбудителя с учетом времени заражения.
Одной и самых частых причин инфекции во время беременности и в послеродовом периоде являются инфекции мочеполового тракта, которые чаще диагностируются в антенатальном периоде [11]. Пиелонефрит является одной из ведущих причин неакушерской госпитализации в дородовом периоде [12]. Сепсис, связанный с хориоамнионитом, чаще всего проявляется во время родов. Респираторные инфекции одинаково распространены как на протяжении самой беременности, так и в периоде после родов. Сепсис вследствие эндомиометрита, мастита, желудочно-кишечных инфекций и инфекций мягких тканей чаще встречается в послеродовом периоде [13].
Знание потенциальных возбудителей, вызывающих септический процесс, имеет решающее значение для оптимального лечения и рационального использования антибиотиков. Основными возбудителями, вызывающими сепсис в послеродовом периоде, являются Escherichia coli, стрептококк группы B, Staphylococcus aureus, анаэробные бактерии и Listeria monocytogenes.
У беременных и родильниц основной причиной сепсиса является кишечная палочка, которая встречается почти в половине случаев; она также является преобладающим изолятом в случаях уросепсиса, хориоамнионита или эндометрита [14][15].
Самым смертоносным возбудителем инфекционного сепсиса является инвазивный стрептококк группы А (также известный как Streptococcus pyogenes). Стрептококк группы А не является частью нормального микробиома урогенитального тракта. Он присутствует только у 0,03 % людей, поэтому рутинный скрининг не рекомендуется, так как не определит возбудителя. Стрептококк группы А вызывает широкий спектр инфекций, включая эндомиометрит, некротический фасциит, пневмонию, целлюлит и фарингит. У пациентов со стрептококком группы А наблюдается быстрое клиническое ухудшение; у 75 % пациентов между первыми признаками инфекции и септическим шоком проходит менее 9 ч, а у 50 % больных это прогрессирование происходит менее чем за 2 ч. Из-за такого быстрого клинического ухудшения около 20 % женщин умирают в течение 7 дней после постановки диагноза. Как вирусные, так и грибковые патогены могут вызывать материнский сепсис. Беременные подвергаются большему риску вирусного сепсиса, чем популяция в целом [16]. Наиболее распространенными вирусными патогенами, связанными с материнским сепсисом, являются грипп, ветряная оспа и вирус простого герпеса. У пациентов с сепсисом, вызванным вирусными инфекциями, обычно развивается пневмония, но могут также наблюдаться гепатит, энцефалит, коагулопатия, острый респираторный дистресс-синдром или септический шок [17].
Некоторые вирусные инфекции создают высокий риск смертности во время беременности. Тяжелый острый респираторный синдром, вызванный коронавирусом 2 (SARS-CoV-2), может привести к дисфункции органов-мишеней и уровню смертности во время беременности порядка 1,3 % [18].
У беременных и родильниц основной причиной сепсиса чаще становятся грамотрицательные бактерии, продуцирующие эндотоксин, эффекты которого и определяют тяжесть течения септического процесса.
В настоящее время для коррекции эндотоксемии не определена ясная терапевтическая стратегия. Для коррекции эндотоксинемии используются фармакологические препараты моно- и поликлональных антител, конкурентные ингибиторы и средства, направленные на нейтрализацию эндотоксина. Однако данные препараты не приводят к ожидаемым результатам [19].
При использовании экстракорпоральных устройств для удаления бактериальных эндотоксинов – липополисахаридов (ЛПС) появляется ряд особенностей: снижение уровня ЛПС лишь в сосудистом русле за счет применения экстракорпоральных картриджей может уравновешиваться концентрацией эндотоксина, поступающего из тканевого пространства [19]. По этой причине используемые адсорбционные устройства должны иметь следующие характеристики: высокие емкостные возможности, надежное связывание эндотоксина на протяжении времени, достаточного для вовлечения в процесс всего системного эндотоксина. Таким образом, раннее начало экстракорпоральной терапии может позволить значительно улучшить результаты лечения у пациентов с явлениями выраженной эндотоксемии [20].
Цель: oценка сорбционной способности различных устройств по удалению эндотоксина в модели пациента с септическим шоком в эксперименте in vitro.
Материалы и методы / Materials and Methods
Дизайн исследования / Study design
Для оценки сорбционной способности различных устройств по удалению эндотоксина в модели пациента с септическим шоком был проведен эксперимент in vitro с использованием фетальной бычьей сыворотки (ФБС) как среды для циркуляции раствора эндотоксина.
Ход эксперимента / Experiment workflow
Метод циркуляции раствора эндотоксина в ФБС в замкнутом контуре был использован для оценки адсорбции эндотоксина в эксперименте in vitro (рис. 1) [21–23].
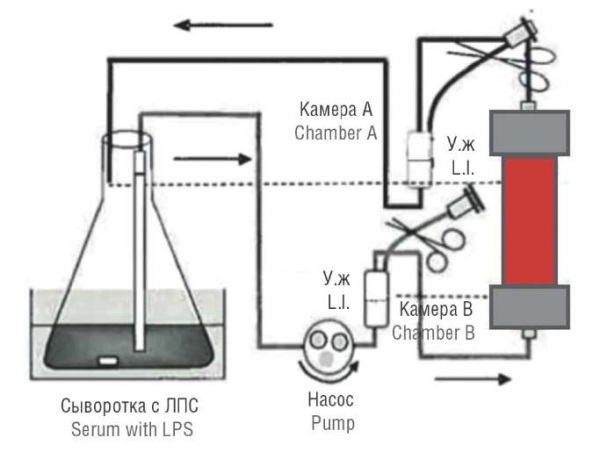
Рисунок 1. Замкнутый перфузионный контур (модифицировано из [21]).
Примечание: ЛПС – липополисахарид; У.ж. – уровень жидкости.
Figure 1. Closed perfusion circuit (modified from [21]).
Note: LPS – lipopolysaccharide; L.l. – liquid level.
В качестве подготовки к эксперименту каждый из выбранных картриджей в соответствии с рекомендациями производителя промывался физиологическим раствором с использованием роликового насоса. ФБС объёмом 1,5 л (Sigma Aldrich, США) помещалась в колбу, в которую добавляли первую дозу ЛПС (E.coli O111: B4; Sigma Aldrich, США) в количестве 12,5 мкг. В течение 4 ч (240 мин), как показано на рисунке 1, проводилась перфузия сыворотки через каждый картридж. Скорость перфузии ФБС через картридж устанавливалась с учетом рекомендации производителя устройства. Для поддержания необходимой для эксперимента температуры сыворотки в колбе на уровне 37 °С использовалась водяная баня в течение всего времени циркуляции. Для перфузии были выбраны следующие картриджи: Toraymyxin PMX-20R (РМ Х) (Toray Medical Co., Ltd., Япония), Alteco® LPS Adsorber (Alteco Medical AB, Швеция), Эфферон ЛПС (ОАО «Эфферон», Россия), Toray Filtryzer BK-2.1U (Toray Medical, Япония).
Вторую дозу ЛПС (37,5 мкг) добавляли в сыворотку на 120-й минуте. Отбор образцов сыворотки проводили по следующей схеме: до начала эксперимента (на 0-й минуте); далее после начала циркуляции (перед внесением второй дозы) – на 30-й, 60-й, 120-й минуте; затем (после внесения 2-й дозы) – на 120-й, 150-й и 240-й минуте после начала циркуляции. Перед измерением уровня ЛПС в образцах сыворотки их хранили при температуре 2–8 °С. Для измерения уровня ЛПС использовался ЛАЛ-реагент (англ. Limulus amebocyte lysate, LAL), производства Pyrostar Fujifilm Wako Chemical (Япония), который смешивался с подготовленным образцом сыворотки в соотношении 1:1 в измерительной пробирке. Концентрацию ЛПС в каждом образце измеряли дважды турбидиметрическим методом с помощью прибора Toxinometer ET-6000 (Pyrostar, Fujifilm Wako Chemical, Япония).
Характеристика используемых для перфузии картриджей / Characteristics of perfusion cartridges
Картридж Toraymyxin PMX-20R (РМ Х) применяется для прямой гемоперфузии, предназначен для избирательного удаления эндотоксина из циркулирующей крови. Являясь средством для экстракорпоральной гемоперфузии, данный картридж содержит полистирол в виде волокон, изготовленных из аль-фахлоро-ацето-амидометилового полистирола. На поверхности этих волокон неподвижно фиксирован полимиксин В, который абсорбирует эндотоксин и удаляет его из циркулирующей крови больного.
Alteco® LPS Adsorber представляет собой картридж, состоящий из полиэтилена, представленного пористым матриксом, на поверхности которого находится сорбирующий синтетический пептид. Картридж предназначен для экстракорпорального выведения эндотоксинов в процессе гемоперфузии. Сорбционная ёмкость в несколько раз превышает уровень эндотоксина, определяемого в крови у больных с сепсисом. Такая структура позволяет селективно сорбировать количество эндотоксина, в несколько раз превышающее уровень эндотоксина, определяемый у пациентов с тяжелым сепсисом.
Картридж Эфферон ЛПС – картридж экстракорпоральной очистки крови методом прямой гемоперфузии. Детоксикация осуществляется за счет селективной адсорбции липополисахаридов (бактериальных эндотоксинов) и неселективного удаления цитокинов внутренней пористой структурой. Картридж представляет собой цилиндрический поликарбонатный корпус, заполненный сферическими гранулами мезопористого полимерного адсорбента, селективного к ЛПС, и изотоническим раствором натрия хлорида.
Картридж Toray Filtryzer BK-2.1U – картридж экстракорпоральной очистки крови, состоящий из полиметилметакрилата (ПММА). Мембраны из ПММА разработаны для обеспечения высокой биосовместимости пациентов и добавления третьего измерения к диализу – адсорбции. Диффузия и конвекция удаляют молекулы малого и среднего размера, адсорбция способна удалять молекулы средней и высокой молекулярной массы, включая связанные с белками уремические токсины (англ. protein-bound uremic toxins, PBUTs).
Этические аспекты / Ethical aspects
В мировой практике для исследования характеристик устройств для экстракорпоральной очистки крови использовались и используются различные среды, такие как физиологический раствор (0,9 % NaCl), растворы альбумина и гемоглобина в воде, цельная кровь, плазма и сыворотка человека и животных. Самые достоверные результаты получаются на цельной человеческой крови, но её применение ограничено доступностью (нормами человеческой морали) и возможными для получения объёмами. Важно отметить, что ограниченное количество пулированной одногруппной цельной крови делает невозможным проведение масштабных опытов. Например, на проведение перфузии на одно тестируемое изделие расходуется 1500 мл среды. Соответственно, для проведения 10 опытов необходимо 15 л крови. Получить, пулировать и хранить такое количество крови представляется непростой задачей, особенно если нужно исключить воздействие на сорбцию антикоагулянтов. Похожие проблемы возникают при использовании человеческой плазмы или сыворотки крови. Применение физиологического раствора будет некорректным, поскольку в данном случае мы имеем слишком «чистую» среду, лишённую множества факторов, присутствующих при очистке крови в реальных условиях. Кроме того, физиологический раствор слабо удерживает растворенные компоненты, поэтому их результаты могут существенно отличаться от результатов in vivo и опытах на ФБС. Поэтому альтернативой крови – «золотой серединой» считается применение ФБС – сыворотки, получаемой из крови эмбрионов крупного скота. Технология её получения хорошо стандартизирована, подготовленная сыворотка пулируется и доступна в объёмах, достаточных для проведения как промышленного контроля качества экстракорпоральных устройств, так и научных экспериментов с высокой степенью достоверности и повторяемостью результатов. Такая сыворотка производится многими известными биотехнологическими компаниями. Гепарин или иные антикоагулянты не вводились, так как в ФБС отсутствуют факторы свёртывания. Кроме того, гепарин способен влиять на сорбирующие свойства исследуемых образцов и вступать во взаимодействие с реагентами для теста на ЛПС (ЛАЛ-теста).
Результаты и обсуждение / Results and Discussion
Полученные результаты (табл. 2, рис. 2) показывают остаточное содержание ЛПС в контуре перфузии после 2 ч (нагрузка 12,5 мкг ЛПС) и 4 ч (суммарная нагрузка 50 мкг ЛПС) перфузии. Можно видеть, что все изделия могут снизить уровень эндотоксина ниже значений 12,5 мкг и даже 50 мкг, хотя ни одно устройство не показало способности снизить содержание ЛПС с «закритических» 50 мкг до «критических» 12,5 мкг.
Таблица 2. Средние значения остаточного липополисахарида (ЛПС) для каждого изделия.
Table 2. Mean values of residual lipopolysaccharide (LPS) for each product.
|
Время, мин Time, minutes |
ЛПС, мкг (%) / LPS, µg (%) |
|||
|
Toraymyxin PMX-20R |
Alteco® LPS Adsorber |
Эфферон ЛПС Efferon LPS |
Toray Filtryzer BK-2.1U |
|
|
0 |
12,42 (25,0) |
11,40 (25,0) |
11,95 (25,0) |
12,51 (25,0) |
|
30 |
4,91 (10,0) |
11,40 (25,0) |
12,91 (26,0) |
13,03 (27,0) |
|
60 |
2,88 (6,0) |
11,40 (25,0) |
11,09 (23,0) |
12,67 (25,0) |
|
120 |
2,49 (5,0) |
10,61 (23,0) |
10,30 (22,0) |
11,66 (23,0) |
|
120 (болюс) / 120 (bolus) |
44,01 (89,0) |
51,50 (100,0) |
54,56 (100,0) |
51,08 (100,0) |
|
150 |
18,84 (38,0) |
49,00 (95,0) |
53,44 (98,0) |
48,55 (95,0) |
|
240 |
17,40 (35,0) |
49,00 (95,0) |
51,64 (95,0) |
46,63 (91,0) |
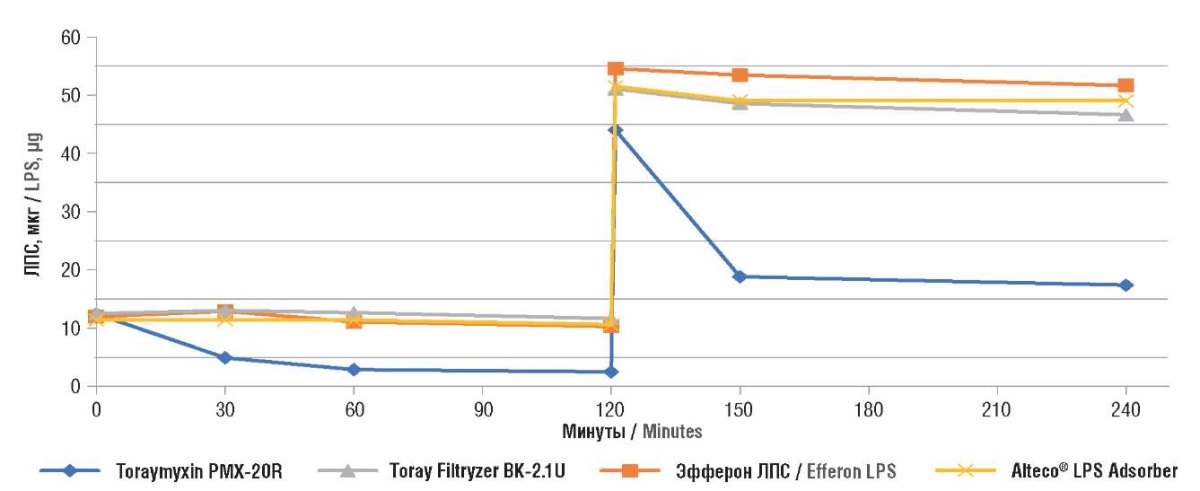
Рисунок 2. Средние значения остаточного липополисахарида (ЛПС)
для каждого картриджа.
Figure 2. Average residual lipopolysaccharide (LPS) values for each cartridge.
Способность колонки Toraymyxin PMX-20R удалять ЛПС оказалась в 5–13 раз больше, чем у остальных изделий. Этот результат позволяет утверждать, что при удалении эндотоксина в сходных условиях колонка Toraymyxin PMX-20R будет иметь более существенный запас сорбционной ёмкости и, следовательно, бóльшие возможности для снижения риска прогрессирования септического шока. Как результат, при лечении мы будем иметь меньший риск развития полиорганной недостаточности и летального исхода [24][25].
Конечно, результаты, полученные при перфузии ФБС нельзя безоговорочно переносить на живой организм. В реальных условиях даже кровь одного здорового субъекта будет отличаться от крови другого по свёртывающей способности, содержанию белка, клеток крови и по множеству факторов. Взаимодействие сорбента с кровью больного будет непредсказуемо отличаться от крови здорового и тем более от крови другого больного. Сорбция в крови в условиях присутствия этих факторов будет меньше, чем сорбция, проводимая на сыворотке. Предсказать насколько – невозможно. По этой причине пытаться сравнить сорбирующую способность устройств с проведением опытов с привлечением людей (и даже животных) невозможно не только ввиду огромной разнородности крови как опытной среды, но и по этическим причинам.
Тем не менее сравнительные результаты, полученные на однородной бычьей сыворотке in vitro, позволяют оценить, сравнить и прогнозировать способность устройств к сорбции уже в условиях живого организма.
В ранее проведенных экспериментальных работах с использованием анализа активности эндотоксина (англ. endotoxin activity assay, ЕАА) были определены границы эндотоксемии между наступлением высокого риска развития септического шока (0,6 ЕА) и переходом к крайне высокой, неконтролируемой эндотоксемии (> 0,9 ЕА). При пересчёте на количественные значения ЛПС этот диапазон лежит между 12,5 и 50,0 (12,5 ± 37,5) мкг ЛПС в крови и тканевой жидкости человека с массой тела около 70 кг. Значения эндотоксиновой нагрузки, измеренные в ЕАА и превосходящие 0,9 ЕА, уже трудно исчислить в «мкг ЛПС», поскольку количество эндотоксина может возрастать экспоненциально, и измерения дают очень большую погрешность (рис. 3) [23].
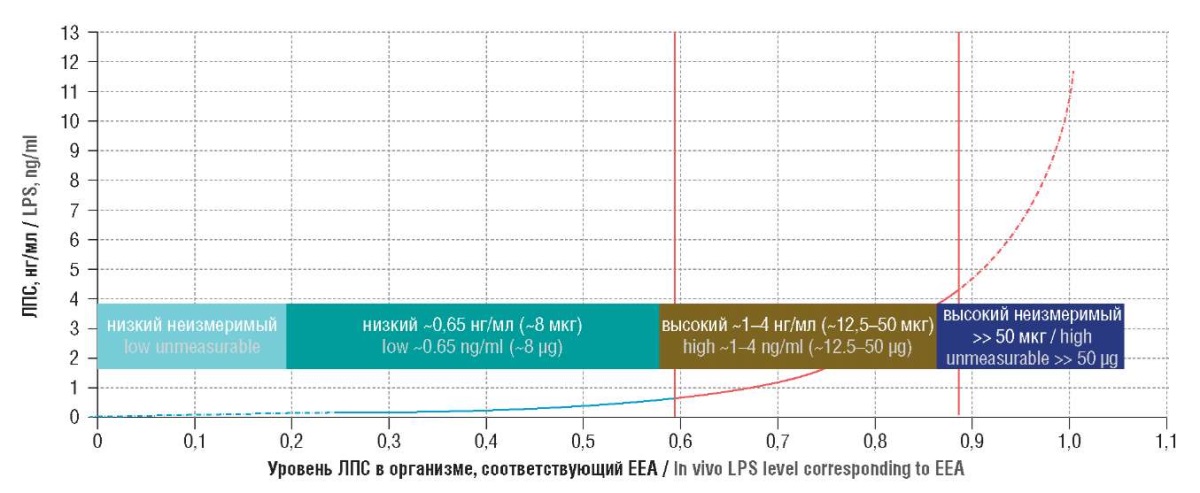
Рисунок 3. Соответствие уровня липополисахарида (ЛПС) в нг/мл
измерениям его активности лабораторным методом [19].
Figure 3. Correspondence between lipopolysaccharide (LPS) level (ng/ml)
and laboratory activity measurements [19].
В выполненном нами эксперименте использованы дозы ЛПС, соответствующие патофизиологическим пороговым значениям: 12,5 мкг (переход от синдрома системного воспалительного ответа (ССВО) к «зрелому» сепсису) и 37,5 мкг (доведение концентрации ЛПС до типичной при тяжелом септическом шоке), что значительно отличает наш эксперимент от проведенных раннее.
Кроме того, впервые продемонстрирована способность даже обычного диализатора на основе ПММА сорбировать пусть и не значимые, но некоторые количества ЛПС, что может быть важным при включении таких фильтров в заместительную почечную терапию при менее тяжелых состояниях, но сопровождающихся воспалительными процессами.
Заключение / Conclusion
Представленная работа, сохраняя преемственность в методе (перфузия ФБС) с предыдущими исследованиями, дает представление о том, достаточно ли сорбционной ёмкости для удаления эндотоксина у каждого из использованных картриджей при начальной (12,5 мкг) нагрузке, соответствующей началу ССВО у типичного пациента, а также насколько картридж может снизить нагрузку эндотоксином при тяжёлом септическом шоке с общей нагрузкой ЛПС до 50 мкг.
Поскольку лечащий врач ограничен как временем проведения процедуры (от 2 ч и более), так и количеством применяемых одновременно или последовательно устройств, то выбор должен быть за устройствами, обеспечивающими максимальную эффективность; этим самым мы не будем терять драгоценное время (и средства) на последовательное применение устройств, не обладающих должной эффективностью.
Список литературы
1. Laura Evans L., Rhodes A., Alhazzani W. et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021. Intensive Care Med. 2021;47(11):1181—247. https://doi.org/10.1007/s00134-021-06506-y.
2. Shields A., de Assis V., Halscott T. Top 10 pearls for the recognition, evaluation, and management of maternal sepsis. Obstet Gynecol. 2021;138(2):289-304. https://doi.org/10.1097/AOG.0000000000004471.
3. Sriskandan S. Severe peripartum sepsis. J R Coll Physicians Edinb. 2011;41(4):339-46. https://doi.org/10.4997/JRCPE.2011.411.
4. Snyder C.C., Barton J.R., Habli M., Sibai B.M. Severe sepsis and septic shock in pregnancy: indications for delivery and maternal and perinatal outcomes. J Matern Fetal Neonatal Med. 2013;26(5):503-6. https://doi.org/10.3109/14767058.2012.739221.
5. Buddeberg B.S., Aveling W. Puerperal sepsis in the 21st century: progress, new challenges and the situation worldwide. Postgrad Med J. 2015;91(1080):572-8. https://doi.org/10.1136/postgradmedj-2015-133475.
6. Shankar-Hari M., Phillips G., Levy M. et al. Developing a new definition and assessing new clinical criteria for septic shock: for the third international consensus definitions for sepsis and septic shock (Sepsis- 3). JAMA. 2016;315(8):775-87. https://doi.org/10.1001/jama.2016.0289.
7. Brink A., Alsma J., Verdonschot R.J.C.G. et al. Predicting mortality in patients with suspected sepsis at the emergency department; a retrospective cohort study comparing qSOFA, SIRS and National Early Warning Score. PLoS One. 2019;14(1):e0211133. https://doi.org/10.1371/journal.pone.0211133.
8. Edwards S.E., Grobman W.A., Lappen J.R. et al. Modified obstetric early warning scoring systems (MOEWS): validating the diagnostic performance for severe sepsis in women with chorioamnionitis. Am J Obstet Gynecol. 2015;212(4):536.e1—8. https://doi.org/10.1016/j.ajog.2014.11.007.
9. Albright C.M., Ali T.N., Lopes V. et al. The Sepsis in Obstetrics Score: a model to identify risk of morbidity from sepsis in pregnancy. Am J Obstet Gynecol. 2014;211(1):39.e1-8. https://doi.org/10.1016/j.ajog.2014.03.01.
10. Bowyer L., Robinson H., Barrett H. et al. SOMANZ guidelines for the investigation and management sepsis in pregnancy. Aust N Z J Obstet Gynaecol. 2017;57(5):540-51. https://doi.org/10.1111/ajo.12646.
11. Hensley M.K., Bauer M.E., Admon L.K., Prescott H.C. Incidence of maternal sepsis and sepsis-related maternal deaths in the United States. JAMA. 2019;322(9):890-92. https://doi.org/10.1001/jama.2019.9818.
12. Knowles S.J., O'Sullivan N.P., Meenan A.M. et al. Maternal sepsis incidence, etiology, and outcome for mother and fetus: a prospective study. BJOG. 2015;122(5):663-71. https://doi.org/10.1111/1471-0528.12892.
13. Acosta C.D., Harrison D.A., Rowan K. et al. Maternal morbidity and mortality from severe sepsis: a national cohort study. BMJ Open. 2016;6(8):e012323. https://doi.org/10.1136/bmjopen-2016-012323.
14. Cheng M.P., Stenstrom R., Paquette K. et al. Blood culture results before and after antimicrobial administration in patients with severe manifestations of sepsis: a diagnostic study. Ann Intern Med. 2019;171(8):547-54. https://doi.org/10.7326/M19-1696.
15. Albright C.M., Ali T.N., Lopes V. et al. Lactic acid measurement to identify risk of morbidity from sepsis in pregnancy. Am J Perinatol. 2015;32(5):481-6. https://doi.org/10.1055/s-0034-1395477.
16. Lin G.L., McGinley J.P., Drysdale S.B., Pollard A.J. Epidemiology and immune pathogenesis of viral sepsis. Front Immunol. 2018;9:2147. https://doi.org/10.3389/fimmu.2018.02147.
17. Assessment and treatment of pregnant women with suspected or confirmed influenza: correction. ACOG Committee Opinion No. 753 American College of Obstetricians and Gynecologists. Obstet Gynecol. 2018;132(4):e169— e173. https://doi.org/10.1097/AOG.0000000000002872.
18. Delahoy M.J., Whitaker M., O'Halloran A. et al. Characteristics and maternal and birth outcomes of hospitalized pregnant women with laboratory-confirmed COVID-19 - COVID-NET, 13 States, March 1 - August 22, 2020. MMWR Morb Mortal Wkly Rep. 2020;69(38):1347-54. https://doi.org/10.15585/mmwr.mm6938e1.
19. Munford R.S. Endotoxemia-menace, marker, or mistake? J Leukoc Biol. 2016;100(4):687-98. https://doi.org/10.1189/jlb.3RU0316-151R.
20. De Rosa S., Villa G., Ronco C. The golden hour of polymyxin B hemoperfusion in endotoxic shock: The basis for sequential extracorporeal therapy in sepsis. Artif Organs. 2020;44(2):184-6. https://doi.org/10.1111/aor.13550.
21. Romaschin A.D., Obiezu-Forster C.V., Shoji H., Klein D.J. Novel insights into the direct removal of endotoxin by polymyxin B hemoperfusion. Blood Purif. 2017;44(3):193-97. https://doi.org/10.1159/000475982.
22. Бабаев М.А., Дымова О.В., Матвеева Н.А., Еременко А.А. Адсорбционные возможности различных экстракорпоральных устройств по очистке крови от липополисахарида в условиях его нарастающей концентрации. (Стендовый эксперимент in vitro на фетальной бычьей сыворотке). Анестезиология и реаниматология. 2021;(5):40-8. https://doi.org/10.17116/anaesthesiology202105140.
23. Yamashita C., Moriyama K., Hasegawa D. et al. Does the endotoxin adsorption of PMX column saturate in 2 hours? Preliminary study. Critical Care. 2020;24(Suppl 1):P269-73. https://doi.org/10.1159/000489920.
24. Marshall J.C., Foster D., Vincent J.-L. et al. Diagnostic and prognostic implications of endotoxemia in critical illness: results of the MEDIC study. J Infect Dis. 2004;190:527-34. https://doi.org/10.1086/422254.
25. Rachoin J.-S., Foster D., Giese R. Importance of endotoxin clearance in endotoxemic septic shock: an analysis from the Evaluating Use of Polymyxin B Hemoperfusion in a Randomized Controlled Trial of Adults Treated for Endotoxemic Septic Shock (EUPHRATES) Trial. Crit Care Explor. 2020;2(2):e0083. https://doi.org/10.1097/CCE.0000000000000083.
Об авторах
А. Ж. БаялиеваРоссия
Баялиева Айнагуль Жолдошевна - д.м.н., профессор.
420012 Казань, ул. Бутлерова, д. 49; 420064 Казань, ул. Оренбургский тракт, д. 138
В. Р. Давыдова
Россия
Давыдова Вероника Рустэмовна - к.м.н.
420012 Казань, ул. Бутлерова, д. 49; 420064 Казань, ул. Оренбургский тракт, д. 138
Что уже известно об этой теме?
► Актуальность сепсиса становится все более заметной во всем мире, а акушерский сепсис имеет свои отличия и часто остается недиагностированным своевременно. Возбудителями бактериального акушерского сепсиса являются как грамположительные, так и грамотрицательные возбудители, а также грибы и анаэробные бактерии; наиболее распространенные возбудители – стрептококки группы В, энтерококки, кишечная палочка и Klebsiella pneumoniae.
► В свою очередь грамотрицательный сепсис характеризуется образованием эндотоксина, который и становится основным патогенетическим звеном и определяет тяжесть состояния пациентки. Для удаления эндотоксина из крови применяют эфферентные экстракорпоральные методики с использованием различных устройств. В каждом устройстве используются разные материалы для адсорбции эндотоксина.
► Хотя эффективность удаления эндотоксина имеет решающее значение для клинической эффективности, существует немного исследований, где бы сравнивали эффективность удаления эндотоксина с помощью различных устройств.
Что нового дает статья?
► Представлены результаты применения различных сорбционных колонок в эксперименте in vitro с введением липополисахарида (ЛПС), соответствующего патофизиологическим пороговым значениям в 12,5 мкг при сепсисе и 37,5 мкг при тяжелом септическом шоке.
► Все изученные картриджи могут снизить уровень эндотоксина ниже значений 12,5 мкг и даже 50 мкг, хотя ни одно устройство не показало способности снизить содержание ЛПС с «закритических» 50 мкг до «критических» 12,5 мкг.
Как это может повлиять на клиническую практику в обозримом будущем?
► Продемонстрирована способность даже обычного диализатора на основе полиметилметакрилата сорбировать, пусть и не значимые, но некоторые количества ЛПС, что может быть важно при включении таких фильтров в заместительную почечную терапию при менее тяжелых состояниях, но сопровождающихся воспалительными процессами.
► При выборе метода лечения лечащий врач ограничен как временем проведения процедуры (от 2 ч и более), так и количеством применяемых одновременно или последовательно устройств. В таких ограниченных условиях выбор должен быть за устройствами, обеспечивающими максимальную эффективность, т. е. картриджем, способным удалить максимальное количество ЛПС, что продемонстрировано в представленном исследовании.
Рецензия
Для цитирования:
Баялиева А.Ж., Давыдова В.Р. Септический шок в акушерстве: роль эфферентных методик в удалении эндотоксина при грамотрицательном сепсисе. Акушерство, Гинекология и Репродукция. 2024;18(4):504-513. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.509
For citation:
Bayalieva A.Zh., Davydova V.R. Septic shock in obstetrics: the role of efferent techniques for endotoxin removal in Gram-negative sepsis. Obstetrics, Gynecology and Reproduction. 2024;18(4):504-513. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.509

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































