Перейти к:
Лаваж легких сурфактантом при неонатальном синдроме аспирации мекония как жизнеспасающая респираторная стратегия: обзор литературы и клинический случай
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.533
Аннотация
Представлен обзор современных исследований о применении сурфактантного лаважа новорожденным с тяжелыми проявлениями синдрома аспирации мекония (САМ), иллюстрированный описанием клинического случая. Околоплодные воды могут быть окрашены меконием в 8-20 % всех родов, причем после полных 42 недель гестации частота САМ достигает 23-52 %. От 2 до 9 % новорожденных, у которых воды были окрашены меконием, впоследствии отмечаются клинические проявления САМ. Около трети новорожденных с САМ нуждаются в интубации трахеи и искусственной вентиляции легких. Летальность при САМ в связи с тяжелыми повреждениями паренхимы легких и развитием легочной гипертензии может превышать 20 %. Другие осложнения, включая синдром утечки воздуха (СУВ), встречаются у 10-30 % детей с САМ. Лаваж сурфактантом может быть одним из клинических инструментов, который позволяет избежать использования экстракорпоральной мембранной оксигенации (ЭКМО) в тяжелых случаях САМ. Приведенное клиническое наблюдение представляет интерес еще и тем, что у зрелого, даже переношенного ребенка с САМ в последующем сформировалась типичная бронхолегочная дисплазия (БЛД), которая требовала соответствующего лечения.
Ключевые слова
Для цитирования:
Мостовой А.В., Карпова А.Л., Попов И.В., Аникеева Л.А., Карпов Н.Ю. Лаваж легких сурфактантом при неонатальном синдроме аспирации мекония как жизнеспасающая респираторная стратегия: обзор литературы и клинический случай. Акушерство, Гинекология и Репродукция. 2024;18(4):581-595. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.533
For citation:
Mostovoi A.V., Karpova A.L., Popov I.V., Anikeeva L.A., Karpov N.Yu. Surfactant lung lavage in neonatal meconium aspiration syndrome as a life-saving respiratory strategy: literature review and a case report. Obstetrics, Gynecology and Reproduction. 2024;18(4):581-595. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.533
Введение / Introduction
Синдромом аспирации мекония (САМ) считается респираторный дистресс у новорожденного ребенка, родившегося с окрашенными меконием околоплодными водами и характерными клинико-рентгенологическими симптомами, которые ничем другим не могут быть объяснены [1]. Околоплодные воды могут быть окрашены меконием в 8–20 % всех родов [1–4], причем после полных 42 недель гестации частота САМ достигает 23–52 % [5][6]. От 2 до 9 % новорожденных, у которых воды были окрашены меконием, впоследствии отмечалась клиническая картина САМ [2][7][8]. Около трети новорожденных с САМ нуждаются в интубации трахеи и механической вентиляции легких [8]. Летальность при САМ в связи с тяжелыми повреждениями паренхимы легких и развитием легочной гипертензии может превышать 20 %. Другие осложнения, включая синдром утечки воздуха (СУВ), встречаются у 10–30 % детей с САМ [9].
Появление мекония в околоплодных водах – результат стимуляции созревающего кишечника вследствие гипоксического стресса, который может вызвать перистальтику и релаксацию ректального сфинктера, приводя к пассажу мекония. Аспирация мекониальными водами может возникнуть, если у плода на фоне прогрессирующей гипоксии развивается дистресс, ведущий к возникновению паттерна «гаспинг-дыхания» [10]. Аспирация вызывает гипоксию после рождения за счет четырех легочных эффектов: обструкция дыхательных путей, дисфункция сурфактанта, химический пневмонит, легочная гипертензия [11].
Синдром аспирации мекония характеризуется развитием в первые 48 ч жизни дыхательной недостаточности, характерных рентгенологических симптомов и осложнений. По степени тяжести дыхательной недостаточности САМ подразделяется на легкое течение, когда кислородная зависимость сохраняется менее 48 ч, новорожденный нуждается в менее чем 40 % кислороде; средняя степень тяжести – новорожденный нуждается в более чем 40 % кислороде в течение более 48 ч, отсутствуют признаки СУВ; тяжелое течение – необходимость в проведении вспомогательной искусственной вентиляции легких (ИВЛ) в течение более чем 48 ч. Частым осложнением при тяжелом течении является персистирующая легочная гипертензия новорожденных (ПЛГН) [2]. Характерные рентгенографические симптомы САМ включают в себя диффузные, полиморфные, неоднородные по структуре узелковые инфильтраты, локальные либо генерализованные, расположенные асимметрично либо симметрично; увеличение воздушности неизмененной легочной ткани; признаки утечки воздуха; плевральный выпот; кардиомегалию [12].
В связи с развитием дыхательной недостаточности новорожденные с САМ нередко нуждаются в проведении той или иной респираторной поддержки. При этом применение терапии постоянным положительным давлением в дыхательных путях (англ. continuous positive airway pressure, СРАР) не рекомендуется, поскольку доказательства эффективности данной технологии у новорождённых с САМ отсутствуют, а также проведение СРАР при САМ может увеличивать риск развития пневмоторакса [13]. В ИВЛ возникает потребность приблизительно у 30–40 % новорожденных с САМ [1][14]. При возрастающей потребности в увеличении параметров традиционной ИВЛ может возникнуть необходимость в проведении высокочастотной осцилляторной ИВЛ (ВЧО ИВЛ) [15][16] или высокочастотной струйной ИВЛ [17]. По данным литературы, около 20–30 % всех детей с САМ, находящихся на ИВЛ, нуждаются в проведении ВЧО ИВЛ [7][11][18]. Основными показаниями для перевода больного с традиционной ИВЛ на ВЧО ИВЛ является рефрактерная гипоксемия и/или высокий уровень фракции кислорода во вдыхаемой смеси (FiO2) = 0,4 и более, а также респираторный ацидоз. В случае развития ПЛГН возможно проведение терапии ингаляцией оксида азота (iNO) [19][20]. Для более объективной диагностики тяжести ПЛГН и выбора лечебной тактики у новорожденных может оказаться эффективным подсчет индекса оксигенации (англ. oxygenation index, OI): OI = FiO2×MAP×100 %/PaO2, где MAP – среднее давление в дыхательных путях (см вод. ст.), PaO2 – парциальное напряжение кислорода в артериальной крови (мм рт. ст.) [21]. Тяжелая дыхательная недостаточность у новорожденных, согласно определению Мантре, диагностируется при увеличении OI более 16 [22]. В случаях, когда OI достигает 40 и более, предсказуемая летальность у таких пациентов может превышать 80 %, поэтому клиницисты рекомендуют проведение экстракорпоральной мембранной оксигенации (ЭКМО) [23–25].
Среди респираторных стратегий в лечении САМ в мире также достаточно широко применяется сурфактантная терапия: лаваж сурфактантом, болюсное введение сурфактанта (особенно в том случае, если возможность проведения ЭКМО отсутствует). Все авторы, посвятившие свои исследования сурфактантной терапии при САМ, указывают на то, что данное лечение проводится только в случае тяжелого течения САМ. Так, H.C. Lin с соавт. (2005) использовали раннюю заместительную терапию сурфактантом или лаваж сурфактантом у тех младенцев с САМ, у которых после применения ВЧО ИВЛ и/или iNO в возрасте 6 ч жизни OI превышал 20 [16].
Одним из новаторов в сурфактантной терапии при САМ стал P.A. Dargaville, который активно популяризировал методику проведения лаважа с сурфактантом у новорожденных [26][27]. В своем исследовании P.A. Dargaville с соавт. (2011) 66 новорожденным с САМ при проведении лаважа вводили две аликвоты 15 мл/кг разведенного бычьего сурфактанта, который затем эвакуировался обратно. Медиана продолжительности дыхательной поддержки была сопоставима у детей, которым проводился легочный лаваж, и у детей контрольной группы (5,5 и 6,0 дней, соответственно; р = 0,77). Потребность в проведении ВЧО ИВЛ и iNO не различалась между группами. Меньшее число новорожденных, которым проводился лаваж, впоследствии умерли или потребовали проведения ЭКМО: 10 % (3/30) в сравнении с 31 % (11/35) в контрольной группе (отношение шансов (ОШ) = 0,24; 95 % доверительный интервал (ДИ) = 0,060–0,97). Процедура выполнения лаважа сопровождалась снижением насыщения крови кислородом (SpO2) без существенного влияния на частоту сердечных сокращений (ЧСС) или изменения артериального давления (АД). После проведения лаважа среднее давление в дыхательных путях снижалось быстрее. Авторы сделали вывод о том, что лаваж легких разведенным сурфактантом не оказывает влияние на продолжительность дыхательной поддержки, но может снизить смертность, особенно в отделениях, где отсутствует возможность выполнения ЭКМО [26][27]. В последующем S. Hahn с соавт. (2013) в метаанализе, посвященном лаважу с сурфактантом при САМ, выявили значительный эффект в пользу лаважа трахеобронхиального дерева (ТБД) в отношении комбинированного результата в виде смерти или использования ЭКМО [28].
S. Arayici с соавт. (2019) в рандомизированном контролируемом исследовании сравнили эффективность легочного лаважа с помощью сурфактанта и болюсное введение сурфактанта с лечебной целью у новорожденных, которым проводилась ИВЛ по поводу САМ [29]. Лечение проводилось в соответствии с методикой, описанной P.A. Dargaville с соавт. [26]. Перед выполнением процедуры лаважа новорожденным проводилась седация и/или миорелаксация. В группе новорожденных, которым выполняли легочный лаваж, последовательно вводилось в ТБД две аликвоты (кратные доли) разведенного свиного сурфактанта порактанта альфа (Куросурф, Chiesi Farmaceutici S.p.A., Италия) в дозе 15 мл/кг с концентрацией фосфолипидов 5,0 мг/мл, с периодом восстановления после введения до подъема сатурации (SpO2) до уровня более 80 %. Промывная жидкость (порактант альфа, разведенный в физиологическом растворе в соотношении 1:15) вводилась в течение 15–20 секунд через катетер, введенный в просвет эндотрахеальной трубки (ЭТТ), после чего применялись три режима ИВЛ с положительным давлением с использованием дыхательного мешка. После вдоха под высоким давлением проводилось открытое отсасывание содержимого с помощью стандартного катетера под отрицательным давлением –150 мм рт. ст. с эвакуацией промывной жидкости до тех пор, пока поток отделяемого из ТБД не прекратится. После лаважа продолжалась ИВЛ с режимами, используемыми до него. Рентгенография грудной клетки проводилась в течение 2–4 ч после введения сурфактанта. Не выявлено преимуществ применения разведенного сурфактанта в сравнении с его болюсным введением в отношении продолжительности дыхательной поддержки у новорожденных с САМ. Тем не менее отмечена тенденция к снижению частоты развития пневмоторакса и повторного введения сурфактанта в группе новорожденных, которым проводился легочный лаваж [29].
Кроме того, в литературе описывается технология применения лаважа сурфактантом при САМ с последующим болюсным введением неразведенного сурфактанта, причем изучается эффективность различных сурфактантов. Предполагается, что легочный лаваж с использованием разведенного сурфактанта с последующим болюсным введением сурфактанта может закрепить положительный эффект легочного лаважа и повлиять на течение заболевания в целом за счет снижения частоты развития пневмоторакса и уменьшения частоты повторных болюсных введений сурфактанта у новорожденных с САМ. Так, Y. Xu с соавт. (2023) на экспериментальной модели САМ у почти доношенных новорожденных кроликов путем введения в трахею восстановленного мекония человека исследовали эффективность бронхолегочного лаважа разведенным искусственным сурфактантом CHF5633 (5,0 мг/мл; 20 мл/кг) изолировано или с последующим болюсным введением неразведенного сурфактанта (100 или 300 мг/кг). Авторы сделали вывод о том, что CHF5633 способствует улучшению выживаемости и положительно влияет на повреждение легочной ткани, вызванное меконием, а лаваж ТБД CHF5633 в сочетании с последующим болюсным введением сурфактанта является оптимальным режимом в лечении САМ [30]. C. Rey-Santano с соавт. (2011) выявили, что лаваж легких разбавленным люцинактантом (10 мг/мл) у новорожденных ягнят с дыхательной недостаточностью и легочной гипертензией, вызванной САМ, значительно улучшает газообмен по сравнению с болюсной (30 мг/мл) инстилляцией (р < 0,05), поэтому является эффективной и безопасной стратегией [31].
В единственном отечественном исследовании, посвященном применению сурфактантной терапии у новорожденных с САМ и опубликованном И.В. Виноградовой и Г.И. Никифоровой в 2011 г., было включено 100 новорожденных с САМ тяжелой степени (основная группа или группа с лаважом – 41 ребенок). Детям проводился легочный лаваж с последующим болюсным введением препарата Сурфактант-БЛ (ООО «Биосурф», Россия). Бычий сурфактант (75 мг во флаконе) разводили в 2,5 мл физиологического раствора согласно инструкции фирмы-производителя [32]. Из полученной эмульсии использовали 20 % препарата (0,5 мл) и дополнительно разводили в 10 раз физиологическим раствором (до 5,0 мл). Оставшиеся 2,0 мл (60 мг) эмульсии вводили попеременно по 1,0 мл в левый и в правый бронхи болюсно через аспирационный катетер. Второй флакон препарата вводили микроструйно, так что общая доза составляла 50 мг/кг. Авторы пришли к выводу, что проведение двухкомпонентной сурфактант-терапии в виде лаважа ТБД разведенным Сурфактантом-БЛ с последующим введением небольшой дозы препарата позволяет статистически значимо уменьшить время достижения нетоксической концентрации кислорода в подаваемой газовой смеси и время нахождения детей на ИВЛ [33].
В модифицированной таблице 1 представлены характеристики основных исследований по применению лаважа сурфактантом при САМ, вошедших в метаанализ, опубликованный в 2020 г. R. Hui с соавт. [34].
Таблица 1. Основные характеристики исследований, включенных в метаанализ [34].
Table 1. Main characteristics of the studies included in the meta-analysis [34].
|
Исследование Study |
Эксперимент / контроль (гестационный возраст) Experiment / control (gestational age) |
Возраст проведения лаважа (час) Patient age of lavage procedure (hour) |
Объем лаважа Lavage volume |
Вид лаважа Lavage type |
Сурфактант, концентрация препарата, страна-производитель Surfactant, preparation concentration, country of origin |
|
Lam B.C. et al. (1999) [35] |
6/6 (39,3 ± 0,2 / (39,3 ± 0,2 / |
3 (2–6) |
15 мл/кг 15 mL/kg |
Не указано Not available |
Сурванта (бычий), Survanta (bovine), |
|
Kowalska K. et al. (2002) [36] |
11/11 (> 35 нед) (> 35 weeks) |
< 6 |
15 мл/кг 15 mL/kg |
0,9 % NaCl + сурфактант 0.9 % NaCl + surfactant |
Сурванта (бычий), Survanta (bovine), |
|
Schlösser R.L. et al. (2002) [37] |
11/7 (38–42 нед) (38–42 weeks) |
Не указано Not available |
20 мл 20 mL |
Разведенный сурфактант Diluted surfactant |
Сурванта (бычий), Survanta (bovine), |
|
Wiswell T.E. et al. (2002) [38] |
15/7 (39,9 ± 1,2 / (39,9 ± 1,2 / |
14–15 |
16 мл/кг за 3 введения 16 mL/kg for the three times |
Разведенный сурфактант Diluted surfactant |
Сурфаксин (синтетический), Surfaxin (synthetic), |
|
Chang H.Y. et al. (2003) [39] |
12/10 (39,3 ± 0,6 / (39,3 ± 0,6 / |
4,2 (2–7) или 5,2 (2–9) 4,2 (2–7) or 5,2 (2–9) |
6–7 или 12–14 мл/кг 6–7 or 12–14 mL/kg |
Разведенный сурфактант Diluted surfactant |
Сурванта (бычий), Survanta (bovine), |
|
Salvia-Roigés M.D. |
7/6 (39–41 нед) (39–41 weeks) |
6 |
15 мл/кг 15 mL/kg |
0,9 % NaCl + сурфактант 0.9 % NaCl + surfactant |
Сурванта (бычий), Survanta (bovine), |
|
Dargaville P.A. et al. (2007) [41] |
8/34 (37–42 нед) (37–42 weeks) |
23 (8–83) |
15 мл/кг за 3 введения 15 mL/kg for the three times |
0,9 % NaCl + сурфактант 0.9 % NaCl + surfactant |
Сурванта (бычий), Survanta (bovine), |
|
Lee S.M. et al. |
7/8 (37–42 нед) (37–42 weeks) |
10,35 ± 6,35 |
20 мл/кг за 3 введения 20 mL/kg for the three times |
0,9 % NaCl + сурфактант 0.9 % NaCl + surfactant |
Ньюфактан (бычий), Newfactan (bovine), |
|
Dargaville P.A. et al. (2011) [26] |
30/35 (38–41 нед) (38–41 weeks) |
14,0 ± 5,9 |
15 мл/кг за 2 введения 15 mL/kg for the two times |
0,9 % NaCl + сурфактант 0.9 % NaCl + surfactant |
Сурванта (бычий), Survanta (bovine), |
|
Gu H.R. (2018) [43] |
51/51 (40,37 ± 1,10 / (40,37 ± 1,10 / |
Не указано Not available |
3–5 мл однократно, 3 раза 3–5 mL once, three times |
0,9 % NaCl + сурфактант 0.9 % NaCl + surfactant |
Куросурф (свиной), Сurosurf (pork), |
|
Bandiya P et al. (2019) [44] |
31/29 (38–39 нед) (38–39 weeks) |
< 2 |
20 мл/кг 20 mL/kg |
0,9 % NaCl + сурфактант 0.9 % NaCl + surfactant |
Сурванта (бычий), Survanta (bovine), |
В мире проводился поиск наиболее эффективного объема промывания разбавленным сурфактантом при САМ. В экспериментальной работе M.J. Jeng с соавт. (2009), индуцируя у 24 новорожденных поросят САМ (вводили в легкие человеческий меконий), пытались сравнить 3 объема разведенного сурфактанта «Сурванта»: 10 мл/кг (лаваж-10), 20 мл/кг (лаваж-20) и 30 мл/кг (лаваж-30). Изменения оксигенации и растяжимости легких в группах лаваж-20 и лаваж-30 были значительно лучше, чем в контрольной группе (без промывания) и в группе лаваж-10 (p < 0,05). Авторы сделали вывод, что использование 20 мл/кг разбавленного поверхностно-активного вещества в двух аликвотах было столь же эффективно, как и 30 мл/кг [45]. H.Y. Hung с соавт. (2006) сравнили результаты лечения 11 доношенных новорожденных с САМ, используя 20 мл разбавленного сурфактанта с концентрацией фосфолипидов 10 мг/мл, с результатами 9 младенцев, ранее получавших промывание в объеме 40 мл (5 мг/мл). Оба объема были одинаково эффективны, однако 20 мл было связано с меньшим количеством побочных эффектов (гипоксемия у 3 детей и белые пятна на рентгенограмме грудной клетки в 5 случаях), которые регистрировались только в группе с 40 мл [46].
Поиск информации по опыту применения лаважа с сурфактантом при тяжелом течении САМ за последние 10 лет в отечественных медицинских библиотеках eLibrary.ru и КиберЛенинка не увенчался успехом. Нет ни одной опубликованной за указанный промежуток времени работы, посвященной данному вопросу, поэтому мы посчитали необходимым поделиться собственным опытом путем представления одного из наиболее сложных клинических случаев, в котором лаваж ТБД сурфактантом у переношенного ребенка с тяжелым течением САМ предопределил исход заболевания и позволил не только спасти жизнь, но и улучшить прогноз.
Клиническое наблюдение / Clinical case
В анамнезе матери – удаление новообразования правой орбиты глаза в 2021 г. Беременная на учете в женской консультации состояла с 20 нед. Настоящая беременность первая, протекала с отеками и маловодием в III триместре. Результат обследования на Streptococcus agalactiae отрицательный. Поступила в перинатальный центр со сроком гестации 43 нед с признаками дистресса плода, поэтому практически сразу была родоразрешена путем операции кесарева сечения. Роды первые, запоздалые, в затылочном предлежании. Околоплодные воды густо прокрашены меконием. Масса тела ребенка при рождении составила 4200 г, рост 55 см, оценка по шкале Апгар – 3/4/5 баллов.
После пересечения пуповины (30 сек) ребенок перемещен под источник лучистого тепла, начато мониторное наблюдение. Учитывая большое количество густых мекониальных вод в ротоглотке, проводилась санация верхних дыхательных путей (ВДП), получены густые темно-зеленые околоплодные воды. С рождения у ребенка отмечались редкие гаспинги, ЧСС – более 100 уд/мин, атония, адинамия, арефлексия. Начата ИВЛ при помощи аппарата для проведения ручной ИВЛ с Т-образным коннектором в открытой реанимационной системе Resuscitaire® RW (Dräger, Германия) через лицевую маску с параметрами: положительное давление вдоха (PIP) = 25,0 см вод. ст., положительное давление на выдохе (РЕЕР) = 6,0 см вод. ст., частота дыхательных движений (ЧДД) = 40 в мин, FiO2 постепенно увеличена до 0,5. Учитывая отсутствие регулярного дыхания (ЧСС более 100 уд/мин), на третьей минуте жизни выполнена интубация трахеи эндотрахеальной трубкой № 3,5, начата ИВЛ через ЭТТ с параметрами: PIP = 25–35 см вод. ст., РЕЕР = 7,0 см вод. ст., ЧДД = 45–60 в мин, FiO2 до 1,0. Установлен желудочный зонд, получено 5 мл темно-зеленых околоплодных вод. Учитывая прогрессирование гипоксемии, дважды выполнена санация трахеи через ЭТТ при помощи мекониального аспиратора, получено обильное количество зеленых околоплодных вод. К 10-й минуте жизни сохранялась потребность в 100 % кислороде, SpO2 находилась в пределах 60–80 %. Попытки увеличения пикового давления на вдохе, перевода на ВЧО ИВЛ – без эффекта, SpO2 выше 60–70 % не поднималась. Тоны сердца были глухими, выслушивались в типичном месте. Дыхание проводилось в обеих сторонах одинаково. По данным оценки кислотно-основного состояния (КОС) в пуповинной крови выявлены выраженные метаболические нарушения: рН = 6,97, рСО2 = 50,4, лактат = 10,3 ммоль/л, ВЕ = –18,3 ммоль/л.
В возрасте 15 мин жизни выполнена катетеризация пупочной вены, внутривенно струйно медленно введён раствор хлорида натрия 0,9 % в дозе 10 мл/кг. Гипоксемия прогрессировала. К 40-й минуте жизни SpO2 в пределах 48–75 %, тотальный цианоз, выраженная мраморность, судороги, редкие гаспинги. Ребенок в операционной, где родился, был переведен на ВЧО ИВЛ аппаратом SLE 5000 в режиме высокочастотной осцилляторной вентиляции (англ. high frequency oscillatory ventilation, HFOV) с параметрами: MAP = 18 см вод. ст., амплитуда (delta P) = 40 см вод. ст., частота (f) = 9 Гц, FiO2 = 1,0, соотношение вдоха к выдоху (I:E) =1:2. На этом фоне SpO2 колебалась в пределах 48–70 %. Тоны сердца были глухими, выслушивались в типичном месте. Дыхание справа стало проводиться хуже. По данным КОС – выраженная гиперкапния, метаболические нарушения (рН = 6,83, рСО2 = 31 мм рт. ст., лактат = 25 ммоль/л, ВЕ = –12,2 ммоль/л). По данным рентгенографии органов грудной клетки выявлен свободный газ в обеих плевральных полостях. Проведена пункция обеих плевральных полостей, удалено по 40 мл воздуха с каждой стороны. Вызван врач – детский хирург, установлены плевральные дренажи с обеих сторон, переведены на пассивную аспирацию. Были изменены параметры ВЧО ИВЛ: MAP = 22 см вод. ст., delta P = 50 см вод. ст., f = 9,0 Гц, FiO2 = 1,0, I:E = 1:2. Положительного эффекта от проведенных манипуляций не получено, состояние с прогредиентно нарастающей гипоксемией и брадикардией. На 70-й минуте жизни развилась критическая брадикардия (ЧСС менее 60 уд/мин). Начат непрямой массаж сердца на фоне ИВЛ с FiO2 = 1,0; каждые 3 минуты внутривенно вводился раствор адреналина 0,1 % в разведении 1:10000 в дозе 0,2 мл/кг/разово; через 8,0 мин от начала непрямого массажа сердца ЧСС увеличилась более 100 уд/мин; непрямой массаж прекращен; SpO2 постепенно поднялась до 80–85 %. Развитие брадикардии было расценено как возможное следствие проведения ВЧО ИВЛ, поэтому ребенок был переведен на традиционную ИВЛ в режиме вспомогательный контролируемый (англ. Assist Control, АС) с параметрами: PIP = 38–40 см вод. ст., РЕЕР = 8,0 см вод. ст., ЧДД = 60 в мин, FiO2 = 1,0. Только на таких параметрах ИВЛ удавалось удерживать SpO2 в пределах 80–88 %, иначе она снижалась до 45–50 %. Учитывая наличие декомпенсированного метаболического ацидоза, проводилось введение гидрокарбоната натрия 4,0 % внутривенно струйно медленно из расчета 4,0 мл/кг/разово.
С целью исключения критического врожденного порока сердца (ВПС) в операционной была выполнена эхокардиография (Эхо-КГ), выявлена выраженная гипертрофия миокарда обоих желудочков и межжелудочковой перегородки с обструкцией выходных отделов обоих желудочков. Начат мониторинг АД, которое в первые два часа жизни не промерялось. Было принято решение о проведении в операционной, где ребенок родился, комбинированной инотропной и вазопрессорной поддержки. АД постепенно удалось поднять до 66/27 мм рт. ст. С целью профилактики гипогликемии начато микроструйное внутривенное введение раствора глюкозы 10 %. С целью оптимизации кардиотонической и инфузионной терапии под контролем ультразвукового исследования (УЗИ) выполнена катетеризация правой яремной вены; при рентгенологическом контроле катетер установлен правильно, отток уверенный. SpO2 c постепенным повышением до 88 %, периодически до 90–91 %. По данным КОС перед переводом ребенка из операционной в отделение реанимации и интенсивной терапии новорожденных (ОРИТН) отмечена положительная динамика: рН = 7,12, рСО2 = 51 мм рт. ст., лактат = 7,0 ммоль/л, ВЕ = –11,7 ммоль/л.
У ребенка с рождения имело место тотальное прокрашивание кожи, ногтей и волос зелеными околоплодными водами, выраженное отшелушивание прокрашенной зеленым меконием кожи крупными пластами по всему телу, стопы «банщика» и ладони «прачки», плотные кости черепа. После стабилизации состояния в возрасте 4 ч жизни в крайне тяжелом состоянии в транспортном инкубаторе на ИВЛ с параметрами PIP = 38 см вод. ст., РЕЕР = 7,0 см вод. ст., ЧДД = 60 в мин, FiO2 = 1,0, под непрерывным мониторным наблюдением, на продолжающейся кардиотонической терапии ребёнок был переведён в ОРИТН. Сразу при поступлении был переведен на ВЧО ИВЛ с параметрами: MAP = 22 см вод. ст., delta P = 50 см вод. ст., f = 9 Гц, FiO2 = 1,0, I:E = 1:2. Однако персистировала гипоксемия со стойким снижением SpO2 до 80–84 % и менее. Увеличение параметров ВЧО ИВЛ не улучшало SpO2, приводя к падению показателей АД. Попытки перевода на традиционную ИВЛ без успеха, отмечалось выраженное падение SpO2. По данным Эхо-КГ были выявлены признаки ПЛГН с повышением среднего давления в легочной артерии до 90 мм рт. ст., поэтому была начата ингаляция оксидом азота (iNO) при помощи аппарата АИТ-NO-01 Тианокс (РФЯЦ-ВНИИЭФ, Россия) с 20 ppm (англ. parts per million; частиц на миллион). Положительной динамики по оксигенации не получено. Параллельно у ребенка прогрессировала артериальная гипотензия, для купирования которой требовалась комбинированная кардиотоническая поддержка, в лечение ПЛГН был добавлен левосимендан.
В лечении пневмоторакса потребовался перевод аспирации воздуха из плевральных полостей с пассивной на активную. OI в возрасте 12 ч жизни составил 48. По данным рентгенографии органов грудной и брюшной полостей в возрасте 12 ч жизни были выявлены распространенные по всем отделам легочных полей участки среднеинтенсивного затемнения, положительный симптом воздушных бронхограмм, тень средостения не расширена, диафрагма, синусы не прослеживаются, ЭТТ в проекции Th2, свободного воздуха в плевральных полостях не определялось, пневматизация кишечных петель не прослеживалась (рис. 1).
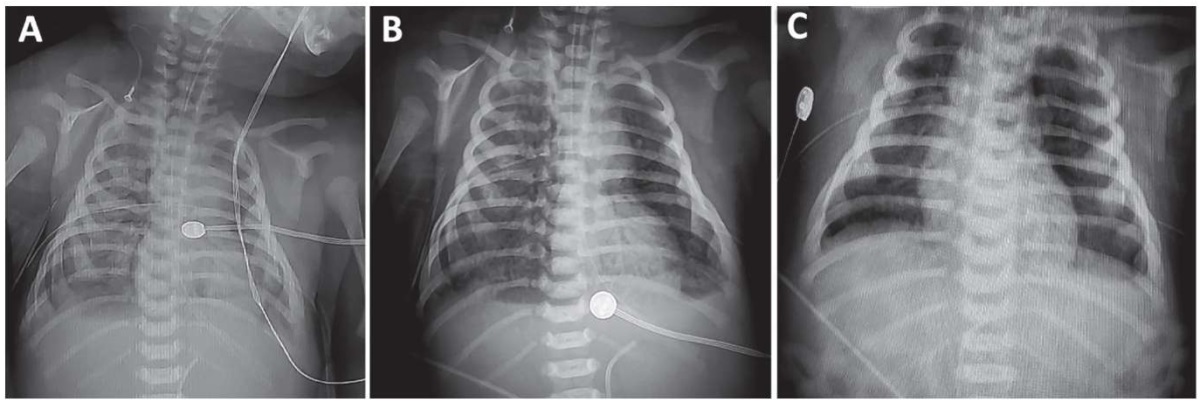
Рисунок 1. Серия рентгенограмм ребенка в течение первых суток жизни:
А – состояние легких после купирования напряженного пневмоторакса
в родильном зале в возрасте первых двух часов жизни;
В – легкие пациента сразу после процедуры сурфактантного лаважа;
С – состояние легких к концу первых суток жизни
(артефакты – водяной матрасик системы гипотермии).
Figure 1. A series of radiographs of the child during the first day of life:
A – the condition of the lungs after tension pneumothorax relief
in the delivery room at the child’s age of the first two hours of life;
B – the patient's lungs immediately after the surfactant lung lavage procedure;
C – the condition of the lungs by the end of the first day of life
(artifacts – a water mattress of the hypothermia system).
С учетом нарастания гипоксемии, наличия у ребенка характерных клинико-рентгенологических признаков САМ врачебной комиссией было принято решение о проведении лаважа ТБД сурфактантом в возрасте 12 ч жизни (протокол врачебной комиссии о назначении препарата «вне инструкции», подкомиссия по неонатологии ГБУЗ ГКБ № 67 им. Л.А. Ворохобова ДЗМ № 656A от 11.08.2023). Для этого порактант альфа в дозе 100 мг/кг был разведен в физиологическом растворе хлорида натрия из расчета 15 мл/кг (предварительно в шприц объемом 60 мл сначала набирался порактант альфа, а затем 0,9 % раствор натрия хлорида). Полученный раствор сурфактанта осторожно, не встряхивая, перемешали. Далее через тонкий катетер диаметром 5Fr, введенный в ЭТТ, быстро провели инстилляцию приготовленного раствора (за 30–40 сек) в легкие новорожденного с последующим удалением его посредством открытой активной аспирации при помощи аспирационного катетера с вакуум-контролем, присоединенного к стерильной одноразовой прозрачной емкости для сбора аспирата. Санация ТБД проводилась после ручной вибрирующей компрессии грудной клетки в течение 10 секунд. Из ЭТТ при санации обратно из ТБД было получено около 25–30 мл содержимого, окрашенного в розовый цвет, с примесью мекония. На фоне проведения лаважа ТБД у ребенка отмечалось кратковременное (в течение 50 секунд) снижение SpO2 до 75 % и ЧСС со 180 до 120 уд/мин с последующим быстрым восстановлением обсуждаемых показателей. После лаважа ТБД сурфактантом SpO2 постепенно, в течение 5–7 мин поднялась до 96–98 %, удалось медленно снизить MAP сначала до 18 см вод. ст., в последующем постепенно до 15 см вод. ст. и менее. OI через 1 ч после проведения лаважа ТБД (в возрасте 13 ч жизни) снизился сначала до 30, затем до 20, в последующем в динамике в течение нескольких суток OI постепенно снизился до 10. После лаважа ТБД сурфактантом пневматизация легочных полей улучшилась. В дальнейшем эпизодов выраженной гипоксемии со снижением SpO2 менее 90 % не отмечалось. Через 2 дня после лаважа ТБД ингаляция оксида азота была прекращена. Центральная гемодинамика также на фоне купирования гипоксемии постепенно нормализовалась. На 7-е сутки жизни удалось полностью отменить кардиотоническую терапию.
На 5-е сутки жизни был купирован левосторонний пневмоторакс, на 10-е сутки жизни – правосторонний. До 15 суток жизни ребенок нуждался в проведении ВЧО ИВЛ с FiO2 = 1,0, далее был переведен на традиционную ИВЛ. На 18-е сутки жизни ребенок экстубирован и переведен на неинвазивную ВЧО ИВЛ, которая продолжалась в течение 7 дней. Далее ребенок был переведен на неинвазивную респираторную поддержку в режиме DuoPAP (двухфазное положительное давление в дыхательных путях), однако продолжала сохраняться зависимость от дополнительного кислорода, FiO2 = 0,4, персистировала гиперкапния в пределах 55–60 мм рт. ст. На 39-е сутки жизни удалось перейти на высокопоточные канюли при помощи аппарата AIRVO™ 2 (Fisher&Paykel Healthcare, Новая Зеландия) с параметрами: FiO2 = 0,3, поток кислорода = 12,0 л/мин. В возрасте 60-ти суток жизни ребенок был переведен на дыхание через кислородные канюли с потоком кислорода 1,0 л/мин и FiO2 = 1,0.
В дальнейшем ребенка постепенно удалось перевести на оксигенотерапию через маску с потоком 0,5 л/мин, оксигенация при этом сохранялась стабильной, SpO2 более 95 %, уровень углекислого газа в крови снизился до 40–50 мм рт. ст. Однако на фоне оксигенотерапии через маску в возрасте 80 суток жизни ребенок стал хуже сосать, прибавки в весе уменьшились, хотя одышка, участие вспомогательной мускулатуры и потребность в дополнительном кислороде не увеличились, поэтому он вновь был переведен на кислородные канюли с потоком 0,5–1,0 л/мин. По данным рентгенологического исследования органов грудной полости (рис. 2), на втором месяце жизни появилась симптоматика, характерная для бронхолегочной дисплазии (БЛД).
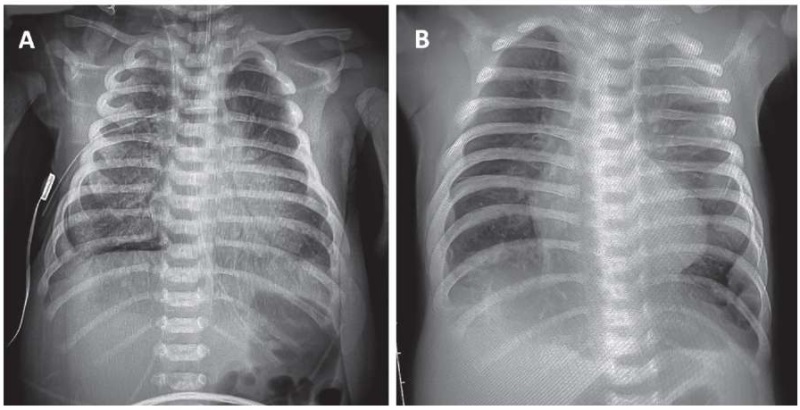
Рисунок 2. Легкие пациента на рентгенограмме
в возрасте конца первой недели жизни (A) и в возрасте 34 суток жизни (B).
Figure 2. X-ray lung imaging of the patient
at the age of the end of the first week of life (A) and at the age of 34 days of life (B).
На втором и третьем месяцах жизни проводилась ингаляционная терапия препаратами фенотерол и ипратропия бромид (Беродуал®, Boehringer Ingelheim International, Германия) и будесонидом (Пульмикорт®, AstraZeneca, Швеция), системная стероидная терапия дексаметазоном (2 курса по 10 дней с интервалом в 1 месяц) в соответствии с клиническими рекомендациями «Бронхолегочная дисплазия» [47].
Параллельно в первые два часа жизни была начата общая терапевтическая гипотермия, поскольку ребенок родился в тяжелой асфиксии, проводилась в течение 72 ч. В неврологическом статусе с рождения имели место кома, клонические судороги, подтвержденные данными амплитудно-интегрированной электроэнцефалографии (аЭЭГ), купированы на первой неделе жизни на фоне комбинированной противосудорожной терапии. В дальнейшем судороги больше не повторялись, противосудорожная терапия к концу второго месяца жизни была постепенно отменена. По данным магнитно-резонансной томографии (МРТ) головного мозга отмечались единичные микрогеморрагии в веществе теменных и затылочных долей головного мозга, гипоплазия мозолистого тела, невыраженная дилатация наружных и внутренних ликворных пространств, ретроцеребеллярная арахноидальная киста. Вскармливание ребенка энтерально было начато с 5-х суток жизни сцеженным грудным молоком с последующим быстрым увеличением объема питания до возрастной нормы. На втором месяце жизни ребенок начал эффективно сосать из бутылочки, однако в связи с персистированием тяжелой дыхательной недостаточности на фоне БЛД энтеральное питание практически до трех месяцев осуществлялось преимущественно через желудочный зонд с целью уменьшения физической нагрузки.
В течение первого месяца жизни ребенок нуждался в антибактериальной терапии со сменой препаратов в зависимости от клинико-инструментальной и лабораторной симптоматики с учетом выраженного поражения легких и персистирования двусторонней пневмонии, наличия с рождения и персистирования в динамике лабораторных маркеров системной воспалительной реакции: на первой неделе жизни повышение С-реактивного белка (СРБ) до 80 мг/л, уровень прокальцитонина (ПКТ) – до 30 пг/мл, интерлейкина (англ. interleukin, IL) IL-6 – более 1000 пг/мл, нейтрофильный индекс (НИ) на 2-е сутки жизни достигал 0,6, персистировала тромбоцитопения. Обследование на внутриутробные инфекции (цитомегаловирусную, вызванную герпесом 1-го, 2-го типов, токсоплазмоз, уреаплазмоз, хламидиоз, микоплазмоз, листериоз) из различных локусов (в том числе, стерильных) не выявило наличие у ребенка данных возбудителей. Бактериологическое исследование материала из различных локусов (ротоглотка, анус, кровь, мокрота), отобранного в первые часы жизни, роста микроорганизмов не выявило.
Ребенок выписан домой в возрасте 3,5 мес с массой тела 5064 г (прибавка в весе за 3,5 мес составила 864 г) без дополнительного кислорода; SpO2 при дыхании комнатным воздухом устойчиво составляла более 95 %. Ребенок активно и полностью высасывал из бутылочки весь необходимый энтеральный объем питания. Мать весь период госпитализации находилась с ребенком по уходу. В возрасте 8 мес нервно-психическое развитие ребенка соответствует возрасту, имеет место легкая белково-энергетическая недостаточность.
Обсуждение / Discussion
В представленном клиническом наблюдении продемонстрирована тяжелая сочетанная перинатальная патология (тяжелая интранатальная асфиксия, церебральная ишемия, синдром аспирации мекония) с тяжелым течением САМ, которая привела к критическому состоянию ребенка на втором часу жизни вплоть до потребности в проведении сердечно-легочной реанимации на фоне прогрессирующей гипоксемии, вызванной сердечно-легочной недостаточностью. Первичным в развитии полиорганной недостаточности, на наш взгляд, в данном клиническом случае стало поражение легких вследствие аспирации мекония. Основным фактором риска в развитии САМ у обсуждаемого ребенка была переношенность. Увеличение индекса оксигенации до 48 в первые 12 ч жизни свидетельствовало о рефрактерной к традиционной терапии дыхательной недостаточности и, по существу, являлось показанием для проведения процедуры ЭКМО [25][48]. Однако данная технология в условиях перинатального центра, где курировался ребенок, была недоступна, а перегоспитализация новорожденного в медицинскую организацию, где данная процедура могла быть выполнена, в крайне тяжелом нестабильном состоянии не представлялась возможной. Подбор способов, режимов и параметров инвазивной дыхательной терапии (ИВЛ, ВЧО ИВЛ, iNO), коррекция нарушений гемодинамики не приводили к ощутимому результату в отношении купирования гипоксемии, последняя персистировала и проградиентно нарастала.
Решение о проведении лаважа ТБД с сурфактантом порактант альфа в данной клинической ситуации, на наш взгляд, можно расценить как процедуру отчаяния, которая в итоге привела к отчетливому быстрому положительному результату и позволила пациенту не только выжить, но и сохранить прогноз без проведения процедуры ЭКМО, в том числе сопряженной с серьезными техническими сложностями и рисками развития осложнений [48][49]. Тот факт, что применение сурфактанта при САМ у новорожденных может снизить тяжесть респираторных заболеваний и уменьшить количество детей с прогрессирующей дыхательной недостаточностью, нуждающихся в поддержке с помощью ЭКМО, подтверждается в метаанализе AI. El Shahed с соавт. (2014) [50] и в исследовании H.C. Lin с соавт. (2005) [16].
Вероятно, позитивного результата при выполнении лаважа ТБД сурфактантом удается достигнуть благодаря тому, что меконий, сорбированный на частицах экзогенно введенного сурфактанта, более эффективно удаляется при лаваже [28]. Эффективность данного метода лечения связана с купированием неминуемо развивающегося при САМ вторичного дефицита эндогенного сурфактанта, потому что меконий деактивирует сурфактант, может угнетать его синтез [51], в том числе за счет гемоглобина и белков плазмы, попадающих в легкие при САМ [52][53]. Некоторые компоненты мекония, особенно свободные жирные кислоты (пальмовая, стеариновая, олеиновая), имеют минимальное поверхностное натяжение выше сурфактанта, в результате чего уменьшается альвеолярная поверхность, вызывая диффузные ателектазы [54].
И.В. Виноградова и Г.И. Никифорова (2011) в своей работе объясняли позитивные результаты разведения сурфактанта важнейшим свойством эмульсии сурфактанта – его высокой сорбирующей способностью [33]. При электронной микроскопии эмульсии Сурфактант-БЛ обнаруживаются везикулярные структуры величиной 0,2–0,5 мкм, образующие агрегаты размером 1,6–1,8 мкм, и 1 мг препарата содержит около 10⁸ частиц [55], на которых и сорбируется меконий при выполнении бронхоальвеолярного лаважа.
Развеять сомнения в отношении возможных нарушений свойств порактанта альфа при его разведении 0,9 % раствором хлорида натрия поможет инструкция к препарату, в которой указывается на то, что основным растворителем порактанта альфа является физиологический раствор хлорида натрия 0,9 %, поэтому уменьшение концентрации сурфактанта или увеличение его объема при помощи данного растворителя не следует рассматривать фактом вмешательства в структуру препарата. Безопасность и эффективность улучшения реологических свойств порактанта альфа путем разведения была продемонстрирована А.В. Мостовым с соавт. ранее в проспективном рандомизированном контролируемом исследовании, опубликованном в 2023 г. Двукратное разведение порактанта альфа приблизило вязкость препарата к обыкновенной воде в эксперименте, а также улучшило клинические исходы у недоношенных новорожденных при сохранении стандартной дозировки [56].
Более того, по мнению J. van der Bleek с соавт. (1993), лаваж сурфактантом с использованием большого объема раствора приводит к более однородному/равномерному распределению и депонированию сурфактанта в легочной ткани [57]. От объема вводимого сурфактанта при лаваже зависит результат. Так, P. Bandiya с соавт. (2018) не получили положительного влияния легочного лаважа сурфактантом у новорожденных с умеренно выраженным или тяжелым САМ на продолжительность дыхательной поддержки в связи с тем, что использовались небольшие объемы разведенного бычьего сурфактанта. При этом авторы указали на то, что непосредственно сама процедура лаважа переносилась детьми хорошо [44]. В тоже время G. Lista с соавт. (2006) [58], а также T. Lejeune и R.E. Pfister (2005) [59] отметили улучшение оксигенации, применяя легочный лаваж даже небольшим объемом свиного сурфактанта у новорожденных с САМ.
Однако в 2019 г. в одном из первых проспективных рандомизированных исследований S. Arayici с соавт. применили высокообъемный легочный лаваж свиным сурфактантом (15 мл/кг), сравнивая его с болюсным введением сурфактанта при лечении новорожденных с САМ [29]. В отличие от G. Lista с соавт. [58], T. Lejeune и R.E. Pfister [59] и P. Bandiya с соавт. [44], S. Arayici и соавт. [29] считают, что именно большой объем «промывного» раствора будет обладать наиболее значимым эффектом и сочетаться с пролонгированным улучшением оксигенации. В нашем клиническом наблюдении мы применили большой объем лаважа (15 мл/кг), который ребенок перенес удовлетворительно.
Говоря о проведении лаважа сурфактантом с использованием большого объема, немаловажным практическим аспектом становится технология получения лаважной жидкости обратно из ТБД. Особого интереса в данном контексте заслуживает исследование P.A. Dargaville с соавт. (2008) [60], на которое мы опирались, делая выбор в отношении технологии аспирации содержимого из ТБД после лаважа. САМ в экспериментальных условиях вызывался у поросят в возрасте 2 нед жизни, которым проводилась ИВЛ, путем введения раствора человеческого мекония 20 % в дозе 4,0 мл/кг. Легочный лаваж проводился непосредственно после введения мекония в трахею – 2 аликвоты физиологического раствора по 8,0 мл/кг (n = 5) или 1 аликвота 15 мл/кг (n = 6). Промывная жидкость удалялась 3 способами: закрытое отсасывание с использованием аспирационного адаптера; открытое отсасывание с отсоединением аппарата ИВЛ; открытое удаление аспирата в сочетании с ручной вибрирующей компрессией грудной клетки. Закрытая аспирация сочеталась с наименьшим количеством полученного обратно мекония и промывной жидкости. Компрессия грудной клетки при санации ТБД увеличивало отхождение мекония и промывной жидкости. В целом, удаление мекония от количества введенного было выше при использовании для лаважа аликвоты объемом 15 мл/кг (45 ± 17 %) в сравнении с использованием двух аликвот по 8,0 мл/кг (24,0 ± 4,5 %; р = 0,028; ANOVA); соответствующие показатели возврата промывной жидкости составили 73 ± 10 % и 49 ± 13 %, соответственно (р < 0,01). Оказалось, что открытое удаление содержимого, ручная вибрирующая компрессия грудной клетки и лаваж более высоким объемом (аликвота 15 мл/кг) – каждый из этих методов улучшает эффективность легочного лаважа при САМ [60]. Количество аспирата после введения лаважного раствора в нашем клиническом наблюдении составило около 40–50 % от введенного объема.
Проведение лаважа ТБД сурфактантом в нашем клиническом наблюдении выполнено в возрасте 12 ч жизни (по причине крайне нестабильной центральной гемодинамики), что не противоречит опубликованным в мировой литературе данным, где диапазон возраста проведения лаважа составил от 2 до 83 ч жизни (табл. 1) [34].
Таким образом, многие авторы во всем мире, посвятившие свои исследования лаважу сурфактантом при САМ, как в экспериментальных работах, так и у новорожденных детей, применяя натуральные (Куросурф, Сурванта, Сурфактант-БЛ), полусинтетические (Ньюфактан) и синтетические (CHF5633, Люциноктант или Сурфаксин) сурфактанты, используя различные объемы разведения поверхностно-активного вещества и стратегии его введения, сходятся во мнении, что данная технология позволяет снизить дальнейшее прогрессирование дыхательной недостаточности (в том числе потребность в проведении ЭКМО); однако вопрос в отношении улучшения заболеваемости и смертности по причине заболеваний легких остается спорным. Например, P.A. Dargaville с соавт. [26] и T.E. Wiswell с соавт. [14] не получили статистически значимого снижения риска развития пневмоторакса при проведении лаважа. В тоже время H.Y. Chang с соавт. (2003) [39], M.D. Salvia-Roigés. с соавт. (2004) [40] и S. Arayici с соавт. (2019) [29] продемонстрировали снижение частоты развития пневмоторакса, хотя в оригинальных исследованиях четко не описывается время возникновения пневмоторакса (до или после процедуры легочного лаважа). К сожалению, про развитие такого серьезного и крайне редкого для зрелых детей заболевания легких, как БЛД у доношенных новорожденных, перенесших САМ, информации практически нет. Встретилось единственное описание подобных случаев в работе H.C. Lin с соавт. (2005), которые указали на развитие БЛД у 2 (1,0 %) из 198 доношенных новорожденных с САМ, родившихся в одном госпитале в течение 9 лет [16]. Представленное нами клиническое наблюдение интересно еще и тем, что у зрелого, даже переношенного ребенка, перенесшего САМ, в последующем сформировалась типичная классическая форма БЛД, которая требовала соответствующего лечения.
Заключение / Conclusion
Представленный нами клинический случай не первый в нашей практике, когда приходится проводить лаваж трахеобронхиального дерева сурфактантом аликвотой объемом 15 мл/кг с последующим болюсным введением сурфактанта после промывания легких. Однако это первый опубликованный в отечественной практике случай, когда заместительная терапия сурфактантом (off-label) позволила нам избежать проведения ЭКМО пациенту при наличии для этого показаний. Данный метод респираторной терапии представляется эффективным и достаточно безопасным способом для снижения риска проведения ЭКМО, синдрома утечки воздуха у доношенных новорожденных с тяжелыми проявлениями САМ. Для определения наиболее эффективных стратегий требуется организация и проведение хорошо спланированных многоцентровых клинических исследований.
Список литературы
1. Wiswell T.E., Tuggle J.M., Turner B.S. Meconium aspiration syndrome: have we made a difference? Pediatrics. 1990;85(5):715-21.
2. Cleary G.M., Wiswell T.E. Meconium-stained amniotic fluid and the meconium aspiration syndrome. An update. Pediatr Clin North Am. 1998;45(3):511-29. https://doi.org/10.1016/s0031-3955(05)70025-0.
3. Nathan L., Leveno K.J., Carmody T.J. et al. Meconium: a 1990s perspective on an old obstetric hazard. Obstet Gynecol. 1994;83(3):329-32.
4. Ross M.G. Meconium aspiration syndrome - more than intrapartum meconium. N Engl J Med. 2005;353(9):946-8. https://doi.org/10.1056/NEJMe058149.
5. Ostrea E.M., Naqvi M. The influence of gestational age on the ability of the fetus to pass meconium in utero. Clinical implications. Acta Obstet Gynecol Scand. 1982;61(3):275-7. https://doi.org/10.3109/00016348209156571.
6. Usher R.H., Boyd M.E., McLean F.H., Kramer M.S. Assessment of fetal risk in postdate pregnancies. Am J Obstet Gynecol. 1988;158(2):259-64. https://doi.org/10.1016/0002-9378(88)90134-2.
7. Dargaville P.A., Copnell B.; Australian and New Zealand Neonatal Network. The epidemiology of meconium aspiration syndrome: incidence, risk factors, therapies, and outcome. Pediatrics. 2006;117(5):1712-21. https://doi.org/10.1542/peds.2005-2215.
8. Velaphi S., Vidyasagar D. Intrapartum and postdelivery management of infants born to mothers with meconium-stained amniotic fluid: evidence-based recommendations. Clin Perinatol. 2006;33(1):29-42. https://doi.org/10.1016/j.clp.2005.11.014.
9. Ghidini A., Spong C.Y. Severe meconium aspiration syndrome is not caused by aspiration of meconium. Am J Obstet Gynecol. 2001;185(4):931-8. https://doi.org/10.1067/mob.2001.116828.
10. Богомазова И.М., Стрижаков А.Н., Игнатко И.В. и др. Неонатальная аспирация мекония: факторы риска и адаптация новорожденных. Акушерство, Гинекология и Репродукция. 2018;12(4):5-14. https://doi.org/10.17749/2313-7347.2018.12.4.005-014.
11. Singh B.S., Clark R.H., Powers R.J., Spitzer A.R. Meconium aspiration syndrome remains a significant problem in the NICU: outcomes and treatment patterns in term neonates admitted for intensive care during a ten-year period. JPerinatol. 2009;29(7):497-503. https://doi.org/10.1038/jp.2008.241.
12. Radiological Imaging of the Neonatal Chest. 2nd Revised Edition. Ed. V. Donoqhue. Springer, 2008. 362 p.
13. Goldsmith J.P. Continuous positive airway pressure and conventional mechanical ventilation in the treatment of meconium aspiration syndrome. JPerinatol. 2008;28 Suppl 3:S49-55. https://doi.org/10.1038/jp.2008.156.
14. Wiswell T.E., Gannon C.M., Jacob J. et al. Delivery room management of the apparently vigorous meconium-stained neonate: results of the multicenter, international collaborative trial. Pediatrics. 2000;105 (1 Pt 1):1–7. https://doi.org/10.1542/peds.105.1.1.
15. Bondarev V.V., Mostovoy A.V., Narimanbecov I.O. High frequency oscillatory ventilation in respiratory treatment of neonates with severe respiratory distress syndrome. The 7th Baltic Sea Congress on Obstetrics and Gynecology. Журнал акушерства и женских болезней. 1999;48(5S):45. (In English). https://doi.org/10.17816/JOWD100809.
16. Lin H.C., Su B.H., Lin T.W. et al. System-based strategy for the management of meconium aspiration syndrome: 198 consecutive cases observations. Acta Paediatr Taiwan. 2005;46(2):67-71.
17. Keszler M., Molina B., Butterfield A.B., Subramanian K.N. Combined high-frequency jet ventilation in a meconium aspiration model. Crit Care Med. 1986;14(1):34-8. https://doi.org/10.1097/00003246-198601000-00009.
18. Tingay D.G., Mills J.F., Morley C.J. et al.; Australian and New Zealand Neonatal Network. Trends in use and outcome of newborn infants treated with high frequency ventilation in Australia and New Zealand, 1996-2003. J Paediatr Child Health. 2007;43(3):160-6. https://doi.org/10.1111/j.1440-1754.2007.01036.x.
19. Мостовой А.В., Иванов С.Л., Морозов К.А. Комплексная терапия легочной гипертензии у новорожденных с применением высокочастотной осцилляторной вентиляции легких и ингаляции оксида азота. Интенсивная терапия в неонатологии. 2003;(2):49-53.
20. Finer N.N., Barrington K.J. Nitric oxide for respiratory failure in infants born at or near term. Cochrane Database Syst Rev. 2006;(4):CD000399. https://doi.org/10.1002/14651858.CD000399.pub2.
21. Мостовой А.В., Карпова А.Л. Искусственная вентиляция легких у новорожденных. Физиологические особенности газообмена и механики дыхания как основа для управления параметрами вентиляции. Детские болезни сердца и сосудов. 2016;13(2):79-87.
22. De Luca D., van Kaam A.H., Tingay D.G. et al. The Montreux definition of neonatal ARDS: biological and clinical background behind the description of a new entity. Lancet Respir Med. 2017;5(8):657-66. https://doi.org/10.1016/S2213-2600(17)30214-X.
23. Schumacher R.E., Roloff D.W., Chapman R. et al. Extracorporeal membrane oxygenation in term newborns. A prospective cost-benefit analysis. ASAIO J. 1993;39(4):873-9.
24. Lakshminrusimha S., Keszler M. Persistent pulmonary hypertension of the newborn. Neoreviews. 2015;16(12):e680-e692. https://doi.org/10.1542/neo.16-12-e680.
25. Kugelman A., Gangitano E., Taschuk R. et al. Extracorporeal membrane oxygenation in infants with meconium aspiration syndrome: a decade of experience with venovenous ECMO. J Pediatr Surg. 2005;40(7):1082-9. https://doi.org/10.1016/j.jpedsurg.2005.03.045.
26. Dargaville P.A., Copnell B., Mills J.F. et al.; lessMAS Trial Study Group. Randomized controlled trial of lung lavage with dilute surfactant for meconium aspiration syndrome. J Pediatr. 2011;158(3):383-389.e2. https://doi.org/10.1016/j.jpeds.2010.08.044.
27. Dargaville P.A. Innovation in surfactant therapy I: surfactant lavage and surfactant administration by fluid bolus using minimally invasive techniques. Neonatology. 2012;101(4):326-36. https://doi.org/10.1159/000337346.
28. Hahn S., Choi H.J., Soll R., Dargaville P.A. Lung lavage for meconium aspiration syndrome in newborn infants. Cochrane Database Syst Rev. 2013;(4):CD003486. https://doi.org/10.1002/14651858.CD003486.pub2.
29. Arayici S., Sari F.N., Kadioglu Simsek G. et al. Lung lavage with dilute surfactant vs. bolus surfactant for meconium aspiration syndrome. J Trop Pediatr. 2019;65(5):491-7. https://doi.org/10.1093/tropej/fmy081.
30. Xu Y., Guo X., Chen M. et al. Efficacy of synthetic surfactant (CHF5633) bolus and/or lavage in meconium-induced lung injury in ventilated newborn rabbits. Pediatr Res. 2023;93(3):541-50. https://doi.org/10.1038/s41390-022-02152-2.
31. Rey-Santano C., Alvarez-Diaz F.J., Mielgo V. et al. Bronchoalveolar lavage versus bolus administration of lucinactant, a synthetic surfactant in meconium aspiration in newborn lambs. Pediatr Pulmonol. 2011t;46(10):991-9. https://doi.org/10.1002/ppul.21460.
32. Инструкция по медицинскому применению лекарственного препарата Сурфактант-БЛ. М.: Министерство здравоохранения Российской Федерации, 2021. 21 с. Режим доступа: https://biosurf.ru/upload/iblock/c9f/c9fdfc8dc57585fcc4e53d6b0eed8fb3.pdf. [Дата обращения: 09.05.2024].
33. Виноградова И.В., Никифорова Г.И. Применение сурфактанта БЛ у новорожденных с синдромом аспирации мекония. Российский вестник перинатологии и педиатрии. 2011;(4):15-9.
34. Hui R., Jing-Jing P., Yun-Su Z. et al. Surfactant lavage for neonatal meconium aspiration syndrome-An updated meta-analysis. J Chin Med Assoc. 2020;83(8):761-73. https://doi.org/10.1097/JCMA.0000000000000357.
35. Lam B.C., Yeung C.Y. Surfactant lavage for meconium aspiration syndrome: a pilot study. Pediatrics. 1999;103(5 Pt 1):1014-8. https://doi.org/10.1542/peds.103.5.1014.
36. Kowalska K, Szymankiewicz M, Gadzinowski J. Aneffectiveness of surfactant lung lavage (SLL) in meconium aspiration syndrome (MAS). Przegl Lek. 2002;59 Suppl 1:21-4. (In Polish).
37. Schlössser R.L., Veldman A., Fischer D. et al. Lavage with exogenous surfactant in neonatal meconium aspiration syndrome. Z Geburtshilfe Neonatol. 2002;206(1):15-8. (In German). https://doi.org/10.1055/s-2002-20945.
38. Wiswell T.E., Knight G.R., Finer N.N. et al. A multicenter, randomized, controlled trial comparing Surfaxin (Lucinactant) lavage with standard care for treatment of meconium aspiration syndrome. Pediatrics. 2002;109(6):1081-7. https://doi.org/10.1542/peds.109.6.1081.
39. Chang H.Y., Hsu C.H., Kao H.A. et al. Treatment of severe meconium aspiration syndrome with dilute surfactant lavage. J Formos Med Assoc. 2003;102(5):326-30.
40. Salvia-Roigés M.D., Carbonell-Estrany X., Figueras-Aloy J., Rodríguez-Miguélez J.M. Efficacy of three treatment schedules in severe meconium aspiration syndrome. Acta Paediatr. 2004;93(1):60-5.
41. Dargaville P.A., Mills J.F., Copnell B. et al. Therapeutic lung lavage in meconium aspiration syndrome: a preliminary report. J Paediatr Child Health. 2007;43(7-8):539-45. https://doi.org/10.1111/j.1440-1754.2007.01130.x.
42. Lee S.M., Kim H.M., Jeon J.H. et al. Effect of surfactant lavage in severe Meconium Aspiration Syndrome. Korean J Pediatr. 2008;51:367-71.
43. Gu H.R. Effect of pig surfactant lung lavage on severe meconium aspiration syndrome. Xian Dai Zhen DuanYu Zhi Liao. 2018;29:719-20. (In Chinese}.
44. Bandiya P., Nangia S., Saili A. Surfactant lung lavage vs. standard care in the treatment of meconium aspiration syndrome - a randomized trial. J Trop Pediatr. 2019;65(2):114-21. https://doi.org/10.1093/tropej/fmy024.
45. Jeng M.J., Soong W.J., Lee Y.S. Effective lavage volume of diluted surfactant improves the outcome of meconium aspiration syndrome in newborn piglets. Pediatr Res. 2009;66(1):107-12. https://doi.org/10.1203/PDR.0b013e3181a29092.
46. Hung H.Y., Jim W.T., Hsu C.H. et al. Small versus large volume dilute surfactant lavage for meconium aspiration syndrome. Acta Paediatr Taiwan. 2006;47(4):181-6.
47. Клинические рекомендации - Бронхолегочная дисплазия (у детей) - 2024-2025-2026 (05.06.2024). М.: Министерство здравоохранения Российской Федерации, 2024. 60 с. Режим доступа: http://disuria.ru/_ld/14/1425_kr24P27p1MZ.pdf. [Дата обращения: 09.05.2024].
48. Xiong J., Zhang L., Bao L. Complications and mortality of venovenous extracorporeal membrane oxygenation in the treatment of neonatal respiratory failure: a systematic review and meta-analysis. BMC Pulm Med. 2020;20(1):124. https://doi.org/10.1186/s12890-020-1144-8.
49. Geyer M., Gohrbandt B., Sagoschen I. et al. Pitfalls of cannulation for extracorporeal life support: review of the literature and illustrative case presentation. J Artif Organs. 2018;21(1):8-16. https://doi.org/10.1007/s10047-017-1004-3.
50. El Shahed A.I., Dargaville P.A., Ohlsson A., Soll R. Surfactant for meconium aspiration syndrome in term and late preterm infants. Cochrane Database Syst Rev. 2014;2014(12):CD002054. https://doi.org/10.1002/14651858.CD002054.pub3.
51. Janssen D.J., Carnielli V.P., Cogo P. et al. Surfactant phosphatidylcholine metabolism in neonates with meconium aspiration syndrome. J Pediatr. 2006;149(5):634-9. https://doi.org/10.1016/j.jpeds.2006.07.027.
52. Dargaville P.A., Mills J.F. Surfactant therapy for meconium aspiration syndrome: current status. Drugs. 2005;65(18):2569-91. https://doi.org/10.2165/00003495-200565180-00003.
53. Lo C.W., Jeng M.J., Chang F.Y. et al. Therapeutic lung lavage with diluted surfactant in neonates with severe meconium aspiration syndrome. J Chin Med Assoc. 2008;71(2):103-9. https://doi.org/10.1016/S1726-4901(08)70084-4.
54. Terasaka D., Clark D.A., Singh B.N., Rokahr J. Free fatty acids of human meconium. Biol Neonate. 1986;50(1):16-20. https://doi.org/10.1159/000242556.
55. Розенберг О.А. Лёгочный сурфактант и его применение при заболеваниях лёгких. Общая реаниматология. 2007;3(1):66-77. https://doi.org/10.15360/1813-9779-2007-1-66-77.
56. Мостовой А.В., Карпова А.Л., Межинский С.С., Володин Н.Н. Влияние различных концентраций порактанта альфа с одинаковой дозой на исходы у недоношенных новорожденных менее 32 недель. Акушерство, Гинекология и Репродукция. 2023;17(5):565—583. (In English). https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.448.
57. van der Bleek J., Plotz F.B., van Overbeek F.M. et al. Distribution of exogenous surfactant in rabbits with severe respiratory failure: the effect of volume. Pediatr Res. 1993;34(2):154-8. https://doi.org/10.1203/00006450-199308000-00009.
58. Lista G., Bianchi S., Castoldi F. et al. Bronchoalveolar lavage with diluted porcine surfactant in mechanically ventilated term infants with meconium aspiration syndrome. Clin Drug Investig. 2006;26(1):13-9. https://doi.org/10.2165/00044011-200626010-00002.
59. Lejeune T., Pfister R.E. Surfactant lavage for extracorporeal membrane oxygenation-requiring meconium aspiration syndrome - a cheap alternative. Eur J Pediatr. 2005;164(5):331-3. https://doi.org/10.1007/s00431-005-1624-0.
60. Dargaville P.A., Copnell B., Tingay D.G. et al. Refining the method of therapeutic lung lavage in meconium aspiration syndrome. Neonatology. 2008;94(3):160-3. https://doi.org/10.1159/000143394.
Об авторах
А. В. МостовойРоссия
Мостовой Алексей Валерьевич - к.м.н.
123423 Москва, ул. Саляма Адиля, д. 2/44; 123995 Москва, ул. Баррикадная, д. 2/1, корп. 1; 150000 Ярославль, ул. Революционная, д. 5
Scopus Author ID 57201723894; Wos ResearcherID AAR-7908-2021
А. Л. Карпова
Россия
Карпова Анна Львовна - к.м.н.
123423 Москва, ул. Саляма Адиля, д. 2/44; 123995 Москва, ул. Баррикадная, д. 2/1, корп. 1; 150000 Ярославль, ул. Революционная, д. 5
И. В. Попов
Россия
Попов Игорь Владимирович.
123423 Москва, ул. Саляма Адиля, д. 2/44
Wos ResearcherID F-7040-2016
Л. А. Аникеева
Россия
Аникеева Любовь Алексеевна.
123423 Москва, ул. Саляма Адиля, д. 2/44
Н. Ю. Карпов
Россия
Карпов Николай Юрьевич.
152303 Тутаев, ул. Комсомольская, д. 104
Что уже известно об этой теме?
► Каждый третий ребенок с синдромом аспирации мекония (САМ) требует интубации трахеи и перевода на искусственную вентиляцию легких, а летальность может достигать 20 %.
► Для того чтобы избежать применения экстракорпоральной мембранной оксигенации (ЭКМО), в мире часто используют заместительную терапию сурфактантом: легочным лаважом или болюсным введением. Терапия сурфактантом острого респираторного дистресс-синдрома (ОРДС) при САМ позволяет снизить летальность и инвалидность.
► Большинство зарубежных исследователей применяют сурфактантный раствор для проведения лаважа в объеме 15–20 мл/кг, также описаны случаи повторного болюсного введения сурфактанта после лаважа. Среди российских публикаций на эту тему подобных исследований не было найдено.
Что нового дает статья?
► Представлен обзор литературы, дающий представление о безопасном и эффективном применении респираторной стратегии сурфактантного лаважа в объеме 15–20 мл/кг и/или болюсного введения сурфактанта при тяжелой форме САМ.
► Представлен собственный успешный практический опыт применения сурфактантного лаважа с последующим болюсным введением сурфактанта у ребенка с синдромом утечки воздуха (СУВ), персистирующей легочной гипертензией новорожденных и неонатальным ОРДС при САМ.
► Впервые в отечественной неонатальной практике подробно описан алгоритм проведения сурфактантного лаважа с последующим болюсным введением сурфактанта с целью улучшения оксигенации и профилактики перевода пациента на ЭКМО.
Как это может повлиять на клиническую практику в обозримом будущем?
► Описанный нами опыт открывает дополнительные возможности неонатальным клиникам проведения заместительной терапии сурфактантом в случае тяжелой формы САМ, когда перевод на ЭКМО или транспортировка в ЭКМО-центр невозможна из-за тяжести состояния больного.
► Применение описанной респираторной стратегии в неонатальной практике позволит снизить риск перевода пациентов на ЭКМО, а также может привести к улучшению оксигенации и последующей быстрой стабилизации пациентов с САМ, снизить риск развития СУВ.
► Наша публикация может послужить примером успешного применения данной респираторной стратегии у новорожденных с тяжелым течением САМ.
Рецензия
Для цитирования:
Мостовой А.В., Карпова А.Л., Попов И.В., Аникеева Л.А., Карпов Н.Ю. Лаваж легких сурфактантом при неонатальном синдроме аспирации мекония как жизнеспасающая респираторная стратегия: обзор литературы и клинический случай. Акушерство, Гинекология и Репродукция. 2024;18(4):581-595. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.533
For citation:
Mostovoi A.V., Karpova A.L., Popov I.V., Anikeeva L.A., Karpov N.Yu. Surfactant lung lavage in neonatal meconium aspiration syndrome as a life-saving respiratory strategy: literature review and a case report. Obstetrics, Gynecology and Reproduction. 2024;18(4):581-595. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.533

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































