Перейти к:
Изучение особенностей таксономического состава микробиоты кишечника и их связи с гормональным и иммунным статусом у женщин с наружным генитальным эндометриозом
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.534
Аннотация
Цель: системная оценка особенностей таксономического состава микробиоты кишечника во взаимосвязи с показателями гормонального и иммунного статуса у пациенток с наружным генитальным эндометриозом (НГЭ).
Материалы и методы. В сравнительное одномоментное исследование были включены 33 пациентки с НГЭ, которые составили основную группу, и 30 здоровых женщин, составивших контрольную группу. Всем женщинам производили оценку гормонального статуса и определение уровней экспрессии цитокинов в периферической крови. Измерение содержания гормонов - эстрадиола (Е2), фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ), пролактина (ПРЛ) осуществляли с помощью иммуноферментного и хемилюминесцентного анализа. Определение уровней экспрессии цитокинов - интерлейкинов (англ. interleukin, IL) IL-6, IL-8, фактора некроза опухоли альфа (англ. tumor necrosis factor alpha, TNF-α) производили с использованием иммуноферментного анализа. Изучение таксономического состава кишечной микробиоты на уровне фил и родов проводили методом секвенирования гена 16S рибосомальной РНК. Для оценки альфа-разнообразия сообщества использовали индексы Chao1, ACE, Sobs.
Результаты. Концентрация Е2 в крови пациенток основной группы была статистически значимо выше по сравнению с женщинами контрольной группы. Также у женщин с НГЭ были отмечены более высокие плазменные концентрации IL-6, IL-8, IL-17 и TNF-a по сравнению с аналогичными показателями группы контроля (р < 0,001). При анализе альфа-разнообразия бактериального сообщества в основной группе было установлено достоверное снижение индекса Chao1. На уровне филумов соотношение Firmicutes/Bacteroidetes у пациенток с НГЭ было увеличено по сравнению с таковым в группе контроля. Среди 20 крупнейших родов у пациенток с НГЭ было отмечено статистически значимое повышение численности Lachnospira, Blautia, Dorea, Streptococcus, Eubacterium hallii_group и достоверное снижение Bifidobacterium и Eubacterium eligens_group. Получена положительная корреляция уровня эстрогена с численностью представителей родов Eubacterium hallii_group и Streptococcus, IL-8 - со Streptococcus, TNF-α - со Streptococcus и Lachnospira, а также отрицательная корреляция между TNF-α и Bifidobacterium.
Заключение. Установлена связь дисбиотических изменений кишечника с развитием эндометриоза. Выявленные корреляции нарушений таксономического состава кишечной микрофлоры с показателями гормонального и иммунного статуса у пациенток с НГЭ указывают на вовлеченность микробиоты кишечника в патофизиологию эндометриоза.
Ключевые слова
Для цитирования:
Бельченко У.Д., Якубова Э.Э., Попович Т.С., Агаева Э.Л., Каялиева Э.З., Худайбердиев Э.Ш., Ли Я.Р., Гасанов С.Р., Передеренко Н.И., Кадыров Э.Ш., Новиков К.В., Остожьев Е.А., Прасолов Н.С., Сорокина Л.Е. Изучение особенностей таксономического состава микробиоты кишечника и их связи с гормональным и иммунным статусом у женщин с наружным генитальным эндометриозом. Акушерство, Гинекология и Репродукция. 2024;18(4):464-474. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.534
For citation:
Belchenko U.D., Yakubova E.E., Popovich T.S., Agaeva E.L., Kayalieva E.Z., Khudaiberdiev E.Sh., Li Y.R., Gasanov S.R., Perederenko N.I., Kadyrov E.Sh., Novikov K.V., Ostozhiev E.A., Prasolov N.S., Sorokina L.E. Features of intestinal microbiota taxonomic composition and their relation with hormonal and immune status assessed in women with external genital endometriosis. Obstetrics, Gynecology and Reproduction. 2024;18(4):464-474. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.534
Введение / Introduction
Согласно современным представлениям, эндометриоз рассматривается как иммунновоспалительный эстрогензависимый патологический процесс, связанный с распространением вне слизистой оболочки тела матки ткани, морфофункционально сходной с эндометрием [1]. Медико-социальная значимость проблемы обусловлена широким распространением патологии, ее существенным негативным влиянием на женское репродуктивное здоровье, психологическое состояние и качество жизни. Распространённость наружного генитального эндометриоза (НГЭ) в общей популяции женщин репродуктивного возраста достигает 6–10 %, при этом указанные данные носят аппроксимативный характер, что обусловлено полиморфностью клинической картины и отсутствием высокоинформативных неинвазивных методов диагностики заболевания [2]. Возникающие трудности на диагностическом этапе часто приводят к установке ошибочного диагноза и/или задержке его постановки [3][4], что в последующем ведет к прогрессированию патологии и развитию тяжелых неблагоприятных последствий [5]. Помимо этого, существующие на сегодня стратегии лечения эндометриоза также все еще остаются недостаточно эффективными и сопряжены с высоким процентом развития рецидивов [3].
При этом ключевым аспектом, обуславливающим неполную результативность диагностических и лечебных мероприятий, является недостаток знаний в вопросах этиопатогенеза НГЭ.
Очевидная мультифакториальность патологии определяет наличие различных теорий возникновения заболевания. Отмеченное значимое увеличение концентрации эстрогенов в менструальной крови и в перинеальной жидкости у пациенток с эндометриозом позволяет отнести рассматриваемую патологию к гормонозависимым заболеваниям [6]. Показано, что эстрогены играют ключевое значение в поддержании воспаления и боли, связанной с НГЭ [7].
В дополнение к дисбалансу нейрогуморальной регуляции при эндометриозе имеет место также девиация иммунного ответа. Исследования иммунных аспектов НГЭ указывают на активацию врожденного компонента иммунитета, а также гиперфункцию В-лимфоцитарного звена на фоне развития Т-клеточного дефицита [8][9]. В этом аспекте особо стоит подчеркнуть роль цитокинов, выполняющих функцию медиаторов межклеточных сигналов и являющихся основными регуляторами активности иммунных клеток.
Сегодня одной из наиболее широко принятых теорий развития эктопических тканей эндометрия становится гипотеза ретроградной менструации, на основании которой в 2008 г. впервые было выдвинута концепция о вкладе бактериальной контаминации в патогенез НГЭ [10]. В литературе наблюдается экспоненциальный рост исследований, связанных с изучением влияния кишечной микробиоты на развитие эндометриоза. Известно, что микрофлора кишечника играет не только важную роль в системных метаболических процессах, но и является ключевым регулятором нейрогуморальных осей и иммунных реакций. Многочисленные исследования демонстрируют связь дисбиоза кишечника с нарушением метаболизма эстрогенов, дисбалансом систем врожденного и адаптивного иммунитета и формированием хронического воспаления при ряде патологий [10][11].
Наконец, имеются фундаментальные и клинические исследования, предоставляющие убедительные доказательства изменений кишечного биоценоза при развитии НГЭ [10][12]. В то же время научные сведенья о таксономическом составе микробиоты кишечника у пациенток с эндометриозом характеризуются фрагментарностью и противоречивостью. В доступной литературе имеются лишь единичные публикации, рассматривающие вероятные патогенетические механизмы взаимосвязи нарушений кишечного биоценоза с эндометриозом.
Между тем углубленное изучение профиля микробиоты кишечника у пациенток с НГЭ потенциально может открывать новые горизонты в отношении разработки инновационных диагностических и терапевтических стратегий данной патологии.
Цель: системная оценка особенностей таксономического состава микробиоты кишечника во взаимосвязи с показателями гормонального и иммунного статуса у пациенток с НГЭ.
Материалы и методы / Materials and Methods
Дизайн исследования / Study design
В период 2023–2024 гг. проведено одномоментное контролируемое исследование с участием 63 женщин, наблюдавшихся в Клиническом медицинском многопрофильном центре Святителя Луки ФГАОУ ВО КФУ им. В.И. Вернадского (Симферополь). Согласно дизайну исследования, все участницы исследования были рандомизированы в 2 группы. Основную группу (ОГ) составили 33 пациентки с установленным диагнозом НГЭ, в контрольную группу вошли 30 здоровых женщин, проходивших диспансеризацию на базе медицинского центра.
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения в основную группу: женщины репродуктивного возраста (18–45 лет); лапароскопически и гистологически верифицированный диагноз НГЭ [1]; подписанное согласие на участие в исследовании.
Критерии включения в контрольную группу: женщины репродуктивного возраста (18–45 лет); отсутствие акушерско-гинекологической патологии в анамнезе; подписанное согласие на участие в исследовании.
Критерии исключения: женщины в возрасте менее 18 и старше 45 лет; беременность или период лактации; общесоматические заболевания в стадии декомпенсации; злокачественные новообразования любой локализации; органические и функциональные заболевания органов желудочно-кишечного тракта в анамнезе; прием за 1 месяц до включения в исследование препаратов из следующих фармакологических групп – гормональные, иммуномодулирующие, антибактериальные, противовирусные, противогрибковые средства, средства, являющиеся источниками пробиотических бактерий и молочнокислых микроорганизмов; отказ от участия в научном исследовании.
Методы исследования / Study methods
Оценка гормонального статуса / Assessment of hormonal status
Определение содержания гормонов – эстрадиола (Е2), фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ), пролактина (ПРЛ) в периферической крови обследуемых осуществляли с помощью иммуноферментного и хемилюминесцентного анализа. Отбор проб крови из локтевой вены осуществляли в утренние часы, натощак, на 2–3-й день менструального цикла. Иммуноферментный анализ проводили с помощью коммерческих наборов компании «Алкор Био» (Россия) на анализаторе Labsystems Multiskan Ascent (Thermo Labsystems, Финляндия). Хемилюминесцентный анализ осуществляли с использованием автоматизированной аналитической системы Immulite 2000 XPi (Siemens Healthcare Diagnostics, США).
Оценка иммунного статуса / Assessment of immune status
Определение уровня экспрессии цитокинов – интерлейкинов (англ. interleukin, IL) IL-6, IL-8, фактора некроза опухоли альфа (англ. tumor necrosis factor alpha, TNF-α) производили с использованием иммуноферментного анализа. Отбор проб из локтевой вены осуществляли в утренние часы, натощак, вне зависимости от дня менструального цикла. Исследования проводили с использованием коммерческих наборов компании ЗАО «Вектор-Бест» (Россия) на анализаторе Labsystems Multiskan Ascent (Thermo Labsystems, Финляндия).
Оценка таксономического состава микробиоты кишечника / Assessment of taxonomic intestinal microbiota composition
Для изучения таксономического состава микробиоты кишечника у всех пациенток однократно проводили забор кала. В день забора образцы замораживали и хранили при температурном режиме –20 °C до постановки реакций. Выделение ДНК из полученных образцов проводили согласно инструкции фирмы-производителя с использованием коммерческого набора «ДНК-сорб-B» (Россия). Концентрацию экстрагированной ДНК измеряли с использованием набора реагентов Qubit dsDNA HS Assay Kit (Thermo Fisher Scientific, США) на специализированном флуориметре Qubit Fluorimeter (Invitrogen, США).
Оценку таксономического состава проводили методом секвенирования гена 16S рибосомальной РНК (рРНК).
Амплификация гипервариабельных областей V3–V4 гена 16S рРНК проведена с помощью полимеразной цепной реакции (ПЦР). Подготовку библиотек осуществляли с использованием наборов NEBNext Multiplex Small RNA Library Prep Set for Illumina (New England Biolabs, Германия). Библиотеки секвенировали на платформе Illumina HiSeq 3000 (Illumina, США) парно-концевым методом.
Обработку полученных данных осуществляли при использовании пакетов ПО Trimmomatic [13] и QIIME [14]. Таксономическая принадлежность прочтений осуществлялась с помощью баз данных CosmosID Metagenomics (www.cosmosid.com) и KEGG Pathogen, MicrobeNet (A CDC Virtual Reference Laboratory, https://microbenet.cdc.gov). Анализ α-разнообразия микробного сообщества проводили посредством расчета индекса Chao1, числа обнаруженных таксонов (± SD; Sobs ) и показателя, демонстрирующего реальное количество таксонов (англ. Abundance Coverage Estimator, ACE).
Методы статистического анализа / Statistic alanalysis
Обработка полученных данных проводилась в программе Statistica 6.0 (StatSoft Inc., США). Различия рассчитывали при помощи критерия Манна–Уитни. Параметры нормального распределения представляли в формате среднее ± статистическая ошибка среднего (M ± m). Данные с ассиметричным распределением описывали в виде медианы и верхнего и нижнего квартилей (Me [Q1; Q3]). Расчет коэффициентов корреляции проводили, используя непараметрический коэффициент Спирмена. Значимость различий устанавливалась при p ≤ 0,05.
Результаты / Results
Клиническая характеристика обследованных женщин / Clinical characteristics of the women examined
Клиническая характеристика пациенток с НГЭ и здоровых женщин представлена в таблице 1. Женщины основной группы и группы контроля были сопоставимы по возрасту (37,0 ± 1,6 лет против 37,7 ± 2,1 лет; р = 0,89) и индексу массы тела (23,0 ± 3,3 кг/м² против 22,06 ± 2,9 кг/м²; р = 0,062). Среди пациенток основной группы у 11 из 35 (31,4 %) установлен НГЭ I–II степени распространенности, у остальных 24 (68,6 %) – НГЭ III–IV степени.
Таблица 1. Клиническая характеристика.
Table 1. Clinical characteristics.
|
Показатель Parameter |
Основная группа Main group n = 33 |
Контрольная группа Control group n = 30 |
|
Возраст, лет, М ± m Age, years, M ± m |
37,0 ± 1,6 |
37,7 ± 2,1 |
|
Индекс массы тела, кг/м², М ± m Body mass index, kg/m², M ± m |
23,0 ± 3,3 |
22,06 ± 2,9 |
|
НГЭ I–II степени распространенности, n (%) ЕGE I–II degree of prevalence, n (%) |
11 (31,4) |
– |
|
НГЭ III–IV степени распространенности, n (%) ЕGE III–IV degree of prevalence, n (%) |
24 (68,6) |
– |
Примечание: НГЭ – наружный генитальный эндометриоз.
Note: EGE – external genital endometriosis.
Особенности гормонального статуса обследованных женщин / Features of hormonal status in the women examined
Проведенный анализ содержания гормонов в плазме крови обследованных женщин позволил выделить ряд отличий (табл. 2).
Так, концентрация Е2 у пациенток основной группы с НГЭ была достоверно выше по сравнению с лицами контрольной группы – 75,6 ± 17,2 пг/л против 49,8 ± 15,26 пг/л (р < 0,001). По содержанию ФСГ, ЛГ и ПРЛ значимых различий между группами получено не было (р > 0,05).
Таблица 2. Показатели гормонального профиля в плазме крови.
Table 2. Parameters of blood plasma hormonal profile.
|
Показатель Parameter |
Основная группа Main group n = 33 |
Контрольная группа Control group n = 30 |
р |
|
Эстрадиол, пг/мл, М ± m / Estradiol, pg/ml, М ± m |
75,6 ± 17,2 |
49,8 ± 15,26 |
< 0,001 |
|
Фолликулостимулирующий гормон, мМЕ/мл, М ± m / Follicle stimulating hormone, mIU/ml, М ± m |
8,3 ± 0,5 |
7,6 ± 0,5 |
0,419 |
|
Лютеинизирующий гормон, мМЕ/мл, М ± m / Luteinizing hormone, mIU/ml, М ±m |
5,3 ± 0,3 |
6,1 ± 0,5 |
0,447 |
|
Пролактин, мкМЕ/мл, М ± m / Prolactin, µIU/ml, M ± m |
290,6 ± 14,4 |
286,8 ± 18,2 |
0,089 |
Таблица 3. Показатели цитокинового профиля в плазме крови.
Table 3. Parameters of blood plasma cytokine profile.
|
Показатель Parameter |
Основная группа Main group n = 33 |
Контрольная группа Control group n = 30 |
р |
|
Интерлейкин-6, пг/мл, М ± m / Interleukin-6, pg/ml, M ± m |
10,7 ± 1,6 |
6,5 ± 0,8 |
< 0,001 |
|
Интерлейкин-8, пг/мл, М ± m / Interleukin-8, pg/ml, M ± m |
14,6 ± 2,1 |
2,2 ± 0,7 |
< 0,001 |
|
Интерлейкин-17, пг/мл, М ± m / Interleukin-17, pg/ml, M ± m |
53,9 ± 3,2 |
75,2 ± 4,9 |
< 0,001 |
|
Фактор некроза опухоли альфа, пг/мл, М ± m / Tumor necrosis factor alpha, pg/ml, М ± m |
9,9 ± 1,8 |
5,2 ± 0,7 |
< 0,001 |
Особенности иммунного статуса обследованных женщин / Features of immune status in the women examined
Концентрации IL-6, IL-8, IL-17 и TNF-α в плазме крови пациенток основной группы статистически значимо превышали аналогичные показатели у здоровых женщин из группы контроля (р < 0,001).
При анализе кишечного микробиома методом 16S рРНК секвенирования было идентифицировано 1 463 557 последовательностей с общим числом оснований 633 820 566 и средней длиной 433,1, причем длина в основном распределялась между 421 и 460. При анализе α-разнообразия бактериального сообщества в основной группе было установлено достоверное снижение индекса Chao1 (p = 0,020). Кроме того, у пациенток с НГЭ обращает на себя внимание тенденция к снижению индексов ACE и Sobs (рис. 1), однако не достигающая статистической значимости (р = 0,060; р = 0,064 соответственно).
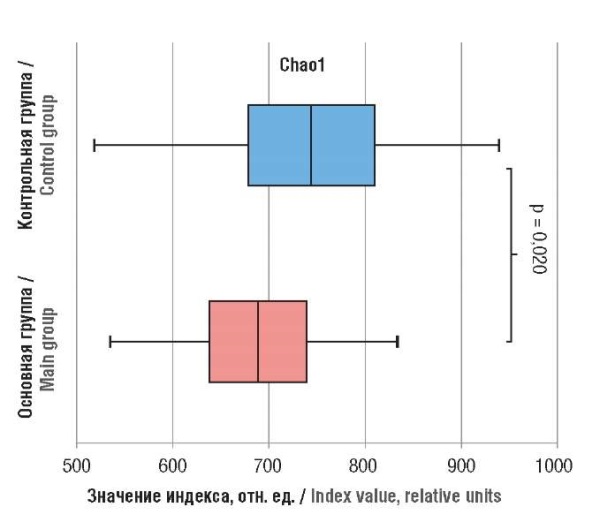


Рисунок 1. Филогенетический состав микробиоты кишечника обследованных женщин.
Figure 1. Phylogenetic intestinal microbiota composition in the women examined.
На уровне филумов соотношение Firmicutes/Bacteroidetes у пациенток с НГЭ было увеличено по сравнению с таковым в группе контроля (p < 0,001). В ходе сравнительного анализа таксономического состава микробиоты среди 20 крупнейших родов в основной группе было зафиксировано достоверное повышение численности Lachnospira (р = 0,001), Blautia (р = 0,008), Dorea (р = 0,041), Streptococcus (p < 0,001), Eubacterium hallii_group (р = 0,009) и достоверное снижение Bifidobacterium (p = 0,001) и Eubacterium eligens_group (р = 0,008) (рис. 2).
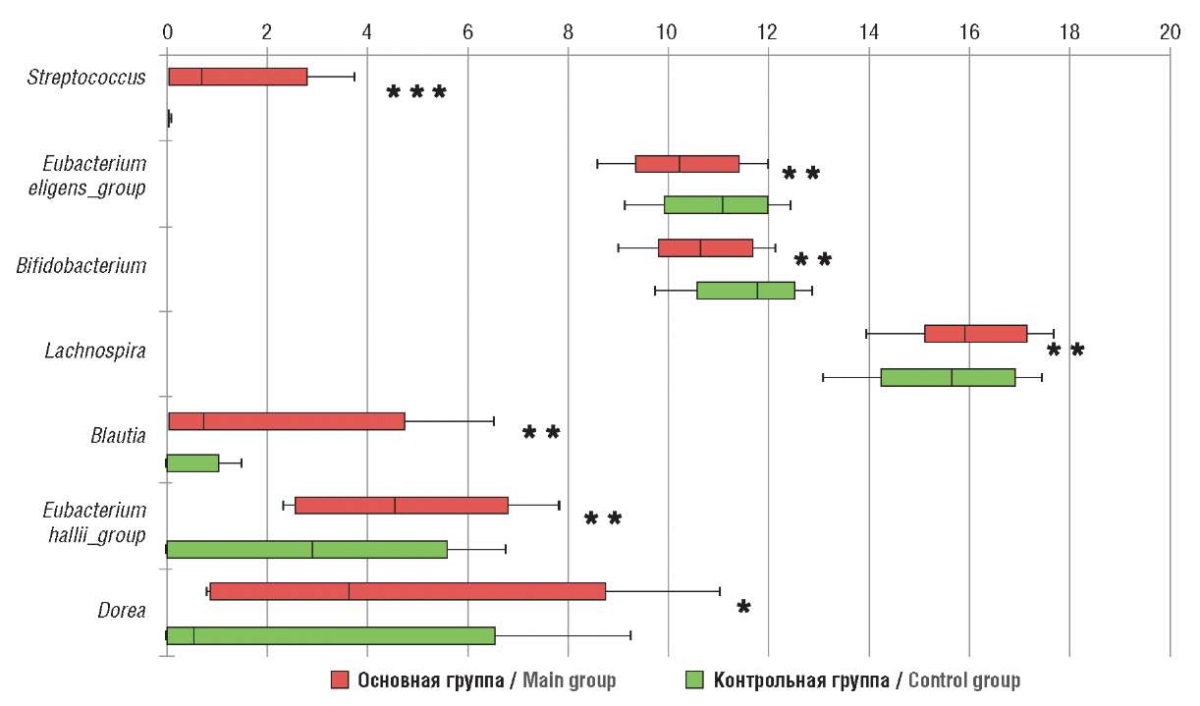
Рисунок 2. Родовой состав микробиоты кишечника обследованных женщин
(линейный дискриминантный анализ, ЛДА).
Примечание: *p< 0,05; **p = 0,01; ***p < 0,01 – значимость различий
по сравнению с контрольной группой.
Figure 2. Generic intestinal microbiota composition in the women examined
(linear discriminative analysis, LDA).
Note: *p < 0.05; **p = 0.01; ***p < 0.01 – significance of differences
compared to control group.
Ассоциации таксономического состава кишечной микробиоты с показателями гормонального и иммунного статуса пациенток с наружным генитальным эндометриозом / Associations between taxonomic intestinal microbiota composition and parameters of hormonal and immune status in patients with external genital endometriosis
При изучении взаимосвязи таксономических особенностей кишечного биоценоза с биохимическими показателями пациенток с НГЭ была получена положительная корреляция уровня эстрогена с численностью представителей родов Eubacterium hallii_group (r = 0,69; р = 0,001) и Streptococcus(r = 0,61; p < 0,001). Уровень плазменного TNF-α имел положительную связь с численностью рода Streptococcus (r = 0,89; p < 0,05) и Lachnospira (r = 0,76; p < 0,05), а также отрицательную с Bifidobacterium (r = –0,89; p = 0,020). Также продемонстрирована достоверная отрицательная корреляция между концентрацией IL-8 в плазме крови и представленностью рода Streptococcus (r = –0,95; p < 0,001).
Обсуждение / Discussion
Этиопатогенез эндометриоза имеет мультифакториальный характер. При этом на сегодняшний день не вызывает сомнений сопряженность данного патологического процесса с нарушениями микрофлоры кишечника, что также подтверждается результатами настоящего исследования.
Установлено, что для женщин с НГЭ характерно снижение α-разнообразия микробного сообщества, что присуще широкому спектру патологий, сопровождающихся хронической воспалительной реакцией [15]. Указанные результаты полностью соотносятся с более ранними публикациями зарубежных коллег, где отмечено выраженное снижение как α-, так и β-разнообразия кишечной микробиоты у женщин с эндометриоидными очагами [16].
В рамках текущей работы были также уточнены представления о таксономических и функциональных особенностях состава микрофлоры кишечника на уровне филумов и родов. Продемонстрировано увеличение соотношения Firmicutes/Bacteroidetes у пациенток с НГЭ, что согласуется с результатами ранее выполненных работ [17]. Согласно литературным данным, соотношение Firmicutes/Bacteroidetes определяется как важный прогностический фактор ряда метаболических и воспалительных патологий, в частности таких, как ожирение [18], сахарный диабет 2-го типа [19] и синдром раздраженного кишечника [20].
Между тем в вопросе особенностей родового и видового состава микробиоты при эндомериозе до сих пор нет единого мнения. Ряд авторов указывают на увеличение представителей Proteobacteria, Actinobacteria, Cyanobacteria, Saccharibacteria, Fusobacteria, Acidobacteria и Patescibacteria [21][22]. L. Huang с соавт. демонстрируют повышение численности Eggerthellalenta и Eubacteriumdolichum на фоне уменьшения Clostridia, Ruminococcus и Lachnospiraceae [23]. В. Ata с соавт. отмечают значимое снижение представленности родов Sneathia, Barnesella и Gardnerella [24]. В ходе нашего исследования у пациенток с НГЭ установлено статистически значимое повышение численности родов Lachnospira, Blautia, Dorea, Streptococcus, Eubacterium рallii_group и достоверное снижение Bifidobacterium и Eubacterium eligens_group. Указанные микроорганизмы обладают выраженным иммуномодулирующим потенциалом, регулируют проницаемость кишечного барьера, продуцируют короткоцепочечные жирные кислоты и другие метаболиты.
В контексте полученных результатов особое внимание привлекают бактерии рода Streptococcus. В ранее выполненной работе J. Biarc с соавт. отмечают увеличение представленности указанного таксона у пациентов с дисбактериозом [25]. Кроме того, авторы демонстрируют, что токсичный белок, выделяемый некоторыми представителями рода Streptococcus, обладает провоспалительным действием, которое опосредовано активацией циклооксигеназы второго типа (ЦОГ-2) и сверхэкспрессией простагландина E2 (ПГЕ2) [26]. Последний, в свою очередь, является медиатором тканевого воспаления, повышает чувствительность ноцицептивных рецепторов и регулирует направление иммунных реакций.
Значимым достижением представленного исследования является также расширение представлений о взаимосвязи микрофлоры кишечника с показателями гормонального и иммунного статуса у пациенток с НГЭ. Общеизвестно, что для женщин с эндометриозом характерен высокий уровень эстрогенов в крови [6]. 17β-эстрадиол (E2) является ключевым гормоном, который опосредует разрастание эндометриоидной ткани, а также усиливает воспаление и болевые ощущения, связанные с ней [27]. Считается, что это локальное накопление эстрогена играет важную роль в развитии и прогрессировании эндометриоидных очагов путем связывания и активации эстрогеновых рецепторов (англ. estrogen receptors, ER) ERα и ERβ. Перекрестное взаимодействие ERα и IL-6 опосредует ранний дебют эндометриоза [28]. Показано, что макрофаги со сверхэкспрессией ERβ в эктопическом эндометрии активно секретируют провоспалительные цитокины TNF-α и IL-8, которые, в свою очередь, являются мощными индукторами ангиогенеза и пролиферации очага поражения [29].
Предыдущие исследования показали, что микробиота кишечника может влиять на системный уровень эстрогена [11]. Частично метаболизированный эстроген выводится с желчью и в конечном итоге попадает в кишечник. Микрофлора кишечника играет важную роль в реабсорбции активных гормонов ферментативными и другими путями [16]. В своей работе М. Leonardi с соавт. указывают, что ряд бактерий, продуцируя β-глюкуронидазу и β-глюкозидазу, способствуют распаду эстрогена, усиливая реабсорбцию его свободной формы и повышая концентрацию указанного гормона в крови [30]. В нашем исследовании также отмечено, что численность бактерий родов Eubacterium hallii_group и Streptococcus положительно коррелирует с уровнем эстрогена у пациенток с НГЭ, что косвенно указывает на вовлеченность дисбиотических изменений кишечника в развитие эндометриоза.
Согласно данным имеющихся публикаций, микрофлора кишечника способна вступать в метаболические взаимодействия с цитокинами, секретируемыми в эндометриоидных очагах, периферической крови и перитонеальной жидкости [31]. Показано, что связь между кишечной микробиотой и цитокиновым профилем – двусторонний процесс, точные механизмы которого нуждаются в дополнительном изучении. Между тем J. Cai с соавт. отмечают, что повышенная проницаемость кишечника и выход продуктов метаболизма бактерий может способствовать изменениям функциональной активности макрофагов в брюшной полости [32]. Кроме того, перитонеальные макрофаги способны усиливать секрецию провоспалительных цитокинов при стимуляции липополисахаридами, опосредуя развитие воспалительной инфильтрации, пролиферации и неоангиогенеза, наблюдаемых при НГЭ [33].
Результаты нашего исследования показали, что уровень TNF-α у пациенток с НГЭ был повышен, а также значимо отрицательно коррелировал с обилием Streptococcus и Lachnospira и имел положительную связь с численностью рода Bifidobacterium. Также установлена статистически значимая корреляция между концентрацией сывороточного IL-8 и представленностью Streptococcus. Выявленные взаимосвязи указывают на тесную связь кишечного дисбиоза с сигнальным путем RIG-I-подобного рецептора (англ. RIG-I-like receptor, RLR). Этот путь после активации может инициировать транскрипцию генов-мишеней ядерного фактора NF-kB (англ. nuclear factor kappa-light-chain-enhancer of activated B cells), включая те, которые связаны с воспалительной реакцией (IL-6, IL-8 и TNFα) [34][35].
Таким образом, представленные результаты текущего исследования подтверждают важное значение микробиоты кишечника в патофизиологии НГЭ.
Заключение / Conclusion
Установлена связь дисбиотических изменений кишечника с развитием эндометриоза. Выявленные корреляции нарушений таксономического состава кишечной микрофлоры с показателями гормонального и иммунного статуса у пациенток с НГЭ указывают на вовлеченность микробиоты кишечника в патофизиологию эндометриоза. Имеющаяся фрагментарность знаний по данному вопросу указывает на актуальность продолжения исследований в направлении установления потенциальных механизмов влияния микробиоты кишечника на нейро-гуморально-иммунную ось у пациенток с НГЭ.
Список литературы
1. Клинические рекомендации - Эндометриоз - 2020 (02.11.2020). М.: Министерство здравоохранения Российской Федерации, 2020. 32 с. Режим доступа: http://disuria.ru/_ld/10/1002_kr20N80mz.pdf. [Дата обращения: 20.05.2024].
2. Taylor H.S., Giudice L.C., Lessey B.A. et al. Treatment of endometriosis-associated pain with elagolix, an oral GnRH antagonist. N Engl J Med. 2017;377(1):28-40. https://doi.org/10.1056/NEJMoa1700089.
3. Bao C., Wang H., Fang H. Genomic evidence supports the recognition of endometriosis as an Inflammatory systemic disease and reveals disease-specific therapeutic potentials of targeting neutrophil degranulation. Front Immunol. 2022;13:758440. https://doi.org/10.3389/fimmu.2022.758440.
4. Greene R., Stratton P., Cleary S.D. et al. Diagnostic experience among 4,334 women reporting surgically diagnosed endometriosis. Fertil Steril. 2009;91(1):32-9. https://doi.org/10.1016/j.fertnstert.2007.11.020.
5. Greenbaum H., Galper B.L., Decter D.H., Eisenberg V.H. Endometriosis and autoimmunity: Can autoantibodies be used as a non-invasive early diagnostic tool? Autoimmun Rev. 2021;20(5):102795. https://doi.org/10.1016/j.autrev.2021.102795.
6. Chen P., Wang D.B., Liang Y.M. Evaluation of estrogen in endometriosis patients: regulation of GATA-3 in endometrial cells and effects on Th2 cytokines. J Obstet Gynaecol Res. 2016;42(6):669-77. https://doi.org/10.1111/jog.12957.
7. Tokushige N., Markham R., Russell P., Fraser I.S. Nerve fibres in peritoneal endometriosis. Hum Reprod. 2006;21(11):3001-7. https://doi.org/10.1093/humrep/del260.
8. Olkowska-Truchanowicz J., Bocian K., Maksym R.B. et al. CD4+ CD25+ FOXP3+ regulatory T cells in peripheral blood and peritoneal fluid of patients with endometriosis. Hum Reprod. 2013;28(1):119-24. https://doi.org/10.1093/humrep/des346.
9. Podgaec S., Barbeiro D.F., Gueuvoghlanian-Silva B.Y. et al. Foxp3 expression in deep rectosigmoid endometriosis lesions and its association with chronic pelvic pain. J Reprod Immunol. 2014;104-105:96-9. https://doi.org/10.1016/j.jri.2014.05.002.
10. Khan K.N., Kitajima M., Imamura T. et al. Toll-like receptor 4-mediated growth of endometriosis by human heat-shock protein 70. Hum Reprod. 2008;23(10):2210-9. https://doi.org/10.1093/humrep/den195.
11. Flores R., Shi J., Fuhrman B. et al. Fecal microbial determinants of fecal and systemic estrogens and estrogen metabolites: a cross-sectional study. J Transl Med. 2012;10(1):253. https://doi.org/10.1186/1479-5876-10-253.
12. Chadchan S.B., Popli P., Ambati C.R. et al. Gut microbiota-derived short-chain fatty acids protect against the progression of endometriosis. Life Sci Alliance. 2021;30;4(12):e202101224. https://doi.org/10.26508/lsa.202101224.
13. Bolger A.M., Lohse M., Usadel B. Trimmomatic: a flexible trimmer for Illumina sequence data. Bioinformatics, 2014;30(15):2114-20. https://doi.org/10.1093/bioinformatics/btu170.
14. Caporaso J.G., Kuczynski J., Stombaugh J. et al. QIIME allows analysis of high-throughput community sequencing data. Nat Methods. 2010;7(5):335-6. https://doi.org/10.1038/nmeth.f.303.
15. Vallejo V., Ilagan J.G. A postpartum death due to coronavirus disease 2019 (COVID-19) in the United States. Obstet Gynecol. 2020;136(1):52-5. https://doi.org/10.1097/AOG.0000000000003950.
16. Svensson A, Brunkwall L., Roth B. et al. Associations between endometriosis and gut microbiota. Reprod Sci. 2021;28(8):2367-77. https://doi.org/10.1007/s43032-021-00506-5.
17. Shan J., Ni Z., Cheng W. et al. Gut microbiota imbalance and its correlations with hormone and inflammatory factors in patients with stage 3/4 endometriosis. Arch Gynecol Obstet. 2021;304(5):1363-73. https://doi.org/10.1007/s00404-021-06057-z.
18. Cani P.D., Possemiers S., Van de Wiele T. et al. Changes in gut microbiota control inflammation in obese mice through a mechanism involving GLP-2-driven improvement of gut permeability. Gut. 2009;58(8):1091- 103. https://doi.org/10.1136/gut.2008.16588.
19. Sohail M.U., Elrayess M.A., Al Thani A.A. et al. Profiling the oral microbiome and plasma biochemistry of obese hyperglycemic subjects in Qatar. Microorganisms. 2019;7(12):645. https://doi.org/10.3390/microorganisms7120645.
20. Yang M., Bose S., Lim S.K., Kim H. Preventive effects of Pyungwi-san against dextran sulfate sodium- and Clostridium difficile-induced inflammatory bowel disease in mice. Int J Mol Sci. 2019;20(24):6346. https://doi.org/10.3390/ijms20246346.
21. Yuan M., Li D., Zhang Z. et al. Endometriosis induces gut microbiota alterations in mice. Hum Reprod. 2018;33(4):607-16. https://doi.org/10.1093/humrep/dex372.
22. Ni Z., Sun S., Bi Y. et al. Correlation of fecal metabolomics and gut microbiota in mice with endometriosis. Am J Reprod Immunol. 2020;84(6):e13307. https://doi.org/10.1111/aji.13307.
23. Huang L., Liu B., Liu Z. et al. Gut microbiota exceeds cervical microbiota for early diagnosis of endometriosis. Front Cell Infect Microbiol. 2021;11:788836. https://doi.org/10.3389/fcimb.2021.788836.
24. Ata B., Yildiz S., Turkgeldi E. et al. The endobiota study: comparison of vaginal, cervical and gut microbiota between women with stage 3/4 endometriosis and healthy controls. Sci Rep. 2019;9(1):2204. https://doi.org/10.1038/s41598-019-39700-6.
25. Biarc J., Nguyen I.S., Pini A. et al. Carcinogenic properties of proteins with pro-inflammatory activity from Streptococcus infantarius (formerly S. bovis). Carcinogenesis. 2009;25(8):1477-84. https://doi.org/10.1093/carcin/bgh091.
26. Abdulamir A.S., Hafidh R.R., Bakar F.A. Molecular detection, quantification, and isolation of Streptococcus gallolyticus bacteria colonizing colorectal tumors: inflammation-driven potential of carcinogenesis via IL-1, COX-2, and IL-8. Mol Cancer. 2010;9:249. https://doi.org/10.1186/1476-4598-9-249.
27. Chantalat E., Valera M.C., Vaysse C. et al. Estrogen receptors and endometriosis. Int J Mol Sci. 2020;21(8):2815. https://doi.org/10.3390/ijms21082815.
28. Burns K.A., Thomas S.Y., Hamilton K.J. et al. Early endometriosis in females is directed by immune-mediated estrogen receptor alpha and IL-6 cross-talk. Endocrinology. 2018;159(1):103-118.https://doi.org/10.1210/en.2017-00562.
29. Symons L.K., Miller J.E., Kay V.R. et al. The immunopathophysiology of endometriosis. Trends Mol Med. 2018;24(9):748-62. https://doi.org/10.1016/j.molmed.2018.07.004.
30. Leonardi M., Hicks C., El-Assaad F. et al. Endometriosis and the microbiome: a systematic review. BJOG. 2020;127(2):239-49. https://doi.org/10.1111/1471-0528.15916.
31. Quaranta G., Sanguinetti M., Masucci L. Fecal microbiota transplantation: a potential tool for treatment of human female reproductive tract diseases. Front Immunol. 2019;10:2653. https://doi.org/10.3389/fimmu.2019.02653.
32. Cai J., Sun L., Gonzalez F.J. Gut microbiota-derived bile acids in intestinal immunity, inflammation, and tumorigenesis. Cell Host Microbe. 2022;30(3):289-300. https://doi.org/10.1016/j.chom.2022.02.004.
33. Ni Z., Ding J., Zhao Q. et al. Alpha-linolenic acid regulates the gut microbiota and the inflammatory environment in a mouse model of endometriosis. Am J Reprod Immunol. 2021;86(4):e13471. https://doi.org/10.1111/aji.13471.
34. Belkaid Y., Hand T.W. Role of the microbiota in immunity and inflammation. Cell. 2014;157(1):121-41. https://doi.org/10.1016/j.cell.2014.03.011.
35. Tao X., Xie Y., Wang L. et al. The expression of Cox-2, NF-kappaB, and VEGF in ectopic endometrial tissues within fallopian tubes suggests different etiologies. Int J Gynecol Pathol. 2014;33(4):411-7. https://doi.org/10.1097/PGP.000000000000008.
Об авторах
У. Д. БельченкоРоссия
Бельченко Ульяна Дмитриевна – студент 6-го курса 1-го Медицинского факультета Ордена Трудового Красного Знамени Медицинского института имени С.И. Георгиевского.
117997 Москва, ул. Академика Опарина, д. 4
Э. Э. Якубова
Россия
Якубова Эдие Эскендеровна – студент 6-го курса 1-го Медицинского факультета Ордена Трудового Красного Знамени Медицинского института имени С.И. Георгиевского.
117997 Москва, ул. Академика Опарина, д. 4
Т. С. Попович
Россия
Попович Татьяна Сергеевна – студент 6-го курса 1-го Медицинского факультета Ордена Трудового Красного Знамени Медицинского института имени С.И. Георгиевского.
117997 Москва, ул. Академика Опарина, д. 4
Э. Л. Агаева
Россия
Агаева Эльвира Ленуровна – студент 6-го курса 1-го Медицинского факультета Ордена Трудового Красного Знамени Медицинского института имени С.И. Георгиевского.
117997 Москва, ул. Академика Опарина, д. 4
Э. З. Каялиева
Россия
Каялиева Эльмаз Зевжетовна – студент 6-го курса 2-го Медицинского факультета Ордена Трудового Красного Знамени Медицинского института имени С.И. Георгиевского.
117997 Москва, ул. Академика Опарина, д. 4
Э.-С. Ш. Худайбердиев
Россия
Худайбердиев Эльм-Султан Шарабдинович – студент 5-го курса 1-го Медицинского факультета Ордена Трудового Красного Знамени Медицинского института имени С.И. Георгиевского.
117997 Москва, ул. Академика Опарина, д. 4
Я. Р. Ли
Россия
Ли Ян Радионович – студент 6-го курса 1-го Медицинского факультета Ордена Трудового Красного Знамени Медицинского института имени С.И. Георгиевского.
117997 Москва, ул. Академика Опарина, д. 4
С. Р. Гасанов
Россия
Гасанов Сархан Рафаил оглы – студент 6-го курса 1-го Медицинского факультета Ордена Трудового Красного Знамени Медицинского института имени С.И. Георгиевского.
117997 Москва, ул. Академика Опарина, д. 4
Н. И. Передеренко
Россия
Передеренко Никита Игоревич – студент 6-го курса 1-го Медицинского факультета Ордена Трудового Красного Знамени Медицинского института имени С.И. Георгиевского.
117997 Москва, ул. Академика Опарина, д. 4
Э. Ш. Кадыров
Россия
Кадыров Эрвин Шевкетович – студент 6-го курса 1-го Медицинского факультета Ордена Трудового Красного Знамени Медицинского института имени С.И. Георгиевского.
117997 Москва, ул. Академика Опарина, д. 4
К. В. Новиков
Россия
Новиков Кирилл Васильевич – студент 6-го курса 1-го Медицинского факультета Ордена Трудового Красного Знамени Медицинского института имени С.И. Георгиевского.
117997 Москва, ул. Академика Опарина, д. 4
Е. А. Остожьев
Россия
Остожьев Евгений Александрович – студент 6-го курса 1-го Медицинского факультета Ордена Трудового Красного Знамени Медицинского института имени С.И. Георгиевского.
117997 Москва, ул. Академика Опарина, д. 4
Н. С. Прасолов
Россия
Прасолов Никита Сергеевич – студент 6-го курса 2-го Медицинского факультета Ордена Трудового Красного Знамени Медицинского института имени С.И. Георгиевского.
117997 Москва, ул. Академика Опарина, д. 4
Л. Е. Сорокина
Россия
Сорокина Лея Евгеньевна – младший научный сотрудник лаборатории цитологии; врач аллерголог-иммунолог.
117997 Москва, ул. Академика Опарина, д. 4; 115533 Москва, ул. Высокая, д. 19, корп. 2
Что уже известно об этой теме?
► Наружный генитальный эндометриоз (НГЭ) представляет собой иммунновоспалительный эстрогензависимый патологический процесс.
► Имеются данные о связи дисбиоза кишечника с нарушением метаболизма эстрогенов, дисбалансом систем врожденного и адаптивного иммунитета и формированием хронического воспаления при ряде патологий.
► Ранее проведенные исследования предоставляют убедительные доказательства изменений кишечного биоценоза при развитии НГЭ.
Что нового дает статья?
► Показано, что для пациенток с НГЭ по сравнению со здоровыми женщинами характерно более низкое бактериальное α-разнообразие.
► Уточнен характер таксономического состава микробиоты кишечника у пациенток с НГЭ на уровне фил и родов.
► Установлены статистически значимые корреляции некоторых родов бактерий с системными уровнями эстрогена и провоспалительных цитокинов.
Как это может повлиять на клиническую практику в обозримом будущем?
► Доказана роль дисбиоза кишечника как значимого фактора в патогенезе НГЭ.
► Прицельное воздействие на микробиоту кишечника может способствовать повышению эффективности терапевтических подходов в лечении НГЭ.
Рецензия
Для цитирования:
Бельченко У.Д., Якубова Э.Э., Попович Т.С., Агаева Э.Л., Каялиева Э.З., Худайбердиев Э.Ш., Ли Я.Р., Гасанов С.Р., Передеренко Н.И., Кадыров Э.Ш., Новиков К.В., Остожьев Е.А., Прасолов Н.С., Сорокина Л.Е. Изучение особенностей таксономического состава микробиоты кишечника и их связи с гормональным и иммунным статусом у женщин с наружным генитальным эндометриозом. Акушерство, Гинекология и Репродукция. 2024;18(4):464-474. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.534
For citation:
Belchenko U.D., Yakubova E.E., Popovich T.S., Agaeva E.L., Kayalieva E.Z., Khudaiberdiev E.Sh., Li Y.R., Gasanov S.R., Perederenko N.I., Kadyrov E.Sh., Novikov K.V., Ostozhiev E.A., Prasolov N.S., Sorokina L.E. Features of intestinal microbiota taxonomic composition and their relation with hormonal and immune status assessed in women with external genital endometriosis. Obstetrics, Gynecology and Reproduction. 2024;18(4):464-474. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.534

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































