Перейти к:
Модификаторы хроматина в патогенезе эндометриоза
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.524
Аннотация
Введение. Исследования показали, что различные эпигенетические аномалии могут играть важную роль в патогенезе эндометриоза. Регуляция структуры хроматина осуществляется главным образом модификаторами хроматина (МХ), которые стимулируют формирование областей генома с различными функциональными структурами и таким образом изменяют паттерны или уровни экспрессии генов, выполняя соответствующие биологические функции и вызывая эпигенетические изменения.
Цель: рассмотреть роль МХ в патогенезе эндометриоза и механизм их регуляции на основании данных современной литературы.
Материалы и методы. Поиск проводился в базах данных PubMed, Scopus, Web of Science, Google Scholar и eLibrary. Были использованы ключевые слова и словосочетания на русском и английском языках, связанные с темой исследования, такие как «эндометриоз», «модификаторы хроматина», «ацетилирование гистонов», «метилирование ДНК», «микроРНК», «endometriosis», «chromatin modifiers», «histone acetylation», «DNA methylation», «microRNA». Оценка статей проводилась в соответствии с рекомендациями PRISMA.
Результаты. Модификаторы хроматина контролируют процессы дифференцировки, роста и развития, старения и гибели клеток, взаимодействуя с различными функциональными элементами хроматина. Они могут вызывать аномальную экспрессию генов, регулируя структуру хроматина, что влияет на возникновение и развитие эндометриоза. Метилирование ДНК определяет типы клеток, контролирует экспрессию генов и стабильность генома. Аномальное метилирование ДНК промоторных участков генов, необходимых для нормальной реакции эндометрия, влияет на развитие эндометриоза. Ингибиторы ДНК-метилтрансфераз (англ. DNA methyltransferase, DNMT) снижают уровень метилирования генов человеческого гомеобокса A10 (англ. homeobox A10, HOXA10) и рецептора прогестерона (англ. progesterone receptor, PR) и усиливают их экспрессию в клетках эндометрия, улучшая восприимчивость эндометрия и ингибируя прогрессирование клеточного цикла. Аномальные модификации гистонов в клетках эндометрия могут способствовать или препятствовать доступу транскрипционных механизмов к хроматиновой ДНК. Ингибиторы гистондеацетилазы эффективно устраняют последствия аномальных модификаций гистонов в эндометриозных клетках и препятствуют прогрессированию эндометриоза. Экспрессия некодирующих РНК и комплексов ремоделирования хроматина также вызывает изменения в структуре хроматина, участвует в возникновении эндометриоза и связана с бесплодием, поскольку способствует пролиферации, инвазии и миграции эндометриоидных клеток.
Заключение. Модификаторы хроматина играют ключевую роль в развитии эндометриоза, контролируя экспрессию генов и структуру хроматина. Понимание этих механизмов предоставляет ценную информацию для диагностики и разработки новых подходов к лечению эндометриоза.
Ключевые слова
Для цитирования:
Абаева К.А., Муртазова Р.Т., Ваниев И.А., Лазарова А.В., Созаева А.А., Гогичаева М.А., Пирожникова А.А., Игнашев К.В., Дадашов М.С., Колесникова Д.В., Байрамова А.А., Кучерская В.Е., Зульфалиева Л.Д., Зайцева А.М. Модификаторы хроматина в патогенезе эндометриоза. Акушерство, Гинекология и Репродукция. 2024;18(4):525-539. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.524
For citation:
Abaeva K.A., Murtazova R.T., Vaniev I.A., Lazarova A.V., Sozaeva A.A., Gogichaeva M.A., Pirozhnikova A.A., Ignashev K.V., Dadashov M.S., Kolesnikova D.V., Bayramova A.A., Kucherskaya V.E., Zulfalieva L.D., Zaitseva A.M. Chromatin modifiers in endometriosis pathogenesis. Obstetrics, Gynecology and Reproduction. 2024;18(4):525-539. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.524
Введение / Introduction
Эндометриоз – это хроническое гормонозависимое заболевание, при котором ткань, подобная эндометрию, разрастается за пределами матки. Оно характеризуется повышением образования эстрогенов на локальном уровне и резистентностью к эффектам прогестерона [1]. Эндометриоз является не только медицинской, но и социальной и экономической проблемой. Это связано с тем, что заболевание часто сопровождается сопутствующей патологией, такой как бесплодие, хронические тазовые боли, нарушения менструального цикла и др. [2]. Всё это приводит к снижению качества жизни пациенток и увеличению расходов на лечение. Заболеваемость эндометриозом растёт во всём мире, и Российская Федерация не является исключением. По разным оценкам, от эндометриоза страдают от 10 до 15 % женщин репродуктивного возраста и 35–50 % женщин с тазовой болью и/или бесплодием. Пик этого заболевания приходится на период от 25 до 45 лет. Тем не менее есть случаи, когда эндометриоз можно обнаружить до менархе и после менопаузы [2][3]. Клиническая диагностика эндометриоза очень сложна. Наиболее распространенными симптомами являются дисменорея, глубокая тазовая боль, дисхезия и дизурия. Согласно имеющимся данным, средняя задержка диагностики от появления симптомов до постановки окончательного диагноза составляет 7 лет [4]. Современные методы лечения эндометриоза зависят от первичных показаний, таких как бесплодие или тазовая боль. Эти методы включают хирургическое вмешательство, гормональную терапию и применение анальгетиков [5]. Однако все эти методы имеют ряд побочных эффектов и редко обеспечивают долгосрочный эффект. Поэтому поиск новых эффективных и безопасных методов лечения эндометриоза остается актуальной задачей современной медицины. Кроме того, эндометриоз связан с повышением риска развития эпителиального рака яичников на 50 % [6].
Наиболее распространённой теорией патогенеза эндометриоза является имплантация и рост фрагментов эндометрия и жизнеспособных клеток вне матки во время ретроградной менструации. Однако эта теория не может полностью объяснить возникновение заболевания, поскольку ретроградная менструация встречается примерно у 90 % женщин, а эндометриоз диагностируется только у 10–15 % из них [7]. Исследования показали, что эндометриоз обладает многофакторным генетическим потенциалом, и различные эпигенетические аномалии могут играть важную роль в его патогенезе [8]. Это указывает на необходимость дальнейшего изучения механизмов развития заболевания. Так, у женщин с эндометриозом обнаружена мутация в белке, реконструирующем хроматин (англ. AT-rich interactive domain-containing protein 1A, ARID1A). Этот белок играет ключевую роль в регуляции структуры хроматина в месте связывания фактора транскрипции AP-1 (англ. activating protein-1). Он способствует экспрессии субъединицы junB белка AP-1, что усиливает инвазивную способность эндометриоидной ткани [9].
В эукариотических клетках генетический материал чаще всего присутствует в виде хроматина. Хроматин состоит в основном из ДНК и гистонов, а также небольшого количества негистоновых белков и РНК. Регуляция структуры хроматина осуществляется главным образом модификаторами хроматина (МХ), которые являются важными регуляторными факторами в эпигенетике, влияющими на репликацию и передачу генетического материала в клетках [10]. МХ представляют собой белковые комплексы, которые модулируют изменения структуры хроматина и обычно делятся на 3 категории: соединения для метилирования ДНК, соединения для модификации гистонов и комплексы для ремоделирования хроматина. Другим фактором, влияющим на изменение структуры хроматина, является некодирующая РНК, особый тип регулятора хроматина. Таким образом, МХ регулируют изменения структуры хроматина, стимулируя формирование областей генома с различными функциональными структурами и, таким образом, изменяя паттерны или уровни экспрессии генов, выполняя соответствующие биологические функции и вызывая эпигенетические изменения [11][12].
Цель: рассмотреть роль МХ в патогенезе эндометриоза и механизм их регуляции на основании данных современной литературы.
Материалы и методы / Materials and Methods
Поиск проводился в базах данных PubMed, Scopus, Web of Science, Google Scholar и eLibrary. Были использованы ключевые слова и словосочетания на русском и английском языках, связанные с темой исследования, такие как «эндометриоз», «модификаторы хроматина», «ацетилирование гистонов», «метилирование ДНК», «микроРНК», «endometriosis», «chromatin modifiers», «histone acetylation», «DNA methylation», «microRNA». Поиск проводился во временном интервале с января 2004 г. по март 2024 г. Оценка статей проводилась в соответствии с рекомендациями PRISMA.
Критериями включения явились: оригинальные научные статьи и обзоры, опубликованные в рецензируемых научных изданиях, содержащие вышеуказанные ключевые слова; исследования, опубликованные на русском или английском языках; оригинальные статьи, оценивающие роль одного или нескольких МХ в патогенезе эндометриоза; обзоры литературы, содержащие значимые сведения для раскрытия темы настоящего обзора. На этапах идентификации и скрининга исключались публикации, не соответствующие теме, а также тезисы конференций, дубликаты, не полнотекстовые версии статей и нерецензируемые источники. Подробный алгоритм и количество включенных/исключенных исследований представлены на рисунке 1. В конечном итоге в настоящий обзор было включено 76 первоисточников.
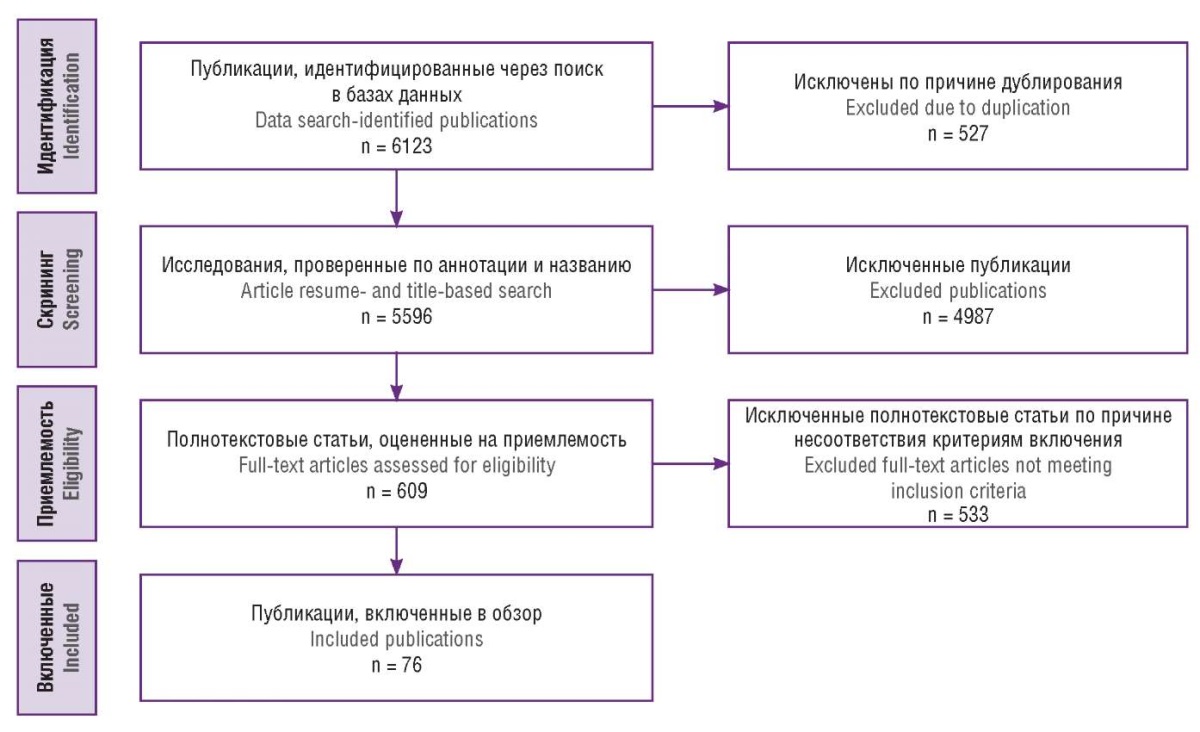
Рисунок 1. Алгоритм поиска исследований.
Figure 1. Study search algorithm.
Результаты анализа были обобщены. Были выделены основные тенденции и направления исследований, а также определены пробелы и перспективы дальнейшего изучения роли МХ в патогенезе эндометриоза.
Результаты / Results
Влияние характера метилирования ДНК на транскрипционную активность генома / DNA methylation pattern affects genome transcriptional activity
Характер метилирования ДНК может влиять на транскрипционную активность определенных участков генома. Метилирование ДНК распространено в CpG-островках – областях, богатых CG-динуклеотидами, и сосредоточено в основном в гетерохроматических областях [13]. Метилирование ДНК – это процесс, при котором к цепочке ДНК ковалентно присоединяется метильная группа, что позволяет корректировать паттерны метилирования геномной ДНК и изменять структуру хроматина. Инициация и поддержание метилирования CpG зависит от ферментов ДНК-метилтрансфераз (англ. DNA methyltransferases, DNMTs). Соединения для метилирования ДНК могут модифицировать различные аминокислоты в цитозине, предотвращая связывание регуляторных факторов с ДНК [14].
Исследования в области деметилирования ДНК ограничены. TET1 (англ. ten-eleven-translocation 1) – это недавно открытый белок, который играет ключевую роль в процессе деметилирования ДНК. Он обладает ферментативной активностью и способен гидроксилировать 5-метилцитозин (5mC), превращая его в 5-гидроксиметилцитозин (5hmC). Этот процесс может использоваться для гидролиза метильной группы тимина [15]. Чем выше степень метилирования, тем плотнее конденсация хроматина и тем ниже транскрипционная активность ДНК. Аномальное метилирование ДНК связано со многими заболеваниями. Во многих исследованиях было показано, что соединения, которые метилируют ДНК, могут влиять на возникновение и развитие эндометриоза, регулируя уровни метилирования в промоторах генома.
Метилирование ДНК / DNA methylation
При эндометриозе были обнаружены различные уровни метилирования ДНК [16]. Исследования показали, что уровни экспрессии ДНК-метилтрансфераз (DNMT1, DNMT3A, DNMT3B) и метил-CpG-связывающий домен белка 2 (англ. methyl-CpG binding domain protein 2, MBD2) значительно снижены в очагах эндометриоза и карциномы эндометрия in situ. MBD2 связывается с DNMT1 и DNMT3A, а экспрессия MBD2 положительно коррелирует с DNMT3A, что может привлекать их к определенным CpG-сайтам (метилированным промоторам) для стимулирования метилирования [17]. Они также взаимодействуют для поддержания паттерна метилирования CpG, тем самым стимулируя сигнальный путь митоген-активируемой протеинкиназы (англ. mitogen-activated protein kinase, MAPK), который индуцирует фосфорилирование целевого белка, активируя нижележащие молекулы и индуцируя пролиферацию клеток, а также повышая активацию сигнализации и дифференциальную экспрессию в эндометриозной ткани [18]. Многочисленные исследования показали, что ингибиторы ДНК-метилтрансферазы могут подавлять рост опухолевых клеток, и в клинической практике используются таргетные препараты против DNMTs [13]. Аномальная экспрессия DNMTs при эндометриозе позволяет предположить, что эти ферменты могут стать новой терапевтической мишенью. Некоторые факторы регуляции хроматина ещё предстоит обнаружить. Однако в промоторных областях некоторых генов, участвующих в возникновении эндометриоза, были обнаружены изменения в метилировании. C. Baumann с соавт. выявили, что в промоторной области белка аргининметилтрансферазы 8 (англ. protein arginine methyltransferase, PRMT8) повышен уровень метилирования ДНК. Это снижает уровень транскрипции PRMT8 и нарушает экспрессию генов, регулируемых эстрогенами, что опосредовано овариальным белком аргининметилтрансферазы (PRMT). В результате ухудшается качество и функция яйцеклеток, что приводит к бесплодию, ассоциированному с эндометриозом [19]. Также было обнаружено, что снижение экспрессии белка PRDM8 (англ. PR/SET domain 8) связано со многими факторами, которые способствуют малигнизации эндометриоза, а также участвуют в развитии и метастазировании рака эндометрия [20], что может указывать на потенциальную связь между PRDM8 и злокачественной трансформацией эндометриоза. Кроме того, было обнаружено снижение уровня метилирования ДНК в промоторной области глутатион-S-трансферазы М1 (англ. glutathione S-transferase M1, GSTM1), что приводит к увеличению экспрессии белка GSTM1 в цитоплазме и ядре эндометрия и ортотопических железистых эпителиальных клетках эндометрия. Повышенная экспрессия белка GSTM1 участвует в патогенезе эндометриоза путем ингибирования пути апоптоза в клетках эндометрия [21]. Эти данные свидетельствуют о том, что эпигенетическая активация слабо метилированной промоторной области GSTM1 может быть связана с повышенным риском развития эндометриоза, и предоставляют новые доказательства в поддержку мнения о том, что эндометриоз может быть эпигенетическим заболеванием.
Кроме того, аномальное метилирование ДНК влияет на экспрессию гена гомеобокса 10A (англ. homeobox 10A, HOXA10) [22]. У женщин с эндометриозом уровень метилирования промотора гена HOXA10 в эндометрии выше, чем у здоровых женщин, что снижает экспресиию белка HOXA10 и приводит к нарушению восприимчивости эндометрия, инвазивности клеток эндометрия и резистентности к прогестерону [23]. Исследования последних лет показали, что 5-аза-2’-дезоксицитидин (AzadC) действует как ингибитор ДНК-метилтрансферазы. Повышая экспрессию HOXA10, AzadC может улучшить восприимчивость эндометрия [24]. Это позволяет предположить, что в будущем AzadC может стать новым методом лечения бесплодия, связанного с эндометриозом. Эти результаты показывают, что изучение факторов регуляции хроматина имеет большое значение.
Важно отметить, что эндометрий очень чувствителен к стероидным гормонам, синтезируемым яичниками. Как эндометриозные, так и нормальные ткани эндометрия претерпевают циклические изменения в уровнях циркулирующих стероидных гормонов, таких как эстроген (Е2) и прогестерон (Р4), вырабатываемых яичником. Исследования показали, что эти стероидные гормоны оказывают воздействие путем связывания с соответствующими им ядерными рецепторами (англ. nuclear receptor, NR) [25]. Среди NR рецепторы эстрогена (англ. estrogen receptors, ER) и прогестерона (англ. progesterone receptor, PR) могут опосредовать экспрессию генов путем привлечения коактиваторов ядерного рецептора (англ. nuclear receptor coactivator, NCOA). Метилирование ДНК NCOA1 повышает уровень мРНК NCOA1 в период секреции, увеличивает экспрессию белка NCOA1, влияет на функциональную активность PR через путь NCOA, способствует развитию резистентности к прогестерону при эндометриозе и вызывает различные нарушения репродуктивной функции, такие как нарушения овуляции и менструации [26]. Более того, по сравнению с нормальными стромальными клетками эндометрия, снижение уровней метилирования ДНК, вызванное вышеупомянутыми ДНК-метилтрансферазами DNMT1, DNMT3A и DNMT, приводит к тому, что стромальные эндометриоидные клетки демонстрируют высокую экспрессию ER2 и низкую экспрессию ER1 [27]. После образования очагов поражения эстроген, благодаря повышенной экспрессии ER2 и провоспалительных факторов, усиливает воспаление и способствует выживанию эктопических эндометриальных клеток [28]. Кроме того, у большинства пациенток процент метилирования гена рецептора прогестерона B (англ. progesterone receptor B, PGR-B) достигает 50 %, что приводит к снижению его экспрессии и нарушению рецептивности эндометрия у пациенток с эндометриозом [29]. Более того, метилирование промотора PGR-B способствует повышению устойчивости эндометриоидной ткани к действию P4, что приводит к усилению реакции на эстрогены и стимулирует пролиферацию эктопического и эутопического эндометрия. Это также повышает инвазивную способность клеток и способствует развитию эндометриоза малого таза и клеточных изменений, делая их более агрессивными [30]. Измененные паттерны метилирования NR предоставляют ценную информацию для дальнейшего понимания роли гормональных рецепторов в эпигенетическом механизме этиологии эндометриоза.
Деметилирование ДНК / DNA demethylation
При эндометриозе представители семейства TET (англ. ten-eleven-translocation) окисляют 5mC до 5hmC, 5-формилцитозина и 5-карбоксилцитозина, удаляя метильную группу из 5mC и обеспечивая более стабильную конформацию [31][32]. У пациенток с эндометриозом экспрессия гена TET1 в менструальном цикле ниже в период секреции, чем в период пролиферации. Это приводит к изменению уровней метилирования ДНК при эндометриозе, что может быть причиной аномальной имплантации эмбриона у пациенток с эндометриозом, страдающих бесплодием [33]. Экспериментальные исследования in vitro показали, что уровни транскриптов TET1 и TET2 были значительно снижены в эндометриоидной ткани. Это могло повлиять на деградацию интерстициальных фибробластов эндометрия человека in vitro, что ещё раз указывает на связь между семейством TET и бесплодием при эндометриозе [34]. Снижение экспрессии TET-белков может быть одной из причин невынашивания беременности.
Влияние модификации гистонов на структуру хроматина и взаимосвязь с регуляторными факторами / Histone modification affects chromatin structure and interplay with regulatory factors
У эукариот нуклеосомы состоят из основного гистонового октамера (H2A, H2B, H3 и H4) с парами оснований ДНК, которые оборачиваются вокруг него [35]. Ферменты, модифицирующие гистоны, изменяют структуру хроматина и обеспечивают сайты связывания для регуляторных белков [36]. Метилирование и ацетилирование гистонов – это 2 типичные модификации нуклеосом, которые играют важную роль в регуляции структуры и функции хроматина [37]. Ковалентная модификация гистонов осуществляется такими ферментами, как гистондеацетилазы (англ. histone deacetylases, HDAC), гистонацетилтрансферазы (англ. histone acetyltransferase, HAT) и гистонметилтрансферазы (англ. histone methyltransferase, HMT). При эндометриозе были обнаружены как метилирование, так и ацетилирование гистонов. Понимание этих процессов может улучшить наши знания об эндометриозе.
Метилирование гистонов / Histone methylation
Метилирование гистонов играет ключевую роль в регуляции экспрессии генов, контролируя доступ транскрипционных механизмов к ДНК хроматина [38]. Одним из примеров является триметилированный 27 лизиновый остаток гистона H3 (H3K27me3), который является репрессивным признаком. Исследования показали, что уровень H3K27me3 статистически значимо выше в железистых клетках внематочных поражений у пациенток с эндометриозом по сравнению со здоровым эндометрием [39]. Именно поэтому было высказано предположение, что H3K27me3 может являться биологическим маркером эндометриоидной ткани. H3K27me3 может подавлять транскрипцию гена и снижать уровень PGR-B, что приводит к резистентности к прогестерону и препятствует децидуализации эндометрия [33]. Одним из белков, участвующих в метилировании гистонов, является энхансер гомолога Zeste 2 (англ. enhancer of zeste homolog 2, EZH2). Этот белок катализирует добавление трёх метильных групп к H3K27me3. Исследования показали, что эндометриальные эпителиальные клетки демонстрируют высокую экспрессию EZH2, которая регулируется прогестероном. Ингибирование гистонметилтрансферазы EZH2 может специфически снижать уровень H3K27me3 в эктопических клетках эндометрия и уменьшать их миграцию и пролиферацию, но не инвазию [40]. С другой стороны, диметилирование гистона 3 по остатку лизина 4 (H3K4me2) является признаком активной транскрипции. H3K4me2 обогащен промоторными участками интерлейкина (англ. interleukin, IL) IL-6 и фактора некроза опухоли-альфа (англ. tumor necrosis factor-alpha, TNF-α) в лейкоцитах, что способствует экспрессии и секреции IL-6 и TNF-α и воспалительному процессу [41]. Таким образом, и H3K27me3 и H3K4me2 играют очевидную роль в развитии эндометриоза. Терапевтическое воздействие на эти модификации гистонов может повысить эффективность целенаправленного лечения эндометриоза и облегчить связанные с ним симптомы.
Ацетилирование гистонов / Histone acetylation
Ацетилирование гистонов – это процесс, при котором ацетильные группы присоединяются к положительно заряженным областям гистонов. Это меняет структуру хроматина и регулирует экспрессию генов, делая гены доступными или недоступными для транскрипционных факторов [42]. J.B. Monteiro с соавт. обнаружили, что очаги эндометриоза были глобально гипоацетилированы в области H3 вблизи промотора HOXA10, что приводило к снижению транскрипции HOXA10. Промотор гена кадгерина 1-го типа (англ. cadherin-1, CDH1) был гипоацетилирован по обоим гистонам H3 и H4 наряду с высоким уровнем метилирования ДНК в промоторе CDH1, что ингибировало экспрессию CDH1 при эндометриозе. Промоторная область стероидогенного фактора 1 (англ. steroidogenic factor 1, SF-1) была специфически обогащена ацетилированием H3 и H4, что приводило к избыточной экспрессии ароматазы и местного эстрадиола [43]. Ацетилирование гистонов регулируется двумя наборами ферментов – HAT и HDAC, которые добавляют или удаляют ацетильные группы, соответственно, как из гистоновых, так и из других белков, регулируя тем самым транскрипцию генов. Как правило, ацетилирование уменьшает положительный заряд на хвостах гистонов, особенно на лизине, что ослабляет взаимодействие гистонов с отрицательно заряженным остовом ДНК. Это приводит к уменьшению плотности упаковки хроматина, делая гены более доступными для транскрипционных факторов. В результате ацетилирование способствует активации генов и увеличению их экспрессии [44]. И наоборот, деацетилирование гистонов приводит к закрытому состоянию хроматина, что делает гены менее доступными для транскрипционных факторов и таким образом способствует подавлению их экспрессии [45]. Ацетилирование гистонов и аномальные уровни гистондеацетилаз связаны с развитием эндометриоза. Фактор, связанный с P300/СВР (англ. P300/CBP-associated factor, PCAF), относится к типу A HAT и играет ключевую роль в этом процессе. Исследование показало, что мРНК PCAF была высоко экспрессирована в эктопическом эндометрии, что указывает на повышенную активность ацетилирования гистонов в этой области. В то же время уровни мРНК гистондеацетилазы 2 (HDAC2) были повышены в эутопическом эндометрии, что свидетельствует о дисрегуляции процессов ацетилирования и деацетилирования гистонов. Дисрегуляция HAT и HDAC может приводить к общему гипоацетилированию гистонов при эндометриозе, что способствует транскрипции генов, связанных с эктопическим ростом эндометрия. Это, в свою очередь, может приводить к аномальной пролиферации и ангиогенезу, характерным для эндометриоза [46][47]. Более того, исследования показали, что избыточная экспрессия HDAC2 при эндометриозе может ингибировать экспрессию ядерного фактора гепатоцитов альфа (англ. hepatocyte nuclear factor alpha, HNF-4α) путем деацетилирования, тем самым снижая уровень обогащения HNF4-α в промоторной области AT-обогащенного белка, содержащего интерактивный домен 1A (англ. AT-rich interactive domain-containing protein 1A, ARID1A), и подавляя экспрессию ARID1A. Напротив, подавление экспрессии HDAC2 может предотвратить развитие эндометриоза путем активации оси HNF-4α/ARID1A, уменьшения площади и массы эндометриозной ткани, ингибирования пролиферации эндометриозных клеток и ускорения апоптоза в эндометриоидных клетках [45][46]. У бесплодных женщин с эндометриозом количество белка HDAC3 в эктопическом эндометрии снижается, что приводит к нарушению имплантации и дефектам эндометрия, которые вызывают бесплодие из-за снижения экспрессии фактора транскрипции 1 (англ. specificity protein 1, SP1), который является основной мишенью прогестерона [47]. Кроме того, ингибирование экспрессии CCAAT-энхансер-связывающего белка (англ. CCAAT-enhancer-binding protein, C/EBP) посредством деацетилирования гистонов помогает стимулировать пролиферацию и предотвращать апоптоз в эндометриоидных клетках [48].
Исследования показали, что лечение ингибиторами гистондеацетилазы (англ. HDAC inhibitors, HDACis) может подавлять пролиферацию клеток в различных линиях раковых клеток и реактивировать транскрипцию отключенных генов; таким образом, HDACis являются потенциальными противоопухолевыми препаратами, которые могут быть использованы для лечения многих заболеваний [49]. В последние годы также изучалось применение HDACis при эндометриозе. HDACis способны усиливать внутриклеточный окислительный стресс, регулируя окислительно-восстановительное состояние тиоредоксина (англ. thioredoxin, TRX) и TRX-связывающего белка-2 (англ. thioredoxin binding protein-2, TBP-2) [50]. Они также могут ингибировать ацетилирование HDAC3 и HDAC4, что приводит к повышению уровней белков p16INK4a, P21 Waf1/Cip1, p27KIP1 и chk2. Кроме того, HDACis реактивируют E-кадгерин и повышают уровни ингибитора циклинзависимой киназы 1 (p21). Эти эффекты способствуют снижению роста и инвазивных свойств стромальных клеток эндометрия, вызывают остановку клеточного цикла и апоптоз в эндометриоидных стромальных клетках [51][52]. Таким образом, HDACis могут быть многообещающим и эффективным методом лечения эндометриоза, подавляя его развитие несколькими путями.
Роль модификаторов хроматина в перемещении нуклеосом и регуляции экспрессии генов / Chromatin modifiers in nucleosome movement and regulated gene expression
Ремоделирование хроматина – это молекулярный механизм, который регулирует уровни экспрессии генов на основе изменений в структуре хроматина. Этот процесс использует АТФ-зависимую энергию для изменения структуры нуклеосом. Гидролиз АТФ регулирует взаимодействие между белками и двухцепочечной ДНК, повышая доступность ДНК в хроматине [53]. Эукариотические клетки содержат 4 семейства комплексов, модулирующих хроматин, которые классифицируются на основе сходства и различий между субъединицами АТФазы: комплексы SWI/SNF (англ. SWItch/Sucrose Non-Fermentable), комплексы ISWI, комплексы CHD (англ. chromoshadow domain) и комплексы INO80 [54]. Среди описанных комплексов ремоделирования хроматина наиболее часто упоминается ARID1A. Ген ARID1A кодирует белок BAF250a, ключевой компонент мультибелкового комплекса ремоделирования хроматина SWI/SNF, присутствующего у всех эукариот [55]. О наличии комплексов ISWI, CHD и INO80 при эндометриозе пока не сообщалось. ARID1A представляет собой субъединицу комплекса переключателя/неферментируемого сахарозой комплекса ремоделирования хроматина массой 250 кДа, которая мутирует при раке молочной железы, раке легких и раке эндометрия, особенно при опухолях, связанных с эндометрием, таких как светлоклеточная карцинома яичников (англ. ovarian clear cell carcinoma, OCCC), эндометриоидная карцинома яичников и эндометриоидная карцинома [56][57]. В нормальном эндометрии ARID1A подавляет воспаление и поддерживает иммунный гомеостаз матки и ее нормальную функцию, однако при эндометриозе были обнаружены мутации ARID1A [56]. По имеющимся данным, потеря ARID1A при атипичном эндометриозе составляет 23,1 %, при этом потеря ARID1A при OCCC увеличивается до 42,3 %. Подавление ARID1A в иммортализованных клеточных линиях эндометриоза вызывает фенотипические изменения, связанные со злокачественной трансформацией. Это позволяет предположить, что аномальные изменения в экспрессии белка ARID1A на фоне атипичного эндометриоза могут привести к более высокому риску злокачественной трансформации [58]. Предполагается, что малигнизация эндометриоза является ранним событием, приводящим к OCCC. Потеря ARID1A также влияет на развитие желез, снижает экспрессию FOXA2 (англ. forkhead box protein A2) и фактора, ингибирующего лейкемию (англ. leukemia inhibitory factor, LIF), нарушает путь LIF-STAT3-EGR1 (англ. leukemia inhibitory factor-signal transducer and activator of transcription 3-early growth response 1), вызывает дефекты восприимчивости эндометрия и снижает нормальную физиологическую роль эндометрия в подавлении воспаления и поддержании иммунного гомеостаза матки [59]. Оценка инвазивной способности эндометриоза показала, что SERPINE1 (ингибитор активатора плазминогена-1; англ. plasminogen activator inhibitor-1, PAI-1) является важным геном-мишенью, который вызывает мутацию ARID1A, способствующую инвазии эндометрия [60]. ARID1A регулирует хроматин сайта, связывающего фактор транскрипции junB, и способствует экспрессии соответствующих генов эпителиально-мезенхимального перехода, включая факторы транскрипции SNAI1 и SNAI2, молекулы межклеточной адгезии (англ. intercellular adhesion molecule, ICAM-1) и адгезии сосудистого эндотелия 1-го типа (англ. vascular cell adhesion molecule 1, VCAM1), а также факторы ремоделирования внеклеточного матрикса LOX (англ. lysyl oxidase) и LOXL2 (англ. lysyl oxidase homolog 2), повышая, таким образом, инвазивную способность эндометрия [9]. Нокаут гена ARID1A у мышей приводит к потере сигнала эпителиального PR и бесплодию [61]. Эти результаты дают новое представление о сигнальных путях при эндометриозе и ещё больше углубляют наше понимание молекулярных механизмов, лежащих в основе нарушения регуляции передачи сигналов при эндометриозе. Они подчёркивают сложность и многогранность патогенеза этого заболевания, а также открывают новые возможности для разработки более эффективных методов диагностики и лечения.
Некодирующие РНК / Non-coding RNAs
Некодирующие РНК (англ. non-coding RNAs, ncRNAs) – это молекулы РНК, которые не служат матрицами для синтеза белков, но регулируют активность генов на разных этапах: от изменения структуры хроматина до трансляции. Такие РНК играют ключевую роль в нормальном развитии и функционировании организма, а их нарушение может привести к различным заболеваниям [62]. В последнее время учёные активно исследуют роль некодирующих РНК в развитии эндометриоза. Особое внимание исследователи уделяют двум типам таких РНК: длинным некодирующим РНК (англ. long non-coding RNA, lncRNA) и микроРНК [1][63].
Длинные некодирующие РНК / Long non-coding RNAs
Длинные некодирующие РНК – это молекулы РНК, длина которых превышает 200 нуклеотидов. Они не кодируют белки. В ядре клетки lncRNA связывается с хроматином и соединяет ДНК с белками, служит каркасом для модификации белковых комплексов. Она направляет их к определённым участкам генома, где они могут активировать или подавлять транскрипцию генов. Таким образом, lncRNA действует как регулятор транскрипции. Полногеномное секвенирование ДНК позволило выявить генетические варианты в генах lncRNA, которые могут играть роль в развитии эндометриоза. Один из примеров – lncRNA антисмысловая РНК транскрипта HOX (англ. HOX transcript antisense RNA, HOTAIR). Она активно экспрессируется в эктопической ткани эндометрия. HOTAIR участвует в регуляции пути miR-519b-3p/PRRG4 (англ. proline rich and gla domain 4), что способствует инвазии и миграции стромальных клеток эндометрия. Это приводит к развитию воспаления и ангиогенеза. Также HOTAIR регулирует ось miR-761/HDAC1 и активирует STAT3-опосредованные воспалительные реакции как in vivo, так и in vitro [64][65]. Экспрессия lncRNA H19 и ncRNA FTX (англ. five prime to Xist) снижается при эндометриозе, что приводит к увеличению доли T-хелперов 17 (англ. T-helper 17, Th17). Следовательно, сверхэкспрессия lncRNA H19 и ncRNA FTX подавляет дифференцировку клеток Th17 и пролиферацию стромальных клеток эндометрия, а также рост эндометриоидной ткани, вызванный дифференцировкой клеток Th17, и вызывает остановку клеточного цикла G0/G1 [66]. Кроме того, подавление экспрессии lncRNA AFAP1-AS1 (англ. actin filament-associated protein 1 antisense RNA 1; ассоциированный с актиновой нитью белок 1 – антисмысловая РНК 1) в стромальных клетках эндометрия непосредственно влияет на функцию miR-424-5p, активируя ось STAT3/трансформирующий фактор роста-β1 (англ. transforming growth factor-beta, TGF-β1)/SMAD2 (англ. similar to mothers against decapentaplegic), ингибируя пролиферацию клеток и способствуя апоптозу [67]. Кроме того, при бесплодии, связанном с эндометриозом, lncRNA MALAT1 (англ. metastasis associated lung adenocarcinoma transcript 1) и LINC01960-201 (англ. long intergenic non-protein coding RNA 01960-201) ассоциированы с количеством фолликулов и децидуализацией стромальных клеток эндометрия в процессе имплантации. Снижение уровня lncRNA MALAT1 повышает уровень ядерного белка P21, активируя путь ERK/MAPK (англ. extracellular signal-regulated kinase/mitogen-activated protein kinase), тем самым ингибируя размножение клеток гранулезы при эндометриозе [68], в то время как аномальная экспрессия LINC01960-201 может привести к снижению восприимчивости эндометрия и повторному выкидышу [69].
Таким образом, lncRNA в основном выполняют регуляторную функцию в процессе транскрипции через специфические механизмы. Они связаны с процессами инвазии, миграции и пролиферации клеток при эндометриозе, а также с бесплодием, которое часто сопровождает это заболевание. Изменение уровня экспрессии lncRNA может оказывать влияние на развитие эндометриоза, что открывает новые возможности для понимания механизмов его возникновения и прогрессирования.
МикроРНК / MicroRNAs
МикроРНК контролируют экспрессию генов путем снижения трансляции белка или стабильности мРНК, а lncRNA, как было показано, являются источниками и подавляющими регуляторами микроРНК. Cирутин-1 (англ. sirtuin-1, SIRT1) является членом семейства белков сиртуина; он регулирует ремоделирование хроматина посредством NAD-зависимого деацетилирования, подавляет воспалительную реакцию стромальных клеток эндометрия и связан с овариальной стимуляцией, децидуализацией стромальных клеток эндометрия и имплантацией эмбриона [70][71]. Исследования показали, что экспрессия и активность SIRT1 регулируются несколькими miRNA. miR-34a может снижать экспрессию SIRT1 и регулировать экспрессию FOXO1 (англ. forkhead box protein O1) в эндометриозной ткани, тем самым снижая апоптоз клеток эндометрия и ингибируя ангиогенез при эндометриозе [72]. Кроме того, микроРНК действуют как регуляторные факторы. Подавление регуляции hsa-miR-100-5p и METTL3 (англ. N6-adenosine-methyltransferase 70 kDa subunit) ингибирует экспрессию SMARCD1 (англ. SWI/SNF-related matrix-associated actin-dependent regulator of chromatin subfamily D member 1), модификацию N6-метиладенина (m6A) и активацию матричной металлопротеиназы-1 (англ. matrix metalloproteinase-1, MMP-1), что, в свою очередь, увеличивает инвазию и подвижность нормальных стромальных клеток эндометрия и эндометриоидных стромальных клеток [73][74]. Применение микроРНК Let-7b с целью терапии эндометриоза исследовалось на мышиной модели. Авторы обнаружили уменьшение объема эндометриоидной ткани. Дальнейшие исследования выявили снижение экспрессии нескольких генов, способствующих развитию эндометриоза, таких как рецептор эстрогена-α (англ. estrogen receptor-α, ER-α), рецептор эстрогена-β (англ. estrogen receptor-β, ER-β), Cyp19a (англ. cytochrome P450 aromatase), KRAS 4A (англ. kirsten rat sarcoma virus 4A), KRAS 4B (англ. kirsten rat sarcoma virus 4 B) и IL-6 [75]. Другое исследование показало, что уровень экспрессии miR-29a в ткани эндометрия связан со стадией менструации и исходом беременности. Ингибирование miR-29a приводит к снижению децидуализации стромальных клеток эндометрия in vitro, в то время как miR-196a усиливает сигнальный путь ERK/MAPK и опосредует снижение экспрессии PR в эктопическом эндометрии пациенток с эндометриозом [76], влияя на нормальное течение беременности. Так, микроРНК играют ключевую роль в регуляции роста тканей и функций во время беременности при эндометриозе, воздействуя на связанные белковые пути. Это позволяет глубже понять процесс патогенеза эндометриоза.
Заключение / Conclusion
Модификаторы хроматина контролируют процессы дифференцировки, роста и развития, старения и гибели клеток, взаимодействуя с различными функциональными элементами хроматина. Они могут вызывать аномальную экспрессию генов, регулируя структуру хроматина, что влияет на возникновение и развитие эндометриоза. Метилирование ДНК определяет типы клеток, контролирует экспрессию генов и стабильность генома. Аномальное метилирование ДНК промоторных участков генов, необходимых для нормальной реакции эндометрия, влияет на развитие эндометриоза. Ингибиторы DNMT снижают уровень метилирования генов HOXA10 и PR и усиливают их экспрессию в клетках эндометрия, улучшая восприимчивость эндометрия и ингибируя прогрессирование клеточного цикла.
Аномальные модификации гистонов в клетках эндометрия могут способствовать или препятствовать доступу транскрипционных механизмов к хроматиновой ДНК. Ингибиторы гистондеацетилазы эффективно устраняют последствия аномальных модификаций гистонов в эндометриозных клетках и препятствуют прогрессированию эндометриоза. Экспрессия некодирующих РНК и комплексов ремоделирования хроматина также вызывает изменения в структуре хроматина, участвует в возникновении эндометриоза и связана с бесплодием, поскольку способствует пролиферации, инвазии и миграции эндометриоидных клеток. Модификаторы хроматина играют ключевую роль в развитии эндометриоза, контролируя экспрессию генов и структуру хроматина. Понимание этих механизмов предоставляет ценную информацию для диагностики и разработки новых подходов к лечению эндометриоза. Несмотря на то, что модификаторы хроматина играют важную роль в развитии эндометриоза, многие аспекты этого заболевания остаются неизученными. Различные клинические проявления эндометриоза, такие как бесплодие и боль, требуют дальнейшего исследования механизмов регуляции хроматина в этих условиях. Также необходимо учитывать, что эндометриоз регулируется множеством факторов, включая иммунитет и гормоны, что делает его сложным для изучения. Поэтому необходимы дополнительные исследования, чтобы полностью понять механизмы регуляции хроматина при эндометриозе и разработать более эффективные методы диагностики и лечения этого заболевания.
Список литературы
1. Кузнецов К.О., Шарипова Э.Ф., Низаева А.С. и др. Роль микроРНК в норме и при патологии эндометрия. Российский вестник акушера-гинеколога. 2023;23(4):27-34. https://doi.org/10.17116/rosakush20232304127.
2. Адамян Л.В., Андреева Е.Н. Эндометриоз и его глобальное влияние на организм женщины. Проблемы репродукции. 2022;28(1):54-64. https://doi.org/10.17116/repro20222801154.
3. Дубровина С.О., Берлим Ю.Д., Александрина А.Д. и др. Современные представления о диагностике и лечении эндометриоза. Акушерство и гинекология. 2023;(2):146-53. https://doi.org/10.18565/aig.2023.43.
4. Ye L., Whitaker L.H.R., Mawson R.L., Hickey M. Endometriosis. BMJ. 2022;379:e068950. https://doi.org/10.1136/bmj-2021-068950.
5. Адамян Л.В., Шаров М.Н., Мурватов К.Д. и др. Возможности повышения эффективности комплексной терапии эндометриоза и хронической тазовой боли у пациенток репродуктивного возраста. Проблемы репродукции. 2023;29(3):91-7. https://doi.org/10.17116/repro20232903191.
6. Хамадьянова А.У., Загидулина А.Р., Загретдинова Д.Р. и др. Перспективы исследования микробиома организма человека для лучшего понимания патогенеза рака яичников. Российский вестник акушера-гинеколога. 2023;23(1):39-46. https://doi.org/10.17116/rosakush20232301139.
7. Самойлова А.В., Гунин А.Г., Сидоров А.Е. и др. Современные направления изучения этиологии и патогенеза эндометриоза (обзор литературы). Проблемы репродукции. 2020;26(5):118-32. https://doi.org/10.17116/repro202026051118.
8. Houshdaran S., Oke A.B., Fung J.C. et al. Steroid hormones regulate genome-wide epigenetic programming and gene transcription in human endometrial cells with marked aberrancies in endometriosis. PLoS Genet. 2020;16(6):e1008601. https://doi.org/10.1371/journal.pgen.1008601.
9. Wilson M.R., Reske J.J., Chandler R.L. AP-1 subunit JUNB promotes invasive phenotypes in endometriosis. Reprod Sci. 2022;29(11):3266-77. https://doi.org/10.1007/s43032-022-00974-3.
10. Lu J., Xu J., Li J. et al. FACER: comprehensive molecular and functional characterization of epigenetic chromatin regulators. Nucleic Acids Res. 2018;46(19):10019-33. https://doi.org/10.1093/nar/gky679.
11. Егорова Д.А., Дерезина В.В., Чебанян М.В. и др. Роль эпигенетики в мужском и женском бесплодии. Акушерство, Гинекология и Репродукция. 2024;18(1):68-82. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.474.
12. Fyodorov D.V., Zhou B.-R., Skoultchi A.I., Bai Y. Emerging roles of linker histones in regulating chromatin structure and function. Nat Rev Mol Cell Biol. 2018;19(3):192-206. https://doi.org/10.1038/nrm.2017.94.
13. Ding L., Yang L., Ren C. et al. A review of aberrant DNA methylation and epigenetic agents targeting DNA methyltransferases in endometriosis. Curr Drug Targets. 2020;21(11):1047-55. https://doi.org/10.2174/1389450121666200228112344.
14. Пономаренко И.В., Полоников А.В., Верзилина И.Н., Чурносов М.И. Молекулярно-генетические детерминанты развития эндометриоза. Вопросы гинекологии, акушерства и перинатологии. 2019;18(1):82-6. https://doi.org/10.20953/1726-1678-2019-1-82-86.
15. Mulholland C.B., Traube F.R., Ugur E. et al. Distinct and stage-specific contributions of TET1 and TET2 to stepwise cytosine oxidation in the transition from naive to primed pluripotency. Sci Rep. 2020;10(1):12066. https://doi.org/10.1038/s41598-020-68600-3.
16. Тихончук Е.Ю., Непша О.С., Адамян Л.В., Кузнецова М.В. Омиксные технологии в исследовании патогенеза эндометриоза (обзор литературы). Проблемы репродукции. 2016;22(5):110-22. https://doi.org/10.17116/repro2016225110-122.
17. Stirzaker C., Song J.Z., Ng W. et al. Methyl-CpG-binding protein MBD2 plays a key role in maintenance and spread of DNA methylation at CpG islands and shores in cancer. Oncogene. 2017;36:1328-38. https://doi.org/10.1038/onc.2016.297.
18. Wang L., Zhao J., Li Y. et al. Genome-wide analysis of DNA methylation in endometriosis using Illumina Human Methylation 450 K BeadChips. Mol Reprod Dev. 2019;86(5):491-501. https://doi.org/10.1002/mrd.23127.
19. Baumann C., Olson M., Wang K. et al. Arginine methyltransferases mediate an epigenetic ovarian response to endometriosis. Reproduction. 2015;150(4):297-310. https://doi.org/10.1530/REP-15-0212.
20. Wu X., Miao J., Jiang J., Liu F. Analysis of methylation profiling data of hyperplasia and primary and metastatic endometrial cancers. Eur J Obstet Gynecol Reprod Biol. 2017;217:161-6. https://doi.org/10.1016/j.ejogrb.2017.08.036.
21. Zhao J., Wang L., Li Y. et al. Hypomethylation of the GSTM1 promoter is associated with ovarian endometriosis. Hum Reprod. 2019;34(5):804-12. https://doi.org/10.1093/humrep/dez039.
22. Сухих Г.Т., Осипьянц А.И., Мальцева Л.И. и др. Аномальное гиперметилирование генов HOXA10 и HOXA11 при бесплодии, ассоциированном с хроническим эндометритом. Акушерство и гинекология. 2015;(12):69-74.
23. Barjaste N., Shahhoseini M., Afsharian P. et al. Genome-wide DNA methylation profiling in ectopic and eutopic of endometrial tissues. J Assist Reprod Genet. 2019;36(8):1743-52. https://doi.org/10.1007/s10815-019-01508-8.
24. Greville G., Llop E., Howard J. et al. 5-AZA-dC induces epigenetic changes associated with modified glycosylation of secreted glycoproteins and increased EMT and migration in chemo-sensitive cancer cells. Clin Epigenetics. 2021;13(1):34. https://doi.org/10.1186/s13148-021-01015-7.
25. Gibson D.A., Simitsidellis I., Collins F., Saunders P.T.K. Androgens, oestrogens and endometrium: a fine balance between perfection and pathology. J Endocrinol. 2020;246(3):R75-R93. https://doi.org/10.1530/JOE-20-0106.
26. Zelenko Z., Aghajanova L., Irwin J.C., Giudice L.C. Nuclear receptor, coregulator signaling, and chromatin remodeling pathways suggest involvement of the epigenome in the steroid hormone response of endometrium and abnormalities in endometriosis. Reprod Sci. 2012;19(2):152-62. https://doi.org/10.1177/1933719111415546.
27. Clemenza S., Capezzuoli T., Eren E. et al. Progesterone receptor ligands for the treatment of endometriosis. Minerva Obstet Gynecol. 2023;75(3):288-97. https://doi.org/10.23736/S2724-606X.22.05157-0.
28. Bulun S.E., Yildiz S., Adli M., Wei J.J. Adenomyosis pathogenesis: insights from next-generation sequencing. Hum Reprod Update. 2021;27(6):1086-97. https://doi.org/10.1093/humupd/dmab017.
29. Rocha C.V., Da Broi M.G., Miranda-Furtado C.L. et al. Progesterone receptor B (PGR-B) is partially methylated in eutopic endometrium from infertile women with endometriosis. Reprod Sci. 2019;26(12):1568-74. https://doi.org/10.1177/1933719119828078.
30. MacLean J.A., Hayashi K. Progesterone actions and resistance in gynecological disorders. Cells. 2022;11(4):647. https://doi.org/10.3390/cells11040647.
31. Nguyen T.V., Lister R. Genomic targeting of TET activity for targeted demethylation using CRISPR/Cas9. Methods Mol Biol. 2021;2272:181-94. https://doi.org/10.1007/978-1-0716-10.1007/s10815-024-03026-81294-1_10.
32. Roca F.J., Loomans H.A., Wittman A.T. et al. Ten-eleven translocation genes are downregulated in endometriosis. Curr Mol Med. 2016;16(3):288-98. https://doi.org/10.2174/1566524016666160225153844.
33. Adamczyk M., Rawtuszko-Wieczorek A.A., Wirstlein P. et al. Assessment of TET1 gene expression, DNA methylation and H3K27me3 level of its promoter region in eutopic endometrium of women with endometriosis and infertility. Biomed Pharmacother. 2022;150:112989. https://doi.org/10.1016/j.biopha.2022.112989.
34. Szczepanska M., Wirstlein P., Zawadzka M. et al. Alternation of ten-eleven translocation 1, 2, and 3 expression in eutopic endometrium of women with endometriosis-associated infertility. Gynecol Endocrinol. 2018;34(12):1084-90. https://doi.org/10.1080/09513590.2018.1490403.
35. Hada A., Hota S.K., Luo J. et al. Histone octamer structure is altered early in ISW2 ATP-dependent nucleosome remodeling. Cell Rep. 2019;28(1):282-94. https://doi.org/10.1016/j.celrep.2019.05.106.
36. Kaleem A., Hoessli D.C., Ahmad I. et al. Immediate-early gene regulation by interplay between different post-translational modifications on human histone H3. J Cell Biochem. 2008;103(3):835-51. https://doi.org/10.1002/jcb.21454.
37. Taing L., Dandawate A., L'Yi S. et al. Cistrome Data Browser: integrated search, analysis and visualization of chromatin data. Nucleic Acids Res. 2024;52(D1):D61-D66. https://doi.org/10.1093/nar/gkad1069.
38. Singh W., Quinn D., Moody T.S., Huang M. Reaction mechanism of histone demethylation in aKG-dependent non-heme iron enzymes. J Phys Chem B. 2019;123(37):7801-11. https://doi.org/10.1021/acs.jpcb.9b06064.
39. Colón-Caraballo M., Monteiro J.B., Flores I. H3K27me3 is an epigenetic mark of relevance in endometriosis. Reprod Sci. 2015;22(9):1134-42. https://doi.org/10.1177/1933719115578924.
40. Colón-Caraballo M., Torres-Reveron A., Soto-Vargas J.L. et al. Effects of histone methyltransferase inhibition in endometriosis!. Biol Reprod. 2018;99(2):293-307. https://doi.org/10.1093/biolre/ioy030.
41. Zhao S., Zhong Y., Fu X. et al. H3K4 methylation regulates LPS-induced proinflammatory cytokine expression and release in macrophages. Shock. 2019;51(3):401-6. https://doi.org/10.1097/SHK.0000000000001141.
42. Gujral P., Mahajan V., Lissaman A.C., Ponnampalam A.P. Histone acetylation and the role of histone deacetylases in normal cyclic endometrium. Reprod Biol Endocrinol. 2020;18(1):84. https://doi.org/10.1186/s12958-020-00637-5.
43. Adamczyk M., Wender-Ozegowska E., Kedzia M. Epigenetic factors in eutopic endometrium in women with endometriosis and infertility. Int J Mol Sci. 2022;23(7):3804. https://doi.org/10.3390/ijms23073804.
44. Gujral P., Mahajan V., Lissaman A.C., Ponnampalam A.P. Histone acetylation and the role of histone deacetylases in normal cyclic endometrium. Reprod Biol Endocrinol. 2020;18(1):84. https://doi.org/10.1186/s12958-020-00637-5.
45. Mai H., Liao Y., Luo S. et al. Histone deacetylase HDAC2 silencing prevents endometriosis by activating the HNF4A/ARID1A axis. J Cell Mol Med. 2021;25:9972-82. https://doi.org/10.1111/jcmm.16835.
46. Samartzis E.P., Noske A., Samartzis N. et al. The expression of histone deacetylase 1, but not other class I histone deacetylases, is significantly increased in endometriosis. Reprod Sci. 2013;20(12):1416-22. https://doi.org/10.1177/1933719113488450.
47. Kim T.H., Yoo J.-Y., Choi K.-C. et al. Loss of HDAC3 results in nonreceptive endometrium and female infertility. Sci Transl Med. 2019;11(474):eaaf7533. https://doi.org/10.1126/scitranslmed.aaf7533.
48. Bedrick B.S., Courtright L., Zhang J. et al. Systematic review of epigenetics of endometriosis. F S Rev. 2024;5(1):100070. https://doi.org/10.1016/j.xfnr.2024.01.003.
49. Seto E., Yoshida M. Erasers of histone acetylation: the histone deacetylase enzymes. Cold Spring Harb Perspect Biol. 2014;6(4):a018713. https://doi.org/10.1101/cshperspect.a018713.
50. Kim H.I., Seo S.K., Chon S.J. et al. Changes in the expression of TBP-2 in response to histone deacetylase inhibitor treatment in human endometrial cells. Int J Mol Sci. 2021;22(3):1427. https://doi.org/10.3390/ijms22031427.
51. Malvezzi H., Dobo C., Filippi R.Z. et al. Altered p16Ink4a, IL-1 в, and Lamin b1 protein expression suggest cellular senescence in deep endometriotic lesions. Int J Mol Sci. 2022;23(5):2476. https://doi.org/10.3390/ijms23052476.
52. Kapoor R., Stratopoulou C.A., Dolmans M.-M. Pathogenesis of endometriosis: new insights into prospective therapies. Int J Mol Sci. 2021;22(21):11700. https://doi.org/10.3390/ijms222111700.
53. Arvindekar S., Jackman M.J., Low J.K.K. et al. Molecular architecture of nucleosome remodeling and deacetylase sub-complexes by integrative structure determination. Protein Sci. 2022;31(9):e4387. https://doi.org/10.1002/pro.4387.
54. Sahu R.K., Singh S., Tomar R.S. The mechanisms of action of chromatin remodelers and implications in development and disease. Biochem Pharmacol. 2020;180:114200. https://doi.org/10.1016/j.bcp.2020.114200.
55. Wiegand K.C., Lee A.F., Al-Agha O.M. et al. Loss of BAF250a (ARID1A) is frequent in high-grade endometrial carcinomas. J Pathol. 2011;224(3):328-33. https://doi.org/10.1002/path.2911.
56. Ярмолинская М.И., Самошкин Н.Г., Полякова В.О., Нетреба Е.А. Экспрессия ARID1A, синтазы простагландина Е2 и рецептора простагландина Е2 у больных с наружным генитальным эндометриозом. Проблемы репродукции. 2019;25(3):34-9. https://doi.org/10.17116/repro20192503134.
57. Kawahara N., Yamada Y., Kobayashi H. CCNE1 is a putative therapeutic target for ARID1A-mutated ovarian clear cell carcinoma. Int J Mol Sci. 2021;22(11):5869. https://doi.org/10.3390/ijms22115869.
58. Murawski M., Jagodzinski A., Bielawska-Pohl A., Klimczak A. Complexity of the genetic background of oncogenesis in ovarian cancer-genetic instability and clinical implications. Cells. 2024;13(4):345. https://doi.org/10.3390/cells13040345.
59. Marquardt R.M., Kim T.H., Yoo J. et al. Endometrial epithelial ARID1A is critical for uterine gland function in early pregnancy establishment. FASEB J. 2021;35(2):e21209. https://doi.org/10.1096/fj.202002178R.
60. Wilson M.R., Reske J.J., Holladay J. et al. ARID1A mutations promote P300-dependent endometrial invasion through super-enhancer hyperacetylation. Cell Rep. 2020;33(6):108366. https://doi.org/10.1016/j.celrep.2020.108366.
61. Kim H.I., Kim T.H., Yoo J.-Y. et al. ARID1A and PGR proteins interact in the endometrium and reveal a positive correlation in endometriosis. Biochem Biophys Res Commun. 2021;550:151-7. https://doi.org/10.1016/j.bbrc.2021.02.144.
62. Бейлерли О.А., Гареев И.Ф. Длинные некодирующие РНК: какие перспективы? Профилактическая медицина. 2020;23(2):124-8. https://doi.org/10.17116/profmed202023021124.
63. Ghafouri-Fard S., Shoorei H., Taheri M. Role of non-coding RNAs in the pathogenesis of endometriosis. Front Oncol. 2020;10:1370. https://doi.org/10.3389/fonc.2020.01370.
64. Zhang L., Yu Z., Qu Q. et al. Exosomal lncRNA HOTAIR promotes the progression and angiogenesis of endometriosis via the miR-761/HDAC1 axis and activation of STAT3-mediated inflammation. Int J Nanomed. 2022;17:1155-70. https://doi.org/10.2147/IJN.S354314.
65. Bao Q., Zheng Q., Wang S. et al. LncRNA HOTAIR regulates cell invasion and migration in endometriosis through miR-519b-3p/PRRG4 pathway. Front Oncol. 2022;12:953055. https://doi.org/10.3389/fonc.2022.953055.
66. Liu Z., Liu L., Zhong Y. et al. LncRNA H19 over-expression inhibited Th17 cell differentiation to relieve endometriosis through miR-342-3p/ IER3 pathway. Cell Biosci. 2019;9:84. https://doi.org/10.1186/s13578-019-0346-3.
67. Huan Q., Cheng S.-C., Du Z.-H. et al. LncRnA AFAP1-AS1 regulates proliferation and apoptosis of endometriosis through activating STAT3/ TGF-e/Smad signaling via miR-424-5p. J Obstet Gynaecol Res. 2021;47(7):2394-405. https://doi.org/10.1111/jog.14801.
68. Li Y., Liu Y.-D., Chen S.-L. et al. Down-regulation of long non-coding RNA MALAT1 inhibits granulosa cell proliferation in endometriosis by up-regulating P21 via activation of the ERK/MAPK pathway. Mol Hum Reprod. 2019;25(1):17-29. https://doi.org/10.1093/molehr/gay045.
69. Cai H., Zhu X., Li Z. et al. lncRNA/mRNA profiling of endometriosis rat uterine tissues during the implantation window. Int J Mol Med. 2019;44(6):2145-60. https://doi.org/10.3892/ijmm.2019.4370.
70. Tatone C., Di Emidio G., Barbonetti A. et al. Sirtuins in gamete biology and reproductive phys- iology: emerging roles and therapeutic potential in female and male infertility. Hum Reprod Update. 2018;24(3):267-89. https://doi.org/10.1093/humupd/dmy003.
71. Taguchi A., Wada-Hiraike O., Kawana K. et al. Resveratrol suppresses inflammatory responses in endometrial stromal cells derived from endometriosis: a possible role of the sirtuin 1 pathway. J Obstet Gynaecol Res. 2014;40(3):770-8. https://doi.org/10.1111/jog.12252.
72. Rezk N.A., Lashin M.B., Sabbah N.A. MiRNA 34-a regulate SIRT-1 and Foxo-1 expression in endometriosis. Noncoding RNA Res. 2021;6(1):35-41. https://doi.org/10.1016/j.ncrna.2021.02.002.
73. Takebayashi K., Nasu K., Okamoto M. et al. hsa-miR-100-5p, an overexpressed miRNA in human ovarian endometriotic stromal cells, promotes invasion through attenuation of SMARCD1 expression. Reprod Biol Endocrinol. 2020;18(1):31. https://doi.org/10.1186/s12958-020-00590-3.
74. Li X., Xiong W., Long X. et al. Inhibition of METTL3/m6A/ miR126 promotes the migration and invasion of endometrial stromal cells in endometriosis. Biol Reprod. 2021;105(5):1221-33. https://doi.org/10.1093/biolre/ioab152.
75. Sahin C., Mamillapalli R., Yi K.W., Taylor H.S. microRNA Let-7b: a novel treatment for endometriosis. J Cell Mol Med. 2018;22(11):5346-53. https://doi.org/10.1111/jcmm.13807.
76. Liu A., Jin M., Xie L. et al. Loss of miR-29a impairs decidualization of endometrial stromal cells by TET3 mediated demethylation of Col1A1 promoter. iScience. 2021;24(9):103065. https://doi.org/10.1016/j.isci.2021.103065.
Об авторах
К. А. АбаеваРоссия
Абаева Кристина Александровна – аспирант кафедры внутренних болезней № 3.
362019 Владикавказ, ул. Пушкинская, д. 40
Р. Т. Муртазова
Россия
Муртазова Роксана Темуровна – аспирант кафедры лучевой диагностики с лучевой терапией и онкологией.
363131 село Октябрьское, Интернациональная ул., д. 9
И. А. Ваниев
Россия
Ваниев Ибрагим Артурович – студент.
362019 Владикавказ, ул. Пушкинская, д. 40
А. В. Лазарова
Россия
Лазарова Амина Владимировна – студент.
362019 Владикавказ, ул. Пушкинская, д. 40
А. А. Созаева
Россия
Созаева Анита Аслановна – студент.
362019 Владикавказ, ул. Пушкинская, д. 40
М. А. Гогичаева
Россия
Гогичаева Милана Аслановна – студент.
362019 Владикавказ, ул. Пушкинская, д. 40
А. А. Пирожникова
Россия
Пирожникова Александра Алексеевна – студент.
194100 Санкт-Петербург, ул. Литовская, д. 2
К. В. Игнашев
Россия
Игнашев Кирилл Владимирович – студент.
194100 Санкт-Петербург, ул. Литовская, д. 2
М. С. Дадашов
Россия
Дадашов Мурад Сахиб оглы – студент.
199034 Санкт-Петербург, Университетская наб., д. 7/9
Д. В. Колесникова
Россия
Колесникова Дарья Вячеславовна – студент.
117997 Москва, ул. Островитянова, д. 1
А. А. Байрамова
Россия
Байрамова Асмар Асаф кызы – студент.
117997 Москва, ул. Островитянова, д. 1
В. Е. Кучерская
Россия
Кучерская Виолетта Евгеньевна – ординатор.
450008 Уфа, ул. Ленина, д. 3
Л. Д. Зульфалиева
Россия
Зульфалиева Лэйла Джахидовна – студент.
450008 Уфа, ул. Ленина, д. 3
А. М. Зайцева
Россия
Зайцева Анастасия Михайловна – ассистент.
127006 Москва, Долгоруковская ул., д. 4
Что уже известно об этой теме?
► Эндометриоз обладает многофакторным генетическим потенциалом, и различные эпигенетические аномалии могут играть важную роль в его патогенезе.
► Модификаторы хроматина влияют на экспрессию генов, регулируя процессы метилирования и изменяя активность ДНК-метилтрансферазы (DNMT), что приводит к изменениям в активности эпигенома.
► Изменения активности эпигенома могут способствовать развитию эндометриоза, нарушая регуляцию генов, связанных с пролиферацией, апоптозом и ангиогенезом.
Что нового дает статья?
► При эндометриозе наблюдается гиперметилирование ДНК локальных клеток за счёт повышенной экспрессии DNMT1, DNMT3A и DNMT3B.
► Снижение экспрессии генов, таких как человеческий гомеобокс A10 (HOXA10), который регулирует рост, дифференцировку и имплантацию эмбриона эндометрия, связано с уменьшением восприимчивости матки и возникновением связанного с эндометриозом бесплодия.
► При эндометриозе изменяется спектр микроРНК, что дополнительно влияет на экспрессию соответствующих целевых мРНК. Так, микроРНК-135a/b, регулирующая HOXA10, активируется при эндометриозе и вызывает резистентность к прогестерону. МикроРНК-199 подавляется, поэтому трансляция циклооксигеназы-2 не подавляется, что приводит к формированию провоспалительной среды, характеризующейся активным синтезом простагландинов и повышенной концентрацией интерлейкина-8.
Как это может повлиять на клиническую практику в обозримом будущем?
► Изменения в паттернах ацетилирования и метилирования гистонов могут способствовать аномальной пролиферации и инвазии клеток эндометрия. Это означает, что разработка препаратов, способных регулировать эти процессы, может стать новым направлением в лечении эндометриоза.
► Понимание роли модификаторов хроматина может привести к созданию более точных диагностических тестов, которые позволят выявлять эндометриоз на ранних стадиях. Это, в свою очередь, позволит начать лечение раньше и предотвратить развитие осложнений.
► Препараты, регулирующие ацетилирование и метилирование гистонов, могут быть использованы для предотвращения развития эндометриоза у женщин из группы риска.
Рецензия
Для цитирования:
Абаева К.А., Муртазова Р.Т., Ваниев И.А., Лазарова А.В., Созаева А.А., Гогичаева М.А., Пирожникова А.А., Игнашев К.В., Дадашов М.С., Колесникова Д.В., Байрамова А.А., Кучерская В.Е., Зульфалиева Л.Д., Зайцева А.М. Модификаторы хроматина в патогенезе эндометриоза. Акушерство, Гинекология и Репродукция. 2024;18(4):525-539. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.524
For citation:
Abaeva K.A., Murtazova R.T., Vaniev I.A., Lazarova A.V., Sozaeva A.A., Gogichaeva M.A., Pirozhnikova A.A., Ignashev K.V., Dadashov M.S., Kolesnikova D.V., Bayramova A.A., Kucherskaya V.E., Zulfalieva L.D., Zaitseva A.M. Chromatin modifiers in endometriosis pathogenesis. Obstetrics, Gynecology and Reproduction. 2024;18(4):525-539. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.524

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































