Перейти к:
Прогнозирование гипертензивных расстройств при беременности у пациенток в «серой» зоне риска по результатам комбинированного скрининга I триместра
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.454
Аннотация
Введение. Гипертензивные расстройства при беременности (ГРБ), в том числе и преэклампсия (ПЭ), являются одной из первостепенных причин, приводящих к критическим ситуациям и материнской смертности в акушерстве. Прогнозирование данного состояния является основополагающим моментом, который лежит в основе профилактики осложнений, а также снижения количества наиболее частых акушерских осложнений, возникающих при реализации ГРБ. Существующие алгоритмы, прогнозирующие риск ПЭ, распределяют риски таким образом, что немалое количество пациенток попадают в категорию ложноотрицательных результатов, и, как следствие, не получают своевременную профилактику и соответствующее динамическое наблюдение. Это, как правило, категория пациенток, имеющих пограничные с высоким риски, которых можно обозначить, как группу среднего риска находящихся в «серой» зоне.
Цель: разработка прогностической модели для стратификации пациенток, имеющих пограничные с высоким риски развития ПЭ по результатам комбинированного скрининга I триместра.
Материалы и методы. В проспективное сравнительное исследование включены 1089 пациенток, прошедших комбинированный скрининг I триместра в сроке беременности 11–14 недель. В группу 1 вошли пациентки с высоким риском ПЭ (1:100 и выше), в группу 2 – со средним (1:101–1:250) и в группу 3 – с низким (ниже 1:250). Всем беременным проведено обследование, включавшее оценку анамнестических, общеклинических и лабораторных данных, измерение уровня среднего артериального давления (АД), пульсационного индекса маточных артерий, определение содержания в сыворотке крови бета-субъединицы хорионического гонадотропина человека (β-ХГЧ), плацентарного фактора роста (англ. placental growth factor, PlGF), ассоциированного с беременностью протеина-А плазмы (англ. pregnancy-associated plasma protein-A, РАРР-А).
Результаты. Оценка влияния различных факторов на риск развития ГРБ осуществлялась методом бинарной логистической регрессии; были выявлены наиболее значимые из них и построена статистическая модель прогнозирования – прогностический индекс гипертензивных расстройств при беременности. Он включает в себя: акушерский анамнез; индекс массы тела; значения PlGF, среднего АД и аланинаминотрансферазы. Показатели чувствительности и специфичности составили 91,2 и 53,6 % соответственно, эффективность способа – 81,8 %.
Заключение. Предложенный способ прогнозирования ГРБ является тестом второй линии и может быть использован в клинической практике для стратификации пациенток, имеющих пограничные с высоким риски развития ПЭ.
Ключевые слова
Для цитирования:
Мостова Н.В., Ковалев В.В., Кудрявцева Е.В. Прогнозирование гипертензивных расстройств при беременности у пациенток в «серой» зоне риска по результатам комбинированного скрининга I триместра. Акушерство, Гинекология и Репродукция. 2024;18(2):200-210. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.454
For citation:
Mostova N.V., Kovalev V.V., Kudryavtseva E.V. Prediction of hypertensive disorders in pregnant women in the «gray» risk zone following combined first-trimester screening. Obstetrics, Gynecology and Reproduction. 2024;18(2):200-210. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.454
Введение / Introduction
Проблема гипертензивных расстройств при беременности (ГРБ) и, в частности, преэклампсии (ПЭ), имеет несколько социально и клинически важных составляющих, являясь одним из значимых факторов материнской и перинатальной заболеваемости и смертности. Каждые 2 минуты в мире от причин, связанных с беременностью и родами, умирает одна женщина, такие данные предоставляет Всемирная организация здравоохранения. При этом ПЭ, осложняя от 2 до 8–10 % всех беременностей, определяет до 40 % материнских потерь [1]. Есть основания полагать, что приведенные выше данные представляют лишь «вершину айсберга» структуры этиологических причин материнской смертности, так как значительная часть случаев гибели женщин в связи с беременностью и родами, якобы обусловленными кровотечениями и экстрагенитальной патологией (гипертоническая болезнь), в действительности прямо связана с ПЭ.
Несмотря на то что данному осложнению беременности уделяется большое внимание исследователей, разработаны подробные классификация и алгоритмы действий в различных ситуациях, медицинский персонал по-прежнему сталкивается с нетипичной, а порой и молниеносно развивающейся клинической картиной гипертензивных расстройств при беременности, что зачастую приводит к критическим состояниям и материнской смертности [2–4].
Акушерство является областью медицины, где существует риск серьёзных, а порой и фатальных осложнений, одновременно как минимум для двух людей – матери и будущего ребенка. Научно обосновано, что внутриутробная среда обитания определяет будущую жизнь и здоровье человека [5]. На сегодняшний день большое количество научных публикаций посвящено отдаленным последствиям для женщины и ребенка после перенесенной матерью ПЭ. Пациентки, имеющие ПЭ в анамнезе, примерно в 15 % случаев рискуют получить данное осложнение при следующей беременности. У женщины в будущем в 2–5 раз повышается риск развития сердечно-сосудистых заболеваний. С учетом того, что смертность от сердечно-сосудистых заболеваний является ведущей во всем мире, в том числе среди женского населения, медицинское сообщество на сегодняшний день прилагает все больше усилий для повышения информированности пациенток с анамнезом ПЭ и врачей о необходимости регулярных обследований и модификации образа жизни с целью снижения кардиоваскулярных рисков [6–8].
Гипертензивные расстройства при беременности в целом часто являются причиной самопроизвольных и индуцированных преждевременных родов. Ранние и, как правило, наиболее тяжелые их формы часто сопровождаются задержкой роста плода. Глубокая недоношенность и низкая масса тела ребенка при рождении в свою очередь повышают риски респираторного дистресс-синдрома, асфиксии, внутрижелудочковых кровоизлияний, инфекционно-воспалительных заболеваний у новорожденных. Кроме того, систематический обзор данных показал, что у девочек, рожденных от матерей, имевших ГРБ, повышен риск ожирения и сердечно-сосудистых заболеваний в детстве и подростковом периоде [9–12].
Факторы риска ПЭ, описанные в последних рекомендациях Национального института здравоохранения (англ. National Institute for Health and Care Excellence, NICE) в 2023 г., делятся на умеренные и высокие. К умеренным относятся: первобеременные пациентки, старший репродуктивный возраст (40 лет и более), повышенный индекс массы тела (ИМТ) ≥ 35 кг/м² при постановке на учет, многоплодная беременность, семейный анамнез ПЭ, а также увеличенный интервал между беременностями (10 лет и более). К высоким рискам, в свою очередь, следует отнести: гипертензивные расстройства в предыдущую беременность, хронические заболевания почек, аутоиммунные заболевания, существовавшую ранее хроническую артериальную гипертензию [13]. При этом Американская коллегия акушеров-гинекологов (англ. American College of Obstetricians and Gynecologists, ACOG) дополнительно к вышеперечисленным рискам выделяет такие факторы, как низкий социальный статус матери, низкий вес ребенка при рождении, экстракорпоральное оплодотворение (ЭКО) и афроамериканская раса, рассматривая их как умеренные [14].
Однако модели, учитывающие лишь данные анамнеза и материнские факторы риска, не обладают удовлетворительной чувствительностью и характеризуются высокой частотой ложноположительных результатов в сравнении с алгоритмом, включающим в себя дополнительно лабораторные и инструментальные показатели. Отдельные маркеры, например, среднее артериальное давление (АД) или плацентарные гормоны достаточно давно рассматривались в качестве проявлений «больших акушерских синдромов», к которым относится и ПЭ, однако впервые о комбинированном риске заговорили после выхода исследования L.C. Poon с соавт., которое положило начало более детальному изучению открывающихся возможностей [15][16].
Модель, разработанная Фондом медицины плода (англ. Fetal Medicine Foundation, FMF), на основе параметров, объединяющих материнские факторы, среднее АД, пульсационный индекс (ПИ) маточных артерий (МА), а также плацентарный фактор роста (англ. placental growth factor, PlGF) и протеин-А плазмы, ассоциированный с беременностью (англ. pregnancy-associated plasma protein-A, РАРР-А) в сыворотке крови матери, является признанным методом определения рисков и рекомендована к использованию как мировым, так и отечественным медицинским сообществом в сфере акушерства и гинекологии [17–21].
Целесообразность расчета риска именно в I триместре заключается в возможности профилактики развития ПЭ или отсрочке ее реализации в сторону более поздних сроков препаратами ацетилсалициловой кислоты. Применение этих лекарственных средств продемонстрировало снижение на 60 % случаев ранней ПЭ при назначении в дозировке 150 мг ежедневно с 12 нед по сравнению с группой плацебо, при этом лучшие исходы наблюдались при начале приема препарата до 16 нед, т. е. до завершения полного формирования плаценты [13][22][23].
Высокая чувствительность любого прогностического метода обеспечивается только при безукоризненном соблюдении необходимых условий на всех этапах расчета риска: от сбора анамнеза до корректного измерения среднего АД и ПИ МА. При этом широкое распространение любого скринингового метода в клинической практике неизбежно влечет за собой снижение его чувствительности особенно там, где присутствует человеческий фактор. Комбинированный риск ПЭ, рассчитанный по методике FMF, принято позиционировать как высокий при показателях расчета 1:100 и выше, весь остальной риск считается низким. Однако существенная доля пациенток, реализовавших различные формы гипертензивных расстройств, в том числе тяжелые и сопровождающиеся перинатальными осложнениями, находились в так называемой «серой» зоне – в диапазоне 1:101–1:250 и названной нами средним риском. Беременные группы высокого риска, как правило, получают от врача-консультанта исчерпывающую информацию о клинических проявлениях ПЭ, «тревожных симптомах», необходимости соблюдения профилактических мер, тогда как группа пациенток среднего риска зачастую остается без дополнительного наблюдения. По данным ретроспективной оценки исходов беременностей за 2020–2022 гг. в Свердловской области, от 15 до 20 % пациенток, у которых возникли ГРБ, находились именно в средней группе риска. Подобная ситуация длительное время наблюдалась в отношении прогнозирования рисков рождения детей с хромосомной аномалией, где высокая группа риска подлежала направлению на инвазивную диагностику, что позволяло окончательно выяснить кариотип плода. Тогда как группа среднего риска, в которой и наблюдалось наибольшее число случаев рождения детей с синдром Дауна, такой возможности не имело, что и предопределяло значительное число ложноотрицательных результатов скрининга. С появлением неинвазивного пренатального тестирования (НИПТ) стала возможна стратификация рисков хромосомных аномалий и использование НИПТ в качестве теста второй линии [24][25]. По нашему мнению, подобный подход может быть использован и в прогнозировании рисков гипертензивных расстройств [26].
Цель: разработка прогностической модели для стратификации пациенток, имеющих пограничные с высоким риски развития ПЭ по результатам комбинированного скрининга I триместра.
Материалы и методы / Materials and Methods
Дизайн исследования / Study design
Исследование проводилось на кафедре акушерства и гинекологии, трансфузиологии ФГБОУ ВО УГМУ Минздрава России и ГАУЗ СО КДЦ ОЗМР; проведено проспективное сравнительное исследование, в котором приняли участие 1089 жительниц Свердловской области, прошедшие комбинированный пренатальный скрининг I триместра с расчетом риска ПЭ.
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения: одноплодная беременность; возрастной диапазон от 16 до 45 лет включительно; согласие на участие в исследовании.
Критерии невключения: многоплодная беременность; выявленные тяжелые пороки развития или хромосомная аномалия у плода; соматические заболевания у беременной тяжелой степени; являющаяся противопоказанием для вынашивания беременности открытая форма туберкулеза; наличие вируса иммунодефицита человека (ВИЧ); алкогольная и/или наркотическая зависимость.
Критерии исключения: отсутствие возможности получения данных о завершении беременности и ее исходе; самопроизвольный выкидыш, либо неразвивающаяся беременность; отказ от участия в исследовании.
Группы обследованных / Patients groups
Среди 1089 пациенток с верифицированным исходом беременности было выделено 3 группы риска развития ПЭ. В группу 1 вошли пациентки с высоким риском ПЭ (1:100 и выше), в группу 2 – со средним (1:101–1:250) и в группу 3 – с низким (ниже 1:250). Именно средняя группа риска представляла для нас особый интерес в данном исследовании как наиболее сложная категория в отношении консультирования, назначения профилактики и требующая разработки тестов второй линии. Среди выделенных групп проведена сравнительная оценка клинико-анамнестических, лабораторных, инструментальных показателей, а также исходов беременности с акцентом на реализацию ГРБ.
Методы исследования / Study methods
Обследование участниц исследования включало в себя оценку данных анамнеза, в том числе акушерского, соматического статуса, лабораторных показателей, регламентированные приказом Минздрава России № 1130н от 20.10.2020 «Об утверждении Порядка оказания медицинской помощи по профилю "акушерство и гинекология"» [21].
В ходе осуществления комплекса пренатальной диагностики I триместра всем пациенткам проведено ультразвуковое исследование специалистами, имеющими сертификат FMF, с оценкой анатомии плода и среднего ПИ МА. Исследования проведены на ультразвуковых системах экспертного класса Voluson E8/E10 (GE Healthcare, США). При помощи автоматической системы иммунологического анализа AutoDELFIA (PerkinElmer, Inc., США) определено содержание материнских сывороточных маркеров, а именно: бета-субъединицы хорионического гонадотропина человека (β-ХГЧ), PAPP-A и PlGF, выраженных в абсолютных значениях и в кратности медиане (англ. multiple of the median, MoM). Проводилось измерение АД с использованием автоматических тонометров (Omron, Япония; CS Medica, Дания) и вычислением среднего значения.
Полученные показатели, необходимые для расчета комбинированного риска, вносились в соответствующее поле программного обеспечения «Astraia», которое является базой данных, разработанной специально для акушеров-гинекологов и позволяющей произвести расчет индивидуального риска самых частых анеуплоидий и акушерских осложнений на основании материнских, лабораторных и инструментальных параметров (Astraia software GmbH, Германия).
Этические аспекты / Ethical aspects
Все участницы исследования оформили добровольное согласие, где были приведены методы, характер исследования, необходимость включения полученных результатов и их использование в дальнейшем для публикаций в научных изданиях. Все процедуры, выполненные в данном исследовании, соответствуют этическим стандартам Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики.
Протокол планируемого исследования представлен на заседании № 7 локального этического комитета ФГБОУ ВО УГМУ Минздрава России от 16.09.2022, в результате чего проведение исследования было одобрено.
Методы статистического анализа / Statistical analysis
Обработка полученных данных проводилась с использованием следующих статистических пакетов: Jamovi (The jamovi project, Австралия), StatTech v. 3.1.6 (ООО «Статтех», Россия).
Критерий Шапиро–Уилка использовали при числе исследуемых менее 50 для оценки количественных показателей на предмет соответствия нормальному распределению. В случае числа исследуемых более 50 применяли критерий Колмогорова–Смирнова.
В случае отсутствия нормального распределения описание количественных данных производили с помощью медианы (Me) и нижнего и верхнего квартилей (Q1–Q3). U-критерий Манна–Уитни использовали для интерпретации значимости различий между исследуемыми группами. Количественные показатели с нормальным распределением описывали с использованием средних арифметических величин (M) и стандартных отклонений (SD), границ 95 % доверительного интервала (95 % ДИ), тогда как анализ категориальных данных продемонстрирован с обозначением абсолютных значений и процентных долей. Критерий χ² Пирсона использовали при аналитике многопольных таблиц сопряженности. В случае уровня значимости (p-value) менее 5 % (р < 0,05) различия принимались как статистически значимые. При создании прогностической модели, характеризующей вероятность наступления определённого исхода, использовали метод логистической регрессии. Экзаменационная выборка позволила оценить уровень чувствительности и специфичности предложенного алгоритма. Для оценки качества представленной модели прогнозирования применяли метод анализа ROC-кривых (area under curve, AUC) с 95 % ДИ.
Результаты / Results
Клинико-анамнестическая характеристика обследованных / Clinical and anamnestic characteristics of patients examined
В группу высокого риска (группа 1) вошли 295 беременных, имевших риск 1:100 и выше, впервые выделенная нами группа среднего риска (группа 2) включала в себя 308 беременных (диапазон риска 1:101–1:250), количество пациенток в группе низкого риска (группа 3) составило 486 (риск 1:251 и ниже).
Группы были сопоставимы по сроку беременности и величине копчико-теменного размера плода. Минимальный возраст пациенток составил 16 лет, максимальный – 45, что соответствовало критериям включения в исследование. Увеличение возраста на каждые 5 лет ассоциируется с большими рисками реализации ПЭ.
В текущем исследовании возраст пациенток, выраженный в медиане, в группе 1 составил 35 (31–38) лет, в группе 2 – 35 (30–37) лет, в группе 3 – 34 (29–37) лет; различия, определяемые как статистически значимые, получены между группами 1 и 2 (p = 0,047), а также группами 1 и 3 (p < 0,001).
Важным аспектом в изучении прогностических маркеров ПЭ и в целом ГРБ является акушерский анамнез. В случаях, где пациенткам предстоят первые роды, шансы попасть в группу высокого и среднего рисков повышаются в 1,8 раза (χ² = 15,9; р < 0,001; отношение шансов (ОШ) = 1,87; 95 % ДИ = 1,37–2,55) и в 2,4 раза (χ² = 34; р < 0,001; ОШ = 2,44; 95 % ДИ = 1,8–3,3) соответственно. При этом в случае беременности, наступившей в результате ЭКО, шансы попасть в группу среднего риска были в 2,1 раза выше, чем в группу низкого риска (χ² = 12,5; p < 0,001; ОШ = 2,14; 95 % ДИ = 1,39–3,27).
Существенные различия присутствовали во всех трех группах при сравнении по показателю «ожирение». Так, у пациенток с ожирением в 4,2 раза повышаются шансы попасть в группу высокого риска (χ² = 65; p < 0,001; ОШ = 4,24; 95 % ДИ = 2,94–6,12) и в 2,5 раза выше – в группу среднего риска (χ² = 24,6; p < 0,001; ОШ = 2,56; 95 % ДИ = 1,751–3,741), нежели в низкую.
Анализ показателей пренатального скрининга I триместра / Analysis of prenatal first trimester screening parameters
Среди показателей, исследуемых в рамках комбинированного пренатального скрининга I триместра, выявлены определенные закономерности (табл. 1).
Таблица 1. Показатели, исследуемые в рамках комбинированного
пренатального скрининга I триместра, для расчета риска преэклампсии.
Table 1. Parameters examined in combined prenatal first trimester screening
to assess preeclampsia risk.
|
Показатель Parameter |
Единица измерения Unit |
Группа 1 Group 1 n = 295 |
Группа 2 Group 2 n = 308 |
Группа 3 Group 3 n = 486 |
p1–2 |
p1–3 |
p2–3 |
|
ХГЧ / hCG, Ме (Q1–Q3) |
МЕ/л / IU/L |
39,4 (23,0–68,7) |
35,5 (22,7–54,9) |
40,8 (26,2–64,0) |
0,109 |
0,457 |
0,007 |
|
МоМ |
1,05 (0,64–1,71) |
0,953 (0,61–1,45) |
1,02 (0,66–1,60) |
0,024 |
0,522 |
0,054 |
|
|
PAPР-А, Ме (Q1–Q3) |
МЕ/л / IU/L |
1,78 (1,06–2,73) |
1,94 (1,21–2,98) |
2,94 (1,90–4,27) |
0,091 |
< 0,001 |
< 0,001 |
|
МоМ |
0,75 (0,52–1,15) |
0,82 (0,542–1,190) |
1,11 (0,73–1,5) |
0,245 |
< 0,001 |
< 0,001 |
|
|
PlGF, Ме (Q1–Q3) |
пг/мл / pg/ml |
14,0 (9,99–20,30) |
17,3 (13,7–21,6) |
27,1 (20,3–35,6) |
< 0,001 |
< 0,001 |
< 0,001 |
|
МоМ |
0,64 (0,46–0,93) |
0,79 (0,62–1,01) |
1,21 (0,94–1,54) |
< 0,001 |
< 0,001 |
< 0,001 |
|
|
Среднее АД / Mean BP, M ± SD |
мм рт. ст. / mm Hg |
95,3 ± 8,99 |
89,0 ± 7,3 |
82,7 ± 6,78 |
< 0,001 |
< 0,001 |
< 0,001 |
|
МоМ |
1,05 (1,00–1,11) |
1,02 (0,96–1,07) |
0,96 (0,92–1,02) |
< 0,001 |
< 0,001 |
< 0,001 |
|
|
ПИ маточных артерий / Uterine artery PI, Ме (Q1–Q3) |
см/с / sm/s |
1,86 (1,56–2,18) |
1,76 (1,5–2,1) |
1,56 (1,3–1,87) |
0,038 |
< 0,001 |
< 0,001 |
|
МоМ |
1,16 (0,97–1,36) |
1,09 (0,94–1,29) |
0,95 (0,81–1,15) |
0,010 |
< 0,001 |
< 0,001 |
Примечание: ХГЧ – хорионический гонадотропин человека;
PAPР-А – ассоциированный с беременностью протеин-А плазмы;
PlGF – плацентарный фактор роста;
АД – артериальное давление; ПИ – пульсационный индекс;
p1–2 – уровень значимости различий между группами 1 и 2;
p1–3 – уровень значимости различий между группами 1 и 3;
p2–3 – уровень значимости различий между группами 2 и 3.
Note: hCG – human chorionic gonadotropin;
PAPP-A – pregnancy-associated plasma protein-A;
PlGF – placental growth factor; BP – blood pressure; PI – pulsation index;
p1–2 – level of significance for differences between group 1 and group 2;
p1–3 – level of significance for differences between group 1 and group 3;
p2–3 – level of significance for differences between group 2 and group 3.
Что касается исходов беременности, следует отметить, что количество случаев ГРБ в группе высокого риска составило 102 (34,6 %), что ожидаемо выше, чем в других группах: в группе среднего риска – 77 (25,0 %) и в группе с низким риском – 38 (7,8 %) случаев (p < 0,001), данные представлены на рисунке 1.
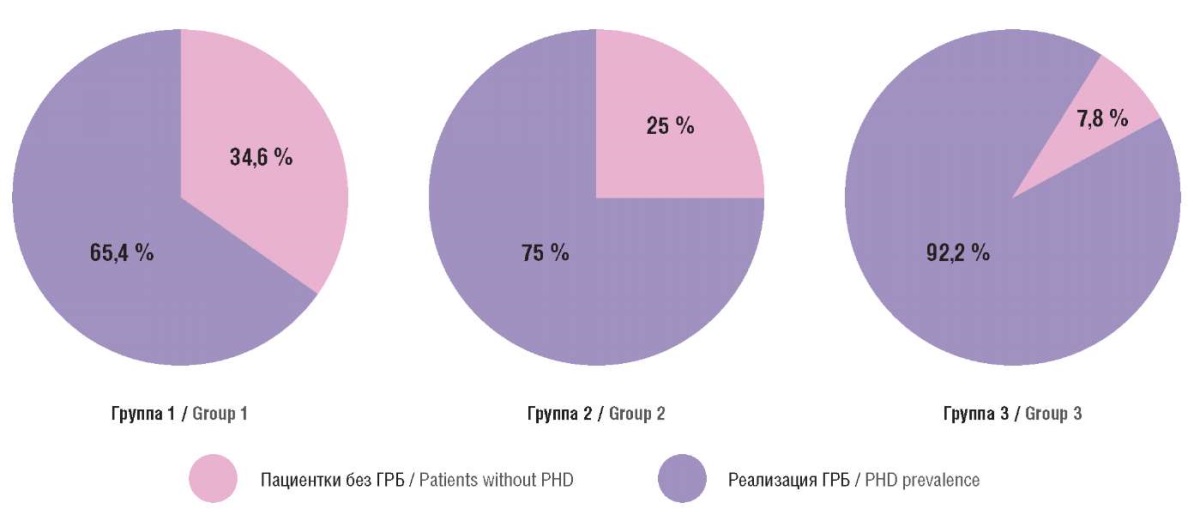
Рисунок 1. Распределение случаев гипертензивных расстройств при беременности (ГРБ)
в группах обследованных.
Figure 1. Distribution of pregnancy hypertensive disorders (РHD) cases in study groups.
Дискриминантный анализ / Discriminant аnalysis
Оценка влияния различных факторов на риск развития ГРБ осуществлялась методом бинарной логистической регрессии, были выявлены наиболее значимые из них и построена статистическая модель прогнозирования. В группе из 308 беременных, прошедших скрининг I триместра и попавших в группу среднего риска (1:101–1:250), был произведен перерасчет риска с вычислением прогностического индекса ГРБ (ПрИГРБ) согласно разработанному алгоритму. В прогностическую модель были включены предикторы с высокой степенью значимости (р < 0,05), представленные в таблице 2.
Таблица 2. Используемые предикторы, оценка (вес) регрессионных коэффициентов
и их статистическая значимость (р).
Table 2. Predictors, regression coefficient assessment (weight) and relevant significance level (p).
|
Предиктор Predictor |
Вес Weight |
Стандартная ошибка (СО) Standard error (SE) |
Z |
p |
|
Индекс массы тела / Body mass index (Х1) |
–0,1 |
0,03 |
–2,94 |
0,003 |
|
Аланинаминотрансфераза / Alanine aminotransferase (Х2) |
–0,05 |
0,01 |
–3,61 |
< 0,001 |
|
Плацентарный фактор роста / Placental growth factor, МоМ (Х3) |
2,52 |
0,53 |
4,7 |
< 0,001 |
|
Среднее артериальное давление / Mean blood pressure, МоМ (Х4) |
–12,5 |
2,3 |
–5,4 |
< 0,001 |
|
Количество беременностей / Number of pregnancies (Х5) |
0,12 |
0,04 |
2,98 |
0,003 |
|
Количество родов / Number of deliveries (Х6) |
0,34 |
0,11 |
3,07 |
0,002 |
|
Константа / Constant |
14,29 |
2,54 |
5,61 |
< 0,001 |
Прогностический индекс гипертензивных расстройств беременности рассчитывается по формуле: ПрИГРБ = 1/(1 + е–Z), где e = 2,718 (константа Эйлера);
Z = –0,1×Х1–0,05×Х2+2,53×Х3–12,5×Х4+0,12×Х5+0,34×Х6+14,29,
где X1 – ИМТ (кг/м²), Х2 – уровень AЛT в I триместре (ЕД/л), Х3 – уровень PLGF в 11–13,6 нед (МоМ), Х4 – уровень среднего АД в 11–13,6 нед (МоМ), Х5 – порядковый номер беременности, Х6 – количество родов, константа = 14,29.
При значении ПрИГРБ ≥ 0,5 – риск высокий, при < 0,5 – риск низкий. По результатам исследования принимается решение о назначении профилактики.
Показатели эффективности представленной модели, рассчитанные с помощью скользящего анализа, указаны в таблице 3.
Таблица 3. Показатели эффективности прогностического правила.
Table 3. Predictive rule efficacy parameters.
|
Показатель Parameter |
Чувствительность (95 % ДИ) Sensitivity (95 % CI) |
Специфичность (95 % ДИ) Specificity (95 % CI) |
Положительная предсказательная ценность (95 % ДИ) Positive predictive value (95 % CI) |
Отрицательная предсказательная ценность (95 % ДИ) Negative predictive value (95 % CI) |
|
Значение Magnitude |
53,62 (41,2–65,72) |
91,26 (86,54–94,74) |
67,27 (55,67–77,09) |
85,4 (76,74–86,19) |
Примечание: ДИ – доверительный интервал.
Note: CI – confidence interval.
Суммарная эффективность модели составила 81,82 (76,64–86,19) %, что соответствует хорошему качеству модели прогнозирования.
Для оценки качества прогностической модели проведен ROC-анализ (рис. 2). Площадь под кривой (AUC) составила 0,856.
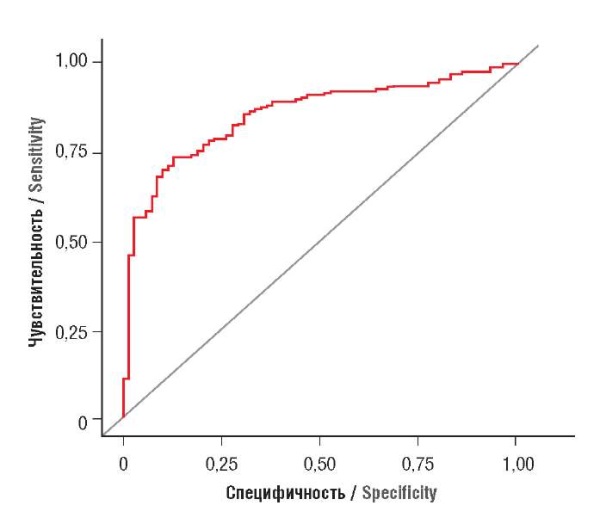
Рисунок 2. ROC-кривая для прогностического индекса
гипертензивных расстройства при беременности (ПрИГРБ).
Figure 2. ROC curve for prognostic index of hypertensive disorders in pregnancy (PrIHDP).
Среднее значение ПрИГРБ составило в группе ГРБ 0,54 (0,42–0,75), в группе без ГРБ – 0,29 (0,13–0,45) (рис. 3). Различия статистически значимы (р < 0,001; U = 3539).
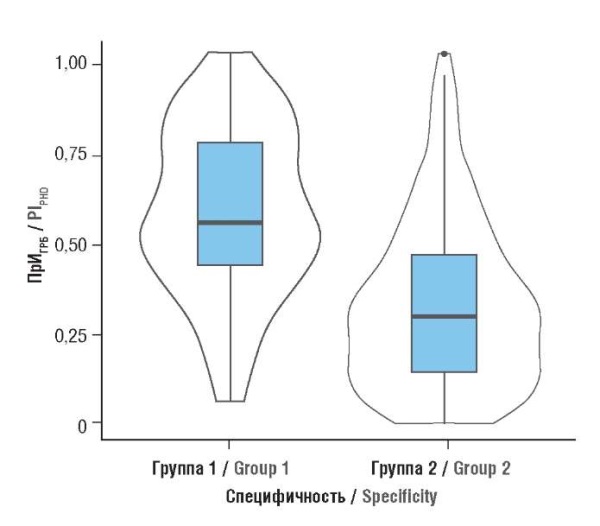
Рисунок 3. Различия прогностического индекса (ПрИГРБ)
в группах с реализацией гипертензивных расстройств при беременности (1)
и нормальным течением беременности (2).
Figure 3. Magnitude of prognostic index (PrIHDP)
related to prevalence of hypertensive disorders during pregnancy (1)
and normal pregnancy course (2).
Обсуждение / Discussion
Неопровержимым является факт, основанный на том, что прогнозирование гипертензивных расстройств при беременности, как и других осложнений группы «больших акушерских синдромов», возможно лишь при использовании комбинации факторов. Но в силу различных патогенетических причин развития ранней и поздней ПЭ, прогнозирование ранней формы данного осложнения беременности имеет более высокую чувствительность, нежели при поздней, что хорошо продемонстрировано не только в исследовании FMF, но и при валидации на российской популяции [27].
Частота развития ГРБ в группе среднего риска или «серой» зоне (1:101–1:250) оказалась существенно ниже, чем в группе высокого риска, но тем не менее составила внушительную когорту в 25 % обследованных пациенток. Это свидетельствует о необходимости дополнительных расчетов степени риска у данного контингента беременных для обоснования необходимости и целесообразности начала профилактических мероприятий.
По данным литературы, большинство пациентов и медицинского персонала положительно относятся к профилактическим мероприятиям; в данном контексте речь идет о препарате ацетилсалициловой кислоты (АСК), который демонстрирует достаточно высокие показатели снижения случаев ПЭ у пациенток высокого риска [22].
Однако любой метод не должен усложняться большим объёмом исследований, он должен быть как и эффективен, так и экономически обоснован, а также легко воспроизводим на большой популяции. Разработанная нами прогностическая модель риска формирования ГРБ может использоваться в качестве теста второй линии в этой группе беременных.
Представленный метод прогнозирования риска ГРБ базируется на результатах расчетов, полученных в ходе проведения обычного комбинированного скрининга I триместра. Охват беременных данным видом скрининга высок в целом и по Российской Федерации; в Свердловской области этот показатель ежегодно составляет 86–88 % среди рано вставших на учет, поэтому представленный тест позволит провести дообследование достаточно большой когорты беременных.
В изученной нами научно-медицинской литературе не обнаружено способа стратификации риска развития ГРБ у беременных, вошедших в группу среднего риска. Тем самым предлагаемый метод прогнозирования является на сегодняшний день единственным способом стратификации рисков гипертензивных расстройств при беременности и может использоваться в клинической практике в качестве теста второй линии.
Сильные и слабые стороны исследования / Study advantages and limitations
По нашему мнению, сильными сторонами предложенной нами прогностической модели являются простота исполнения, доступность включенных в нее показателей, воспроизводимость результатов, отсутствие значимых экономических затрат. Отрицательная сторона представленной прогностической модели состоит в её относительно невысокой специфичности. Однако следует отметить, что хотя алгоритмы программного обеспечения «Astraia» и обладают достаточно высокой заявленной ложноотрицательной прогностической ценностью, на деле не позволяют выявить достаточно большое количество пациенток с ГРБ, помещая их в низкие риски. Предложенный способ, как второй этап обследования, позволит стратифицировать риски у беременных, попавших в зону ложноотрицательных результатов [15][28].
Заключение / Conclusion
В представленном прогностическом алгоритме используются анамнестические, биохимические и инструментальные параметры. Показатели чувствительности и специфичности метода составили соответственно 91,2 и 53,6 %, эффективность – 81,8 %. Предложенный нами тест позволяет охватить большое количество пациенток и своевременно стратифицировать беременных «серой» зоны в группу высокого риска для проведения дополнительных методов обследования и профилактических мероприятий, в частности, таргетного применения препаратов ацетилсалициловой кислоты.
Список литературы
1. Duley L. The global impact of pre-eclampsia and eclampsia. Semin Perinatol. 2009;33(3):130–7. doi: 10.1053/j.semperi.2009.02.010.
2. Trends in maternal mortality 2000 to 2020: estimates by WHO, UNICEF, UNFPA, World Bank Group and UNDESA/Population Division, Overview 2023. World Health Organization, 2023. Режим доступа: www.who.int/publications/i/item/9789240068759. [Дата обращения: 02. 10. 2023].
3. Сидорова И.С., Никитина Н.А., Филиппов О.С. и др. Решенные и нерешенные вопросы преэклампсии по результатам анализа материнской смертности за последние 10 лет. Акушерство и гинекология. 2021;(4):64–74. doi: 10.18565/aig.2021.4.64-74.
4. Than N.G., Romero R., Tarca A.L. et al. Integrated systems biology approach identifies novel maternal and placental pathways of preeclampsia. Front Immunol. 2018;9:1661. doi: 10.3389/fimmu.2018.01661.
5. Romero R. Prenatal medicine: the child is the father of the man. 1996. J Matern Fetal Neonatal Med. 2009;22(8):636–9. doi: 10.1080/14767050902784171.
6. Kessous R., Shoham-Vardi I., Pariente G. et al. Long-term maternal atherosclerotic morbidity in women with pre-eclampsia. Heart. 2015;101(6):442–6. doi: 10.1136/heartjnl-2014-306571.
7. Brouwers L., van der Meiden-van Roest A.J., Savelkoul C. et al. Recurrence of pre-eclampsia and the risk of future hypertension and cardiovascular disease : a systematic review and meta-analysis. BJOG. 2018;125(13):1642–54. doi: 10.1111/1471-0528.15394.
8. Sukmanee J., Liabsuetrakul T. Risk of future cardiovascular diseases in different years postpartum after hypertensive disorders of pregnancy : а systematic review and meta-analysis. Medicine. 2022;101(30):e29646. doi: 10.1097/MD.0000000000029646.
9. Долгополова Е.Л., Ломова Н.А., Караваева А.Л. и др. Тяжелая преэклампсия и задержка роста плода: отдаленные прогнозы для матерей и потомства. Акушерство и гинекология. 2020;(12):100–7. doi: 10.18565/aig.2020.12.100-107.
10. Yan S., Lyu J., Liu Z. et al. Association of gestational hypertension and preeclampsia with offspring adiposity : a systematic review and meta-analysis. Front Endocrinol. 2022;13:906781. doi: 10.3389/fendo.2022.906781.
11. Huang C., Li J., Qin G. et al. Maternal hypertensive disorder of pregnancy and offspring early-onset cardiovascular disease in childhood, adolescence, and young adulthood: a national population-based cohort study. PLoS Med. 2021;18(9):e1003805. doi: 10.1371/journal.pmed.1003805.
12. Karatza A.A., Dimitriou G. Preeclampsia emerging as a novel risk factor for cardiovascular disease in the offspring. Curr Pediatr Rev. 2020;16(3):194–9. doi: 10.2174/1573396316666191224092405.
13. NICE Clinical Guideline. Hypertension in pregnancy: diagnosis and management. National Institute for Health and Care Excellence (NICE), 2023. 62 p. Режим доступа: https://www.nice.org.uk/guidance/ng133/resources/hypertension-in-pregnancy-diagnosis-and-management-pdf-66141717671365. [Дата обращения: 02. 10. 2023].
14. AGOG practice advisory: low-dose aspirin use for the prevention of preeclampsia and related morbidity and mortality. AGOG, 2021. Режим доступа: https://www.acog.org/clinical/clinical-guidance/practice-advisory/articles/2021/12/low-dose-aspirin-use-for-the-prevention-of-preeclampsia-and-related-morbidity-and-mortality. [Дата обращения: 02. 10. 2023].
15. Poon L.C., Kametas N.A., Maiz N. et al. First-trimester prediction of hypertensive disorders in pregnancy. Hypertension. 2009;53(5):812–8. doi: 10.1161/HYPERTENSIONAHA.108.127977.
16. O'Gorman N., Wright D., Poon L.C. et al. Multicenter screening for pre-eclampsia by maternal factors and biomarkers at 11-13 weeks' gestation: comparison with NICE guidelines and ACOG recommendations. Ultrasound Obstet Gynecol. 2017;49(6):756–60. doi: 10.1002/uog.17455.
17. Poon L.C., Stratieva V., Piras S. et al. Hypertensive disorders in pregnancy: combined screening by uterine artery Doppler, blood pressure and serum PAPP-A at 11-13 weeks. Prenat Diagn. 2010;30(3):216–23. doi: 10.1002/pd.2440.
18. Wright D., Akolekar R., Syngelaki A. et al. A competing risks model in early screening for preeclampsia. Fetal Diagn Ther. 2012;32(3):171–8. doi: 10.1159/000338470.
19. Tan M.Y., Wright D., Syngelaki A. et al. Comparison of diagnostic accuracy of early screening for pre-eclampsia by NICE guidelines and a method combining maternal factors and biomarkers: results of SPREE. Ultrasound Obstet Gynecol. 2018;51(6):743–50. doi: 10.1002/uog.19039.
20. Poon L.C., Shennan A., Hyett J.A. et al. The International Federation of Gynecology and Obstetrics (FIGO) initiative on pre-eclampsia: a pragmatic guide for first-trimester screening and prevention. Int J Gynaecol Obstet. 2019;145 Suppl 1(Suppl 1):1–33. doi: 10.1002/ijgo.12802.
21. Приказ Минздрава России от 20. 10. 2020 N 1130н «Об утверждении Порядка оказания медицинской помощи по профилю "акушерство и гинекология"». М.: Министерство здравоохранения Российской Федерации, 2020. 688 с. Режим доступа: http://perinatcentr.ru/files/N_1130.pdf. [Дата обращения: 02. 10. 2023].
22. Rolnik D.L., Wright D., Poon L.C. et al. ASPRE trial: performance of screening for preterm pre-eclampsia. Ultrasound Obstet Gynecol. 2017;50(4):492–5. doi: 10.1002/uog.18816.
23. Wright D., Poon L.C., Rolnik D.L. et al. Aspirin for Evidence-Based Preeclampsia Prevention trial: influence of compliance on beneficial effect of aspirin in prevention of preterm preeclampsia. Am J Obstet Gynecol. 2017;217(6):685.e1–685.e5. doi: 10.1016/j.ajog.2017.08.110.
24. Кудрявцева Е.В., Канивец И.В., Киевская Ю.К. и др. Неинвазивный пренатальный тест в России: популяционное исследование. Акушерство и гинекология. 2019;(12):28–33. doi: 10.18565/aig.2019.12.30-35.
25. Кудрявцева Е.В., Ковалев В.В., Николаева Е.Б., Дектярев А.А. Неинвазивный пренатальный скрининг: первый опыт Свердловской области. Уральский медицинский журнал. 2019;15(183):78–81. URL: https://www.elibrary.ru/item.asp?id=41589641&ysclid=lwbzesv5a2697312447.
26. Morain S., Greene M.F., Mello M.M. A new era in noninvasive prenatal testing. N Engl J Med. 2013;369(6):499–501. doi: 10.1056/NEJMp1304843.
27. Холин А.М., Муминова К.Т., Балашов И.С. и др. Прогнозирование преэклампсии в первом триместре беременности: валидация алгоритмов скрининга на российской популяции. Акушерство и гинекология. 2017;(8):74–84. doi: 10.18565/aig.2017.8.74-84.
28. Parra-Cordero M., Rodrigo R., Barja P. et al. Prediction of early and late pre-eclampsia from maternal characteristics, uterine artery Doppler and markers of vasculogenesis during first trimester of pregnancy. Ultrasound Obstet Gynecol. 2013;41(5):538–44. doi: 10.1002/uog.12264.
Об авторах
Н. В. МостоваРоссия
620067; ул. Флотская, д. 52; Екатеринбург
В. В. Ковалев
Россия
620028; ул. Репина, д. 3; Екатеринбург
Е. В. Кудрявцева
Россия
620067; ул. Флотская, д. 52;; 620028; ул. Репина, д. 3; Екатеринбург
Что уже известно об этой теме?
► Преэклампсия (ПЭ) – это ведущая причина критических ситуаций и материнской смертности в мире.
► Прогнозирование любого заболевания беременности позволяет минимизировать осложнения.
► Существуют алгоритмы расчета риска ПЭ, однако они сопряжены с большим количеством ложноотрицательных результатов.
Что нового дает статья?
► Разработан алгоритм расчета риска для пациенток пограничной зоны риска.
► В представленном способе прогнозирования учитываются анамнестические данные, показатели скрининга I триместра, а также биохимического анализа крови.
Как это может повлиять на клиническую практику в обозримом будущем?
► Разработанный алгоритм прогнозирования гипертензивных расстройств при беременности может использоваться в практике акушера-гинеколога для стратификации пациенток, имеющих пограничные с высоким риски. Это позволит оптимизировать тактику ведения беременности, а также назначения профилактической или таргетной терапии.
Рецензия
Для цитирования:
Мостова Н.В., Ковалев В.В., Кудрявцева Е.В. Прогнозирование гипертензивных расстройств при беременности у пациенток в «серой» зоне риска по результатам комбинированного скрининга I триместра. Акушерство, Гинекология и Репродукция. 2024;18(2):200-210. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.454
For citation:
Mostova N.V., Kovalev V.V., Kudryavtseva E.V. Prediction of hypertensive disorders in pregnant women in the «gray» risk zone following combined first-trimester screening. Obstetrics, Gynecology and Reproduction. 2024;18(2):200-210. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.454

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































