Перейти к:
Возможности применения искусственного интеллекта в современной гинекологии
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.511
Аннотация
Введение. Искусственный интеллект (ИИ) - это технология, которая имитирует обработку данных человеческим мозгом, его интеллектуальное поведение и критическое мышление. Сложные модели ИИ потенциально могут улучшить процесс ведения пациентов за счет ускорения процессов и повышения их точности и эффективности при меньших затратах человеческого ресурса. Применение ИИ в гинекологии все еще находится на ранней стадии по сравнению с другими специальностями. Важно понимать, что доступные методы клинической визуализации имеют определенные ограничения, а именно, рабочую нагрузку клинициста и вариабельность интерпретации результатов различными врачами. ИИ, в свою очередь, обладает потенциалом для преодоления этих ограничений при одновременном повышении точности диагностики.
Цель: структурировать и проанализировать современные литературные данные, посвященные использованию ИИ в гинекологии.
Материалы и методы. Поиск первоисточников проводился в электронных базах данных PubMed, eLibrary и Google Scholar. Поисковые запросы включали следующие ключевые слова на русском и английском языках: «искусственный интеллект», «гинекология», «рак эндометрия», «эндометриоз», «рак яичников», «диагностика», «онкогинекология», «artificial intelligence», «gynecology», «endometrial cancer», «endometriosis», «ovarian cancer», «diagnostics», «oncogynecology». Временной интервал поиска: с февраля 2014 г. по февраль 2024 г. Оценка статей проводилась в соответствии с рекомендациями PRISMA. После проведения идентификации, до этапа скрининга, исключали дубликаты. На этапе скрининга авторами анализировались названия и аннотации обнаруженных статей на соответствие теме настоящего обзора, а также на наличие полнотекстового варианта; тезисы и письма в редакции научных журналов на этом этапе исключались. На приемлемость оценивали 685 полнотекстовых статей, критериями включения явились: публикация на русском или английском языках; в исследовании описано использование технологий ИИ в диагностике или лечении гинекологических заболеваний. Все разногласия между авторами разрешались путем консенсуса. В конечном итоге в настоящий обзор было включено 80 первоисточников.
Результаты. Системы на основе ИИ преуспели в анализе и интерпретации изображений и за последнее десятилетие стали мощными инструментами, которые произвели революцию в области гинекологической визуализации. В проанализированных исследованиях ИИ смог обеспечить более быстрые и точные прогнозы и диагностику, повысив общую эффективность гинекологической помощи. Важно отметить, что ИИ не может в полной мере заменить врачей, однако он может идеально интегрироваться в клиническую практику, помогая в процессе принятия решений, уменьшая ошибки дифференциальной диагностики и вариативность взаимодействия между различными специалистами. В области онкогинекологии, несомненно, одним из наиболее многообещающих аспектов является возможность более качественного и особенно раннего установления диагноза и, в конечном счете, улучшение выживаемости пациентов.
Заключение. На данный момент достигнуты огромные успехи, и в ближайшие несколько лет ожидается только большее развитие ИИ. На самом деле предстоит пройти еще очень долгий путь, прежде чем технологии, основанные на ИИ, будут полностью интегрированы в клиническую практику.
Ключевые слова
Для цитирования:
Шайлиева Ш.Л., Мамчуева Д.Х., Вишневская А.П., Джалаева Х.Ш., Рамазанова Э.Г., Кокаева Я.Р., Елоева З.М., Айсанова Д.Р., Виноградова А.С., Туко Р.Р., Синева А.В., Валиуллина Л.А., Куцева А.А. Возможности применения искусственного интеллекта в современной гинекологии. Акушерство, Гинекология и Репродукция. 2024;18(4):563-580. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.511
For citation:
Shailieva Sh.L., Mamchueva D.Kh., Vishnevskaya A.P., Dzhalaeva Kh.Sh., Ramazanova E.G., Kokaeva Y.R., Eloeva Z.M., Aisanova D.R., Vinogradova A.S., Tuko R.R., Sineva A.V., Valiullina L.A., Kutseva A.A. An opportunity for using artificial intelligence in modern gynecology. Obstetrics, Gynecology and Reproduction. 2024;18(4):563-580. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.511
Введение / Introduction
За последние годы интерес к изучению технологий искусственного интеллекта (ИИ) и возможности их применения в медицинской практике значительно возросли [1]. Системы, основанные на ИИ, успешно применяются в ряде различных областей медицины, особенно в сфере лучевой диагностики [2], открывая широкие возможности для более эффективного использования медицинской визуализации [3].
Искусственный интеллект – это технология, которая имитирует обработку данных человеческим мозгом, его интеллектуальное поведение и критическое мышление [4]. Сложные модели ИИ потенциально могут улучшить процесс ведения пациентов за счет ускорения процессов и повышения их точности и эффективности при меньших затратах человеческого ресурса [5]. ИИ доказал свои преимущества в диагностике и лечении заболеваний, организации здравоохранения, разработке лекарственных средств и прецизионной медицине [6]. Тем не менее применение ИИ в гинекологии все еще находится на ранней стадии по сравнению с другими специальностями. Важно понимать, что доступные методы клинической визуализации имеют определенные ограничения, а именно, рабочую нагрузку клинициста и вариабельность интерпретации результатов различными врачами. ИИ, в свою очередь, обладает потенциалом для преодоления этих ограничений при одновременном повышении точности диагностики [7]. Кроме того, ИИ обладает огромным и признанным потенциалом для оказания содействия в выполнении повторяющихся задач, таких как автоматическая идентификация изображений хорошего качества и выявление паттернов визуализации [8].
Цель: структурировать и проанализировать современные литературные данные, посвященные использованию ИИ в гинекологии.
Материалы и методы / Materials and Methods
Поиск первоисточников проводился в электронных базах данных PubMed, eLibrary и Google Scholar. Поисковые запросы включали следующие ключевые слова на русском и английском языках: «искусственный интеллект», «гинекология», «рак эндометрия», «эндометриоз», «рак яичников», «диагностика», «онкогинекология», «artificial intelligence», «gynecology», «endometrial cancer», «endometriosis», «ovarian cancer», «diagnostics», «oncogynecology». Временной интервал поиска: с февраля 2014 г. по февраль 2024 г.
Оценка статей проводилась в соответствии с рекомендациями PRISMA. После проведения идентификации, до этапа скрининга, исключали дубликаты. На этапе скрининга авторами анализировались названия и аннотации обнаруженных статей на соответствие теме настоящего обзора, а также на наличие полнотекстового варианта; тезисы и письма в редакции научных журналов на этом этапе исключались. На приемлемость оценивали 685 полнотекстовых статей, критериями включения явились: публикация на русском или английском языках; в исследовании описано использование технологий ИИ в диагностике или лечении гинекологических заболеваний. Все разногласия между авторами разрешались путем консенсуса. В конечном итоге в настоящий обзор было включено 80 первоисточников. Алгоритм отбора проиллюстрирован на рисунке 1.
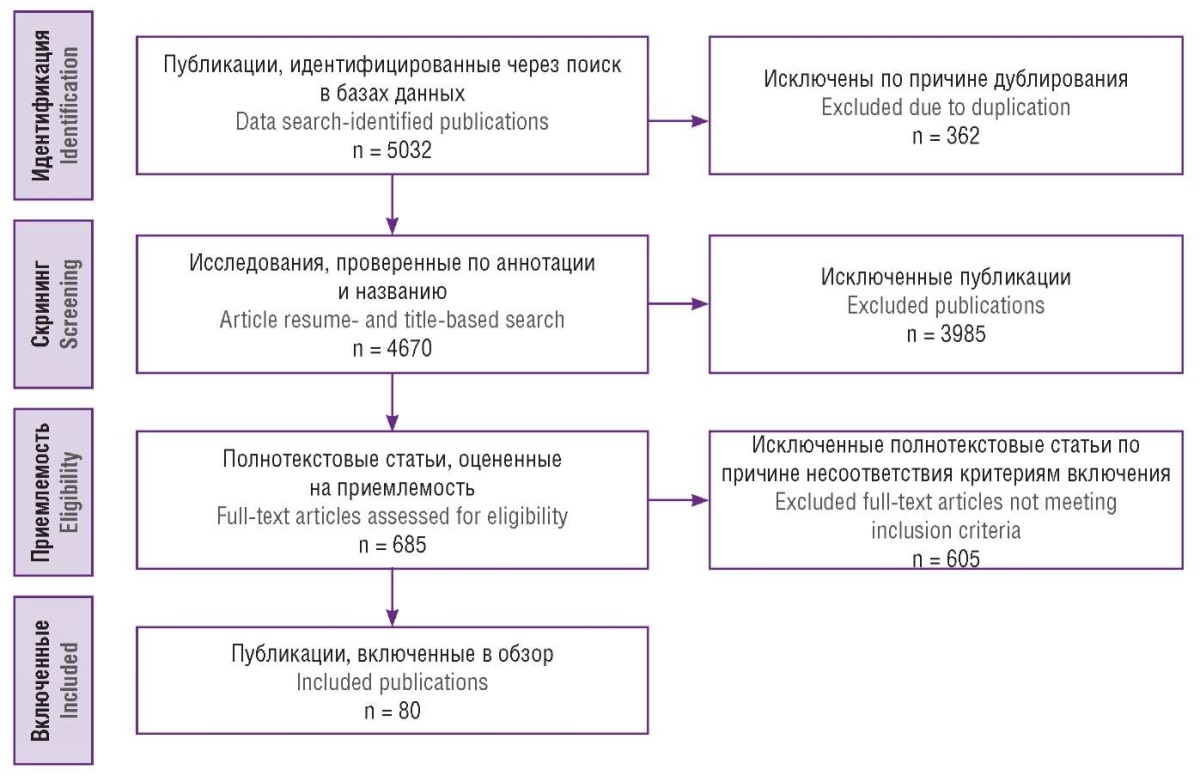
Рисунок 1. Алгоритм отбора первоисточников.
Figure 1. Study search algorithm.
Результаты / Results
Искусственный интеллект (основные понятия) / Artificial intelligence (basic concepts)
При обсуждении концепции ИИ и его подмножеств важно уточнить, что ИИ, машинное обучение (МО) и глубокое обучение (ГО) являются пересекающимися понятиями [9]. Фактически, компьютерные алгоритмы МО автоматически разрабатываются на основе входных обучающих данных для распознавания закономерностей в больших базах данных [10]. Таким образом, эти модели представляются высокоэффективными инструментами для прогнозирования будущих результатов на основе новых непредвиденных данных и принятия решений в различных медицинских специальностях. Кроме того, модели могут быть определены по мере постоянного добавления новых данных.
Алгоритмы МО могут быть как контролируемыми, так и неконтролируемыми [11]. Контролируемый алгоритм использует набор данных, содержащий входные объекты, помеченные в начале обучения, для изучения отображения и установления значимых взаимосвязей между входными данными и соответствующими выходными данными, а также для создания модели, способной различать выходные метки. Затем обученная модель принимает новые, свежие, невидимые данные и делает прогнозы или классификации на основе знаний из помеченных примеров [12]. Таким образом, эти модели сильно зависят от качества помеченных данных. Более того, как только модель разработана, она тестируется на данных нового пациента, помимо тех, которые были включены в обучающие данные, чтобы определить ее применимость к другим людям или клиническим ситуациям [13]. Неконтролируемые модели МО – это системы, управляемые данными, которые автоматически обучаются на основе взаимосвязей между элементарными битами информации, связанными с каждой переменной набора данных. В отличие от контролируемого МО, неконтролируемые методы выявляют ассоциации или кластеры, существующие в наборах данных и шаблонах моделей, без каких-либо предопределенных выходных данных [14]. Неконтролируемое обучение может дополнять контролируемое МО. Поскольку эти методы могут обнаруживать потенциально нераспознанные паттерны из больших баз данных, они могут использоваться в контролируемых алгоритмах, которые, в свою очередь, будут создавать новые модели для различения интересующих классов [12].
Альтернативно, ГО является подмножеством МО. Свёрточные нейронные сети (СНС) представляют собой сложную многослойную архитектуру, нацеленную на эффективное распознавание образов, входят в состав технологий ГО. СНС используют некоторые особенности зрительной коры, где взаимосвязанные нейроны обрабатывают и передают информацию [15]. Поэтому они особенно приспособлены к задачам, связанным с визуальными образами.
Алгоритмы ИИ, а именно, ГО и СНС, имеют большие перспективы в области медицинской визуализации: от распознавания, обработки и реконструкции изображений до автоматизированного анализа и классификации [16]. Таким образом, они вносят большой вклад в дисциплины, которые в значительной степени полагаются на изображения, и гинекология могла бы стать перспективным направлением разработки и применения моделей ИИ.
Возможности применения ИИ в гинекологии / An opportunity for using AI in gynecology
Рак шейки матки / Cervical cancer
В Российской Федерации (РФ) рак шейки матки (РШМ) в общей структуре онкологической заболеваемости занимает 4-е ранговое место, а среди органов репродуктивной системы – 2-е место (13,3 %), уступая раку молочной железы (47,8 %) [17]. В 2017 г. РШМ на территории РФ в структуре смертности от злокачественных новообразований занял 10-е ранговое место, данный показатель составил 5,18 ‰; летальность на первом году с момента установления диагноза составила 14,6 % [18]. Важно отметить, что РШМ легко поддается лечению при его раннем выявлении. В повседневной практике скрининг РШМ проводится с применением тестирования на вирус папилломы человека (ВПЧ) и цитологического исследования. Таким образом, результаты скрининга в значительной степени зависят от опыта специалиста, проводящего исследование. Кольпоскопия также является важным компонентом выявления РШМ. Однако из-за возросшей нагрузки на врачей визуальный скрининг нередко приводит к ошибочному диагнозу и низкой точности диагностики [19]. Несколько авторов описывали потенциал использования ИИ в цитологическом исследовании, а также в анализе изображений, полученных при кольпоскопии. ИИ позволяет выявлять аномальные клетки или поражения, тем самым улучшая скрининг и диагностику РШМ [20]. Подход «see and treat» («смотри и лечи») позволяет проводить более раннее и эффективное лечение поражений с использованием малоинвазивных процедур, включая термокоагуляцию, снижая смертность [21], одновременно уменьшая потребность в патологоанатомическом исследовании биопсийного материала.
Первыми, кто изучил внедрение модели ИИ в диагностику РШМ методом кольпоскопии, были G. Mehlhorn с соавт. [22]. Авторы разработали компьютерное диагностическое устройство (КДУ), основанное на методах обработки изображений, для автоматического анализа кольпоскопических изображений. Разработанная система КДУ показала диагностическую точность 80 %, чувствительность 85 % и специфичность 75 % в дифференциальной диагностике слабой цервикальной дисплазии, цервикальной интраэпителиальной неоплазии I степени (англ. cervical intraepithelial neoplasia grade I, CIN1) и плоскоклеточных интраэпителиальных поражений высокой степени (англ. high-grade squamous intraepithelial lesions, HSILs) – CIN2 или CIN3 при кольпоскопии [22]. Другое исследование, проведенное той же исследовательской группой, подтвердило преимущество применения КДУ при оценке результатов кольпоскопии, продемонстрировав повышение точности диагностики, когда обследование оценивал молодой специалист с небольшим опытом [23]. P. Bountris с соавт. разработали и обучили систему поддержки принятия врачебных решений (СППВР), основанную на искусственной нейронной сети, для сортировки 740 женщин перед направлением на кольпоскопию; сортировка была основана на результатах цитологического исследования и экспрессии различных биомаркеров [24]. Для проведения кольпоскопии были отобраны женщины с выявленной цервикальной интраэпителиальной неоплазией 2 степени (CIN2+) или выше. СППВР показала чувствительность 89,4 %, специфичность 97,1 %, положительное прогностическое значение 89,4 % и отрицательное прогностическое значение 97,1 %. При применении в клинической практике эта система потенциально может снизить количество кольпоскопических исследований.
M. Sato с соавт. первыми разработали предварительную модель ГО на основе нейронной сети Keras с 485 изображениями от 158 пациенток, прошедших кольпоскопию [25]. Была предпринята попытка классифицировать изображения кольпоскопии и установить предварительный диагноз с использованием СНС. Пациенты были разделены на 3 группы: тяжелая дисплазия, карцинома in situ(англ. carcinoma in situ, CIS) и инвазивный рак (англ. invasive carcinoma, IC). Целью авторов явилась оценка осуществимости и полезности применения ИИ в клинической практике как быстрого и эффективного способа получения точного предоперационного диагноза, который мог бы помочь врачам в процессе принятия клинических решений. Точность модели в этом наборе данных достигла 50 % [25].
M.N. Asiedu с соавт. извлекли цветовые и текстурные признаки из визуального осмотра с помощью уксусной кислоты и раствора Люголя, а затем использовали эти данные для обучения модели машины опорных векторов (англ. support vector machines, SVM), позволяющей отличать CIN от нормальной ткани и доброкачественных опухолей [26]. Предложенная система обеспечила чувствительность, специфичность и точность 81,3 %, 78,6 % и 80,0 % соответственно, достигнув большей эффективности по сравнению со специалистами, использующими тот же набор данных. Y. Miyagi с соавт. разработали CНС для классификации плоскоклеточных интраэпителиальных поражений шейки матки на основе кольпоскопических изображений 330 пациенток: 97 из них имели плоскоклеточные интраэпителиальные поражения низкой степени тяжести (англ. low-grade squamous intraepithelial lesions, LSILs) и 213 HSILs; всем пациенткам была проведена кольпоскопия и биопсия пораженного участка [27]. СНС дифференцировали HSIL от LSIL с более высокой точностью (82,3 % против 79,7 %) и специфичностью (88,2 % против 77,3 %), хотя и с несколько меньшей чувствительностью (80,0 % против 83,1 %) по сравнению с кольпоскопией и биопсией. Исследование, проведенное этим же авторским коллективом в 2020 г., включало результаты ВПЧ-теста [28]. Обученная СНС показала точность 94,1 %, что превышает общемировой показатель точности гинекологов в 84,3 %. Это исследование было одним из первых, в которое были включены дополнительные переменные с целью повышения диагностической точности СНС.
В 2020 г. C. Yuan с соавт. работали над базой данных, состоящей из 22330 случаев, включая 10365 случаев без патологии, 6357 случаев LSILs и 5608 случаев HSILs [29]. Основываясь на наборе данных из трех кадров на случай, авторы разработали остаточную сеть (англ. Residual Network, ResNet) СНС для различения нормы и диспластических поражений (LSILs или HSILs). СНС показала чувствительность 85 %, специфичность 82 % и точность 93 %. Кроме того, авторы разработали U-Net СНС, способную определять границы плоскоклеточных поражений (LSILs или HSILs). Модель имела чувствительность 84,7 % на изображениях с уксусной кислотой и 61,6 % на изображениях с раствором Люголя. Эти модели определения границ поражения имеют первостепенное значение для проведения биопсии на основе кольпоскопии. Наконец, авторы разработали модель СНС MASK-R для выявления HSIL. Модель выявляла HSIL с чувствительностью 84,7 % как на изображениях с уксусной кислотой, так и на изображениях с раствором Люголя, точно идентифицируя пораженные участки.
P. Xue с соавт. провели исследование по разработке и валидации вспомогательной диагностической системы кольпоскопического ИИ (англ. Colposcopic Artificial Intelligence Auxiliary Diagnostic System, CAIADS) с использованием цифровых записей 19435 пациентов, включая изображения, полученные при кольпоскопии, и результаты патологоанатомических исследований [30]. По результатам исследования точность CAIADS была выше, чем при ручной интерпретации кольпоскопии (82,2 % против 65,9 %). Модель CAIADS смогла повысить свою диагностическую точность после учета факторов, связанных с пациентами (таких, как предыдущие результаты цитологического исследования). Новая модель также продемонстрировала превосходную способность прогнозировать участки для проведения биопсии, при этом медиана степени пересечения между двумя ограничивающими рамками (англ. median mean intersection over union, mIoU) составила 0,758.
В 2021 г. L. Fu с соавт. намеревались создать модель, включающую результаты ВПЧ-теста, цитологического и кольпоскопического исследований [31]. Прежде всего, авторы получили изображения кольпоскопии и создали модель ГО на основе нескольких изображений, используя многофакторную логистическую регрессию (англ. multivariable logistic regression, MLR), представляющую площадь под кривой (англ. area under the curve, AUC), равную 0,845. Затем результаты цитологического теста и ВПЧ-теста были использованы для построения модели МО с AUC = 0,837. Наконец, авторы построили кросс-модальную интегрированную модель с использованием МО, объединив модель ГО на основе множественных изображений и совместную диагностическую модель цитологии и ВПЧ-теста. Авторы доказали синергетические преимущества объединенной модели, представив более высокий показатель AUC, равный 0,921 [31]. Метод классификации предраковых поражений шейки матки на основе ShuffleNet, основанный на кольпоскопических изображениях, был разработан S. Fang с соавт. [32]. Набор данных изображений был разделен на 5 категорий, а именно: норма, РМШ, LSILs (CIN1), HSILs (CIN2/CIN3) и новообразование шейки матки. В этом наборе данных изображения кольпоскопии были расширены, чтобы уменьшить влияние неравномерного распределения между категориями поражений; кроме того, сеть ShuttleNet сравнивалась с другими СНС (такими, как RestNet или DenseNet). Новая модель СНС продемонстрировала глобальную точность 81,23 % при AUC = 0,99. В недавнем исследовании X. Chen с соавт. собрали изображения из 6002 кольпоскопических исследований, включая отсутствие патологии и LSILs/HSILs [33]. Для точной идентификации HSIL была разработана новая модель, основанная на EfficcientNet-B0 с использованием рекуррентного блока Gate. СНС показала чувствительность в 93,6 %, специфичность 87,6 % и точность 90,6 % при дифференцировке изображений HSIL, LSIL и нормальной шейки матки.
Кроме того, диагноз РШМ также может быть поставлен с помощью магнитно-резонансной томографии (МРТ). A. Urushibara с соавт. провели исследование, включавшее 418 пациенток: 177 пациенток с гистологически подтвержденным РШМ и 241 здоровую пациентку, которые прошли МРТ в период с 2013 по 2020 гг. [34]. Авторы сравнили эффективность архитектуры ГО, называемой Exception, с эффективностью врачей-рентгенологов в диагностике РШМ на сагиттальных Т2-взвешенных изображениях (T2-ВИ). По результатам исследования СНС продемонстрировала более высокую чувствительность (88,3 % против 78,3–86,7 %) и точность (90,8 % против 86,7–89,2 %) при аналогичной специфичности.
Разработка моделей ИИ для диагностики РШМ также может осуществляться на гистологическом уровне. N. Sompawong с соавт. применили MaskR-СНС для анализа клеток шейки матки путем оценки аномальных ядерных признаков на гистологических препаратах [35]. Предложенный алгоритм достиг точности 91,7 %, чувствительности 91,7 % и специфичности 91,7 %. P. Sanyal с соавт. обучили СНС выявлять аномальные признаки по мазкам жидкостной цитологии (англ. liquid-based cytology, LBC), используя 2816 изображений: 816 с аномальными признаками, указывающими на LSIL или HSIL, и 2000 изображений, содержащих доброкачественные эпителиальные клетки и реактивные изменения [36]. Упомянутая модель показала чувствительность 95,6 % при специфичности 79,8 %. Кроме того, ее высокая отрицательная прогностическая ценность в 99,1 % делает ее потенциально ценным инструментом для скрининга РШМ. Технологическое развитие сопровождалось многоцентровым обсервационным исследованием, в котором анализировалась эффективность оценки цитологии с помощью ИИ для выявления CIN или рака [37]. Авторы использовали 188542 цифровых цитологических изображения для обучения контролируемого алгоритма ГО. Модель ГО выявила 92,6 % CIN2 и 96,1 % CIN3, продемонстрировав эквивалентную чувствительность, но более высокую специфичность по сравнению со специалистами-цитологами.
В когортном исследовании, включавшем 700 тыс. женщин, оценивалась эффективность системы Landing Cyto Scanner®, которая основана на ИИ [38]. В исследовании сравнивалась эффективность ручной оценки гистологического и кольпоскопического исследований с эффективностью ИИ. Коэффициент совпадения между ИИ и показаниями, полученными вручную, составил 94,7 %, а значение kappa составило 0,92. Большое количество проанализированных изображений способствовало высокой достоверности исследования, учитывая способность ИИ исключать большинство результатов цитологических исследований без патологии с повышенной чувствительностью по сравнению с ручной сортировкой. Результаты данного исследования подтверждают возможность использования Landing Cyto Scanner® для первичного скрининга РШМ [38]. Совсем недавно китайская группа ученых изучала диагностические характеристики жидкостной цитологии с применением ИИ (англ. artificial intelligence-enabled liquid-based cytology, AI-LBC) при сортировке женщин с ВПЧ [39]. AI-LBC достигла чувствительности в идентификации CIN2+, сравнимой с таковой у опытных специалистов (86,49 % против 83,78 %), но значительно более высокой по специфичности (51,33 % против 40,93 %). Аналогичные результаты наблюдались для CIN3+. Более того, AI-LBC сократила количество направлений на кольпоскопию на 10 % по сравнению с врачами, что сделало процесс диагностики более эффективным за счет уменьшения количества ложноположительных результатов при цитологическом исследовании. Несмотря на наличие обнадеживающих результатов, необходимо проведение дополнительных исследований, направленных на оценку разработанной модели.
Чтобы повысить точность диагностики поражений шейки матки, были оценены новые методы получения изображений. Эндомикроскопия высокого разрешения (англ. high-resolution endomicroscopy, HRME) состоит из волоконно-оптического флуоресцентного микроскопа, способного получать изображения ядер in vivo. D. Brenes с соавт. использовали набор данных изображений от более чем 1600 пациентов для обучения, валидации и тестирования алгоритма СНС для диагностики случаев CIN2+ по изображениям HRME [40]. Предлагаемый метод неизменно превосходил существующие методы, являющиеся «золотым стандартом», достигая точности 87 %, чувствительности 94 % и специфичности 58 %. Благодаря включению результатов ВПЧ-теста, специфичность возросла до 71 %.
Наконец, ИИ-модели также могут предоставлять прогностическую информацию, определяющую дальнейшую терапию. K. Matsuo с соавт. сравнили эффективность модели ГО с четырьмя моделями анализа выживаемости, включая модель регрессии пропорциональных рисков Кокса [41]. В исследовании приняли участие 768 женщин, средний срок наблюдения составил 40,2 мес. Предложенная модель продемонстрировала превосходную производительность, превзойдя модели прогнозирования общей выживаемости, однако продемонстрировала аналогичные результаты в прогнозировании выживаемости без прогрессирования заболевания. Прогностическая информация, полученная с использованием алгоритмов ГО, также была проанализирована в ретроспективном исследовании, в котором оценивали 431 женщину с РШМ, 157 из которых имели рецидивирующее течение [42]. Трех- и 6-месячная выживаемость после рецидива сравнивались между текущим подходом (модель линейной регрессии) и экспериментальным подходом, предложенным авторами (модель нейронной сети ГО). Исходные данные модели ГО включали некоторые клинические и лабораторные параметры и позволили значительно улучшить прогноз 3-месячной (AUC = 0,747 против 0,652) и 6-месячной (AUC = 0,724 против 0,685) выживаемости. Более точные прогнозы продолжительности жизни женщин с рецидивирующим РШМ открывают путь для принятия еще более персонализированных клинических решений, помогая клиницистам индивидуально корректировать объем и характер оказываемой медицинской помощи.
Рак эндометрия / Endometrial cancer
Рак эндометрия является наиболее распространенным гинекологическим злокачественным новообразованием в развитых странах, распространенность которого неуклонно растет [43]. Обычно заболевание диагностируется на ранней локализованной стадии на фоне кровотечения в постменопаузе. Тем не менее случаи запущенного рака эндометрия имеют неблагоприятный прогноз [44]. Кроме того, цитологическое исследование эндометрия не является экономически эффективным методом скрининга из-за большого количества ложноотрицательных результатов. В этом контексте алгоритмы ИИ представляют собой полезный инструмент либо для автоматической классификации гистероскопических или гистопатологических изображений, необходимых для диагностики рака эндометрия, либо для планирования тактики оперативного лечения.
M.S. Neofytou с соавт. первыми разработали КДУ-систему для классификации гистероскопических изображений на основе анализа цвета и текстуры [45]. В общей сложности у 40 пациенток было выделено 418 интересующих областей, и эти данные были использованы для обучения двух классификаторов: вероятностной нейронной сети (ВНС) и модели SVM. Модель SVM достигла самого высокого процента (79 %) правильной дифференцировки между нормальной и аномальной тканью эндометрия [45]. A.A. Vlachokosta с соавт. разработали нейронную сеть для классификации гистероскопических изображений эндометрия путем оценки сосудов эндометрия и особенностей текстуры [46]. Для выбора признаков авторы использовали метод нечёткой кластеризации C-средних. В исследование были включены в общей сложности 28 пациенток с аномальными маточными кровотечениями, 10 пациенток с раком эндометрия и 39 пациенток без каких-либо патологических состояний. Точность нейронной сети составила 91,2 %, чувствительность – 93,6 %, специфичность – 83,8 %. Роль моделей ИИ в гистероскопии также рассматривалась Y. Zhang с соавт., которые получили 1851 гистероскопических изображений от 454 пациенток с подтвержденными поражениями эндометрия, включая гиперплазию эндометрия без атипии, атипичную гиперплазию, рак эндометрия, полипы эндометрия и подслизистые миомы, для создания и обучения модели VGG Net-16, 16-слойной ГО СНС [47]. Общая точность классификации поражений эндометрия, полученная при использовании данной модели, составила 80,8 %. Для дихотомической классификации как доброкачественных, так и предраковых/злокачественных поражений точность, чувствительность и специфичность модели составили 90,8 %, 83,0 % и 96,0 % соответственно. В обеих задачах классификации модель СНС превосходила ручную оценку врачом-гинекологом. В японском исследовании была разработана модель на основе ГО при использовании 411800 изображений из 177 видеороликов (включая нормальные результаты, полипы эндометрия, миомы эндометрия, атипичную неоплазию эндометрия и рак эндометрия) [48]. Разработанная СНС имела бинарную природу (злокачественные/доброкачественные или нормальные результаты). Авторами оценивались 3 различные модели – Xception, MobileNetV2 и EfficientNet-B0. После объединения всех обученных моделей была достигнута диагностическая точность 90,3 %, чувствительность 91,7 % и специфичность 89,4 %.
Оценка глубины инвазии в миометрий с использованием МРТ является неотъемлемой частью обследования пациенток, страдающих раком эндометрия, поскольку это влияет на выбор терапевтической тактики и прогноз заболевания. Таким образом, МРТ-анализ на основе ИИ представляется эффективным по времени и затратам подходом. X. Chen с соавт. оценили эффективность ГО в определении глубины инвазии рака эндометрия на основе МРТ с использованием T2-ВИ [49]. Изображения 530 пациенток с гистологически подтвержденным раком эндометрия были использованы для обучения и валидации модели с помощью алгоритма YOLOv3 (англ. You Only Look Once, Version 3) для определения областей поражения, достигнув точности 84,8 %, чувствительности 66,7 % и специфичности 87,5 % при определении глубины инвазии в миометрий. При оценке совместной работы специалистов и обученной СНС были достигнуты более высокая точность (86,2 %) и чувствительность (77,8 %) при равной специфичности. X. Zhu с соавт. разработали новый метод оценки глубины инвазии миометрия с помощью МРТ [50]. В отличие от других ранее описанных моделей прогнозирования авторы использовали геометрический признак, названный авторами «решетчатая структура» (англ. lattice structure, LS), предназначенный для описания нарушения структуры эндометрия. Множественная вероятностная SVM включала LS и текстурные объекты, которые объединялись для формирования ансамблевой модели EPSVM. Предложенная методика показала более надежные прогнозы, достигнув точности, чувствительности и специфичности 93,7 %, 94,7 % и 93,3 % соответственно и продемонстрировав более высокую производительность, чем у широко используемых классификаторов и моделей, использующих LS или текстурные признаки по отдельности. Таким образом, компьютерная классификация, основанная на предложенном методе, сможет помочь врачам точно идентифицировать глубокую инвазию миометрия при оценке МРТ. Кроме того, использование моделей ИИ в радиологической диагностике рака эндометрия также рассматривалось в нескольких других работах. В 2021 г. Y. Zahng с соавт. проанализировали результаты предоперационного МРТ 158 пациенток с раком эндометрия и разработали архитектуру СНС для прогнозирования рака эндометрия на основе рентгенологических признаков, полученных при МРТ [51]. Значение AUC радиомодели составило 0,897 в тренировочной группе. Комплексная модель прогнозирования, включающая конкретные параметры визуализации и клинико-патологическую информацию, позволила достичь значения AUC = 0,913. Основываясь на этих результатах, авторы предположили, что параметры радиомики могут быть использованы в качестве неинвазивных маркеров для прогнозирования рака эндометрия. В 2022 г. A. Urushibara с соавт. сравнили диагностическую эффективность модели СНС с тремя специалистами рентгенологами в диагностике рака эндометрия [52]. По результатам исследования СНС продемонстрировала не худшую диагностическую эффективность, чем рентгенологи.
Диагноз рака эндометрия обычно ставится после гистологического подтверждения. Таким образом, ИИ может играть определенную роль в упрощении гистопатологической диагностики, одновременно снижая проблему вариабельности между различными специалистами. H. Sun с соавт. разработали КДУ, основанное на СНС и механизмах внимания, называемое HieNet, для скрининга гистопатологических изображений эндометрия [53]. Авторы разработали модель для различения четырех классов тканей эндометрия, а именно, нормального эндометрия, полипа эндометрия, гиперплазии эндометрия и аденокарциномы эндометрия. Десятикратный набор данных перекрестной валидации показал точность 76,9 %, в то время как набор данных валидации из 200 изображений препаратов, окрашенных гематоксилином и эозином, достиг точности 84,5 %. Выявляя гистопатологические корреляции локальных особенностей изображения на уровне пикселей с морфологическими характеристиками ткани эндометрия, разработанная модель может помочь патологоанатомам в лучшей интерпретации диагноза.
Наконец, ценность моделей МО и ГО сосредоточена не только на упрощении установления диагноза, но, что более важно, они предоставляют значительную прогностическую информацию. Так, Y. Feng с соавт. разработали модель случайного леса (англ. random forest, RF), которая смогла предсказать гистологический тип, стадию и степень злокачественности карциномы эндометрия до оперативного вмешательства на основе базы данных, содержащей возраст, индекс массы тела и результаты обследований 329 пациенток с раком эндометрия [54]. Радиочастотная модель имела AUC = 0,69 и точность 81 % для гистологического прогнозирования; AUC = 0,66 и точность 63 % для определения стадии заболевания; AUC = 0,64 и точность 43 % для классификации. Прогностическая эффективность врачей совместно с ИИ была выше, чем без использования ИИ и при использовании только RF. Тем не менее скромные результаты модели нуждаются в совершенствовании перед ее клиническим внедрением. X. Li с соавт. представили свою работу, направленную на оценку эффективности методов классификации МО, основанных на клинических и рентгенологических признаках из Т2-ВИ МРТ-изображений, в прогнозировании глубины инвазии миометрия, категории клинического риска, гистологического типа и инвазии лимфоваскулярного пространства (ИЛВП) у женщин с раком эндометрия [55]. Значения AUC для глубокой инвазии миометрия, рака эндометрия высокого риска, гистологического типа эндометрия и классификации ИЛВП составили 0,79, 0,82, 0,91 и 0,85 соответственно в наборе данных независимого внешнего тестирования. Эта работа демонстрирует преимущества внедрения модели МО для получения диагностической и прогностической информации при единственном МРТ-исследовании.
Эндометриоз / Endometriosis
Эндометриоз является хроническим заболеванием, представляющим собой глобальную как медицинскую, так и социально-экономическую проблему для современного общества. Эндометриозом болеют от 10 до 15 % женщин репродуктивного возраста и 35–50 % женщин с тазовой болью и/или бесплодием. Пик этого заболевания приходится на период от 25 до 45 лет. Тем не менее есть случаи, когда эндометриоз можно обнаружить до менархе и после менопаузы [56]. Заболеваемость эндометриозом растет во всем мире, и Россия не является исключением. Эндометриоз определяется как внематочный рост ткани, подобной эндометрию, в различных органах, а именно, в яичниках, тонкой кишке, ободочной кишке, мочевом пузыре и брюшине, вызывающий болевые ощущения и репродуктивные нарушения. Трансвагинальное ультразвуковое исследование (УЗИ) широко используется в клинической практике для скрининга эндометриоза, однако лапароскопическое исследование с биопсией остается «золотым стандартом» диагностики эндометриоза [57]. Алгоритмы ИИ могут играть ключевую роль в раннем выявлении заболевания, а именно, посредством автоматической оценки результатов визуализации, которые обычно трудно интерпретировать, или посредством разработки прогностических моделей для более ранней диагностики и лучшего контроля заболевания.
Эндометриоз состоит из множества симптомов, нередко неспецифических, что затрудняет его диагностику в клинической практике. Фактически, отсутствие клинических и малоинвазивных маркеров заболевания приводит к значительному количеству диагностических лапароскопий, выполняемых в этом клиническом контексте. В 2022 г. был разработан алгоритм МО, основанный на 16 клинических симптомах и данных о пациенте [58]. Среди протестированных моделей классификатор мягкого голосования (англ. Soft Voting Classifier), RF и экстремальное повышение градиента (англ. Extreme Gradient Boosting, XGBoost) выделились как модели с наилучшей производительностью, чувствительностью и специфичностью в диапазоне 95 %, 98 % и 80 % соответственно. Высокая эффективность диагностики позволяет предположить, что алгоритм является потенциальной заменой диагностической лапароскопии, а также предоставляет врачам возможный инструмент для минимально инвазивной диагностики.
Современные данные свидетельствуют о том, что эндометриоз характеризуется изменением количества некоторых молекул (например, белков, антигенов) в крови, которое можно оценить с помощью рамановской спектроскопии, неинвазивного метода диагностики эндометриоза [59]. U. Parlatan с соавт. описали модель классификации на основе рамановской спектроскопии, разработанной на основе образцов крови 94 пациенток (49 с эндометриозом и 45 здоровых лиц). Среди протестированных методов МО наилучшую эффективность классификации продемонстрировал метод k ближайших соседей (англ. k-nearest neighbors, kNN) с чувствительностью 80,5 % и специфичностью 89,7 %. Как только модель была протестирована на ранее неизвестных данных (англ. unseen data), она показала значение чувствительности и специфичности, равное 100 %. В этой работе была предложена классификация рамановской спектроскопии на основе ИИ в качестве потенциальной замены лапароскопии в будущем, учитывая минимально инвазивный характер обследования, требующий только взятия образца периферической крови [60].
Поражение толстой кишки при эндометриозе является распространенным явлением, и на сегодняшний день имеются опубликованные работы о применении моделей ИИ в диагностике. S. Guerriero с соавт. протестировали несколько моделей МО во время ультразвуковой диагностики эндометриоза с поражением кишечника [61]. Авторы сравнили точность различных методов МО, сочетающих возраст пациентки с ультразвуковыми маркерами, а именно, наличие УЗИ-признаков аденомиоза матки, наличие эндометриомы, спаек яичника с маткой, наличие симптома «целующихся яичников» и отсутствие признаков скольжения, чтобы вызвать подозрение на эндометриозное поражение кишечника. Модели были разработаны на основе данных 333 пациентов, причем набор тестовых данных включал 67 % изображений, а набор валидационных данных – 33 %. Алгоритм нейронной сети (NeuralNet) продемонстрировал наилучшие результаты с точностью 73 %, чувствительностью 72 %, специфичностью 73 %, с положительным прогностическим значением (англ. positive predictive value, PPV) 52 % и отрицательным прогностическим значением (англ. negative predictive value, NPV) 86 % для диагностики ректосигмоидного эндометриоза [61]. Однако эта модель не превзошла современные модели логистической регрессии с точки зрения точности диагностики, что ограничивает ее применение в клинической практике.
Облитерация прямокишечно-маточного углубления (ПМУ) является следствием воспаления в малом тазу, часто наблюдаемого у пациенток с эндометриозом. С целью оценки ПМУ используется «скользящий знак» при трансвагинальном УЗИ (ТВУЗИ). В 2021 г. была создана модель ГО на основе временной остаточной сети для автоматической классификации «скользящего знака» как положительного (нормального) или отрицательного (аномального, указывающего на облитерацию ПМУ) с использованием набора данных из 749 записанных ультразвуковых видеороликов [62]. В обучающем наборе данных точность модели составила 88,8 %, чувствительность – 88,6 %, специфичность – 90,0 %, PPV – 98,7 % и NPV – 47,7 %. Однако, несмотря на удовлетворительные характеристики модели, необходимо учитывать техническую сложность оценки «скользящего знака», что может ограничить широкое применение модели ГО.
Таким образом, было разработано несколько моделей ИИ (клинических, биохимических и радиологических) для ранней, минимально инвазивной диагностики эндометриоза. Основной целью этих алгоритмов является сокращение числа диагностических лапароскопий, выполняемых для диагностики эндометриоза, которые обычно проводятся через несколько месяцев или лет от момента проявления симптомов заболевания, и многократных обследований с недиагностическими результатами. Тем не менее все алгоритмы были разработаны ретроспективно и нуждаются в валидации в проспективных многоцентровых исследованиях, чтобы обеспечить более раннюю диагностику этого тяжелого заболевания.
Рак яичников / Ovarian cancer
Несмотря на достижения в терапии, рак яичников остается наиболее смертоносным видом гинекологического рака, главным образом потому, что у женщин он диагностируется на поздней стадии [63]. Следовательно, повышение чувствительности диагностических инструментов, стандартизация методов визуализации и разработка прогностических моделей риска злокачественных новообразований могли бы снизить смертность от рака яичников путем раннего выявления этого злокачественного новообразования.
ТВУЗИ обычно проводится при скрининге рака яичников или при клиническом подозрении при наличии симптомов (а именно, боли в животе, дискомфорт в области таза или необъяснимая потеря веса). Однако, несмотря на удовлетворительную чувствительность диагностики рака яичников, низкий уровень PPV ограничивает применение ТВУЗИ и часто приводит к ненужным процедурам [64]. Действительно, провести дифференциальную диагностику между доброкачественными и злокачественными опухолями яичников непросто. Чтобы упростить решение данной задачи была разработана и апробирована модель классификации SVM для автоматического различения злокачественных и доброкачественных опухолей яичников, использующая набор данных из 1000 доброкачественных и 1000 злокачественных ультразвуковых изображений [65]. Была достигнута точность 99,9 %, чувствительность 100 % и специфичность 99,8 %.
U. Alqasemi с соавт. выделили 24 уникальных признака из более чем 400 ультразвуковых и фотоакустических изображений, полученных из 33 яичников 24 пациенток ex vivo, и использовали их для обучения трех классификаторов, а именно, обобщенной линейной модели, нейронной сети и SVM [66]. Основной целью модели было провести дифференциальную диагностику между доброкачественными и злокачественными новообразованиями, при этом наилучшие результаты были получены с помощью SVM. При проверке набора данных из 95 «unseen» изображений, полученных еще от 20 пациентов, классификатор SVM достиг чувствительности 76,9 % и специфичности 95,1 %.
Автоматическая диагностика опухоли яичника также может быть основана на различиях интенсивности цвета. U.R. Acharya с соавт. разработали КДУ под названием GyneScan® для автоматической классификации опухолей яичников на доброкачественные и злокачественные, основанное на незначительных изменениях интенсивности серого на трансвагинальных ультразвуковых изображениях в формате 3D (1300 доброкачественных и 1300 злокачественных) [67]. kNN/ВНС с 11 классификаторами показали 100 % точность классификации, чувствительность, специфичность и положительное прогностическое значение при выявлении рака яичников. Это исследование показало, что использование КДУ во время ТВУЗИ является ценным инструментом для повышения точности диагностики.
Модели ГО также использовались для повышения точности диагностики ТВУЗИ при раке яичников. Для автоматической классификации образований придатков была разработана СНС, основанная на 39 злокачественных и 105 доброкачественных случаях, сочетающая особенности ультразвуковых изображений и возраст пациента [68]. Модель показала общую точность 98,8 %, чувствительность 98,5 % и специфичность 98,9 %. В другом исследовании была разработана СНС, основанная на 3 алгоритмах ГО (VGG16, ResNet50 и MobileNet), которая сравнивалась с ручной оценкой врачом ультразвуковой диагностики [69]. Модель ГО продемонстрировала сопоставимую диагностическую точность и чувствительность (более 95 %) при оценке 3077 ультразвуковых изображений 758 женщин с раком яичников. Y. Gao с соавт. разработали СНС на основе набора данных из 34488 изображений рака яичников и 541442 изображений доброкачественных образований [70]. Разработанная модель продемонстрировала более высокую точность по сравнению с ручной оценкой специалистом в выявлении рака яичников (88,8 % против 85,7 %). Эти результаты обнадеживают, учитывая специфику ТВУЗИ, и делают доступным скрининг рака яичников с помощью ИИ даже в неблагоприятных условиях. Однако из-за ретроспективного характера исследований дополнительные исследования могут способствовать повышению достоверности результатов.
Диагностика рака яичников нередко включает компьютерную томографию (КТ). S. Wang с соавт. разработали модель ГО для определения риска рецидива на основе предоперационных КТ-изображений 245 пациенток с серозным раком яичников высокой степени злокачественности [71]. Модель объединила функции ГО с моделью пропорционального риска Кокса для автоматического определения вероятности рецидива в течение 3 лет. Комбинированная модель имела AUC = 0,772 и 0,825 для прогнозирования рецидива в течение 3 лет в двух валидационных группах. Модели МО также были разработаны на основе КТ-изображений с контрастированием. Для автоматического распознавания доброкачественных и злокачественных опухолей яичников была разработана комплексная модель с комбинацией радиомики и функций ГО [72]. Модель МО показала удовлетворительную производительность с точностью 82 %, специфичностью 89 % и чувствительностью 68 %.
Кроме того, ИИ может сыграть определенную роль в повышении точности диагностики с помощью МРТ. В исследовании A.F. Kazerooni с соавт. набор данных состоял из 55 сонографически неопределимых образований яичников (27 доброкачественных и 28 злокачественных) [73]. Авторы использовали проспективный анализ предоперационных МРТ-изображений с динамическим контрастированием для определения наилучших описательных параметров для прогнозирования злокачественности сложных образований яичников. Время достижения максимального эффекта и скорость промывки обеспечивают высочайшую чувствительность и специфичность. Во второй части эксперимента, основываясь на комбинации этих двух параметров, авторы разработали классификатор дерева принятия решений, используя линейное уравнение, полученное с помощью линейного дискриминантного анализа (ЛДА), который является контролируемой моделью классификации МО. Точность модели ЛДА составила 89 %, а соотношение AUC и ROC превысило 0,93. Y. Li с соавт. провели ретроспективное исследование с участием 501 женщины с целью разработки и валидации объективной модели оценки МО на основе МРТ для дифференциальной диагностики доброкачественных и злокачественных эпителиальных опухолей яичников [74]. Результаты использования МО были лучше, чем при ручной оценке рентгенологом, при этом значения AUC превышали 0,90. Важность распознавания образований придатков с помощью ИИ заключается также в исключении злокачественности образований придатков, сокращении количества ненужных операций и сохранении функции яичников и фертильности.
Применение моделей ИИ также может быть направлено на распознавание типов рака яичников, а не только на определение злокачественной природы образования в придатках. Предварительное исследование, проведенное H. Zhang с соавт., оценивало способность радиомической модели МРТ дифференцировать доброкачественные образования яичников от злокачественных и различать эпителиальные карциномы I или II типа [75]. Что касается классификации доброкачественных и злокачественных образований, то радиомическая модель МРТ достигла высокой точности в 87 % в ходе независимой валидации. Что касается классификации между подтипами типа I и типа II, то метод продемонстрировал удовлетворительную эффективность, показав точность в 84 %.
С другой стороны, существует необходимость рассмотреть возможность использования моделей ИИ в гистопатологической диагностике рака яичников. A. BenTaieb с соавт. разработали модель SVM для автоматического гистопатологического определения подтипов рака яичников, основанную на наборе данных из 133 пациентов [76]. Модель, разработанная авторами, достигла существенного согласия с 6 клиницистами, которые оценивали один и тот же набор данных, с диагностической точностью 90 % при определении подтипа. M. Akazawa с соавт. оценивали гистологический тип опухоли яичников с использованием 5 алгоритмов МО, а именно, SVM, RF, наивного байесовского классификатора (англ. Naive Bayes, NB), логистической регрессии (ЛР) и экстремального градиентного ускорения (XGBoost) в прогнозировании гистологического типа опухолей яичников на основе признаков, обычно получаемых из анализов крови, анамнеза пациентки и данных предоперационных обследований [77]. XGBoost показал лучшую производительность с точностью до 80 %.
Наконец, ИИ может также играть роль в предоставлении прогностической информации для пациентов с раком яичников. A. Enshaei с соавт. сосредоточились на разработке нейронной сети, способной прогнозировать общую выживаемость пациентов с эпителиальным раком, предсказав общую выживаемость с точностью 93 % [78]. Также ИИ продемонстрировал хорошие результаты в прогнозировании исхода операции (полная/оптимальная циторедукция или неоптимальная циторедукция) с точностью 77 %. В конце 2022 г. было проведено многоцентровое исследование, целью которого была разработка модели прогнозирования МО для диагностики и прогнозирования развития эпителиального рака яичников на основе возраста и 33 биомаркеров периферической крови у 521 пациентки с раком яичников и 144 пациенток с доброкачественными гинекологическими заболеваниями [79]. XGBoost, контролируемый метод МО, показал многообещающие результаты, поскольку значения AUC-ROC дифференциальной диагностики эпителиального рака яичников от доброкачественных образований, определения гистологического подтипа опухоли, степени и клинической стадии составили 0,958, 0,792, 0,819 и 0,68 соответственно. Наличие проверенных моделей для получения информации о предоперационном прогнозе важно для обеспечения надлежащего хирургического лечения и отбора пациенток из группы высокого риска для мониторинга рецидивов заболевания, что снижает смертность, связанную с раком яичников.
Обсуждение / Discussion
Системы на основе ИИ преуспели в анализе и интерпретации изображений и за последнее десятилетие стали мощными инструментами, которые произвели революцию в области гинекологической визуализации. В упомянутых выше исследованиях ИИ смог обеспечить более быстрые и точные прогнозы и диагностику, повысив общую эффективность гинекологической помощи. ИИ не может в полной мере заменить врачей, однако он может идеально интегрироваться в клиническую практику, помогая в процессе принятия решений и уменьшая ошибки дифференциальной диагностики и вариативность взаимодействия между различными специалистами. В области онкогинекологии, несомненно, одним из наиболее многообещающих аспектов является возможность более качественного и особенно раннего установления диагноза и, в конечном счете, улучшение выживаемости пациентов.
Помимо убедительных результатов упомянутых в обзоре исследований, большинство из этих работ были выполнены с использованием ретроспективного анализа данных, поэтому невозможно исключить предвзятость. Таким образом, эти алгоритмы должны быть тщательно протестированы перед их внедрением в повседневную клиническую практику. Другие исследования были проведены с небольшим числом пациентов, поэтому они все еще нуждаются в оценке с использованием более крупных баз данных, чтобы подтвердить их надежность. Поскольку инструменты ИИ сами по себе обладают потенциалом для повышения эффективности классификации по мере получения новых данных и использования алгоритмов, наступление эры больших данных приведет к экспоненциальному развитию методов ИИ в ближайшем будущем. Таким образом, повышение качества исходных данных, собираемых в клинической практике с использованием стандартизированных методов, является важным требованием для обеспечения повышения надежности этих методов.
Применение ИИ-систем в гинекологии все еще развивается. Действительно, необходимо учитывать важность конфиденциальности данных и предвзятости при внедрении ИИ. Эта новая технология здравоохранения в значительной степени зависит от наличия большого объема данных, а их обезличивание или повторная идентификация – сложная и трудоемкая задача, которая не всегда решается. Обработка большого объема информации создает проблемы в управлении данными. Решением этой проблемы могло бы стать обобщение технологии блокчейн на данные, полученные с помощью ИИ. Блокчейн позволяет локально хранить децентрализованные медицинские данные, которые остаются неизменными [80]. Таким образом, внедрение технологии блокчейн в следующие модели ИИ имеет фундаментальное значение для обеспечения интеграции постоянно растущей информации.
Кроме того, важно решить проблему искажения данных. На самом деле, разработке моделей ИИ обычно присущи искажения спектра, при которых технология может быть применена не к той популяции, для которой она была разработана. Большинство работ, рассмотренных в этом обзоре, имеют потенциальную погрешность в спектре, поскольку они были разработаны на основе данных местных или национальных пациентов. Таким образом, обнадеживающие результаты этих моделей следует интерпретировать с осторожностью, учитывая необходимость проверки результатов в гетерогенном мультицентрическом контексте, предпочтительно во всемирном масштабе, прежде чем внедрять модели ИИ в клиническую практику.
Заключение / Conclusion
Активное развитие ИИ и его растущий потенциал во многих областях здравоохранения делают эту тему актуальной. Возможности применения ИИ в гинекологии представляются очень многообещающими. Несомненно, модели ИИ являются крайне выгодным решением для современной гинекологии, поскольку позволяют экономить время и ресурсы. Тем не менее необходимо проведение дополнительных исследований, чтобы подтвердить применимость ИИ в клинической практике. На данный момент были достигнуты огромные успехи, и в ближайшие несколько лет ожидается только большее развитие ИИ. На самом деле предстоит пройти еще очень долгий путь, прежде чем технологии, основанные на ИИ, будут полностью интегрированы в клиническую практику.
Список литературы
1. Мелдо А.А., Уткин Л.В., Трофимова Т.Н. Искусственный интеллект в медицине: современное состояние и основные направления развития интеллектуальной диагностики. Лучевая диагностика и терапия. 2020;11(1):9-17. https://doi.org/10.22328/2079-5343-2020-11-1-9-17.
2. Труфанов Г.Е., Ефимцев А.Ю. Технологии искусственного интеллекта в МР-нейровизуализации. Взгляд рентгенолога. Российский журнал персонализированной медицины. 2023;3(1):6-17. https://doi.org/10.18705/2782-3806-2023-3-1-6-17.
3. Данилов Г.В., Ишанкулов Т.А., Котик К.В. и др. Технологии искусственного интеллекта в клинической нейроонкологии. Вопросы нейрохирургии имени Н.Н. Бурденко. 2022;86(6):127 33. https://doi.org/10.17116/neiro202286061127.
4. Сухих Г.Т., Давыдов Д.Г., Логинов В.В. и др. Состояние и перспективы внедрения технологий искусственного интеллекта в акушерско-гинекологическую практику. Акушерство и гинекология. 2021;(2):5-12. https://doi.org/10.18565/aig.2021.2.5-12.
5. Liu P.R., Lu L., Zhang J.Y. et al. Application of Artificial Intelligence in medicine: an overview. Curr Med Sci. 2021;41(6):1105-15. https://doi.org/10.1007/s11596-021-2474-3.
6. Рязанова С.В., Мазаев В.П., Комков А.А. Новые тенденции становления искусственного интеллекта в медицине. CardioCoMaTUka. 2021;12(4):227-33. https://doi.org/10.17816/22217185.2021.4.201264.
7. Jost E., Kosian P., Cruz J.J. et al. Evolving the era of 5D ultrasound? A systematic literature review on the applications for artificial intelligence ultrasound imaging in obstetrics and gynecology. J Clin Med. 2023;12(21):6833. https://doi.org/10.3390/jcm12216833.
8. Drukker L., Noble J.A., Papageorghiou A.T. Introduction to artificial intelligence in ultrasound imaging in obstetrics and gynecology. Ultrasound Obstet Gynecol. 2020;56(4):498-505. https://doi.org/10.1002/uog.22122.
9. Токмачева А.А., Вялкин Д.С., Троц А.А. и др. Радиомика в диагностике узловых образований щитовидной железы. Вестник рентгенологии и радиологии. 2023;104(4):270-78. https://doi.org/10.20862/0042-4676-2023-104-4-270-278.
10. Успенский В.Е., Сапранков В.Л., Мазин В.И. и др. Машинное обучение и искусственный интеллект в прогнозировании, диагностике и лечении заболеваний грудной аорты (обзор литературы). Российский журнал персонализированной медицины. 2023;3(3):118-31. https://doi.org/10.18705/2782-3806-2023-3-3-118-131.
11. Mota J., Almeida M.J., Mendes F. et al. From data to insights: How is AI revolutionizing small-bowel endoscopy? Diagnostics (Basel). 2024;14(3):291. https://doi.org/10.3390/diagnostics14030291.
12. Albahra S., Gorbett T., Robertson S. et al. Artificial intelligence and machine learning overview in pathology & laboratory medicine: A general review of data preprocessing and basic supervised concepts. Semin Diagn Pathol. 2023;40(2):71-87. https://doi.org/10.1053/j.semdp.2023.02.002.
13. Handelman G.S., Kok H.K., Chandra R.V. et al. eDoctor: machine learning and the future of medicine. J Intern Med. 2018;284(6):603-19. https://doi.org/10.1111/joim.12822.
14. Eckhardt C.M., Madjarova S.J., Williams R.J. et al. Unsupervised machine learning methods and emerging applications in healthcare. Knee Surg Sports Traumatol Arthrosc. 2023;31(2):376-81. https://doi.org/10.1007/s00167-022-07233-7.
15. Li N., Zhao X., Yang Y., Zou X. Objects classification by learning-based visual saliency model and convolutional neural network. Comput Intell Neurosci. 2016;2016:7942501. https://doi.org/10.1155/2016/7942501.
16. Shrestha P., Poudyal B., Yadollahi S. et al. A systematic review on the use of artificial intelligence in gynecologic imaging - background, state of the art, and future directions. Gynecol Oncol. 2022;166(3):596-605. https://doi.org/10.1016/j.ygyno.2022.07.024.
17. Кулиева Г.З., Мкртчян Л.С., Крикунова Л.И. и др. Эпидемиологические аспекты заболеваемости раком шейки матки и смертности от него (обзор литературы). Опухоли женской репродуктивной системы. 2023;19(3):77-84. https://doi.org/10.17650/1994-4098-2023-19-3-77-84.
18. Богомазова Т.В., Чимитдоржиева Т.Н. Заболеваемость и смертность от рака шейки матки в Забайкальском крае. Гинекология. 2020;22(4):11-6. https://doi.org/10.26442/20795696.2020.4.200224.
19. Wang P., Gao D., Yu X., Zhu G. Value of high-risk human papillomavirus detection combined with colposcopy in the diagnosis of cervical cancer and precancerous lesions. Oncol Lett. 2024;27(4):185. https://doi.org/10.3892/ol.2024.14318.
20. Xue P., Ng M.T.A., Qiao Y. The challenges of colposcopy for cervical cancer screening in LMICs and solutions by artificial intelligence. BMC Med. 2020;18(1):169. https://doi.org/10.1186/s12916-020-01613-x.
21. Bedell S.L., Goldstein L.S., Goldstein A.R., Goldstein A.T. Cervical cancer screening: past, present, and future. Sex Med Rev. 2020;8(1):28-37. https://doi.org/10.1016/j.sxmr.2019.09.005.
22. Mehlhorn G., Münzenmayer C., Benz M. et al. Computer-assisted diagnosis in colposcopy: results of a preliminary experiment? Acta Cytol. 2012;56(5):554-9. https://doi.org/10.1159/000341546.
23. Mehlhorn G., Kage A., Munzenmayer C. et al. Computer-assisted diagnosis (CAD) in colposcopy: evaluation of a pilot study. Anticancer Res. 2012;32(12):5221-6.
24. Bountris P., Haritou M., Pouliakis A. et al. An intelligent clinical decision support system for patient-specific predictions to improve cervical intraepithelial neoplasia detection. Biomed Res Int. 2014;2014:341483. https://doi.org/10.1155/2014/341483.
25. Sato M., Horie K., Hara A. et al. Application of deep learning to the classification of images from colposcopy. Oncol Lett. 2018;15(3):3518—23. https://doi.org/10.3892/ol.2018.7762.
26. Asiedu M.N., Simhal A., Chaudhary U. et al. Development of algorithms for automated detection of cervical pre-cancers with a low-cost, point-of-care, pocket colposcope. IEEE Trans Biomed Eng. 2019;66(8):2306-18. https://doi.org/10.1109/TBME.2018.2887208.
27. Miyagi Y., Takehara K., Miyake T. Application of deep learning to the classification of uterine cervical squamous epithelial lesion from colposcopy images. Mol Clin Oncol. 2019;11(6):583-9. https://doi.org/10.3892/mco.2019.1932.
28. Miyagi Y., Takehara K., Nagayasu Y., Miyake T. Application of deep learning to the classification of uterine cervical squamous epithelial lesion from colposcopy images combined with HPV types. Oncol Lett. 2020;19(2):1602-10. https://doi.org/10.3892/ol.2019.11214.
29. Yuan C., Yao Y., Cheng B. et al. The application of deep learning based diagnostic system to cervical squamous intraepithelial lesions recognition in colposcopy images. Sci Rep. 2020;10(1):11639. https://doi.org/10.1038/s41598-020-68252-3.
30. Xue P., Tang C., Li Q. et al. Development and validation of an artificial intelligence system for grading colposcopic impressions and guiding biopsies. BMC Med. 2020;18(1):406. https://doi.org/10.1186/s12916-020-01860-y.
31. Fu L., Xia W., Shi W. et al. Deep learning based cervical screening by the cross-modal integration of colposcopy, cytology, and HPV test. Int J Med Inform. 2022;159:104675. https://doi.org/10.1016/j.ijmedinf.2021.104675.
32. Fang S., Yang J., Wang M. et al. An improved image classification method for cervical precancerous lesions based on ShuffleNet. Comput Intell Neurosci. 2022;2022:9675628. https://doi.org/10.1155/2022/9675628.
33. Chen X., Pu X., Chen Z. et al. Application of EfficientNet-B0 and GRU-based deep learning on classifying the colposcopy diagnosis of precancerous cervical lesions. Cancer Med. 2023;12(7):8690-9. https://doi.org/10.1002/cam4.5581.
34. Urushibara A., Saida T., Mori K. et al. Diagnosing uterine cervical cancer on a single T2-weighted image: Comparison between deep learning versus radiologists. Eur J Radiol. 2021;135:109471. https://doi.org/10.1016/j.ejrad.2020.109471.
35. Sompawong N., Mopan J., Pooprasert P. et al. Automated Pap smear cervical cancer screening using deep learning. Annu Int Conf IEEE Eng Med Biol Soc. 2019;2019:7044-8. https://doi.org/10.1109/EMBC.2019.8856369.
36. Sanyal P., Barui S., Deb P., Sharma H.C. Performance of a convolutional Neural Network in screening liquid based cervical cytology smears. J Cytol. 2019;36(3):146-51. https://doi.org/10.4103/JOC.JOC_201_18.
37. Bao H., Bi H., Zhang X. et al. Artificial intelligence-assisted cytology for detection of cervical intraepithelial neoplasia or invasive cancer: A multicenter, clinical-based, observational study. Gynecol Oncol. 2020;159(1):171-8. https://doi.org/10.1016/j.ygyno.2020.07.099.
38. Bao H., Sun X., Zhang Y. et al. The artificial intelligence-assisted cytology diagnostic system in large-scale cervical cancer screening: A populationbased cohort study of 0.7 million women. Cancer Med. 2020;9(18):6896-906. https://doi.org/10.1002/cam4.3296.
39. Xue P., Xu H.M., Tang H.P. et al. Assessing artificial intelligence enabled liquid-based cytology for triaging HPV-positive women: a population-based cross-sectional study. Acta Obstet Gynecol Scand. 2023;102(8):1026-33. https://doi.org/10.1111/aogs.14611.
40. Brenes D., Barberan C.J., Hunt B. et al. Multi-task network for automated analysis of high-resolution endomicroscopy images to detect cervical precancer and cancer. Comput Med Imaging Graph. 2022;97:102052. https://doi.org/10.1016/j.compmedimag.2022.102052.
41. Matsuo K., Purushotham S., Jiang B. et al. Survival outcome prediction in cervical cancer: Cox models vs deep-learning model. Am J Obstet Gynecol. 2019;220(4):381.e1-381.e14. https://doi.org/10.1016/j.ajog.2018.12.030.
42. Matsuo K., Purushotham S., Moeini A. et al. A pilot study in using deep learning to predict limited life expectancy in women with recurrent cervical cancer. Am J Obstet Gynecol. 2017;217(6):703-5. https://doi.org/10.1016/j.ajog.2017.08.012.
43. Кузнецов К.О., Шарипова Э.Ф., Низаева А.С. и др. Роль микроРНК в норме и при патологии эндометрия. Российский вестник акушера-гинеколога. 2023;23(4):27-34. https://doi.org/10.17116/rosakush20232304127.
44. Петрожицкая А.А., Танделов Р.К., Зайцев Н.А., Морхов К.Ю. Органосохраняющее лечение атипической гиперплазии и рака эндометрия: современные тенденции. Злокачественные опухоли. 2023;13(2):69-79. https://doi.org/10.18027/2224-5057-2023-13-2-5.
45. Neofytou M.S., Pattichis M.S., Pattichis C.S. et al. Texture-based classification of hysteroscopy images of the endometrium. Conf Proc IEEE Eng Med Biol Soc. 2006;2006:3005-8. https://doi.org/10.1109/IEMBS.2006.259811.
46. Vlachokosta A.A., Asvestas P.A., Gkrozou F. et al. Classification of hysteroscopical images using texture and vessel descriptors. Med Biol Eng Comput. 2013;51(8):859-67. https://doi.org/10.1007/s11517-013-1058-1.
47. Zhang Y., Wang Z., Zhang J. et al. Deep learning model for classifying endometrial lesions. J Transl Med. 2021;19(1):10. https://doi.org/10.1186/s12967-020-02660-x.
48. Takahashi Y., Sone K., Noda K. et al. Automated system for diagnosing endometrial cancer by adopting deep-learning technology in hysteroscopy. PLoS One. 2021;16(3):e0248526. https://doi.org/10.1371/journal.pone.0248526.
49. Chen X., Wang Y., Shen M. et al. Deep learning for the determination of myometrial invasion depth and automatic lesion identification in endometrial cancer MR imaging: a preliminary study in a single institution. Eur Radiol. 2020;30(9):4985-94. https://doi.org/10.1007/s00330-020-06870-1.
50. Zhu X., Ying J., Yang H. et al. Detection of deep myometrial invasion in endometrial cancer MR imaging based on multi-feature fusion and probabilistic support vector machine ensemble. Comput Biol Med. 2021;134:104487. https://doi.org/10.1016/j.compbiomed.2021.104487.
51. Zhang Y., Gong C., Zheng L. et al. Deep learning for intelligent recognition and prediction of endometrial cancer. J Healthc Eng. 2021;2021:1148309. https://doi.org/10.1155/2021/1148309.
52. Urushibara A., Saida T., Mori K. et al. The efficacy of deep learning models in the diagnosis of endometrial cancer using MRI: a comparison with radiologists. BMC Med Imaging. 2022;22(1):80. https://doi.org/10.1186/s12880-022-00808-3.
53. Sun H., Zeng X., Xu T. et al. Computer-aided diagnosis in histopathological images of the endometrium using a convolutional neural network and attention mechanisms. IEEE J Biomed Health Inform. 2020;24(6):1664-76. https://doi.org/10.1109/JBHI.2019.2944977.
54. Feng Y., Wang Z., Xiao M. et al. An applicable machine learning model based on preoperative examinations predicts histology, stage, and grade for endometrial cancer. Front Oncol. 2022;12:904597. https://doi.org/10.3389/fonc.2022.904597.
55. Li X., Dessi M., Marcus D. et al. Prediction of deep myometrial infiltration, clinical risk category, histological type, and lymphovascular space invasion in women with endometrial cancer based on clinical and T2-weighted MRI radiomic features. Cancers (Basel). 2023;15(8):2209. https://doi.org/10.3390/cancers15082209.
56. Адамян Л.В., Андреева Е.Н. Эндометриоз и его глобальное влияние на организм женщины. Проблемы репродукции. 2022;28(1):54-64. https://doi.org/10.17116/repro20222801154.
57. Дубровина С.О., Берлим Ю.Д., Александрина А.Д. и др. Современные представления о диагностике и лечении эндометриоза. Акушерство и гинекология. 2023;(2):146-53. https://doi.org/10.18565/aig.2023.43.
58. Bendifallah S., Puchar A., Suisse S. et al. Machine learning algorithms as new screening approach for patients with endometriosis. Sci Rep. 2022;12(1):639. https://doi.org/10.1038/s41598-021-04637-2.
59. Тимурзиева А.Б. Использование paмaн-флуоресцентных технологий в ранней диагностике воспалительных и опухолевых заболеваний как часть стратегического направления формирования общественного здоровья и инструмент для повышения качества оказания медицинской помощи: обзор литературы. Лазерная медицина. 2021;25(4):42-50. https://doi.org/10.37895/2071-8004-2021-25-4-42-50.
60. Parlatan U., Inanc M.T., Ozgor B.Y. et al. Raman spectroscopy as a non-invasive diagnostic technique for endometriosis. Sci Rep. 2019;9(1):19795. https://doi.org/10.1038/s41598-019-56308-y.
61. Guerriero S., Pascual M., Ajossa S. et al. Artificial intelligence (AI) in the detection of rectosigmoid deep endometriosis. Eur J Obstet Gynecol Reprod Biol. 2021;261:29-33. https://doi.org/10.1016/j.ejogrb.2021.04.012.
62. Maicas G., Leonardi M., Avery J. et al. Deep learning to diagnose pouch of Douglas obliteration with ultrasound sliding sign. Reprod Fertil. 2021;2(4):236-43. https://doi.org/10.1530/RAF-21-0031.
63. Хамадьянова А.У., Загидулина А.Р., Загретдинова Д.Р. и др. Перспективы исследования микробиома организма человека для лучшего понимания патогенеза рака яичников. Российский вестник акушера-гинеколога. 2023;23(1):39-46. https://doi.org/10.17116/rosakush20232301139.
64. Koutras A., Perros P., Prokopakis I. et al. Advantages and limitations of ultrasound as a screening test for ovarian cancer. Diagnostics (Basel). 2023;13(12):2078. https://doi.org/10.3390/diagnostics13122078.
65. Acharya U.R., Sree S.V., Krishnan M.M. et al. Ovarian tumor characterization using 3D ultrasound. Technol Cancer Res Treat. 2012;11(6):543-52. https://doi.org/10.7785/tcrt.2012.500272.
66. Alqasemi U., Kumavor P., Aguirre A., Zhu Q. Recognition algorithm for assisting ovarian cancer diagnosis from coregistered ultrasound and photoacoustic images: ex vivo study. J Biomed Opt. 2012;17(12):126003. https://doi.org/10.1117/1.JBO.17.12.126003.
67. Acharya U.R., Sree S.V., Kulshreshtha S. et al. GyneScan: an improved online paradigm for screening of ovarian cancer via tissue characterization. Technol Cancer Res Treat. 2014;13(6):529-39. https://doi.org/10.7785/tcrtexpress.2013.600273.
68. Aramendía-Vidaurreta V., Cabeza R., Villanueva A. et al. Ultrasound image discrimination between benign and malignant adnexal masses based on a Neural Network Approach. Ultrasound Med Biol. 2016;42(3):742-52. https://doi.org/10.1016/j.ultrasmedbio.2015.11.014.
69. Christiansen F., Epstein E.L., Smedberg E. et al. Ultrasound image analysis using deep neural networks for discriminating between benign and malignant ovarian tumors: comparison with expert subjective assessment. Ultrasound Obstet Gynecol. 2021;57(1):155-63. https://doi.org/10.1002/uog.23530.
70. Gao Y., Zeng S., Xu X. et al. Deep learning-enabled pelvic ultrasound images for accurate diagnosis of ovarian cancer in China: a retrospective, multicentre, diagnostic study. Lancet Digit Health. 2022;4(3):179-87. https://doi.org/10.1016/S2589-7500(21)00278-8.
71. Wang S., Liu Z., Rong Y. et al. Deep learning provides a new computed tomography-based prognostic biomarker for recurrence prediction in high-grade serous ovarian cancer. Radiother Oncol. 2019;132:171-7. https://doi.org/10.1016/j.radonc.2018.10.019.
72. Jan Y.T., Tsai P.S., Huang W.H. et al. Machine learning combined with radiomics and deep learning features extracted from CT images: a novel AI model to distinguish benign from malignant ovarian tumors. Insights Imaging. 2023;14(1):68. https://doi.org/10.1186/s13244-023-01412-x.
73. Kazerooni A.F., Malek M., Haghighatkhah H. et al. Semiquantitative dynamic contrast-enhanced MRI for accurate classification of complex adnexal masses. J Magn Reson Imaging. 2017;45(2):418-27. https://doi.org/10.1002/jmri.25359.
74. Li Y., Jian J., Pickhardt P.J. et al. MRI-based machine learning for differentiating borderline from malignant epithelial ovarian tumors: a multicenter study. J Magn Reson Imaging. 2020;52(3):897-904. https://doi.org/10.1002/jmri.27084.
75. Zhang H., Mao Y., Chen X. et al. Magnetic resonance imaging radiomics in categorizing ovarian masses and predicting clinical outcome: a preliminary study. Eur Radiol. 2019;29(7):3358-71. https://doi.org/10.1007/s00330-019-06124-9.
76. BenTaieb A., Li-Chang H., Huntsman D., Hamarneh G. A structured latent model for ovarian carcinoma subtyping from histopathology slides. Med Image Anal. 2017;39:194-205. https://doi.org/10.1016/j.media.2017.04.008.
77. Akazawa M., Hashimoto K. Artificial intelligence in ovarian cancer diagnosis. Anticancer Res. 2020;40(8):4795-800. https://doi.org/10.21873/anticanres.14482.
78. Enshaei A., Robson C.N., Edmondson R.J. Artificial intelligence systems as prognostic and predictive tools in ovarian cancer. Ann Surg Oncol. 2015;22(12):3970-5. https://doi.org/10.1245/s10434-015-4475-6.
79. Wu M., Zhao Y., Dong X. et al. Artificial intelligence-based preoperative prediction system for diagnosis and prognosis in epithelial ovarian cancer: a multicenter study. Front Oncol. 2022;12:975703. https://doi.org/10.3389/fonc.2022.975703.
80. Литвин А.А., Коренев С.В., Князева Е.Г., Литвин В. Возможности блокчейн-технологии в медицине (обзор). Современные технологии в медицине. 2019;11(4):191-9. https://doi.org/10.17691/stm2019.11.4.21.
Об авторах
Ш. Л. ШайлиеваРоссия
Шайлиева Шеридан Ларсеновна – ассистент.
369000 Черкесск, ул. Ставропольская, д. 36
Д. Х. Мамчуева
Россия
Мамчуева Джамиля Хасановна – ординатор.
369000 Черкесск, ул. Ставропольская, д. 36
А. П. Вишневская
Россия
Вишневская Алина Петровна – ординатор.
367000 Махачкала, площадь Ленина, д. 1
Х. Ш. Джалаева
Россия
Джалаева Хадижат Шахбановна – ординатор.
367000 Махачкала, площадь Ленина, д. 1
Э. Г. Рамазанова
Россия
Рамазанова Эльвира Гасановна – студент.
367000 Махачкала, площадь Ленина, д. 1
Я. Р. Кокаева
Россия
Кокаева Яна Руслановна – ассистент.
362019 Владикавказ, ул. Пушкинская, д. 40
З. М. Елоева
Россия
Елоева Зарина Маратовна – студент.
362019 Владикавказ, ул. Пушкинская, д. 40
Д. Р. Айсанова
Россия
Айсанова Диана Руслановна – студент.
355017 Ставрополь, ул. Мира, д. 310
А. С. Виноградова
Россия
Виноградова Анастасия Сергеевна – ординатор.
355017 Ставрополь, ул. Мира, д. 310
Р. Р. Туко
Россия
Туко Рузанна Руслановна – студент.
355017 Ставрополь, ул. Мира, д. 310
А. В. Синева
Россия
Синева Ангелина Вадимовна – студент.
450008 Уфа, ул. Ленина, д. 3
Л. А. Валиуллина
Россия
Валиуллина Лилия Альбертовна – студент.
450008 Уфа, ул. Ленина, д. 3
А. А. Куцева
Россия
Куцева Алина Андреевна – студент.
117997 Москва, ул. Островитянова, д. 1
Что уже известно об этой теме?
► Искусственный интеллект (ИИ) активно развивается в различных медицинских специальностях, особенно связанных с визуализацией.
► ИИ обладает потенциалом для преодоления ограничений ручной оценки медицинских изображений при одновременном повышении точности диагностики.
► ИИ обладает огромным и признанным потенциалом для оказания содействия в выполнении повторяющихся задач, таких как автоматическая идентификация изображений хорошего качества и выявление паттернов визуализации.
Что нового дает статья?
► Модели на основе ИИ позволяют эффективно диагностировать и прогнозировать течение рака шейки матки.
► Было разработано несколько моделей ИИ (клинических, биохимических и радиологических) для ранней, минимально инвазивной диагностики эндометриоза. Основной целью этих алгоритмов является сокращение числа диагностических лапароскопий.
► ИИ продемонстрировал высокую диагностическую и прогностическую эффективность при раке эндометрия и раке яичников, что может существенно снизить смертность, связанную с этими заболеваниями.
Как это может повлиять на клиническую практику в обозримом будущем?
► В области онкогинекологии ИИ дает возможность более раннего установления диагноза, что приведет к снижению смертности.
► ИИ является крайне выгодным решением для современной гинекологии, поскольку позволяет экономить время и ресурсы.
► ИИ не может в полной мере заменить врачей, однако он может идеально интегрироваться в клиническую практику, помогая в процессе принятия решений и уменьшая ошибки дифференциальной диагностики и вариативность взаимодействия между различными специалистами.
Рецензия
Для цитирования:
Шайлиева Ш.Л., Мамчуева Д.Х., Вишневская А.П., Джалаева Х.Ш., Рамазанова Э.Г., Кокаева Я.Р., Елоева З.М., Айсанова Д.Р., Виноградова А.С., Туко Р.Р., Синева А.В., Валиуллина Л.А., Куцева А.А. Возможности применения искусственного интеллекта в современной гинекологии. Акушерство, Гинекология и Репродукция. 2024;18(4):563-580. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.511
For citation:
Shailieva Sh.L., Mamchueva D.Kh., Vishnevskaya A.P., Dzhalaeva Kh.Sh., Ramazanova E.G., Kokaeva Y.R., Eloeva Z.M., Aisanova D.R., Vinogradova A.S., Tuko R.R., Sineva A.V., Valiullina L.A., Kutseva A.A. An opportunity for using artificial intelligence in modern gynecology. Obstetrics, Gynecology and Reproduction. 2024;18(4):563-580. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.511

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































