Перейти к:
Особенности транскрипционного профиля пациенток с ранней и поздней преэклампсией
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.483
Аннотация
Цель: исследование молекулярных механизмов развития различных клинических фенотипов преэклампсии (ПЭ) на основании изучения специфичных для данного осложнения беременности паттернов транскриптома плацентарной ткани.
Материалы и методы. В проспективное наблюдательное сравнительное исследование в параллельных группах включены 43 беременных, которые были разделены на 2 группы: основная – 23 беременных с диагностированной ПЭ и контрольная – 20 соматически здоровых женщин с неосложненным течением беременности, родового и послеродового периода. С целью изучения фенотипических особенностей ПЭ было проведено последующее разделение основной группы беременных с ПЭ на подгруппы по сроку дебюта патологии: ранняя (n = 10) и поздняя (n = 13) ПЭ. Методом полногеномного секвенирования нового поколения (англ. next-generation sequencing, NGS) проведен сравнительный анализ динамики уровня 18 микроРНК в ткани плаценты.
Результаты. Беременные с ранней ПЭ по отношению к контрольной группе характеризовалась достоверно низким уровнем экспрессии hsa-miR-656-3p (р < 0,001), hsa-miR-323a-5p (р = 0,017), hsa-miR-519c-3p (р = 0,019), hsa-let-7i-5p (р = 0,019), hsa-miR-433-3p (р = 0,019), hsa-let-7g-5p (р = 0,030), hsa-miR-214-5p (р = 0,030), hsa-miR-27a-5p (р = 0,031), hsa-miR-339-5p (р = 0,041), hsa-miR-524-5p (р = 0,045), hsa-miR-1283 (р = 0,049) и более высоким уровнем экспрессии hsa-miR-151a-5p (р = 0,007), hsa-miR-4521 (р = 0,018), hsa-miR-30d-5p (р = 0,026), hsa-miR-548l (р = 0,027), hsa-miR-133b (р = 0,034), hsa-miR-424-5p (р = 0,042), hsa-miR-211-5p (р = 0,049). У пациенток с поздней ПЭ установлено статистически значимое снижение экспрессии молекул hsa-miR-656-3p (р = 0,050) и hsa-miR-574-3p (р = 0,017), а также достоверное повышение hsa-miR-211-5р (р = 0,001) в сравнении с контрольной группой. В подгруппе женщин с ранним дебютом ПЭ зафиксировано значимое снижение уровня экспрессии hsa-miR-323-5p (р = 0,007) и гиперэкспрессия hsa-miR-30d-5p (р = 0,002), hsa-miR-5481 (р = 0,027) по сравнению с подгруппой женщин с поздней ПЭ.
Заключение. Отмеченная разнонаправленность экспрессии некоторых микроРНК в подгруппах пациенток с ПЭ подтверждает правомерность разделения данной патологии согласно двум различным фенотипическим проявлениям (ранней и поздней форм) и свидетельствует о существовании различных патофизиологических векторов в процессе
формирования ПЭ.
Для цитирования:
Котельникова В.Э., Пантюхова Д.Е., Аблямитова Ф.Д., Викинская С.Н., Халилова Х.У., Мустафаева Л.Ф., Бариева Д.А., Яровая Д.В., Чопик Н.Д., Ермакова М.С., Сорокина Л.Е. Особенности транскрипционного профиля пациенток с ранней и поздней преэклампсией. Акушерство, Гинекология и Репродукция. 2024;18(2):167-179. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.483
For citation:
Kotelnikova V.E., Pantyukhova D.E., Ablyamitova F.D., Vikinskaya S.N., Khalilova Kh.U., Mustafaeva L.F., Barieva D.A., Yarovaya D.V., Chopik N.D., Ermakova M.S., Sorokina L.E. Transcriptional profile features in patients with early and late preeclampsia. Obstetrics, Gynecology and Reproduction. 2024;18(2):167-179. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.483
Введение / Introduction
Смещение фокуса внимания на проблему преэклампсии (ПЭ) в современной акушерско-гинекологической практике обусловлено не только ее лидирующей позицией в структуре причин материнских и перинатальных потерь, но и отсутствием ожидаемых успехов в прогнозировании, профилактике и лечении этой патологии [1][2]. На протяжении длительного периода времени центральное значение в развитии ПЭ и ассоциированных с ней патологий отводилось нарушениям физиологической плацентации. При этом прорыв в области молекулярной биологии, совершенный за последние десятилетия, поставил под сомнение традиционные концепции патофизиологии ПЭ. В настоящее время представления о гетерогенной природе ПЭ значительно расширились. Так, в частности, с клинической точки зрения в плане исходов беременности и влияния на качество последующей жизни женщины целесообразным представляется выделение ранней или плацентарной (возникшей до 34 нед) и поздней или материнского происхождения (после 34 нед) ПЭ. При этом стоит отметить, что существующие на сегодняшний день теории не способны в полной мере объяснить механизм формирования данных клинических фенотипов акушерской патологии.
Учитывая медико-социальную значимость проблемы, возникает необходимость в четкой верификации факторов, способствующих инициированию и прогрессированию того или иного фенотипа ПЭ, что является ключевой задачей для стратификации риска и имеет решающее значение для понимания путей взаимодействия в динамической системе «мать–плод».
Сегодня, в эру развития «омиксных технологий», высокоприоритетным направлением становится изучение молекулярно-генетических механизмов, связанных с программированием клеток трофобласта, лежащих в основе развития того или иного патологического процесса [3]. Так, в частности, изучение транскриптома, являющегося связующим элементом между «константным» геномом и «вариабельным» протеомом, представляется одним из наиболее приоритетных направлений в части расширения представления о патогенезе ПЭ и оптимизации превентивных и лечебно-диагностических мероприятий при развитии осложненной беременности.
В современной научной литературе уже накоплен значительный пул исследований по оценке транскриптомного профиля женщин с ПЭ по сравнению с физиологической беременностью. Оправданность подобных работ подтверждается знаниями об уникальной структуре транскриптома плацентарной ткани, а также ключевом значении микроРНК в процессах дифференциации, миграции и инвазии клеток трофобласта, ангиогенезе, поддержании сосудистого тонуса, инициации и поддержании реакций воспаления и иммунного ответа [4].
Несмотря на определенные успехи в данном направлении, существует насущная проблема фрагментарности и противоречивости накопленных результатов, что не может не мотивировать к научному поиску, переосмыслению уже имеющихся данных для уточнения представлений об основных причинно-следственных механизмах развития различных фенотипов ПЭ.
Цель: исследование молекулярных механизмов развития различных клинических фенотипов ПЭ на основании изучения специфичных для данного осложнения беременности паттернов транскриптома плацентарной ткани.
Материалы и методы / Materials and Methods
Дизайн исследования / Study design
На базе Перинатального центра ГБУЗ РК РКБ им. Н.А. Семашко (Симферополь) в период 2021–2023 гг. проведено проспективное наблюдательное сравнительное исследование в параллельных группах. Включенные в клиническое исследование пациентки были разделены на следующие группы: основная – 23 беременных с диагностированной ПЭ и контрольная – 20 соматически здоровых женщин с неосложненным течением беременности, родового и послеродового периода.
С целью изучения фенотипических особенностей ПЭ на молекулярном уровне было проведено разделение основной группы беременных с ПЭ на 2 подгруппы по сроку дебюта патологии: ранняя (n = 10) и поздняя (n = 13) ПЭ. Постановка диагноза ПЭ проводилась на основании критериев, указанных в Федеральных клинических рекомендациях Российского общества акушеров-гинекологов (РОАГ) в рамках соответствующей нозологии [5].
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения в основную группу: возрастная группа от 18 до 45 лет; одноплодная беременность 22–42 нед; наличие у беременной клинических проявлений, характерных для ПЭ, подтвержденных лабораторными исследованиями, после 20 нед беременности; информированное добровольное согласие.
Критерии включения в контрольную группу: возрастная группа от 18 до 45 лет; одноплодная беременность 22–42 нед; неосложненное течение беременности; информированное добровольное согласие.
Критерии исключения: возрастная группа младше 18 и старше 45 лет; многоплодная беременность; отсутствие клинической манифестации экстрагенитальной патологии; инфекционно-воспалительные процессы в острой фазе; онкологические заболевания в анамнезе, психические расстройства; отказ от участия в исследовании.
Методы исследования / Study methods
Обследование пациенток включало в себя сбор анамнеза, объективный осмотр, комплекс лабораторных (клинический анализ крови, биохимический анализ крови, коагулограмма, общий анализ мочи) и инструментальных (ультразвуковая фетометрия, доплерометрическое исследование, кардиотокография) методов.
Оценка транскриптомного профиля включала в себя сбор образцов ткани плаценты с последующим определением 18 плаценто-специфичных микроРНК методом полногеномного секвенирования нового поколения (англ. next-generation sequencing, NGS).
Выделение РНК из плацентарной ткани / Placental tissue RNA isolation
Отбор образцов ткани плаценты осуществляли непосредственно после родоразрешения. Фрагменты промывали в изотоническом растворе NaCl, замораживали и хранили в жидком азоте при –20 °С до проведения исследований. Фрагмент замороженного образца плаценты (примерно 50 мкг) измельчали в ступке. К полученному гомогенату добавляли 700 мкл реагента для лизиса Qiazol, 140 мкл хлороформа, а также 3,5 мкл контрольной синтетической cel-miR-39 (RNA Spike-In Kit, Qiagen, Германия), разведенной в 125 раз согласно протоколу производителя. Далее тотальную РНК выделяли набором miRNEasy Mini Kit (Qiagen, Германия) согласно протоколу производителя.
Глубокое секвенирование микроРНК / microRNA deep sequencing
Для подготовки библиотек микроРНК использовали набор MGIEasy Small RNA Library Prep Kitv.2.0 (BGI-940-000196-00, MGI, КНР) согласно интрукции производителя. Малые РНК конвертировали в комплементарную (кДНК) в реакции обратной транскрипции с последующим проведением ПЦР-амплификации кДНК-библиотеки плацентарной ткани. Проведя очистку, в полиакриламидном геле осуществляли последующее извлечение кДНК-фракции длиной 140–160 пар оснований. Количество и качество кДНК оценивали с помощью Qubit™ ssDNA Assay Kit (Cat. No. Q10212 Thermo Fisher Scientific, США) и флуориметра Qubit®. Очищенную кДНК-библиотеку секвенировали на платформе MGI DNBSEQ-G400 (BGI, Китай) в режиме SE50. Анализ данных проведен с использованием программы Novoalign (http://www.novocraft.com/products/novoalign/) посредством выравнивания нуклеотидных последовательностей против референсного генома, аннотированного в базе miRBase (http://www.mirbase.org).
Этические аспекты / Ethical aspects
Исследование проведено в соответствии с этическими стандартами Хельсинской декларации Всемирной медицинской ассоциации 1964 г. и ее последующими изменениями. Все включенные в исследование пациентки дали добровольное согласие на участие в исследовании и проведение медицинских вмешательств. Клиническое исследование одобрено этическим комитетом Ордена Трудового Красного Знамени Медицинского института имени С.И. Георгиевского (структурное подразделение ФГАОУ ВО «Крымский федеральный университет имени В.И. Вернадского»); протокол № 5 от 23.05.2023.
Методы статистического анализа / Statistical alanalysis
Оценку нормальности распределения данных проводили с помощью критерия Шапиро–Уилка. Представление нормально распределенных данных осуществляли в виде среднего арифметического и стандартного отклонения (М ± σ), ненормально распределённых данных – в виде медианы и интерквартильного размаха (Ме [ Q25; Q75]). Сравнение категориальных переменных в группах проводили с использованием двустороннего F-критерия Фишера. В случае ограничений использования F-критерия (одна из долей при сопоставлении двух выборок равна 0 % или 100 %) применяли Z-критерий для долей с поправкой для концевых точек. Выявление различий в степени экспрессии исследуемых микроРНК выполняли с использованием теста Вилкоксона–Манна–Уитни. Статистическую значимость устанавливали при p ≤ 0,05.
Результаты и обсуждение / Results and Discussion
Клинико-анамнестическая характеристика и исходы беременности в группах обследованных представлены в таблице 1.
Таблица 1. Клинико-анамнестическая характеристика и перинатальные исходы.
Table 1. Clinical and anamnestic characteristics and perinatal outcomes.
|
Показатель Parameter |
Основная группа Main group n = 23 |
Контрольная группа Control group n = 20 |
|
Клинико-анамнестическая характеристика / Clinical and anamnestic characteristics |
||
|
Возраст, лет, Ме [ Q25; Q75] / Age, years, Ме [ Q25; Q75] |
30 [ 26,5; 33,5] |
32 [ 26; 36] |
|
Индекс массы тела, кг/м², Ме [ Q25; Q75] / Body mass index, kg/m², Ме [ Q25; Q75] |
24,3 [ 22,7; 32,5] |
26,5 [ 23,6; 30,4] |
|
Преэклампсия в анамнезе, n (%) / History of preeclampsia, n (%) |
2 (18,2) |
0 (0) |
|
Хроническая артериальная гипертензия, n (%) / Chronic hypertension, n (%) |
1 (9,1) |
0 (0) |
|
Пренатальный скрининг, риск преэклампсии высокий, n (%) |
6 (54,5) |
0 (0) |
|
Манифестация преэклампсии, недель, Ме [ Q25; Q75] |
34 [ 28; 35] |
– |
|
Ранняя преэклампсия, n (%) / Early-onset preeclampsia, n (%) |
5 (45,5) |
– |
|
Поздняя преэклампсия, n (%) / Late-onset preeclampsia, n (%) |
6 (54,5) |
– |
|
Умеренная преэклампсия, n (%) / Mild preeclampsia, n (%) |
9 (81,8) |
– |
|
Тяжелая преэклампсия, n (%) / Severe preeclampsia, n (%) |
2 (18,2) |
– |
|
Клинические симптомы / Clinical signs |
||
|
Систолическое артериальное давление, мм рт. ст., Ме [ Q25; Q75] |
150 [ 142,5; 153] |
110 [ 110; 120] |
|
Диастолическое артериальное давление, мм рт. ст., Ме [ Q25; Q75] |
90 [ 90; 100] |
70 [ 70; 70] |
|
Протеинурия, г/л, Ме [ Q25; Q75] / Proteinuria, g/L, Ме [ Q25; Q75] |
0,53 [ 0,3; 1,3] |
– |
|
Отеки, n (%) / Edema, n (%) |
8 (72,7) |
1 (20,0) |
|
Нарушение маточно-плацентарно-плодового кровотока, n (%) |
1 (9,1) |
0 (0) |
|
Лабораторные данные / Laboratory data |
||
|
Гемоглобин, г/л, Ме [ Q25; Q75] / Hemoglobin, g/L, Ме [ Q25; Q75] |
107 [ 97; 115] |
118 [ 113; 119] |
|
Гематокрит, %, Ме [ Q25; Q75] / Hematocrit, %, Ме [ Q25; Q75] |
32,2 [ 29,1; 35,45] |
35,6 [ 33,6; 36,11] |
|
Количество эритроцитов, ×10¹²/л, Ме [ Q25; Q75] |
3,6 [ 3,33; 3,83] |
4,02 [ 3,70; 4,18] |
|
Количество тромбоцитов, ×10⁹/л, Ме [ Q25; Q75] / Platelets, ×10⁹/L, Ме [ Q25; Q75] |
220 [ 161,5; 281,0] |
168 [ 166; 170] |
|
Общий белок, г/л, Ме [ Q25; Q75] / Total protein, g/L, Ме [ Q25; Q75] |
61 [ 59,5; 64,4] |
65 [ 62; 66] |
|
Креатинин, мкмоль/л, Ме [ Q25; Q75] / Creatinine, µmol/L, Ме [ Q25; Q75] |
85 [ 78,5; 105,0] |
98 [ 98; 99] |
|
Мочевина, ммоль/л, Ме [ Q25; Q75] / Urea, mmol/L, Ме [ Q25; Q75] |
4,95 [ 3,77; 5,75] |
2,7 [ 2,3; 2,9] |
|
Аспартатаминотрансфераза, ЕД/л, Ме [ Q25; Q75] |
28 [ 23,0; 34,1] |
– |
|
Аланинаминотрансфераза, ЕД/л, Ме [ Q25; Q75] |
21 [ 13,0; 23,73] |
– |
|
Лактатдегидрогеназа, ЕД/л, Ме [ Q25; Q75] |
485 [ 333,25; 651,5] |
190 [ 165; 200] |
|
Активированное частичное тромбопластиновое время, с, Ме [ Q25; Q75] |
28,5 [ 27,35; 29,65] |
27,6 [ 25; 28] |
|
Фибриноген, г/л, Ме [ Q25; Q75] / Fibrinogen, g/L, Ме [ Q25; Q75] |
4,27 [ 4,05; 4,36] |
4,0 [ 3,88; 4,3] |
|
Перинатальные исходы / Perinatal outcomes |
||
|
Срок родоразрешения, недель, Ме [ Q25; Q75]: Delivery time, weeks, Ме [ Q25; Q75]: |
37,3 [ 36,3; 38,1] |
40,3 [ 39,2; 40,3] |
|
– преждевременные роды, n (%) – preterm delivery, n (%) |
7 (63,6) |
0 (0) |
|
– своевременные роды, n (%) – term delivery, n (%) |
4 (36,4) |
5 (100,0) |
|
Кесарево сечение, n (%) / Cesarean section, n (%) |
7 (63,6) |
0 (0) |
|
Масса тела ребенка при рождении, г, Ме [ Q25; Q75] |
2260 [ 2135; 2900] |
3660 [ 3650; 3870] |
|
Оценка по шкале Апгар, n (%): Apgar score, n (%): |
||
|
8–10 баллов 8–10 points |
1 (9,1) |
5 (100,0) |
|
≤ 6–7 баллов ≤ 6–7 points |
10 (90,9) |
0 (0) |
|
Неонатальная заболеваемость / Neonatal morbidity |
||
|
Задержка роста плода, n (%) / Fetal growth retardation, n (%) |
7 (63,6) |
0 (0) |
|
Недоношенность, n (%) / Premature birth, n (%) |
3 (27,3) |
0 (0) |
|
Респираторный дистресс-синдром, n (%) / Respiratory distress syndrome, n (%) |
3 (27,3) |
0 (0) |
|
Врожденная пневмония, n (%) / Congenital pneumonia, n (%) |
0 (0) |
0 (0) |
|
Церебральная депрессия плода, n (%) / Fetal cerebral depression, n (%) |
1 (9,1) |
0 (0) |
|
Неонатальная желтуха, n (%) / Neonatal jaundice, n (%) |
1 (9,1) |
0 (0) |
|
Дыхательная недостаточность у новорожденного, n (%) |
3 (27,3) |
0 (0) |
|
Первичный ателектаз у новорожденного, n (%) |
1 (9,1) |
0 (0) |
Проведенное глубокое секвенирование образцов плацентарной ткани у пациенток с ПЭ и женщин с неосложненным течением беременности позволило выявить ряд молекулярных особенностей на уровне транскриптома. Однонаправленные изменения экспрессии микроРНК были идентифицированы у пациенток как с ранним, так и поздним дебютом ПЭ: 11 микроРНК имели сниженный уровень, 7 микроРНК – повышенный уровень.
При этом подгруппа беременных с ранней ПЭ по отношению к контрольной группе характеризовалась значимо более низким уровнем экспрессии hsa-miR-656-3p (р < 0,001), hsa-miR-323a-5p (р = 0,017), hsa-miR-519c-3p (р = 0,019), hsa-let-7i-5p (р = 0,019), hsa-miR-433-3p (р = 0,019), hsa-let-7g-5p (р = 0,030), hsa-miR-214-5p (р = 0,030), hsa-miR-27a-5p (р = 0,031), hsa-miR-339-5p (р = 0,041), hsa-miR-524-5p (р = 0,045), hsa-miR-1283 (р = 0,049) и более высоким уровнем экспрессии hsa-miR-151a-5p (р = 0,007), hsa-miR-4521 (р = 0,018), hsa-miR-30d-5p (р = 0,026), hsa-miR-548l (р = 0,027), hsa-miR-133b (р = 0,034), hsa-miR-424-5p (р = 0,042), hsa-miR-211-5p (р = 0,049).
Транскриптомный анализ микроРНК в подгруппе поздней ПЭ позволил отметить статистически значимое снижение экспрессии молекул hsa-miR-656-3p (р = 0,050) и hsa-miR-574-3p (р = 0,017), а также достоверное повышение hsa-miR-211-5р (р = 0,001) в сравнении с группой женщин с неосложненным течением беременности.
При проведении сравнительного анализа среди пациенток с акушерской патологией в подгруппе женщин с ранним дебютом ПЭ зафиксировано выраженное значимое снижение уровня экспрессии hsa-miR-323-5p (р = 0,007) и гиперэкспрессия hsa-miR-30d-5p (р = 0,002), hsa-miR-5481 (р = 0,027) по сравнению с подгруппой поздней ПЭ (табл. 2).
Таблица 2. Сравнительный анализ уровней экспрессии микроРНК
в образцах плацентарной ткани методом глубокого секвенирования.
Table 2. Deep sequencing in comparatively analyzed placental microRNA expression levels.
|
МикроРНК MicroRNA |
Локализация генов (хромосома) Gene localization (chromosome) |
р1 |
р2 |
р3 |
|
hsa-miR-656-3p |
chr14q32.31 |
< 0,001 |
0,050 |
0,169 |
|
hsa-miR-151a-5p |
chr8q24.3 |
0,007 |
0,083 |
0,491 |
|
hsa-miR-323a-5p |
chr14q32.31 |
0,017 |
0,656 |
0,019 |
|
hsa-miR-4521 |
chr17p13.1 |
0,018 |
0,194 |
0,245 |
|
hsa-miR-519c-3p |
chr9q13.42 |
0,019 |
0,017 |
0,205 |
|
hsa-let-7i-5p |
chr12q14.1 |
0,019 |
0,299 |
0,819 |
|
hsa-miR-433-3p |
chr14q32.2 |
0,019 |
0,178 |
0,378 |
|
hsa-miR-30d-5p |
chr8q24.22 |
0,026 |
0,411 |
0,002 |
|
hsa-miR-548l |
chr11q21 |
0,027 |
0,996 |
0,027 |
|
hsa-let-7g-5p |
chr13p21.2 |
0,030 |
0,304 |
0,778 |
|
hsa-miR-214-5p |
chr1q24.3 |
0,030 |
0,281 |
0,963 |
|
hsa-miR-27a-5p |
chr19p13.12 |
0,031 |
0,254 |
0,298 |
|
hsa-miR-133b |
сhr6p12.2 |
0,034 |
0,258 |
0,350 |
|
hsa-miR-339-5p |
chr7p22.3 |
0,041 |
0,198 |
0,509 |
|
hsa-miR-424-5p |
chrXq26.3 |
0,042 |
0,105 |
0,603 |
|
hsa-miR-524-5p |
chr19q13.42 |
0,045 |
0,098 |
0,230 |
|
hsa-miR-211-5p |
chr15q13.3 |
0,049 |
0,001 |
0,323 |
|
hsa-miR-1283 |
chr19q13.42 |
0,049 |
0,250 |
0,565 |
Примечание: р1 – статистическая значимость различий
между подгруппой с ранней преэклампсией и контрольной группой;
р2 – статистическая значимость различий
между подгруппой с поздней преэклампсией и контрольной группой;
р3 – статистическая значимость различий
между подгруппами с ранней и поздней преэклампсией;
выделены значимые различия.
Note: p1 – statistical differences between early preeclampsia subgroup and control group;
р2 – statistical differences between late preeclampsia subgroup and control group;
p3 – statistical differences between early and late preeclampsia subgroups;
significant differences are highlighted.
Анализ литературных данных позволил установить, что большинство из дифференциально экспрессирующихся микроРНК в группе женщин с ПЭ ассоциированы с процессом физиологической плацентации и регулируют экспрессию генов, участвующих в пролиферации, дифференцировке, инвазии, миграции, апоптозе и ангиогенезе в ткани трофобласта.
В контексте рассматриваемой проблемы отдельно стоит подчеркнуть наши результаты, касающиеся экспрессии микроРНК, кодируемых генами, расположенными внутри кластеров хромосомы 19 (C19MC). Обращает на себя внимание факт, что различная экспрессия паттернов микроРНК данных кластеров может характеризовать разные этапы беременности в зависимости от срока гестации и развития ворсинчатого дерева. Так, показано, что «отцовский» C19MC кластер преимущественно экспрессируется на ранних этапах развития беременности и ассоциирован с фундаментальными процессами глубокой инвазии трофобласта и ремоделирования спиральных артерий матки. Увеличение экспрессии микроРНК кластера C19MC имеет место в случаях развития гипоксии трофобласта/плаценты, которая, как известно, является неотъемлемым патогенетическим звеном ПЭ. В то же время большая часть трофобластных микроРНК из «материнского» кластера хромосомы 14 (C14MC) активно экспрессируется в период I триместра беременности и перед родами, что указывает на его функциональный потенциал в отношении поддержания гомеостаза в системе «мать–плацента–плод».
С учетом вышеизложенного интерес представляют данные относительно представленности hsa-miR-656-3p в плацентарной ткани. Учитывая статистически значимую тенденцию к снижению экспрессированности в обеих подгруппах женщин с ПЭ, miR-656-3p может выступать в качестве перспективного биомаркера для диагностики данной акушерской патологии (рис. 1). При этом проведенный теоретический поиск не выявил в доступной литературе исследований, касающихся роли miR-656-3p в развитии беременности. Между тем, в работе C.G. Howe с соавт. обсуждается критическая роль miR-656 в плацентации и росте плода, а также имеются указания на ассоциацию экспрессированности данной микроРНК с гестационным возрастом и фактом рождения детей мужского пола [6]. Существуют также отдельные научные публикации, демонстрирующие вовлеченность данной микроРНК в развитие кардиоваскулярной патологии, иммуного ответа, регуляцию процессов пролиферации и миграции раковых клеток посредством влияния на сфингозин-1-фосфат фосфатазу 1 (англ. sphingosine-1-phosphate phosphatase 1, SGPP1).
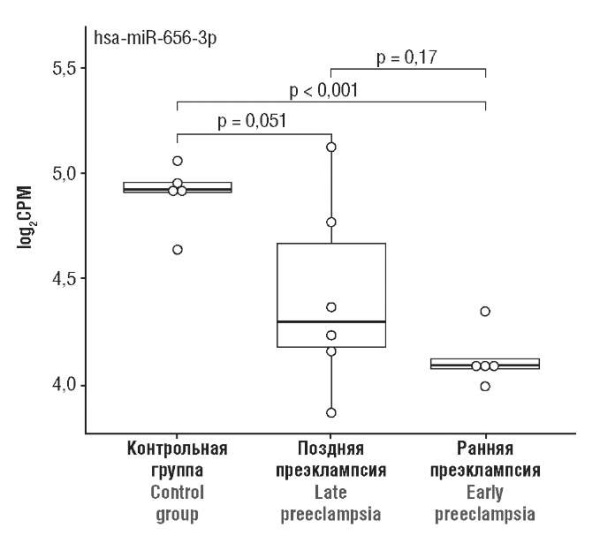
Рисунок 1. Уровень экспрессии miR-656-3p в образцах плацентарной ткани,
определенный методом глубокого секвенирования.
Примечание: данные представлены в виде логарифмированных по основанию 2 значений RQ
(относительное количество микроРНК в подгруппах с ранней и поздней ПЭ
по сравнению с контрольной группой);
log2CPM – относительный уровень экспрессии в выборке (log2 трансформация);
CPM – количество прочтений на миллион.
Figure 1. Placental miR-656-3p expression level determined by deep sequencing.
Note: Data are presented as RQ value base 2 logarithm
(relative abundance of miRNAs in subgroups with early and late PE compared to the group);
log2CPM – relative expression level in the sample (log2 transformation);
CPM – count per million.
Научную значимость представляют также наши результаты, демонстрирующие разнонаправленность экспрессии трех микроРНК в подгруппах пациенток с разным временным дебютом ПЭ.
В частности, данная работа демонстрирует статистически значимое повышение экспрессии hsa-miR-30d-5p и hsa-miR-5481 у пациенток с дебютом ПЭ до 34 нед. Ранее проведенные исследования о роли miR-30d позволяют рассматривать данную молекулу в качестве благоприятного маркера рецептивности эндометрия, детерминирующим, в свою очередь, успешную имплантацию. В исследовании S. Kuokkanen с соавт. было обнаружено, что экспрессия miR-30d в стадии поздней пролиферации эндометрия ниже, чем в среднесекреторной фазе [7]. J.L. Cai с соавт. показали, что полихлорированные бифенилы могут нарушать рецептивность эндометрия in vitro путем регуляции экспрессии miR-30d и координации эпителиально-мезенхимального перехода [8]. По результатам работы Y. Zhao с соавт. отмечено, что экспрессия miR-30d-5p значительно снижена в эндометрии пациенток с повторной неудачной имплантацией по сравнению с фертильными женщинами. Кроме того, авторы указывают на отрицательную корреляцию между уровнями miR-30d-5p и супрессором цитокиновой сигнализации 1 (англ. suppressor of cytokine signaling, SOCS1), который является ключевым негативным регулятором сигнализации цитокинов и фактора роста. При этом точные механизмы данной взаимосвязи остаются все еще не до конца ясны [9].
Сведения о влиянии сниженного уровня miR-30d у матери и/или эмбриона на нарушение имплантации эмбриона и развитие плода также подтверждены в экспериментальном исследовании N. Balaguer с соавт. на крысиной модели [10].
Проведенные рабочей группой под руководством L. Zhang флюоресцентная гибридизация in situ (англ. fluorescence in situ hybridization, FISH) и полимеразная цепная реакция с обратной транскрипцией (ПЦР-ОТ) показали, что уровень miR-30d значительно снижен в плацентарной ткани пациенток с гестационным сахарным диабетом по отношению к группе с неосложненной беременностью. Последующий биоинформатический анализ и анализ активности репортеров люциферазы показали, что miR-30d-5p, связываясь с 3'UTR (мРНК) протоонкогена семейства RAS – RAB8A, ингибирует биосинтез белка [11]. В литературе показано важное значение семейства RAS в процессах инвазии и миграции клеток, регуляции дифференцировки эпителия, метаболизме холестерина и работе инсулинозависимого белка-переносчика глюкозы (англ. glucose transport protein, GLUT) GLUT4, а также активации толл-подобного рецептора (англ. toll-like receptor, TLR) TLR4 и выработке провоспалительных цитокинов [12–15]. Все эти результаты позволяют предположить, что miR-30d-5p регулирует ряд фундаментальных процессов беременности и путем обратной модуляции экспрессии RAB8A, что может способствовать патологии тканей плаценты и возникновению неблагоприятных исходов беременности.
В отношении has-miR-548l в доступной литературе имеются единичные публикации, демонстрирующие ее функциональный потенциал. Так, имеются указания на достоверное снижение экспрессированности miR-548l в ткани эндометрия у пациенток с эндометриозом. Авторы объясняют, что расположение в геномно нестабильных участках обусловливает нацеленность микроРНК на онкогены, гены-супрессоры опухолей, ангиогенез, а также гены, связанные с воспалением или иммунной функцией. Программный анализ c использованием биомедицинского ресурса Target Scan позволил идентифицировать мишень miR-548l – ген OPRM1, кодирующий μ1-опиоидный рецептор [16]. Помимо участия в проведении болевых импульсов, стимуляция OPRM1 вызывает массу других биологических эффектов, среди которых наибольшее значение имеет влияние на систему иммунитета и инициацию воспаления. В пользу ассоциации степени экспрессированости miR-548l с индукцией иммунно-воспалительных реакцией свидетельствуют также работы в сфере транскриптомики, выполненные с участием пациентов онкологического профиля [17][18].
Еще одним потенциальным биомаркером в текущем исследовании, демонстрирующим разнонаправленный характер формирования того или иного фенотипа ПЭ, является hsa-miR-323-5p. По нашим данным, экспрессия этой молекулы была значительно снижена у пациенток с ранним дебютом ПЭ по отношению к таковой у женщин с поздней формой патологии. hsa-miR-323-5p – относительно новая микроРНК. Имеются лишь немногочисленные работы, свидетельствующие о влиянии данной микроРНК на процессы дифференцировки и пролиферации клеток, что тем самым косвенно отражает ее функциональный потенциал в отношении эндотелиальных клеток, процессов ишемии/гипоксии и окислительного метаболизма. Так, на основании проведённого исследования B. Cheng с соавт. предлагают использовать hsa-miR-323-5p как новый диагностический биомаркер в случае критической ишемии конечностей у пациентов с диабетом 2-го типа [19]. В другой работе, состоящей из экспериментальной и клинической части, было показано, что miR-323 высоко экспрессируется в образцах крови лабораторных животных и пациентов с ишемической болезнью сердца и атеросклерозом. Дальнейший биоинформационный анализ продемонстрировал выраженное влияние miR-323 на снижение экспрессии гена сиртуина-1 (англ. sirtuin-1 gene, SIRT1), что в последующем сопровождалось усилением апоптоза эндотелиальных клеток сосудов и повышением секреции белков, связанных с сигнальными путями ac-p65 и ядерного фактора каппа B (англ. nuclear factor kappa B, NF-κB).
Имеющиеся транскриптомные исследования, проведенные с участием пациенток акушерско-гинекологического профиля, предлагают рассматривать данную miR-323-3p в качестве диагностического предиктора эктопической беременности. Примечательно, что ряд публикаций демонстрируют однозначную тенденцию к повышению концентраций сывороточной miR-323-3p в случае эктопической беременности по сравнению с внематочной беременностью и/или самопроизвольным абортом. Интерес вызывает и отмеченный в исследовании P.L. Hedley с соавт. факт гиперэкспрессированности miR-323-3p у женщин с развившейся во время беременности тромбоэмболией легочной артерии [20].
С помощью баз miRTarBase, TarBase и Gene Ontology был проведен анализ сигнальных путей, в регуляции которых опосредованно могут принимать участие выявленные нами дифференциально экспрессированные плацентарные микроРНК. В результате установлена вовлеченность указанных микроРНК в регуляцию более 100 каскадов сигнальных реакций и биологических процессов, включая путь гипоксией индуцируемого фактора (англ. hypoxia inducible factor, HIF), киназы PI3KIII и протеин-киназы В (PI3K/AKT), р53-опосредованный путь, канцерогенез, инфекционно-воспалительные заболевания и др. (рис. 2). При этом стоит отметить, что обозначенные сигнальные пути и молекулярные функции исследуемых микроРНК, в целом, укладываются в общепринятое представление о патогенезе ПЭ.

Рисунок 2. Потенциальная роль дифференциально экспрессированных плацентарных микроРНК в регуляции различных сигнальных путей и биологических процессов.
Figure 2. Potential role for differentially expressed placental miRNAs
in regulating diverse signaling pathways and biological events.
Заключение / Conclusion
«Омиксные технологии» в настоящее время являются незаменимым инструментом для анализа сложных массивов биологических данных, позволяющим найти новые ассоциации между различными патогенетическими звеньями многокомпонентного процесса, в том числе разобраться в разнообразии клинических вариантов такой актуальной проблемы, как ПЭ.
Выявленная по данным проведенного транскриптомного анализа дифференциальная экспрессия некоторых плацентарных микроРНК при ПЭ указывает на ассоциацию данной патологии с неполноценной инвазией трофобласта, системным воспалительным ответом, эндотелиальной дисфункцией, дисбалансом ангиогенных и антиангиогенных факторов и метаболическими нарушениями.
При этом отмеченная разнонаправленность экспрессии некоторых микроРНК в подгруппах пациенток с ПЭ подтверждает правомерность разделения данной патологии согласно двум различным фенотипическим проявлений (ранней и поздней форм) и свидетельствует о существовании различных патофизиологических векторов в процессе формирования ПЭ.
Так, развитие ранней ПЭ с клинической манифестацией симптомов до 34 нед в большей степени ассоциировано с поверхностной инвазией вне ворсинчатого цитотрофобласта и нарушением иммунной толерантности материнского организма к плоду. В свою очередь, позднюю ПЭ правомерно рассматривать как чисто материнский синдром. Манифестация патологических изменений в ткани плаценты после 34 нед может объясняться вторичными нарушениями кровотока в микроциркуляторном русле матери и собственно метаболическими нарушениями материнского организма.
Приведенные заключения требуют дополнительного подтверждения и указывают на необходимость расширения спектра молекулярно-генетических исследований в этой области с учетом современных достижений в сфере «омиксных» технологий.
Список литературы
1. Филиппов О.С., Гусева Е.В. Материнская смертность в Российской Федерации в 2019 г. Проблемы репродукции. 2020;26(6–2):8–26. doi: 10.17116/repro2020260628.
2. Сидорова И.С., Никитина Н.А., Филиппов О.С. и др. Решенные и нерешенные вопросы преэклампсии по результатам анализа материнской смертности за последние 10 лет. Акушерство и гинекология. 2021;(4):64–74. doi: 10.18565/aig.2021.4.64-74.
3. Aldridge S., Teichmann S.A. Single cell transcriptomics comes of age. Nat Commun. 2020;11(1):4307. doi: 10.1038/s41467-020-18158-5.
4. Gong S., Gaccioli F., Dopierala J. et al. The RNA landscape of the human placenta in health and disease. Nat Commun. 2021;12(1):2639. doi: 10.1038/s41467-021-22695-y.
5. Клинические рекомендации – Преэклампсия. Эклампсия. Отеки, протеинурия и гипертензивные расстройства во время беременности, в родах и послеродовом периоде – 2021-2022-2023 (24. 06. 2021). М.: Министерство здравоохранения Российской Федерации, 2021. 54 с. Режим доступа: http://disuria.ru/_ld/10/1046_kr21O10O16MZ.pdf. [Дата обращения: 25. 12. 2023].
6. Howe C.G., Foley H.B., Kennedy E.M. et al. Extracellular vesicle microRNA in early versus late pregnancy with birth outcomes in the MADRES study. Epigenetics. 2022;17(3):269–85. doi: 10.1080/15592294.2021.1899887.
7. Kuokkanen S., Chen B., Ojalvo L. et al. Genomic profiling of microRNAs and messenger RNAs reveals hormonal regulation in microRNA expression in human endometrium. Biol Reprod. 2010;82(4):791–801. doi: 10.1095/biolreprod.109.081059.
8. Cai J.L., Liu L.L., Hu Y. et al. Polychlorinated biphenyls impair endometrial receptivity in vitro via regulating mir-30d expression and epithelial mesenchymal transition. Toxicology. 2016;365:25–34. doi: 10.1016/j.tox.2016.07.017.
9. Zhao Y., He D., Zeng H. et al. Expression and significance of miR-30d-5p and SOCS1 in patients with recurrent implantation failure during implantation window. Reprod Biol Endocrinol. 2021;19(1):138. doi: 10.1186/s12958-021-00820-2.
10. Balaguer N., Moreno I., Herrero M. et al. MicroRNA-30d deficiency during preconception affects endometrial receptivity by decreasing implantation rates and impairing fetal growth. Am J Obstet Gynecol. 2019;221(1):46. e1–46.e16. doi: 10.1016/j.ajog.2019.02.047.
11. Zhang L., Li K., Tian S. et al. Down-regulation of microRNA-30d-5p is associated with gestational diabetes mellitus by targeting RAB8A. J Diabetes Complications. 2021;35(8):107959. doi: 10.1016/j.jdiacomp.2021.107959.
12. Sun Y., Bilan P.J., Liu Z., Klip A. Rab8A and Rab13 are activated by insulin and regulate GLUT4 translocation in muscle cells. Proc Natl Acad Sci U S A. 2010;107(46):19909–14. doi: 10.1073/pnas.1009523107.
13. Ishikura S., Bilan P.J., Klip A. Rabs 8A and 14 are targets of the insulin-regulated Rab-GAP AS160 regulating GLUT4 traffic in muscle cells. Biochem Biophys Res Commun. 2007;353(4):1074–9. doi: 10.1016/j.bbrc.2006.12.140.
14. Wall A.A., Luo L., Hung Y. et al. Small GTPase Rab8a-recruited phosphatidylinositol 3-kinase γ regulates signaling and cytokine outputs from endosomal toll-like receptors. J Biol Chem. 2017;292(11):4411–22. doi: 10.1074/jbc.M116.766337.
15. Nakajo A., Yoshimura S., Togawa H. et al. EHBP1L1 coordinates Rab8 and Bin1 to regulate apical-directed transport in polarized epithelial cells. J Cell Biol. 2016;212(3):297–306. doi: 10.1083/jcb.201508086.
16. Wright K.R., Mitchell B., Santanam N. Redox regulation of microRNAs in endometriosis-associated pain. Redox Biol. 2017;12:956–66. doi: 10.1016/j.redox.2017.04.037.
17. Cai H., Zhou H., Miao Y. et al. MiRNA expression profiles reveal the involvement of miR-26a, miR-548l and miR-34a in hepatocellular carcinoma progression through regulation of ST3GAL5. Lab Invest. 2017;97(5):530–42. doi: 10.1038/labinvest.2017.12.
18. Liu C., Yang H., Xu Z. et al. microRNA-548l is involved in the migration and invasion of non-small cell lung cancer by targeting the AKT1 signaling pathway. J Cancer Res Clin Oncol. 2015;141(3):431–41. doi: 10.1007/s00432-014-1836-7.
19. Cheng B., Li J.Y., Li X.C. et al. MiR-323b-5p acts as a novel diagnostic biomarker for critical limb ischemia in type 2 diabetic patients. Sci Rep. 2018;8(1):15080. doi: 10.1038/s41598-018-33310-4.
20. Hedley P.L., Larsen S.O., Wøjdemann K.R. et al. First trimester maternal serum microRNA expression profile differentiates between uncomplicated pregnancies, and pregnancies which develop pre-eclampsia. medRxiv. 2023;23289708. doi: 10.1101/2023.05.09.23289708.
Об авторах
В. Э.А. КотельниковаРоссия
Виктория Эдгарда Александровна Котельникова, студент
295051; бульвар Ленина, д. 5/7; Симферополь
Д. Е. Пантюхова
Россия
Дарья Евгеньевна Пантюхова, студент
295051; бульвар Ленина, д. 5/7; Симферополь
Ф. Д. Аблямитова
Россия
Фера Диляверовна Аблямитова, студент
295051; бульвар Ленина, д. 5/7; Симферополь
С. Н. Викинская
Россия
Светлана Николаевна Викинская, студент
295051; бульвар Ленина, д. 5/7; Симферополь
Х. У. Халилова
Россия
Хатидже Умеровна Халилова, студент
295051; бульвар Ленина, д. 5/7; Симферополь
Л. Ф. Мустафаева
Россия
Лиля Февзиевна Мустафаева, студент
295051; бульвар Ленина, д. 5/7; Симферополь
Д. А. Бариева
Россия
Диана Айдыновна Бариева, студент
295051; бульвар Ленина, д. 5/7; Симферополь
Д. В. Яровая
Россия
Дарья Викторовна Яровая, студент
295051; бульвар Ленина, д. 5/7; Симферополь
Н. Д. Чопик
Россия
Наталья Дмитриевна Чопик, студент
295051; бульвар Ленина, д. 5/7; Симферополь
М. С. Ермакова
Россия
Мария Сергеевна Ермакова, студент
295051; бульвар Ленина, д. 5/7; Симферополь
Л. Е. Сорокина
Россия
Лея Евгеньевна Сорокина, младший научный сотрудник, врач аллерголог-иммунолог
295051; бульвар Ленина, д. 5/7; Симферополь; 115533; ул. Высокая, д. 19, корп. 2; Москва
Что уже известно об этой теме?
► Расширение современных представлений о мультифакториальности генеза и гетерогенности клинических проявлений преэклампсии (ПЭ) повлекло за собой выделение новых фенотипических вариантов данной патологии.
► Выделение ранней и поздней форм ПЭ при беременности имеет принципиальное значение для оценки прогноза и выбора тактики ведения пациенток.
► Плацентарный транскриптом играет важную роль в регуляции взаимодействий между «статичным» геномом и «динамичным» протеомом, что делает его перспективным инструментом для изучения молекулярных механизмов, лежащих в основе ПЭ.
Что нового дает статья?
► Доказана ассоциация ПЭ с неполноценной инвазией трофобласта, системным воспалительным ответом, эндотелиальной дисфункцией, дисбалансом ангиогенных и антиангиогенных факторов и метаболическими нарушениями.
► Продемонстрирована вовлеченность hsa-miR-656-3p, hsa-miR-151a-5p, hsa-miR-323a-5p, hsa-miR-4521, hsa-miR-519c-3p, hsa-let-7i-5p, hsa-miR-433-3p, hsa-miR-30d-5p, hsa-miR-548l, hsa-let-7g-5p, hsa-miR-214-5p, hsa-miR-27a-5p, hsa-miR-133b, hsa-miR-339-5p, hsa-miR-424-5p, hsa-miR-524-5p, hsa-miR-211-5p, hsa-miR-1283 в развитие ПЭ.
► Доказанная разнонаправленность экспрессии ряда плаценто-специфичных микроРНК в подгруппах беременных с ранней и поздней ПЭ свидетельствует о существовании различных патофизиологических векторов в процессе формирования рассматриваемой акушерской патологии.
Как это может повлиять на клиническую практику в обозримом будущем?
► Изменение экспрессии hsa-miR-656-3p, hsa-miR-151a-5p, hsa-miR-323a-5p, hsa-miR-4521, hsa-miR-519c-3p, hsa-let-7i-5p, hsa-miR-433-3p, hsa-miR-30d-5p, hsa-miR-548l, hsa-let-7g-5p, hsa-miR-214-5p, hsa-miR-27a-5p, hsa-miR-133b, hsa-miR-339-5p, hsa-miR-424-5p, hsa-miR-524-5p, hsa-miR-211-5p, hsa-miR-1283 позволяет рассматривать указанные микроРНК в качестве потенциальных биомаркеров развития ранней и/или поздней ПЭ.
► Выявленная ассоциация между изменениями транскриптома и развитием акушерской патологии позволяет изменить терапевтические подходы и стратегии в отношении пациенток с ранней и поздней ПЭ.
Рецензия
Для цитирования:
Котельникова В.Э., Пантюхова Д.Е., Аблямитова Ф.Д., Викинская С.Н., Халилова Х.У., Мустафаева Л.Ф., Бариева Д.А., Яровая Д.В., Чопик Н.Д., Ермакова М.С., Сорокина Л.Е. Особенности транскрипционного профиля пациенток с ранней и поздней преэклампсией. Акушерство, Гинекология и Репродукция. 2024;18(2):167-179. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.483
For citation:
Kotelnikova V.E., Pantyukhova D.E., Ablyamitova F.D., Vikinskaya S.N., Khalilova Kh.U., Mustafaeva L.F., Barieva D.A., Yarovaya D.V., Chopik N.D., Ermakova M.S., Sorokina L.E. Transcriptional profile features in patients with early and late preeclampsia. Obstetrics, Gynecology and Reproduction. 2024;18(2):167-179. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.483

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































