Перейти к:
Роль внеклеточных ловушек нейтрофилов в прогрессии рака и развитии тромбозов
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.475
Аннотация
Введение. Первоначально обнаруженные как механизм защиты нейтрофилов хозяина от патогенов и предотвращения распространения инфекции из очага воспаления, внеклеточные ловушки нейтрофилов (англ. neutrophil extracellular traps, NETs) оказались вовлечены в прогрессирование других заболеваний, связанных со стерильным воспалением, таких как аутоиммунные заболевания, диабет и рак. Компоненты NETs (миелопероксидаза, цитруллинированные гистоны, бесклеточная ДНК) имеют разностороннюю направленность в отношении опухолевых клеток, поэтому важно знать особенности биологических функций этих компонентов и их место в канцерогенезе, чтобы в дальнейшем можно было выделить основные молекулярные мишени для таргетной терапии онкогинекологических заболеваний.
Цель: определение влияния NETs на прогрессирование/метастазирование опухоли и риск тромбоза в контексте онкогинекологического рака.
Материалы и методы. Проведено одноцентровое интервенционное исследование. Обследованы 70 женщин с раком матки, яичников и шейки матки (основная группа). В качестве контрольной группы были отобраны 60 практически здоровых женщин соответствующего возраста без тромботических осложнений. Оценивали содержание миелопероксидазы (англ. myeloperoxidase, MРO), цитруллинированного гистона (англ. citrullinated histone, сitH3) и провоспалительного цитокина интерлейкина-1β (англ. interleukin-1β), а также изучено соотношение нейтрофилов и лимфоцитов (англ. neutrophil/ lymphocyte ratio, NLR).
Результаты. Значения МРО (p < 0,001), IL-1β (p < 0,001) и NLR (p = 0,003) были достоверно чаще повышены у пациенток с онкогинекологической патологией по сравнению с группой практически здоровых женщин. У 32 (45,7 %) из 70 женщин с онкологическими заболеваниями репродуктивной системы наблюдались метастазы. Анализ в зависимости от наличия/ отсутствия у пациенток метастазов показал существенные различия в уровне МРО (p = 0,002) и отсутствие статистически значимых различий в содержании сitH3, IL-1β и NLR (p = 0,441, p = 0,159 и p = 0,739 соответственно). Повышенный уровень сitH3 достоверно чаще, чем показатели MPO, IL-1β и NLR ассоциировался с развитием тромбозов у больных основной группы исследования (p < 0,001).
Заключение. Такие компоненты NETs, как МРО и сitH3 отражают потенциальную роль воспаления и NETs во многих аспектах рака, включая метастазирование опухоли и риск развития тромбозов у онкобольных.
Ключевые слова
Для цитирования:
Хизроева Д.Х., Асланова З.Д., Солопова А.Г., Бицадзе В.О., Воробьев А.В., Татаринцева А.Ю., Гри Ж., Элалами И., Макацария Н.А., Блинов Д.В. Роль внеклеточных ловушек нейтрофилов в прогрессии рака и развитии тромбозов. Акушерство, Гинекология и Репродукция. 2024;18(1):55-67. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.475
For citation:
Khizroeva J.Kh., Aslanova Z.D., Solopova A.G., Bitsadze V.O., Vorobev А.V., Tatarintseva А.Yu., Gris J., Elalamy I., Makatsariya N.А., Blinov D.V. The role of neutrophil extracellular traps in cancer progression and thrombosis development. Obstetrics, Gynecology and Reproduction. 2024;18(1):55-67. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.475
Введение / Introduction
В 2004 г. V. Brinkmann с соавт. обнаружили новый механизм иммунной защиты нейтрофилов [1], называемый внеклеточными ловушками нейтрофилов (англ. neutrophil extracellular traps, NETs), состоящих из волокон ДНК, гистонов, гранулированного содержимого и антимикробных белков, которые способствуют улавливанию и уничтожению патогенных бактерий [2]. Формирование NETs, известное как нетоз (англ. NETosis), происходит, когда специфические протеазы транслоцируются в ядро нейтрофила, что приводит к деконденсации их хроматина посредством цитруллинирования. Миелопероксидаза (англ. myeloperoxidase, MPO) и эластаза (англ. neutrophils elastase, NE) нейтрофилов высвобождаются из азурофильных гранул нейтрофилов и перемещаются в ядро клетки [2][3]. Активированная пептидил-аргинин деиминаза 4 (англ. peptidyl arginine deiminase 4, PAD4) перемещается в ядро и катализирует дезаминирование гистонов (англ. histone, Н) H2A, H3 и H4, превращая остатки аргинина в цитруллин. Потеря положительного заряда гистонов приводит к заметному снижению компактности хроматина. Эти слабо связанные нити затем в конечном итоге удаляются из клетки, разрывая ее или оставляя мембрану неповрежденной. Ядерные и митохондриальные мембраны распадаются, внутриклеточное содержимое высвобождается во внеклеточное пространство, и нейтрофил погибает. Последующая целостность мембраны зависит от характера раздражителя, провоцирующего нетоз. Таким образом, формирование NETs может быть достигнуто в процессе гибели клеток (суицидальный нетоз) или в связи с высвобождением митохондриальной ДНК из жизнеспособных нейтрофилов (витальный нетоз).
Хорошо известно, что нейтрофилы могут быстро уничтожать патогены путем фагоцитоза, а также за счет высвобождения мощного антимикробного арсенала, который включает гранулированные ферменты, белки и окислители (активные формы кислорода). Поэтому первоначально возникновение NETs было расценено как новый иммунный ответ на бактериальную инфекцию. Однако впоследствии было обнаружено, что нетоз проявляется и при множестве других воспалительных заболеваний, включая рак. Связь между хроническим воспалением и раком подозревалась давно, но только недавно были частично раскрыты клеточные и молекулярные механизмы этой ассоциации. И сегодня воспаление, связанное с раком, признано движущей силой развития онкогенеза. Реакция организма на рак не является уникальным механизмом, она имеет много параллелей с воспалением и процессом заживлением ран. Более того, воспаление является ключевым компонентом микроокружения опухоли [4]. Полиморфизмы генов провоспалительных цитокинов связаны с повышенной восприимчивостью к развитию раковой опухоли, и наоборот, ингибирование провоспалительных цитокинов снижает риск развития экспериментального рака. Если генетическое повреждение является «спичкой, которая разжигает огонь» рака, то некоторые виды воспаления могут стать «топливом, которое подпитывает пламя» [5]. Эпидемиологические исследования показывают, что хронические инфекции лежат в основе 15–20 % всех случаев развития рака, и риск канцерогенеза возрастает в условиях хронического воспаления [6]. Еще в XIX веке немецкий патолог Рудольф Вирхов, наблюдая за лейкоцитарной инфильтрацией в опухолевой ткани, сделал вывод, что злокачественные новообразования возникают в области хронического воспаления, вызывающего повреждение тканей и усиленный рост клеток [5].
Ассоциированные с опухолью макрофаги и ассоциированные с опухолью нейтрофилы, которые обеспечивают первую линию защиты при попадании в организм инфекционного агента, являются прототипами воспалительных клеток при воспалении, связанном с раком. Они способствуют росту опухоли и метастазированию путем прямого взаимодействия с раковыми клетками, включая раковые стволовые клетки, а также путем стимулирования ангиогенеза, ремоделирования тканей и подавления эффективного адаптивного иммунитета.
В настоящее время наше понимание многочисленных функций нейтрофилов in vivo у онкологических больных остается ограниченным. Еще несколько лет назад нейтрофилам уделялось небольшое внимание в иммунологии опухоли, воспринимая их как второстепенный компонент микроокружения опухоли, поскольку они считались короткоживущими клетками с периодом полураспада в крови человека около 10 ч с ограниченной транскрипционной активностью [7]. Однако есть доказательства важной роли опухольассоциированных нейтрофилов в прогрессировании опухоли. Маркировка человеческих нейтрофилов in vivo показала, что эти клетки выживают в кровотоке более 5 дней. Более того, цитокины, секретируемые опухолевыми и иммунными клетками, такие как интерлейкины (англ. interleukin, IL) IL-1β, IL-6 или фактор некроза опухоли альфа (англ. tumor necrosis factor alpha, TNF-α) могут продлевать продолжительность их жизни [8].
В течение последнего десятилетия функции нейтрофилов у онкологических больных начали изучаться более подробно. Нейтрофилы присутствуют в микроокружении опухоли и проявляют как проонкогенные, так и противоопухолевые реакции. Нейтрофилы могут способствовать генетической нестабильности, пролиферации опухолевых клеток, ангиогенезу и подавлению противоопухолевого иммунного ответа. И наоборот, нейтрофилы могут проявлять противоопухолевую резистентность путем прямого уничтожения опухолевых клеток или путем совместного взаимодействия с другими иммунными клетками. В различных экспериментальных моделях нейтрофилы проявляли противоопухолевую активность, непосредственно убивая опухолевые клетки и активируя αβ-Т-клетки и CD4+ и CD8+ Т-клетки [9]. Однако опухолевые факторы могут перепрограммировать нейтрофилы с противоопухолевого фенотипа на проопухолевый фенотип [10].
Известно, что нейтрофилы инфильтрируют ткань опухоли, являясь ключевым медиатором неопластической трансформации, прогрессирования опухоли, ангиогенеза и модуляции иммунного ответа. NETs прямо или косвенно способствуют росту и прогрессированию опухоли, распространению ее на отдаленные участки и защищают раковые клетки, предотвращая их от воздействия цитотоксических лимфоцитов. NETs также могут способствовать ангиогенезу опухоли и прогрессированию воспалительного микроокружения, создавая своеобразную петлю положительной обратной связи: попадая в кровоток, NETs повреждают эндотелиальные клетки, способствуя дальнейшему воспалению и вызывая активацию тромбоцитов и других нейтрофилов, что приводит к дальнейшему высвобождение NETs [11]. Активация тромбоцитов, в свою очередь, также может способствовать ряду негативных исходов, связанных с метастазированием опухоли и развитием венозных тромбоэмболических осложнений (ВТЭО) [12].
Внеклеточные ловушки нейтрофилов способствуют метастазированию с помощью нескольких механизмов. Из-за слабой ангиогенной активности и защитной роли иммунных клеток метастатические раковые клетки могут оставаться бездействующими в течение длительного периода [13]. NE и катепсин G пробуждают дремлющие раковые клетки, расщепляя белок внеклеточного матрикса ламин, генерируя эпитоп, который связывается с опухолевыми интегринами, приводя к пролиферации и миграции раковых клеток [10][14]. Кроме того, NETs усиливают метастазирование, способствуя эпителиально-мезенхимальному переходу, при котором эпителиальные клетки трансформируются в мезенхимальные, обладающие высокой миграционной и инвазивной способностью [15]. Нейтрофилы могут прилипать к циркулирующим опухолевым клеткам, способствуя их пролиферации и метастазированию [16]. Хорошо известно, что нейтрофилы питают опухолевые клетки с помощью своего секрета, включающего различные цитокины, хемокины, факторы роста и внеклеточный матрикс [17]. Более того, нейтрофилы обеспечивают липидами опухолевые клетки (своего рода топливом), стимулируя их пролиферацию и метастатическую активность. В экспериментальной модели рака молочной железы резидентные макрофаги стимулируют легочные нейтрофилы накапливать липиды и, в свою очередь, транспортировать накопленные ими липиды к метастатическим опухолевым клеткам для выживания и пролиферации, что приводит к ускоренному метастазированию в легких [18].
Также NETs способствуют образованию предметастатической ниши путем захвата циркулирующих опухолевых клеток в свою «паутинообразную» структуру, образуя участок, из которого эти клетки затем могут экстравазировать. Интересным является тот факт, что хирургическая резекция, направленная на уменьшение опухолевой нагрузки, на самом деле может способствовать метастазированию за счет активации нейтрофилов и последующего образования NETs. Данный эффект повышенного метастазирования после хирургического вмешательства был воспроизведен на мышиных моделях и был устранен обработкой ферментом ДНКазой I или ингибированием PAD4 для диссоциации NETs или предотвращения их высвобождения, соответственно [19].
NETs могут способствовать тромбозу, усиливая состояние гиперкоагуляции раковых больных [20][21].
В связи с этим можно предположить, что выявление и ингибирование NETs имеет большое значение не только для диагностики рака, но и определения прогноза и профилактики метастазирования. Нацеливание на опухоль-ассоциированные нейтрофилы и NETs может проложить путь к инновационным терапевтическим подходам в лечении рака, дополняющих циторедуктивную терапию и иммунотерапию. К сожалению, на сегодняшний день не существует стандартизированного определения «нормальных» уровней нетоза, и диагностика NETs, которая включает определение циркулирующей бесклеточной ДНК (англ. cell-free DNA, cfDNA), цитруллинированного
гистона (англ. citrullinated histone, citH3), NE и MPO, выполняется лишь в специализированных лабораториях [1].
Другими потенциальными биомаркерами воспаления и NETs могут служить нейтрофильно/лимфоцитарное соотношение (англ. neutrophil/lymphocyte ratio, NLR) и/или уровень мощного провоспалительного цитокина IL-1β, который, как правило, воздействует на пролиферацию и инвазию раковых клеток, неоангиогенез или инфильтрирующие опухоль иммунные клетки. Однако в зависимости от типа или стадии рака, основного типа иммунных клеток, присутствующих в микроокружении опухоли, и используемого противоракового лечения IL-1β может проявлять и противоопухолевые свойства. На различных моделях опухолей было показано, что инъекция IL-1β может уменьшать или не уменьшать рост опухоли в зависимости от условий эксперимента. Слишком раннее введение или однократная инъекция IL-1β не оказывает влияния на рост опухоли, в то время как несколько инъекций и более высокие дозы (10 мкг) ингибируют рост опухоли [22]. Когда эти эксперименты проводились на мышах с иммунодефицитом, IL-1β не оказывал никакого эффекта, что позволяет предположить участие Т-клеток в эффектах, опосредованных IL-1β. Поэтому ингибирование IL-1β не всегда может быть полезным для пациентов, и влияние IL-1β на прогрессию опухоли требует дальнейших исследований [23].
Нейтрофильно/лимфоцитарное соотношение используется в качестве надежного и дешевого маркера продолжающегося воспаления, связанного с раком, и достоверного показателя прогноза опухолей. Сегодня NLR широко используется практически во всех медицинских дисциплинах в качестве надежного и легкодоступного маркера иммунного ответа на различные инфекционные и неинфекционные раздражители. Этот биомаркер отражает динамическую взаимосвязь между врожденным (нейтрофилы) и адаптивным (лимфоциты) клеточным иммунным ответом при различных патологических состояниях. На его результат влияют различные факторы, включая возраст, расу, прием лекарств, хронические заболевания, такие как ишемическая болезнь сердца, инсульт, диабет, ожирение, психиатрический диагноз, анемия, стресс и рак. В большинстве метаанализов изучалась прогностическая ценность NLR при различных солидных опухолях, и было установлено пороговое значение выше 3,0 [24]. Тяжесть критического состояния, уровень стресса и серьезного воспаления выражается в резком увеличении значений NLR выше 11 и даже выше 30.
В связи с этим основной вопрос настоящего исследования заключался в том, имеют ли NETs прогностическую ценность у пациентов с онкогинекологическим раком.
Цель: определение влияния NETs на прогрессирование/метастазирование опухоли и риск тромбоза в контексте онкогинекологического рака.
Материалы и методы / Materials and Methods
Дизайн исследования / Study design
Проведено одноцентровое интервенционное исследование, основную группу которого составили 70 женщин с диагностированным онкогинекологическим раком. Контрольную группу составили 60 практически здоровых женщин. Сбор клинического материала проводился с 2021 по 2023 гг. на базе ФГБУ «Российский научный центр рентгенорадиологии» Министерства здравоохранения Российской Федерации. Средний возраст всей когорты обследованных женщин составил 56,0 [ 47,0; 63,0] лет. Для характеристики стадий рака были использованы клиническая классификация (0–IV стадии болезни) и международная система классификации злокачественных новообразований TNM, в которой учитываются следующие характеристики: T (англ. tumor) – размеры самой опухоли; N (англ. nodulus) – распространение на лимфатические узлы; M (англ. metastasis) – наличие или отсутствие метастазов.
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения в основную группу: возраст от 18 до 75 лет; подтвержденный диагноз онкогинекологического заболевания женской репродуктивной системы по данным клинико-лабораторных, инструментальных и морфологических исследований; подписанное информативное согласие.
Критерии исключения из основной группы: возраст младше 18 лет либо старше 75 лет; тяжелая сопутствующая патология, не связанная с онкологическим заболеванием; психические заболевания; беременность; нежелание участвовать в исследовании.
Критерии включения в контрольную группу: практически здоровые женщины без диагностированного онкологического заболевания и без тромбоза в анамнезе в возрасте от 18 до 75 лет.
Критерии исключения из контрольной группы: отказ от участия в исследование.
Методы исследования / Study methods
На первом этапе исследования в первый день госпитализации в ФГБУ «РНЦРР» Минздрава России (до начала терапии) отбирали образцы крови для общеклинического и биохимического анализа крови; также было выполнено определение содержания фибриногена и D-димера, значений протромбинового времени (ПВ), активированного частичного тромбопластинового времени (АЧТВ), международного нормализованного отношения (МНО).
На следующем этапе проводилась диагностика NETs. Было выполнено определение содержания МРО, сitH3, IL-1β и значений NLR. Количественное определение МРО проводили методом иммуноферментного анализа (ИФА) с использованием тест систем MPO Human Kit (Hycult Biotech, Нидерланды). Нормативный диапазон содержания МРО в сыворотке крови согласно данным производителя составляет 2,23–2,89 нг/мл.
Концентрацию сitH3 определяли ИФА методом с помощью реактива CitH3 (Clone 11D3) EIA Kit (Cayman Chemical, США); референсные значения составляли 0–5 нг/мл.
Для количественного определения IL-1β методом ИФА был использован набор IL-1 beta Human ELISA Kit (Invitrogen by Thermo Fisher Scientific, США) с референсным нормативными значениями 0–5 пг/мл.
NLR определяли путем деления абсолютного содержания нейтрофилов к абсолютному содержанию лимфоцитов (NLR = ANC/ALC, где ANC – это абсолютное содержание нейтрофилов (англ. absolute neutrophils count); ALC – aбсолютное содержание лимфоцитов (англ. absolute lymphocyte count). Возможно также деление процентного соотношения уровня нейтрофилов к процентному содержанию лимфоцитов. Нормальный диапазон NLR находится в пределах 1–2, значения свыше 3,0 и ниже 0,7 у взрослых являются патологическими. Показатели в «серой зоне» между 2,3–3,0 являются ранним предупреждением о патологическом состоянии или процессе, таком как рак, атеросклероз, инфекция, воспаление, психические расстройства и стресс [25].
Этические аспекты / Ethical aspects
Исследование проведено в соответствии с этическими стандартами Хельсинской декларации Всемирной медицинской ассоциации 1964 г. и ее последующими изменениями. Устное и письменное согласие пациентов было получено до включения в исследование. Исследование было одобрено локальным этическим комитетом Сеченовского Университета, протокол № 10-21 от 17.06.2021.
Статистический анализ / Statistical analysis
Статистический анализ проводился с использованием программы StatTech v. 4.0.4 (ООО «Статтех», Россия). Сравнение двух групп по количественному показателю, имеющему нормальное распределение, при условии равенства дисперсий выполнялось с помощью t-критерия Стьюдента. Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью U-критерия Манна–Уитни. Вычисляли абсолютные и относительные частоты (% от общего числа наблюдений), медианы с интерквартильным интервалом (Ме [Q25; Q75]). Рассчитывали параметры описательной статистики: среднее (М), стандартное отклонение (SD), 95 % доверительный интервал (95 % ДИ).
Для оценки диагностической значимости количественных признаков при прогнозировании определенного исхода применяли метод анализа ROC-кривых. Разделяющее значение количественного признака в точке cut-off определяли по наивысшему значению индекса Юдена. Различия считали статистически значимыми при p < 0,05.
Результаты и обсуждение / Results and Discussion
Основную группу исследования составили 70 женщин со злокачественным заболеванием: у 8 женщин был диагностирован рак шейки матки (у 4 – I стадия, у 4 – III стадия рака), у 38 – рак тела матки (у 24 – I стадия, у 10 – III стадия рака), у 24 – рак яичников (у 4 – I стадия, у 2 – II стадия, у 16 – III стадия, у 2 – IV стадия). Гистологически у всех пациенток была выявлена аденокарцинома. Не было статистических различий по возрасту и индексу массы тела (ИМТ) в основной группе женщин с онкогинекологическим диагнозом (n = 70) и в контрольной группе практически здоровых женщин (n = 60).
Сравнительная характеристика рутинных показателей крови (общий уровень лейкоцитов, тромбоцитов, лимфоцитов, гемоглобина, СОЭ) не выявила статистически значимых различий. В основной группе выявлено 5 случаев анемии, столько же наблюдалось в контрольной группе; отмечена статистически значимая разница медиан NLR (p = 0,014). В группе с онкологической патологией NLR было статистически значимо выше, чем в контрольной (табл. 1).
Таблица 1. Показатели общеклинического анализа крови.
Table 1. Parameters of general blood test.
|
Показатель Parameter |
Нормальные значения Normal range |
Основная группа Main group n = 70 Me [Q25; Q75] |
Контрольная группа Control group n = 60 Me [Q25; Q75] |
р |
|
Лейкоциты, ×109/л Leukocytes, ×109/L |
3,5–10,5 |
6,24 [ 4,60; 7,36] |
6,18 [ 4,79; 7,12] |
0,680 |
|
Гемоглобин, г/л Hemoglobin, g/L |
120–140 |
125 [ 122; 131] |
127 [ 121; 134] |
0,654 |
|
Тромбоциты, ×109/л Platelets, ×109/L |
144–372 |
247 [ 211; 313] |
245 [ 220; 315] |
0,768 |
|
Лимфоциты абс., тыс/мкл Lymphocytes abs., ths/µl |
1,2–3,2 |
1,59 [ 1,39; 2,01] |
1,93 [ 1,48; 2,28] |
0,364 |
|
Лимфоциты, % Lynmphocytes, % |
19–37 |
24,0 [ 22,3; 30,8] |
25,6 [ 20,0; 32,3] |
0,874 |
|
Скрость оседания эритроцитов (СОЭ), мм/час |
2–15 |
12,0 [ 10,0; 14,3] |
9,0 [ 5,0; 13,3] |
0,166 |
|
Количество случаев лимфоцитопении |
– |
12/70 |
8/20 |
0,572 |
|
Количество случаев лимфоцитоза Lymphocytosis rate |
– |
6/70 |
3/60 |
0,552 |
|
Количество случаев анемии Anemia rate |
– |
15/70 |
15/60 |
1,000 |
|
Количество случаев повышения СОЭ Increased ESR rate |
– |
12/70 |
9/60 |
1,000 |
|
Отношение нейтрофилы/лимфоциты |
1,0–3,0 |
2,95 [ 2,09; 3,39] |
1,9 [ 1,45; 2,58] |
0,03 |
Примечание: выделены значимые различия между группами.
Note: significant inter-group differences are highlighted.
Определение маркеров NETs продемонстрировало следующие результаты: в основной группе пациентов высокое содержание МРО было выявлено у 64 (91,4 %) женщин, которое варьировало от 7,61 до 36,86 нг/мл при нормальных значениях 2,23–2,89 нг/мл. В контрольной группе повышенный уровень МРО наблюдался у 10 (16,7 %) из 60 пациентов, при этом максимальное значение не превышало 3,65 нг/мл. Построенный график boxplot (рис. 1) демонстрирует статистически значимые различия (р < 0,001) содержания МРО в группах исследования.
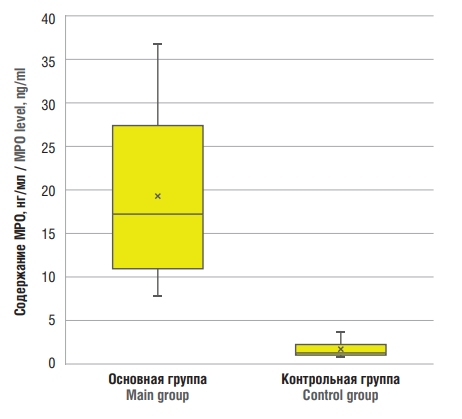
Рисунок 1. Содержание миелопероксидазы (МРО) в сыворотке крови.
Figure 1. Serum myeloperoxidase (MPO) level.
Определение концентрации сitH3 не выявило значимых различий между группами (p = 0,536). Повышенные значения сitH3 установлены у 26 (37 %) из 70 женщин основной группы и у 20 (33,3 %) из 60 женщин контрольной группы. При этом повышение уровня сitH3 у одной из пациенток основной группы было почти в 3 раза выше, чем в контрольной группе, и составляло 36,55 нг/мл (при нормальных значениях менее 5 нг/мл). Максимальное повышение уровня сitH3 в контрольной группе достигало 13,9 нг/мл (у 1 женщины контрольной группы). Кроме того, следует отметить, что наиболее высокое содержание сitH3 в крови выявлено у 7 (10 %) женщин с тромботическими осложнениями, перенесенными незадолго до диагностирования онкологического заболевания.
Содержание провоспалительного цитокина IL-1β в сыворотке крови было статистически значимо выше, чем в контрольной группе. У 49 (70 %) женщин с онкогинекологическими злокачественными заболеваниями (рис. 2) уровень IL-1β превышал норму, в то время как в контрольной группе ни у одной женщины не отмечалось повышение его значений (р < 0,001).
При сравнении пациентов с онкологической патологией и практически здоровых женщин (табл. 2) выявлены статистически значимые различия в следующих параметрах: содержание МРО (р < 0,001), значения IL-1β (р < 0,001) и NLR (p = 0,030). Различия оказались статистически незначимы при сравнении уровня сitH3 (p = 0,536).
Таблица 2. Содержание компонентов внеклеточных ловушек нейтрофилов в сыворотке крови.
Table 2. Blood serum level of neutrophil extracellular traps constituents.
|
Показатель Parameter |
Нормальные значения Normal range |
Основная группа Main group n = 70 Me [Q25; Q75] |
Контрольная группа Control group n = 60 Me [Q25; Q75] |
р |
|
Миелопероксидаза, нг/мл Myeloperoxidase, ng/ml |
2,23–2,89 |
18,38 [ 2,99; 35,24] |
1,50 [ 0,62; 3,65] |
< 0,001 |
|
Интерлейкин-1β, пг/мл Interleukin-1β level, pg/ml |
< 5,0 |
5,53 [ 2,65; 7,10] |
1,69 [ 0,90; 3,20] |
< 0,001 |
|
Цитруллинированный гистон, нг/мл Citrullinated histone, ng/ml |
< 5,0 |
6,98 [ 0,01; 36,55] |
5,35 [ 1,76; 13,90] |
0,536 |
|
Отношение нейтрофилы/лимфоциты Neutrophil/lymphocyte ratio |
1,0–3,0 |
3,11 [ 1,30; 8,70] |
1,9 [ 1,0; 4,0] |
0,030 |
Примечание: выделены значимые различия между группами.
Note: significant inter-group differences are highlighted.
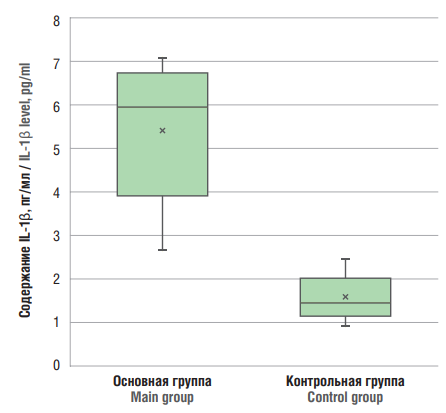
Рисунок 2. Содержание интерлейкина-1β (IL-1β) в сыворотке крови.
Figure 2. Serum interleukin-1β (IL-1β) level.
На следующем этапе был выполнен сравнительный анализ уровней МРО, IL-1β, сitH3 и NLR в зависимости от стадии заболевания, наличия тромбоза и метастазов у пациенток основной группы.
При сравнении значений МРО, IL-1β, сitH3 и NLR от стадии рака мы не нашли достоверной зависимости (табл. 3).
У 16 (22,8 %) женщин основной группы в течение 1 года до диагностирования и уже после выявления онкологического заболевания наблюдались венозные и артериальные тромбозы. При анализе содержания МРО, IL-1β и значений NLR в зависимости от тромбоза (используемый метод: t–критерий Стьюдента) в анамнезе пациенток основной группы не удалось установить статистически значимых различий (p = 0,761, p = 0,745 и p = 0,351 соответственно). Однако при анализе значений сitH3 в зависимости от наличия тромбоза нами были установлены статистически значимые различия (p < 0,001) (табл. 4).
У 32 (45,7 %) из 70 женщин с онкологическими заболеваниями репродуктивной системы наблюдались метастазы. Анализ значений МРО, IL-1β и NLR установил существенные различия (p = 0,002) в уровне МРО в зависимости от наличия у пациенток метастазов (табл. 5).
Таблица 3. Содержание миелопероксидазы, интерлейкина-1β, цитруллинированного гистона и соотношения нейтрофилы/лимфоциты у онкогинекологических пациентов в зависимости от стадии заболевания.
Table 3. Myeloperoxidase, interleukin-1β, citrullinated histone level and neutrophil/lymphocyte ratio in gynecological cancer patients related to disease stage.
|
Показатель Parameter |
Стадия рака / Cancer stage Me [Q25; Q75] |
р |
|||
|
I |
II |
III |
IV |
||
|
Миелопероксидаза, нг/мл Myeloperoxidase, ng/ml |
19,27 |
10,28 |
21,13 |
21,45 |
0,964 |
|
Интерлейкин-1β, пг/мл Interleukin-1β level, pg/ml |
5,17 |
5,17 |
5,75 |
5,00 |
0,864 |
|
Цитруллинированный гистон, нг/мл Citrullinated histone, ng/ml |
3,54 |
19,60 |
4,05 |
13,95 |
0,231 |
|
Отношение нейтрофилы/лимфоциты Neutrophil/lymphocyte ratio |
2,85 |
3,05 |
1,85 |
2,29 |
0,838 |
Таблица 4. Cодержание цитруллинированного гистона (сitH3) у онкогинекологических пациентов в зависимости от наличия тромбоза.
Table 4. Thrombosis-related citrullinated histone (сitH3) level in gynecological cancer patients.
|
Показатель Parameter |
Категория Category |
Содержание сitH3, нг/мл / сitH3 level, ng/ml |
р |
||
|
Me |
Q₁–Q₃ |
n |
|||
|
Тромбоз Thrombosis |
Наличие тромбоза Thrombosis detected |
16,74 |
15,65–20,02 |
7 |
< 0,001 |
|
Отсутствие тромбоза No thrombosis |
2,00 |
0,52–5,57 |
23 |
||
Таблица 5. Содержание миелопероксидазы (МРО) у онкогинекологических пациентов в зависимости от наличия метастазов.
Table 5. Metastasis-related myeloperoxidase (MPO) level in gynecological cancer patients.
|
Показатель Parameter |
Категория Category |
Содержание МРО, нг/мл / MPO level, ng/ml |
р |
||
|
M ± SD |
95 % ДИ / 95 % Cl |
n |
|||
|
Метастазы Metastases |
Метастазы есть Metastasis detected |
26,26 ± 11,20 |
19,79–32,73 |
14 |
0,002 |
|
Метастазов нет No metastasis |
12,88 ± 10,30 |
7,40–18,37 |
16 |
||
Примечание: 95 % ДИ – 95 % доверительный интервал.
Note: 95% CI – 95% confidence interval.
При оценке зависимости вероятности наличия метастазов от содержания МРО с помощью ROC-анализа была получена следующая кривая (рис. 3).
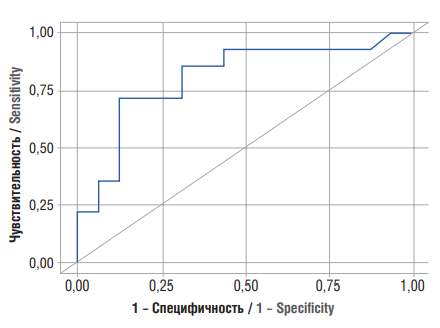
Рисунок 3. ROC-кривая, характеризующая зависимость вероятности метастазов от содержания миелопероксидазы.
Figure 3. ROC curve characterizing a relation between metastasis probability and myeloperoxidase level.
Площадь под ROC-кривой составила 0,806 ± 0,083 с 95 % ДИ = 0,644–0,968. Полученная модель была статистически значимой (p = 0,004). Анализ чувствительности и специфичности модели в зависимости от пороговых значений МРО показал, что пороговое ее содержание в точке cut-off, которому соответствовало наивысшее значение индекса Юдена, составило 22,990 нг/мл. Вероятность наличия метастазов прогнозировалась при содержании МРО выше данной величины или равном ей. Чувствительность и специфичность модели составили 71,4 % и 87,5 %, соответственно.
При анализе значений сitH3, IL-1β и NLR в зависимости от наличия метастазов не удалось установить статистически значимых различий (p = 0,441, p = 0,159 и p = 0,739 соответственно).
Заключение / Conclusion
Присутствие лейкоцитов в опухолях, описанное еще в XIX веке Рудольфом Вирховым, стало первым признаком возможной связи между воспалением и раком. Тем не менее только в течение последнего десятилетия были получены четкие доказательства того, что воспаление играет решающую роль в онкогенезе, и сегодня воспаление и NETs часто связывают с развитием и прогрессированием рака. Раковые клетки рекрутируют ассоциированные с опухолью нейтрофилы, высвобождая NETs в микроокружение опухоли.
Результаты проведенного исследования показывают, что такие компоненты NETs, как МРО, сitH3, IL-1β и NLR отражают потенциальную роль воспаления и NETs во многих аспектах рака, включая метастазирование опухоли и риск развития тромбозов у онкобольных. Такие лабораторные биомаркеры, как МРО, IL-1β и NLR были достоверно чаще повышены у пациентов с онкологической патологией по сравнению с группой практически здоровых женщин.
Содержание МРО было повышено практически у всех пациенток (91,4 %) основной группы независимо от стадии болезни. Анализ значений МРО в зависимости от наличия метастазов выявил статистически значимые различия при сравнении с онкобольными без метастазирования опухоли. Вероятность наличия метастазов прогнозировалась при пороговом содержании МРО свыше 22,990 нг/мл.
NETs могут способствовать тромбозу, а циркулирующий биомаркер NETs – сitH3 является прогностическим фактором риска развития венозного тромбоза у онкологических больных.
Данное исследование предоставляет дополнительные доказательства роли NETs в метастазировании рака и развитии тромбозов и подчеркивает важность проведения диагностики биомаркеров NETs для дифференциации пациентов с более высоким риском метастатического прогрессирования опухоли или развития ВТЭО, что позволит лучше персонифицировать схемы лечения данных больных. NETs может быть многообещающей терапевтической мишенью при раке, так как ингибирование образования NETs или рассасывание NETs в экспериментальных моделях снижает тяжесть заболевания и уменьшает риск метастазирования опухоли.
Список литературы
1. Brinkmann V., Reichard U., Goosmann C. et al. Neutrophil extracellular traps kill bacteria. Science. 2004;303(5663):1532–5. https://doi.org/10.1126/science.1092385.
2. Snoderly H.T., Boone B.A., Bennewitz M.F. Neutrophil extracellular traps in breast cancer and beyond: current perspectives on NET stimuli, thrombosis and metastasis, and clinical utility for diagnosis and treatment. Breast Cancer Res. 2019;21(1):145. https://doi.org/10.1186/s13058-019-1237-6.
3. Papayannopoulos V., Metzler K.D., Hakkim A., Zychlinsky A. Neutrophil elastase and myeloperoxidase regulate the formation of neutrophil extracellular traps. J Cell Biol. 2010;191(3):677–91. https://doi.org/10.1083/jcb.201006052.
4. Hanahan D., Weinberg R.A. Hallmarks of cancer: the next generation. Cell. 2011;144(5):646–74. https://doi.org/10.1016/j.cell.2011.02.013.
5. Balkwill F., Mantovani A. Inflammation and cancer: back to Virchow? Lancet. 2001;357(9255):539–45. https://doi.org/10.1016/S0140-6736(00)04046-0.
6. Bonavita E., Galdiero M.R., Jaillon S., Mantovani A. Phagocytes as сorrupted зolicemen in сancer-кelated шnflammation. Adv Cancer Res. 2015;128:141–71. https://doi.org/10.1016/bs.acr.2015.04.013.
7. Coffelt S., Wellenstein M., de Visser K. Neutrophils in cancer: neutral no more. Nat Rev Cancer. 2016;16(7):431–46. https://doi.org/10.1038/nrc.2016.52.
8. Colotta F., Re F., Polentarutti N. et al. Modulation of granulocyte survival and programmed cell death by cytokines and bacterial products. Blood. 1992;80(8):2012–20.
9. Carnevale S., Ghasemi S., Rigatelli A., Jaillon S. The complexity of neutrophils in health and disease: focus on cancer. Semin Immunol. 2020;48:101409. https://doi.org/10.1016/j.smim.2020.101409.
10. De Meo M.L., Spicer J.D. The role of neutrophil extracellular traps in cancer progression and metastasis. Semin Immunol. 2021;57:101595. https://doi.org/10.1016/j.smim.2022.101595.
11. Слуханчук Е.В., Бицадзе В.О., Солопова А.Г. и др. Маркеры внеклеточных ловушек нейтрофилов у женщин со злокачественными новообразованиями репродуктивной системы, получавших хирургическое лечение и адъювантную химиотерапию. Акушерство, Гинекология и Репродукция. 2023;17(4):420–32. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.432.
12. Cristinziano L., Modestino L., Antonelli A. et al. Neutrophil extracellular traps in cancer. Semin Cancer Biol. 2022;79:91–104. https://doi.org/10.1016/j.semcancer.2021.07.011.
13. Sosa M.S., Bragado P., Aguirre-Ghiso J.A. Mechanisms of disseminated cancer cell dormancy: an awakening field. Nat Rev Cancer. 2014;14(9):611–22. https://doi.org/10.1038/nrc3793.
14. Albrengues J., Shields M.A., Ng D. et al. Neutrophil extracellular traps produced during inflammation awaken dormant cancer cells in mice. Science. 2018;361(6409):eaao4227. https://doi.org/10.1126/science.aao4227.
15. Poto R., Cristinziano L, Modestino L. et al. Neutrophil extracellular traps, angiogenesis and cancer. Biomedicines. 2022;10(2):431. https://doi.org/10.3390/biomedicines10020431.
16. Szczerba M.B., Castro-Giner F., Vetter M. et al. Neutrophils escort circulating tumour cells to enable cell cycle progression. Nature. 2019;566(7745):553–7. https://doi.org/10.1038/s41586-019-0915-y.
17. Shaul M.E., Fridlender Z.G. Tumour-associated neutrophils in patients with cancer. Nat Rev Clinical Oncol. 2019;16(10):601–20. https://doi.org/10.1038/s41571-019-0222-4.
18. Li P., Lu M., Shi J. et al. Lung mesenchymal cells elicit lipid storage in neutrophils that fuel breast cancer lung metastasis. Nat Immunol. 2020;21(11):1444–55. https://doi.org/10.1038/s41590-020-0783-5.
19. Tohme S., Yazdani H.O., Al-Khafaji A.B. et al. Neutrophil extracellular traps promote the development and progression of liver metastases after surgical stress. Cancer Res. 2016;76(6):1367–80. https://doi.org/10.1158/0008-5472.CAN-15-1591.
20. Mauracher L.M., Posch F., Martinod K. et al. Citrullinated histone H3, a biomarker of neutrophil extracellular trap formation, predicts the risk of venous thromboembolism in cancer patients. J Thromb Haemost. 2018;16(3):508–18. https://doi.org/10.1111/jth.13951.
21. Слуханчук Е.В., Бицадзе В.О., Солопова А.Г. и др. Иммунотромбоз, прогрессия опухоли и метастазирование. Роль интерлейкина-8 и внеклеточных ловушек нейтрофилов. Вопросы гинекологии, акушерства и перинатологии. 2023;22(4):48–56. https://doi.org/10.20953/1726-1678-2023-4-48-56.
22. North R.J., Neubauer R.H., Huang J.J. et al. Interleukin 1-induced, T cellmediated regression of immunogenic murine tumors. Requirement for an adequate level of already acquired host concomitant immunity. J Exp Med. 1988;168(6):2031–43. https://doi.org/10.1084/jem.168.6.2031.
23. Rébé C., Ghiringhelli F. Interleukin-1β and cancer. Cancers (Basel). 2020;12(7):1791. https://doi.org/10.3390/cancers12071791.
24. Zahorec R. Neutrophil-to-lymphocyte ratio, past, present and future perspectives. Bratisl Lek Listy. 2021;122(7):474–88. https://doi.org/10.4149/BLL_2021_078.
25. Forget P., Khalifa C., Defour J.P. et al. What is the normal value of the neutrophil-to-lymphocyte ratio? BMC Res Notes. 2017;10(1):12. https://doi.org/10.1186/s13104-016-2335-5.
Об авторах
Д. Х. ХизроеваРоссия
Хизроева Джамиля Хизриевна – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова. Scopus Author ID: 57194547147. Researcher ID: F-8384-2017.
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
З. Д. Асланова
Россия
Асланова Замиля Джамалидиновна – аспирант кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
А. Г. Солопова
Россия
Солопова Антонина Григорьевна – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова. Scopus Author ID: 6505479504. Researcher ID: Q-1385-2015.
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
В. О. Бицадзе
Россия
Бицадзе Виктория Омаровна – д.м.н., профессор РАН, профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова. Scopus Author ID: 6506003478. Researcher ID: F-8409-2017.
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
А. В. Воробьев
Россия
Воробьев Александр Викторович – к.м.н., доцент кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова. . Scopus Author ID: 57191966265. Researcher ID: F-8804-2017.
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
А. Ю. Татаринцева
Россия
Татаринцева Алёна Юрьевна – студент Института клинической медицины имени Н.В. Склифосовского
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Ж.-К. Гри
Франция
Гри Жан-Кристоф – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова; профессор гематологии, зав. лабораторией гематологии факультета биологических и фармацевтических наук Университета Монпелье и Университетской больницы Нима; иностранный член РАН. Scopus Author ID: 7005114260. Researcher ID: AAA-2923-2019.
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4; 34090 Монпелье, ул. Огюста Бруссоне, д. 163
И. Элалами
Франция
Элалами Исмаил – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова; профессор; директор гематологии Центра Тромбозов. Scopus Author ID: 7003652413. Researcher ID: AAC-9695-2019.
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4; 75006 Париж, Улица медицинского факультета, д. 12; 75020 Париж, Китайская улица, д. 4
Н. А. Макацария
Россия
Макацария Наталия Александровна – к.м.н., доцент кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова. Researcher ID: F-8406-2017
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Д. В. Блинов
Россия
Блинов Дмитрий Владиславович – к.м.н., ассистент кафедры спортивной медицины и медицинской реабилитации Института клинической медицины имени Н.В. Склифосовского; руководитель по медицинским и научным вопросам; доцент кафедры спортивной, физической и реабилитационной медицины. Scopus Author ID: 6701744871. Researcher ID: E-8906-2017. RSCI: 9779-8290.
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4; 127006 Москва, ул. Садовая-Триумфальная, д. 4–10; 123056 Москва, 2-я Брестская ул., д. 5, с. 1–1а
Рецензия
Для цитирования:
Хизроева Д.Х., Асланова З.Д., Солопова А.Г., Бицадзе В.О., Воробьев А.В., Татаринцева А.Ю., Гри Ж., Элалами И., Макацария Н.А., Блинов Д.В. Роль внеклеточных ловушек нейтрофилов в прогрессии рака и развитии тромбозов. Акушерство, Гинекология и Репродукция. 2024;18(1):55-67. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.475
For citation:
Khizroeva J.Kh., Aslanova Z.D., Solopova A.G., Bitsadze V.O., Vorobev А.V., Tatarintseva А.Yu., Gris J., Elalamy I., Makatsariya N.А., Blinov D.V. The role of neutrophil extracellular traps in cancer progression and thrombosis development. Obstetrics, Gynecology and Reproduction. 2024;18(1):55-67. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2024.475

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































