Перейти к:
Протеомика материнской крови при реализации рецидива ранней преэклампсии
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.460
Аннотация
Цель: изучить вклад эндотелиальных белков материнской крови в реализацию рецидива ранней преэклампсии (рПЭ).
Материалы и методы. В рамках проспективного когортного исследования проведен протеомный анализ периферической крови 137 беременных. По окончанию беременности выделено 3 клинических группы: группа контроля – 40 женщин с благоприятным течением настоящей и предыдущей беременности и родами в срок; группа сравнения – 59 пациенток с эпизодом рПЭ в анамнезе, но благоприятным течением настоящей беременности; основная группа – 38 пациенток с рецидивом рПЭ. Динамическому исследованию в 3 точках (в 11–13, 19–21 и 27–28 нед беременности) подлежали биологически активные вещества, свидетельствующие о нарушении функции эндотелия: значения эндотелина-1 (ЭТ-1), активность металлопротеиназы ADAMTS-13 (англ. a disintegrin and metalloproteinase with thrombospondin type 1 motif, member 13), уровень фактора фон Виллебранда (англ. von Willebrand factor, vWF) и концентрация гомоцистеина (ГЦ). Отдельно рассчитано и проанализировано соотношение значений ADAMTS-13/vWF.
Результаты. Для пациенток с рецидивом рПЭ характерно значимое повышение концентрации ЭТ-1 на всех сроках гестации: 0,92; 1,07 и 1,36 пкмоль/мл против 0,29; 0,33 и 0,29 пкмоль/мл в группе контроля (р < 0,0001 во всех точках исследования). Вне зависимости от исхода беременности с увеличением срока гестации отмечено повышение уровня vWF, однако при рецидиве рПЭ медиана (Ме) его значений (Ме = 343 МЕ) была статистически значимо выше (р < 0,0001), чем в группе контроля (Ме = 260 МЕ). Во всех группах на протяжении наблюдаемой беременности прослеживалось значимое снижение активности ADAMTS-13, при этом в 11–13 нед у пациенток основной группы активность ADAMTS-13 имела минимальные значения – 63,4 % (р = 0,0007 относительно группы контроля). По отношению ADAMTS-13/vWF в группе с рецидивом рПЭ установлены значимые различия с группой контроля как в 11–13 нед (0,32 против 0,52; р < 0,0001), так и в 27–28 нед (0,15 против 0,22; р < 0,0001) беременности. Концентрация ГЦ снижалась со сроком гестации, но в 11–13 нед у пациенток основной группы значения ГЦ (Ме = 8,0 мкмоль/л) были значимо больше, чем в группе контроля (Ме = 5,9 мкмоль/л; р < 0,00010).
Заключение. В сроке гестации 11–13 нед все проанализированные биомаркеры вносят вклад в реализацию рецидива рПЭ, определяя при суммарном воздействии 62,3 % риска. При беременности 19–21 нед дисбаланс по оси ADAMTS-13/vWF в ассоциации с повышением уровня ЭТ-1 определяет риск рецидива заболевания в 65,6 % случаев. Установлено, что в сроке гестации 27–28 нед сопряженный сдвиг значений ЭТ-1, vWF и ADAMTS-13 определяет 67,9 % риска реализации рецидива заболевания.
Ключевые слова
Для цитирования:
Николаева М.Г., Терехина В.Ю., Момот А.П. Протеомика материнской крови при реализации рецидива ранней преэклампсии. Акушерство, Гинекология и Репродукция. 2023;17(6):718-728. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.460
For citation:
Nikolaeva M.G., Terekhina V.Yu., Momot A.P. Maternal blood proteomics during relapse of early preeclampsia. Obstetrics, Gynecology and Reproduction. 2023;17(6):718-728. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.460
Введение / Introduction
Во всем мире 10–15 % всех случаев материнской смертности могут быть связаны с преэклампсией (ПЭ) и/или другими плацентарным заболеваниями [1]. В тяжелых случаях ПЭ приводит к жизнеугрожающим состояниям – эклампсии, HELLP-синдрому, преждевременной отслойке плаценты, и именно с ранней ПЭ (рПЭ) связаны фетальные осложнения, такие как задержка роста плода, респираторный дистресс-синдром новорожденных и мертворождение [2]. Как известно, рецидив рПЭ регистрируется в диапазоне от 5 до 65 % [3][4], в связи с чем поиск эффективных маркеров прогнозирования риска рецидива рПЭ – одно из приоритетных направлений развития акушерской науки. Учитывая гетерогенный, полисистемный характер поражения при рПЭ, маловероятно, что какой-либо отдельный протокол скрининга, содержащий небольшую группу биомаркеров, может обладать необходимой специфичностью и чувствительностью для точного прогнозирования рецидива рПЭ [5]. Особый интерес представляют биологически активные вещества, экспрессируемые эндотелием, дисфункция которого сохраняется длительное время после родоразрешения с тяжелой ПЭ [6]. Так, например, профессор Н.И. Фадеева с соавт. еще в 2001 г. показали ценность определения фактора фон Виллебранда (англ. von Willebrand factor, vWF) у женщин, беременность которых осложнилась ПЭ, а также наличие взаимосвязи влияния сосудисто-тромбоцитарного гемостаза на здоровье новорожденных [7]. В это же время S. Nishikawa с соавт. определили, что уровень эндотелина-1 (ЭТ-1) в сыворотке крови беременных с ПЭ выше, чем у здоровых беременных (p < 0,001) [8]. Исследователи из Винницы получили аналогичные данные [9]. Ученые из Индонезии под руководством M.K. Simanjuntak определили, что уровень ЭТ-1 в периферической крови у беременных с ПЭ выше, чем у женщин с физиологическим течением гестации (p < 0,05); также ими определена положительная корреляция между ЭТ-1 и средним артериальным давлением (r = 0,34; р < 0,05) [10]. Незначительное количество работ посвящено исследованию металлопротеиназы ADAMTS-13 (англ. a disintegrin and metalloproteinase with thrombospondin type 1 motif, member 13) в группе риска развития ПЭ [11][12]. Чаще изучение данного маркера связано с работами по тромботической микроангиопатии (ТМА), где ADAMTS-13 рассматривается как протеиназа vWF [13]. Но как известно, рПЭ позиционируется исследователями именно как вторичная ТМА [14][15], и исследование показателей сосудисто-тромбоцитарного гемостаза, а именно, соотношения по оси ADAMTS-13/vWF представляет особый интерес.
Цель: изучить вклад эндотелиальных белков материнской крови в реализацию рецидива рПЭ.
Материалы и методы / Materials and Methods
Дизайн исследования / Study design
В рамках проспективного когортного исследования проведен протеомный анализ периферической крови 137 беременных в 3 точках – в 11–13, 19–21 и 27–28 нед беременности. Набор клинического материала осуществлен в родовспомогательном стационаре 3 уровня.
Группы обследованных / Patient groups
По окончанию беременности были выделены следующие клинические группы (рис. 1): группа контроля (40 женщин с физиологическим течением наблюдаемой и предыдущей беременности и срочными родами); группа наблюдения с рПЭ, включавшая группу сравнения (59 пациенток с рПЭ в анамнезе, но физиологическим течением настоящей гестации) и основную группу (38 пациенток с рецидивом рПЭ). Важно уточнить, что пациентки основной группы и группы сравнения принимали ацетилсалициловую кислоту согласно клиническим рекомендациям [16].
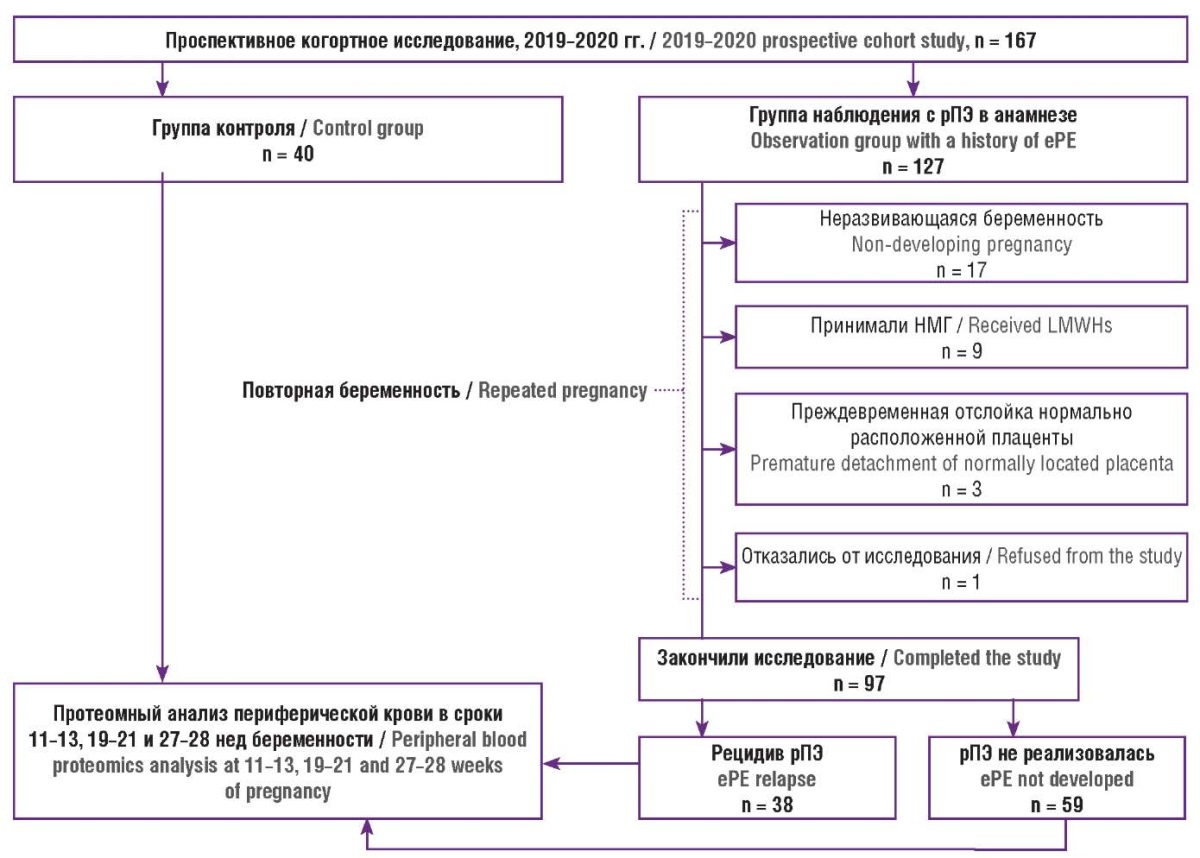
Рисунок 1. Дизайн исследования.
Примечание: рПЭ – ранняя преэклампсия;
НМГ – низкомолекулярные гепарины.
Figure 1. Study design.
Note: еPE – early preeclampsia;
LMWHs – low molecular weight heparins.
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения в группу наблюдения: возраст 18–35 лет; одноплодная беременность; рПЭ в анамнезе либо рецидив рПЭ; подписанное информированное согласие.
Критерии включения в группу контроля: возраст 18–35 лет; отсутствие соматической и гинекологической патологии; согласие на участие в исследовании.
Критерии исключения: возраст менее 18 и более 35 лет; беременность, наступившая в результате экстракорпорального оплодотворения; многоплодная беременность; эпизоды тромбоза в личном анамнезе; экстрагенитальная патология, определяющая риск развития ПЭ; нежелание участвовать в исследовании.
Методы исследования / Study methods
Динамическому исследованию в 3 точках (в 11–13, 19–21 и 27–28 нед беременности) подлежали биологически активные вещества, свидетельствующие о нарушении функции эндотелия: значения ЭТ-1, активность ADAMTS-13, уровень vWF и концентрация гомоцистеина (ГЦ). Отдельно рассчитано и проанализировано соотношение значений ADAMTS-13/vWF.
Методом иммуноферментного анализа определяли в периферической крови женщин уровень ГЦ (Axis-Shield Diagnostics Ltd, Великобритания) и концентрацию ЭТ-1 (R&D Systems, США). Для измерения активности ADAMTS-13 использовали хромогенный тест TECHNOZYM® ADAMTS-13 Activity ELISA (DiaPharma Group Inc., США), активности vWF – набор Rictocetin Cofactor Kit (Helena Biosciences Europe, Великобритания). Все тесты выполнены на сертифицированном оборудовании.
Этические аспекты / Ethical aspects
Все процедуры, выполненные в данном исследовании, соответствовали этическим стандартам Хельсинской декларации 1964 г. и ее последующим изменениям и сопоставимым нормам этики. Все пациентки подписали добровольное информированное согласие на участие в исследовании и отбор биоматериала для анализа.
Исследование получило одобрение локального этического комитета ФГБОУ ВО АГМУ Минздрава России, протокол заседания № 9 от 29.11.2019.
Статистические методы / Statistical analysis
С целью определения нормальности распределения показателей лабораторных тестов в группах сравнения использовали критерий Шапиро–Уилка. Категориальные переменные описаны с использованием частоты (n) и удельного веса (%); непрерывные переменные описаны с использованием медианы (Ме), 95 % доверительного интервала (95 % ДИ) для медианы и интерквартильного размаха [ 25-й и 75-й перцентили]. Сравнение рядов выполняли с использованием непараметрических методов (U-тест Манна–Уитни). Для выявления взаимосвязи между риском рецидива рПЭ и несколькими независимыми переменными (показатели лабораторных тестов, отражающих функцию эндотелия) проведен множественный регрессионный анализ. Статистическую значимость устанавливали при p < 0,05 и определяли с помощью программного обеспечения MedCalc version 17.9.7 (MedCalc Software, Бельгия).
Результаты / Results
Клинические характеристики пациенток с реализацией рецидива рПЭ свидетельствуют о том, что в 20 (52,6 %) наблюдениях определены заболевания, не являющиеся факторами риска развития рПЭ, остальные 18 (47,8 %) женщин соматически здоровы (табл. 1).
При динамическом исследовании уровня ЭТ-1 установлено, что в точке 11–13 нед беременности, соответствующей окончанию первой волны инвазии трофобласта (рис. 2), медиана показателя у пациенток основной группы статистически значимо выше, чем у групп наблюдения (p < 0,0001) и контроля (p = 0,0003).
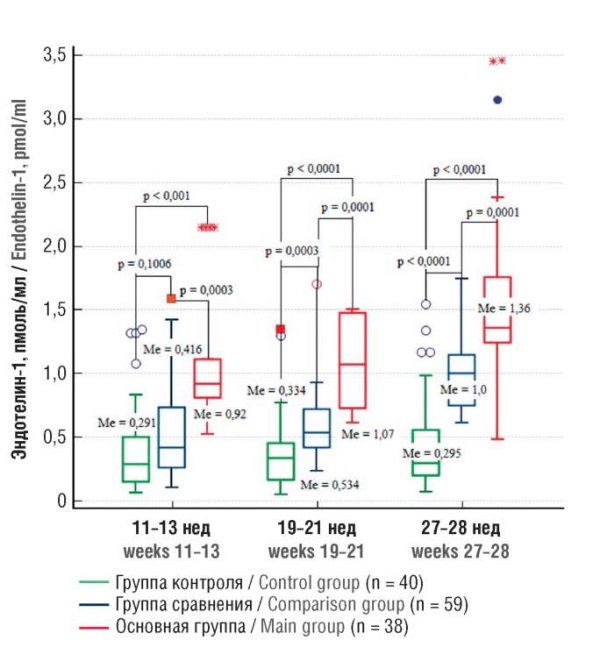
Рисунок 2. Динамика медианы (Ме) значений эндотелина-1
в сроки гестации 11–13, 19–21 и 27–28 нед
у женщин с рецидивом ранней преэклампсии (рПЭ)
в наблюдаемую беременность (основная группа), с рПЭ в анамнезе,
но физиологическим течением данной беременности (группа сравнения),
с неотягощенным личным анамнезом
и физиологическим течением беременности (контрольная группа)
Примечание: медиана (Ме) – маркер;
«ящик» – 95 % доверительный интервал для Ме;
усы – межквартильный диапазон Q1–Q3;
свободные элементы – выбросы.
Figure 2. Median (Me) dynamics of endothelin-1 level
at gestational age of 11–13, 19–21 and 27–28 weeks
in women with recurrent early preeclampsia (еPE)
during the observed pregnancy (main group), with a history of еPE,
but physiological course of ongoing pregnancy (comparison group),
with unburdened personal history
and physiological pregnancy course (control group).
Note: median (Me) – marker;
“box” – 95 % confidence interval for Me;
whiskers – interquartile range Q1–Q3;
free elements are emissions.
С увеличением срока гестации, в 19–21 нед уровень ЭТ-1 имел тенденцию к росту во всех группах и оставался статистически значимо выше в основной группе относительно групп сравнения (p = 0,0001) и контроля (p < 0,0001). Необходимо отметить, что прирост показателя в основной (1,07 пкмоль/л против 0,92 пкмоль/л) и контрольной (0,334 пкмоль/л против 0,391 пкмоль/л) группах был идентичен – на 16 и 14 % соответственно. В группе сравнения Ме показателя увеличилась на 22,2 % (0,534 пкмоль/л против 0,416 пкмоль/л), что не имело статистической разницы при сравнении в группах.
Анализ уровня ЭТ-1 в сроке гестации 27–28 нед определил увеличение медианы показателя в основной группе и группе сравнения: на 29 % (1,37 пкмоль/мл против 1,07 пкмоль/л) и на 47 % (1,00 пкмоль/мл против 0,534 пкмоль/мл) соответственно. Однако в группе женщин с физиологическим течением беременности уровень ЭТ-1 в 27–28 нед беременности, напротив, уменьшился, вернувшись к показателю в 11–13 нед гестации (рис. 2). При этом разница между основной группой и группой сравнения составила 1,36 раза (p = 0,0001), с группой контроля – 4,7 раза (p < 0,0001).
Далее были проанализированы показатели сосудисто-тромбоцитарного гемостаза, свидетельствующие при их дисбалансе о нарушение функции эндотелия. При определении vWF в 11–13 и в 19–21 нед беременности его значения во всех группах определены как сопоставимые (рис. 3). Однако при исследовании показателя в 27–28 нед беременности, а именно в этом сроке в группе женщин с рецидивом рПЭ (основная группа) в 42,1 % случаев был установлен диагноз тяжелой ПЭ, уровень vWF у пациенток с рецидивом заболевания был статистически значимо выше, чем в группах контроля (p < 0,0001) и сравнения (p < 0,0001). Медиана значений vWF определена у пациенток основной группы в 1,8 раза выше, чем у женщин с рПЭ в анамнезе, но с благоприятным течением наблюдаемой беременности.
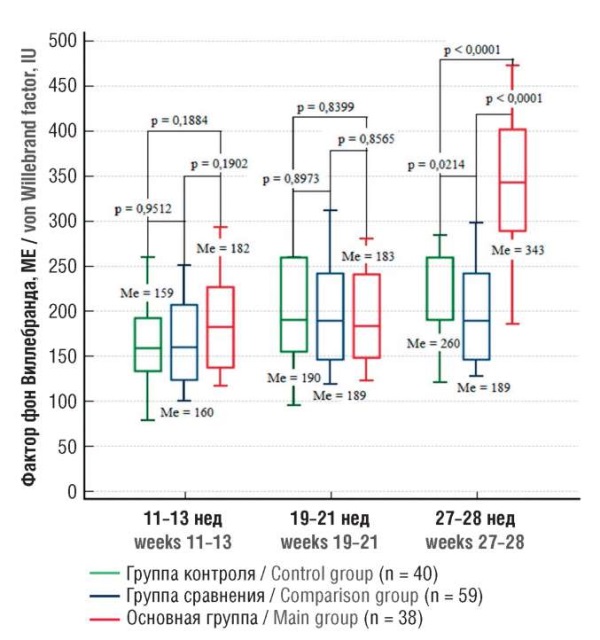
Рисунок 3. Динамика медианы (Ме) значений фактора фон Виллебранда
в сроки гестации 11–13, 19–21 и 27–28 нед у женщин с рецидивом рПЭ
в наблюдаемую беременность (основная группа), с рПЭ в анамнезе,
но физиологическим течением данной беременности (группа сравнения),
с неотягощенным личным анамнезом
и физиологическим течением беременности (группа контроля).
Примечание: медиана (Ме) – маркер;
«ящик» – 95 % доверительный интервал для Ме;
усы – межквартильный диапазон Q1–Q3.
Figure 3. Median (Me) dynamics of von Willebrand factor level
at gestational age of 11–13, 19–21 and 27–28 weeks
in women with recurrent early preeclampsia (еPE)
during the observed pregnancy (main group), with a history of еPE,
but physiological course of ongoing pregnancy (comparison group),
with unburdened personal history
and physiological pregnancy course (control group).
Note: median (Me) – marker;
“box” – 95 % confidence interval for Me;
whiskers – interquartile range Q1–Q3.
Интересные данные получены при анализе активности металлопротеиназы ADAMTS-13 в различные сроки гестации. Во всех группах отмечено снижение показателя со сроком гестации (рис. 4). При этом, несмотря на статистически различные показатели активности в 11–13 нед беременности в группах контроля и сравнения, снижение активности ADAMTS-13 идентично: на 31,9 % (с 85,3 до 55,3 %; р < 0,0001) и на 42,0 % (с 114,7 до 66,5 %; р < 0,0001) соответственно. В группе с рецидивом рПЭ определено снижение показателя по медиане всего на 16,1 % (с 63,4 до 53,2 %; р = 0,0001).
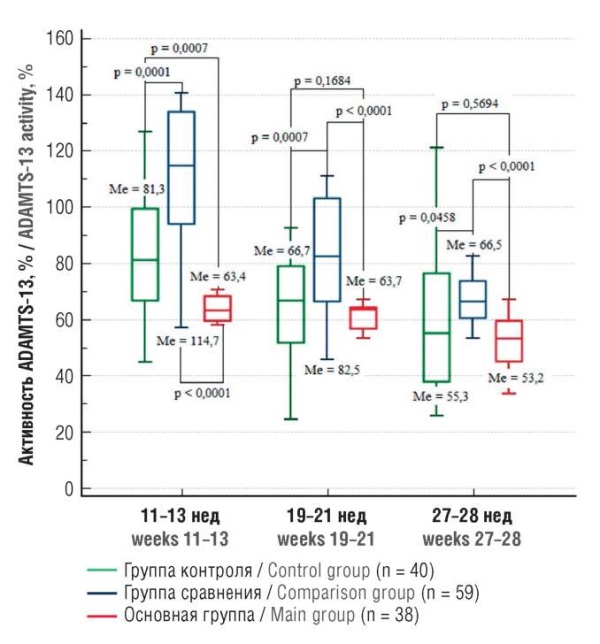
Рисунок 4. Динамика медианы (Ме) активности металлопротеиназы ADAMTS-13
в сроки гестации 11–13, 19–21 и 27–28 нед у женщин с рецидивом рПЭ
в наблюдаемую беременность (основная группа), с рПЭ в анамнезе,
но физиологическим течением данной беременности (группа сравнения),
с неотягощенным личным анамнезом
и физиологическим течением беременности (группа контроля).
Примечание: медиана (Ме) – маркер;
«ящик» – 95 % доверительный интервал для Ме;
усы – межквартильный диапазон Q1–Q3.
Figure 4. Median (Me) dynamics of metalloproteinase ADAMTS-13 activity level
at gestational age of 11–13, 19–21 and 27–28 weeks
in women with recurrent early preeclampsia (еPE)
during the observed pregnancy (main group), with a history of еPE,
but physiological course of ongoing pregnancy (comparison group),
with unburdened personal history
and physiological pregnancy course (control group).
Note: median (Me) – marker;
“box” – 95 % confidence interval for Me;
whiskers – interquartile range Q1–Q3.
Также необходимо отметить, что максимальная активность металлопротеиназы во всех точках исследования определена в группе пациенток с рПЭ в анамнезе и с благоприятным течением настоящей беременности (группа сравнения). В основной группе с реализованным рецидивом рПЭ в первой точке исследования (11–13 нед гестации) определена минимальная активность ADAMTS-13, достоверно меньшая при сравнении с ее значением в группах контроля (р = 0,0007) и сравнения (р = 0,0001).
Принимая во внимание биологическое взаимодействие рассматриваемых маркеров повреждения эндотелия, представлялось целесообразным проанализировать ось ADAMTS-13/vWF. Как видно из рисунка 5, во всех группах происходило снижение соотношения по оси ADAMTS-13/vWF, при этом самые высокие его значения выявлены в группе сравнения. Учитывая, что снижение соотношения ADAMTS-13/vWF является основным маркером эндотелиопатии [17], становится объяснимым полученный результат у пациенток основной группы, в которой определены статистически значимо низкие значения во всех точках исследования как по сравнению с группой контроля, так и группой сравнения. При этом необходимо отметить, что именно в случае рецидива рПЭ наблюдали максимально выраженное снижение соотношения ADAMTS-13/vWF с увеличением срока гестации, а именно: в 2,36 раза (с 0,52 до 0,22; р < 0,0001) в группе контроля, в 1,76 раза (с 0,74 до 0,42; р < 0,0001) в группе сравнения и в 2,6 раза (с 0,39 до 0,15; р < 0,0001) в основной группе.
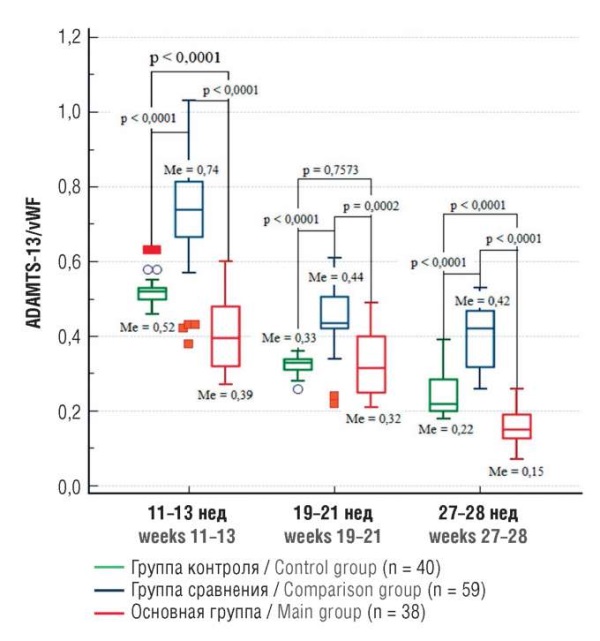
Рисунок 5. Динамика медианы соотношения ADAMTS-13/vWF
в сроки гестации 11–13, 19–21 и 27–28 нед у женщин с рецидивом рПЭ
в наблюдаемую беременность (основная группа), с рПЭ в анамнезе,
но физиологическим течением данной беременности (группа сравнения),
с неотягощенным личным анамнезом
и физиологическим течением беременности (группа контроля).
Примечание: медиана (Ме) – маркер;
«ящик» – 95 % доверительный интервал для Ме;
усы – межквартильный диапазон Q1–Q3;
свободные элементы – выбросы.
Figure 5. Median (Me) dynamics of ADAMTS-13/vWF ratio
at gestational age of 11–13, 19–21 and 27–28 weeks
in women with recurrent early preeclampsia (еPE)
during the observed pregnancy (main group), with a history of еPE,
but physiological course of ongoing pregnancy (comparison group),
with unburdened personal history
and physiological pregnancy course (control group).
Note: median (Me) – marker;
“box” – 95 % confidence interval for Me;
whiskers – interquartile range Q1–Q3;
free elements are emissions.
Учитывая, что сверхпороговый уровень ГЦ рассматривается как биомаркер дисфункции эндотелия по причине формирования оксидативного стресса, проанализирована динамика уровня данной аминокислоты в группах. Результаты анализа были предсказуемы, так как все пациентки принимали профилактические дозы фолиевой кислоты и/или минерало-витаминные комплексы во время беременности. Во всех группах происходило снижение показателя с течением беременности, и в сроки гестации 19–21 и 27–28 нед медианы значений ГЦ были сопоставимы во всех группах исследования (рис. 6). Однако в первой точке исследования (11–13 нед гестации) в группе пациенток с реализацией рецидива рПЭ (основная группа) уровень ГЦ хотя и находился в пределах референсных значений к сроку гестации [18], все же был значимо бóльшим относительно и группы контроля (р < 0,0001) и группы сравнения (р = 0,0232).
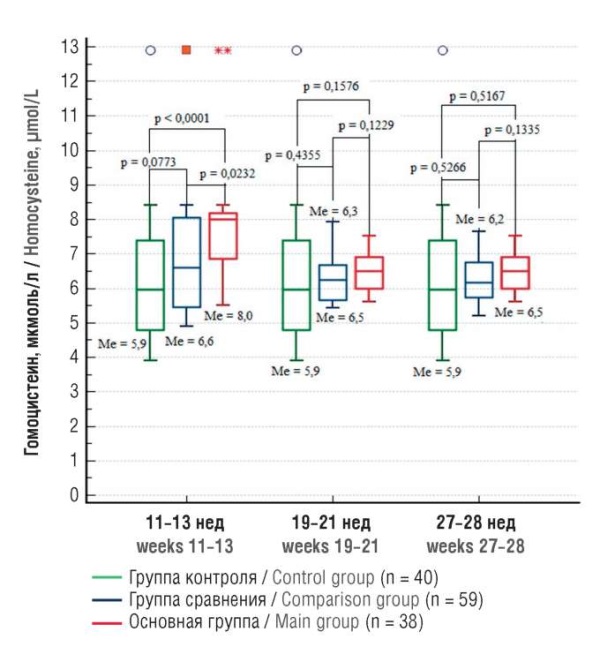
Рисунок 6. Динамика медианы (Ме) значений гомоцистеина
в сроки гестации 11–13, 19–21 и 27–28 нед у женщин с рецидивом рПЭ
в наблюдаемую беременность (основная группа), с рПЭ в анамнезе,
но физиологическим течением данной беременности (группа сравнения),
с неотягощенным личным анамнезом
и физиологическим течением беременности (группа контроля).
Примечание: медиана (Ме) – маркер;
«ящик» – 95 % доверительный интервал для Ме;
усы – межквартильный диапазон Q1–Q3;
свободные элементы – выбросы.
Figure 6. Median (Me) dynamics of homocysteine level
at gestational age of 11–13, 19–21 and 27–28 weeks
in women with recurrent early preeclampsia (еPE)
during the observed pregnancy (main group), with a history of еPE,
but physiological course of ongoing pregnancy (comparison group),
with unburdened personal history
and physiological pregnancy course (control group).
Note: median (Me) – marker;
“box” – 95 % confidence interval for Me;
whiskers – interquartile range Q1–Q3;
free elements are emissions.
Для определения потенциального вклада выявленных изменений по уровню и концентрации биомаркеров, определяющих повреждение эндотелия, проведен множественный регрессионный анализ по каждой точке динамического исследования (табл. 1). В качестве зависимой переменной выбран рецидив рПЭ при наблюдаемой беременности. Независимые переменные сохранялись в модели путем пошагового выключения при отсутствии статистически значимого влияния на зависимую переменную (рецидив рПЭ).
Таблица 1. Результаты множественного регрессионного анализа
биомаркеров дисфункции эндотелия
при реализации рецидива ранней преэклампсии в различные сроки гестации.
Table 1. Multiple regression analysis of endothelial dysfunction biomarkers
during early preeclampsia relapse at different stages of gestation.
|
Независимые переменные Independent variables |
Коэффициент Coefficient |
t |
р |
|
11–13 нед беременности / 11–13 weeks of pregnancy |
|||
|
Постоянная / Constant |
–0,05633 |
– |
– |
|
Гомоцистеин / Homocysteine |
0,1277 |
4,381 |
< 0,0001 |
|
Эндотелин-1 / Endothelin-1 |
0,2842 |
3,652 |
0,0005 |
|
Ось ADAMTS-13:Ас/vWF:Ag / ADAMTS-13:Ac/vWF:Ag аxis |
–0,7425 |
2,381 |
0,0198 |
|
Коэффициент детерминации (R2) / Determination coefficient (R2) |
0,6225 |
||
|
19–21 нед беременности / 19–21 weeks of pregnancy |
|||
|
Постоянная / Constant |
0,4796 |
– |
– |
|
Ось ADAMTS-13:Ас/vWF:Ag / ADAMTS-13:Ac/vWF:Ag аxis |
–0,9607 |
–2,602 |
0,0110 |
|
Эндотелин-1 / Endothelin-1 |
0,8183 |
11,934 |
< 0,0001 |
|
Коэффициент детерминации (R2) / Determination coefficient (R2) |
0,6559 |
||
|
27–28 нед беременности / 27–28 weeks of pregnancy |
|||
|
Постоянная / Constant |
–0,2118 |
– |
– |
|
Эндотелин-1 / Endothelin-1 |
0,2244 |
4,880 |
< 0,0001 |
|
vWF:Ag |
0,0030 |
7,380 |
< 0,0001 |
|
ADAMTS-13 |
–0,0079 |
–4,787 |
< 0,0001 |
|
Коэффициент детерминации (R2) / Determination coefficient (R2) |
0,6794 |
||
Примечание: vWF – фактор фон Виллебранда;
Ac – активность;
Ag – антиген.
Note: vWF – von Willebrand factor;
Ac – activity;
Ag – antigen.
Согласно проведенному анализу, в сроке гестации 11–13 нед все проанализированные биомаркеры вносят вклад в реализацию рецидива рПЭ, определяя при суммарном воздействии 62,3 % риска. При беременности 19–21 нед ГЦ как фактор риска утрачивает свое значение. Дисбаланс по оси ADAMTS-13:Ас/vWF:Ag (активность ADAMTS-13/антиген vWF) в ассоциации с повышением активности ЭТ-1 определяют риск рецидива заболевания в 65,6 % случаев. В сроке гестации 27–28 нед определено 3 биомеркера – ЭТ-1, vWF и ADAMTS-13, сопряженный сдвиг которых определяет 67,9 % риска.
Обсуждение / Discussion
Идентификация биомаркеров играет решающую роль в персонализированной медицине как в клинических, так и в исследовательских условиях. На конгрессе Международного общества по тромбозам и гемостазу (англ. International Society on Thrombosis and Haemostasis, ISTH) в 2022 г. было установлено, что ЭТ-1 и эндотелиальные микровезикулы являются потенциальными предикторами рецидива рПЭ [19]. Результаты представленного нами исследования полностью соответствуют заявленному на конгрессе утверждению: уровень ЭТ-1 во всех точках исследования у пациенток с рецидивом рПЭ был статистически значимо выше, чем у женщин с благоприятным течением беременности. При этом необходимо отметить, что роль других эндотелиальных протеинов в патогенезе и реализации рецидива рПЭ до настоящего времени является предметом научных дискуссий. Наиболее доступен для изучения vWF, и многочисленные исследования демонстрируют статистически значимое увеличение этого показателя у беременных с ПЭ или HELLP-синдромом [20][21]. Так, например, по результатам исследования ученых из Египта, уровень антигена vWF в плазме был значительно выше при ПЭ по сравнению с группой при нормальном течении гестации, а также с небеременными (p < 0,01 для обеих групп). С целью прогнозирования риска сосудистых нарушений сетчатки у пациенток с ПЭ, О.В. Коленко с соавт. изучали взаимосвязи между биохимическими показателями эндотелиальной дисфункции и морфометрическими параметрами желтого пятна. Определено, что к III триместру беременности уровень vWF повышается, и в группе женщин с тяжелой ПЭ определяется статистически значимо выше, чем у здоровых беременных [22]. Представленные результаты согласуются с нашими как по срокам гестации, так и по кратности повышения vWF в плазме крови.
Исследования ранних лет демонстрируют неоднозначные выводы по изучению роли металлопротеиназы ADAMTS-13 во время беременности. Так, например, в 2007 г. команда ученых из Бельгии исследовала активность ADAMTS-13 в различных клинических ситуациях. Было определено, что физиологическая беременность сопровождается снижением активности ADAMTS-13 на 24,7 % [23]. В работе российских ученых установлено более выраженное снижение активности ADAMTS-13 при нормальной беременности – с 84,6 % в I триместре до 44,6 % в III, т. е. на 47,3 % [17], что согласуется с нашими результатами – в группе контроля активность ADAMTS-13 снизилась с 81,3 % в I триместре до 55,3% к 28 нед гестации, что составило 31,9 %.
Роль ADAMTS-13 в развитии ПЭ впервые показана группой ученых из Франции в проспективном исследовании «случай–контроль». Установлено, что низкие показатели активности ADAMTS-13 (≤ 70 %) были достоверно связаны с развитием ПЭ (отношение шансов (ОШ) = 4,2; 95 % ДИ = 1,1–15), причем эта связь не зависела от уровня vWF и факторов риска ПЭ. Авторы также предполагают количественное снижение белка при реализации ПЭ, а уменьшение активности ADAMTS-13 связывают с повышением уровня провоспалительных цитокинов – интерлейкина-6 и С-реактивного белка, специфичных маркеров ПЭ. Кроме того, в работе определено, что уровни активности ADAMTS-13 ≤ 57 % были достоверно ассоциированы с ранним началом ПЭ (OШ = 2,5; 95 % ДИ = 1,1–5,8) [24]. Другое заключение сделано A. Molvarec c соавт., которые не обнаружили разницы в активности ADAMTS-13 у беременных с ПЭ и здоровых беременных, при этом уровень vWF был значительно выше у пациенток с ПЭ [25]. По результатам нашей работы, активность ADAMTS-13 при развитии рецидива рПЭ определена достоверно ниже относительно группы контроля в сроке 11–13 нед, составляя по медиане 63,4 % (р = 0,0007). Возможно, снижение активности ADAMTS-13 можно рассматривать в качестве одного из факторов недостаточной инвазии синтициотрофобласта с последующим снижением маточно-плацентарного перфузионного давления и развитием ишемии плаценты [26].
Ось ADAMTS-13:Aс/vWF:Ag уже длительное время рассматривается как пара – кандидат на объяснение патофизиологии ПЭ [24][27][28]. Однако неоднозначность представленных результатов, скорее всего, обусловлена тем, что вмешивающихся факторов, действующих разнонаправленно и определяющих уровень vWF и активность ADAMTS-13 (ADAMTS-13:Ас), достаточно много. Пионерская работа российских ученых представила данные о соотношении ADAMTS-13:Aс/vWF:Ag у женщин с физиологическим течением гестации. В работе показано, что по мере увеличения срока беременности наблюдается прогрессивное снижение ADAMTS-13:Aс на фоне роста уровня vWF:Ag, что может являться признаком развития эндотелиопатии [17]. Наши данные совпадают с результатами коллег по части благоприятной беременности, при этом в случае реализации рецидива рПЭ смещение по оси ADAMTS-13/vWF более выражено в сторону уменьшения показателя: Ме = 0,39 в 11–13 нед и Ме = 0,15 в 27–28 нед гестации.
Заключение / Conclusion
Биологически активные протеины, экспрессируемые скомпрометированным эндотелием у пациенток с рПЭ в анамнезе вносят значимый вклад в реализацию рецидива заболевания. Наиболее значимым маркером, позволяющим прогнозировать риск рецидива заболевания и определяющим его развития в течение всей беременности, является ЭТ-1, а в сроки гестации 11–13 и 19–21 нед – отношение по оси ADAMTS-13/vWF.
Список литературы
1. Xue Y., Yang N., Gu X. et al. Risk prediction model of early-onset preeclampsia based on risk factors and routine laboratory indicators. Life (Basel). 2023;13(8):1648. https://doi.org/10.3390/life13081648.
2. Jiao Y., Liu Y., Li H. et al. Value of proteinuria in evaluating the severity of HELLP and its maternal and neonatal outcomes. BMC Pregnancy Childbirth. 2023;23(1):591. https://doi.org/10.1186/s12884-023-05862-5.
3. van Eerden L., de Groot C.J.M., Zeeman G.G. et al. Subsequent pregnancy outcome after mid-trimester termination of pregnancy for preeclampsia. Aust N Z J Obstet Gynaecol. 2018;58(2):204–9. https://doi.org/10.1111/ajo.12691.
4. Gottardi E., Lecarpentier E., Villette C. et al. Preeclampsia before 26 weeks of gestation: Obstetrical prognosis for the subsequent pregnancy. J Gynecol Obstet Hum Reprod. 2021;50(3):102000. https://doi.org/10.1016/j.jogoh.2020.102000.
5. Nguyen T.P.H., Patrick C.J., Parry L.J., Familari M. Using proteomics to advance the search for potential biomarkers for preeclampsia: A systematic review and meta-analysis. PLoS One. 2019;14(4):e0214671. https://doi.org/10.1371/journal.pone.0214671.
6. Sandvik M.K., Leirgul E., Nygård O. et al. Preeclampsia in healthy women and endothelial dysfunction 10 years later. Am J Obstet Gynecol. 2013;209(6):569.e1–569.e10. https://doi.org/10.1016/j.ajog.2013.07.024.
7. Фадеева Н.И., Суворова А.В., Малюга О.М. Фактор Виллебранда – как маркер эндотелиальной дисфункции у беременных женщин с гестозом и родившихся у них новорожденных. Сибирский медицинский журнал (Иркутск). 2001;24(1):28–32.
8. Nishikawa S., Miyamoto A., Yamamoto H. et al. The relationship between serum nitrate and endothelin-1 concentrations in preeclampsia. Life Sci. 2000;67(12):1447–54. https://doi.org/10.1016/S0024-3205(00)00736-0.
9. Булавенко О.В., Васькив О.В. Плазменные концентрации эндотелина-1 и С-натрийуретического пептида у беременных с гестационной гипертензией. Перинатология и педиатрия. 2017;(1):46–50.
10. Simanjuntak M.K., Idris I., Sunarno I. et al. Mean arterial pressure and the endothelin-1 levels in preeclampsia. Gac Sanit. 2021;35(Suppl 2):S242– S244. https://doi.org/10.1016/j.gaceta.2021.07.016.
11. Aref S., Goda H. Increased VWF antigen levels and decreased ADAMTS13 activity in preeclampsia. Hematology. 2013;18(4):237–41. https://doi.org/10.1179/1607845412Y.0000000070.
12. Brown S.A., Eldridge A., Collins P.W., Bowen D.J. Increased clearance of von Willebrand factor antigen post-DDAVP in Type 1 von Willebrand disease: is it a potential pathogenic process? J Thromb Haemost. 2003;1(8):1714-7. https://doi.org/10.1046/j.1538-7836.2003.00359.x.
13. Davidesko S., Pikovsky O., Al-Athamen K. et al. von Willebrand factor antigen: a biomarker for severe pregnancy complications in women with hereditary thrombotic thrombocytopenic purpura? J Thromb Haemost. 2023;21(6):1623-1629. https://doi.org/10.1016/j.jtha.2023.02.022.
14. Коротчаева Ю.В., Козловская Н.Л., Шифман Е.М. и др. Атипичный гемолитико-уремический синдром и преэклампсия: причина или следствие? Вопросы гинекологии, акушерства и перинатологии. 2021;20(4):55–63.
15. Gardikioti A., Venou T.M., Gavriilaki E. et al. Molecular advances in preeclampsia and HELLP syndrome. Int J Mol Sci. 2022;23(7):3851. https://doi.org/10.3390/ijms23073851.
16. Клинические рекомендации – Преэклампсия. Эклампсия. Отеки, протеинурия и гипертензивные расстройства во время беременности, в родах и послеродовом периоде – 2021-2022-2023 (24.06.2021). М.: Министерство здравоохранения Российской Федерации, 2021. 54 с. Режим доступа: http://disuria.ru/_ld/10/1046_kr21O10O16MZ.pdf. [Дата обращения: 16.10.2023].
17. Григорьева К.Н., Гашимова Н.Р., Бицадзе В.О. и др. Клиническое значение состояния оси ADAMTS-13/vWF у беременных в различные триместры гестации. Акушерство, Гинекология и Репродукция. 2023;17(2):221–30. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.405.
18. Момот А.П., Тараненко И.А., Белозеров Д.Е. и др. Инициация свертывания крови в разные сроки физиологически протекающей беременности. Бюллетень Сибирского отделения Российской академии медицинских наук. 2014;34(5):58–66. https://doi.org/10.18411/d-2016-064.
19. Scully M., Neave L. Etiology and outcomes: Thrombotic microangiopathies in pregnancy. Res Pract Thromb Haemost. 2023;7(2):100084. https://doi.org/10.1016/j.rpth.2023.100084.
20. Alpoim P.N., Gomes K.B., Godoi L.C. et al. ADAMTS13, FVIII, von Willebrand factor, ABO blood group assessment in preeclampsia. Clin Chim Acta. 2011;412(23–24):2162–6. https://doi.org/10.1016/j.cca.2011.07.030.
21. Yoshida Y., Matsumoto M., Yagi H. et al. Severe reduction of free-form ADAMTS13, unbound to von Willebrand factor, in plasma of patients with HELLP syndrome. Blood Adv. 2017;1(20):1628–31. https://doi.org/10.1182/bloodadvances.2017006767.
22. Коленко О.В., Помыткина Н.В., Сорокин Е.Л. и др. О взаимосвязи между биохимическими факторами эндотелиальной дисфункции, свободнорадикального окисления и морфометрическими показателями макулярной зоны при преэклампсии. Вестник офтальмологии. 2019;135(2):39–47. https://doi.org/10.17116/oftalma201913502139.
23. Feys H.B., Canciani M.T., Peyvandi F. et al. ADAMTS13 activity to antigen ratio in physiological and pathological conditions associated with an increased risk of thrombosis. Br J Haematol. 2007;138(4):534–40. https://doi.org/10.1111/j.1365-2141.2007.06688.x.
24. Stepanian A., Cohen-Moatti M., Sanglier T. et al.; ECLAXIR Study Group. Von Willebrand factor and ADAMTS13: a candidate couple for preeclampsia pathophysiology. Arterioscler Thromb Vasc Biol. 2011;31(7):1703–9. https://doi.org/10.1161/ATVBAHA.111.223610.
25. Molvarec A., Rigó J., Bõze T. et al. Increased plasma von Willebrand factor antigen levels but normal von Willebrand factor cleaving protease (ADAMTS13) activity in preeclampsia. Thromb Haemost. 2009;101(2):305–11.
26. Qu H., Khalil R.A. Role of ADAM and ADAMTS disintegrin and metalloproteinases in normal pregnancy and preeclampsia. Biochem Pharmacol. 2022;206:115266. https://doi.org/10.1016/j.bcp.2022.115266.
27. Franchini M., Montagnana M., Targher G., Lippi G. Reduced von Willebrand factor-cleaving protease levels in secondary thrombotic microangiopathies and other diseases. Semin Thromb Hemost. 2007;33(8):787–97. https://doi.org/10.1055/s-2007-1000365.
28. Zander C.B., Cao W., Zheng X.L. ADAMTS13 and von Willebrand factor interactions. Curr Opin Hematol. 2015;22(5):452–9. https://doi.org/10.1097/MOH.0000000000000169.
Об авторах
М. Г. НиколаеваРоссия
Николаева Мария Геннадьевна – д.м.н., профессор кафедры акушерства и гинекологии с курсом дополнительного профессионального образования Алтайский ГМУ; старший научный сотрудник, Алтайский филиал НМИЦГ. Scopus Author ID: 57191960907. Researcher ID: AAI-6271-2020.
656038 Барнаул, проспект Ленина, д. 40; 656045 Барнаул, ул. Ляпидевского, д. 1
В. Ю. Терехина
Россия
Терехина Василиса Юрьевна – ассистент кафедры акушерства и гинекологии с курсом дополнительного профессионального образования. . Scopus Author ID: 57253007400. Researcher ID: ABC-8270-2021.
656038 Барнаул, проспект Ленина, д. 40
А. П. Момот
Россия
Момот Андрей Павлович – д.м.н., профессор, руководитель лаборатории гемостаза Алтайский ГМУ; директор, Алтайский филиал НМИЦГ. Scopus Author ID: 6603848680. Researcher ID: M-7923-2015.
656038 Барнаул, проспект Ленина, д. 40; 656045 Барнаул, ул. Ляпидевского, д. 1
Рецензия
Для цитирования:
Николаева М.Г., Терехина В.Ю., Момот А.П. Протеомика материнской крови при реализации рецидива ранней преэклампсии. Акушерство, Гинекология и Репродукция. 2023;17(6):718-728. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.460
For citation:
Nikolaeva M.G., Terekhina V.Yu., Momot A.P. Maternal blood proteomics during relapse of early preeclampsia. Obstetrics, Gynecology and Reproduction. 2023;17(6):718-728. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.460

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































