Перейти к:
Многоликость и многообразие тромбозов у новорожденного после операций на сердце
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.444
Аннотация
На примере одного пациента показано развитие двух эпизодов послеоперационных тромбозов, имеющих различные механизмы. Тромбоз системно-легочного анастомоза был обусловлен индуцированной напряжением сдвига секрецией и трансформацией фактора фон Виллебранда (англ. von Willebrand factor, vWF) на участке выполненного соустья. Изменение соотношения vWF/ADAMTS-13 (англ. a disintegrin and metalloprotease with thrombospondin type 1 motif, member 13) в пользу vWF сопровождалось адгезией и активацией тромбоцитов в области анастомоза и привело к его тромбозу. Второй эпизод тромбоза с локализацией в системах верхней и нижней полых вен развился на фоне эскалации инфекционного процесса и характеризовался не только тромбоцитопенией, но и снижением концентрации фибриногена. В данной клинической ситуации разрешение инфекционного процесса, а также применение адекватной антитромботической терапии привело к выздоровлению.
Ключевые слова
Для цитирования:
Купряшов А.А., Токмакова К.А., Самуилова Д.Ш., Шилкин Д.Н. Многоликость и многообразие тромбозов у новорожденного после операций на сердце. Акушерство, Гинекология и Репродукция. 2023;17(5):663-669. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.444
For citation:
Kupryashov A.A., Tokmakova K.A., Samuilova D.Sh., Shilkin D.N. The many faces of thrombosis in post-cardiac surgery newborn. Obstetrics, Gynecology and Reproduction. 2023;17(5):663-669. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.444
Введение / Introduction
Кардиохирургический пациент является достаточно сложной моделью для анализа состояния системы свертывания крови. Во-первых, данная категория больных имеет исходные изменения как плазменного, так и тромбоцитарного гемостаза на фоне хронического эндотелиального повреждения при системной артериальной гипоксемии, недостаточности кровообращения, изменении напряжения сдвига [1]. Во-вторых, условия хирургического вмешательства, помимо непосредственной механической травмы, сопряжены с активацией протеаз коагуляционного и фибринолитического каскадов, активацией тромбоцитов, ишемически-реперфузионным повреждением клеток [2]. В раннем послеоперационном периоде при наличии стандартных условий хирургического лечения нередко наблюдается тромбоцитопения, что обусловлено как периоперационной гемодилюцией, так и потреблением тромбоцитов в рамках хирургического гемостаза [3]. Однако явления длительно персистирующей тромбоцитопении или же тромбоцитопении, возникшей впервые в более поздние послеоперационные сроки, зачастую рассматриваются стереотипно, без учета возможных механизмов ее развития. Данный подход обуславливает ошибки в интерпретации клинического статуса пациента, а следовательно, и ошибки в лечебных подходах. При этом «позднюю» тромбоцитопению зачастую ошибочно связывают с риском возникновения кровотечений и редко рассматривают как проявление тромбообразования.
На фоне активации и повреждения сосудистого эндотелия активность металлопротеазы ADAMTS-13 (англ. a disintegrin and metalloprotease with thrombo-spondin type 1 motif, member 13) не обеспечивает должного и своевременного протеолиза фактора фон Виллебранда (англ. von Willebrand factor, vWF), который в данном случае имеет высокую степень экзоцитоза из телец Вейбеля–Паладе [4]. Мультимер vWF обладает высоким протромботическим потенциалом, который реализуется при участии активированных тромбоцитов, экспрессирующих мембранные гликопротеиновые рецепторы GP1b [5]. Данное взаимодействие, происходящее при относительном дефиците металлопротеазы ADAMTS-13, проводит к адгезии и агрегации тромбоцитов на поверхности эндотелия сосудистой стенки, формированию тромбоцитарного тромба и последующему развитию тромботической микроангиопатии на фоне высокого потребления тромбоцитов и лабораторного явления тромбоцитопении [6].
Учитывая, что частота тромбозов у пациентов кардиохирургического стационара составляет 11–37 %, часть из которых являются фатальными [7], особого внимания заслуживает оценка вероятных клеточно-молекулярных механизмов развития тромбоцитопении в каждом конкретном клиническом случае.
Клинический случай / Clinical case
Клинико-анамнестическая характеристика пациентки / Patient clinical and anamnestic characteristics
Девочка через сутки после рождения была госпитализирована на фоне тяжелой артериальной гипоксемии – насыщение артериальной крови кислородом (англ. arterial blood oxygen saturation, SataO2) составляло 75 % в связи с наличием атрезии легочной артерии с интактной межжелудочковой перегородкой. C первых часов жизни ей проводилась инфузия алпростадила в дозе 0,005 мкг/кг/мин.
Этические аспекты / Ethical aspects
После разъяснения хода обследования и лечения законными представителями пациента было подписано «Информированное согласие» на проводимое лечение и хирургическую коррекцию порока в объеме паллиативного вмешательства. Взаимодействие с пациентом и законными представителями пациента отвечало принципам, установленным Хельсинской декларацией. В соответствии с положениями Федерального закона №152-ФЗ от 27.07.2006 «О персональных данных» при подготовке статьи использованы обезличенные персональные данные пациента.
Первый эпизод тромбоза / First episode of thrombosis
На 8-й день жизни пациентке выполнен модифицированный системно-легочный анастомоз по Blalock–Taussig протезом из политетрафторэтилена (GORE-TEX® Stretch, Gore, США) диаметром 3,5 мм. После операции артериальная гипоксемия регрессировала, SataO2 составило 93 %. В послеоперационном периоде антитромботическая терапия проводилась нефракционированным гепарином (НФГ) путем непрерывной инфузии со скоростью 3 Ед/кг/ч, при этом значения активированного частичного тромбопластинового времени (АЧТВ) находились в диапазоне 71–120 секунд.
На 4-е сутки после операции у больной развился тромбоз системно-легочного анастомоза, сопровождавшийся тромбоцитопенией (наименьшее число тромбоцитов составляло 26×10⁹/л).
Лабораторные данные / Laboratory data
Лабораторные показатели гемостаза на этот момент отражали состояние гипокоагуляции на фоне малых доз НФГ (8 Ед/кг/ч): АЧТВ – 117 секунд, протромбиновое время – 15,2 секунд, международное нормализованное отношение (МНО) – 1,5, содержание фибриногена – 5,76 г/л. Пространственно-временная динамика образования фибрина отражала гипокоагуляционный профиль (рис. 1). Концентрация ADAMTS-13 составляла 0,105 ЕД/мл.
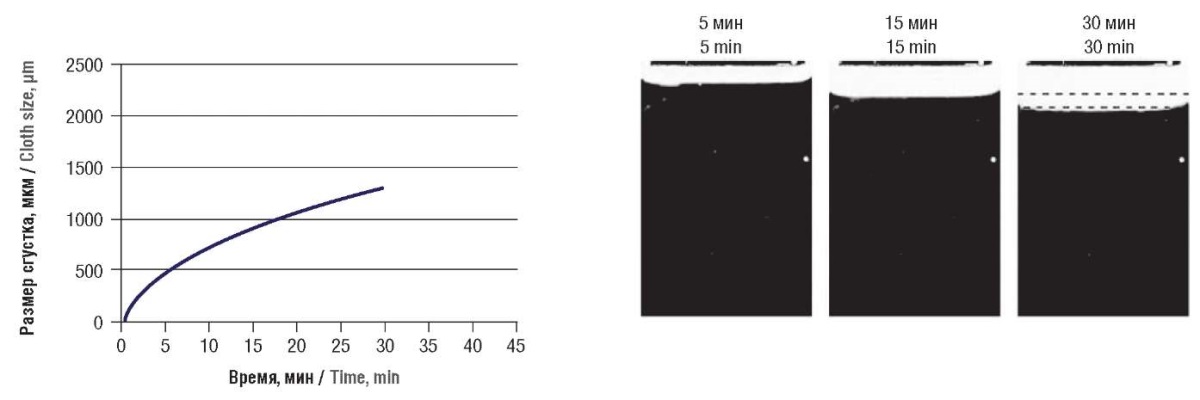
Рисунок 1. Пространственно-временная динамика
образования фибрина в момент первого эпизода тромбоза
(Tlag = 0,8 мин, Vi = 65,8 мкм/мин, Vst = 27,5 мкм/мин,
CS = 1307 мкм, D = 23544 у.е., спонтанные сгустки отсутствуют).
Слева представлена диаграмма изменения размера сгустка во времени,
справа – фоторегистрация роста сгустка
через 5, 15 и 30 минут после активации.
Примечание: Tlag – время задержки роста сгустка;
Vi – начальная скорость роста сгустка;
Vst – стационарная скорость роста сгустка;
CS – размер сгустка через 30 минут;
D – плотность сгустка.
Figure 1. Spatio-temporal change in blood plasma fibrin clot formation
(thrombodynamics assay) at first episode of thrombosis
(Tlag = 0.8 min, Vi = 65.8 µm/min, Vst = 27.5 µm/min,
CS = 1307 µm, D = 23544 c.u., lacked spontaneous clots).
On the left is a diagram of the clot size changing over time,
on the right – photographic recording of clot growth
5, 15 and 30 minutes after activation.
Note: Tag – lag time of clot growth;
Vi – initial rate of clot growth;
Vst – stationary rate of clot growth;
CS – clot size;
D – clot density.
С целью поддержания проходимости открытого артериального протока возобновлено применение алпростадила. При значении активности антитромбина 20 % на фоне инфузии гепарина в дозе 8 Ед/кг/ч и значениях АЧТВ от 89 до 117 секунд произведено введение концентрата антитромбина в дозе 260 Ед/сут.
На 4-е сутки после первой операции в экстренном порядке ребенку выполнен аорто-легочный анастомоз протезом из политетрафторэтилена (GORE-TEX® Stretch, Gore, США) в условиях искусственного кровообращения. Учитывая персистирующую тромбоцитопению на протяжении 5 послеоперационных суток, с целью снижения риска кровотечения в послеоперационном периоде однократно проводилось переливание концентрата тромбоцитов.
В связи с резидуальным характером межпредсердного сообщения на 26-е сутки жизни выполнена транслюминальная баллонная атриосептостомия.
Второй эпизод тромбоза / Second episode of thrombosis
С 34-х суток жизни у пациентки отмечено увеличение потребности в НФГ более 30 Ед/кг/ч. На 41-е сутки наблюдения на фоне прогрессирования инфекционного процесса (количество лейкоцитов – 15,6×10⁹/л, относительный нейтрофилез – 71,8 %, уровень С-реактивного белка – 4,57 мг/дл, концентрация прокальцитонина – 0,67 нг/мл) отмечено развитие тромбозов подключичной и внутренней яремной вены справа, а с 47-х суток – развитие илеофеморального флеботромбоза, который сопровождался рецидивом тромбоцитопении (89×10⁹/л), а также снижением уровня фибриногена и умеренным увеличением концентрации D-димера (рис. 2).
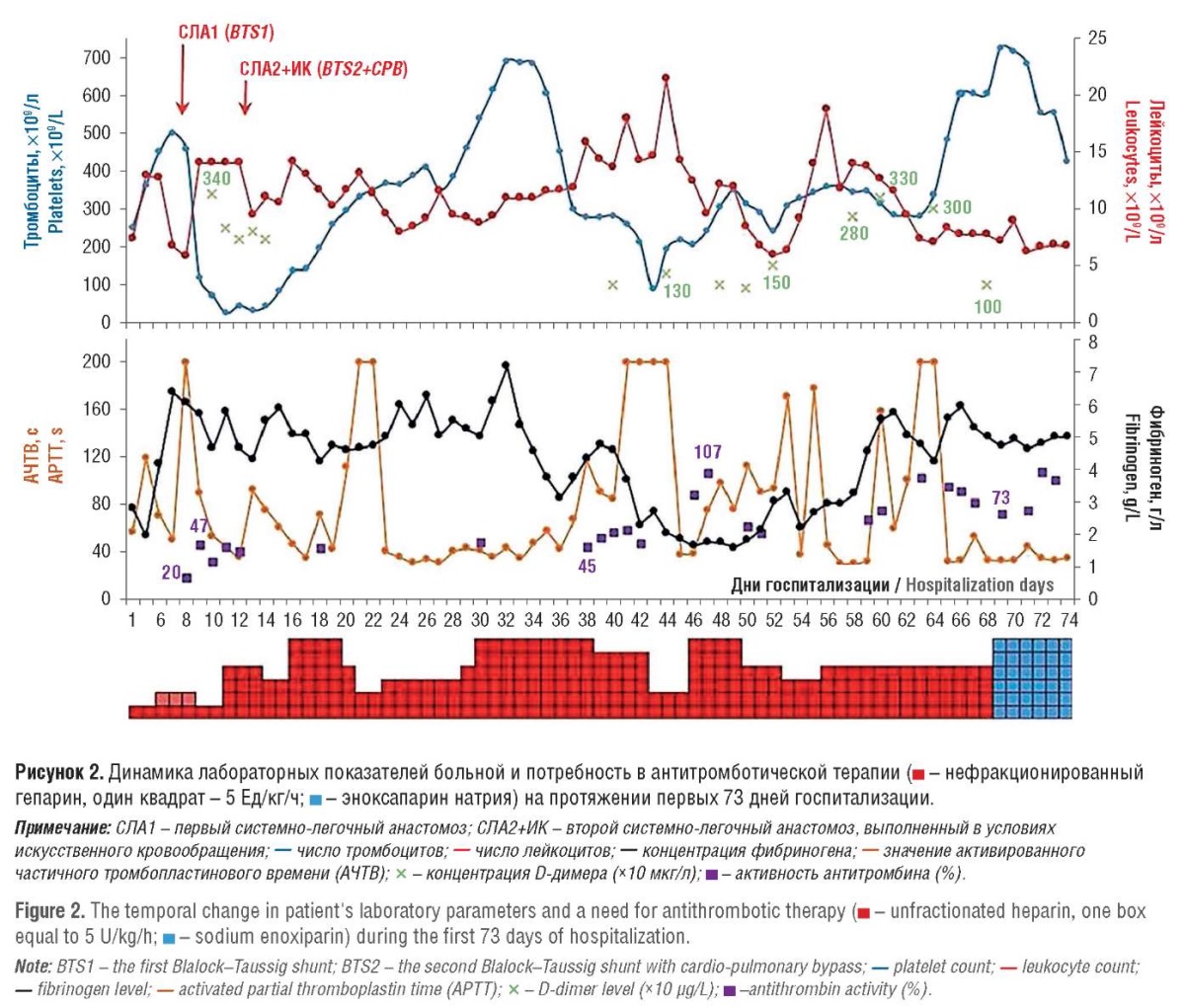
Лабораторные данные / Laboratory data
Агрегация тромбоцитов с аденозиндифосфатом на момент второго эпизода тромбоза составила 75 %, с ристомицином – 84 %. Активность антитромбина была равна 93 %, содержание vWF – 1,98 ЕД/мл, концентрация ADAMTS-13 – 0,25 ЕД/мл, активность ADAMTS-13 – 0,45 ЕД/мл, активность ингибитора ADAMTS-13 – 2,11 ЕД/мл. Соотношение vWF/ADAMTS-13 составило 7,92. Активность протеина С соответствовала 67 %, уровень синдекана-1 – 4,4 нг/мл.
Антифосфолипидные антитела не обнаружены, за исключением антител к комплексу фосфатидилсерин-протромбин (IgG – 15,5 ммоль/л).
Оценка полиморфизма генов гемостаза / Assessment of hemostasis gene polymorphism
При оценке полиморфизма генов гемостаза исключен полиморфизм С6771 в гене метилентетрагидрофосфатредуктазы (MTHFR), а также мутация G11691A в гене фактора V Leiden. При этом определена гетерозиготная форма полиморфизма 494 С/Т в гене протромбина (Thr 165 Met), гетерозиготная форма полиморфизма 46С/Т в гене фактора XII, гетерозиготная форма полиморфизма 163G/Т в гене XIII, гомозиготная форма полиморфизма гликопротеина Gp-IIIa тромбоцитов.
Терапевтическая тактика / Curative measures
Произведена замена НФГ на низкомолекулярный гепарин (НМГ) – эноксапарин натрия под контролем анти-Ха активности с поддержанием значений более 0,3. НМГ применялся в течение 41 суток, до момента выписки из стационара. Тромбоцитопения в данном случае рассматривалась как тромбоцитопения потребления, заместительной терапии не проводилось. По достижению стабилизации общего состояния и разрешения тромбозов на 110-е сутки после рождения и госпитализации пациентка была переведена в педиатрический стационар для дальнейшего лечения.
Обсуждение / Discussion
В представленном клиническом случае на примере первых дней жизни пациента с врожденным пороком сердца показано развитие двух эпизодов послеоперационных тромбозов, имеющих различные механизмы.
Первый эпизод формирования тромба в области системно-легочного анастомоза, по-видимому, обусловлен индуцированной напряжением сдвига секрецией и трансформацией vWF на участке выполненного соустья [8]. Это неминуемо вызвало потребление ADAMTS-13, что и зафиксировано у больной. Изменение соотношения vWF/ADAMTS-13 в пользу vWF сопровождалось адгезией и активацией тромбоцитов в области анастомоза и привело к его тромбозу [9]. Можно предполагать, что развитие данного тромбоза произошло на фоне повышенной агрегационной способности тромбоцитов и риском иммунной тромбоцитопении на фоне генотипа T/C по маркеру T1565C гена ITGB3. При этом тромбоз был ограничен только зоной вмешательства, а лабораторно характеризовался тромбоцитопенией до 26×10⁹/л. Стандартные лабораторные методы оценки гемостаза и пространственно-временная динамика образования фибринового сгустка отражали гипокоагуляционный профиль на фоне проводимой антитромботической терапии. Применение концентрата тромбоцитов на этом этапе лечения было обусловлено необходимостью проведения оперативного вмешательства в условиях ИК.
Применение концентрата антитромбина не позволило достичь увеличения активности антитромбина в плазме крови, а также обеспечить большую предсказуемость терапии НФГ: отсутствовала связь между его дозой и концентрацией (анти-Xа активностью), активностью антитромбина и АЧТВ. Эффект применения НФГ находится в тесной связи с его клиренсом, который у больного в критическом состоянии сильно зависит от изменения белкового состава плазмы и адсорбции гепарина на эндотелии, а также степени участия в угнетении гемостаза отличных от антитромбина систем антикоагуляции: ингибитора пути тканевого фактора и кофактора II гепарина [10]. Не следует также игнорировать истощение антитромбина при длительном применении гепарина или использовании его высоких доз [11].
Второй эпизод тромбоза с локализацией в системах верхней и нижней полых вен развился на фоне эскалации инфекционного процесса, который характеризовался не только тромбоцитопенией, но и снижением концентрации фибриногена. Нельзя исключить участие системы комплемента [12], которая, с одной стороны, обуславливала активацию и повреждение эндотелия, выражавшиеся в возрастании содержания синдекана-1 и vWF, с другой, истощение ADAMTS-13 и, как следствие, нарушение соотношения vWF/ADAMTS-13 [13–15]. На этом этапе лечения поддержание целевых значений АЧТВ достигалось нарастающими дозами НФГ. Несмотря на физиологическую активность антитромбина и высокие дозы НФГ, обеспечить его терапевтическую концентрацию удавалось с большим трудом, что может быть связано с ускорением его клиренса на фоне повреждения эндотелия и высокой концентрации белков острой фазы воспаления [16]. У больного, находящегося в критическом состоянии, лучший фармакологический профиль, большую эффективность и безопасность антитромботической терапии можно ожидать при использовании НМГ, что и отмечено в данном случае [7].
Отдельного внимания заслуживает концентрация D-димера на высоте формирования венозного тромбоза менее ожидаемой, что отражает низкую скорость фибринолиза в условиях высокого тромбинового потенциала и возрастающей активности тромбин-зависимых ингибиторов, например, тромбин-активируемого ингибитора фибринолиза. С другой стороны, нельзя исключить и высокую активность нетоза при системном воспалительном ответе с формированием резистентности к действию плазмина [17][18].
В данной клинической ситуации разрешение инфекционного процесса, а также применение адекватной антитромботической терапии привело к выздоровлению пациентки.
Заключение / Conclusion
Данное клиническое наблюдение наглядно показывает многообразие клеточно-молекулярных механизмов развития тромбозов у новорожденного с многочисленными послеоперационными осложнениями, отсутствие линейных связей между различными звеньями гемостаза, сложность интерпретации лабораторных показателей системы свертывания крови, что предопределяет необходимость поиска истинных причин и последующих вторичных нарушений в каждом конкретном случае.
Список литературы
1. Krispinsky L.T., Stark R.J., Parra D.A. et al. Endothelial-dependent vasomotor dysfunction in infants after cardiopulmonary bypass. Pediatr Crit Care Med. 2020;21(1):42–9. https://doi.org/10.1097/ PCC.0000000000002049.
2. Selim J., Hamzaoui M., Boukhalfa I. et al. Cardiopulmonary bypass increases endothelial dysfunction after pulmonary ischaemia-reperfusion in an animal model. J Cardiothorac Surg. 2021;59(5):1037–47. https://doi.org/10.1093/ejcts/ezaa412.
3. Skeith L., Baumann Kreuziger L., Crowther M.A., Warkentin T.E. A practical approach to evaluating postoperative thrombocytopenia. Blood Adv. 2020;4(4):776–83. https://doi.org/10.1182/bloodadvances.2019001414.
4. Soejima K., Nakagaki T. Interplay between ADAMTS13 and von Willebrand factor in inherited and acquired thrombotic microangiopathies. Semin Hematol. 2005;42(1):56–62. https://doi.org/10.1053/j.seminhematol.2004.09.008.
5. Mannucci P.M., Parolari A., Canciani M.T. et al. Opposite changes of ADAMTS-13 and von Willebrand factor after cardiac surgery. J Thromb Haemost. 2005;3(2):397–9. https://doi.org/10.1111/j.1538-7836.2005.01115.x.
6. Chang J.C. TTP-like syndrome: novel concept and molecular pathogenesis of endotheliopathy-associated vascular microthrombotic disease. Thromb J. 2018;16:20. https://doi.org/10.1186/s12959-018-0174-4.
7. Manlhiot C., Menjak I.B., Brandão L.R. et al. Risk, clinical features, and outcomes of thrombosis associated with pediatric cardiac surgery. Circulation. 2011;124(14):1511–9. https://doi.org/10.1161/CIRCULATIONAHA.110.006304.
8. Favaloro E.J., Henry B.M., Lippi G. Increased VWF and decreased ADAMTS- 13 in COVID-19: creating a milieu for (micro) thrombosis. Semin Thromb Hemost. 2021;47(4):400–18. https://doi.org/10.1055/s-0041-1727282.
9. Naqvi T.A., Baumann M.A, Chang J.C. Post-operative thrombotic thrombocytopenic purpura: a review. Int J Clin Pract. 2004;58(2):169–72. https://doi.org/10.1111/j.1368-5031.2004.0080.x.
10. Chin V.M., Holland M.L., Parker M.M. et al. Antithrombin activity and heparin response in neonates and infants undergoing congenital cardiac surgery: a retrospective cohort study. Can J Anaesth. 2016;63(1):38–45. https://doi.org/10.1007/s12630-0150500.
11. Broman L.M. When antithrombin substitution strikes back. Perfusion. 2020;35(1_suppl):34–7. https://doi.org/10.1177/0267659120906770.
12. Eriksson O., Mohlin C., Nilsson B., Ekdahl K.N. The human platelet as an innate immune cell: interactions between activated platelets and the complement system. Front Immunol. 2019;10:1590. https://doi.org/10.3389/fimmu.2019.01590.
13. Passov A., Schramko A., Salminen U.-S. et al. Endothelial glycocalyx during early reperfusion in patients undergoing cardiac surgery. PLoS One. 2021;16(5):e0251747. https://doi.org/10.1371/journal.pone.0251747.
14. Dong J.-F., Whitelock J., Bernardo A. et al. Variations among normal individuals in the cleavage of endothelial-derived ultra-large von Willebrand factor under flow. J Thromb Haemost. 2004;2(8):1460–6. https://doi.org/10.1111/j.1538-7836.2004.00830.x.
15. Hunt R., Hoffman C.M., Emani S. et al. Elevated preoperative von Willebrand factor is associated with perioperative thrombosis in infants and neonates with congenital heart disease. J Thromb Haemost. 2017;15(12):2306–16. https://doi.org/10.1111/jth.13860.
16. Owings J.T., Pollock M.E., Gosselin R.C. et al. Anticoagulation of children undergoing cardiopulmonary bypass is overestimated by current monitoring techniques. Arch Surg. 2000;135(9):1042–7. https://doi.org/10.1001/archsurg.135.9.1042.
17. Jeppesen A.N., Duez C., Kirkegaard H. et al. Fibrinolysis in cardiac arrest patients treated with hypothermia. Ther Hypothermia Temp Manag. 2022 Dec 6. https://doi.org/10.1089/ther.2022.0037. Online ahead of print.
18. Cahilog Z., Zhao H., Wu L. et al. The role of neutrophil NETosis in organ injury: novel inflammatory cell death mechanisms. Inflammation. 2020;43(6):2021–32. https://doi.org/10.1007/s10753-020-01294-x.
Об авторах
А. А. КупряшовРоссия
Купряшов Алексей Анатольевич – д.м.н., зав. отделом клинической и производственной трансфузиологии с диагностической лабораторией
121552 Москва, Рублевское шоссе, д. 135
К. А. Токмакова
Россия
Токмакова Ксения Александровна – к.м.н., старший научный сотрудник отдела клинической и производственной трансфузиологии с диагностической лабораторией
121552 Москва, Рублевское шоссе, д. 135
Д. Ш. Самуилова
Россия
Самуилова Дания Шавкетовна – д.б.н., главный научный сотрудник отдела клинической и производственной трансфузиологии с диагностической лабораторией
121552 Москва, Рублевское шоссе, д. 135
Д. Н. Шилкин
Россия
Шилкин Дмитрий Николаевич – аспирант кафедры сердечно-сосудистой хирургии с курсом аритмологии и клинической электрофизиологии
121552 Москва, Рублевское шоссе, д. 135
Рецензия
Для цитирования:
Купряшов А.А., Токмакова К.А., Самуилова Д.Ш., Шилкин Д.Н. Многоликость и многообразие тромбозов у новорожденного после операций на сердце. Акушерство, Гинекология и Репродукция. 2023;17(5):663-669. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.444
For citation:
Kupryashov A.A., Tokmakova K.A., Samuilova D.Sh., Shilkin D.N. The many faces of thrombosis in post-cardiac surgery newborn. Obstetrics, Gynecology and Reproduction. 2023;17(5):663-669. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.444

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































