Перейти к:
Синдром Майера–Рокитанского–Кюстера–Хаузера
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.419
Аннотация
История синдрома Майера–Рокитанского–Кюстера–Хаузера (СМРКХ) поучительна не только с исторической точки зрения, но и с гносеологической. Остаются загадкой не только механизмы эмбриогенеза, но не решены многие хирургические аспекты коррекции данного синдрома. Сделана попытка упорядочить и детализировать наиболее интересные аспекты синдрома.
Ключевые слова
Для цитирования:
Адамян Р.Т., Блбулян А.К., Абрамян Р.А., Абрамян Л.Р., Абрамян Г.Р., Гардян Г.К., Блбулян Д.А. Синдром Майера–Рокитанского–Кюстера–Хаузера. Акушерство, Гинекология и Репродукция. 2023;17(5):654-662. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.419
For citation:
Adamyan R.T., Blbulyan A.K., Abrahamyan R.A., Abrahamyan L.R., Abrahamyan G.R., Ghardyan G.K., Blbulyan D.A. Mayer–Rokitansky–Küster–Hauser syndrome. Obstetrics, Gynecology and Reproduction. 2023;17(5):654-662. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.419
Введение / Introduction
“Omnia mirabilis rara,
sed haec appretiare potentia rariorest”
«Все удивительное редко,
но способность оценить это еще реже»
Всю эволюцию биологических видов фундаментальная наука рассматривала с позиций классического дарвинизма, а именно, изменчивости, наследственности и отбора. Эти 3 фактора и определяют динамику адаптируемости биологического вида. В качестве основного аргумента эволюционирующего начала биологического вида всегда рассматривалась разнополость. Но как оказалось, лишь половой диморфизм со множеством возможных хромосомных комбинаций и отбором наиболее приспособленных не полностью отражает суть диморфизма. Согласно эволюционной теории пола В.А. Геодакяна, мужское и женское начала представляют собой сопряжённые подсистемы, которые эволюционируют уже асинхронно и реагируют на любые изменения окружающей среды с целью быстрой адаптации. Автор вводит понятие «ускоренная внутривидовая эволюция» [1]. Как это происходит?
Во-первых, за счет анатомо-физиологических особенностей. Экзопозиция мужских гонад уже располагает к рецепции любой внешней информации, в том числе и мутагенной, и долгое время «непонятный излишек» сперматозоидов позволяет Природе экспериментировать. Поэтому мужская подсистема оперативна. Женские же гонады располагаются в особых гомеостатических условиях и реализуются в большинстве своем одной большой яйцеклеткой. Этим женская подсистема стабильна, а следовательно, консервативна.
Таким образом, любая внешняя информация, которая может привести к изменчивости в одной подсистеме (мужской или оперативной) путем отбора, реализуется в пределах другой (женской или консервативной) подсистемы.
И благодаря диморфизму и асинхронности накопления и реализации генетических программ у мужчин и женщин обеспечивается внутривидовая ускоренная эволюция.
Интересно, что эмбриология пола per se детерминирована не только и не столько наличием половых хромосом. С 5-й недели беременности закладываются будущие гонады, пока индифферентные. Это состояние длится всего 7–10 дней. В частности, наличие только Y хромосомы еще не есть гарантия полноценного формирования мужского фенотипа. Здесь важны антимюллеров гормон, тестостерон и ряд других генетических сигналов. Таким образом, формирование мужского пола есть результат активной дифференцировки с участием множества дополнительных факторов (известных и неизвестных). В противном случае вся система реализуется с формированием женского фенотипа [2]. Но даже при наличии столь стабильной детерминации внутри женского фенотипа возможны аномалии развития. К счастью, частота подобных аномалий невысока, но каждый такой случай есть конкретная человеческая личностная проблема. Одной из таких аномалий развития является синдром Майера–Рокитанского–Кюстера–Хаузера (СМРКХ), на идентификацию которого ушло около 130 лет [3]. Синдром представляет собой нарушение внутриутробного развития мюллеровых протоков и встречается с частотой 1:5000. Характерной клинической картиной является агенезия или аплазия матки и влагалища при нормальном женском кариотипе (46, XX). Наружные гениталии развиты правильно, репродуктивная эндокринная функция не нарушена. Такие девушки достигают пубертатного периода с нормальными телархе и пубархе.
Основной повод обращения к врачам – первичная аменорея. Могут быть циклические боли внизу живота, диспареуния. Если первичная аменорея является лишь фактом, то циклический болевой синдром уже есть жалоба. Как говорил великий французский хирург Рене Лериш: «Здоровье – это жизнь в тишине органов». К сожалению, сложилось так, что в медицине познание реализуется через патологию. Иначе – через патологию мы познаем норму. История открытия синдрома на каком-то этапе подтверждает эту истину.
Патология порой тестирует наши знания. Например, сочетание СМРКХ и эндометриоза даже при полной аплазии и, следовательно, отсутствии функционирующего эндометрия ставит под сомнение теорию ретроградной менструации Симпсона (одна из концепций эндометриоза).
Не меньший интерес с гносеологической точки зрения представляют сочетанные формы. Если СМРКХ в сочетании с агенезией и эктопией почек вполне соответствует известным правилам эмбриогенеза, то аномалии развития шейного отдела позвоночника, тем более патология слухового аппарата или пороки сердца трудно вписываются в эти «правила». Исследования, проводимые на генетическом уровне, не прибавили ясности. Так что на своем пути познания медицина еще долго будет спотыкаться до тех пор, пока мы не сможем выработать более или менее приемлемый единый концепт жизни.
Весьма интересна и поучительна история идентификации данного синдрома. Еще в 1562 г. итальянский анатом Реальдо Коломбо описал аномалию развития под названием «vulva rara». Но истинно научное познание синдрома начинается 3,5 века спустя. И в этом свою неоценимую роль сыграли «анатомические театры» Европы. Впервые анатомическое описание аплазии матки и влагалища независимо друг от друга описывают малоизвестный немецкий патолог Майер и знаменитый австрийский патологоанатом, политик и философ барон фон Рокитанский.
Интересно, что Майер опередил Рокитанского на 9 лет. Но из-за информационной изолированности тех лет они оба считаются первооткрывателями. Не последнюю роль сыграл, видимо, колоссальный авторитет Рокитанского.
Проходит еще 80 лет, пока немецкий гинеколог Кюстер (1910) оперирует девушку с циклическими болями и атрезией влагалища. Это как раз тот симптомный случай, который помог детализировать патоморфологию рудиментов матки, и удалением которых облегчил состояние пациентки. И лишь спустя более полувека швейцарский гинеколог Хаузер (1961) детализирует всю полноту клинических форм синдрома с выделением чистых и сочетанных, симптомных и «немых» форм (в зависимости от степени аплазии), и устанавливается кардинальная специфика синдрома – нормальный женский кариотип (46, XX) [4].
Известно, что одним из фундаментальных свойств живой материи является воспроизведение. При СМРКХ вся психоэмоциональная, эндокринная и рецептивная системы в большинстве своем развиты полноценно. А следовательно, главная внутренняя тенденция к реализации воспроизведения – либидо – не нарушена. И отсутствие условия (влагалища) для реализации сексуальной функции является главным травмирующим фактором.
Следовательно, создание искусственного влагалища (неовагины) стало основной идеей на пути улучшения качества жизни этих женщин.
Исторически именно хирургия являлась тем единственным инструментом, которая давала возможность реконструкции анатомических структур.
На этом пути важно различать 2 больших периода развития хирургии – доантисептический и современный (антисептический) периоды, на стыке которых лежат идеи великого Джозефа Листера, а год 1872 считается началом эры антисептики.
Идея Дюпюитрена (1817) создания канала в пузырно-прямокишечной клетчатке расслоением тканей, т. е. идея кольпопоэза, хотя и зародилась в доантисептическую эру, по существу, стала концептуальной. Нам необходимо чаще вникать в суть процессов, чтобы по достоинству оценить эпохальность той или иной идеи. Например, идея кесарева сечения уже сама по себе гениальна и соразмерна с изобретением колеса [5]. Таких идей в медицине не мало, но и не много.
В дальнейшем были предложены способы создания искусственного влагалища из кожи, отрезков кишечника, брюшины, мочевого пузыря, расширенной уретры и рудиментов матки. Актуальными остались кожный (Гепнер К.Ф. 1872, Abbe-Mcindoe), кишечный (J. Baldwin, 1904) и брюшинный (Отт Д.О. 1897; Давыдов С.Н.; Адамян Л.В.) [6–8]. Все 3 методики относятся к аутопластическим реконструкциям. Что касается гомопластических (донорских) и гетеропластических (от животных, из синтетических материалов) способов создания неовагины, они не нашли своего применения. Но как это часто бывает, нельзя исключить технологический прорыв, который сможет актуализировать эти идеи.
Из нехирургических методов следует упомянуть дилатационный и тяговый (G. Vecchietty) [9]. Из-за способности ткани вульвы к растяжению еще в 1830 г. Fletcher и Amusat предложили технику длительного надавливания пальцем в зоне преддверия влагалища с постепенным образованием углубления. В 1938 г. Франк модифицировал этот метод с использованием специальных протезов (различной длины и диаметра) [10]. С тех пор дилатационная техника претерпела ряд модификаций, но смысл остался прежний. Правда, метод требует времени, терпения и настроя пациентки.
Тяговый метод Vecchietty отличается от дилатационного тем, что вдавление будущего влагалища создается за счет вытяжения купола последнего тяговым аппаратом, установленным на передней брюшной стенке [9].
Такое изобилие методов создания неовагины само по себе уже говорит о том, что нет одного и идеального. Ибо все они имеют свои положительные и отрицательные стороны. И выбор остается за хирургом, за подсчетом рисковых моментов для жизни пациентки и возможных ранних и отдаленных осложнений.
Новая эра открылась с созданием вспомогательных репродуктивных технологий, в частности, экстракорпорального оплодотворения (ЭКО). Возможности ЭКО еще более расширились с привлечением суррогатного материнства и дали возможность этим женщинам с СМРКХ достичь биологического воспроизводства и тем самым материнства – этого божественного и трудно описуемого феномена.
Наибольший интерес представляют попытки трансплантационного решения проблемы. Еще в 1996 г. в шведском городе Гетеборге начались опыты по пересадке матки. И уже в 2013 г. 9 женщинам с СМРКХ трансплантировали донорские матки, из них у 7 успешно. Наконец, в 2014 г. впервые в мире путем кесарева сечения родился новорожденный от матери с пересаженной маткой. Интересно, что донорская матка принадлежала женщине 61 года, дважды рожавшей и уже 7 лет находящейся в постменопаузальном периоде [11].
Клинический случай / Clinical case
Пациентка Р.А., 1996 г.р., обратилась в Республиканский институт репродуктивного здоровья, перинатологии, акушерства и гинекологии 07.01.2022 по поводу аменореи и отсутствия влагалища. Конституционально нормостенического телосложения, рост 168 см, масса тела 56 кг. Детский анамнез не отягощен, росла и развивалась нормально. Вторичные половые признаки развиты правильно.
Гормональный статус (содержание фолликулостимулирующего гормона, лютеинизирующего гормона, эстрадиола, антимюллерова гормона, пролактина) в пределах физиологической нормы, кариотип 46, ХХ. Овуляторная функция яичников нормальная. Ультразвуковое исследование (рис. 1) показало отсутствие матки, нормальные придатки и отсутствие верхних 2/3 влагалища. Наружные гениталии развиты правильно. Оволосение по женскому типу. Большие половые губы прикрывают малые. Вход во влагалище в виде небольшого углубления (1,5–2,0 см). Расположение мочеиспускательного канала, клитора и прямой кишки топографически не нарушены. Со стороны остальных органов брюшной полости аномалий развития и расположения почек не выявлено. Со стороны слухового аппарата, позвоночника и сердца патологий не выявлено. Диагностирована изолированная (чистая) форма СМРКХ. От длительного дилатационного метода пациентка отказалась. Поэтому женщине был предложен хирургический кольпопоэз.
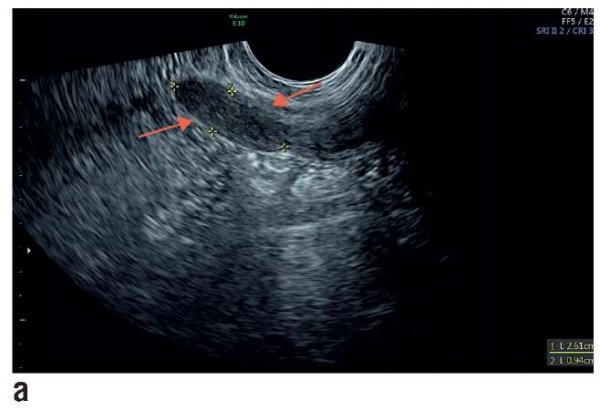
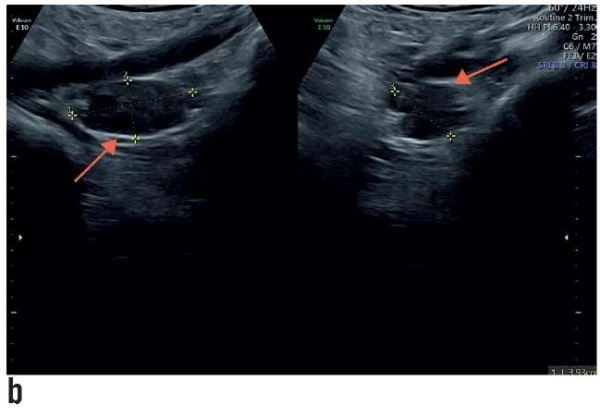
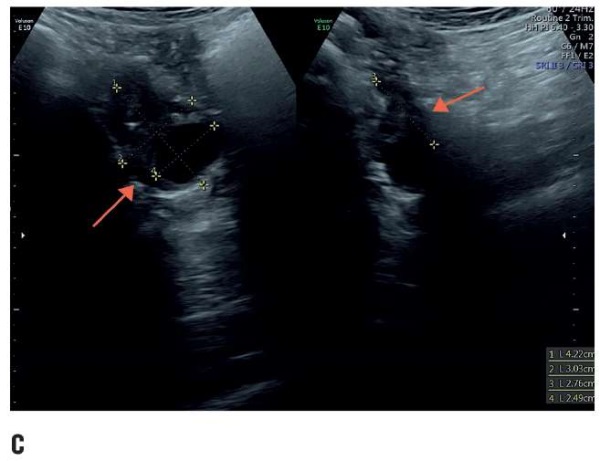
Рисунок 1. Трансректальное предоперационное ультразвуковое исследование:
а) гипопластическая матка (2,72×0,94×2,61 см),
b) правый (3,93×1,89×2,28 см)
и с) левый (4,22×3,03×2,76 см) нормальные яичники.
Структуры обозначены стрелками.
Figure 1. Transrectal preoperative ultrasound examination:
а) hypoplastic uterus (2.72×0.94×2.61 cm),
b) normal right (3.93×1.89×2.28 cm)
and с) left (4.22×3.03×2.76 cm) ovaries.
Arrows indicate the structures of interest.
Описано большое количество различных кожных лоскутов, применяемых с целью кольпопоэза: кожно-мышечные лоскуты тонкой мышцы бедра [12], чрезтазовые кожно-мышечные лоскуты прямой мышцы живота [13], свободный лопаточный лоскут [14], половой лоскут бедра и другие. Среди них, на наш взгляд, выгодно выделяется половой лоскут бедра (англ. Pudendal Thigh Flap, PTF), поскольку он прост в заборе, надежен, нетравматичен для донорского ложа, при этом обладает высоким уровнем чувствительности и эластичности. Этот комплекс тканей был впервые описан J.T.K. Wee и V.T. Joseph в 1989 г. в Сингапуре [15], после чего ряд центров сообщал о хороших результатах при его использовании для кольпопоэза [16–19].
Операция состояла из следующих этапов:
- создание полости в малом тазу для неовлагалища с лапароскопическим контролем со стороны брюшной полости;
- выделение по предварительной разметке Сингапурских лоскутов;
- формирование неовлагалища из выделенных лоскутов;
- размещение неовлагалища в полость малого таза.
По нижнему краю входа в остаточное влагалище выполнили разрез в форме «бабочки». В области данного разреза сформировали отверстие, через которое тупым путем (с использованием расширителя Гегара № 26) создали полость для неовлагалища (рис. 2в). Расположение неовагинального ложа соответствовало нормальному расположению влагалища.
PTFs выделялись билатерально. Лоскуты ограничены медиально волосистой частью больших половых губ, дистально – возможностями кровоснабжения, проксимально – сухожильным центром промежности, латерально – величиной донорского дефекта (рис. 2а). Размеры лоскута зависят от конституции пациента и варьируют в среднем от 4 до 6 см в ширину и от 12 до 15 см в длину. В лоскуты входит кожа, подкожная жировая клетчатка, широкая фасция бедра (глубокая фасция), эпимизий приводящих мышц. Особенно важно сохранение перфорантных сосудов, входящих в основание лоскутов и не мешающих их ротации. Донорская область была закрыта первично.
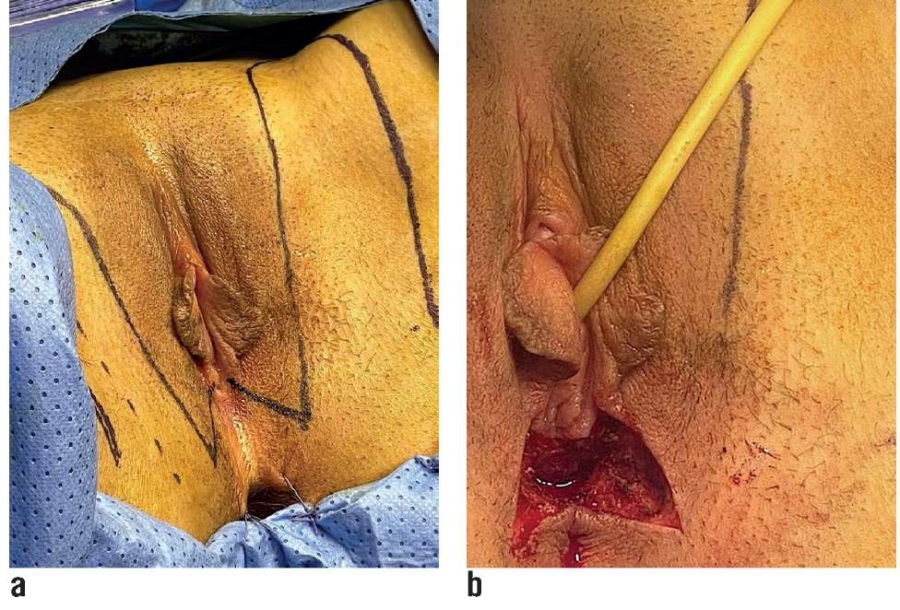
Рисунок 2. Этапы выполнения операции:
а) предоперационная разметка кожно-фасциальных Сингапурских лоскутов;
b) вид отверстия, через которое формировали полость для неовлагалища.
Figure 2. Stages of surgical operation:
a) preoperative mapping of fasciocutaneous (Singapore) flaps;
b) a type of orifice through which the cavity for the neovagina was formed.
Выделенные лоскуты (рис. 3а) сшили между собой длительно рассасывающимся шовным материалом на цервикальном расширителе Гегара № 26 в форме трубки, представляющей собой неовагину (рис. 3б). Затем конструкция была помещена в сформированную полость в малом тазу и укреплена наружными швами (рис. 3в, 3г).
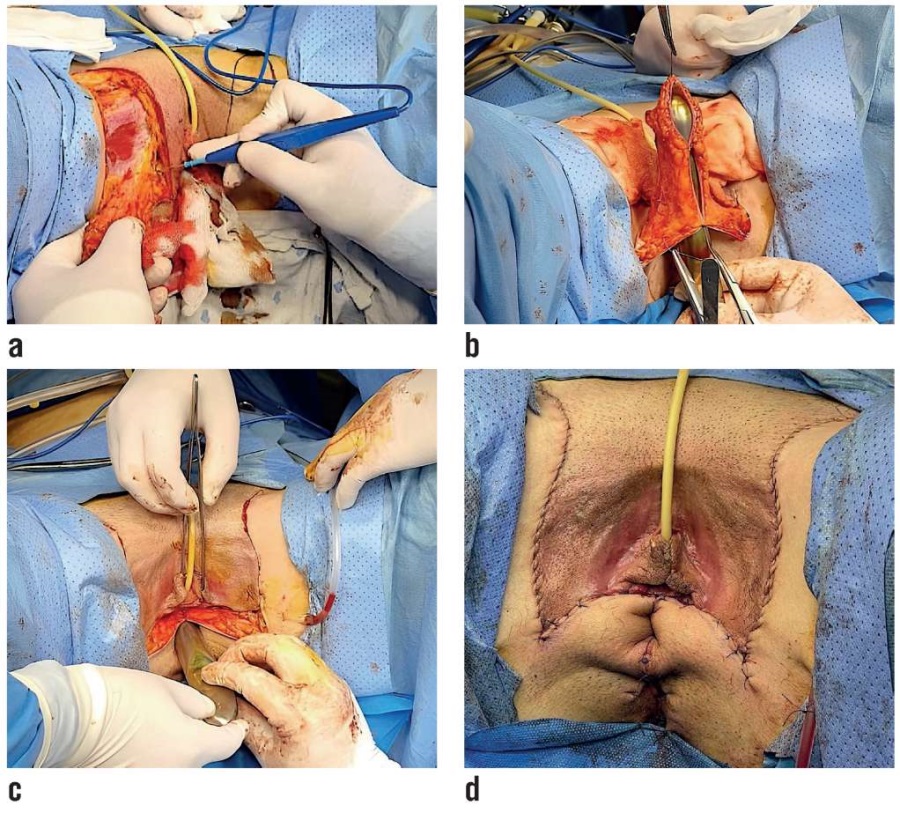
Рисунок 3. Этапы выполнения операции:
а) процесс выделения кожно-фасциальных лоскутов;
b) этап создания неовлагалища на цервикальном расширителе Гегара;
с) размещение неовлагалища в сформированную полость
в малом тазу между мочевым пузырем, уретрой и прямой кишкой;
d) вид наружных половых органов сразу после завершения операции.
Figure 3. Stages of surgical operation:
a) separation of fasciocutaneous flaps;
b) formation of neovagina on the Hegar cervical dilator;
c) neovagina is placed into small pelvis cavity formed
between the bladder, urethra, and rectum;
d) the appearance of the external genitalia immediately after surgical operation.
По окончании операции полость неовлагалища была туго тампонирована марлевым тампоном, пропитанным левомеколем. Установлена также система активного дренирования. В места забора лоскутов помещены резиновые выпускники. Рана укреплена сверху космопором. Марлевый тампон был заменен на новый через 7 дней, после чего он тоже был извлечен ещё через 4 дня.
Состояние тканей после операции было нормальным, осложнений не выявлено, влагалище было проходимо (рис. 4). Длина неовагины сразу после операции составила 10,5 см, в ширину влагалище пропускало 2 пальца. О наличии следов вмешательства при общем осмотре тела свидетельствовали лишь небольшие рубцы в медиальных областях паховых складок (рис. 5). По желанию девушки в дальнейшем могут быть выполнены процедуры эстетической коррекции наружных половых органов и рубцов оперативными и неоперативными способами.

Рисунок 4. Пациентка Р.
Проходимость (а) и внешний вид наружных половых органов (b)
через 2 месяца после операции.
Figure 4. Patient R.
Patency (a) and appearance of the external genitalia (b)
2 months post-surgery.

Рисунок 5. Пациентка Р.
Внешний вид тела спереди (а) и сзади (b) через 2 месяца после операции.
Figure 5. Patient R.
Front (a) and back (b) general appearance 2 months post-surgery.
После извлечения марлевых тампонов в неовагину ничего не вводилось в течение 3 месяцев, дилатационная терапия в этот отрезок времени тоже не проводилась. Через 3 месяца после операции было рекомендовано включать регулярную половую жизнь, либо искусственно разрабатывать полость для правильного ее формирования во время продолжающихся процессов ремоделирования раны. Мы считаем важным соблюдение данной рекомендации в течение 1 года после вмешательства, поскольку это предотвращает вероятность контракции лоскутов и стенозирования полости, а также способствует увеличению длины неовагины до нужных размеров. Через 1 год после операции получен результат в виде функционального влагалища нужной ширины и глубины, эмоционального удовлетворения от наличия половой жизни.
По нашему мнению, данный метод имеет ряд существенных преимуществ:
- кожа снабжена колоссальным числом чувствительных рецепторов из областей внутренних поверхностей бедер и паха, что обеспечивает хорошую поверхностную чувствительность;
- основные этапы операции проводятся экстраперитонеально, что позволяет избежать многих осложнений;
- не требуется пожизненной дилатационной терапии с целью предотвращения контракции и стенозирования; регулярный коитус/искусственное разрабатывание полости обязательны только в период ремоделирования раны (примерно 1 год);
- рубцы малозаметные, располагаются по паховой складке;
- возможно проведение основания лоскута в подкожном туннеле для лучшего эстетического вида промежности.
Несмотря на все положительные моменты, методика не лишена недостатков:
- наличие хоть и малозаметных, но все же видимых снаружи рубцов промежности и паховой складки;
- необходимость для получения наиболее физиологичных результатов хоть и временной, но все же дилатационной терапии;
- отсутствие естественной лубрикации;
- рост волос в полости влагалища. Проблема решаема использованием перед операцией лазерной эпиляции. Кроме того, со временем наблюдается тенденция к уменьшению интравагинального роста волос благодаря процессам атрофии волосяных фолликулов и метаплазии кожи [20];
- склонность лоскутов к апикальным некрозам, что ограничивает их длину (как правило, максимум 15 см). Причина данного феномена в том, что Сингапурский лоскут кровоснабжается из 3 ангиосом: первая – из системы внутренней половой артерии, вторая – из запирательной артерии, третья – из системы наружной половой артерии. Согласно теории Тейлора и Палмера, между ангиосомами есть микроанастомозы (choke vessels), и если между первой ангиосомой (в месте питающей ножки) и второй ангиосомой мощности этих сосудистых соединений достаточно, то между второй и третьей (апикальной) ангиосомой кровоснабжение может стать недостаточным. При желании удлинить лоскуты можно использовать способы их «тренировки» [21].
Заключение / Conclusion
Реконструкция влагалища кожно-фасциальными Сингапурскими лоскутами представляет собой надежную методику, в большинстве случаев лишенную каких-либо осложнений. Параметры неовагинальных карманов во многом напоминают нормальную женскую анатомию: имеют достаточную глубину и ширину, правильный угол наклона, не требуют пожизненной дилатации, обладают хорошей эластичностью и чувствительностью, не склонны к пролапсу. Все это приводит к выводу о том, что этот способ кольпопоэза может быть хорошим выбором как в случае врожденных патологий влагалища, так и при других ситуациях. Но одной лишь «морфологической имитацией» невозможно достичь полноценной самоидентификации. Для этого требуется длительная психоэмоциональная реабилитация с целью достижения лучшего качества жизни. Медицинская наука еще не сказала своего окончательного слова, но одно справедливо: с постижением загадочных явлений жизни станут возможны самые фантастические планы человеческого разума.
Список литературы
1. Геодакян В.А. Эволюционные хромосомы и эволюционный половой диморфизм. Известия Академии Наук. Серия Биологическая. 2000;(2):133–48.
2. Kobayashi A., Behringer R.R. Developmental genetics of the female reproductive tract in mammals. Nat Rev Genet. 2003;4(12):969–80. https://doi.org/10.1038/nrg1225.
3. Realdus Columbus M. De re Anatomica libri XV. Paris: Andream Wechelum, 1562.
4. Küster H. Uterus bipartitus solidus rudimentarius cum vagina solida. Z Geburtshilfe Gynäkol. 1910;67:692–718.
5. Marsh C.A., Will M.A., Smorgick N. et al. Uterine remnants and pelvic pain in females with Mayer-Rokitansky-Kuster-Hauser syndrome. J Pediatr Adolesc Gynecol. 2013;26(3):199–202. https://doi.org/10.1016/j.jpag.2012.11.014.
6. Banister J.B., McIndoe A.H. Congenital absence of the vagina, treated by means of an indwelling skin-graft. Proc R Soc Med. 1938;31(9):1055–6.
7. Baldwin J. XIV. The formation of an artificial vagina by intestinal transplantation. Ann Surg. 1904;40(3):398–403.
8. Давыдов С.Н. Кольпопоэз из брюшины маточно-прямокишечного пространства. Акушерство и гинекология. 1969;45(12):55–7.
9. Vecchietti G. Neovagina nella sindrome di Rokitansky–Kuster–Hauser. Attual Ostet Ginecol. 1965;11:131–47.
10. Frank R.T. The formation of an artificial vagina without operation. Am J Obstet Gynecol. 1938;35:1053–5.
11. Heller-Boersma J.G., Schmidt U.H., Edmonds D.K. Psychological distress in women with uterovaginal agenesis (Mayer-Rokitansky-Kuster-Hauser syndrome, MRKH). Psychosomatics. 2009;50(3):277–81. https://doi.org/10.1176/appi.psy.50.3.277.
12. McCraw J.B., Massey F.M., Shanklin K.D., Horton C.E. Vaginal reconstruction with gracilis myocutaneous flaps. Plast Reconstr Surg. 1976;58(2):176–83. https://doi.org/10.1097/00006534-197608000-00006.
13. Tobin G.R., Day T.G. Vaginal and pelvic reconstruction with distally based rectus abdominis myocutaneous flaps. Plast Reconstr Surg. 1988;81(1):62–70. https://doi.org/10.1097/00006534-198801000-00012.
14. Johnson N., Lilford R.J., Batchelor A. The free-flap vaginoplasty; a new surgical procedure for the treatment of vaginal agenesis. Br J Obstet Gynaecol. 1991;98(2):184–8. https://doi.org/10.1111/j.1471-0528.1991.tb13366.x.
15. Wee J.T.K., Joseph V.T. A new technique of vaginal reconstruction using neurovascular pudendal thigh flap: a preliminary report. Plast Reconstr Surg. 1989;83(4):701–9. https://doi.org/10.1097/00006534-198904000-00018.
16. Wamalwa A.O., Khainga S.O. Island singapore flap vaginoplasty of two adult cases of Mayer–Rokitansky–Küster–Hauser syndrome type I. Ann Afr Surg. 2019;16(1):40–2. http://doi.org/10.4314/aas.v16i1.10.
17. Selçuk C.T., Evsen M.S., Özalp B., Durgun M. Reconstruction of vaginal agenesis with pudendal thigh flaps thinned with liposuction. J Plast Reconstr Aesthet Surg. 2013;66(9):e246–50. https://doi.org/10.1016/j.bjps.2013.04.006.
18. Joseph V.T. Pudendal-thigh flap vaginoplasty in the reconstruction of genital anomalies. J Pediatr Surg. 1997;32(1):62–5. https://doi.org/10.1016/s0022-3468(97)90095-6.
19. Ohmaru Y., Sakata K., Hashiguchi S.-I. et al. A new modified Pudendal Thigh Flap of vaginoplasty including reconstruction of vaginal vestibule. Case Reports Plast Surg Hand Surg. 2017;4(1):21–6. http://doi.org/10.1080/23320885.2017.1296363.
20. Giraldo F., Solano A., Mora M.J., Smith V. Hair growth in the vagina after reconstruction with pudendal thigh flaps in congenital vaginal agenesis. Plast Reconstr Surg. 1998;102(3):924–5. https://doi.org/10.1097/00006534-199809030-00066.
21. Tham N.L.Y., Pan W.R., Rozen W.M. et al. The pudendal thigh flap for vaginal reconstruction: Optimising flap survival. J Plast Reconstr Aesthet Surg. 2010;63(5):826–31. https://doi.org/10.1016/j.bjps.2009.02.060.
Об авторах
Р. Т. АдамянРоссия
Адамян Рубен Татевосович – д.м.н., профессор отделения пластической, реконструктивной и челюстно-лицевой хирургии; профессор кафедры онкологии, радиотерапии и реконструктивной хирургии
119991 Москва, Ленинские горы, д. 1
109004 Москва, ул. Земляной Вал, д. 62
А. К. Блбулян
Армения
Блбулян Армен Кимович – д.м.н., зам. директора по научной работе
0078 Ереван, ул. Маркаряна, д. 6/2
Р. А. Абрамян
Армения
Абрамян Размик Аршалуйсович – д.м.н., профессор, академик НАН Республики Армения, директор
0078 Ереван, ул. Маркаряна, д. 6/2
Л. Р. Абрамян
Армения
Абрамян Лусине Размиковна – д.м.н., профессор, зав. кафедрой акушерства и гинекологии № 2
Ереван 0025, ул. Корюна, д. 2
Г. Р. Абрамян
Армения
Абрамян Гоар Размиковна – д.м.н., доцент кафедры акушерства и гинекологии № 2
Ереван 0025, ул. Корюна, д. 2
Г. К. Гардян
Армения
Гардян Гегам Карапетович – ассистент кафедры патологической анатомии и клинической морфологии, клинический ординатор кафедры акушерства и гинекологии № 2
Ереван 0025, ул. Корюна, д. 2
Д. А. Блбулян
Россия
Блбулян Давид Арменович – клинический ординатор кафедрыакушерства,гинекологии и перинатологии
109004 Москва, ул. Земляной Вал, д. 62
Рецензия
Для цитирования:
Адамян Р.Т., Блбулян А.К., Абрамян Р.А., Абрамян Л.Р., Абрамян Г.Р., Гардян Г.К., Блбулян Д.А. Синдром Майера–Рокитанского–Кюстера–Хаузера. Акушерство, Гинекология и Репродукция. 2023;17(5):654-662. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.419
For citation:
Adamyan R.T., Blbulyan A.K., Abrahamyan R.A., Abrahamyan L.R., Abrahamyan G.R., Ghardyan G.K., Blbulyan D.A. Mayer–Rokitansky–Küster–Hauser syndrome. Obstetrics, Gynecology and Reproduction. 2023;17(5):654-662. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.419

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































