Перейти к:
Что изменилось за год в профилактике венозных тромбоэмболических осложнений у беременных и родильниц?
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.439
Аннотация
В России, как и во всем мире, проблема венозных тромбоэмболических осложнений (ВТЭО) у беременных и родильниц не теряет актуальности. Специализированные мероприятия с участием экспертов как нельзя лучше способствуют активному обсуждению и конструктивному решению сложных задач, к которым относится тромбопрофилактика в акушерстве. Безусловно, не на все спорные вопросы имеются ответы, но критический взгляд и аргументированные выступления лидеров мнения по рассматриваемому направлению, несомненно, улучшат понимание и подходы к вопросу профилактики грозных осложнений у беременных и рожениц, каковыми являются тромбоэмболические события. К тому же активно обсуждаемые новые данные по дозированию низкомолекулярных гепаринов (НМГ) у беременных позволят обновить текущие клинические рекомендации, что, вероятно, улучшит клинические исходы терапии.
Ключевые слова
Для цитирования:
Бицадзе В.О., Зайнулина М.С., Хизроева Д.Х., Николаева М.Г., Макацария А.Д. Что изменилось за год в профилактике венозных тромбоэмболических осложнений у беременных и родильниц? Акушерство, Гинекология и Репродукция. 2023;17(4):533-545. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.439
For citation:
Bitsadze V.O., Zainulina M.S., Khizroeva J.Kh., Nikolaeva M.G., Makatsariya A.D. What has changed over the year in the prevention of venous thromboembolic events in pregnant women and puerperas? Obstetrics, Gynecology and Reproduction. 2023;17(4):533-545. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.439
Без сомнения, значимым событием для акушеров-гинекологов, занимающихся проблемами гемостаза у беременных, является ежегодная Всероссийская конференция с международным участием «Гемостаз, репродукция и женское здоровье». С 1 по 2 июня 2023 г. прошла уже VII конференция в историческом месте и прекрасном дворце Белозерских-Белосельских в Санкт-Петербурге. Участники конференции смогли получить самые новые данные по вопросам нарушений в системе гемостаза при гестации, при этом наслаждаясь историческим местом проведения.
Особый интерес аудитории вызвала интерактивная дискуссия «Что изменилось за год в профилактике венозных тромбоэмболических осложнений у беременных и родильниц?», в которой приняли участие всемирно признанные эксперты в вопросах гемостаза у беременных.
Как отметила в своем докладе д.м.н., проф. Бицадзе Виктория Омаровна – тромбоэмболические осложнения (ВТЭО) во время беременности и послеродовом периоде продолжают оставаться основной непрямой причиной материнской смертности во всем мире [1], при этом в России за период 2005–2018 гг. отмечен неуклонный рост ВТЭО [2]. Необходимо отметить, что по данным исследования SAVE, куда входили и российские женщины, 20 % пациенток с реализовавшимися тромбозами имели высокий риск развития ВТЭО [3], а значит, их развитие было предсказуемым. Как правило, более чем у 50 % беременных причиной тромбоэмболических осложнений является та или иная форма тромбофилии [4]. Проф. В.О. Бицадзе подчеркнула, что несмотря на то, что проблема ВТЭО имеет мультидисциплинарный характер, первым рубежом к ее решению у беременных является стратификация рисков акушером-гинекологом на прегравидарном этапе и с самых ранних сроков беременности, включая индивидуальные риски, с целью своевременной и адекватной как первичной, так и вторичной тромбопрофилактики.
Как известно, Европейский Комитет по изучению причин тромбозов и тромбоэмболий при Европарламенте за период с 2005 по 2010 гг. выявил несоответствие между громадным прорывом в научном понимании механизмов тромбозов, прогрессом в фарминдустрии, появлением новых противотромботических препаратов и неснижающейся частотой ВТЭО в клинической практике во всем мире. Удалось выявить факторы, сдерживающие эффективность профилактики ВТЭО в клинической практике:
- недостаточные знания по патофизиологии тромбозов, не позволяющие правильно оценить риски;
- недостаточные знания фармакодинамики и фармакокинетики антикоагулянтов и, соответственно, необоснованный страх и отказ от их применения;
- неадекватное формирование групп пациентов высокого риска тромбозов;
- отсутствие своевременного прогнозирования риска тромбоза,
и, как следствие, отсутствие или позднее начало противотромботической профилактики, а также отсутствие четких рекомендаций по профилактике ВТЭО для практических врачей. Данные выводы стали основанием для создания ряда регламентирующих документов, в первую очередь Королевского колледжа акушеров и гинекологов (англ. Royal College of Obstetricians and Gynaecologists, RCOG), по оценке риска тромботических осложнений и рекомендаций по их минимизации [5]. На основании Постановления Правительства «Об утверждении порядка поэтапного перехода медицинских организаций к оказанию медицинской помощи на основе клинических рекомендаций от 17.11.2021, № 1968», медицинская помощь в Российской Федерации (РФ) организуется и оказывается на основе клинических рекомендаций, одобренных научно-практическим Советом Минздрава РФ и размещенных в Рубрикаторе Минздрава РФ. Таким образом, одобренные 14.02.2022 клинические рекомендации «Венозные осложнения по время беременности и в послеродовом периоде. Акушерская тромбоэмболия» стали обязательными к исполнению акушерами-гинекологами с 01.01.2023 [6]. Текущие рекомендации регламентируют процесс оценки рис- ка ВТЭО на балльной основе, а также сроки начала и длительности тромбопрофилактики, обязательные к исполнению всеми акушерами-гинекологами. При этом препаратами выбора для использования в антенатальном и постнатальном периодах для профилактики ВТЭО являются низкомолекулярные гепарины (НМГ) [6]. В свою очередь, юридические вопросы регулирования оказания своевременной и качественной помощи регламентируются статьей 41 ФЗ N 326-ФЗ от 29.11.2010 о порядке применения санкций к медицинским организациям за нарушения по результатам медико-экономического контроля, медико- экономической экспертизы или экспертизы качества медицинской помощи, выявленным при проведении контроля объемов, сроков, качества и условий предоставления медицинской помощи [7]. Таким образом, с учетом высоких требований к качеству оказываемой помощи сегодня важна своевременная актуализация клинических рекомендаций, разъяснение основных положений и дальнейшее внедрение их в клиническую практику для улучшения результатов профилактики ВТЭО у беременных и рожениц.
Важным аспектом на пути выполнения клинических рекомендаций по профилактике ВТЭО является не только подписание информированного согласия на использование антикоагулянтных препаратов, но и сроки начала и длительности их применения во время геcтации. Как подчеркнула д.м.н., проф. Зайнулина Марина Сабировна, другим важным аспектом является обоснованность использования лекарственных средств для профилактики ВТЭО. Сегодня в вопросе выбора и согласования терапии принимает участие как доктор, так и пациент, который зачастую диктует свои предпочтения, как правило, не имея квалификационных знаний в этой области. Иногда препараты, которые используют пациенты в качестве профилактических средств, не имеют такового действия или имеют очень низкий антикоагулянтный эффект в отличие от НМГ, которые убедительно доказали свою высокую профилактическую эффективность [8]. Так, использование дипиридамола, ацетилсалициловой кислоты (АСК), сулодексида вселяет ложные надежды у пациента, нуждающегося в надежной профилактике ВТЭО, так как механизм действия этих средств имеет сомнительный или слабовыраженный (а иногда и полностью отсутствующий) антикоагулянтный эффект. В первую очередь, перечисленные препараты обеспечивают ангиопротекторное, фибринолитическое и профибринолитическое действие, а также влияние (ингибирование) на адгезию тромбоцитов. На основании этого данные лекарственные средства не могут быть рекомендованы в качестве надежного средства для профилактики ВТЭО, в том числе и у беременных и рожениц. Более того, и АСК и сулодексид, согласно инструкциям по применению, противопоказаны к использованию в I триместре беременности, а АСК – и в III.
Безопасность и эффективность применения НМГ для профилактики ВТЭО во время беременности подтверждена многочисленными исследованиями. Еще в 2005 г. результаты метаанализа по использованию различных НМГ, основанные на результатах 81 отчета и 2777 беременностей, показали, что частота развития ВТЭО и артериальных тромбозов у беременных составила 0,86 % (95 % доверительный интервал (ДИ) = 0,55–1,28 %) и 0,50 % (95 % ДИ = 0,28–0,84 %). Значительные кровотечения развились у 1,98 % (95 % ДИ = 1,50–2,57 %) и были ассоциированы с акушерскими причинами, аллергические кожные реакции – у 1,80 % (95 % ДИ = 1,34–2,37 %), гепарин-индуцированная тромбоцитопения (ГИТ) – у 0 %, тромбоцитопения (не была связана с использованием НМГ) – у 0,11 % (95 % ДИ = 0,02–0,32 %) и переломы, связанные с остеопорозом, – у 0,04 % (95 % ДИ < 0,01–0,20 %) беременных [8]. В целом, в 94,7 % случаев беременности завершились живорождением, включая 85,4 % беременных с повторными потерями, получавшими НМГ. Максимальная эффективность продемонстрирована у беременных (n = 473), применявших надропарин кальция (Фраксипарин). В отличие от других НМГ, у женщин, получавших надропарин кальция, не было зарегистрировано ни тромбозов, ни тяжелых кровотечений (табл. 1).
Многочисленные клинические исследования эффективности надропарина кальция (фраксипарин) по снижению числа ВТЭО, в том числе у женщин с тромбофилиями высокого риска, при низком числе серь- езных нежелательных явлений [9] позволяют рекомендовать его ведущими международными и Российскими сообществами акушеров-гинекологов для предупреждения таких серьезных осложнений как тромбоз глубоких вен (ТГВ) и тромбоэмболия легочной артерии (ТЭЛА) [5][6][10][11].
Как заметила проф. Хизроева Джамиля Хизриевна, в условиях, когда вспомогательные репродуктивные технологии (ВРТ) стали рутинной практикой у бесплодных пар, вопрос профилактики ВТЭО становится все более актуальным среди врачей-репродуктологов, особенно при оказании помощи женщинам старшего репродуктивного возраста, количество которых значительно возросло за последние 30 лет [12–14]. Интересны данные одного из самых крупных исследований Шведского регистра, где были оценены риски тромбозов у женщин в протоколах экстракорпорального оплодотворения (ЭКО) (n = 23 498) и женщин с естественной беременностью (n = 11 960), сопоставимых по возрасту и календарному сроку родов, оцененных в трех периодах: до наступления беременности, в период беременности и до 42 дней после родов, с 43-го дня после родов и до 336-го дня после родов (рис. 1).
Так, доля женщин, перенесших ЭКО и ВТЭО, составила 4,2 случая на 1000 (n = 99) по сравнению с 2,5 на 1000 (n = 291) из 116 960 женщин со спонтанно наступившей беременностью. Риск ВТЭО был значительно повышен в течение I триместра (1,5/1000 против 0,3/1000). При этом риск ТЭЛА у женщин после ЭКО был увеличен почти в 7 раз в течение I триместра по сравнению с женщинами со спонтанной беременностью, и составил 3,0/10000 против 0,4/10000. Риск артериальных тромбозов также был повышен, особенно в первые 10 дней после переноса эмбриона, и сохранялся длительно. Более того, в Датском регистре, оценивавшем риск тромбоза почти у 19 тыс. женщин, выявлено закономерное увеличение случаев ВТЭО при развитии многоплодной беременности [13]. В свою очередь Шведское когортное исследование у более чем 900 тыс. женщин продемонстрировало 8-кратное увеличение риска тромбозов в I триместре у женщин с ЭКО (отношение рисков = 8,69; 95 % доверительный интервал (ДИ) = 3,83–12,67) по сравнению с женщинами, рожавшими после естественного зачатия. Интересно, что частота ВТЭО у женщин, рожавших после переноса замороженных-размороженных эмбрионов, не увеличилась в течение I триместра. Эти свидетельствует о том, что криоперенос эмбрионов может быть предпочтительным методом ЭКО с минимальным риском для матери [14].
Одним из самых значительных факторов риска ВТЭО при проведении ЭКО является синдром гиперстимуляции яичников (СГЯ), являясь ятрогенным и порой фатальным осложнением. Женщины с СГЯ демонстрируют увеличение частоты ВТЭО практически в 100 раз в течение I триместра беременности в ответ на экзогенный хорионический гонадотропин человека (ХГЧ), а через 10 дней и на эндогенный ХГЧ, вырабатываемый трофобластом при успешном ЭКО, по сравнению с естественной беременностью (относительный риск (ОР) = 87,3; 95 % ДИ = 54,1–140,8). В целом, в 30 % случаев СГЯ переносится в легкой форме, а в 3–8 % случаев – в средней и тяжелой. Повышенный риск ВТЭО составляет в I триместре ОР = 9,8 (95 % ДИ = 6,7–14,3) с сохраняющимися фоновыми показателями во II и III триместрах, начальном послеродовом периоде и в первые 3 года после цикла ЭКО [15].
Хорионический гонадотропин человека играет важную роль в патогенезе стимуляции яичников, приводя к увеличению провоспалительных цитокинов и вазоактивных веществ, в частности сосудистого эндотелиального фактора роста (или сосудистого фактора проницаемости), принадлежащего к семейству гепарин-связывающих белков и являющегося важнейшим фактором ангиогенеза. Очевидно, он влияет на фолликулогенез, функцию желтого тела и ангиогенез яичников. В итоге развивается СГЯ, сопровождающийся огромным выбросом провоспалительных цитокинов, выработкой большого количества сосудистого эндотелиального фактора и развитием синдрома «капиллярных утечек» с выходом части плазмы из сосудистого русла в интерстициальное пространство, формируя характерную клинику СГЯ: асцит, гидроторакс, гиповолемию, снижение перфузии тканей и органов, отеки, поражение печени и почек, гемоконцентрацию и тромбозы. Наряду с белками острой фазы воспаления, важными медиаторами при СГЯ являются провоспалительные цитокины – интерлейкины (англ. interleukin, IL) IL-1β и IL-6. Внутриовариальная ренин-ангиотензиновая система, участвующая в регуляции проницаемости сосудов, изобилует всеми вышеперечисленными факторами воспаления и коагуляции. Все эти системы провоцируют и усугубляют состояние гиперстимуляции яичников, по-своему напоминая процесс тромбовоспаления, вносящий вклад в инициацию и распространение коагуляции (рис. 2).
Таким образом, формирование СГЯ обеспечивает высокий риск (4 балла по RCOG) развития ВТЭО [16].
Представленные проф. Д.Х. Хизроевой клинические случаи еще раз наглядно продемонстрировали специфичность формирования тромбозов верхних конечностей при ЭКО, недостаточную настороженность к проблеме ВТЭО у женщин в программах ЭКО, недостаточную диагностику тромбофилий, которая сегодня еще раз актуализирует вопрос скрининга на наличие тромбофилий у женщин с бесплодием, вступающих в протокол ЭКО, а также необходимости адекватной терапии, в том числе и при легких формах СГЯ.
К сожалению, факт неудачной ВРТ, выявленный в регистре RIETE, вообще не учитывается в качестве фактора риска ВТЭО. При этом выявлен более высокий риск ТЭЛА в неудачных циклах, чем в успешных на всех сроках: во время беременности, послеродового периода и контрацепции [17].
Таким образом, в современных условиях, когда лечение бесплодия становится обыденным, полученные данные еще раз подтверждают наличие рисков ВТЭО на протяжении всей беременности, с большей частотой в I триместре и высокой статистической значимостью у женщин с беременностью после ВРТ, а также сохранением рисков после регресса клинической картины СГЯ даже более чем через 3 мес. «Prevention is the daughter of intelligence («Профилактика – дочь разума»)», – завершила свое выступление Джамиля Хизриевна словами известного английского лорда Walter Raleigh, которые в полной мере подтверждают актуальность превентивной медицины сегодня.
Проф. Николаева Мария Геннадьевна, отвечая на давно обсуждаемый вопрос по дозированию НМГ у беременных для профилактики ВТЭО, сформулировала 4 основных критерия эффективности и безопасности тромбопрофилактики, которые представляют наибольший интерес практического использования НМГ в акушерстве: риск развития тромбоэмболических осложнений, риск развития больших (массивных) кровотечений, комплаентность терапии при ее длительном использовании, а также необходимость лабораторного контроля.
Дискуссии об адекватности используемых профилактических доз антикоагулянтов продолжаются в течение нескольких десятилетий. Известно, что индивидуальные особенности пациента, в первую очередь нарушение функции почек, являются причиной возможного ограничения эффективности низких доз НМГ. Логичен вопрос, нужен ли лабораторный контроль длительного использования НМГ в различных клинических когортах пациентов? С одной стороны, большинство международных экспертов не согласны с утверждением, что для оценки эффективности НМГ необходимо документировать уровни анти-Ха активности, так как лабораторные показатели не являются предикторами клинических результатов. По мнению J.R. van Lennep с соавт., изучение динамики лабораторных показателей имеет исследовательский интерес, но все что важно для пациента и врача – это клинический исход [18]. С другой стороны, для минимизации нежелательных явлений, особенно больших кровотечений, особенно у пациентов со сниженной функцией почек и для подбора доз НМГ у пациентов с морбидным ожирением может быть актуален контроль анти-Xa активности при использовании НМГ, особенно в промежуточных и терапевтических дозах.
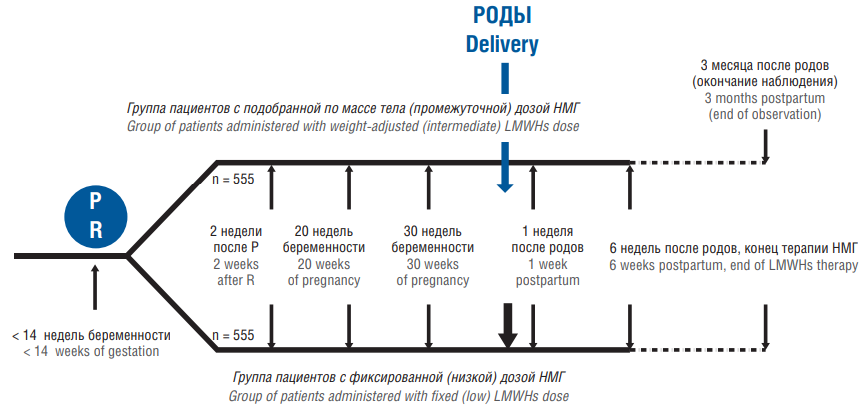
Наиболее актуальный и беспрецедентный по дизайну, количеству включенных пациентов и конечным точкам исследования является международный проект по оценке эффективности и безопасности низких фиксированных и промежуточных (адаптированных по массе тела) доз НМГ для вторичной профилактики ВТЭО у женщин с отягощенным анамнезом [19, 20]. В проекте приняли участие 70 клинических центров из 9 стран мира: Нидерланды, Франция, Ирландия, Бельгия, Норвегия, Дания, Канада, США, Россия. В исследовании были рандомизированы 1110 беременных с ВТЭО в анамнезе и показанием к анте- и постнатальной медикаментозной тромбопрофилактике в сроке до 14-й недели гестации. Первичной конечной точкой эффективности определены симптоматические повторные ВТЭО, развившиеся во время беременности и за 6 нед после родоразрешения. Первичной конечной точкой безопасности были клинически значимые кровотечения, гемотрансфузии за 6 нед после родов, смертность, кожные реакции в течение всей беременности и 3 мес послеродового периода. Все женщины после рандомизации распределялись в 2 параллельные группы: группу, получавшую тромбопрофилактику в фиксированной (низкой) дозе, и группу, получавшую подобранные по массе тела (промежуточные) дозы, по 555 человек в каждой (рис. 3).
Режим используемых НМГ при проведении проспективного исследования Highlow представлен в таблице 2.
Наиболее часто назначаемыми НМГ были надропарин кальция и эноксапарин натрия – в 36,8 % (n = 408) и 37,2 % (n = 413) случаев соответственно.
Было выявлено, что венозная тромбоэмболия произошла у 11 (2,0 %) из 555 женщин в группе промежуточных доз с поправкой на массу тела и у 16 (3,0 %) из 555 в группе фиксированных (низких) доз (ОР = 0,69; 95 % ДИ = 0,32–1,47; p = 0,33). Венозная тромбоэмболия развилась до родов у 5 (1,0 %) женщин в группе промежуточных доз и у 5 (1,0 %) женщин в группе низких доз, а также после родов у 6 (1,0 %) женщин и 11 (2,0 %) (рис. 4А). В свою очередь, большое кровотечение во время лечения произошло у 23 (4,0 %) из 520 женщин в группе промежуточных доз и у 20 (4,0 %) из 525 в группе низких доз (ОР = 1,16; 95 % ДИ = 0,65–2,09) (рис. 4В).
Таким образом, проведенное исследование подтвердило, что использование фиксированных низких доз НМГ абсолютно оправдано, так как применение НМГ в промежуточных дозах с поправкой по массе тела в дородовом и послеродовом периодах у женщин с ВТЭО в анамнезе не сопровождалось дополнительным снижением риска рецидива ВТЭО. При этом частота развития больших и малых кровотечений в дородовом и послеродовом периодах у женщин, использующих низкие фиксированные и промежуточные дозы НМГ, также статистически не отличалась, хотя была незначительно выше в подгруппе больших доз [20].
Эти данные легли в основу создания кратких алгоритмов по профилактике и лечению ВТЭО во время беременности (табл. 3).
Представленные данные предсказуемо вызвали оживленную дискуссию среди экспертов-участников, что еще раз подтверждает многообразие подходов разных школ в данном вопросе, отражающих, в первую очередь, приверженность к персонифицированному подходу в вопросе тромбопрофилактики наряду с унифицированными алгоритмами протоколов и клинических рекомендаций для врачей. В частности, проф. В.О. Бицадзе еще раз отметила, что пациентки высокого риска рецидивирующих тромбозов с тяжелыми формами генетической тромбофилии (тяжелый дефицит антитромбина III, протеина С, мультигенные и гомозиготные мутации генов фактора V Leiden и/или протромбина G20210A) и с тромботическим антифосфолипидным синдромом (с двойной и тройной позитивностью по критериальным антителам) не могут получать фиксированную малую дозу НМГ на протяжении всего гестационного процесса и требуют промежуточных и в ряде случаев даже лечебных доз, в особенности во второй половине беременности.
Несомненно и то, что данные, полученные в исследовании Highlow, смогут помочь сформулировать общий подход в вопросе профилактики ВТЭО для акушеров-гинекологов первого звена и унифицировать алгоритмы ведения пациенток для улучшения общих результатов профилактики ВТЭО. Важно, что эти данные согласуются с результатами ранее проведенных исследований в популяциях пациентов различного профиля, где надропарин кальция (Фраксипарин, Аспен Хэлс) обеспечивал эффективное снижение рисков ВТЭО, благоприятный профиль местной переносимости при сравнении его с эноксапарином и далтепарином, что обеспечивало надропарину кальция в 3 раза лучшую комплаентность терапии [22][23].
Важно еще раз отметить, что использование НМГ в профилактических дозах не требует определения анти-Ха активности, уровня D-димера, делая современную терапию достаточно эффективной, безопасной и удобной для длительного амбулаторного использования [6], что как нельзя лучше подтверждает золотые слова Зиновия Соломоновича Баркагана: «Наука должна быть для больного…».
Несмотря на давно обсуждаемый вопрос последних десятилетий «Все ли НМГ одинаковы, и как определиться в их разнообразии?», он по-прежнему вызывает массу споров и неоднозначных решений, осветила проф. В.О. Бицадзе [24][25]. Основной вывод, основанный на особенностях строения НМГ (их животное происхождение, специфические производственные процессы), определяет каждый из них как отдельный объект с доказательствами эффективности и безопасности каждого на основании программы клинических исследований (показания, оптимальные дозы) и общего вывода о невозможности взаимозаменяемости! По мнению ведущих международных сообществ – Управлению по контролю качества пищевых продуктов и лекарственных средств (англ. Food and Drug Administration, FDA), Всемирной организации здравоохранения (ВОЗ), Американской коллегии клинических фармакологов (англ. American College of Clinical Pharmacy, ACCP), Американской кардиологической ассоциации (англ. American Heart Association, AHA), Американской коллегии кардиологов (англ. American College of Cardiology, ACC), НМГ не являются терапевтически взаимозаменяемыми [26][27].
Так, гетерогенность молекул различных НМГ влияет на их анти-Xa и анти-IIa активности, обеспечивая им разные биологические и клинические эффекты, что подтверждается клиническими данными, полученными в программах клинических исследований, которые значительно отличаются друг от друга. Они отличаются по соотношению анти-Ха/анти-IIa активности, биодоступности, риску кровотечения и по иммуногенному потенциалу с лучшим профилем у надропарина кальция при подкожном введении (рис. 5) [28–31].
В свою очередь, U. Kistler с соавт. подчеркнули, что несмотря на кажущуюся схожесть надропарина и эноксапарина в предупреждении подтвержденных симптоматических послеоперационных тромбоэмболических событий, отмечается увеличение клинически значимых кровотечений на 30 % в группе эноксапарина [32].
Таким образом, совершенно очевидна разница между различными НМГ ввиду значительных различий как в их физических, биохимических, так и фармакологических и клинических свойствах [28–32].
Другой важный вопрос – вопрос подобия копий НМГ. Важно помнить, что биологические препараты получаются путем экстракции из биологических тканей или с помощью биотехнологических процессов и отличаются от низкомолекулярных препаратов тем, что состоят из гораздо более крупных молекул сложной структуры, включающих рекомбинантные факторы свертывания крови, гормоны, цитокины, факторы роста, ферменты, факторы свертывания крови, антитела или фрагменты антител. Классическая концепция дженериков не применима к этому классу лекарств, а термин «биоаналоги» или «биосимиляры» (англ. biosimilars) используется для обозначения продуктов, разработанных для того, чтобы быть похожими на исходный биологический препарат и демонстрировать фармакологическую активность оригинального НМГ при ее меньшей стоимости. Однако в первую очередь безопасность биосимиляров не подкреплена таким же количеством клинических доказательств, которую имеет оригинальный продукт. На этом основании решение о терапевтической замене НМГ биоаналогами не должно приниматься только по экономическим соображениям, так как даже незначительные различия в процессе производства НМГ могут иметь серьезные последствия в клинических ситуациях. История знает случаи, когда в ноябре 2007 г. FDA не одобрило аналог НМГ, поскольку в заявке не был адекватно рассмотрен потенциал иммуногенности препарата [33].
Итак, нефракционированный гепарин (НФГ) – многокомпонентная, полифармакологическая смесь сульфатированного мукополисахарида, которую трудно охарактеризовать, при этом НМГ – деполимеризованные гепарины, зависящие от процесса химических и физических модификаций. Таким образом, каждый НМГ отличается друг от друга. Это также должно быть справедливо для биоаналогов, так как одной химической эквивалентности может быть недостаточно для доказательства одинаковости биологических препаратов. Экономическая целесообразность применения биосимиляров не должна быть использована в ущерб безопасности НМГ. Так, нашумевший «Гепариновый кризис», случившийся в 2008 г., был связан с контаминацией гиперсульфатированными хондроитинсульфатами, полученными в процессе экстракции гепарина из животного материала, а также другими компонентами, которые вызывали у пациентов тяжелые иммунные реакции [34].
Что еще более важно, это схожесть фармакодинамических характеристик и клинической эквивалентности, которые должны быть представлены в качестве критериев приемлемости для аналогов лекарственных препаратов биологического происхождения [35]. На этом основании FDA одобряет копию оригинального НМГ при соблюдении всех 5 критериев для определения эквивалентности физико-химических свойств:
1) источник гепарина,
2) метод деполимеризации,
3) основное дисахаридное звено определенных полисахаридных фрагментов и конкретных последовательностей олигосахаридов,
4) биологические и биохимические оценочные тесты,
5) эквивалентность фармакодинамического профиля in vivo [35].
В свою очередь, требования к регистрации в Европейском агентстве по лекарственным средствам (англ. European Medicines Agency, EMA) в отличие от FDA более жесткие, где рассматривается копия оригинального НМГ при наличии следующих сравнений:
– анти-Ха фактора и антитромбинового времени, активированного частичного тромбопластинового времени (АЧТВ), протромбинового времени (ПВ), высвобождения ингибитора пути тканевого фактора (англ. tissue factor pathway inhibitor, TFPI);
– исследования безопасности в отношении иммуногенности копии и оригинатора, включая оценку образования антител к тромбоцитарному фактору 4 (англ. platelet factor 4, PF4) и развитие ГИТ II типа;
– наличии одного мощного рандомизированного двойного слепого клинического исследования с параллельными группами в отношении профилактики ВТЭО, или артериальной тромбоэмболии, или лечения ВТЭО в группах с высоким риском тромбообразования (например, при ортопедических операциях) [36].
Рекомендации EMA и консенсусный документ Международного общества по тромбозу и гемостазу (англ. International Society on Thrombosis and Haemostasis, ISTH) по производству биоаналогов НМГ включают также необходимость проведения in vivo сравнительных исследований способности оригинального НМГ и его биоаналога высвобождать из стенки сосуда ингибитор пути тканевого фактора (TFPI) [37]. Это очень важный момент, поскольку не все аспекты того, что считается клинически значимым эффектом отдельного НМГ, описаны в документах, предназначенных для руководства по производству биоаналогов НМГ.
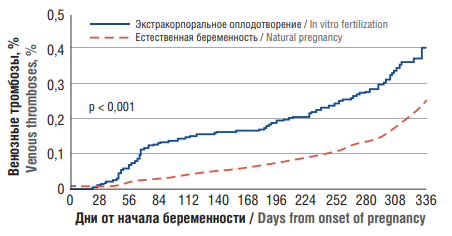
Рисунок 1. Частота венозных тромбоэмболических осложнений у женщин после проведения экстракорпорального оплодотворения и у женщин с естественной беременностью (адаптировано из [12]).
Figure 1. The incidence rate of venous thromboembolic events in women after in vitro fertilization and in women with natural pregnancy (adapted from [12]).
Таблица 1. Клинические осложнения использования различных низкомолекулярных гепаринов при беременности по разным показаниям (адаптировано из [8]).
Table 1. Pregnancy-associated clinical complications related to various low molecular weight heparins under different indications (adapted from [8]).
|
Осложнения Complications |
Фраксипарин (надропарин кальция) Fraxiparine (nadroparin calcium) |
Все НМГ All LMWH |
|
Число пациентов Number of patients |
473 |
2 777 |
|
Тромбоз глубоких вен, n (%) Deep vein thrombosis, n (%) |
0 (0) |
14 (0,58) |
|
Тромбоэмболия легочной артерии, n (%) Pulmonary embolism, n (%) |
0 (0) |
5 (0,18) |
|
Другие неуточненные ВТЭО, n (%) Other unspecified VTEs, n (%) |
0 (0) |
3 (0,11) |
|
Артериальные тромбозы, n (%) Arterial thromboses, n (%) |
0 (0) |
14 (0,50) |
|
Тяжелое антенатальное кровотечение, n (%) Severe antenatal bleeding, n (%) |
0 (0) |
12 (0,43) |
|
Послеродовая гематома, 500 мл, n (%) Postpartum hematoma, 500 ml, n (%) |
0 (0) |
26 (0,94) |
|
Раневая гематома, n (%) Wound hematoma, n (%) |
0 (0) |
17 (0,61) |
|
Аллергия, n (%) Allergy, n (%) |
18 (4,29) |
50 (1,80) |
|
Низкое количество тромбоцитов, n (%) Low platelet count, n (%) |
0 (0) |
3 (0,11) |
|
Остеопороз, n (%) Osteoporosis, n (%) |
0 (0) |
1 (0,04) |
Примечание: ВТЭО – венозные тромбоэмболические осложнения.
Note: VTEs – venous thromboembolic events
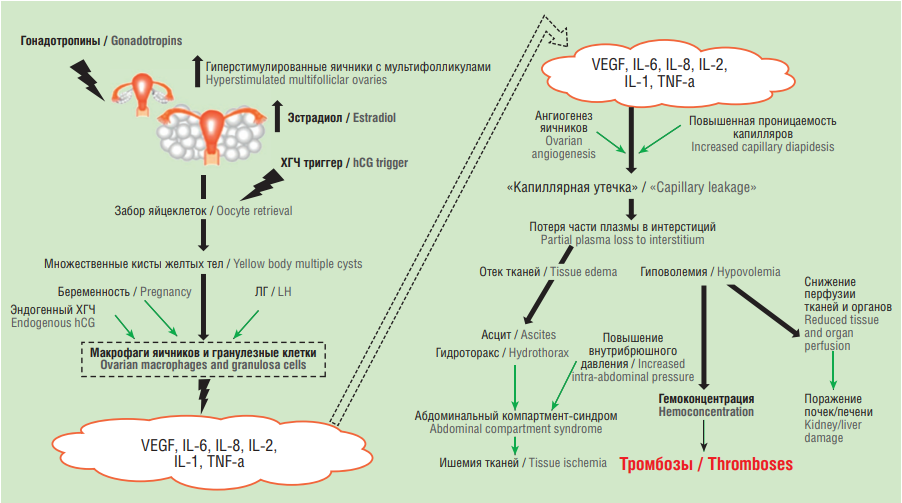
Рисунок 2. Патофизиология синдрома гиперстимуляции яичников [рисунок авторов].
Примечание: ХГЧ – хорионический гонадотропин человека; VEGF – фактор роста эндотелия сосудов; IL – интерлейкин; TNF-α – фактор некроза опухоли-альфа; ЛГ – лютеинизирующий гормон.
Figure 2. Pathophysiology of ovarian hyperstimulation syndrome [drawn by authors].
Note: hCG – human chorionic gonadotropin; VEGF – vascular endothelial growth factor; IL – interleukin; TNF-α – tumor necrosis factor-alpha; LH – luteinizing hormone.
|
Масса тела, кг Body weight, kg |
Надропарин, доза, МЕ Nadroparin, dose, IU |
Эноксапарин, доза, МЕ Enoxaparin, dose, IU |
Далтепарин, доза, МЕ Dalteparin, dose, IU |
Тинзапарин*, доза, МЕ Tinzaparin*, dose, IU |
|
Дозы НМГ, подобранные по массе тела (промежуточные) / Weight-adjusted (intermediate) LMWHs doses |
||||
|
< 50 |
3800 |
6000 |
7500 |
4500 |
|
от 50 до < 70 / 50 to < 70 |
5700 |
8600 |
1000 |
7000 |
|
от 70 до < 100 / 70 to < 100 |
7600 |
10000 |
12500 |
10000 |
|
≥ 100 |
9500 |
12000 |
15000 |
12000 |
|
Фиксированные (низкие) дозы НМГ / Fixed (low) LMWHs doses |
||||
|
< 100 |
2850 |
4000 |
5000 |
3500 |
|
> 100 |
3800 |
6000 |
7500 |
4500 |
Рисунок 3. Дизайн и использованные дозы низкомолекулярных гепаринов (НМГ) в исследовании Highlow (адаптировано из [20]).
Примечание: Р – рандомизация; МЕ – международные единицы; *препарат не зарегистрирован на территории Российской Федерации.
Figure 3. Design and doses of low molecular weight heparins (LMWHs) used in the Highlow study (adapted from [20]).
Note: R – randomization; IU – international units; *the drug is not registered in the Russian Federation.
Таблица 2. Использованные низкомолекулярные гепарины (НМГ) в исследовании Highlow для профилактики повторных венозных тромбоэмболических осложнений во время беременности и послеродовом периоде (адаптировано из [20]).
Table 2. Low molecular weight heparins (LMWHs) used in the Highlow study for prevention of recurrent venous thromboembolic events during pregnancy and postpartum (adapted from [20]).
|
НМГ LMWHs |
Фиксированные (низкие) дозы НМГ Fixed (low) LMWHs doses n = 555 n (%) |
Подобранные по массе тела (промежуточные) дозы НМГ Weight-adjusted (intermediate) LMWHs doses n = 555 n (%) |
|
Эноксапарин натрия Enoxaparin sodium |
198 (35,7) |
215 (38,7) |
|
Надропарин кальция Nadroparin calcium |
205 (36,9) |
203 (36,6) |
|
Далтепарин натрия Dalteparin sodium |
69 (12,4) |
76 (13,7) |
|
Тинзапарин натрия* Tinzaparin sodium* |
82 (15,0) |
59 (10,5) |
Примечание: *препарат не зарегистрирован на территории Российской Федерации.
Note: *the drug is not registered in the Russian Federation.
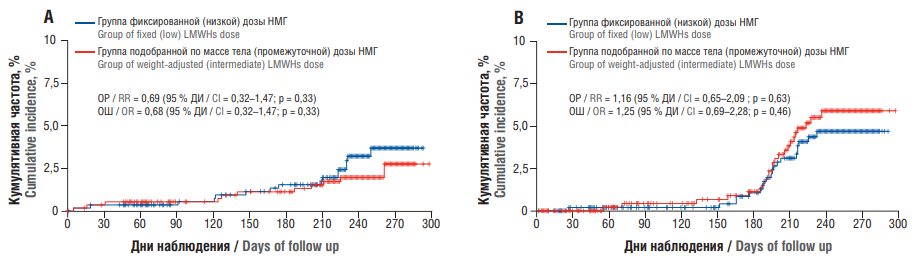
Рисунок 4. Частота развития венозных тромбоэмболических осложнений (А) и больших кровотечений (В) [20].
Примечание: НМГ – низкомолекулярные гепарины; ОР – отношение рисков; ОШ – отношение шансов; ДИ – доверительный интервал.
Figure 4. The incidence of venous thromboembolic events (A) and major bleedings (B) [20].
Note: LMWHs – low molecular weight heparins; RR – risk ratio; OR – odds ratio; CI – confidence interval.
Таблица 3. Рекомендуемые профилактические и терапевтические режимы дозирования низкомолекулярных гепаринов (НМГ) у беременных [21].
Table 3. Recommended prophylactic and therapeutic dosing regimens for low molecular weight heparins (LMWHs) in pregnant women [21].
|
Дозы Doses |
Далтепарин натрия Dalteparin sodium |
Надропарин кальция Nadroparin calcium |
Парнапарин натрия Parnaparin sodium |
Бемипарин натрия Bemiparin sodium |
Эноксапарин натрия Enoxaparin sodium |
|
Профилактические Preventive |
5000 ЕД ежедневно 5000 IU daily |
0,3 мл ежедневно 0.3 ml daily |
0,3 мл (3200 МЕ) ежедневно 0.3 ml (3200 IU) daily |
2500 МЕ или 3500 МЕ подкожно (в зависимости от массы тела) 2500 IU or 3500 IU subcutaneously (body weight-related) |
40 мг ежедневно 40 mg daily |
|
Высокая профилактическая (промежуточная), возможно использование при ИМТ ≥ 40 High prophylactic (intermediate), may be used for BMI ≥ 40 |
5000 ЕД каждые 12 ч или 10000 единиц 1 раз в день 5000 IU every 12 hours or 10000 units once a day |
0,3 мл каждые 12 ч или 0,6 мл 1 раз в день 0.3 ml every 12 hours оr 0.6 ml once a day |
0,3 мл каждые 12 ч (4250 МЕ) ежедневно 0.3 ml every 12 hours (4250 IU) daily |
– |
40 мг каждые 12 ч или 80 мг 1 раз в день 40 mg every 12 hours or 80 mg once a day |
|
Терапевтическая Therapeutic |
100 ЕД/кг каждые 12 ч или 200 ЕД/кг ежедневно после родов 100 U/kg every 12 hours or 200 U/kg daily postpartum |
86 ЕД/кг каждые 12 ч или 171 ЕД/кг 1 раз в сутки 86 U/kg every 12 hours or 171 U/kg once a day |
96 ЕД/кг каждые 12 ч или 192 ЕД/кг 1 раз в сутки 96 U/kg every 12 hours or 192 U/kg once a day |
– |
1 мг/кг каждые 12 ч или 1,5 мг/кг ежедневно после родов 1 mg/kg every 12 hours or 1.5 mg/kg daily postpartum |
Примечание: ИМТ – индекс массы тела.
Note: BMI – body mass index.
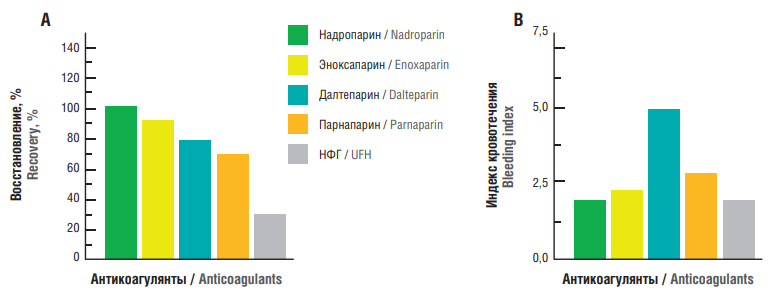
Рисунок 5. Биодоступность низкомолекулярных гепаринов (НМГ) и нефракционированного гепарина (НФГ) по анти-Ха активности (А) и индексу кровотечения (В) (адаптировано из [28]).
Figure 5. Bioavailability of low molecular weight heparins (LMWHs) and unfractionated heparin (UFH) assessed by anti-Xа activity (А) and bleeding index (В) (adapted from [28]).
Заключение / Conclusion
В ходе встречи эксперты совместно с аудиторией обсудили целый ряд наиболее актуальных вопросов тромбопрофилактики у беременных и рожениц, которые сегодня стоят перед профессиональным сообществом:
- в зоне чьей ответственности находится проведение профилактики ВТЭО у беременной и родильницы;
- какова обоснованность использования некоторых лекарственных препаратов, не имеющих антикоагулянтного действия, для профилактики ВТЭО во время беременности;
- есть ли особенности профилактики ВТЭО в прог- раммах ВРТ и нужно ли проводить профилактику при неудачной ВРТ;
- какие дозы НМГ использовать при рутинной профилактике ВТЭО у беременных и родильниц;
- как определиться в разнообразии НМГ, и можно ли считать, что все НМГ одинаковые?
Важно, что все участники дискуссии единогласно подтвердили важность проблемы профилактики ВТЭО в антенатальном и послеродовом периодах и определили очевидность дальнейших шагов по пути улучшения ситуации с тромбопрофилактикой. Несмотря на все сложности, сохраняется возможность использования российскими пациентками оригинальных и проверенных практикой НМГ, сочетающих в себе, с одной стороны, высокие стандарты качества производства, а с другой стороны, убедительность полученных научных данных, а также возможность безопасного использования удобных в применении лекарственных препаратов, таких как фраксипарин (надропарин кальция).
Список литературы
1. Surveillance of maternal deaths in the UK 2011-13 and lessons learned to inform maternity care from the UK and Ireland Confidential Enquiries into Maternal Deaths and Morbidity 2009-13. MBRRACE-UK, 2015. 116 р. Available at: https://maternalmentalhealthalliance.org/wp-content/uploads/MBRRACE-UK-Maternal-Report-2015-3.pdf.
2. Здравоохранение в России. Статистический сборник. М.: Федеральная служба государственной статистики (Росстат), 2019. 171 с. Режим доступа: https://rosstat.gov.ru/storage/mediabank/Zdravoohran-2019.pdf.
3. Gris J.-C., Aoun J., Rzaguliyeva L. et al. Risk assessment and management of venous thromboembolism in women during pregnancy and puerperium (SAVE): an international, cross-sectional study. TH Open. 2018;2(2):e116–e130. https://doi.org/10.1055/s-0038-1635573.
4. Anderson F.A., Spencer F.A. Risk factors for venous thromboembolism. Circulation. 2003;107(23 Suppl 1):9–16. https://doi.org/10.1161/01.CIR.0000078469.07362.E6.
5. Royal College of Obstetricians and Gynaecologists. Reducing the Risk of Venous Thromboembolism during Pregnancy and the Puerperium. Green-top Guideline No. 37a. London: RCOG, 2015. Available at: https://www.rcog.org.uk/globalassets/documents/guidelines.
6. Клинические рекомендации – Венозные осложнения во время беременности и послеродовом периоде. Акушерская тромбоэмболия – 2022-2023-2024 (14.02.2022). М.: Министерство здравоохранения Российской Федерации, 2022. 66 с. Режим доступа: http://disuria.ru/_ld/11/1153_kr22O22MZ.pdf.
7. Федеральный закон РФ от 29.11.2010 N 326-ФЗ – Об обязательном медицинском страховании в РФ – Действующая последняя редакция от 24.02.2021 – Редакция N 35 – В действии с 24.02.2021. 87 c. Режим доступа: http://disuria.ru/_ld/0/62_326FZ29112010.pdf.
8. Greer I.A., Nelson-Piercy С. Low molecular weight heparins for thromboprophylaxis and treatment of venous thromboembolism in pregnancy: a systematic review of safety and efficacy. Blood. 2005;106(2):401–7. https://doi.org/10.1182/blood-2005-02-0626.
9. Simeone R., Giacomello R., Bruno G. et al. Thrombogenesis in thrombophilic pregnancy: evaluation of low-molecular-weight heparin prophylaxis. Acta Haematol. 2017;137(4):201–6. https://doi.org/10.1159/000467385.
10. ACOG Practice Bulletin No. 197: Inherited Thrombophilias in Pregnancy. Obstet Gynecol. 2018;132(1):e18–e34. https://doi.org/10.1097/AOG.0000000000002703.
11. Bates S.M., Middeldorp S., Rodger M. et al. Guidance for the treatment and prevention of obstetric-associated venous thromboembolism. J Thromb Thrombolysis. 2016;41(1):92–128. https://doi.org/10.1007/s11239-015-1309-0.
12. Henriksson P., Westerlund E., Wallén H. et al. Incidence of pulmonary and venous thromboembolism in pregnancies after in vitro fertilisation: cross sectional study. BMJ. 2013;346:e8632. https://doi.org/10.1136/bmj.e8632.
13. Hansen A.T., Kesmodel U.S., Juul S., Hvas A.M. Increased venous thrombosis incidence in pregnancies after in vitro fertilization. Hum Reprod. 2014;29(3):611–7. https://doi.org/10.1093/humrep/det458.
14. Olausson N., Discacciati A., Nyman A.I. et al. Incidence of pulmonary and venous thromboembolism in pregnancies after in vitro fertilization with fresh respectively frozen-thawed embryo transfer: Nationwide cohort study. J Thromb Haemost. 2020;18(8):1965–73. https://doi.org/10.1111/jth.14840.
15. Arya R., Shehata H.A., Patel R.K. et al. Internal jugular vein thrombosis after assisted conception therapy. Br J Haematol. 2001;115(1):153–5. https://doi.org/10.1046/j.1365-2141.2001.03081.x.
16. Rova K., Henrik Passmark H., Lindqvist P.G. Venous thromboembolism in relation to in vitro fertilization: an approach to determining the incidence and increase in risk in successful cycles. Fertil Steril. 2012;97(1):95–100. https://doi.org/10.1016/j.fertnstert.2011.10.038.
17. Grandone E., Di Micco P.P., Villani M. et al.; RIETE Investigators. Venous thromboembolism in women undergoing assisted reproductive technologies: data from the RIETE Registry. Thromb Haemost. 2018;118(11):1962–8. https://doi.org/10.1055/s-0038-1673402.
18. van Lennep J.E.R., Meijer E., Klumper F.J.C.M et al. Low-molecularweight-heparin and pregnancy, when the dose does it: a nephrologist’s opinion: reply to a rebuttal. J Thromb Haemost. 2011;9(10):2129–30. https://doi.org/10.1111/j.1538-7836.2011.04441.x.
19. Bleker S.M., Buchmüller A., Chauleur C. et al. Low-molecular-weight heparin to prevent recurrent venous thromboembolism in pregnancy: Rationale and design of the Highlow study, a randomised trial of two doses. Thromb Res. 2016;144:62–6. https://doi.org/10.1016/j.thromres.2016.06.001.
20. Bistervels I.M., Buchmüller A., Wiegers H.M.G. et al. Intermediate-dose versus low-dose low-molecular-weight heparin in pregnant and postpartum women with a history of venous thromboembolism (Highlow study): an open-label, multicentre, randomised, controlled trial. Lancet. 2022;400(10365):1777–87. https://doi.org/10.1016/S0140-6736(22)02128-6.
21. Шмаков Р.Г., Вавилова Т.В, Николаева М.Г. и др. Краткие алгоритмы диагностики, профилактики и лечения венозных тромбоэмболических осложнений во время беременности. Акушерство и гинекология. 2022;12 (приложение):4–12.
22. van der Wall S.J., Klok F.A., den Exter P.L. et al. Higher adherence to treatment with low-molecular-weight-heparin Nadroparin than Enoxaparin because of side effects in cancer-associated venous thromboembolism. Hemasphere. 2018;2(1):e19. https://doi.org/10.1097/HS9.0000000000000019.
23. Mismetti P., Laporte S., Darmon J.Y. et al. Meta-analysis of low molecular weight heparin in the prevention of venous thromboembolism in general surgery. Br J Surg. 2001;88(7):913–30. https://doi.org/10.1046/j.0007-1323.2001.01800.x
24. Snijder C.A., Cornette J.M.W., Hop W.C.J. et al. Thrombophylaxis and bleeding complications after cesarean section. Acta Obstet Gynecol Scand. 2012;91(5):560–56. https://doi.org/10.1111/j.1600-0412.2012.01351.x.
25. Бицадзе В.О., Слуханчук Е.В., Хизроева Д.Х. и др. Антикоагулянтные, противовоспалительные, противовирусные и противоопухолевые свойства гепаринов. Акушерство, Гинекология и Репродукция. 2021;15(3):295–312. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2021.216.
26. Antman E.M., Hand M., Armstrong P.W. et al. 2007 focused update of the ACC/AHA 2004 guidelines for the management of patients with ST-elevation myocardial infarction: A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation. 2008;117:296–329. https://doi.org/10.1161/CIRCULATIONAHA.107.188209.
27. Hirsh J., Bauer K.A., Donati M.B. et al. Parenteral anticoagulants: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest. 2008;133(6 Suppl):141S–159S. https://doi.org/10.1378/chest.08-0689.
28. Fareed J., Walenga J.M., Hoppensteadt D. et al. Biochemical and pharmacologic inequivalence of low molecular weight heparins. Ann N Y Acad Sci. 1989;556:333–53. https://doi.org/10.1111/j.1749-6632.1989.tb22515.x.
29. Ofosu F.A. Differences in the safety profiles of two low-molecular-weight heparins. Thromb Haemost. 2008;99(6):989–90. https://doi.org/10.1160/TH08-05-0274.
30. Nenci G.G. Low molecular weight heparins: are they interchangeable? No.J Thromb Haemost. 2003;1:12–3.
31. van der Heijden J.F., Prins M.H., Büller H.R. Low molecular weight heparins: are they interchangeable? Haemostasis. 2000;30 Suppl 2:148– 57. https://doi.org/10.1159/000054183.
32. Kistler U., Kramers-de Quervain I., Munzinger U., Kucher N. Bleeding complications after systemic switch of routine prophylaxis for major orthopedic surgery. Thromb Haemost. 2008;99(6):1049–52. https://doi.org/10.1160/TH08-01-0019.
33. Maddineni J., Walenga J.M., Jeske W.P. et al. Product individuality of commercially available low-molecular-weight heparins and their generic versions: therapeutic implications. Clin Appl Thromb Hemost. 2006;12(3):267–76. https://doi.org/10.1177/1076029606291434.
34. U.S. Identifies Tainted Heparin in 11 Countries. The New York Times. April 22, 2008. Available at: https://www.nytimes.com/2008/04/22/health/policy/22fda.html.
35. Stevenson J.G. Clinical Data and Regulatory Issues of Biosimilar Products. Am J Manag Care. 2016;21(16 Suppl):s320–s330.
36. Gray E., Rigsby P., Behr-Gross M.-E. Collaborative study to establish the low-molecular-mass heparin for assay – European Pharmacopoeia Biological Reference Preparation. Pharmeuropa Bio. 2004;2004(1):59–76.
37. Harenberg J., Kakkar A., Bergqvist D. et al.; Subcommittee on Control of Anticoagulation of the SSC of the ISTH. Recommendations on biosimilar low-molecular-weight heparins. J Thromb Haemost. 2009;7(7):1222–5. https://doi.org/10.1111/j.1538-7836.2009.03349.x.
Об авторах
В. О. БицадзеРоссия
Бицадзе Виктория Омаровна – д.м.н., профессор РАН, профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 6506003478.
Researcher ID: F-8409-2017.
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
М. С. Зайнулина
Россия
Зайнулина Марина Сабировна – д.м.н., главный врач СПб ГБУЗ «Родильный дом № 6 имени профессора В.Ф. Снегирева»; профессор кафедры акушерства, гинекологии и репродуктологии ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова»
Scopus Author ID: 37076359000.
Researcher ID: B-5746-2018
192014 Санкт-Петербург, ул. Маяковского, д. 5;
197022 Санкт-Петербург, ул. Льва Толстого, д. 6/8
Д. Х. Хизроева
Россия
Хизроева Джамиля Хизриевна – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 57194547147.
Researcher ID: F-8384-2017
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
М. Г. Николаева
Россия
Николаева Мария Геннадьевна – д.м.н., профессор кафедры акушерства и гинекологии с курсом дополнительного профессионального образования ФГБОУ ВО «Алтайский государственный медицинский университет» ; старший научный сотрудник, Алтайский филиал ФГБУ «Национальный медицинский исследовательский центр гематологии»
Scopus Author ID: 57191960907.
Researcher ID: AAI-6271-2020.
656038 Барнаул, пр. Ленина, д. 40;
656045 Барнаул, ул. Ляпидевского, д. 1
А. Д. Макацария
Россия
Макацария Александр Давидович – д.м.н., профессор, академик РАН, зав. кафедрой акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова Сеченовского Университета; вице-президент Российского общества акушеров-гинекологов (РОАГ); Заслуженный врач Российской Федерации; Почетный профессор Венского Университета
Scopus Author ID: 57222220144.
Researcher ID: M-5660-2016
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Рецензия
Для цитирования:
Бицадзе В.О., Зайнулина М.С., Хизроева Д.Х., Николаева М.Г., Макацария А.Д. Что изменилось за год в профилактике венозных тромбоэмболических осложнений у беременных и родильниц? Акушерство, Гинекология и Репродукция. 2023;17(4):533-545. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.439
For citation:
Bitsadze V.O., Zainulina M.S., Khizroeva J.Kh., Nikolaeva M.G., Makatsariya A.D. What has changed over the year in the prevention of venous thromboembolic events in pregnant women and puerperas? Obstetrics, Gynecology and Reproduction. 2023;17(4):533-545. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.439

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































