Перейти к:
Магнитно-резонансная томография при раке шейки матки: современные возможности радиомного анализа и перспективы развития методики
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.440
Аннотация
Введение. В связи с развитием современных визуализационных технологий в последние годы большое внимание уделяется радиомике и, в частности, текстурному анализу. Сложности клинической оценки распространенности опухолевого процесса при раке шейки матки (РШМ) приводят к необходимости расширения знаний о применении технологий медицинской визуализации от преимущественно качественного анализа к мультипараметрическому подходу, включая количественную оценку исследуемых параметров.
Цель: проанализировать литературные данные по использованию радиомики и анализу текстур изображений при диагностике и прогнозировании агрессивности онкогинекологических заболеваний, в том числе РШМ.
Материалы и методы. В работе проведен систематический поиск литературы по базам данных PubМed/MEDLINE, eLibrary, Scopus, в ресурсах NCCN, ESUR, ACR; интервал поиска – 2016–2023 гг. Были изучены все опубликованные работы по использованию радиомики и анализу текстур изображений при диагностике и прогнозировании РШМ. Поиск проводили по ключевым словам и словосочетаниям на русском и английском языках: «рак шейки матки», «радиомика», «текстурный анализ», «онкология», «cervical cancer», «radiomics», «texture analysis», «oncology». В исследование были включены полнотекстовые источники и литературные обзоры по изучаемой тематике. Дублирующиеся публикации исключались.
Результаты. Обобщены особенности и преимущества применения радиомики и анализа текстур изображений в диагностике РШМ. Внедрение радиомного подхода расширило взгляды на интерпретацию медицинских изображений. Параметры, извлекаемые из цифровых изображений на основе радиомики, в ряде исследований показали свою высокую информативность, что вносит вклад в повышение диагностической точности исследования, а также расширяет возможности прогнозирования эффективности лечения пациенток с РШМ.
Заключение. Применение радиомики в диагностике в онкогинекологии, в том числе РШМ, является одним из перспективных, активно развивающихся направлений анализа в лучевой диагностике, требующее дальнейшего изучения.
Для цитирования:
Солопова А.Е., Носова Ю.В., Бендженова Б.Б. Магнитно-резонансная томография при раке шейки матки: современные возможности радиомного анализа и перспективы развития методики. Акушерство, Гинекология и Репродукция. 2023;17(4):500-511. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.440
For citation:
Solopova A.E., Nosova J.V., Bendzhenova B.B. Magnetic resonance imaging in cervical cancer: current opportunities of radiomics analysis and prospects for its further developmen. Obstetrics, Gynecology and Reproduction. 2023;17(4):500-511. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.440
Введение / Introduction
Согласно статистическим данным 2021 г. злокачественных новообразований, рак шейки матки (РШМ) занимает в России 5-е место (4,9 % от общего количества злокачественных образований) в структуре онкологической заболеваемости у женщин и 10-е место в структуре смертности. По оценке GLOBOCAN (англ. Global Cancer Observatory, Мировая статистика заболеваемости раком), на 2020 г. в мире зарегистрировано 604 тыс. новых случаев РШМ, из них 342 тыс. смертей [1]. Неуклонный рост заболеваемости РШМ и большой процент впервые выявленных опухолей на поздних стадиях объясняет необходимость разработки новых алгоритмов обследования и ведения пациенток.
Для стадирования РШМ во всем мире используется классификация Международной федерации гинекологии и акушерства (англ. International Federation of Gynecology and Obstetrics, FIGO, 2018) и Международной классификации стадий злокачественных ново- образований (англ. Tumor, Nodus, Metastasis, TNM; 8-е издание, 2016).
Определение стадии при РШМ преимущественно основывается на клинических данных, при этом не всегда клинически возможно надежно оценить распространенность опухолевого процесса в полном объеме. Трудности, с которыми сталкивается клиницист, в первую очередь связаны с оценкой истинных размеров опухоли, в особенности ее эндофитной части, наличия и объема параметральной инвазии, вовлеченности в опухолевый процесс истинной стенки таза, а также с выявлением пораженных регионарных лимфатических узлов (как макро-, так и микрометастазов) [2][3].
В последние десятилетия применение технологий медицинской визуализации значительно расширилось, клиницисты и врачи функциональной диагностики шагнули далеко вперед от преимущественно качественного анализа к количественному подходу, раскрывающему огромное количество информации.
Пересмотренная классификация FIGO (2018) рекомендует использовать современные методы визуализации и данные патологоанатомического исследования, где они доступны, для стадирования злокачественного процесса на первом этапе. Классификация FIGO допускает любой из методов в зависимости от их доступности в лечебном учреждении – ультразвуковое исследование (УЗИ), компьютерную томографию (КТ), магнитно-резонансную томографию (МРТ), позитронно-эмиссионную томографию (ПЭТ) для получения информации о размере опухоли, статусе лимфатических узлов и локальном или системном распространении [4]. При этом МРТ является методом выбора для оценки поражения шейки матки размером более 5 мм и рекомендуется для начальной оценки в случаях, если размер опухоли превышает 2 см [5]. Высокое тканевое разрешение МРТ определяет информативность при оценке опухолевого распространения в области малого таза. Специализированные импульсные последовательности МРТ – Т2-взвешенное изображение (англ. T2-weighted image, T2-WI), диффузионно-взвешенное изображение (англ. diffusion-weighted imaging, DWI), динамическое усиление контраста (англ. dynamic contrast-enhanced, DCE) рассматриваются как наиболее перспективные в качестве основы прогнозирования и оценки ответа на лечение [6–8].
Радиомика на сегодняшний день является быстро расширяющейся областью клинических исследований, которая дает возможность количественной оценки внутриопухолевой гетерогенности [9]. Гетерогенность опухоли показала значительную корреляционную взаимосвязь с особенностями ее радиомной структуры у онкологических пациентов [10–12]. При этом с учетом бурного развития методики требуется анализ и обобщение актуальных на сегодняшний день мировых данных.
Цель: проанализировать литературные данные по использованию радиомики и анализу текстур изображений при диагностике и прогнозировании агрессивности онкогинекологических заболеваний, в том числе РШМ.
Материалы и методы / Materials and Methods
Проведен систематический поиск литературы по базам данных PubМed/MEDLINE с использованием строки поиска «Radiomics» [All Fields], «digital image texture analysis» [All Fields] и «Cervical cancer» [All Fields], в eLibrary – «радиомика» и «анализ текстур цифровых изображений», Scopus (подборки научных монографий и статей), в ресурсах Национальной комплексной сети по борьбе с раком (англ. National Comprehensive Cancer Network, NCCN), Европейского общества урогенитальной радиологии (англ. European Society of Urogenital Radiology, ESUR), Американского колледжа радиологии (англ. American College of Radiology, ACR); интервал поиска – 2016–2023 гг.
Были изучены все опубликованные работы по использованию радиомики и анализу текстур изображений при диагностике и прогнозировании онкологических заболеваний. В исследование были включены полнотекстовые источники и литературные обзоры по изучаемой тематике. Дублирующиеся публикации исключались.
Результаты и обсуждение / Results and Discussion
Современные подходы в диагностике рака шейки матки / Current approaches to cervical cancer diagnostics
Рак шейки матки остается важной проблемой всемирного общественного здравоохранения, несмотря на очевидные достижения последних лет в области профилактики, скрининга и ранней диагностики.
Пересмотренная система стадирования FIGO (2018) включила в стадию IB3 дополнительные группы в зависимости от размера первичной опухоли: IB1 (≤ 2 см), IB2 (> 2 см и ≤ 4 см) и IB3 (> 4 см). Стадия IB1 дает возможность проведения органосохраняющего лечения, стадии IB2 и IB3 подлежат неоадъювантной химиотерапии (НАХТ) и радикальному хирургическому лечению. Дистанционная лучевая терапия в сочетании с химиотерапией на основе платины (ХЛТ) с последующей брахитерапией в настоящее время является основным методом лечения местнораспространенных стадий РШМ (IIB–IVA) [13]. Хотя показатели выживаемости с местнораспространенным РШМ улучшаются, у каждой третьей пациентки развиваются локальные и внутритазовые рецидивы, что подтверждает гипотезу о наличии остаточного заболевания после окончания ХЛТ [14].
Несмотря на положительные стороны, связанные с этим терапевтическим подходом, отдаленные результаты лечения (общая выживаемость) по-прежнему составляют лишь 57–67 %, что требует поиска более эффективных стратегий диагностики и лечения [15–17]. В то же время при IB2–IIA стадиях радикальное хирургическое вмешательство является альтернативным вариантом лечения; также опубликован ряд работ по применению НАХТ при IIB стадии с последующим радикальным хирургическим лечением. НАХТ в последние годы широко применяется у больных РШМ как с целью уменьшения размеров первичной опухоли, так и для улучшения результатов лучевого и хирургического лечения.
Согласно данным метаанализа, НАХТ с последующим хирургическим вмешательством улучшает результаты выживаемости по сравнению с лучевой терапией [18].
Существенным преимуществом применения НАХТ также является снижение рисков развития ранних и поздних послеоперационных осложнений. Одним из главных маркеров прогноза и эффективности проводимой неоадъювантной терапии является регресс опухоли как по данным лучевых методов исследования, так и на основании микроскопического анализа лечебного патоморфоза. Однако ключевую роль в этом по-прежнему играет клиническая оценка эффекта для определения групп пациентов, которые нуждаются в хирургическом лечении или проведении лучевой терапии. В качестве основных ошибок при выборе терапии выступают местные рецидивы и отдаленные метастазы, что говорит о наличии микроскопически остаточного заболевания и представляет собой основной фактор риска прогрессирования процесса. В клинической практике стандартом ранней диа- гностики РШМ на сегодняшний день является кольпоскопия, цитологическое исследование цервикальных мазков, гистологическое исследование биоптата шейки матки и цервикального канала. Однако наиболее прогностически значимые признаки опухоли, такие как статус лимфатических узлов, параметральная и лимфоваскулярная инвазия, часто недооцениваются из-за очевидных ограничений этого метода [4]. В таком случае единственным способом оценить лимфоваскулярную инвазию или обнаружить микроэмболы опухоли в структуре зачастую визуально интактного лимфоузла является выполнение расширенного оперативного вмешательства с последующей морфологической оценкой удаленных препаратов [8]. В связи с этим для выбора оптимального и безопасного метода лечения клиницисту критически важно получить сведения о размере, распространенности первичной опухоли и вовлеченности в процесс лимфатических узлов на предоперационном этапе. МРТ в настоящее время считается «золотым» стандартом визуализационной диагностики для локальной оценки стадии РШМ и прогноза перед началом лечения [4][5]. Классификация FIGO (2018), а также рекомендации ESUR (2020) подчеркивают значимость инструментальной предоперационной оценки шейки матки и рекомендуют использовать результаты визуализационных исследований (МРТ, КТ, ПЭТ-КТ) как обязательную часть стадирования. Пересмотренная система стадирования признает важность оценки размера опухоли как основного фактора риска метастазирования, а также исследования состояния регионарных лимфатических узлов и вовлеченность параметральной клетчатки в опухолевый процесс [19].
Кроме того, МРТ широко применяется для оценки терапевтического эффекта после проведенной неоадъювантной терапии, предоставляя данные о клиническом ответе опухоли на лечение, а также об основных прогностических факторах, тем самым распределяя пациентов на группы, которым в зависимости от полученных результатов будет показано хирургическое лечение или лучевая терапия.
Мультипараметрическая магнитно-резонансная томография / Multiparametric magnetic resonance imaging
Магнитно-резонансная томография обладает многими преимуществами в связи с высокой пространственной и тканевой визуализацией по сравнению с такими диагностическими методами, как УЗИ и КТ, и предоставляет возможность с высокой точностью определять изменения в структуре опухоли. Корреляция между визуализационными и патоморфологическими критериями поспособствовала изменению рекомендаций ESUR [20]. Сочетание Т2-WI и DWI является мощным клиническим инструментом МР-исследования при РШМ, при этом DCE-МРТ является предпочтительным, но необязательным дополнением при первичном стадировании заболевания [21].
Пораженная ткань характеризуется промежуточной интенсивностью сигнала на Т2-WI, повышенной на DWI с высоким b-фактором и сниженной на параметрических картах измеряемого коэффициента диффузии (ИКД) [22]. Т2-WI характеризуются высоким естественным мягкотканным контрастом и позволяют с высокой точностью визуализировать контуры и внутреннюю структуру опухоли, реактивные изменения и степень инфильтрации стромы шейки матки, так как ткань новообразования обладает более высокой интенсивностью сигнала относительно гипоинтенсивной неизмененной стромы. Кроме того, нативные Т2-WI позволяют оценить распространение опухоли за пределы шейки матки – инфильтрацию параметриальной клетчатки, а также контактную инфильтрацию соседних органов, включая прямую кишку и мочевой пузырь [23].
DWI-МРТ позволяет отобразить процесс диффузии молекул воды в биологических тканях [24][25]. Для оценки истинного ограничения диффузии используются несколько b-факторов: базовый низкий – 0 с/мм2, а также 500/800/1000 с/мм2. Далее строятся параметрические карты измеряемого коэффициента диффузии (ИКД-карты), которые представляют собой цветовое отражение различных значений ИКД [26].
DWI-МРТ с построением ИКД-карт обладает высокой чувствительностью (91–97 %) и специфичностью (91–100 %) в характеристике наличия и оценки местного распространения РШМ, поскольку среднее значение ИКД в опухолевой ткани значительно ниже показателей в нормальной ткани шейки матки [3]. ИКД может быть использован как дополнительный критерий в определении степени агрессии опухоли шейки матки, а также прогнозировать эффективность лечения РШМ [27].
По данным исследований, МРТ обладает высокой диагностической точностью в оценке местного распространения опухоли (специфичность = 88–91 %) в диагностике распространения РШМ в стенку мочевого пузыря/прямой кишки [28][29].
На DWI с высоким b-фактором лимфатические узлы в норме обладают высокой интенсивностью сигнала, что связано с характеристиками лимфоидной ткани. Отсутствие различий в значениях ИКД интактных и метастатических лимфоузлов ограничивают возможности метода [30]. Специфичность и чувствительность для увеличенных лимфоузлов с нарушенной структурой выше, чем при вторичном поражении лимфоузла без увеличения размера. Таким образом, опубликованные за последние годы работы отечественных и зарубежных коллег демонстрируют неоднозначные результаты диагностической эффективности МРТ с применением стандартных последовательностей по сравнению с патоморфологическим исследованием.
По данным метаанализа, опубликованного в 2019 г., чувствительность метода при оценке параметральной инвазии варьировала от 43,2 до 81,1 %, что может привести к некорректному определению исходной стадии заболевания, ошибкам в интерпретации клинического ответа опухоли на лечение и, как следствие, к неверному определению дальнейшей тактики ведения пациентов и значительно снижает показатели общей и безрецидивной выживаемости. Одним из решений сложившейся проблемы может стать использование текстурного анализа [31].
Текстурный анализ / Texture analysis
Радиомика, реализуя принципы прецизионной медицины через лучевую диагностику, является одной из наиболее перспективных областей в онкологии, с развитием которой кардинально меняются взгляды на интерпретацию медицинских изображений. Источником радиомных маркеров становятся также клинические, патоморфологические, генетические исследования.
Радиомный анализ является развивающимся направлением лучевой диагностики и представляет компьютерное извлечение большого числа количественных характеристик из медицинских изображений. Анализируя данные с учетом конкретного клинического запроса, данный инструмент в перспективе способен стать эффективным помощником в принятии клинических решений [32].
Текстурный анализ изображений позволяет дать объективную характеристику гетерогенности опухоли, характеризуя распределение и взаимосвязь уровней вокселей в изображении [33][34].
В современных работах авторы сообщают об успешном использовании текстурного анализа в дифференциальной диагностике новообразований, получении дополнительной информации об агрессивности опухоли и прогнозировании ответа на НАХТ до ее начала. Предполагается, что радиомика на основе МРТ может повысить точность оценки терапевтического ответа на НАХТ у пациентов с местнораспространенным РШМ [35–40].
Радиомикологическое моделирование состоит из нескольких этапов: сбор и предварительная обработка данных, выделение контуров опухоли (сегментация изображений), извлечение количественных данных, моделирование, статистическая обработка полученных данных и их валидация [41][42].
Сегментация является ключевым начальным этапом рабочего процесса, определяя зону интереса, которая будет использована для радиомного анализа; и если ранее этот процесс требовал ручной обработки – специалист лучевой диагностики самостоятельно определял и выделял эту область для последующего анализа, то на сегодняшний день сообщается о достижении полной автоматизации. Автоматическая сегментация может решить основную проблему воспроизводимости исследования между наблюдателями при ручной сегментации, которая также требует существенной затраты временного ресурса [43].
Для выполнения текстурного анализа используются различные пакеты программного обеспечения, позволяющие проводить мультимодальный радиометрический анализ одновременно большого количества медицинских изображений [44][45].
Радиомика в диагностике в онкогинекологии / Radiomics in oncogynecologic diagnostics
На сегодняшний день радиомика наиболее перспективна в диагностике и прогнозировании лечения онкологических заболеваний и включает в себя преобразование цифровых медицинских изображений в извлекаемые количественные показатели на основе интенсивности сигнала, формы, объёма и текстурных особенностей различных локусов как внутри опухоли, так и в окружающих поражение тканях и лимфатических узлах, что позволяет оценить опухолевую гетерогенность [46].
Различия показателей в структуре опухоли на основе радиомики полученных изображений позволяют повысить диагностическую точность, прогнозировать эффективность лечения, а также появление отдаленных метастазов или локального рецидива заболевания [47].
Таким образом, применение текстурного анализа в онкогинекологии является одним из современных стратегических подходов в диагностике онкологических заболеваний.
Дооперационная стратификация рисков агрессии при карциноме эндометрия крайне важна для планирования лечения. Опубликован ряд работ, продемонстрировавших эффективность применения моделей на основе мультипараметрической МРТ с трехмерным радиомическим анализом изображений в выявлении фенотипов высокого риска: оценка глубины инвазии в миометрий, лимфоваскулярной инвазии, степени дифференцировки опухоли – высокодифференцированная/низкодифференцированная (англ. high/low grade), а также стадии опухолевого процесса [34][48][49].
Y. Ueno с соавт. в публикации 2017 г. сообщили, что при анализе 137 пациенток, перенесших операцию по поводу рака эндометрия, используя 11 признаков, полученных из последовательностей T2-WI, DWI, ИКД и постконтрастных МР-изображений, достигли диагностической точности 81 % в оценке глубины инвазии миометрия [34].
Модель A. Stanzione с соавт., из которой было извлечено 1132 признака, смогла определить глубину инвазии миометрия c точностью 86 % и 91 % и площадью под ROC-кривой 0,92 и 0,94 при тестовой и финальной проверке соответственно [48].
В исследовании M. Miccò с соавт. было извлечено 228 радиомических признаков, и в конечном итоге их количество было ограничено: 38 для оценки инвазии миометрия, 29 для лимфоваскулярной инвазии и 15 для предикции степени дифференцировки опухоли. Текстурный анализ всего объема опухоли продемонстрировал умеренно высокие показатели диагностической эффективности в определении глубины инвазии в миометрий с площадью под кривой рабочих характеристик (англ. area under curve, АUC) 0,85 и 0,68 в группах обучения и валидированной группе соответственно, 0,92 и 0,81 при прогнозировании лимфоваскулярной инвазии, а также 0,84 и 0,76 в стратификации опухолей низкого риска по сравнению с другими степенями дифференцировки (промежуточный/низкий/высокий) [49].
При прогнозировании рака эндометрия низкого риска диагностическая точность составила 0,86, при специфичности 0,93 и отрицательной прогностической значимости 0,89, что говорит о высокой диагностической ценности модели в стратификации предоперационного риска у больных раком эндометрия и позволит в перспективе избегать чрезмерного лечения при аденокарциномах эндометрия с низким потенциалом злокачественности (англ. high grade).
В контексте диагностики новообразований яичников текстурный анализ на основе МРТ позволяет с высокой точностью дифференцировать рак яичников от неэпителиальных злокачественных опухолей.
В ретроспективное когортное исследование М. Cheng с соавт. было включено в общей сложности 148 пациенток с 173 опухолями (81 случай опухоли стромы полового тяжа у 73 пациенток и в 92 случаях – эпителиальные злокачественные опухоли яичника у 75 пациенток), которые были случайным образом разделены на когорты предварительной разработки и финального тестирования в соотношении 8:2. Радиомические признаки были извлечены из каждой опухоли, проведена 5-кратная перекрестная проверка для выбора стабильных признаков в когорте предварительной разработки и построена радиомическая модель на основе этих выбранных признаков. Однофакторный и многофакторный анализы использовались для выявления независимых предикторов клинических признаков и стандартных параметров МРТ для дифференциации стромальных и эпителиальных опухолей. В завершение исследования была построена модель логистической регрессии с использованием 9 признаков, которые продемонстрировали превосходную прогностическую способность с AUC = 0,915 (95 % доверительный интервал (ДИ) = 0,869–0,962) и AUC = 0,867 (95 % ДИ = 0,732–1,000) в когортах предварительной разработки и финального тестирования соответственно. Смешанная модель, в которой сочетались радиомические сигнатуры, традиционные МР-параметры (ИКД) и индекс ROMA (англ. risk of оvarian malignancy algorithm), достигла наилучших диагностических результатов с AUC = 0,934 (95 % ДИ = 0,892–0,976) и AUC = 0,875 (95 % ДИ = 0,743–1,000) соответственно [50].
Применительно к образованиям шейки матки основные направления внедрения радиомного анализа направлены на повышение информативности МРТ в диагностике вторичного поражения лимфоузлов, прогнозирование эффективности противоопухолевого лечения. Так, в исследование М. Fang с соавт. было включено 120 пациенток с РШМ и разработана рентгеномная модель, основанная на признаках, которые показали хорошую эффективность в прогнозировании ответа на ХЛТ у пациентов с местнораспространенными стадиями РШМ. Исследование показало, что 4-я неделя после начала лечения является оптимальной для прогнозирования раннего рецидива РШМ при распространённых стадиях. Прогностическая модель в этом исследовании объединила данные T2-WI и DWI пациенток с распространенным РШМ. Комбинация текстурных параметров T2-WI – неравномерность длины выполнения (англ. Run Length Nonuniformity, RLN) и длительное выделение высокого уровня серого (англ. Long Run High Gray-Level Empha, LRHGE), рассчитанная на картах ИКД, продемонстрировала наибольшую эффективность (AUC = 0,885), чем каждый из этих показателей по отдельности (AUC = 0,787 и AUC = 0,775, соответственно) [51].
Поражение лимфатических узлов при РШМ является одним из наиболее важных прогностических признаков. Общая 5-летняя выживаемость пациенток при ранних стадиях РШМ без поражения лимфатических узлов составляет 90 %, тогда как у пациенток с пораженными узлами – 65 % [52].
Рекомендации FIGO базируются на проведении двусторонней тазовой лимфодиссекции (англ. pelvic lymph node dissection, PLND) у пациентов с ранними стадиями РШМ по FIGO (IA2, IB1, IIA) [56]. При этом распространенность поражения лимфатических узлов на ранних стадиях болезни оценивается примерно в 15–20 % [53]. Таким образом, значительная часть пациентов подвергается необоснованной процедуре PLND, сопровождающейся риском тяжелых осложнений и ухудшением качества жизни [54][55]. И хотя биопсия сигнальных лимфатических узлов (англ. sentinel lymph nodes, SLN) таза менее инвазивна по сравнению с PLND и является на сегодняший день альтернативным методом выявления метастазов в лимфоузлах таза, ее точность все еще зависит от множества факторов – особенностей самой методики, дорогостоящего оборудования, опыта патолога [56]. Кроме того, биопсия сторожевых узлов является инвазивным методом, требующим общего наркоза. Поэтому существует актуальная потребность в поиске неинвазивного и надежного метода для оценки метастатического статуса узлов у пациентов с ранними стадиями болезни.
В исследовании T. Wang с соавт. разрабатывалась одна из первых неинвазивных моделей радиомики на основе мультипараметрического анализа (T2-WI и DWI) для предварительного прогнозирования статуса тазовых лимфоузлов у пациентов с ранними стадиями РШМ перед операцией. Авторами проведен многофакторный логистический регрессионный анализ для создания радиомических и клинических моделей в основной группе пациентов. Радиомическая модель была создана путем интеграции радиомической сигнатуры с клинико-патологическими факторами, в то время как клиническая модель была построена только на основе клинико-патологических факторов. Обе модели прошли предварительную внутрицентровую валидацию. Для предсказания вероятности метастазов в тазовые лимфатические узлы (англ. pelvic lymph node, PLN) были построены радиомическая и клиническая номограммы на основе соответствующих моделей [57]. При этом радиомическая номограмма была построена путем интеграции текстурных характеристик, полученных из базовых последовательностей T2-WI и DWI, которые показали наилучшие результаты для прогнозирования метастазирования в лимфатические узлы, и клинических данных: возраст, степень опухолевой дифференцировки и статус лимфоуза (рис. 1).
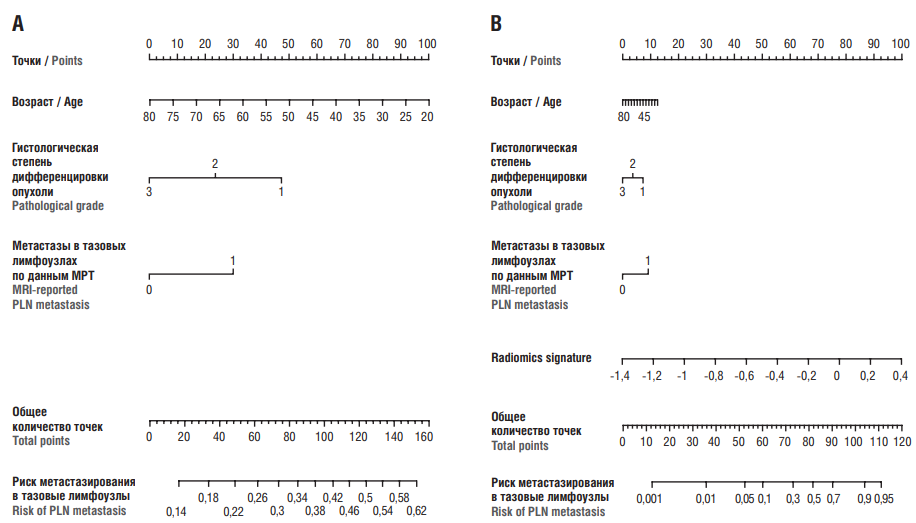
Рисунок 1. Номограммы, разработанные на основе клинических и радиомических характеристик: А – номограмма, отражающая клинические характеристики; В – номограмма, включающая радиомические характеристики [57].
Примечание: MРТ – магнитно-резонансная томография; PLN – тазовые лимфатические узлы.
Figure 1. Nomograms developed by using clinical and radiomics characteristics: A – clinical characteristics-based nomogram; B – radiomics characteristics-based nomogram [57].
Note: MRI – magnetic resonance imaging; PLN – pelvic lymph node.
Для сравнения также была построена клиническая номограмма на основе только клинико-патологических предикторов.
Радиомическая и клиническая номограммы показали статистически значимые различия в своей диагностической эффективности – AUC = 0,893 (95 % ДИ = 0,817–0,969) и AUC = 0,616 (95 % ДИ = 0,468–0,764) соответственно в основной группе и AUC = 0,922 (95 % ДИ = 0,825–1,00) и AUC = 0,799 (95 % ДИ = 0,599–0,998) в группах при предварительной валидации. Очевидно, что номограмма радиомики демонстрирует значительное улучшение показателей прогнозирования метастазирования в лимфатические узлы по сравнению с клинической номограммой.
Клинико-патологические характеристики отражают качественные и общие особенности опухолей и неизбежно включают субъективное суждение врача и опыт оператора, в то время как радиомические признаки включают количественную информацию в многомерном математическом аспекте и могут отражать гетерогенность и биологическое поведение опухолей, что делает оценку, основанную на радиомических признаках, более объективной и точной. Кроме того, точное преоперационное обнаружение метастазов в лимфатические узлы с использованием стандартных методов визуализации до сих пор представляет технические сложности: МРТ и мультиспиральная КТ имеют аналогичные ограничения, связанные с малым размером опухоли; единственным признанным критерием для диагностики метастазов в лимфоузлы является то, что короткая ось лимфоузла превышает 1 см, и это ограничение может легко привести к недооценке рисков.
Отличающееся по дизайну исследование A.S. Becker с соавт., опубликованное в 2017 г., посвящено поиску радиомических маркеров для дифференцировки и стадирования РШМ. Двадцать три пациента были включены в это проспективное исследование. МРТ органов малого таза была выполнена на 3-Т МРТ-сканере, протокол исследования включал последовательность DWI со значениями b-фактора 40, 300 и 800 с/мм2. Для анализа текстуры в механически выбранной исследователем области интереса (англ. region of interest, ROI) в опухоли, большой ягодичной мышце и подкожно-жировой клетчатки использовали ИКД [58].
В рамках исследования было вычислено 32 текстурных признака из гистограмм и детализированных матриц – матрица совместной встречаемости уровней серого (англ. Gray Level Co-occurrence Matrix, GLCM), матрица длины пробега серых уровней (англ. Gray Level Run Length Matrix, GLRLM) и матрица зон размера на уровне серого (англ. Gray Level Size Zone, GLSZM). Выявленные признаки были исследованы на предмет корреляции со степенью дифференцировки опухоли (корреляционный анализ Спирмена) и статусом лимфатических узлов (тест Крускала–Уоллиса). В ходе исследования A.S. Becker с соавт. обнаружили, что с дифференцировкой опухоли статистически значимо коррелировали лишь 3 признака: длительное выделение высокого уровня серого (англ. Long Run High Gray-Level Empha, LRHGE) (ϱ = 0,53; р = 0,03), акцент на большой зоне (англ. Zone percentage, ZP) (ϱ = –0,49; р < 0,05) и акцент на малой зоне (англ. Small zone emphasis, SZE) (ϱ = –0,51; р = 0,04), в то время как ни один из них не коррелировал с гистологическим подтипом или стадией по FIGO. Затем кластерный анализ выявил, что более высокая асимметрия или эксцесс (текстурные параметры первого порядка) были связаны с положительным статусом лимфоузла – 0,65 против 1,08 (p = 0,04) и 0,53 против 1,67 (p = 0,02) соответственно, из чего авторами был сделан вывод, что LRHGE и эксцесс могут быть использованы в качестве двух независимых маркеров степени дифференцировки опухоли и наличия метастазов в лимфатических узлах соответственно [58]. Неожиданно текстурный анализ не позволил дифференцировать гистологический тип опухоли. Учитывая относительно небольшой размер выборки, использованной в этом пилотном исследовании, было бы преждевременно делать какие-либо выводы из этого отрицательного результата; тем не менее, возможно, что в конечном счете, другие маркеры визуализации могут превосходить радиомические признаки для предсказания гистологического типа (такие как параметры перфузии, полученные при количественном анализе мультипараметрической МРТ).
Целью исследования X.-Х. Li с соавт. было изучение диагностической ценности комбинации количественных параметров мультипараметрической МРТ с перфузионным протоколом, определяемых в опухоли, и текстурных признаков на основе T2-WI для прогнозирования параметриальной инвазии. После предварительной оценки 62 пациентки с гистопатологически подтвержденным РШМ (25–56 лет, средний возраст 45 лет) отвечали всем критериям включения в исследование (27 с параметриальной инвазией и 35 без инвазии), включая стадию IA по FIGO (n = 14), IB (n = 9), IIA (n = 12), IIB (n = 15), IIIA (n = 7) и IIIB (n = 5). На предоперационном этапе всем пациенткам выполнялась DCE-МРТ с постпроцессинговой обработкой полученных изображений и построением перфузионных карт для последующей количественной оценки параметров перфузии в опухоли: объемный коэффициент переноса из кровеносного сосуда во внеклеточный матрикс (англ. volumetric transfer coefficient, Ktrans), коэффициент, определяющий обратное перераспределение контрастного препарата между кровеносным сосудом и внеклеточным внесосудистым пространством (англ. the rate constant, Kep) и внеклеточное объемное соотношение (англ. extracellular volume, Ve) [59]. В результате ROC-анализа были установлены пороговые значения (cut-off) для наиболее информативных визуализационных и текстурных показателей для оценки параметральной инвазии: пороговое значение Ktrans ≥ 0,286 мин–1 может стать оптимальным порогом для установления вовлеченности в процесс параметральной клетчатки и использоваться в клинической практике (AUC = 0,788; чувствительность = 0,839; специфичность = 0,657).
Среди параметров текстурного анализа наилучшую диагностическую эффективность показали энергия и энтропия. Энергия отражает однородность и фактурность изображений. Чем мягче распределен серый цвет изображения, тем выше его значение. Энтропия, отражающая степень хаотичности уровней серого, является также эффективной мерой информации в изображениях и используется для оценки однородности текстуры изображения. В исследовании X.-Х. Li с соавт. пороговое значение Энергии составило ≤ 0,488 (AUC = 0,761; чувствительность = 0,710; специфичность = 0,714) и Энтропии ≥ 1,387 (AUC = 0,749; чувствительность = 0,581; специфичность = 0,943). Для оценки диагностической эффективности комбинаций количественных показателей в исследовании была построена модель логистической регрессии, проведена оценка ее информативности (ROC-анализ). Наиболее информативной предикторной комбинацией (с AUC = 0,727, чувствительностью 0,806 и специфичностью 0,657) является Ktrans + Энтропия. По своей диагностической эффективности она превзошла комбинированное использование Ktrans + Энергия (AUC = 0,727, чувствительность = 0,806, специфичность = 0,657) и Энтропия + Энергия (AUC = 0,619, чувствительность = 0,548, специфичность = 0,771, соответственно). Наиболее информативной в оценке инвазии явилась комбинация всех трех параметров – Ktrans + Энтропия + Энергия (AUС = 0,925, чувствительность = 0,935, специфичность = 0,829), что обосновывает сочетанное применение мультипараметрической МРТ и текстурного анализа в рамках предоперационного обследования пациенток [59].
Таким образом, значение энтропии в группе с параметриальной инфильтрацией было выше, чем в группе без инфильтрации, что указывало на то, что распределение пикселей изображения в группе с инфильтрацией было более дискретным и неупорядоченным. Причина такой разницы может быть связана со степенью дифференцировки опухоли. В нескольких исследованиях показано, что опухоли с высокой степенью злокачественности обладают высокой гетерогенностью, что и отражает высокое значение энтропии в низкодифференцированных карциномах [60]. Другими словами, мультипараметрическая МРТ, представляющая количественную перфузионную информацию на молекулярном уровне, и особенности текстуры, представляющие собой математическую модель оценки распределения и взаимосвязи уровней пикселей или вокселей серого в изображении, являются одним из наиболее перспективных сочетаний для диагностики РШМ с параметральной инфильтрацией. Вышеизложенное открывает новые возможности использования более точных количественных параметров на микроскопическом уровне вместо того, чтобы ставить субъективный диагноз по данным лишь клинического осмотра с большой погрешностью для оценки параметриальной инфильтрации. Количественные параметры могут использоваться в качестве важного вспомогательного диагностического инструмента для рутинного МРТ-обследования и могут служить ориентиром для создания модели прогнозирования РШМ, степени агрессии и ответа на химиотерапию с помощью искусственного интеллекта.
Заключение / Conclusion
Таким образом, точная и своевременная диагностика злокачественных опухолей определяет успех лечения и улучшает прогноз заболевания. Визуализационная диагностика – один из наиболее значимых этапов, позволяющий неинвазивно оценить характеристики опухоли и степень распространенности процесса. Полученные цифровые изображения опухоли отражают ее анатомические и функциональные изменения. Учитывая активное внедрение «машинной» обработки изображений в последние годы, радиомика является перспективной областью постпроцессинга, и ее развитие может способствовать повышению воспроизводимости и точности использования «больших данных»: от технических аспектов непосредственно к клиническим исходам, дополняя фундаментальные знания о биологии опухоли и ее молекулярном окружении, позволяя разработать персонализированные стратегии лечения на основе прогнозирования ответа опухоли на терапию.
Список литературы
1. Bray F., Ferlay J., Soerjomataram I. et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68(6):394–424. https://doi.org/10.3322/caac.21492.
2. Pecorelli S. Revised FIGO staging for carcinoma of the vulva, cervix, and endometrium. Int J Gynaecol Obstet. 2009;105(2):103–4. https://doi.org/10.1016/j.ijgo.2009.02.012.
3. Petsuksiri1 J., Jaishuen A., Pattaranutaporn P., Chansilpa Y. Advanced imaging applications for locally advanced cervical cancer. Asian Pacific J Cancer Prev. 2012;13(5):1713–8. https://doi.org/10.7314/APJCP.2012.13.5.1713.
4. Bhatla N., Aoki D., Sharma D.N., Sankaranarayanan R. Cancer of the cervix uteri. Int J Gynecol Obstet. 2018;143 Suppl 2:22–36. https://doi.org/10.1002/ijgo.12611.
5. Sala E., Rockall A.G., Freeman S.J. et al. The added role of MR imaging in treatment stratification of patients with gynecologic malignancies: what the radiologist needs to know. Radiology. 2013;266(3);717–40. https://doi.org/10.1148/radiol.12120315.
6. Gui B., Miccò M., Valentini A.L. et al. Prospective multimodal imaging assessment of locally advanced cervical cancer patients administered by chemoradiation followed by radical surgery – the "PRICE" study 2: role of conventional and DW-MRI. Eur Radiol. 2019;29(4):2045–57. https://doi.org/10.1007/s00330-018-5768-5.
7. Valentini A.L., Miccò M., Gui B. et al. The PRICE study: The role of conventional and diffusion-weighted magnetic resonance imaging in assessment of locally advanced cervical cancer patients administered by chemoradiation followed by radical surgery. Eur Radiol. 2018;28(6):2425–35. https://doi.org/10.1007/s00330-017-5233-x.
8. Jalaguier-Coudray A., Villard-Mahjoub R., Delouche A. et al. Value of dynamic contrast-enhanced and diffusion-weighted MR imaging in the detection of pathologic complete response in cervical cancer after neoadjuvant therapy: A retrospective observational study. Radiology. 2017;284(2):432–42. https://doi.org/10.1148/radiol.2017161299.
9. Schreuder S.M., Lensing R., Stoker J., Bipat S. Monitoring treatment response in patients undergoing chemoradiotherapy for locally advanced uterine cervical cancer by additional diffusion-weighted imaging: A systematic review. J Magn Reson Imaging. 2015;42(3):572–94. https://doi.org/10.1002/jmri.24784.
10. Lambin P., Rios-Velazquez E., Leijenaar R. et al. Radiomics: extracting more Information from medical images using advanced feature analysis. Eur J Cancer. 2012;48(4):441–6. https://doi.org/10.1016/j.ejca.2011.11.036.
11. Lucia F., Visvikis D., Desseroit M.-C. et al. Prediction of outcome using pretreatment 18F-FDG PET/CT and MRI radiomics in locally advanced cervical cancer treated with chemoradiotherapy. Eur J Nucl Med Mol Imaging. 2018;45(5):768–86. https://doi.org/10.1007/s00259-017-3898-7.
12. Torheim T., Groendahl A.R., Andersen E.K.F. et al. Cluster analysis of dynamic contrast enhanced MRI reveals tumor subregions related to locoregional relapse for cervical cancer patients. Acta Oncol. 2016;55(11):1294–8. https://doi.org/10.1080/0284186X.2016.1189091.
13. Koh W.-J., Abu-Rustum N.R., Bean S. et al. Cervical Cancer, Version 3.2019, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2019;17(1):64–84. https://doi.org/10.6004/jnccn.2019.0001.
14. Quinn M.A., Benedet J.L., Odicino F. et al. Carcinoma of the cervix uteri. FIGO 26th annual report on the results of treatment in gynecological cancer. Int J Gynaecol Obstet. 2006;95 Suppl 1:S43–103. https://doi.org/10.1016/S0020-7292(06)60030-1.
15. Guan Y., Li W., Jiang Z. et al. Whole-lesion apparent Diffusion coefficient-based entropy-related parameters for characterizing cervical cancers: initial findings. Acad Radiol. 2016;23(12):1559–67. https://doi.org/10.1016/j.acra.2016.08.010.
16. Neoadjuvant Chemotherapy for Locally Advanced Cervical Cancer Meta-analysis Collaboration. Neoadjuvant chemotherapy for locally advanced cervical cancer: a systematic review and meta-analysis of individual patient data from 21 randomised trials. Eur J Cancer.2003;39(17):2470–86. https://doi.org/10.1016/s0959-8049(03)00425-8.
17. Michel G., Morice P., Castaigne D. et al. Lymphatic spread in stage Ib and II cervical carcinoma: anatomy and surgical implications. Obstet Gynecol. 1998;91(3):360–3. https://doi.org/10.1016/s0029-7844(97)00696-0.
18. Bhatla N., Berek J.S., Fredes M.C. et al. Revised FIGO staging for carcinoma of the cervix uteri. Int J Gynaecol Obstet. 2019;145(1):129–35. https://doi.org/10.1002/ijgo.12749.
19. Manganaro L., Lakhman Y., Bharwani N. et al. Staging, recurrence and follow-up of uterine cervical cancer using MRI: updated Guidelines of the European Society of Urogenital Radiology after revised FIGO staging 2018. Eur Radiol. 2021;31(10):7802–16. https://doi.org/10.1007/s00330-020-07632-9.
20. Rockall A.G., Ghosh S., Alexander-Sefre F. еt al. Can MRI rule out bladder and rectal invasion in cervical cancer to help select patients for limited EUA. Gynecol Oncol. 2006;101(2):244–9. https://doi.org/10.1016/j.ygyno.2005.10.012.
21. Кwee T.C., Takahara T., Ochiai R. et al. Diffusion-weighted whole-body imaging with background body signal suppression (DWIBS): features and potentional applications in oncology. Eur Radiol. 2008;18(9):1937–52. https://doi.org/10.1007/s00330-008-0968-z.
22. Koh D.M, Collins D.J. Diffusion-weighted MRI in the body: applications and challenges in oncology. AJR Am J Roentgenol. 2007;188(6):1622–35. https://doi.org/10.2214/AJR.06.1403.
23. Figueiras R.G., Goh V., Padhani A.R. et al. The role of functional imaging in colorectal cancer. AJR Am J Roentgenol. 2010;195(1):54–66. https://doi.org/10.2214/AJR.10.4422.
24. Kuang F., Ren J., Zhong Q. et al. The value of apparent diffusion coefficient in the assessment of cervical cancer. Eur Radiol. 2013;23(4):1050–8. https://doi.org/10.1007/s00330-012-2681-1.
25. Liu Y., Bai R., Sun H. et al. Diffusion weighted imaging in predicting and monitoring the response of uterine cervical cancer to combined chemoradiation. Clin Radiol. 2009;64(11):1067–74. https://doi.org/10.1016/j.crad.2009.07.010.
26. Chen Y.B., Hu C.M., Chen G.L. et al. Staging of uterine cervical carcinoma: whole body diffusion-weighted magnetic resonance imaging. Abdom Imaging. 2011;36(5):619–26. https://doi.org/10.1007/s00261-010-9642-4.
27. Qi Y.-F., He Y.-L., Lin C.-Y. et al. Diffusion-weighted imaging of cervical cancer: feasibility of ultra-high b-value at 3T. Eur J Radiol. 2020;124:108779. https://doi.org/10.1016/j.ejrad.2019.108779.
28. Chung H.H., Kang S.-B., Cho J.Y. et al. Can preoperative MRI accurately evaluate nodal and parametrial invasion in early stagе cervical cancer? Jpn J Clin Oncol. 2007;37(5):370–5. https://doi.org/10.1093/jjco/hym036.
29. Kim S.H., Han M.C. Invasion of the urinary bladder by uterine cervical carcinoma: evaluation with MR imaging. AJR Am J Roentgenol. 1997;168(2):393–7. https://doi.org/10.2214/ajr.168.2.9016214.
30. Mirestean C.C., Pagute O., Buzea C. et al. Radiomic machine learning and texture analysis – new horizons for head and neck oncology. Maedica (Bucur). 2019;14(2):126–30. https://doi.org/10.26574/maedica.2019.14.2.126.
31. Giganti F., Antunes S., Salerno A. et al. Gastric cancer: texture analysis from multidetector computed tomography as a potential preoperative prognostic biomarker. Eur Radiol. 2017;27(5):1831–9. https://doi.org/10.1007/s00330-016-4540-y.
32. Beig N., Khorrami M., Alilou M. et al. Perinodular and intranodular radiomic features on lung CT images distinguish adenocarcinomas from granulomas. Radiology. 2019;290(3):783–92. https://doi.org/10.1148/radiol.2018180910.
33. Sidhu H.S., Benigno S., Ganeshan B. et al. Textural analysis of multiparametric MRI detects transition zone prostate cancer. Eur Radiol. 2017;27(6):2348–58. https://doi.org/10.1007/s00330-016-4579-9.
34. Ueno Y., Forghani B., Forghani R. et al. Endometrial carcinoma: MR imaging-based texture model for preoperative risk stratification – a preliminary analysis. Radiology. 2017;284(3):748–57. https://doi.org/10.1148/radiol.2017161950.
35. Lakhman Y., Veeraraghavan H., Chaim J. et al. Differentiation of uterine leiomyosarcoma from atypical leiomyoma: diagnostic accuracy of qualitative MR imaging features and feasibility of texture analysis. Eur Radiol. 2017;27(7):2903–15. https://doi.org/10.1007/s00330-016-4623-9.
36. De Cecco C.N., Ciolina M., Caruso D. et al. Performance of diffusion-weighted imaging, perfusion imaging, and texture analysis in predicting tumoral response to neoadjuvant chemoradiotherapy in rectal cancer patients studied with 3T MR: initial experience. Abdom Radiol (NY). 2016;41(9):1728–35. https://doi.org/10.1007/s00261-016-0733-8.
37. Liu Z., Zhang X.Y., Shi Y.J. et al. Radiomics analysis for evaluation of pathological complete response to neoadjuvant chemoradiotherapy in locally advanced rectal cancer. Clin Cancer Res. 2017;23(23):7253–62. https://doi.org/10.1158/1078-0432.CCR-17-1038.
38. Gardin I., Grégoire V., Gibon D. et al. Radiomics: principles and radiotherapy applications. Crit Rev Oncol Hematol. 2019;138:44–50. https://doi.org/10.1016/j.critrevonc.2019.03.015.
39. Chaddad A., Kucharczyk M.J., Daniel P. et al. Radiomics in glioblastoma: current status and challenges facing clinical implementation. Front Oncol. 2019;9:374. https://doi.org/10.3389/fonc.2019.00374.
40. van Velden F.H., Kramer G.M., Frings V. et al. Repeatability of radiomic features in non-small-cell lung cancer [18F]FDG-PET/CT studies: impact of reconstruction and delineation. Mol Imaging Biol. 2016;18(5):788–95. https://doi.org/10.1007/s11307-016-0940-2.
41. Nioche C., Orlhac F., Boughdad S. et al. LIFEx: a freeware for radiomic feature calculation in multimodality imaging to accelerate advances in the characterization of tumor heterogeneity. Cancer Res. 2018;78(16):4786–9. https://doi.org/10.1158/0008-5472.can-18-0125.
42. Zhang L., Fried D.V., Fave X.J. et al. IBEX: an open infrastructure software platform to facilitate collaborative work in radiomics. Med Phys. 2015;42(3):1341–53. https://doi.org/10.1118/1.4908210.
43. Wu J., Tha K.K., Xing L., Li R. Radiomics and radiogenomics for precision radiotherapy. J Radiat Res. 2018;59(suppl_1):i25–i31. https://doi.org/10.1093/jrr/rrx102.
44. Coroller T.P., Grossmann P., Hou Y. et al. CT-based radiomic signature predicts distant metastasis in lung adenocarcinoma. Radiother Oncol. 2015;114(3):345–50. https://doi.org/10.1016/j.radonc.2015.02.015.
45. Mattonen S.A., Palma D.A., Johnson C. et al. Detection of local cancer recurrence after stereotactic ablative radiation therapy for lung cancer: physician performance versus radiomic assessment. Int J Radiat Oncol Biol Phys. 2016;94(5):1121–8. https://doi.org/10.1016/j.ijrobp.2015.12.369.
46. Cook G.J., Yip C., Siddique M. et al. Are pretreatment 18F-FDG PET tumor textural features in non-small cell lung cancer associated with response and survival after chemoradiotherapy? J Nucl Med. 2013;54(1):19–26. https://doi.org/10.2967/jnumed.112.107375.
47. Huang Y., Liu Z., He L. et al. Radiomics signature: a potential biomarker for the prediction of disease-free survival in early-stage (I or II) non-small cell lung cancer. Radiology. 2016;281(3):947–57. https://doi.org/10.1148/radiol.2016152234.
48. Stanzione A., Cuocolo R., Del Grosso R. et al. Deep myometrial infiltration of endometrial cancer on MRI: a radiomics-powered machine learning pilot study. Acad Radiol. 2021;28(5):737–44. https://doi.org/10.1016/j.acra.2020.02.028.
49. Miccò M., Gui B., Russo L. et al. Preoperative tumor texture analysis on MRI for high-risk disease prediction in endometrial cancer: a hypothesis-generating study. J Pers Med. 2022;12(11):1854. https://doi.org/10.3390/jpm12111854.
50. Cheng M., Tan S., Ren T. et al. Magnetic resonance imaging radiomics to differentiate ovarian sex cord-stromal tumors and primary epithelial ovarian cancers. Front Oncol. 2023;12:1073983. https://doi.org/10.3389/fonc.2022.1073983.
51. Fang M., Kan Y., Dong D. et al. Multi-habitat based radiomics for the prediction of treatment response to concurrent chemotherapy and radiation therapy in locally advanced cervical cancer. Front Oncol. 2020;10:563. https://doi.org/10.3389/fonc.2020.00563.
52. Gien L., Gien L.T., Covens A. Lymph node assessment in cervical cancer: prognostic and therapeutic implications. J Surg Oncol. 2009;99(4):242–47. https://doi.org/10.1002/jso.21199.
53. Small W., Bacon M.A., Bajaj A. et al. Cervical cancer: a global health crisis.Cancer. 2017;123(13):2404–12. https://doi.org/10.1002/cncr.30667.
54. Ferrandina G., Anchora L.P., Gallotta V. et al. Can we define the risk of lymph node metastasis in early-stage cervical cancer patients? A largescale, retrospective study. Ann Surg Oncol. 2017;24(8):2311–8. https://doi.org/10.1245/s10434-017-5917-0.
55. Macdonald M.C., Tidy J.A. Can we be less radical with surgery for early cervical cancer? Curr Oncol Rep. 2016;18(3):16. https://doi.org/10.1007/s11912-016-0501-5.
56. Kadkhodayan S., Hasanzadeh M., Treglia G. et al. Sentinel node biopsy for lymph nodal staging of uterine cervix cancer: a systematic review and meta-analysis of the pertinent literature. Eur J Surg Oncol. 2015;41(1):1–20. https://doi.org/10.1016/j.ejso.2014.09.010.
57. Wang T., Gao T., Yang J. et al. Preoperative prediction of pelvic lymph nodes metastasis in early-stage cervical cancer using radiomics nomogram developed based on T2-weighted MRI and diffusion-weighted imaging. Eur J Radiol. 2019;114:128–35. https://doi.org/10.1016/j.ejrad.2019.01.003.
58. Becker A.S., Ghafoor S., Marcon M. et al. MRI texture features may predict differentiation and nodal stage of cervical cancer: a pilot study. Acta Radiol Open. 2017;6(10):205846011772957. https://doi.org/10.1177/2058460117729574.
59. Li X.X., Lin T.-T., Liu B., Wei W. Diagnosis of cervical cancer with parametrial invasion on whole-tumor dynamic contrast-enhanced magnetic resonance imaging combined with whole-lesion texture analysis based on T2-weighted images. Front Bioeng Biotechnol. 2020;8:590. https://doi.org/10.3389/fbioe.2020.00590.
60. Avanzo M., Stancanello J., El Naqa I. Beyond imaging: the promise of radiomics. Phys Med. 2017;38:122–39. https://doi.org/10.1016/j.ejmp.2017.05.071.
Об авторах
А. Е. СолоповаRussian Federation
Солопова Алина Евгеньевна – д.м.н., ведущий научный сотрудник отдела лучевой диагностики Национального медицинского исследовательского центра акушерства, гинекологии и перинатологии имени академика В.И. Кулакова; профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова Сеченовского университета
Scopus Author ID: 24460923200
Researcher ID: P-8659-2015
117997 Москва, ул. академика Опарина, д. 4;
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Ю. В. Носова
United Arab Emirates
Носова Юлия Витальевна – к.м.н., врач-специалист отделения акушерства и гинекологии
Дубай, Хадаэк Мухаммед Бин Рашид, Эль Барша Саут 3, ул. Хесса, д. 3/5
Б. Б. Бендженова
Russian Federation
Бендженова Бова Батнасановна – врач акушер-гинеколог, онколог гинекологического отделения
125284 Москва, 2-й Боткинский проезд, д. 5
Рецензия
Для цитирования:
Солопова А.Е., Носова Ю.В., Бендженова Б.Б. Магнитно-резонансная томография при раке шейки матки: современные возможности радиомного анализа и перспективы развития методики. Акушерство, Гинекология и Репродукция. 2023;17(4):500-511. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.440
For citation:
Solopova A.E., Nosova J.V., Bendzhenova B.B. Magnetic resonance imaging in cervical cancer: current opportunities of radiomics analysis and prospects for its further developmen. Obstetrics, Gynecology and Reproduction. 2023;17(4):500-511. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.440
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































