Перейти к:
Маркеры внеклеточных ловушек нейтрофилов у женщин со злокачественными новообразованиями репродуктивной системы, получавших хирургическое лечение и адъювантную терапию
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.432
Аннотация
Введение. Исследования свидетельствуют о связи между повышением концентрации внеклеточной ДНК (вкДНК) и химиотерапией, при этом большинство из них сосредоточены на опухоли как источнике вкДНК. Повышенная концентрация вкДНК, наблюдаемая у пациентов на фоне химиотерапии, может быть связана с нетозом, так как вкДНК при раке по своим характеристикам сходна с внеклеточными ловушками нейтрофилов (англ. neutrophil extracellular traps, NETs).
Цель: оценка маркеров нетоза при хирургическом лечении и адьювантной химиотерапии пациенток со злокачественными новообразованиями женской репродуктивной системы.
Материалы и методы. В проспективном нерандомизированном интервенционном контролируемом исследовании приняли участие 111 пациенток со злокачественными заболеваниями молочных желез и женских половых органов различных локализаций и стадий, госпитализированных с целью проведения планового оперативного лечения или курса химиотерапии. В контрольную группу вошли 33 здоровые женщины. Оперативному лечению подверглись 69 пациенток. Адъювантная химиотерапия с паклитакселом и карбоплатином проведена 25 пациенткам подгруппы «рак яичников» и 17 пациенткам подгруппы «рак молочной железы». В качестве биомаркеров нетоза были выбраны цитруллинированный гистон H3 (англ. citrullinated histone H3, citH3) и миелопероксидаза (англ. myeloperoxidase, MPO). Эти маркеры отличают NETs от другой вкДНК, полученной из опухоли, что повышает информативность исследования. Концентрацию маркеров нетоза оценивали дважды – до операции или начала курса химиотерапии при поступлении пациенток в отделение и через 14 дней после операции или через 14 дней после второго курса химиотерапии.
Результаты. У всех пациенток концентрации маркеров нетоза до начала терапии были достоверно повышены по сравнению с контрольной группой (р = 0,0001), также как и через 14 дней после оперативного лечения (р = 0,0001) или после второго курса химиотерапии (р = 0,0001). Однако у прооперированных пациенток не было выявлено значимого повышения концентрации маркеров нетоза после операции по сравнению с дооперационными значениями. При этом у пациенток, прошедших 2 курса химиотерапии, было установлено достоверное повышение маркеров нетоза по сравнению с исходными значениями.
Заключение. Проведенное исследование выявило взаимосвязь между использованием паклитаксел-содержащей химиотерапии и ростом концентрации NETs у пациенток подгрупп «рак яичников» и «рак молочной железы». Химиотерапия является важнейшими компонентом ведения пациентов со злокачественными новообразованиями женской репродуктивной системы, поэтому разработка новых стратегий для снижения риска тромбоза и резистентности к ней имеет жизненно важное значение.
Ключевые слова
Для цитирования:
Слуханчук Е.В., Бицадзе В.О., Солопова А.Г., Хизроева Д.Х., Гри Ж., Элалами И., Дегтярева Н.Д., Гилева М.А., Самбурова Н.В., Щербаков Д.В., Якубова Ф.Э., Зелепухина М.Е., Блинов Д.В., Макацария А.Д. Маркеры внеклеточных ловушек нейтрофилов у женщин со злокачественными новообразованиями репродуктивной системы, получавших хирургическое лечение и адъювантную терапию. Акушерство, Гинекология и Репродукция. 2023;17(4):420-432. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.432
For citation:
Slukhanchuk E.V., Bitsadze V.O., Solopova A.G., Khizroeva J.Kh., Gris J., Elalamy I., Degtyareva N.D., Gileva M.A., Samburova N.V., Shcherbakov D.V., Yakubova F.E., Zelepukhina M.E., Blinov D.V., Makatsariya A.D. Neutrophil extracellular traps-associated markers in malignant neoplasms of the female reproductive system after surgical treatment and adjuvant chemotherapy. Obstetrics, Gynecology and Reproduction. 2023;17(4):420-432. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.432
Введение / Introduction
Тромбоз на фоне химиотерапии является частым осложнением у онкологических больных. Риск тромботических осложнений при этом в 5–7 раз повышен по сравнению со здоровыми людьми. Частота тромбоза зависит от стадии заболевания и используемых химиотерапевтических препаратов. О связи между раком, химиотерапией и тромбозом известно давно, однако молекулярные механизмы, с помощью которых химиотерапевтические агенты способствуют тромбозу, до конца не изучены. Потенциальные механизмы, с помощью которых химиотерапия способствует гиперкоагуляции, включают повышение прокоагулянтной активности тканевого фактора, активацию тромбоцитов [1], повышение концентраций фосфатидилсерина, микрочастиц [2] и внеклеточной ДНК (вкДНК) [3].
В большинстве исследований циркулирующая ДНК изучалась в контексте скрининга рака, опухолевой нагрузки и оценки метастазирования; количественные изменения использовались для улучшения диа- гностики и мониторинга ответа на противоопухолевую терапию [4]. При раке легкого концентрация ДНК в плазме повышена по сравнению со здоровыми людьми и еще больше повышена после химиотерапии [5]. В недавно проведенных исследованиях было продемонстрировано, что химиотерапия может увеличить количество циркулирующей ДНК у онкологических больных с последующей гиперкоагуляцией [6].
Исследования, изучающие связь между противоопухолевой терапией и циркулирующими внеклеточными ловушками нейтрофилов (англ. neutrophil extracellular traps, NETs), остаются скудными. Некоторые исследования свидетельствуют о связи между повышением концентрации вкДНК и устойчивостью к химиотерапии. Источником вкДНК при этом могут быть нейтрофилы. Ранее концентрация вкДНК предлагалась для прогнозирования прогрессирования рака и терапевтического эффекта [7]. S. Holdenrieder с соавт. изучали содержание циркулирующей ДНК и гис- тонов в качестве биомаркеров ответа на химиотерапию у пациентов с диагнозом немелкоклеточного рака легкого III или IV стадии. Их исследование показало, что хороший ответ на терапию коррелировал с более низкими концентрациями компонентов NETs [8].
Большинство исследований сосредоточены на опухоли как доминирующем источнике вкДНК. Недавно выдвинуто предположение о том, что нейтрофилы также вносят свой вклад в рост концентрации вкДНК [7]. Исследования показали, что вкДНК при раке по своим характеристикам сходна с NETs [9]. Следовательно, повышенная концентрация вкДНК, наблюдаемая у пациентов с резистентностью к лечению, может быть частично связана с нетозом.
Воспаление признано ключевым компонентом патофизиологии рака [10]. Оркестр из иммунных клеток участвует в инвазии, росте и распространении клеток опухоли [11]. В прогрессии опухоли и метастазировании нейтрофилы принимают активное участие, что дает возможность рассматривать их и их производные (NETs) как потенциальные терапевтические мишени [12]. После открытия NETs оказалось, что их роль более сложна, чем первоначально предполагалось [13]. В процессе синтеза NETs, называемым нетозом, нейтрофилы вытесняют сети деконденсированного хроматина, украшенного гистонами [7]. Опухолевая ткань выделяет гранулоцитарный колониестимулирующий фактор (англ. granulocyte colony-stimulating factor, G-CSF), запускающий нетоз (рис. 1) [6]. Классический суицидальный нетоз завершается лизисом нейтрофила. Существует и другой, нелитический, витальный нетоз [14]. В составе NETs участвуют различные гистоны, способствующие прогрессии рака и резистентности к терапии [15], такие как эластаза, катепсин G (англ. cathepsin G, CG) и матриксная металлопротеиназа-9 (англ. matrix metalloproteinase-9, MMP-9) [16].
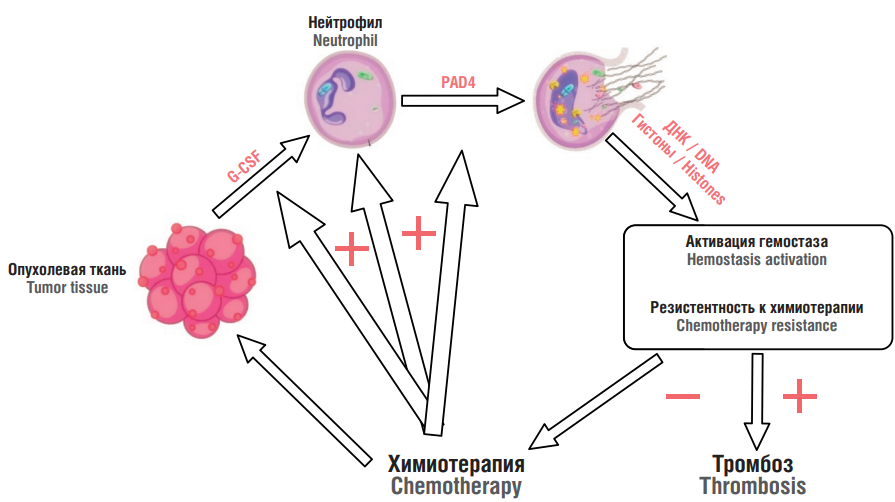
Рисунок 1. Химиотерапия и внеклеточные ловушки нейтрофилов (NETs) [рисунок авторов].
Примечание: PAD4 – пептидил-аргинин деиминаза 4; G-CSF – гранулоцитарный колониестимулирующий фактор; «+» – активация и усиление процесса; «–» – подавление процесса, снижение эффекта.
Figure 1. Chemotherapy and neutrophil extracellular traps (NETs) [drawn by authors].
Note: PAD4 – peptidyl-arginine deiminase 4; G-CSF – granulocyte colony-stimulating factor; «+» – process activation and enhancement; «–» – process suppression, lowered effect.
В исследованиях было показано, что химиотерапевтические препараты рака молочной железы индуцируют образование NETs. Для их формирования требуется продукция активных форм кислорода (АФК), поскольку у пациентов с мутациями NADPH-оксидазы, которые нарушают выработку АФК, не образуются сети [17].
Опухоль-ассоциированные нейтрофилы (ОАН) являются важными компонентами микроокружения опухоли, которое в формировании резистентности к противоопухолевой терапии играет центральную роль [18]. Нейтрофилы продуцируют цитокины и хемокины, способствующие выживанию опухолевых клеток, подавляя тем самым ответ на терапию [19]. Данное утверждение подтверждают клинические данные, демонстрирующие лучший терапевтический ответ и прогноз у пациентов с легкой нейтропенией на фоне химиотерапии [20]. Подавление ОАН может улучшать ответ на химиотерапию независимо от других искажающих факторов. Связь между нейтропенией и хорошим прогнозом сначала рассматривалась как совпадение. В настоящее время считается, что нейтропения является маркером достаточной терапевтической дозы и свидетельствует о присутствии ОАН-зависимых механизмов резистентности [21]. Причастность нейтрофилов к формированию резистентности к терапии хорошо описана, в связи с чем вызывает интерес к нетозу как механизму резистентности [22].
В центре внимания нашего исследования находился эффект карбоплатина и паклитаксела на активность процессов нетоза. Нами была предпринята попытка показать, действительно ли данные химиотерапевтические препараты индуцируют высвобождение NETs у онкогинекологических пациенток. В качестве биомаркеров нетоза у онкогинекологических пациенток на фоне химиотерапии были выбраны цитруллинированный гистон H3 (англ. citrullinated histone H3, citH3) и миелопероксидаза (англ. myeloperoxidase, MPO). Эти маркеры отличают NETs от вкДНК, полученной из опухоли, что повышает информативность исследования.
Цель: оценка маркеров нетоза при хирургическом лечении и адьювантной химиотерапии пациенток со злокачественными новообразованиями женской репродуктивной системы.
Материалы и методы / Materials and Мethods
Дизайн исследования / Study design
В проспективном нерандомизированном интервенционном контролируемом исследовании участвовали 144 женщины: 111 пациенток в возрасте от 34 лет до 72 лет, госпитализированных с целью проведения планового оперативного лечения или курса химиотерапии в Университетскую клиническую больницу № 4 Сеченовского Университета и ФГБНУ РНЦХ им. акад. Б.В. Петровского (основная группа), и 33 условно здоровых сотрудниц баз проводимого исследования в возрасте от 32 до 68 лет, которые вошли в контрольную группу.
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения (основная группа): возраст 18 лет и старше; диагноз при поступлении – злокачественные новообразования тела матки, яичников, молочных желез, шейки матки; согласие на исследование и подписание информированного добровольного согласия.
Критерии включения (контрольная группа): возраст 18 лет и старше; отсутствие воспалительных, онкологических заболеваний, тромбозов и тромбоэмболий; согласие на участие в исследовании и подписанное информированное добровольное согласие.
Критерии исключения (для обеих групп): возраст до 18 лет; на момент отбора образца плазмы активный инфекционно-воспалительный процесс; тяжелое течение и обострение сердечно-сосудистых заболеваний; декомпенсация сахарного диабета; обострение хронических заболеваний почек и печени; сопутствующие другие онкологические заболевания; тромбоэмболические осложнения, прием антикоагулянтов и антиагрегантов; коагулопатии и тромбоцитопатии; тромботический или геморрагический синдром; отказ от участия в исследовании.
Группы обследованных / Patients groups
Основную группу составили 111 пациенток со злокачественными заболеваниями женских половых органов и молочных желез на различных стадиях: рак тела матки (подгруппа 1; n = 25), рак яичников (подгруппа 2; n = 36), рак шейки матки – аденокарцинома цервикального канала (подгруппа 3; n = 17), рак молочной железы (подгруппа 4; n = 33). Контрольную группу составили 33 здоровые женщины.
Оперативному лечению подверглись 69 пациенток: 25 в подгруппе 1 (рак тела матки), 11 в подгруппе 2 (рак яичников), 17 в подгруппе 3 (рак шейки матки), 16 в подгруппе 4 (рак молочной железы).
Для проведения адъювантной химиотерапии гос- питализировано 25 пациенток подгруппы 1 (рак тела матки) и 17 пациенток подгруппы 4 (рак молочной железы). Пациенткам с раком тела матки химиотерапия проводилась по схеме: паклитаксел 175 мг/м2 внутривенно 3 часа в 1 день и карбоплатин AUC 6 внут- ривенно 1 час в 1 день 21-дневного курса. Женщинам из подгруппы «рак молочной железы» химиотерапия проводилась в различных режимах в зависимости от принадлежности опухоли к одному из молекулярно- биологических подтипов и стадии заболевания. В исследование были включены пациентки, в состав химиотерапии у которых входил паклитаксел.
Методы исследования / Study methods
Образцы плазмы у обследованных женщин получали путем венепункции: у онкогинекологических пациенток первый раз – до оперативного лечения, до профилактического назначения антикоагулянтов, до начала курса химиотерапии при поступлении пациентки в отделение, второй раз – через 14 дней после операции или через 14 дней после второго курса химиотерапии и хранили после центрифугирования при температуре –80° С. Отбор крови натощак сухой стерильной иглой из локтевой вены производили в плас- тиковую пробирку с антикоагулянтом – 3,8 % трехзамещенным цитратом натрия в соотношении 9:1. У женщин контрольной группы образцы плазмы отбирали однократно в момент профилактического ежегодного осмотра.
Определение маркеров нетоза / Assessing NETosis markers
Набор для иммуноферментного анализа (ИФА) MPO, Human, ELISA kit (Hycult Biotech, Нидерланды) использовали для определения концентрации в плазме крови антигена миелопероксидазы человека (MПO:Aг). Нормальный референтный уровень МПО:Аг составляет 2,56 ± 0,33 нг/мл. С помощью набора для ИФА Citrullinated Histone H3 ELISA Kit (Cayman Chemical, AnnArbor, США) проводили определение в плазме крови citH3.
Этические аспекты / Ethical aspects
В исследовании были соблюдены требования Хельсинской декларации. После получения исчерпывающей информации участницы исследования подписали информированное согласие. Исследование одобрено этическим комитетом Сеченовского Университета, протокол № 03-23 от 16.02.2023.
Статистический анализ / Statistical analysis
Обработка данных осуществлялась с использованием программного обеспечения Statistica 7.0 (StatSoft, Inc. CШA).
Для возраста и лабораторных показателей статистический анализ включал в себя расчёт описательных статистик: минимального и максимального значений, средней (M), среднеквадратического отклонения (SD).
Для оценки нормальности распределения применялся тест Харке–Бера (Jarque–Beratest). На уровне значимости p ≤ 0,05 нулевая гипотеза H0 о том, что остатки значений рассматриваемых показателей групп участников имеют нормальное распределение, откланялась.
Сравнение значений показателей между группами и непараметрическая оценка проведена при помощи критерия Манна–Уитни для несвязанных выборок (Mann–Whitney U-test). Нами была сформулирована нулевая гипотеза H0 как отсутствие различий между группами пациенток. Во всех случаях H0 отклонялась при уровнях значимости p ≤ 0,05.
Сравнение значений показателей и непараметрическая оценка между группами пациенток до и после операции и до и после проведения химиотерапии проведена с использованием критерия Вилкоксона для связанных выборок (Wilcoxon Matched Pairs Test). Нами была сформулирована нулевая гипотеза H0 как отсутствие различий между пациентками до и после соответствующего метода лечения. Во всех случаях H0 отклонялась при уровнях значимости p ≤ 0,01.
Результаты / Results
Значимых возрастных различий между группами не было. У всех онкогинекологических пациенток на момент поступления в стационар концентрации маркеров нетоза (citH3 и МПО:Аг) были повышены и дос- товерно отличались от контрольной группы (табл. 1).
В таблицах 2 и 3 показаны достоверно повышенные концентрации маркеров нетоза у прооперированных пациенток через 14 дней после операции и у пациенток, прошедших 2 курса химиотерапии, при сравнении с контрольной группой.
Далее проведено сравнение концентраций маркеров нетоза у пациенток, прошедших оперативное лечение, до и после вмешательства, а также концентраций маркеров нетоза у пациенток, госпитализированных для проведения химиотерапии до и после 2 курсов химиотерапии. У прооперированных пациенток значимых различий показателей до и после операции выявлено не было (табл. 4). При этом в группе химио- терапии установлено достоверное повышение концентраций маркеров нетоза через 14 дней после второго курса химиотерапии (табл. 5).
Таблица 1. Содержание маркеров нетоза (citH3 и МПО:Аг) у онкогинекологических пациенток до начала терапии по сравнению с контрольной группой.
Table 1. NETosis markers (citH3 and MPO:Ag) level in female cancer patients before onset of therapy compared with control group.
|
Показатель Parameter |
Подгруппы онкогинекологических пациенток Subgroups of female cancer patients n = 111 |
Контрольная группа Control group n = 33 |
Значимость отличий (р) онкогинекологических подгрупп от контрольной группы Significance of difference (p) between female cancer subgroups and control group |
||||||
|
1 n = 25 |
2 n = 36 |
3 n = 17 |
4 n = 33 |
1 |
2 |
3 |
4 |
||
|
Концентрация сitH3 до начала терапии, нг/мл, M ± SD сitH3 level before therapy, ng/ml, M ± SD min–max |
2,72 ± 0,60 1,1–3,5 |
1,72 ± 0,76 1,0–3,5 |
2,54 ± 0,64 0,93–2,5 |
0,69 ± 0,52 0,05–2,10 |
0,33 ± 0,13 0,14–0,6 |
0,0001 |
0,0001 |
0,0001 |
0,0001 |
|
Концентрация MПО:Аг до начала терапии, нг/мл, M ± SD MPO:Ag level before therapy, ng/ml, M ± SD min–max |
30,18 ± 12,53 12–51 |
12,03 ± 3,44 9,1–21,5 |
23,68 ± 7,89 8,1–31,0 |
6,43 ± 2,50 3,4–12,9 |
2,45 ± 0,20 2,2–2,8 |
0,0001 |
0,0001 |
0,0001 |
0,0001 |
Примечание: citH3 – цитруллинированный гистон Н3; МПО:Аг – антиген миелопероксидазы; 1 – подгруппа 1 (рак тела матки); 2 – подгруппа 2 (рак яичников); 3 – подгруппа 3 (рак шейки матки); 4 – подгруппа 4 (рак молочной железы).
Note: citH3 – citrullinated histone H3; MPO:Ag – myeloperoxidase antigen; 1 – subgroup 1 (uterine body cancer); 2 – subgroup 2 (ovarian cancer); 3 – subgroup 3 (cervical cancer); 4 – subgroup 4 (breast cancer).
Таблица 2. Содержание маркеров нетоза (citH3 и МПО:Аг) у онкогинекологических пациенток через 14 дней после оперативного лечения по сравнению с контрольной группой.
Table 2. NETosis markers (citH3 and MPO:Ag) level in female cancer patients 14 days after surgical treatment compared with control group.
|
Показатель Parameter |
Подгруппы онкогинекологических пациенток Subgroups of female cancer patients n = 69 |
Контрольная группа Control group n = 33 |
Значимость отличий (р) онкогинекологических подгрупп от контрольной группы Significance of difference (p) between female cancer subgroups and control group |
||||||
|
1 n = 25 |
2 n = 11 |
3 n = 17 |
4 n = 16 |
1 |
2 |
3 |
4 |
||
|
Концентрация сitH3 до начала терапии, нг/мл, M ± SD сitH3 level before therapy, ng/ml, M ± SD min–max |
2,64 ± 0,68 1,2–4,0 |
3,95 ± 5,83 1,2–21,4 |
2,45 ± 0,52 1,2–3,1 |
0,61 ± 0,44 0,2–2,1 |
0,33 ± 0,13 0,14–0,60 |
0,0001 |
0,0001 |
0,0001 |
0,0003 |
|
Концентрация MПО:Аг до начала терапии, нг/мл, M ± SD MPO:Ag level before therapy, ng/ml, M ± SD min–max |
29,48 ± 11,42 11,42–49,00 |
11,37 ± 1,76 8,6–14,2 |
39,27 ± 6,84 9,0–300,3 |
6,04 ± 2,29 3,4–11,6 |
2,45 ± 0,20 2,2–2,8 |
0,0001 |
0,0001 |
0,0001 |
0,0001 |
Примечание: citH3 – цитруллинированный гистон Н3; МПО:Аг – антиген миелопероксидазы; 1 – подгруппа 1 (рак тела матки); 2 – подгруппа 2 (рак яичников); 3 – подгруппа 3 (рак шейки матки); 4 – подгруппа 4 (рак молочной железы).
Note: citH3 – citrullinated histone H3; MPO:Ag – myeloperoxidase antigen; 1 – subgroup 1 (uterine body cancer); 2 – subgroup 2 (ovarian cancer); 3 – subgroup 3 (cervical cancer); 4 – subgroup 4 (breast cancer).
Таблица 3. Содержание маркеров нетоза (citH3 и МРО:Аг) у онкогинекологических пациенток через 14 дней после второго курса химиотерапии по сравнению с контрольной группой.
Table 3. NETosis markers (citH3 and MPO:Ag) level in female cancer patients 14 days after the second course of chemotherapy compared with control group.
|
Показатель Parameter |
Подгруппы онкогинекологических пациенток Subgroups of female cancer patients n = 42 |
Контрольная группа Control group n = 33 |
Значимость отличий (р) онкогинекологических подгрупп от контрольной группы Significance of difference (p) between female cancer subgroups and control group |
||
|
1 n = 25 |
4 n = 17 |
1 |
4 |
||
|
Концентрация сitH3 до начала терапии, нг/мл, M ± SD сitH3 level before therapy, ng/ml, M ± SD min–max |
2,87 ± 0,98 2,0–5,1 |
1,85 ± 1,35 0,1–5,4 |
0,33 ± 0,13 0,14–0,60 |
0,0001 |
0,0001 |
|
Концентрация MПО:Аг до начала терапии, нг/мл, M ± SD MPO:Ag level before therapy, ng/ml, M ± SD min–max |
22,5 ± 6,58 15,0–39,2 |
13,26 ± 4,24 9,0–22,1 |
2,45 ± 0,20 2,2–2,8 |
0,0001 |
0,0001 |
Примечание: citH3 – цитруллинированный гистон Н3; МПО:Аг – антиген миелопероксидазы; 1 – подгруппа 1 (рак тела матки); 4 – подгруппа 4 (рак молочной железы).
Note: citH3 – citrullinated histone H3; MPO:Ag – myeloperoxidase antigen; 1 – subgroup 1 (uterine body cancer); 4 – subgroup 4 (breast cancer).
Таблица 4. Содержание маркеров нетоза (citH3 и МПО:Аг) у онкогинекологических пациенток до и через 14 дней после оперативного лечения.
Table 4. NETosis markers (citH3 and MPO:Ag) level in female cancer patients before surgery and 14 days afterwards.
|
Показатель Parameter |
Онкогинекологические пациентки Female cancer patients n = 69 |
Значимость отличий (р) от контрольной группы Significance of difference (p) compared with control group |
|
|
до операции before surgery |
после операции after surgery |
||
|
Концентрация сitH3 нг/мл, M ± SD сitH3 level, ng/ml, M ± SD min–max |
2,09 ± 1,05 0,32–3,50 |
2,05 ± 1,00 0,2–21,4 |
0,0209 |
|
Концентрация MПО:Аг, нг/мл, M ± SD MPO:Ag level, ng/ml, M ± SD min–max |
20,30 ± 13,06 3,4–51,0 |
19,50 ± 12,37 3,4–300,3 |
0,0714 |
Примечание: citH3 – цитруллинированный гистон Н3; МПО:Аг – антиген миелопероксидазы.
Note: citH3 – citrullinated histone H3; MPO:Ag – myeloperoxidase antigen.
Таблица 5. Содержание маркеров нетоза (citH3 и МПО:Аг) у онкогинекологических пациенток до начала первого и через 14 дней после второго курса химиотерапии.
Table 5. NETosis markers (citH3 and MPO:Ag) level in female cancer patients before chemotherapy and 14 days after its second course.
|
Показатель Parameter |
Онкогинекологические пациентки Female cancer patients n = 42 |
Значимость отличий (р) от контрольной группы Significance of difference (p) compared with control group |
|
|
до химиотерапии before chemotherapy |
после химиотерапии after chemotherapy |
||
|
Концентрация сitH3 нг/мл, M ± SD сitH3 level, ng/ml, M ± SD min–max |
1,23 ± 0,71 0,05–2,80 |
2,46 ± 1,24 0,1–5,4 |
0,0001 |
|
Концентрация MПО:Аг, нг/мл, M ± SD MPO:Ag level, ng/ml, M ± SD min–max |
10,02 ± 4,36 3,9–21,5 |
18,76 ± 7,31 9,0–39,2 |
0,0001 |
Примечание: citH3 – цитруллинированный гистон Н3; МПО:Аг – антиген миелопероксидазы.
Note: citH3 – citrullinated histone H3; MPO:Ag – myeloperoxidase antigen.
Обсуждение / Discussion
Результаты проведенного исследования в очередной раз демонстрируют провоспалительный статус онкологических пациенток. Полученные данные до начала терапии выявили во всех подгруппах повышенные показатели маркеров нетоза.
Ряд стимулов может запускать процесс образования NETs. Стимуляция нейтрофилов различными агентами приводит к фосфорилированию НАДФН- оксидазы протеинкиназой С. Повышенная активность НАДФН-оксидазы приводит к образованию АФК и PAD4-зависимому цитруллинированию гистонов, что ведет к деконденсации хроматина, распаду ядерной мембраны и образованию NETs. В нетозе активное участие принимает пептидил-аргинин деиминаза 4 (англ. peptidyl-arginine deiminase 4, PAD4), которая способствует цитруллинированию гистонов. Пептидил-аргинин деиминазы представляют собой семейство ферментов, которые катализируют превращение остатков аргинина в остатки цитрулина Са2+-зависимым образом [23]. Это преобразование приводит к потере заряда белка и называется цитруллинированием [24]. У людей было обнаружено 5 изотипов PAD (PAD1–4 и PAD6) с тканеспецифической экспрессией изотипов [25]. Из существующих изотипов PAD4 обнаруживается в основном в лейкоцитах; это единственный изотип, который находится в ядре, и подавление PAD4 предотвращает цитруллинирование гистона H3 и образование NETs [26]. Мыши, лишенные PAD4, неспособны к деконденсации хроматина или формированию NETs и защищены от тромбоза [27].
В одном из исследований изучалась роль PAD4 в развитии гиперкоагуляции на фоне химиотерапии и повышенной концентрации вкДНК [28]. Было показано, что химиотерапия при раке легких на основе платины индуцирует высвобождение вкДНК, что приводит к увеличению образования тромбина у мышей PAD4+/+. Более того, увеличение концентрации вкДНК и тромбина зависело от PAD4, поскольку химиотерапия не влияла ни на концентрацию вкДНК, ни на образование тромбина у мышей PAD4–/–. Все эти данные свидетельствуют о том, что химиотерапия на основе платины способна вызывать прокоагулянтные эффекты через нетоз у здоровых мышей в течение 24 часов после начала лечения. Нейтрофилы и ранее были идентифицированы как источник индуцированной химиотерапией вкДНК [3]. Xимиотерапия на основе платины индуцирует высвобождение вкДНК из нейтрофилов, а не из опухолевых клеток при раке легких или других клеток-хозяев, таких как эндотелиальные клетки или моноциты [29]. Индуцированное химиотерапией высвобождение вкДНК из нейтрофилов происходит путем нетоза, а не апоптоза или некроза [3]. Нетоз представляет собой PAD4- зависимый процесс, поскольку гистоны нейтрофилов подвергаются цитруллинированию с помощью PAD4 с последующей деконденсацией хроматина [30]. Терапия ДНКазой снижала образование тромбина в плазме мышей PAD4+/+, получавших химиотерапию, но не PAD4–/–, что говорит о том, что химиотерапия на основе платины вызывает прокоагулянтные эффекты посредством высвобождения вкДНК зависимым от PAD4 образом [28]. Опухоль создает среду, которая предрасполагает нейтрофилы к высвобождению вкДНК. Недавние исследования показали, что опухоль-ассоциированные нейтрофилы запускают нетоз под воздействием гранулоцитарного колониестимулирующего фактора (granulocyte colony-stimulating factor, G-CSF). После повторного запуска нетоза на фоне химиотерапии праймированные нейтрофилы с большей вероятностью подвергаются нетозу по сравнению с нейтрофилами, которые не подвергались воздействию G-CSF [6]. М. Demers с соавт. также демонстрируют, что прогрессирование опухоли (рак молочной железы) связано с повышением уровня G-CSF, нейтрофилов и вкДНК в плазме [6].
Деградация NETs осуществляется ДНКазой 1, поскольку антитела к ДНКазе 1 подавляют деградацию NETs [31]. Однако использование физиологических концентраций ДНКазы I недостаточно для достижения полной деградации NETs. Помимо нее играет роль и активное поглощение NETs макрофагами путем фагоцитоза [32]. Химиотерапия не влияет на концентрацию и активность ДНКазы у пациентов при раке молочной железы [33]; вкДНК, как известно, способствует развитию прокоагулянтного состояния за счет нарушения процессов фибринолиза [34][35]. В эксперименте одновременная обработка сгустков крови ДНКазой и тканевым активатором плазминогена (англ. tissue plasminogen activator, tPA) была наиболее эффективной для лизиса, что позволяет предположить, что NETs могут служить каркасом для образования сгустка [36].
В нашем исследовании у 42 пациенток, госпитализированных для проведения химиотерапии, исходно не было выявлено различий в концентрациях маркеров нетоза по сравнению с пациентками, планирующими оперативное вмешательство. Однако далее, через 14 дней после второго курса паклитаксел-содержащей химиотерапии в подгруппе «рак молочной железы» и паклитаксел/карбоплатин-содержащей терапии в подгруппе «рак яичников» рост маркеров нетоза оказался достоверно более выраженным, чем у 69 пациенток через 14 дней после оперативного вмешательства.
Отличительной чертой опухолевой клетки является быстрое и неконтролируемое клеточное деление. Таким образом, принцип действия многих классических химиотерапевтических средств заключается в воздействии на процесс клеточного деления быстро делящихся клеток, оставляя неповрежденными покоя- щиеся клетки. Чаще всего это достигается за счет использования препаратов, способных вызывать «повреждение» ДНК, приводящее к остановке клеточного цикла и впоследствии к апоптозу.
Первоначально выделенный из коры западного тиса, паклитаксел и родственные таксаны были идентифицированы как многообещающие средства для лечения рака благодаря их способности ингибировать пролиферацию. Паклитаксел оказывает противоопухолевое действие за счет стабилизации тубулина (микротрубочек), что приводит к ингибированию их разборки [37]. Микротрубочки представляют собой полимеры цитоскелета, которые играют роль в формировании цитоскелета клеток, их транспорте, подвижности и делении [38]. Стабилизация микротрубочек достигается преимущественным связыванием паклитаксела с β-тубулином [39], что приводит к остановке митоза и индукции апоптоза в пролиферирующих клетках [40]. Было обнаружено, что таксаны обладают противоопухолевой активностью в отношении многочисленных типов опухолей, включая рак молочной железы, яичников, головного мозга и легких [41].
Карбоплатин является производным цисплатина и таким образом имеет аналогичный механизм действия связывания ДНК, ингибирования репликации ДНК и индукции гибели клеток. Как и цисплатин, карбоплатин проходит стадии внутриклеточного гидролиза до образования межцепочечных и внутрицепочечных поперечных связей ДНК. В отличие от своего предшественника цисплатина, карбоплатин обладает меньшей эффективностью, но и меньшим количеством побочных эффектов, что объясняется более низкой скоростью образования аддукта платина-ДНК [42]. Из-за меньшего количества побочных эффектов карбоплатин можно вводить в более высоких дозах.
Нейтрофилы ранее ассоциировались с плохой реакцией на блокаду контрольных точек иммунотерапии. Недавние результаты исследований показали, что нетоз является возможным механизмом такого сопротивления [22]. При аденокарциноме поджелудочной железы Y. Zhang с соавт. определили, что нейтрофилы, активированные интерлейкином-17 (англ. interleukin-17, IL-17), подвергаются нетозу и защищают опухолевые клетки от CD8+ T-клеток. Исследователи обнаружили, что блокада IL-17 повышает чувствительность опухоли к терапии [43].
А. Teijeira с соавт. обнаружили, что агонисты хемокиновых рецепторов CXCR1 и CXCR2 индуцируют нетоз и защищают опухолевые клетки от иммунной цитотоксичности. In vitro исследования продемонстрировали, что NETs обволакивают опухолевые клетки, физически препятствующих контакту с CD8+ Т-клетками и естественными киллерами. Обработка ДНКазой 1 восстанавливала контакт эффектор-мишень и приводила к уничтожению опухолевых клеток [44].
Пять компонентов NETs описаны как участники формирования резистентности к терапии рака: эластаза нейтрофилов, ММП-9 и катепсин G, а также лиганд рецептора программируемой клеточной гибели 1 (англ. programmed cell death ligand 1, PD-L1) и молекула карциноэмбрионального антигена клеточной адгезии 1 (англ. carcinoembryonic antigen cell adhesion molecule 1, CEACAM1) [7].
Эластаза нейтрофилов представляет собой сериновую протеазу, которая находится в азурофильных гранулах, потенцирует антимикробную активность нейтрофилов и высвобождается во внеклеточное пространство при дегрануляции и нетозе [7]. По результатам исследований, эластаза нейтрофилов может способствовать развитию резистентности к терапии, способствуя эпителиально-мезенхимальному переходу (ЭМП) [45]. При ЭМП клетка переходит в мезенхимальный фенотип с большой миграционной и антиапоптотической способностью [46].
MMP-9 представляет собой белок нейтрофилов, который, как известно, способствует прогрессии рака через внеклеточный матрикс (ВКМ) [47]. Кроме того, недавние исследования показали, что с MMP-9 связана и химиорезистентность опухоли. Н. Gao с соавт. при распространенном первичном раке желудка обнаружили, что положительная экспрессия MMP-9 и связанная с ней деградация ВКМ сопутствовали плохому ответу на химиотерапию [48]. Одним из механизмов влияния ММР-9 является ангиогенез, который, как известно, усложняет лечение рака за счет формирования аномальной сосудистой сети опухоли и торможения диффузии химиотерапевтических агентов [49].
CEACAM1 представляет собой трансмембранный гликопротеин, принадлежащий к семейству белков раково-эмбрионального антигена (англ. carcinoembryonic antigen, СЕА), которые участвуют в прогрессии рака и активации нейтрофилов [50]. CEACAM1 из NETs способствует прометастатическому NET-зависимому влиянию, усиливая адгезию и миграцию опухолевых клеток [50]. CEACAM1 также способствует истощению пула Т-клеток [51].
Противоопухолевая активность Т-клеток регулируется мембраным рецептором PD-1, который может способствовать истощению пула Т-клеток при взаимодействии со своим лигандом PDL-1 [51]. Истощение Т-клеток, в свою очередь, является хорошо описанным механизмом прогрессирования рака и резистентности к иммунотерапии [52]. NETs играют большую роль в истощении Т-клеток и формировании резистентности к иммунотерапии, и NETs-зависимое истощение пула Т-клеток устранялось путем использования ДНКазы [53].
Таким образом, результаты исследования, демонстрирующие достоверно более выраженный рост концентрации NETs у пациенток после химиотерапии по сравнению с пациентками после оперативного лечения, могут явиться основой для формирования гипотезы о том, что нетоз – это один из процессов, лежащих в основе протромботического состояния при проведении химиотерапии, а также возможная причина неэффективности и резистентности к терапии.
Заключение / Conclusion
Нетоз является особым механизмом биологии нейтрофилов, и его значение в клинической онкологии находится на старте изучения.
Химиотерапия является важнейшим компонентом противоопухолевой терапии, поэтому разработка новых стратегий для снижения осложнений, резистентности и повышения эффективности имеет жизненно важное значение. Учитывая вероятность того, что NETs вносят вклад в протромботический потенциал химиотерапии, а также способствуют развитию резистентности к химиотерапии, необходимо рассмотреть целесообразность мониторинга нетоза на фоне лечения с целью прогнозирования и возможного улучшения в будущем ответа на терапию, а также снижения частоты осложнений.
Как клинические, так и фундаментальные научные данные, изложенные в этой статье, подтверждают необходимость дальнейшего изучения NETs-зависимых взаимодействий, способствующих, с одной стороны, развитию протромботических состояний при химиотерапии и раке, а с другой, позволяющих новообразованиям сопротивляться различным видам терапии.
Список литературы
1. van Es N., Sturk A., Middeldorp S., Nieuwland R. Effects of cancer on platelets. Semin Oncol. 2014;41(3):311–8. https://doi.org/10.1053/j.seminoncol.2014.04.015.
2. Thaler J., Pabinger I., Sperr W.R., Ay C. Clinical evidence for a link between microparticle-associated tissue factor activity and overt disseminated intravascular coagulation in patients with acute myelocytic leukemia. Thromb Res. 2014;133(3):303–5. https://doi.org/10.1016/j.thromres.2013.12.029.
3. Swystun L.L., Mukherjee S., Liaw P.C. Breast cancer chemotherapy induces the release of cell-free DNA, a novel procoagulant stimulus. J Thromb Haemost. 2011;9(11):2313–21. https://doi.org/10.1111/j.1538-7836.2011.04465.x.
4. Schwarzenbach H., Hoon D.S., Pantel K. Cell-free nucleic acids as biomarkers in cancer patients. Nat Rev Cancer. 2011;11(6):426–37. https://doi.org/10.1038/nrc3066.
5. Lee Y.J., Yoon K.-A., Han J.-Y. et al. Circulating cell-free DNA in plasma of never smokers with advanced lung adenocarcinoma receiving gefitinib or standard chemotherapy as first-line therapy circulating DNA in prognosis of advanced NSCLC. Clin Cancer Res. 2011;17(15):5179–87. https://doi.org/10.1158/1078-0432.CCR-11-0400.
6. Demers M., Krause D.S., Schatzberg D. et al. Cancers predispose neutrophils to release extracellular DNA traps that contribute to cancerassociated thrombosis. Proc Natl Acad Sci U S A. 2012;109(32):13076– 81. https://doi.org/10.1073/pnas.1200419109.
7. Cools-Lartigue J., Spicer J., Najmeh S., Ferri L. Neutrophil extracellular traps in cancer progression. Cell Mol Life Sci. 2014;71(21):4179–94. https://doi.org/10.1007/s00018-014-1683-3.
8. Holdenrieder S., Stieber P., von Pawel J. et al. Circulating nucleosomes predict the response to chemotherapy in patients with advanced non–small cell lung cancer. Clin Cancer Res. 2004;10(18 Pt):5981–7. https://doi.org/10.1158/1078-0432.CCR-04-0625.
9. Fuchs T.A., Kremer Hovinga J.A., Schatzberg D. et al. Circulating DNA and myeloperoxidase indicate disease activity in patients with thrombotic microangiopathies. Blood. 2012;120(6):1157–64. https://doi.org/10.1182/blood-2012-02-412197.
10. Coussens L.M., Werb Z. Inflammation and cancer. Nature. 2002;420(6917):860–7. https://doi.org/10.1038/nature01322.
11. Gonzalez H., Hagerling C., Werb Z. Roles of the immune system in cancer: from tumor initiation to metastatic progression. Genes Dev. 2018;32(19– 20):1267–84. https://doi.org/10.1101/gad.314617.118.
12. Shaul M.E., Fridlender Z.G. Tumour-associated neutrophils in patients with cancer. Nat Rev Clin Oncol. 2019;16(10):601–20. https://doi.org/10.1038/s41571-019-0222-4.
13. Burn G.L., Foti A., Marsman G. et al. The neutrophil. Immunity. 2021;54(7):1377–91. https://doi.org/10.1016/j.immuni.2021.06.006.
14. Papayannopoulos V. Neutrophil extracellular traps in immunity and disease. Nat Rev Immunol. 2018;18(2):134. https://doi.org/10.1038/nri.2017.105.
15. Huang H., Zhang H., Onuma A.E., Tsung A. Neutrophil elastase and neutrophil extracellular traps in the tumor microenvironment. Adv Exp Med Biol. 2020;1263:13–23. https://doi.org/10.1007/978-3-030-44518-8_2.
16. Garley M., Jabłońska E., Dąbrowska D. NETs in cancer. Tumor Biol. 2016;37(11):14355–61. https://doi.org/10.1007/s13277-016-5328-z.
17. Bianchi M., Niemiec M.J., Siler U. et al. Restoration of anti-Aspergillus defense by neutrophil extracellular traps in human chronic granulomatous disease after gene therapy is calprotectin-dependent. J Allergy Clin Immunol. 2011;127(5):1243–52.e7. https://doi.org/10.1016/j.jaci.2011.01.021.
18. Wang S., Li Y., Xing C. et al. Tumor microenvironment in chemoresistance, metastasis and immunotherapy of pancreatic cancer. Am J Cancer Res. 2020;10(7):1937–53.
19. Hedrick C.C., Malanchi I. Neutrophils in cancer: heterogeneous and multifaceted. Nat Rev Immunol. 2022;22(3):173–87. https://doi.org/10.1038/s41577-021-00571-6.
20. Kan M., Imaoka H., Watanabe K. et al. Chemotherapy-induced neutropenia as a prognostic factor in patients with pancreatic cancer treated with gemcitabine plus nab-paclitaxel: a retrospective cohort study. Cancer Chemother Pharmacol. 2020;86(2):203–10. https://doi.org/10.1007/s00280-020-04110-3.
21. Kasi P.M., Grothey A. Chemotherapy-induced neutropenia as a prognostic and predictive marker of outcomes in solid-tumor patients. Drugs. 2018;78(7):737–45. https://doi.org/10.1007/s40265-018-0909-3
22. Zhang Y., Guoqiang L., Sun M., Lu X. Targeting and exploitation of tumorassociated neutrophils to enhance immunotherapy and drug delivery for cancer treatment. Cancer Biol Med. 2020;17(1):32–43. https://doi.org/10.20892/j.issn.2095-3941.2019.0372.
23. Vossenaar E.R., Zendman A.J., van Venrooij W.J., Pruijn G.J. PAD, a growing family of citrullinating enzymes: genes, features and involvement in disease. Bioessays. 2003;25(11):1106–18. https://doi.org/10.1002/bies.10357.
24. Hensen S.M., Pruijn G.J. Methods for the detection of peptidylarginine deiminase (PAD) activity and protein citrullination. Mol Cel Proteomics. 2014;13(2):388–96. https://doi.org/10.1074/mcp.R113.033746.
25. van Beers J.J., Zendman A.J., Raijmakers R. et al. Peptidylarginine deiminase expression and activity in PAD2 knock-out and PAD4-low mice. Biochimie. 2013;95(2):299–308. https://doi.org/10.1016/j.biochi.2012.09.029.
26. Lewis H.D., Liddle J., Coote J.E. et al. Inhibition of PAD4 activity is sufficient to disrupt mouse and human NET formation. Nat Chem Biol. 2015;11(3):189–91. https://doi.org/10.1038/nchembio.1735.
27. Martinod K., Demers M., Fuchs T.A. et al. Neutrophil histone modification by peptidylarginine deiminase 4 is critical for deep vein thrombosis in mice. Proc Natl Acad Sci U S A. 2013;110(21):8674–9. https://doi.org/10.1073/pnas.1301059110.
28. Lysov Z., Dwivedi D.J., Gould T.J., Liaw P.C. Procoagulant effects of lung cancer chemotherapy: impact on microparticles and cell-free DNA. Blood Coagul Fibrinolysis. 2017;28(1):72–82. https://doi.org/10.1097/MBC.0000000000000546.
29. Lysov Z., Swystun L.L., Kuruvilla S. et al. Lung cancer chemotherapy agents increase procoagulant activity via protein disulfide isomerasedependent tissue factor decryption. Blood Coagul Fibrinolysis. 2015;26(1):36–45. https://doi.org/10.1097/MBC.0000000000000145.
30. Wang H.-J., Huang H., Chuang Y.-C., Huang H.-C. Paclitaxel induces up-regulation of tissue factor in human aortic endothelial cells. Int Immunopharmacol. 2009;9(1):144–7. https://doi.org/10.1016/j.intimp.2008.10.003.
31. Hakkim A., Fürnrohr B.G., Amann K. et al. Impairment of neutrophil extracellular trap degradation is associated with lupus nephritis. Proc Natl Acad Sci U S A. 2010;107(21):9813–18. https://doi.org/10.1073/pnas.0909927107.
32. Farrera C., Fadeel B. Macrophage clearance of neutrophil extracellular traps is a silent process. J Immunol. 2013;191(5):2647–56. https://doi.org/10.4049/jimmunol.1300436
33. Stoetzer O.J., Fersching D.M., Salat C. et al. Prediction of response to neoadjuvant chemotherapy in breast cancer patients by circulating apoptotic biomarkers nucleosomes, DNAse, cytokeratin-18 fragments and survivin. Cancer Lett. 2013;336(1):140–8. https://doi.org/10.1016/j.canlet.2013.04.013.
34. Longstaff C., Varjú I., Sótonyi P. et al. Mechanical stability and fibrinolytic resistance of clots containing fibrin, DNA, and histones. J Biol Chem. 2013;288(10):6946–56. https://doi.org/10.1074/jbc.M112.404301.
35. Varjú I., Longstaff C., Szabó L. et al. DNA, histones and neutrophil extracellular traps exert anti-fibrinolytic effects in a plasma environment. Thromb Haemost. 2015;113(6):1289–98. https://doi.org/10.1160/TH14-08-0669.
36. Fuchs T.A., Brill A., Duerschmied D. et al. Extracellular DNA traps promote thrombosis. Proc Natl Acad Sci U S A. 2010;107(36):15880–5. https://doi.org/10.1073/pnas.1005743107.
37. Schiff P.B., Fant J., Horwitz S.B. Promotion of microtubule assembly in vitro by taxol. Nature. 1979;277(5698):665–7. https://doi.org/10.1038/277665a0.
38. Nogales E., Grayer Wolf S., Khan I.A. et al. Structure of tubulin at 6.5 Å and location of the taxol-binding site. Nature. 1995;375(6530):424–7. https://doi.org/10.1038/375424a0.
39. Nogales E. Structural insights into microtubule function. Annu Rev Biochem. 2000;69:277–302. https://doi.org/10.1146/annurev.biochem.69.1.277.
40. Schiff P.B., Horwitz S.B. Taxol stabilizes microtubules in mouse fibroblast cells. Proc Natl Acad Sci U S A. 1980;77(3):1561–5. https://doi.org/10.1073/pnas.77.3.1561.
41. Marupudi N.I., Han J.E., Li K.W. et al. Paclitaxel: a review of adverse toxicities and novel delivery strategies. Expert Opin Drug Saf. 2007;6(5):609–21. https://doi.org/10.1517/14740338.6.5.609.
42. Knox R.J., Friedlos F., Lydall D.A., Roberts J.J. Mechanism of cytotoxicity of anticancer platinum drugs: evidence that cis-diamminedichloroplatinum (II) and cis-diammine-(1,1-cyclobutanedicarboxylato) platinum (II) differ only in the kinetics of their interaction with DNA. Cancer Res.1986;46(4 Pt):1972–9.
43. Zhang Y., Chandra V., Riquelme Sanchez E. et al. Interleukin-17-induced neutrophil extracellular traps mediate resistance to checkpoint blockade in pancreatic cancer. J Exp Med. 2020;217(12):e20190354. https://doi.org/10.1084/jem.20190354.
44. Teijeira Á., Garasa S., Gato M. et al. CXCR1 and CXCR2 chemokine receptor agonists produced by tumors induce neutrophil extracellular traps that interfere with immune cytotoxicity. Immunity. 2020;52(5):856– 71.e8. https://doi.org/10.1016/j.immuni.2020.03.001.
45. Zhu T., Zou X., Yang C. et al. Neutrophil extracellular traps promote gastric cancer metastasis by inducing epithelial-mesenchymal transition. Int J Mol Med. 2021;48(1):127. https://doi.org/10.3892/ijmm.2021.4960.
46. Ribatti D., Tamma R., Annese T. Epithelial-mesenchymal transition in cancer: a historical overview. Trans Oncol. 2020;13(6):100773. https://doi.org/10.1016/j.tranon.2020.100773.
47. Cabral-Pacheco G.A., Garza-Veloz I., Castruita-De la Rosa C. et al. The roles of matrix metalloproteinases and their inhibitors in human diseases. Int J Mol Sci. 2020;21(24):9739. https://doi.org/10.3390/ijms21249739.
48. Gao H., Lan X., Li S., Xue Y. Relationships of MMP-9, E-cadherin, and VEGF expression with clinicopathological features and response to chemosensitivity in gastric cancer. Tumor Biol. 2017;39(5):1010428317698368. https://doi.org/10.1177/1010428317698368.
49. Viallard C., Larrivée B. Tumor angiogenesis and vascular normalization: alternative therapeutic targets. Angiogenesis. 2017;20(4):409–26. https://doi.org/10.1007/s10456-017-9562-9.
50. Rayes R.F., Vourtzoumis P., Rjeily M.B. et al. Neutrophil extracellular trapassociated CEACAM1 as a putative therapeutic target to prevent metastatic progression of colon carcinoma. J Immunol. 2020;204:(8)2285–94. https://doi.org/10.4049/jimmunol.1900240.
51. Wherry E.J. T cell exhaustion. Nat Immunol. 2011;12(6):492–9. https://doi.org/10.1038/ni.2035.
52. Jiang W., He Y., He W. et al. Exhausted CD8+ T cells in the tumor immune microenvironment: new pathways to therapy. Front Immunol. 2021;11:622509. https://doi.org/10.3389/fimmu.2020.622509.
53. Kaltenmeier C., Yazdani H.O., Morder K. et al. Neutrophil extracellular traps promote T cell exhaustion in the tumor microenvironment. Front Immunol. 2021;12:785222. https://doi.org/10.3389/fimmu.2021.785222.
Об авторах
Е. В. СлуханчукРоссия
Слуханчук Екатерина Викторовна – к.м.н., доцент кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
В. О. Бицадзе
Россия
Бицадзе Виктория Омаровна – д.м.н., профессор РАН, профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 6506003478.
Researcher ID: F-8409-2017.
А. Г. Солопова
Россия
Солопова Антонина Григорьевна – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 6505479504.
Researcher ID: Q-1385-2015
Д. Х. Хизроева
Россия
Хизроева Джамиля Хизриевна – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 57194547147.
Researcher ID: F-8384-2017
Ж.-К. Гри
Россия
Гри Жан-Кристоф – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова Ф Сеченовского университета; профессор гематологии, зав. лабораторией гематологии факультета биологических и фармацевтических наук Университета Монпелье и Университетской больницы Нима, Франция; иностранный член РАН
Scopus Author ID: 7005114260.
Researcher ID: AAA-2923-2019
И. Элалами
Россия
Элалами Исмаил – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова Сеченовского Университета,; профессор медицинского Университета Сорбонны; директор гематологии Центра Тромбозов, Госпиталь Тенон
Scopus Author ID: 7003652413.
Researcher ID: AAC-9695-2019
Н. Д. Дегтярева
Россия
Дегтярева Наталья Дмитриевна – студент 5-го курса Клинического института детского здоровья имени Н.Ф. Филатова
М. А. Гилева
Россия
Гилева Мария Алексеевна – клинический ординатор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
Н. В. Самбурова
Россия
Самбурова Наталья Викторовна – к.м.н., доцент кафедры патофизиологии Института биодизайна и моделирования сложных систем
Scopus Author ID: 57208129705
Д. В. Щербаков
Россия
Щербаков Денис Викторович – к.м.н., доцент кафедры общей гигиены института общественного здоровья имени Ф.Ф. Эрисмана
Ф. Э. Якубова
Россия
Якубова Фидан Эльчин кызы – клинический ординатор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
М. Е. Зелепухина
Россия
Зелепухина Мария Евгеньевна – студент 5-го курса Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Д. В. Блинов
Россия
Блинов Дмитрий Владиславович – к.м.н., ассистент кафедры спортивной медицины и медицинской реабилитации Института клинической медицины имени Н.В. Склифосовского Сеченовского Университета; руководитель по медицинским и научным вопросам, Институт Превентивной и Социальной Медицины; доцент кафедры спортивной, физической и реабилитационной медицины АНО ДПО «Московский медико-социальный институт имени Ф.П. Гааза»
Scopus Author ID: 6701744871.
Researcher ID: E-8906-2017
А. Д. Макацария
Россия
Макацария Александр Давидович – д.м.н., профессор, академик РАН, зав. кафедрой акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова Сеченовского Университета; вице-президент Российского общества акушеров-гинекологов (РОАГ); Заслуженный врач Российской Федерации; Почетный профессор Венского Университета
Scopus Author ID: 57222220144.
Researcher ID: M-5660-2016
Рецензия
Для цитирования:
Слуханчук Е.В., Бицадзе В.О., Солопова А.Г., Хизроева Д.Х., Гри Ж., Элалами И., Дегтярева Н.Д., Гилева М.А., Самбурова Н.В., Щербаков Д.В., Якубова Ф.Э., Зелепухина М.Е., Блинов Д.В., Макацария А.Д. Маркеры внеклеточных ловушек нейтрофилов у женщин со злокачественными новообразованиями репродуктивной системы, получавших хирургическое лечение и адъювантную терапию. Акушерство, Гинекология и Репродукция. 2023;17(4):420-432. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.432
For citation:
Slukhanchuk E.V., Bitsadze V.O., Solopova A.G., Khizroeva J.Kh., Gris J., Elalamy I., Degtyareva N.D., Gileva M.A., Samburova N.V., Shcherbakov D.V., Yakubova F.E., Zelepukhina M.E., Blinov D.V., Makatsariya A.D. Neutrophil extracellular traps-associated markers in malignant neoplasms of the female reproductive system after surgical treatment and adjuvant chemotherapy. Obstetrics, Gynecology and Reproduction. 2023;17(4):420-432. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.432

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































