Перейти к:
Современный взгляд на роль микробиома женского репродуктивного тракта в исходах ЭКО
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.433
Аннотация
Введение. В последнее десятилетие знания о микробиоме женского репродуктивного тракта были существенно расширены благодаря высокопроизводительному секвенированию 16S рибосомальной РНК (рРНК). Однако сведения о роли микробиома в исходах экстракорпорального оплодотворения (ЭКО) являются немногочисленными и противоречивыми.
Цель: проанализировать литературные данные для оценки влияния микробиома влагалища, матки и яичников на результаты ЭКО.
Материалы и методы. Обзор выполнен на основании публикаций в базах данных PubМed/MEDLINE, EBSCO, ResearchGate, Google Academy и еLibrary за последние 20 лет. Поиск проводили по ключевым словам и словосочетаниям на русском и английском языках: «микробиом влагалища», «микробиом цервикального канала», «микробиом матки», «микробиом яичников», «микробиом фолликулов», «ЭКО», «невынашивание», «выкидыш», «неудачи имплантации», «снижение овариального резерва», «инфламмасома», «vaginal microbiome», «cervical microbiome», «uterine microbiome», «ovarian microbiome», «microbiome of ovarian follicles», «IVF», «miscarriage», «early pregnancy loss», «implantation failure», «ovarian failure», «inflammasome». В обзор были включены только полнотекстовые оригинальные статьи и обзоры, опубликованные в рецензируемых журналах. Критериями исключения были: исследования с количеством менее 10 наблюдений в каждой группе, тезисы конференций, исследования микробиома мужского репродуктивного тракта. Дублирующиеся публикации были исключены. Отбор проводился независимо двумя соавторами, в случае несовпадения оценок привлекались два других соавтора.
Результаты. Даны характеристики микробиомов влагалища, матки и яичников, представлена их классификация, описаны особенности микробиомов при неудачах имплантации и невынашивании беременности после ЭКО. Установлено, что снижение общего количества лактобактерий и увеличение доли L. jensenii, G. vaginalis и Proteobacteria во влагалищном микробиоме являются предикторами неудач имплантации. Также неудачи ЭКО ассоциированы с присутствием в просвете матки Atopobium, Bifidobacterium, Chryseobacterium, Gardnerella, Streptococcus, Haemophilus, Staphylococcus, Brevundimonas и Ralstonia, а в ткани эндометрия – Bifidobacterium, Gardnerella и Klebsiella. Доминирование лактобактерий в микробиоме матки, напротив, оказывает благоприятный эффект. Колонизация фолликула любыми микроорганизмами, а также наличие в фолликулярной жидкости триметиламин-N-оксида (ТМАО), являющегося метаболитом анаэробных бактерий, ассоциированных с бактериальным вагинозом, также ухудшает результаты ЭКО.
Кроме этого, установлена роль инфекционного фактора в снижении овариального резерва. Активация инфламмасомы NLRP3 (англ. NLR Family Pyrin Domain Containing 3) лигандами микроорганизмов стимулирует синтез провоспалительных цитокинов и способствует снижению количества фолликулов. Блокировка NLRP3 в экспериментах на мышах может отсрочить истощение пула фолликулов и привести к увеличению фертильности.
Заключение. Благоприятные исходы ЭКО ассоциированы с преобладанием лактобактерий в микробиоме влагалища и эндометрия, а также с отсутствием микроорганизмов в фолликулярной жидкости. Наличие ТМАО в фолликулярной жидкости, а также активация инфламмасомы NLRP3 являются отрицательными предикторами исходов ЭКО.
Ключевые слова
Для цитирования:
Турсунова Н.Б., Лебедева О.П., Алтухова О.Б., Нагорный А.В. Современный взгляд на роль микробиома женского репродуктивного тракта в исходах ЭКО. Акушерство, Гинекология и Репродукция. 2023;17(4):512-525. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.433
For citation:
Tursunova N.B., Lebedeva O.P., Altukhova O.B., Nagorny A.V. An updated view on the role of the female reproductive tract microbiome in IVF outcomes. Obstetrics, Gynecology and Reproduction. 2023;17(4):512-525. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.433
Введение / Introduction
Бесплодие представляет собой серьезную клиническую проблему в промышленно развитых странах, в том числе в Российской Федерации (РФ). По данным ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России, в нашей стране частота бесплодных пар составляет 15 %, а в некоторых регионах цифра достигает 18–20 % [1]. Статистика РФ схожа с общемировой, где бесплодием страдают около 12 % пар [2]. В развитии женского бесплодия большую роль играет наличие инфекционного процесса, что приводит к хроническому эндометриту и непроходимости маточных труб [3].
В значительной степени проблему с бесплодием решает экстракорпоральное оплодотворение (ЭКО). По данным Российской ассоциации репродукции человека (РАРЧ), в России к беременности приводят около 35 % программ ЭКО [4].
Эффективность ЭКО зависит от многих факторов: возраста женщины, длительности бесплодия в паре, количества ранее проведенных программ, овариального резерва пациентки и качества сперматозоидов партнера, а также от состава микробиома.
Известно, что микробиом половых путей пациенток с бесплодием существенно отличается от здоровых женщин. Состав микробиома динамичен и подвержен влиянию различных факторов: возраста женщины, фазы менструального цикла, изменений уровней половых и других гормонов, способа контрацепции, приема лекарственных препаратов [5][6].
Важно отметить, что данные о микробиоценозе женских половых путей могут быть получены несколькими способами. Основными считаются методы бактериологического исследования, основанные на культивировании бактерий, а также технологии на основе молекулярного секвенирования, выявляющие совокупность генов микроорганизмов [7].
Значительная часть известных на сегодняшний день работ, описывающих микробиоценоз человека, основана только на культуральных методах исследования. Однако многие микроорганизмы, преимущественно анаэробные бактерии, не могут быть идентифицированы с использованием данного метода из-за медленного роста и необходимости создания ан- аэробной среды. Это приводит к недооценке разно- образия состава микробиома женских половых путей.
Секвенирование 16S рибосомальной РНК (16S рРНК) основано на анализе консервативных генов, имеющихся у всех прокариот. Этот метод является более точным и позволяет быстро и полно определить качественный и количественный состав микробиома. Для него необязательно наличие живых мик- роорганизмов в исследуемом образце, что предъявляет меньше требований к хранению и транспортировке материала [8].
Роль микроорганизмов как экзогенного, так и эндогенного происхождения в исходах ЭКО недооценена из-за ограниченного количества публикаций, посвященных этой теме [9]. В связи с этим данный обзор обобщает информацию о составе микробиоты женских половых путей и ее влиянии на исходы циклов ЭКО. Также представляет интерес роль факторов местного иммунитета, распознающих консервативные структуры бактерий микробиома, в патогенезе неудач имплантации и самопроизвольных выкидышей ранних сроков.
Цель: проанализировать литературные данные для оценки влияния микробиома влагалища, матки и яичников на результаты ЭКО.
Материалы и методы / Materials and Methods
Выполнен систематический обзор литературы с использованием подхода PRISMA [10], посвященный взаимосвязям микробиомов влагалища, матки и яичников, а также ряда факторов местного иммунитета с исходами ЭКО. Поиск литературы осуществлен в поисковых базах данных PubМed/MEDLINE, EBSCO, ResearchGate, Google Academy и еLibrary за последние 20 лет. Поиск проводили по ключевым словам и словосочетаниям на русском и английском языках: «микробиом влагалища», «микробиом цервикального канала», «микробиом матки», «микробиом яичников», «микробиом фолликулов», «ЭКО», «невынашивание», «выкидыш», «неудачи имплантации», «снижение овариального резерва», «инфламмасома», «vaginal microbiome», «cervical microbiome», «uterine microbiome», «ovarian microbiome», «microbiome of ovarian follicles», «IVF», «miscarriage», «early pregnancy loss», «implantation failure», «ovarian failure», «inflammasome». В обзор были включены только полнотекстовые оригинальные статьи и обзоры, опубликованные в рецензируемых журналах. Критериями исключения были: исследования с количеством менее 10 наблюдений в каждой группе, тезисы конференций, исследования микробиома мужского репродуктивного тракта. Дублирующиеся публикации были исключены (рис. 1). Отбор проводился независимо двумя соавторами, в случае несовпадения оценок привлекались два других соавтора.

Результаты и обсуждение / Results and Discussion
Влияние микробиома влагалища на исходы ЭКО / Vaginal microbiome affecting IVF outcomes
В 2011 г. было проведено знаменательное исследование J. Ravel с соавт. [11], которое явилось основополагающим для дальнейшего изучения микробиома женских половых путей. Суть данного исследования заключалась в характеристике микробного состава влагалища у здоровых женщин репродуктивного возраста с помощью технологии высокопроизводительного секвенирования. Участие в нем принимали пациентки четырех разных этнических групп, не страдающие заболеваниями женской репродуктивной системы. В ходе данной работы было установлено, что можно выделить 5 типов влагалищного микробиома (англ. community state types, CSTs) в зависимости от преобладания спе- цифических бактерий. Так, в 4 типах из 5 (CST I, CST II, CST III, CST V) преобладают виды Lactobacillus spp. (L. crispatus, L. gasseri, L. iners, L. jensenii соответственно) [11]. Микробиом, в котором преобладают лактобактерии (за исключением L. iners), обладает протективным действием, препятствуя заражению инфекциями, передаваемыми половым путем [12]. В настоящее время доказано, что снижение бактериального разнообразия в сочетании с доминированием Lactobacillus связано с меньшим числом воспалительных заболеваний органов малого таза у женщин [13].
Для четвертого типа микробиома (CST IV), состоящего преимущественно из облигатных анаэробов, выявлена связь с риском заражения половыми инфекциями [14, 15], ВИЧ-инфекцией [16], развитием бесплодия, невынашивания беременности и преждевременных родов [6][17].
В 2020 г. те же авторы расширили классификацию микробиома влагалища, разделив CST I и CST II на подтипы A и B в зависимости от количества преобладающих видов лактобактерий, а CST IV – на подтипы A, B и С в зависимости от преобладания Candidatus Lachnocurva vaginae (Bacterial Vaginosis-Associated Bacterium-1, BVAB1), G. vaginalis или других микроорганизмов соответственно [18]. Известно, что тип влагалищного микробиома как до беременности, так и на ранних сроках может отличаться у пациенток разных этносов, что следует учитывать при проведении многоцентровых исследований [19][20].
Доминирование Lactobacillus у большинства здоровых женщин репродуктивного возраста обеспечивает протективный эффект за счет того, что лактобактерии вырабатывают вещества бактерицидного характера [13]. Молочная кислота, выделяемая ими в качестве побочного продукта ферментации, значительно снижает pH (до 3,5–4,0), тем самым способствуя подавлению роста патогенных микроорганизмов. Помимо молочной кислоты, бактерии рода Lactobacillus также продуцируют бактериоцины, представляющие собой белковые соединения, которые способны уничтожать чужеродные микроорганизмы, что достигается путем повышения проницаемости мембран у клеток-мишеней. Однако Lactobacillus доминирует только на протяжении репродуктивного возраста, когда в достаточных количествах вырабатываются эстрогены, которые стимулируют выработку и накопление гликогена, необходимого для роста Lactobacillus и колонизации вагинального эпителия [17].
Процедура ЭКО – многоступенчатая, и ее успех зависит от многих факторов, в том числе от состояния микробиома. Еще 20 лет назад при исследовании мик- робиоты нижних отделов женских половых путей было установлено, что отсутствие роста патогенных микроорганизмов на культуральных средах у пациенток, которым было проведено ЭКО, было ассоциировано с высокой частотой наступления беременности (85,7 %), в то время как при выявлении E. faecalis, U. urealyticum и M. hominis беременность наступила только в 7,5 % случаев [21].
При анализе влагалищного микробиома методом 16S рРНК секвенирования было установлено, что его состав может влиять на исходы ЭКО [22]. В крупном исследовании R. Koedooder с соавт. (2019) было показано, что снижение общего количества лактобактерий менее 20 %, увеличение L. jensenii более 30 %, наличие G. vaginalis и Proteobacteria в количестве более 28 % ассоциировалось с неблагоприятными исходами ЭКО, в частности, с частотой наступления беременности менее 6 % [23].
Снижение количества лактобактерий и более высокое микробное α-разнообразие было связано и с рецидивирующими неудачами имплантации (англ. recurrent implantation failure, RIF) после переноса эмбрионов с нормальной морфологией [24][25].
Влияние микробиома матки на исходы ЭКО / Uterine microbiome affecting IVF outcomes
Микробиом верхних отделов половых путей изучен меньше, чем микробиом влагалища, однако и на данный момент существует ряд исследований, в которых детально описан его состав [17, 26].С помощью метода полимеразной цепной реакции (ПЦР) было показано, что количество бактерий в эндометрии значительно ниже, чем в вагинальных пробах [26].
Несмотря на достаточно большое количество работ, описывающих микробиом матки, многие из них являются противоречивыми. Это связано с тем, что в большинстве из них микробиом оценивали у женщин, которые не являлись здоровыми. Так, J.M. Franasiak с соавт. (2015) исследовали микробиом пациенток с бесплодием, поступивших для проведения ЭКО [7]. В ряде исследований оценивали микробиом матки после гистерэктомии [27–31] или гистероскопии [30, 32]. С учетом того, что показаниями для проведения данных операций являются миома матки, аденомиоз, гиперплазия эндометрия и другие состояния, причиной которых является абсолютная или относительная гиперэстрогения, которая, в свою очередь, может влиять на состав микробиома, полученные результаты нельзя считать нормой. Кроме того, данные состояния встречаются чаще всего у женщин позднего репродуктивного возраста, уже имеющих экстрагенитальные заболевания, которые также могут повлиять на спектр выявляемых микроорганизмов. Наше мнение разделяют и другие авторы [33]. В случае гистероскопии нельзя исключить контаминацию образцов микробиотой из влагалища и цервикального канала [34].
Существует только несколько работ, в которых был изучен микробиом матки у здоровых женщин репродуктивного возраста. Сбор материала проводили с помощью стерильного катетера. Было установлено, что у здоровых женщин в эндометрии доминируют Lactobacillus spp., а другими распространенными видами являются Gardnerella, Bifidobacterium, Streptococcus и Prevotella [35][36]. Было предложено классифицировать микробиом эндометрия в зависимости от преобладания лактобактерий: микробиом с преобладанием лактобактерий (Lactobacillus-dominated, LD) в случае, когда более 90 % бактерий принадлежат к Lactobacillus spp., и микробиом без преобладания Lactobacillus (non-Lactobacillus-dominated, NLD), где менее 90 % бактерий принадлежат к Lactobacillus spp., а более 10 % являются представителями других семейств микроорганизмов [35].
Влияние микробиома матки на репродуктивный потенциал женщин также остается открытым. Существует ряд работ, в которых оценивали влияние микробиома матки на результаты вспомогательных репродуктивных технологий (ВРТ).
J.M. Franasiak с соавт. (2016) при исследовании микробиома, полученного с поверхности катетера после переноса эмбриона, не выявили достоверных различий между группой пациенток, у которых беременность в дальнейшем прогрессировала, и женщин с неудачами имплантации [37].
I. Moreno с соавт. (2016) установили, что пациентки, у которых в полости матки до переноса эмбриона не доминировали лактобактерии, имели достоверно более низкую частоту имплантаций и живорождений, однако частота самопроизвольных выкидышей у них достоверно не отличалась от женщин с микробиомом, в котором преобладали лактобактерии [35]. Однако К. Kyono с соавт. (2019) не выявили достоверных различий в частоте наступления беременности и частоте самопроизвольных выкидышей после ЭКО у пациенток, в микробиоме которых доминировали лактобактерии, и пациенток без доминирования лактобактерий [36].
В крупном многоцентровом исследовании (n = 342), включавшем в себя пациенток из Европы, Азии и Америки, обследованных перед процедурой ЭКО, было установлено, что лактобактерии являются доминирующими микроорганизмами как в просвете полости матки, так и в ткани эндометрия [38]. Бактерии родов Streptomyces, Clostridium и Chryseobacterium выявлялись только в просвете полости матки, в то время как исключительно в ткани эндометрия были обнаружены микроорганизмы родов Escherichia, Klebsiella, Bacillus, Cupriavidus, Finegoldia, Micrococcus и Tepidimonas. Наблюдалась отрицательная корреляционная связь между количеством лактобактерий в просвете полости матки и таких патогенных микроорганизмов, как Gardnerella, Bifidobacterium, Atopobium, Staphylococcus, Streptococcus и Chryseobacterium. В то же время лактобактерии имели положительную корреляционную связь с бактериями-комменсалами Clostridium и Streptomyces. Интересно, что в ткани эндометрия, полученной при биопсии, лактобактерии имели только отрицательные корреляционные связи с Gardnerella, Bifidobacterium и Atopobium. Таким образом, можно сделать вывод, что в присутствии лактобактерий наблюдается снижение количества патогенных микроорганизмов в полости матки.
В этом же исследовании была проведена оценка роли микробиома матки в результатах ЭКО. Было установлено, что пациентки, родившие живых детей, достоверно чаще имеют микробиом, в котором доминируют лактобациллы. Неудачи имплантации были ассоциированы с присутствием в просвете матки Atopobium, Bifidobacterium, Chryseobacterium, Gardnerella и Streptococcus, а в ткани эндометрия – Bifidobacterium, Gardnerella и Klebsiella в количествах, превышающих верхний доверительный интервал. У пациенток с самопроизвольными выкидышами в просвете матки наблюдалось достоверное увеличение бактерий родов Haemophilus и Staphylococcus.
В работе В.В. Бариновой с соавт. (2021) у пациенток с многократными неудачами имплантации в анамнезе было выявлено большее разнообразие микробиома матки и достоверно более высокие концентрации Methylobacterium aerolatum, Comamonas testosteroni, а также присутствие Streptococcus spp. и Gardnerella vaginalis по сравнению с группой здоровых пациенток без отягощенного анамнеза. У пациенток контрольной группы были выявлены достоверно более высокие концентрации Lactobacillus iners, Lactobacillus acidophilus, Lactobacillus jensenii, Lactobacillus crispatus, Prevotella melaninogenica, Bacteroides vulgatus, Corynebacterium bouchesdurhonense, Bacteroide scaccae, Bifidobacterium gallinarum, Bifidobacterium adolescentis [39].
В следующей работе та же группа авторов в качестве контрольной группы взяла только пациенток, у которых в анамнезе были нормальные срочные роды. Интересно, что при таком дизайне исследования доля лактобацилл в основной и контрольной группах достоверно не отличалась, а у пациенток с неудачами имплантации наблюдалось увеличение доли бактерий родов Brevundimonas и Ralstonia [40].
В новом исследовании K. Vomstein с соавт. (2022) исследовали микробиом эндометрия у небеременных женщин с привычным невынашиванием (n = 20), повторными неудачами имплантации эмбриона (n = 20) и пациенток контрольной группы, у которых беременности в анамнезе отсутствовали (n = 10) в течение всего менструального цикла. Отсутствие контаминации подтверждали с помощью сравнения влагалищного микробиома и микробиома, полученного из полости матки. Было установлено, что у здоровых женщин репродуктивного возраста лактобактерии доминируют в фолликулярную фазу менструального цикла, но при этом их количество увеличивается во время овуляции и в лютеиновую фазу менструального цикла. Proteobacteria также в большом количестве выявлялись в первую фазу цикла, но их количество достоверно снижалось после овуляции [41].
У пациенток с привычным невынашиванием количество бактерий типа Firmicutes было выше в фолликулярную фазу, затем достоверно увеличиваясь в лютеиновую фазу. Это увеличение сопровождалось увеличением числа Proteobacteria в лютеиновую фазу. У пациенток с повторными неудачами имплантации наблюдалось увеличение разнообразия, высокое содержание Proteobacteria с одновременным снижением Firmicutes по сравнению со здоровыми пациентками и женщинами с привычным невынашиванием беременности. В фолликулярную фазу у них отмечалось более высокое содержание Bacteroidetes по сравнению с контрольной группой, в то время как у здоровых пациенток достоверно чаще превалировали Acinetobacteria. На более низких таксономических уровнях у здоровых пациенток достоверно чаще преобладали бактерии семейства Lactobacillales, в то время как у пациенток с привычными неудачами имплантации достоверно выше было количество бактерий родов Gardnerella и Dialister [41].
Влияние микробиома яичников на исходы ЭКО / Ovarian microbiome affecting IVF outcomes
Немногочисленные исследования фолликулярной жидкости показывают, что она имеет активный мик- робиом [7], однако точно не установлено, представляют выделенные бактерии истинную колонизацию или контаминацию фолликулярной жидкости яичников из нижних отделов репродуктивного тракта [42]. В связи с этим некоторые авторы предложили сравнивать бактерии, обнаруженные в фолликулярной жидкости, с бактериями в вагинальном секрете, взятом в то же время, и рассматривать идентичные виды как контаминацию [7].
E.S. Peltzer с соавт. (2011) культуральными методами провели исследование фолликулярной жидкости у 71 пациентки, поступивших для проведения ЭКО. Из них контрольную группу составили 18 здоровых женщин, у которых показанием для проведения ЭКО послужил мужской фактор бесплодия. Влагалищный секрет собирали с помощью тампона. Пункцию фолликула производили стерильной иглой трансвагинальным доступом. Микроорганизмы культивировали для их качественного обнаружения. Если бактерии обнаруживали только в фолликулярной жидкости, то это расценивали как колонизацию. Если же одни и те же микроорганизмы обнаруживали и во влагалище и фолликулярной жидкости, то данный факт расценивали как контаминацию. Бактерии были обнаружены во всех образцах: 37 колонизированных (в том числе у 12 фертильных женщин) и 34 контаминированных (в том числе у 6 фертильных женщин). Бактерии, колонизирующие фолликулярную жидкость, включали Lactobacillus iners, Actinomyces spp., Corynebacterium aurimucosum, Fusobacterium spp., Peptoniphilus asaccharolyticus, Peptostreptococcus spp., представителей родов Propionibacterium и Prevotella, Staphylococcus spp., а также дрожжеподобные грибы Candida parapsilosis. У всех женщин, независимо от этиологии бесплодия, большее количество различных микроорганизмов выявлялось в левом фолликуле яичника [42].
Была произведена оценка состава микробиоты яичников здоровых женщин, которым ЭКО производили по причине мужского бесплодия, и пациенток с женским бесплодием с колонизированной или контаминированной фолликулярной жидкостью. И у фертильных и у бесплодных женщин с колонизированной фолликулярной жидкостью частота оплодотворения была значительно ниже (43 и 36 % соответственно) по сравнению с женщинами с контаминированной фолликулярной жидкостью (61 и 77 % соответственно). Бесплодные женщины с колонизированной фолликулярной жидкостью также имели более низкую частоту наступления беременности после переноса свежих эмбрионов (29 %) по сравнению с женщинами с контаминированной фолликулярной жидкостью (59 %). Авторы предполагают, что это может быть результатом повреждения ооцита in vivo после контакта с бактериями или продуктами бактериального метаболизма [42].
Известно, что совместное культивирование некоторых видов бактерий, колонизирующих фолликулярную жидкость человека in vivo, вызывает фрагментацию ДНК в ооцитах мыши после 12 ч инкубации in vitro, что позволяет предположить, что это один из механизмов, влияющих на качество ооцитов и/или эмбрионов, что приводит к ухудшению исходов ЭКО [43]. Если предположить, что микробная колонизация явилась результатом восходящей инфекции, то одним из возможных механизмов неудач имплантации у данных пациенток также может быть сдвиг баланса Т-хелперов (англ. Т-helper, Th) Th1/Th2 в сторону Th1 в результате действия микробных эндотоксинов грамотрицательных микроорганизмов на эндометрий [44][45].
Группой авторов под руководством E.S. Pelzer было установлено, что бактерии, выделенные из фолликулярной жидкости, способны персистировать до 28 нед на питательных средах in vitro, а добавление в данные среды эстрадиола и прогестерона стимулирует рост таких микроорганизмов, как Lactobacillus spp., Bifidobacterium spp., Streptococcus spp. и E. coli. Такие микроорганизмы фолликулярной жидкости, как Lactobacillus spp., Streptococcus spp. и Propionibacterium spp. были способны образовывать биопленки на питательных средах [46].
При неудачах имплантации выявили высокое содержание анаэробов в средах для культивирования. Данные анаэробные микроорганизмы не подвергались воздействию пенициллина, стрептомицина или гентамицина – противомикробных препаратов, традиционно включаемых в среды для культивирования эмбрионов, что в итоге приводило к неблагоприятным исходам [47]. В связи с этим необходимы дальнейшие исследования, чтобы установить оптимальное использование антибиотиков для повышения эффективности при циклах ЭКО. Наилучшей рекомендацией является минимизация риска заражения из внешних источников. Экзогенный путь загрязнения эмбрионов может быть вызван атмосферным воздухом на рабочем месте, микробиотой половых путей доноров или непреднамеренным введением микроорганизмов во время процедур in vitro [48]. Улучшение условий окружающей среды и качества воздуха было связано с общим положительным влиянием на клинические исходы (например, в одной клинике после соблюдения всех требований по стандарту качества воздуха, увеличились показатели живорождения, снизилась частота выкидышей) [49].
Анаэробные микроорганизмы, ассоциированные с бактериальным вагинозом, выделяют биогенные амины – кадаверин, путресцин и триметиламин [50]. Триметиламин-N-оксид (ТМАО) является продуктом метаболизма холина и L-карнитина, способствует активации путей воспалительного и окислительного стресса. Известно, что ТМАО вызывает воспаление сосудов, индуцируя формирование NLRP3 (англ. NLR Family Pyrin Domain Containing 3) инфламмасомы через сигнальный путь SIRT3-SOD2-mtROS [51]. Инфламмасомы – это макромолекулярные белковые комплексы, в состав которых входят активированные NOD-подобные рецепторы (англ. nucleotide-binding oligomerization domain-like receptors) [52]. Они способны длительно существовать в клетке, активируя синтез каспаз и провоспалительных цитокинов, что в итоге приводит к особому типу программированной клеточной гибели – пироптозу. Известно, что инфламмасома NLRP3 влияет на овариальный резерв, о чем будет сказано ниже [53][54]. Поэтому исследование, анализирующее связь уровня ТМАО в фолликулярной жидкости человека с результатами ЭКО, представляет особый интерес с точки зрения патогенеза репродуктивных осложнений у пациенток с доминирующей анаэробной нелактобациллярной мик- рофлорой [55].
В работе, посвященной роли ТМАО в исходах ЭКО, было проанализированно 143 цикла у 111 пациенток, 42 из которых привели к имплантации эмбриона [56]. Уровни ТМАО и его предшественников (холина, L-карнитина и гамма-бутиробетаина) измеряли с помощью сверхвысокоэффективной жидкостной хроматографии. Уровни гамма-бутиробетаина и ТМАО были ниже в фолликулярной жидкости ооцитов, подвергшихся нормальному оплодотворению, по сравнению с ооцитами, не подвергшимися оплодотворению. Также, ТМАО и промежуточный гамма-бутиробетаин были значительно ниже в фолликулярной жидкости ооцитов, которые развились в эмбрионы более высокого качества, чем в фолликулярной жидкости, соответствующей эмбрионам более низкого качества. Значимых взаимосвязей между предшественниками ТМАО – холином или L-карнитином – и результатами процедур ЭКО не наблюдалось. Таким образом, сделан вывод, что TMAO присутствует в фолликулярной жидкости, и что его уровень может служить отрицательным прогностическим биомаркером качества эмбриона [48][49] (рис. 2).
Роль инфекционного фактора в снижении овариального резерва / Infections affecting lowered ovarian reserve
Снижение овариального резерва представляет собой одну из основных проблем, влияющих на результаты ЭКО [56]. Известно, что у пациенток с первичной недостаточностью яичников наблюдается увеличение количества Streptococcus spp. [57] и снижение количества лактобактерий в микробиоме влагалища [58]. Однако данные изменения могут быть не причиной, а следствием первичной недостаточности яичников в связи со снижением уровня эстрогенов. В этой связи представляют интерес экспериментальные работы на животных, позволяющие оценить роль микробного фактора в снижении овариального резерва.
Известно, что различные микроорганизмы содержат консервативные молекулы, которые способны активировать рецепторы системы врожденного иммунитета (толл-, NOD-подобные рецепторы, а также другие группы рецепторов) [59, 60]. В частности, активация NOD-подобных рецепторов приводит к образованию инфламмасом, синтезу провоспалительных цитокинов и клеточной гибели путем пироптоза.
Инфламмасомы – это цитоплазматический механизм защиты хозяина, активация которого влияет на инициацию сигнальных путей, обеспечивающих эффективный врожденный (неспецифический) иммунитет [61]. В последние годы растет интерес к инфламмасоме NLRP3, так как предполагается ее роль в процессе овуляции [62], а также воздействии на овариальный резерв [54, 63]. Активация данной инфламмасомы происходит в ответ на присутствие бактерий и их токсинов, вирусов, грибов, простейших, а также молекул, ассоциированных с повреждением тканей (англ. damage-associated molecular patterns, DAMPs), таких как АТФ, кристаллы мочевой кислоты и амилоид [64]. Результатом активации является синтез провоспалительных цитокинов – интерлейкинов (англ. interleukin, IL) IL-1β и IL-18.
NLRP3 экспрессируется в гранулезных клетках, цитоплазме яйцеклетки, а также в железистом эпителии матки. Его экспрессия возрастает с возрастом и имеет сильную обратную корреляционную связь с уровнем антимюллерова гормона [53]. В ряде работ было установлено, что у мышей, нокаутированных по NLRP3 или белку его сигнального пути ASC (англ. apoptosis-associated speck-like protein containing a CARD, апоптоз-ассоциированный Speck-подобный белок, содержащий CARD), ослабляется возрастное истощение пула фолликулов на всех стадиях развития мышей по сравнению с контрольной группой дикого типа [54][63].
В другом исследовании было показано, что у нокаутированных по NLRP3 мышей наблюдается более высокая продолжительность жизни, более высокий уровень антимюллерова гормона, большее количество фолликулов и большая частота овуляций по сравнению с мышами дикого типа [53]. Аналогичные изменения происходят у мышей дикого типа, которые длительно получают препарат MCC950, ингибирующий NLRP3 (рис. 3). Однако у мышей, нокаутированных по ASC, авторы не выявили различий вышеуказанных показателей с мышами дикого типа.
У нокаутированных по NLRP3 мышей также увеличивается скорость аутофагии. Стоит отметить, что аутофагия в яичниках сохраняет продолжительность жизни ооцитов за счет поддержания запаса женских половых клеток до образования примордиальных фолликулов [53]. Известно, что продолжительность жизни яичников можно улучшить путем увеличения скорости аутофагии [65]. В связи с этим ингибирование NLRP3 может быть ключом к увеличению продолжительности жизни фолликулов. Таким образом, блокировка инфламмасомы NLRP3 может отсрочить истощение пула фолликулов и привести к увеличению фертильности [54].

Рисунок 2. Микробиом женских половых путей, связанный с благоприятными исходами экстракорпорального оплодотворения [рисунок авторов].
Figure 2. Female genital tract microbiome associated with favorable in vitro fertilization outcomes [drawn by authors].
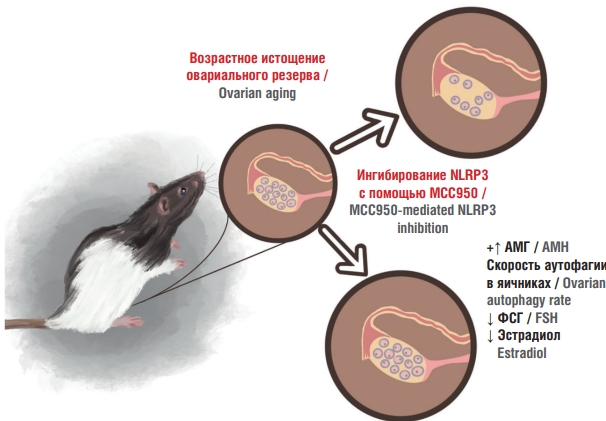
Рисунок 3. Эффекты, полученные вследствие прямого ингибирования NLRP3 с помощью фармакологического препарата MCC950 у диких мышей [рисунок авторов].
Примечание: АМГ – антимюллеров гормон; ФСГ – фолликулостимулирующий гормон; NLRP3 – инфламмасома NLRP3 (NLR Family Pyrin Domain Containing 3); МСС950 – соединение, содержащее диарилсульфонилмочевину (прямой ингибитор инфламмасомы NLRP3).
Figure 3. Effects of NLRP3 inhibition by pharmacological drug MCC950 in wild mice [drawn by authors].
Note: AMH – anti-Mullerian hormone; FSH – follicle stimulating hormone; NLRP3 – NLRP3 inflammasome (NLR Family Pyrin Domain Containing 3); МСС950 – diarylsulfonylurea-containing compound (direct inhibitor of NLRP3 inflammasome).
Заключение / Conclusion
На основании приведенных данных можно сделать вывод, что высокий показатель успешности беременности часто связан с микроорганизмами рода Lactobacillus, находящихся в вагинальном, цервикальном, маточном микробиоме и в микробиоме фолликулярной жидкости. Частота успешной имплантации, беременности и живорождения была выше у женщин, у которых во всех указанных нишах доминировали лактобактерии.
Микробный состав эндометрия до сих пор является открытым вопросом, и его влияние на исход оплодотворения остается малоизученным. Тем не менее существующие исследования показывают благотворное влияние Lactobacillus в эндометрии на исходы ЭКО.
Состав фолликулярной жидкости, возможно, играет основополагающую роль в исходах вспомогательных репродуктивных технологий. Следует минимизировать возможности контаминации и колонизации фолликулярной жидкости, так как это коррелирует с неблагоприятными исходами ЭКО. Женщинам с повторными неудачными циклами ЭКО может быть полезен микробный скрининг вагинальных мазков перед началом цикла ЭКО для выявления аномальной вагинальной флоры или посев фолликулярной жидкости, собранной во время трансвагинального извлечения ооцитов, на наличие микроорганизмов. Лечение противомикробными препаратами может улучшить исходы ЭКО. Роль ТМАО и его предшественников в циклах ЭКО требует дальнейшего тщательного изучения, так как его присутствие может снижать качество ооцитов и быть отрицательным предиктором исходов ЭКО.
Истощение овариального резерва из-за активации инфламмасомы NLRP3 является важным открытием. Использование препаратов, блокирующих NLRP3, может привести к увеличению репродуктивного возраста. Необходимы дальнейшие исследования, чтобы определить, существует ли причинно-следственная связь между воспалением и истощением пула фолликулов по мере старения женщин. Тем не менее опубликованные исследования позволяют предположить, что инфламмасома NLRP3 является потенциально новой терапевтической мишенью для лечения бесплодия.
Список литературы
1. Мороцкая А.В. Молекулярные факторы рецептивности эндометрия. Журнал акушерства и женских болезней. 2017;66(S):128–9.
2. Ombelet W. WHO fact sheet on infertility gives hope to millions of infertile couples worldwide. Facts Views Vis Obgyn. 2020;12(4):249–51.
3. Guerri G., Maniscalchi T., Barati S. et al. Non-syndromic monogenic female infertility. Acta Biomed. 2019;90(10–S):68–74. https://doi.org/10.23750/abm.v90i10-S.8763.
4. Корсак В.С., Смирнова А.А., Шурыгина О.В. Регистр ВРТ Российской ассоциации репродукции человека. Отчет за 2017 год. Проблемы репродукции. 2019;25(6):9-21. https://doi.org/10.17116/repro2019250619.
5. Козлова А.А., Николаева А.В., Припутневич Т.В. и др. Микробиом влагалища женщины во время беременности и в послеродовом периоде: динамика, взаимосвязь с кишечной микрофлорой, влияние на становление микробиоты новорожденного. Акушерство и гинекология. Новости. Мнения. Обучение. 2021;9(4):71–8. https://doi.org/10.33029/2303-96982021-9-4-71-78.
6. Лебедева О.П., Грязнова М.В., Козаренко О.Н. и др. Микробиом влагалища при нарушениях менструального цикла (обзор). Научные результаты биомедицинских исследований. 2021;7(4):433–50. https://doi.org/10.18413/2658-6533-2021-7-4-0-9.
7. Franasiak J.M., Scott R.T. Reproductive tract microbiome in assisted reproductive technologies. Fertil Steril. 2015;104(6):1364–71. https://doi.org/10.1016/j.fertnstert.2015.10.012.
8. Cason C., D’Accolti M., Soffritti I. et al. Next-generation sequencing and PCR technologies in monitoring the hospital microbiome and its drug resistance. Front Microbiol. 2022;13:969863. https://doi.org/10.3389/fmicb.2022.969863.
9. Боярский К.Ю., Кахиани Е.И. Микробиом репродуктивной системы человека. Проблемы репродукции. 2019;25(4):27–34. https://doi.org/10.17116/repro20192504127.
10. Moher D., Liberati A., Tetzlaff J. et al. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA Statement. PLoS Med. 2009;6(6):e1000097. https://doi.org/10.1371/journal.pmed1000097.
11. Ravel J., Gajer P., Abdo Z. et al. Vaginal microbiome of reproductive-age women. Proc Natl Acad Sci U S A. 2011;108 Suppl 1(Suppl 1):4680–7. https://doi.org/10.1073/pnas.1002611107.
12. Moosa Y., Kwon D., de Oliveira T., Wong E.B. Determinants of vaginal microbiota composition. Front Cell Infect Microbiol. 2020;10:467. https://doi.org/10.3389/fcimb.2020.00467.
13. Gupta P., Singh M.P., Goyal K. Diversity of vaginal microbiome in pregnancy: deciphering the obscurity. Front Public Health. 2020;8:326. https://doi.org/10.3389/fpubh.2020.00326.
14. Brotman R.M., Bradford L.L., Conrad M. et al. Association between Trichomonas vaginalis and vaginal bacterial community composition among reproductive-age women. Sex Transm Dis. 2012;39(10):807–12. https://doi.org/10.1097/OLQ.0b013e3182631c79.
15. Anahtar M.N., Byrne E.H., Doherty K.E. et al. Cervicovaginal bacteria are a major modulator of host inflammatory responses in the female genital tract. Immunity. 2015;42(5):965–76. https://doi.org/10.1016/j.immuni.2015.04.019.
16. Gosmann C., Anahtar M.N., Handley S.A. et al. Lactobacillus-deficient cervicovaginal bacterial communities are associated with increased HIV acquisition in young South African women. Immunity. 2017;46(1):29–37. https://doi.org/10.1016/j.immuni.2016.12.013.
17. Moreno I., Simon C. Deciphering the effect of reproductive tract microbiota on human reproduction. Reprod Med Biol. 2018;18(1):40–50. https://doi.org/10.1002/rmb2.12249.
18. France M.T., Ma B., Gajer P. et al. VALENCIA: a nearest centroid classification method for vaginal microbial communities based on composition. Microbiome. 2020;8(1):166. https://doi.org/10.1186/s40168-020-00934-6.
19. Gryaznova M., Lebedeva O., Kozarenko O. et al. Lower genital tract microbiome in early pregnancy in the Eastern European population. Microorganisms. 2022;10(12):2368. https://doi.org/10.3390/microorganisms10122368.
20. Lebedeva O.P., Popov V.N., Syromyatnikov M.Y. et al. Female reproductive tract microbiome and early miscarriages. APMIS. 2023;131(2):61–76. https://doi.org/10.1111/apm.13288.
21. Ricci S., De Giorgi S., Lazzeri E. et al. Impact of asymptomatic genital tract infections on in vitro Fertilization (IVF) outcome. PLoS One. 2018;13(11):e0207684. https://doi.org/10.1371/journal.pone.0207684.
22. Schoenmakers S., Laven J. The vaginal microbiome as a tool to predict IVF success. Curr Opin Obstet Gynecol. 2020;32(3):169–78. https://doi.org/10.1097/GCO.0000000000000626.
23. Koedooder R., Singer M., Schoenmakers S. et al. The vaginal microbiome as a predictor for outcome of in vitro fertilization with or without intracytoplasmic sperm injection: a prospective study. Hum Reprod. 2019;34(6):1042–54. https://doi.org/10.1093/humrep/dez065.
24. Fu M., Zhang X., Liang Y. et al. Alterations in vaginal microbiota and associated metabolome in women with recurrent implantation failure. mBio. 2020;11(3):e03242–19. https://doi.org/10.1128/mBio.03242-19.
25. Diaz-Martínez M.D.C., Bernabeu A., Lledó B. et al. Impact of the vaginal and endometrial microbiome pattern on assisted reproduction outcomes. J Clin Med. 2021;10(18):4063. https://doi.org/10.3390/jcm10184063.
26. Mitchell C.M., Haick A., Nkwopara E. et al. Colonization of the upper genital tract by vaginal bacterial species in nonpregnant women. Am J Obstet Gynecol. 2015;212(5):611.e1–9. https://doi.org/10.1016/j.ajog.2014.11.043.
27. Miles S.M., Hardy B.L., Merrell D.S. Investigation of the microbiota of the reproductive tract in women undergoing a total hysterectomy and bilateral salpingo-oopherectomy. Fertil Steril. 2017;107(3):813–820.e1. https://doi.org/10.1016/j.fertnstert.2016.11.028.
28. Chen C., Song X., Wei W. et al. The microbiota continuum along the female reproductive tract and its relation to uterine-related diseases. Nat Commun. 2017;8(1):875. https://doi.org/10.1038/s41467-017-00901-0.
29. Li F., Chen C., Wei W. et al. The metagenome of the female upper reproductive tract. Gigascience. 2018;7(10):giy107. https://doi.org/10.1093/gigascience/giy107.
30. Wee B. A., Thomas M., Sweeney E. L. et al. A retrospective pilot study to determine whether the reproductive tract microbiota differs between women with a history of infertility and fertile women. Aust N Z J Obstet Gynaecol. 2018;58(3):341–8. https://doi.org/10.1111/ajo.12754.
31. Winters A.D., Romero R., Gervasi M. T. et al. Does the endometrial cavity have a molecular microbial signature? Sci Rep. 2019;9(1):9905. https://doi.org/10.1038/s41598-019-46173-0.
32. Pelzer E.S., Willner D., Buttini M.et al. A role for the endometrial microbiome in dysfunctional menstrual bleeding. Antonie Van Leeuwenhoek. 2018;111(6):933–43. https://doi.org/10.1007/s10482-017-0992-6.
33. Verstraelen H., Vilchez-Vargas R., Desimpel F. et al. Characterisation of the human uterine microbiome in non-pregnant women through deep sequencing of the V1-2 region of the 16S rRNA gene. PeerJ. 2016;4:e1602. https://doi.org/10.7717/peerj.1602.
34. Baker J.M., Chase D.M., Herbst-Kralovetz M.M. Uterine microbiota: residents, tourists, or invaders? Front Immunol. 2018;9:208. https://doi.org/10.3389/fimmu.2018.00208.
35. Moreno I., Codoñer F. M., Vilella F. et al. Evidence that the endometrial microbiota has an effect on implantation success or failure. Am J Obstet Gynecol. 2016;215(6):684–703. https://doi.org/10.1016/j.ajog.2016.09.075.
36. Kyono K., Hashimoto T., Nagai Y. et al. Analysis of endometrial microbiota by 16S ribosomal RNA gene sequencing among infertile patients: a single-center pilot study. Reprod Med Biol. 2018;17(3):297–306. https://doi.org/10.1002/rmb2.12105.
37. Franasiak J.M., Werner M.D., Juneau C.R. et al. Endometrial microbiome at the time of embryo transfer: next-generation sequencing of the 16S ribosomal subunit. J Assist Reprod Genet. 2016;33(1):129–36. https://doi.org/10.1007/s10815-015-0614-z.
38. Moreno I., Garcia-Grau I., Perez-Villaroya D. et al. Endometrial microbiota composition is associated with reproductive outcome in infertile patients. Microbiome. 2022;10(1):1. https://doi.org/10.1186/s40168-021-01184-w.
39. Баринова В.В., Кузнецова Н.Б., Буштырева И.О. и др. Микробиом эндометрия у женщин с многократными неудачами экстракорпорального оплодотворения. Вопросы гинекологии, акушерства и перинатологии. 2021;20(3): 5–11. https://doi.org/10.20953/1726-1678-2021-3-5-11.
40. Баринова В.В., Кузнецова Н.Б., Буштырева И.О. и др. Микробиом эндометрия при многократных неудачах вспомогательных репродуктивных технологий и у здоровых женщин: где норма и где патология? Акушерство и гинекология. 2021;(6):105–14. https://doi.org/10.18565/aig.2021.6.105-114.
41. Vomstein K., Reider S., Böttcher B. et al. Uterine microbiota plasticity during the menstrual cycle: Differences between healthy controls and patients with recurrent miscarriage or implantation failure. J Reprod Immunol. 2022;151:103634. https://doi.org/10.1016/j.jri.2022.103634.
42. Pelzer E.S., Allan J.A., Cunningham K. et al. Microbial colonization of follicular fluid: alterations in cytokine expression and adverse assisted reproduction technology outcomes. Hum Reprod. 2011;26(7):1799–812. https://doi.org/10.1093/humrep/der108.
43. Pelzer E.S., Allan J.A., Waterhouse M.A. et al. Microorganisms within human follicular fluid: effects on IVF. PLoS One. 2013;8(3):e59062. https://doi.org/10.1371/journal.pone.0059062.
44. Borges E.D., Berteli T.S., Reis T.F. et al. Microbial contamination in assisted reproductive technology: source, prevalence, and cost. J Assist Reprod Genet. 2020;37(1):53–61. https://doi.org/10.1007/s10815-019-01640-5.
45. Peymani R., DeCherney A. Microbiome, infection and inflammation in infertility. In: Genital Infections and Infertility. Ed. A. Darwich. Intech Open, 2016. 99–133. https://doi.org/10.5772/63090.
46. Pelzer E.S., Allan J.A., Theodoropoulos C. et al. Hormone-dependent bacterial growth, persistence and biofilm formation – a pilot study investigating human follicular fluid collected during IVF cycles. PLoS One. 2012;7(12):e49965. https://doi.org/10.1371/journal.pone.0049965.
47. Swain J.E. Optimal human embryo culture. Semin Reprod Med. 2015;33(2):103–17. https://doi.org/10.1055/s-0035-1546423.
48. Maduka R., Osaikhuwuomwan J., Aziken M. The effect of bacterial colonization of the embryo transfer catheter on Outcome of In vitro Fertilization–Embryo transfer treatment. Afr J Med Health Sci. 2018;17(1):7–13. https://doi.org/10.5897/AJMHS.9000011.
49. Poletto K.Q., de Lima Y.A.R., Approbato M.S. Effect of the air filtration system replacement on embryo quality in the assisted reproduction laboratory. Rev Bras Ginecol Obstet. 2018;40(10):625–30. https://doi.org/10.1055/s-0038-1670715.
50. Ceccarani C., Foschi C., Parolin C. et al. Diversity of vaginal microbiome and metabolome during genital infections. Sci Rep. 2019;9(1):14095. https://doi.org/10.1038/s41598-019-50410-x.
51. Chen M.L., Zhu X.H., Ran L. et al. Trimethylamine-N-oxide induces vascular inflammation by activating the NLRP3 inflammasome through the SIRT3-SOD2-mtROS signaling pathway. J Am Heart Assoc. 2017;6(9):e006347. https://doi.org/10.1161/JAHA.117.006347.
52. Лебедева О.П. Роль рецепторов NOD1 и NOD2 в распознавании патогенов в женском репродуктивном тракте. Акушерство и гинекология. 2019;(5):25–9. https://doi.org/10.18565/aig.2019.5.25-29.
53. Navarro-Pando J.M., Alcocer-Gómez E., Castejón-Vega B. et al. Inhibition of the NLRP3 inflammasome prevents ovarian aging. Sci Adv. 2021;7(1):eabc7409. https://doi.org/10.1126/sciadv.abc7409.
54. Lliberos C., Liew S. H., Mansell A. et al. The inflammasome contributes to depletion of the ovarian reserve during aging in mice. Front Cell Dev Biol. 2021;8:628473. https://doi.org/10.3389/fcell.2020.628473.
55. Nagy R.A., Homminga I., Jia C. et al. Trimethylamine-N-oxide is present in human follicular fluid and is a negative predictor of. embryo quality. Hum Reprod. 2020;35(1):81–8. https://doi.org/10.1093/humrep/dez224.
56. Адамян Л.В., Пивазян Л.Г. Междисциплинарный подход и современное состояние вопроса о преждевременном старении яичников (обзор литературы). Проблемы репродукции. 2023;29(1):94-103. https://doi.org/10.17116/repro20232901194.
57. Wu J., Ning Y., Tan L. et al. Characteristics of the vaginal microbiome in women with premature ovarian insufficiency. J Ovarian Res. 2021;14(1):172. https://doi.org/10.1186/s13048021-00923-9.
58. Wang J., Xu J., Han Q., et al. Changes in the vaginal microbiota associated with primary ovarian failure. BMC Microbiol. 2020;20(1):230. https://doi.org/10.1186/s12866-020-01918-0.
59. Лебедева О.П., Кирко Р. Экспрессия толл-подобных рецепторов в женском репродуктивном тракте и ее гормональная регуляция (обзор). Научные результаты биомедицинских исследований. 2018;4(3):3–17. https://doi.org/10.18413/2313-8955-2018-4-3-0-1.
60. Лебедева О.П., Жукова И.О., Ивашова О. Н. и др. Роль рецепторов RIG-I, AIM2 и IFI16, распознающих вирусную ДНК и РНК, в патогенезе самопроизвольных выкидышей и неразвивающейся беременности ранних сроков. Акушерство и гинекология. 2018;(7):579–61. https://doi.org/10.18565/aig.2018.7.57-61.
61. Chernikov O.V., Moon J.S., Chen A. et al. Editorial: NLRP3 Inflammasome: regulatory mechanisms, role in health and disease and therapeutic potential. Front Immunol. 2021;12:765199. https://doi.org/10.3389/fimmu.2021.765199.
62. Zhang Z., Wang F., Zhang Y. Expression and contribution of NLRP3 inflammasome during the follicular development induced by PMSG. Front Cell Dev Biol. 2019;7:256. https://doi.org/10.3389/fcell.2019.00256.
63. Lliberos C., Liew S. H., Zareie P. et al. Evaluation of inflammation and follicle depletion during ovarian ageing in mice. Sci Rep. 2021;11(1):278. https://doi.org/10.1038/s41598-020-79488-4.
64. de Zoete M. R., Palm N. W., Zhu S. et al. Inflammasomes. Cold Spring Harb Perspect Biol. 2014;6(12):a016287. https://doi.org/10.1101/cshperspect.a016287.
65. Dou X., Sun Y., Li J. et al. Short-term rapamycin treatment increases ovarian lifespan in young and middle-aged female mice. Aging Cell. 2017;16(4):825–6. https://doi.org/10.1111/acel.12617.
Об авторах
Н. Б. ТурсуноваРоссия
Турсунова Нафиса Баходуровна – студент 6-го курса
308015 Белгород, ул. Победы, д. 85
О. П. Лебедева
Россия
Лебедева Ольга Петровна – д.м.н., доцент, профессор кафедры акушерства и гинекологии ФГАОУ ВО «Белгородский государственный национальный исследовательский университет»; ведущий научный сотрудник лаборатории метагеномики и пищевых биотехнологий ФГБОУ ВО «Воронежский государственный университет инженерных технологий»
Scopus Author ID: 55655876400
Researcher ID: E-59692015
308015 Белгород, ул. Победы, д. 85
394036 Воронеж, проспект Революции, д. 19
О. Б. Алтухова
Россия
Алтухова Оксана Борисовна – д.м.н., доцент, зав. кафедрой акушерства и гинекологии, ФГАОУ ВО «Белгородский государственный национальный исследовательский университет»; зав. отделением гинекологии ОГБУЗ «Белгородская областная клиническая больница Святителя Иоасафа»
Scopus Author ID: 57216900558
308015 Белгород, ул. Победы, д. 85
308000 Белгород, ул. Некрасова, д. 8/9
А. В. Нагорный
Россия
Нагорный Андрей Владимирович – к.м.н., начальник аккредитационно-симуляционного центра, доцент кафедры акушерства и гинекологии ФГАОУ ВО «Белгородский государственный национальный исследовательский университет»; врач акушер-гинеколог отделения гинекологии ОГБУЗ «Белгородская областная клиническая больница Святителя Иоасафа»
308015 Белгород, ул. Победы, д. 85
308000 Белгород, ул. Некрасова, д. 8/9
Рецензия
Для цитирования:
Турсунова Н.Б., Лебедева О.П., Алтухова О.Б., Нагорный А.В. Современный взгляд на роль микробиома женского репродуктивного тракта в исходах ЭКО. Акушерство, Гинекология и Репродукция. 2023;17(4):512-525. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.433
For citation:
Tursunova N.B., Lebedeva O.P., Altukhova O.B., Nagorny A.V. An updated view on the role of the female reproductive tract microbiome in IVF outcomes. Obstetrics, Gynecology and Reproduction. 2023;17(4):512-525. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.433

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































