Перейти к:
Оценка эффективности радонотерапии и модуляции стероидогенеза в экспериментальной модели хронического эндометрита
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.374
Аннотация
Цель: оценка терапевтической эффективности и модуляции стероидогенеза при применении радонотерапии в экспериментальной модели хронического эндометрита (ХЭ).
Материалы и методы. Изучался терапевтический эффект минеральных вод с содержанием радона 5,4–6,2 нКи/дмЗ. Формирование экспериментального эндометрита лабораторным крысам линии Wistar (n = 40) производилось аутокаловой взвесью. Животные опытной группы (n = 10) получали антибактериальную терапию препаратом цефтриаксон с третьих суток от начала эксперимента в течение 7 дней, а с 41-го дня – 10 процедур радонотерапии минеральной водой в виде ванн 1 раз в день, первая процедура длительностью 5 мин, вторая – 8 мин, третья – 10 мин, далее все процедуры по 15 мин. Животные группы сравнения I (n = 10) получали антибактериальную терапию, радонотерапию по вышеописанной схеме, а также пелоидотерапию природной соленасыщенной среднесульфидной иловой лечебной грязью по схеме, аналогичной радонотерапии. Крысы группы сравнения II (n = 10) получали антибактериальную и пелоидотерапию по схеме, аналогичной группе сравнения I. Крысы контрольной группы (n = 10) после моделирования экспериментального ХЭ лечения не получали. Выраженность признаков воспалительного процесса оценивали при гистологическом исследовании микропрепаратов эндометрия, уровни стероидных гормонов (прогестерон, эстрадиол) в венозной крови животных – методом иммуноферментного анализа.
Результаты. В эндометрии животных контрольной группы выявлялся диффузный инфильтрат плотностью 180,7 ± 9,0 иммунокомпетентных клеток, в опытной группе его плотность была ниже (на 30,7 % по отношению к контрольной группе; р = 0,002) и составила 125,4 ± 8,1 клеток, а в группе сравнения I плотность воспалительной инфильтрации оказалась минимальной (снижена на 88,7% в сравнении с контрольной группой; р < 0,001) и составила 20,5 ± 1,8 клеток. В опытной группе и в группах сравнения I и II определено статистически значимое повышение уровня прогестерона в крови после лечения в сравнении с контрольной группой (р = 0,008). При применении радонотерапии в опытной группе отмечалось более выраженное повышение уровня прогестерона в сравнении с применением пелоидотерапии в группе сравнения II. Под влиянием радоновой бальнеотерапии у лабораторных животных основной группы происходило значимое снижение уровня эстрадиола в сравнении с контрольной группой (р = 0,008) в отличие от групп сравнения I и II, где существенного изменения уровня эстрадиола по сравнению с группой контроля не наблюдалось.
Заключение. Радонотерапия обладает противовоспалительной эффективностью в условиях экспериментальной модели ХЭ. При сочетании с пелоидотерапией эффект потенцируется. Применение радоновой бальнеотерапии сопровождается значимым повышением уровня прогестерона и снижением содержания эстрадиола, что диктует необходимость проведения клинических исследований, которые позволили бы подтвердить ее эффективность у пациенток с репродуктивной дисфункцией, включая заболевания, сопровождающиеся гиперэстрогенией.
Для цитирования:
Чернова А.Е., Ремнева О.В., Бобров И.П., Лепилов А.В., Мазко О.Н., Макарова О.Г., Семенихина Н.М., Рожкова О.В., Гребцов И.В., Баранов Д.А., Антонова С.А., Баранова В.В. Оценка эффективности радонотерапии и модуляции стероидогенеза в экспериментальной модели хронического эндометрита. Акушерство, Гинекология и Репродукция. 2023;17(3):321-331. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.374
For citation:
Chernova A.E., Remneva O.V., Bobrov I.P., Lepilov A.V., Mazko O.N., Makarova O.G., Semenikhina N.M., Rozhkova O.V., Grebtsov I.V., Baranov D.A., Antonova S.A., Baranova V.V. Assessing radonotherapy effectiveness and modulated steroidogenesis in experimental chronic endometritis model. Obstetrics, Gynecology and Reproduction. 2023;17(3):321-331. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.374
Введение / Introduction
На сегодняшний день акцентуация роли прегравидарной (преконцепционной) подготовки входит в число ключевых задач акушерско-гинекологической службы. Доля супружеских пар, прошедших преконцепционную подготовку, в Российской Федерации составляет не более 4 % [1]. При этом даже в благоприятных для зачатия условиях фертилизация реализуется в беременность только в 30 % случаев, а невынашивание и бесплодие у пациенток репродуктивного возраста обеспечивают неутешительные демографические показатели [2].
Одними из ведущих причин инфертильности и репродуктивных потерь являются инфекционно-воспалительные и эндокринные факторы. Среди воспалительных заболеваний органов малого таза до 73 % случаев гистологически верифицируется хронический эндометрит (ХЭ), который выступает как этиологический фактор в случаях с привычными потерями беременности до 50 %, с нарушением репродуктивной функции – до 23 %, с неудачами вспомогательных репродуктивных технологий (ВРТ) – до 60 % [3–9]. В структуре эндокринных дисфункций недостаточность лютеиновой фазы, связанная с нарушениями секреции прогестерона желтым телом, рассматривается как значимый фактор бесплодия и ранних потерь беременности в естественном цикле и в рамках программ ВРТ. Известно, что в условиях дефицита прогестерона нарушаются адекватная имплантация, секреторная трансформация эндометрия и рост эмбриона [10–12]. На разработку эффективных и безопасных методов коррекции данных нарушений на сегодняшний день направлен вектор научного поиска акушерско-гинекологического сообщества [13–15].
Большой интерес в аспекте прегравидарной подготовки представляют природные физические факторы ввиду широкого арсенала клинических эффектов, доступности, безопасности и малоинвазивности данных методик. Широкое применение в практике нашла методика бальнеотерапии минерально-газовыми радоновыми водами благодаря иммуномодулирующему, противовоспалительному, дренажно-дезинтоксикационному действию, коррекции психоэмоциональных и вегетососудистых нарушений [16][17]. Указанные лечебные эффекты радоновой бальнеотерапии обусловлены наличием растворенного в минеральной воде радона (Rn) – инертного газа, распад которого сопровождается α-излучением. При бальнеопроцедуре через кожу в организм проникает не более 0,5 % радона и 1,5–2 % его дочерних продуктов, 60 % которых далее диффундируют в подлежащие ткани и кровеносное русло, что обусловливает высокую концентрацию продуктов ионизации в органах и тканях [18, 19]. Известна высокая результативность применения радонотерапии при гинекологических гормонозависимых заболеваниях, ассоциированных с гиперэстрогенией, благодаря модуляции гормонального гомеостаза [20], но научных работ по ее эффективности при хроническом воспалительном процессе эндометрия нами в доступной литературе не найдено.
Хронический эндометрит и нарушение стероидогенеза зачастую играют ключевую роль в этиопатогенезе невынашивания и репродуктивных потерь, что позволяет рассматривать терапевтические эффекты радонотерапии как перспективные для прегравидарной подготовки инфертильных пациенток. Ввиду недостатка актуальных литературных данных относительно указанного аспекта применения природных физических факторов нами было проведено экспериментальное исследование.
Цель: оценка терапевтической эффективности и модуляции стероидогенеза при применении радонотерапии в экспериментальной модели ХЭ.
Материалы и методы / Materials and Мethods
Дизайн исследования / Study design
В условиях экспериментальной модели ХЭ определяли противовоспалительное действие радонотерапии, проведенной по стандартным методикам; изучали влияние радонотерапии и комплексного лечения на содержание эстрадиола и прогестерона в крови лабораторных животных для оценки возможностей применения результатов исследования в клинической практике при прегравидарной подготовке пациенток с ХЭ.
В эксперименте изучали терапевтический эффект природного физического фактора – бальнеотерапии (радонотерапии). Использовалась слабоминерализованная (0,3 г/л) щелочная (рН = 9,2) сульфатно-гидрокарбонатно-натриевая минеральная вода с низким содержанием радона: радиоактивность 5,4–6,2 нКи/дм3 из источника – скважины № 4Э Белокурихинского месторождения (Алтайский край), температурой 38–40 °С. С учетом периода полураспада радона (3,8 сут) доставка минеральной воды из источника в виварий производилась каждые трое суток. В качестве сравнительной лечебной методики оценивали эффективность пелоидотерапии природной соленасыщенной среднесульфидной иловой лечебной грязи озера Мармышанское Романовского района Алтайского края температурой 38–40 °С.
Эксперимент проводили на самках лабораторных крыс линии Wistar (n = 40), возрастом 3 мес, массой тела 180–200 г. Животных содержали в стандартных условиях сертифицированного вивария ФГБОУ ВО АГМУ Минздрава России при температуре воздуха в помещении 20–22 °С со свободным доступом к пище и воде.
Этические аспекты / Ethical aspects
Исследование было одобрено Комитетом по этике при ФГБОУ ВО АГМУ Минздрава России, протокол № 9 от 28.10.2021. Эксперимент проводили в соответствии с директивами Европейской Конвенции о защите позвоночных животных, используемых в экспериментах или иных научных целых (Страсбург, 1986).
Моделирование хронического эндометрита / Chronic endometritis model
У всех крыс формировали экспериментальный ХЭ по следующей запатентованной методике: в маточный рог лабораторной крысы методом спринцевания вводили аутокаловую взвесь в объеме 0,1 мл [21]. Сбор аутокала лабораторных крыс производили перед началом эксперимента. Животные за сутки до сбора материала были ограничены в пище, но при этом имели свободный доступ к воде. После смешивания аутокала с физиологическим раствором в соотношении 1:10 полученный раствор дважды фильтровали через марлевый стерильный материал. Далее в полость маточного рога всех крыс методом спринцевания через маточный зонд вводили полученную смесь. На основании экспериментальных данных, ХЭ начинает формироваться не ранее чем через 40 дней после введения аутокаловой взвеси.
Группы животных / Аnimal groups
Животные были разделены на 4 группы: контрольная группа (n = 10), опытная группа (n = 10), группа сравнения I (n = 10), группа сравнения II (n = 10). С третьих суток после манипуляции моделирования ХЭ животные опытной группы и групп сравнения I, II начинали получать антибактериальную терапию препаратом широкого спектра действия (цефтриаксон) в соответствии с весом животного в течение 7 дней из расчета 20 мг на 1 кг массы в сутки – 0,4 мл внутримышечно при весе животного 200 г.
C 41-го дня после введения аутокаловой взвеси животные получали лечение с применением природных факторов по следующей схеме: крысы опытной группы получали радоновые ванны 1 раз в день, № 10; первая процедура длительностью 5 мин, вторая – 8 мин, третья – 10 мин, далее все процедуры по 15 мин. Крысы группы сравнения I получали ванны с минеральной водой и пелоидотерапию; в один день животные сначала получали радонотерапию по 1 процедуре в день (первая процедура длительностью 5 мин, вторая – 8 мин, третья – 10 мин, далее все процедуры по 15 мин), после чего проводили пелоидотерапию (через 2 ч после бальнеотерапии 1 раз в день в течение 10 мин); всего 10 процедур бальнеотерапии и пелоидотерапии на курс с проведением обеих процедур ежедневно. Крысы группы сравнения II получали только пелоидотерапию по схеме, аналогичной для группы сравнения I. Крысы контрольной группы после моделирования экспериментального ХЭ лечения не получали.
Методы исследования / Study methods
После окончания эксперимента проводили отбор крови из латеральной хвостовой вены у всех животных для исследования уровней эстрадиола и прогестерона, после чего под эфирным наркозом проводилась лапаротомия с гистерэктомией и краниоцервикальная декапитация.
Вырезку образцов гистологического материала производили на уровне тела матки (в области бифуркации) и в средней части правого и левого рога матки. Для подготовки к морфологическому исследованию полученные образцы в течение 24–48 ч фиксировали в 10 % нейтральном формалине, далее материал обрабатывали в автомате гистологической проводки Tissue-Tek VIP TM6 (Sakura, Япония), после – на станции парафиновой заливки Tissue-Tek TEC 5 (Sakura, Япония) с использованием парафина Histomix (BiOvitrum, Россия). Гистологические срезы толщиной 5–7 мкм получали на роторном микротоме Accu-Cut SRM (Sakura, Япония). Далее применяли окраску по стандартной методике с гематоксилином и эозином в автостейнере Tissue-Tek Prisma (Sakura, Япония), затем препараты заключали под пленку в автомате Tissue-Tek Film (Sakura, Япония). Фотофиксацию гистологической картины эндометрия производили при помощи микроскопа Leica DM 750 (Leica Microsystems, Германия) с цифровой видеокамерой Leica EC3 (Leica Microsystems, Германия). Подсчет клеточной плотности воспалительного инфильтрата производили при увеличении микроскопа ×400 в 5 полях зрения, в каждом случае в программе Image Tool 3.0. с помощью инструмента Count and Tag.
Гистологическое исследование микропрепаратов эндометрия животных группы сравнения II, получавших пелоидотерапию в сочетании с антибактериальной терапией, не проводилось ввиду известного и описанного раннее в литературе противовоспалительного эффекта пелоидов в отношении гистологических маркеров ХЭ [22–24].
Во всех экспериментальных группах исследовали уровни гормонов (прогестерон, эстрадиол) в венозной крови путем иммуноферментного анализа (ИФА) с применением 96-ти луночных планшетов Стероид ИФА-17-ОН-прогестерон 100-31 и 100-40 Стероид ИФА-эстрадиол (Алкор Био, Россия).
Статистические методы / Statistical analysis
Для статистической обработки результатов исследования применяли пакет статистических программ SPSS Statistics версия 23 (IBM, США) и возможности статистического анализа в программе Microsoft Excel 2010. Производили расчет среднего арифметического (M) и ошибки среднего арифметического (m) при нормальном распределении данных в выборке или медианы (Me) и интерквартильного размаха (Q1–Q3) при ненормальном распределении данных. Для оценки нормальности распределения данных использовали критерий Шапиро–Уилка. Методы параметрической статистики применяли при нормальном распределении данных (t-критерий Стьюдента), а если полученные данные не соответствовали критериям нормального распределения, то применяли критерий Манна–Уитни. Пороговым значением значимости данных считали р < 0,05.
Результаты / Results
При гистологическом исследовании в эндометрии крыс контрольной группы выявлена диффузная воспалительная инфильтрация, представленная лимфоцитами, макрофагами, эозинофилами и нейтрофилами, затрагивающая поверхностный и базальный слои эндометрия. Плотность воспалительного инфильтрата составила 180,7 ± 9,0 клеток. Эпителий желез находился в состоянии атрофии. В строме эндометрия определялись выраженные явления отека, синусоидные капилляры, сосуды находились в состоянии выраженного полнокровия с набухшим эндотелием (рис. 1).
При исследовании образцов гистологического материала опытной группы (радонотерапия в комбинации с антибактериальной терапией) отмечалось снижение плотности воспалительного инфильтрата (на 30,7 % по отношению к контрольной группе; р = 0,002) до 125,4 ± 8,1 клеток. В инфильтрате преобладали эозинофилы, лимфоциты определялись в небольшом количестве (рис. 2). Воспалительная инфильтрация отмечалась в поверхностных и глубоких базальных отделах эндометрия, имелись слабые признаки отека стромы. Сосуды находились в состоянии менее выраженного полнокровия. Выраженных атрофических изменений желез стромы не отмечалось.
Гистологическая картина эндометрия животных группы сравнения I, получавших комбинированное лечение в виде антибактериальной, радоно- и пелоидотерапии, была максимально приближена к интактным здоровым животным: воспалительная инфильтрация была представлена небольшим количеством лимфоцитов, единичными нейтрофилами, локализующимися лишь в поверхностных слоях эндометрия. Плотность воспалительной инфильтрации оказалась минимальной и составила 20,5 ± 1,8 клеток (снижена на 88,7% в сравнении с контрольной группой; р = 0,000001). Признаки отека стромы не определялись (рис. 3).
Результаты содержания стероидных гормонов в крови лабораторных животных представлены в таблице 1.
Выявлено, что под влиянием радонотерапии в основной группе, радонотерапии и пелоидотерапии в группе сравнения I и пелоидотерапии в группе сравнения II происходило статистически значимое повышение уровня прогестерона в крови после лечения в сравнении с контрольной группой (р = 0,008). При применении радонотерапии в опытной группе отмечалось более выраженное повышение уровня прогестерона в сравнении с применением пелоидотерапии в группе сравнения II. Под влиянием радоновой бальнеотерапии у лабораторных животных основной группы происходило значимое снижение уровня эстрадиола в сравнении с контрольной группой (р = 0,008) в отличие от групп сравнения I и II, где существенного изменения уровня эстрадиола по сравнению с группой контроля не наблюдалось.
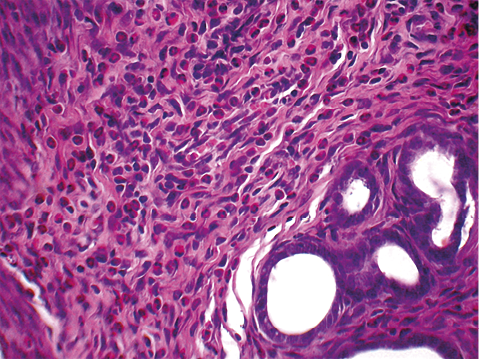
Рисунок 1. Эндометрий маточного рога крысы контрольной группы. Окраска гематоксилином и эозином, увеличение ×400.
Figure 1. Uterine horn endometrium in control rat. Stained with hematoxylin and eosin, ×400.
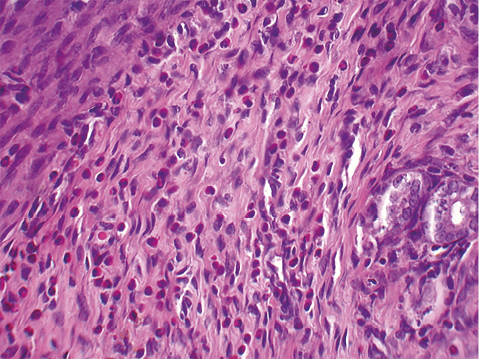
Рисунок 2. Эндометрий маточного рога крысы опытной группы. Окраска гематоксилином и эозином, увеличение ×400.
Figure 2. Uterine horn endometrium in experimental rat. Stained with hematoxylin and eosin, ×400.
Таблица 1. Уровень прогестерона и эстрадиола в крови лабораторных крыс.
Table 1. Blood progesterone and estradiol level in laboratory rats.
|
Группа животных Animal group |
Прогестерон, нг/л Progesterone, ng/L Ме (Q1–Q3) |
р |
Эстрадиол, нг/л Estradiol, ng/L Ме (Q1–Q3) |
р |
|
Контрольная Control |
22,19 (18,9–23,47) |
– |
44,0 (43,48–54,74) |
– |
|
Опытная (антибактериальная терапия + радонотерапия) Experimental (antibacterial therapy + radon therapy) |
105,30 (103,88–112,77) |
р1–2 = 0,008 |
30,46 (28,63–32,17) |
р1–2 = 0,008 |
|
Группа сравнения I: (радонотерапия + пелоидотерапия + антибактериальная терапия) Comparison group I: (radon therapy + peloid therapy + antibiotic therapy) |
80,32 (72,49–82,94) |
р1–3 = 0,008 |
42,9 (41,92–44,34) |
р1–3 = 0,95 |
|
Группа сравнения II (пелоидотерапия + антибактериальная терапия) Comparison group II: (peloid therapy + antibiotic therapy) |
85,90 (85,56–91,47) |
р1–4 = 0,008 |
53,49 (52,42–55,65) |
р1–4 = 0,42 |
Примечание: р1–2 – статистическая значимость различий между контрольной и опытной группами; р1–3 – статистическая значимость различий между контрольной группой и группой сравнения I; р1–4 – статистическая значимость различий между контрольной группой и группой сравнения II.
Note: р1–2 – significant differences between control and experimental groups; р1–3 – significant differences between control group and comparison group I; р1–4 – significant differences between control group and comparison group II.
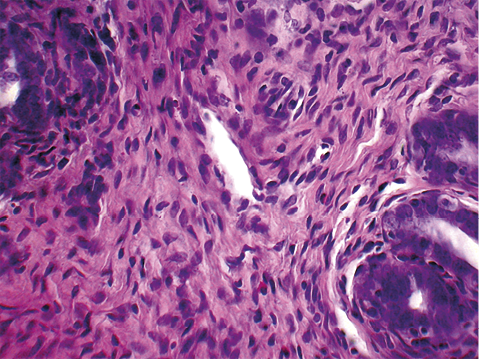
Рисунок 3. Эндометрий маточного рога крысы группы сравнения I. Окраска гематоксилином и эозином, увеличение ×400.
Figure 3. Uterine horn endometrium in comparison group I. Stained with hematoxylin and eosin, ×400.
Обсуждение / Discussion
В условиях экспериментальной модели эндометрита продемонстрирована терапевтическая эффективность радонотерапии в отношении снижения выраженности гистологических признаков воспаления: снижение плотности воспалительной инфильтрации, представленной макрофагами, эозинофилами и нейтрофильными лейкоцитами, выраженности признаков отека стромы, полнокровия сосудов стромы. Плотность воспалительного инфильтрата в результате лечебного воздействия радонотерапии в сочетании с антибактериальной терапией уменьшилась на 30,7 % (р = 0,002), а в комплексе с пелоидотерапией – на 88,7 % (р = 0,000001). При сочетании лечебных методик грязелечения, радонотерапии и антибактериальной терапии в эксперименте отмечен потенцированный противовоспалительный эффект.
Согласно действующим протоколам лечения пациенток с гистологически верифицированным ХЭ, первым этапом проводится этиотропная антибактериальная терапия, вторым – восстановление морфофункционального потенциала, устранение вторичных повреждений и обеспечение регенерации эндометриальной ткани [25]. В программу комплексного лечения ХЭ рекомендовано включать мероприятия, направленные на восстановление секреторной трансформации эндометрия. Потому хроническое латентное воспаление, как правило, сопровождает эндометриальная дисфункция (эндометриопатия), при которой наблюдается нарушение рецептивности ткани эндометрия, секреции интегринов и микроглобулинов, а также задержка формирования пиноподий и «окна имплантации» [25].
Наиболее показательный результат в проведенном нами моделировании экспериментального эндометрита был продемонстрирован в группе лабораторных животных, которые получали комплексное лечение. Гистологическая картина эндометрия максимально была приближена к группе интактных животных, что позволяет констатировать – комплексная терапия природными физическими факторами в сочетании с этиотропной антибактериальной терапией приводит к полноценному восстановлению морфологической структуры эндометрия. Оценка стероидогенеза в эксперименте продемонстрировала модулирующее действие радонотерапии: выраженное повышение уровня прогестерона при одновременном достоверном снижении эстрадиола венозной крови животных. С клинической точки зрения указанное терапевтическое действие радона приведет к коррекции эндометриопатии и недостаточности секреторной трансформации эндометрия.
Схожие экспериментальные исследования по изучению терапевтической эффективности различных лечебных факторов в отношении гистологических маркеров ХЭ проводились отечественными учеными. Так, в эксперименте на половозрелых самках крыс определяли влияние магнийсодержащей композиции (МСК) – природного полиминерала (Бишофит) на морфологические показатели клеточной инфильтрации в условиях ХЭ, а также на показатели активности желатиназы В в ткани эндометрия [26]. Было выявлено, что под влиянием магнийсодержащего препарата у крыс с экспериментальным ХЭ увеличивалась активность желатиназы В в строме. При этом наблюдалось увеличение содержания магния в эритроцитарной массе крови из нижней полой вены, что сопровождалось восстановлением эозинофильно-плазмоцитарной и увеличением макрофагально-лимфоцитарной инфильтрации тканей эндометрия по сравнению с этими показателями у животных с экспериментальным ХЭ без терапии. В сравнении с полученными нами результатами оценки эффектов радонотерапии, магнийсодержащий комплекс не привел к выраженному противовоспалительному эффекту в отношении гистологических маркеров ХЭ, продемонстрировав модуляцию клеточного состава воспалительного инфильтрата. При этом повышение активности матриксных металлопротеиназ под влиянием МСК, полученное в эксперименте, обеспечивало один из вариантов патогенетической терапии и препятствовало хронизации воспалительного процесса в эндометрии, что не было изучено в отношении радонотерапии.
Высокие результаты противовоспалительной эффективности на биологической модели экспериментального эндометрита продемонстрировало исследование с ортилией однобокой (Orthilia secunda (L.) House) [15]. Показано, что экстракт ортилии однобокой в дозе 0,04 мг/кг в сутки приводит не только к нормализации морфологии эндометрия, но и к секреторной его перестройке, необходимой для имплантации плодного яйца. Результаты модуляции стероидогенеза, полученные при применении радонотерапии в эксперименте, могут обеспечивать благоприятный гормональный фон и соответствующие ему морфологические изменения в эндометрии для адекватного формирования «окна имплантации». Однако полученные результаты экспериментального исследования требуют проведения дальнейших клинических испытаний для подтверждения указанных терапевтических эффектов. При проведении исследований следует учитывать ограничения к применению радонотерапии, связанные с наличием ряда противопоказаний для данной методики, такие как лейкопения, гипертиреоз, плохая переносимость радоновой минеральной воды (повышенная потливость, одышка, головокружение и проч.), доброкачественные опухоли, вегетососудистые дисфункции.
Заключение / Conclusion
В условиях экспериментальной модели ХЭ продемонстрирована противовоспалительная эффективность радоновой бальнеотерапии. При комплексном применении радонотерапии и пелоидотерапии отмечается потенцирующий эффект. Под воздействием радоновой бальнеотерапии происходит модуляция стероидогенеза, которая заключается в значимом повышении уровня прогестерона при достоверном снижении уровня эстрадиола. Это позволяет рассматривать данную методику как перспективную для проведения клинических исследований, которые позволили бы подтвердить ее эффективность у пациенток с репродуктивной дисфункцией, включая заболевания, сопровождающиеся гиперэстрогенией.
Список литературы
1. Радзинский В.Е. Акушерская агрессия. v. 2.0. М.: StatusPraesens, 2017. 839 c. Режим доступа: https://akusher-lib.ru/wp-content/uploads/2018/11/Akusherskaya-agressiya-v.-2.0.pdf. [Дата обращения: 20.11.2022].
2. Радзинский В.Е., Оразмурадов А.А. Беременность ранних сроков. От прегравидарной подготовки к здоровой гестации. Изд. 3-е, перераб. и доп. М.: StatusPraesens, 2020. 800 с. Режим доступа: https://kingmed.info/media/book/5/4690.pdf. [Дата обращения: 20.11.2022].
3. Тапильская Н.И., Савичева А.М., Шалепо К.В., Копылова А.А. Опыт лечения хронического эндометрита. Гинекология. 2020;22(4):68–70. https://doi.org/10.26442/20795696.2020.4.200312.
4. Яковчук Е.К., Сулима А.Н., Рыбалка А.Н. и др. Хронический эндометрит: современное состояние проблемы, основные аспекты патогенеза, влияние на репродуктивную функцию. Российский вестник акушера-гинеколога. 2016;16(5):37–41. https://doi.org/10.17116/rosakush20161653-41.
5. Vitagliano A., Saccardi C., Litta P.S., Noventa M. Chronic endometritis: Really so relevant in repeated IVF failure? Am J Reprod Immunol. 2017;78(6). https://doi.org/10.1111/aji.12758.
6. Vitagliano A., Noventa M., Gizzo S. Autoimmunity, systemic inflammation, and their correlation with repeated implantation failure and recurrent miscarriage: Is chronic endometritis the missing piece of the jigsaw? Am J Reprod Immunol. 2017;77(1). https://doi.org/10.1111/aji.12597.
7. Gay C., Hamdaoui N., Pauly V. et al. Impact of antibiotic treatment for chronic endometritis on unexplained recurrent pregnancy loss. J Gynecol Obstet Hum Reprod. 2021;50(5):102034. https://doi.org/10.1016/j.jogoh.2020.102034.
8. Peigen C., Panyu C., Yingchun G. et al. Interaction between chronic endometritis caused endometrial microbiota disorder and endometrial Immune environment change in recurrent implantation failure. Front Immunol. 2021;12:748447. https://doi.org/10.3389/fimmu.2021.748447.
9. Pinar M.H., Gibbins K., He M. et al. Early pregnancy losses: Review of nomenclature, histopathology, and possible etiologies. Fetal Pediatr Pathol. 2018;37(3):191–209. https://doi.org/10.1080/15513815.2018.1455775.
10. Иванов И.А. Патофизиологические основы недостаточности лютеиновой фазы и ее роль в нарушениях репродуктивной функции. Медицинский совет. 2021;(3):89–97. https://doi.org/10.21518/2079-701X-2021-3-89-97.
11. Румянцева З.С., Люманова Э.Ю., Волоцкая Н.И., Аникин С.С. Предикторы неразвивающейся беременности и роль прегравидарной подготовки в профилактике ранних репродуктивных потерь. Вятский медицинский вестник. 2021;(1):64–9. https://doi.org/10.24411/2220-7880-2021-10154.
12. Волков В.Г., Ахильгова З.С. Факторы риска ранних потерь беременности. Вестник новых медицинских технологий. Электронное издание. 2020;(1):66–71. https://doi.org/10.24411/2075-4094-2020-16597.
13. Фесюн А.Д., Кульчицкая Д.Б., Котенко Н.В. и др. Разработка комплексных программ санаторно-курортного лечения женщин с диагнозом хронический эндометрит. Вопросы курортологии, физиотерапии и лечебной физической культуры. 2021;98(3–2):201–2. https://doi.org/10.17116/kurort20219803221.
14. Kitaya K., Takeuchi T., Mizuta S. et al. Endometritis: new time, new concepts. Fertil Steril. 2018;110(3):344–50. https://doi.org/10.1016/j.fertnstert.2018.04.012.
15. Скоропацкая О.А., Таранина Т.С., Мазко О.Н., Зенкина Н.П. Фитотерапия экспериментального эндометрита: подбор дозы экстракта ортилии однобокой (Orthilia secunda (L.) House). Бюллетень медицинской науки. 2018;(1):86–9.
16. Ахкубекова Н.К., Терешин А.Т., Бестаева А.Э. Коррекция психоэмоциональных и вегетососудистых нарушений у больных эндометриоидной болезнью под воздействием комплексной радоно-, лазеро- и фармакотерапии. Физиотерапия, бальнеология и реабилитация. 2019;18(3):161–5. https://doi.org/10.17816/1681-3456-2019-18-3-161-165.
17. Куреленок С.А., Гордон К.В. Санаторно-курортное лечение гинекологических больных с сочетанной патологией репродуктивной системы. Вестник новых медицинских технологий. Электронное издание. 2013;(1):109.
18. Разумов А.Н., Пурига А.О., Юрова О.В. Современные возможности радонотерапии в медицинской реабилитации пациентов. Вопросы курортологии, физиотерапии и лечебной физической культуры. 2015;92(4):54–60. https://doi.org/10.17116/kurort2015454-60.
19. Пономаренко Г.Н. Физическая и реабилитационная медицина: национальное руководство. М.: ГЕОТАР-Медиа, 2016. 688 с.
20. Маньшина Н.В. Санаторно-курортное лечение женщин с гиперэстрогенией. Медицинский совет. 2007;(4):67–70.
21. Тихаева К.Ю., Рогова Л.Н., Ткаченко Л.В. Способ моделирования экспериментального хронического воспаления эндометрия у крыс. Патент РФ № 2580986, МПК G09B 23/28. от 10.04.2016. Бюл. № 10. 9 c. Режим доступа: https://patents.s3.yandex.net/RU2580986C1_20160410.pdf. [Дата обращения: 20.11.2022].
22. Трунченко Н.В., Макаров К.Ю., Соколова Т.М. Клинико-морфологические особенности течения хронического эндометрита в стадии ремиссии и возможности коррекции применением пелоидотерапии. Медицина и образование в Сибири. 2014;(2):32.
23. Омарпашаева М.И. Состояние цитокинового профиля у женщин после прерывания несостоявшегося выкидыша и в динамике восстановительного лечения. Актуальные проблемы медицины и биологии. 2018;(3):11–5. https://doi.org/110.24411/2587-4926-2018-10030.
24. Носкова И.Н., Артымук Н.В. Эффективность преконцепционной интравагинальной пелоидотерапии у женщин с потерей беременности в ранние сроки. Мать и дитя в Кузбассе. 2012;(S1):113–8.
25. Прегравидарная подготовка. Клинический протокол Междисциплинарной ассоциации специалистов репродуктивной медицины (МАРС). Версия 2.0. [Коллектив авторов]. М.: 2020. 128 с. Режим доступа: http://praesens.ru/files/2020/broshyury/Protokol_MARS.pdf. [Дата обращения: 20.11.2022].
26. Рогова Л.Н., Тихаева К.Ю., Ткаченко Л.В. и др. Влияние магнийсодержащей композиции на морфологические показатели и активность желатиназы B в тканях эндометрия при экспериментальном хроническом воспалении эндометрия. Акушерство, Гинекология и Репродукция. 2020;14(6):637–45. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2020.143.
Об авторах
А. Е. ЧерноваРоссия
Чернова Анастасия Евгеньевна – аспирант кафедры акушерства и гинекологии с курсом дополнительного профессионального образования
656038 Барнаул, проспект Ленина, д. 40
О. В. Ремнева
Россия
Ремнева Ольга Васильевна – д.м.н., профессор, зав. кафедрой акушерства и гинекологии с курсом дополнительного профессионального образования
656038 Барнаул, проспект Ленина, д. 40
И. П. Бобров
Россия
Бобров Игорь Петрович – д.м.н., профессор кафедры судебной медицины и патологической анатомии имени профессора В.Н. Крюкова с курсом дополнительного профессионального образования
656038 Барнаул, проспект Ленина, д. 40
А. В. Лепилов
Россия
Лепилов Александр Васильевич – д.м.н., профессор, зав. кафедрой судебной медицины и патологической анатомии имени профессора В.Н. Крюкова с курсом дополнительного профессионального образования
656038 Барнаул, проспект Ленина, д. 40
О. Н. Мазко
Россия
Мазко Олеся Николаевна – к.б.н., доцент кафедры фармакологии имени профессора В.М. Брюханова
656038 Барнаул, проспект Ленина, д. 40
О. Г. Макарова
Россия
Макарова Олеся Геннадьевна – к.фарм.н., доцент кафедры фармакологии имени профессора В.М. Брюханова
656038 Барнаул, проспект Ленина, д. 40
Н. М. Семенихина
Россия
Семенихина Наталья Михайловна – к.вет.н, старший научный сотрудник научно-исследовательского института биологической медицины
656049 Барнаул, проспект Ленина, д. 61
О. В. Рожкова
Россия
Рожкова Ольга Владимировна – к.м.н., врач акушер-гинеколог
656045 Барнаул, ул. Фомина, д. 154
И. В. Гребцов
Россия
Гребцов Иван Викторович – врач-патологоанатом
656045 Барнаул, Змеиногорский тракт, д. 110
Д. А. Баранов
Россия
Баранов Данил Андреевич – студент 4-го курса Института клинической медицины
656038 Барнаул, проспект Ленина, д. 40
С. А. Антонова
Россия
Антонова Софья Александровна – студент 5-го курса Института клинической медицины
656038 Барнаул, проспект Ленина, д. 40
В. В. Баранова
Россия
Баранова Виктория Викторовна – студент 6-го курса Института клинической медицины
656038 Барнаул, проспект Ленина, д. 40
Рецензия
Для цитирования:
Чернова А.Е., Ремнева О.В., Бобров И.П., Лепилов А.В., Мазко О.Н., Макарова О.Г., Семенихина Н.М., Рожкова О.В., Гребцов И.В., Баранов Д.А., Антонова С.А., Баранова В.В. Оценка эффективности радонотерапии и модуляции стероидогенеза в экспериментальной модели хронического эндометрита. Акушерство, Гинекология и Репродукция. 2023;17(3):321-331. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.374
For citation:
Chernova A.E., Remneva O.V., Bobrov I.P., Lepilov A.V., Mazko O.N., Makarova O.G., Semenikhina N.M., Rozhkova O.V., Grebtsov I.V., Baranov D.A., Antonova S.A., Baranova V.V. Assessing radonotherapy effectiveness and modulated steroidogenesis in experimental chronic endometritis model. Obstetrics, Gynecology and Reproduction. 2023;17(3):321-331. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.374

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































