Перейти к:
Внутриутробная активация иммунной системы плода в ответ на COVID-19 у матери
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.404
Аннотация
Введение. СOVID-19 во время беременности представляет серьезную угрозу как для здоровья матери, так и для здоровья будущего ребенка. Беременные имеют высокую вероятность проявления осложнений респираторных вирусных инфекций с развитием критических состояний, которые обусловлены физиологическими изменениями в иммунной и сердечно-легочной системах. Однако бессимптомное течение COVID-19 у беременных может сопровождаться синдромом фетального воспалительного ответа (СФВО), что приводит к неблагоприятным последствиям для жизни и здоровья новорожденного.
Цель: оценка воспалительного ответа у плода вследствие воздействия COVID-19 на мать во время беременности.
Материалы и методы. Проведено проспективное рандомизированное сравнительное исследование с участием 92 беременных. В основную группу вошли 62 беременные с перенесенной коронавирусной инфекцией: подгруппу 1 составили 30 беременных, у которых методом полимеразной цепной реакции (ПЦР) определено наличие SARS-CoV-2 за 4–6 нед до родов; подгруппу 2 – 32 беременные, у которых SARS-CoV-2 методом ПЦР был выявлен во время гестации ранее. Контрольная группа была сформирована из 30 здоровых беременных. У всех участниц исследования в периферической крови и пуповиной крови новорожденных определяли уровень циркулирующих цитокинов, а именно, интерлейкинов (англ. interleukin, IL) IL-1α, IL-6, IL-8, IL-10, гранулоцитарно-макрофагального колониестимулирующего фактора (англ. granulocyte-macrophage colony-stimulating factor, GM-CSF), фактора некроза опухоли альфа (англ. tumor necrosis factor alpha, TNF-α), интерферона гамма (англ. interferon gamma, IFN-γ), воспалительного белка макрофагов-1β (англ. Macrophage inflammatory protein-1β, MIP-1β), хемокина-10 (англ. C-X-C motif chemokine ligand 10, CXCL-10) и проводили анализ клеточных маркеров (CD86, CD80, CD4, CD25, CD25, CCR7); также всем новорожденным было выполнено ультразвуковое исследование вилочковой железы.
Результаты. Дендритные клетки пуповинной крови новорожденных, родившихся от матерей подгруппы 1, показали значительное увеличение экспрессии CD80 и CD86 по сравнению с контрольной группой (p = 0,023). В образцах пуповинной крови детей, родившихся от матерей подгруппы 1, была повышена доля CD4+, CCR7+ T-клеток с сопутствующим снижением доли наивных CD4+ T-клеток по сравнению с контрольной группой (p = 0,016). Выявлено, что количество наивных регуляторных Т-клеток (англ. regulatory T cells, Treg) CD4 +CD25+Foxp3+ у матерей в исследованных группах статистически значимо не различалось, а функциональная активность Treg у матерей с тяжелым течением СOVID-19 (подгруппа 2) была существенно подавлена. У новорожденных подгруппы 1 были выявлены значительно более высокие уровни провоспалительных цитокинов и хемокинов по сравнению с контрольной группой (p < 0,05). При этом содержание цитокинов в периферической крови матерей основной и контрольной групп на момент родоразрешения достоверно не различалось. Беременные с SARS-CoV-2 демонстрировали сильный специфичный Т-клеточный ответ. Было обнаружено снижение размеров вилочковой железы у новорожденных на фоне COVID-19 у матери.
Заключение. Синдром фетального воспалительного ответа имеет место при COVID-19 и характеризуется активацией фетальной иммунной системы и повышенной продукцией провоспалительных цитокинов. Тяжесть заболевания у беременной не коррелирует с тяжестью течения СФВО в неонатальном периоде и может варьировать от минимальных изменений на уровне лабораторных показателей до развития осложнений со стороны органов и систем.
Ключевые слова
Для цитирования:
Гашимова Н.Р., Панкратьева Л.Л., Бицадзе В.О., Хизроева Д.Х., Макацария Н.А., Третьякова М.В., Шкода А.С., Григорьева К.Н., Цибизова В.И., Гри Ж., Якубова Ф.Э., Блинов Д.В., Макацария А.Д. Внутриутробная активация иммунной системы плода в ответ на COVID-19 у матери. Акушерство, Гинекология и Репродукция. 2023;17(2):188-201. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.404
For citation:
Gashimova N.R., Pankratyeva L.L., Bitsadze V.O., Khizroeva J.Kh., Makatsariya N.A., Tretyakova M.V., Shkoda A.S., Grigoreva K.N., Tsibizova V.I., Gris J., Yakubova F.E., Blinov D.V., Makatsariya A.D. Intrauterine activation of the fetal immune system in response to maternal COVID-19. Obstetrics, Gynecology and Reproduction. 2023;17(2):188-201. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.404
Введение / Introduction
С декабря 2019 г. вспышка новой коронавирусной инфекции (COVID-19) в Китае привлекла большое внимание во всем мире. Как беременная, так и ее плод считаются группой высокого риска во время инфицирования COVID-19 [1]. До сих пор отдаленное влияние для плодов и новорожденных вследствие воздействия SARS-CoV-2 на матерей во время беременности остается неизученным. Тяжелые формы COVID-19 развиваются у беременных с имеющимися сопутствующими заболеваниями сердечно-сосудистой системы, легких, печени, почек, с сахарным диабетом, артериальной гипертензией, ожирением, антифосфолипидным синдромом и тромбофилией. Существует возможность негативного воздействия COVID-19 на плод через активацию иммунной системы плода и иммунную систему матери, что может сопровождаться синдромом фетального воспалительного ответа (СФВО). Гипервоспалительный ответ, который был очевиден при инфекциях SARS-CoV-2 по сравнению другими коронавирусными инфекциями, может способствовать тяжести заболевания [2]. Гипервоспаление связано с высвобождением и инфильтрацией нейтрофилов в различных органах с образованием внеклеточных ловушек нейтрофилов (англ. neutrophil extracellular traps, NETs) и цитокиновым штормом. Тяжелые случаи COVID-19 характеризуются повышением уровней провоспалительных цитокинов в плазме крови, а именно, интерлейкинов (англ. interleukin, IL) IL-1β, IL-2, IL-6, IL-7, IL-10, гранулоцитарно-макрофагального колониестимулирующего фактора (англ. granulocyte-macrophage colony-stimulating factor, GM-CSF) и фактора некроза опухоли альфа (англ. tumor necrosis factor alpha, TNF-α) [3]. Кроме того, уровни цитокинов обратно коррелируют с количеством CD4+ и CD8+ Т-клеток, В-клеток, естес- твенных киллеров – NK-клеток (англ. natural killer cells, NK cells), которые проявляются в виде лимфопении в периферической крови, что лежит в основе неконтролируемого гипервоспалительного ответа при COVID-19 [4]. Несмотря на снижение количества Т-клеток, иммунный ответ на COVID-19 характеризуется повышением T-хелперов 17 (англ. T-helpers 17, Th17) с одновременным снижением регуляторных Т-клеток (англ. regulatory T cells, Treg), что в последующем приводит к уменьшению соотношения Treg/Th17 (рис. 1).
Было показано, что неконтролируемое высвобождение провоспалительных цитокинов в случаях COVID-19 обусловлено чрезмерной активацией Th17-иммунного ответа [5]. Тем не менее иммунные механизмы цитокинового шторма при COVID-19 до конца не изучены. Интересно, что цитокиновый шторм также был описан при других тяжелых острых респираторных синдромах, а именно, при ближневосточном респираторном синдроме (англ. Middle East Respiratory Syndrome, MERS), тяжелом остром респираторном синдроме (англ. Severe Acute Respiratory Syndrome, SARS) и при сезонных гриппах (H5N1 и H1N1). Цитокиновые профили при различных респираторных синдромах были схожими, что указывает на общую патофизиологию. Так, при SARS были обнаружены повышенные концентрации IL-1, IL-6, IL-12, трансформирующего фактора роста бета (англ. transforming growth factor-beta, TGF-β), интерферона гамма (англ. interferon gamma, IFN-γ), монокина, индуцируемого IFN-γ (англ. monokine induced by IFN-γ, MIG), IL-8; при MERS повышены концентрации IFN-α, IL-1β, IL-2, IL-6, IL-8 и IFN-α; при гриппе H1N1 – IFN-γ, TNF-α, IL-6, IL-8, IL-9, IL-17, IL-15, а при гриппе H1N5 повышены уровни IFN-γ, IL-6, IL-8, IL-10, MIG [6].
Недавнее исследование цитокинового профиля у пациентов с респираторными инфекциями различной этиологии показало, что содержание воспалительных цитокинов, в том числе IL-1β, IL-6, IL-8 и растворимого рецептора TNF-1 (англ. soluble tumor necrosis factor receptor 1, sTNFR1), было значительно выше у пациентов с COVID-19, чем у пациентов без коронавирусной инфекции в отделении интенсивной терапии [7]. Это исследование согласуется с недавним метаанализом, в котором демонстрируются повышенные показатели маркеров воспаления, таких как прокальцитонин, С-реактивный белок и IL-6 у пациентов с COVID-19 [8], и с другими исследованиями, в которых описаны изменения маркеров воспаления, таких как IL-6, IL-1β, IL-10, TNF-α, GM-CSF и IL-17 у инфицированных COVID-19 пациентов [9][10].
При повышенном содержании материнские провоспалительные цитокины проникают через плацентарный барьер и стимулируют воспалительные реакции и активацию иммунной системы у плода, что может привести к повреждению многих органов с негативными последствиями для развития плода [11]. В свою очередь цитокиновый шторм может спровоцировать острый респираторный дистресс-синдром, полиорганную недостаточность (ПОН) и смерть. Неконтролируемое системное воспаление также может вызвать неблагоприятные исходы беременности – выкидыши, преждевременные роды, дистресс плода, преэклампсию, задержку внутриутробного роста плода и СФВО [5]. Синдром фетального воспалительного ответа – патологическое состояние, при котором происходит активация иммунной системы плода и повышение продукции провоспалительных цитокинов, что в итоге может вести к развитию ПОН у плода и новорожденного (рис. 2). Также в литературе имеются данные, что коронавирусная инфекция у матери во время беременности приводит к уменьшению размеров вилочковой железы (тимуса) у плода [12–14].
Уже ясно, что новая коронавирусная инфекция будет с нами еще много лет, и нам нужно больше знать о том, как жить с не до конца изученным вирусом SARS-CoV-2, чтобы максимально защитить беременную и подавить его негативное воздействие на плод.
Цель: оценка воспалительного ответа у плода вследствие воздействия COVID-19 на мать во время беременности.
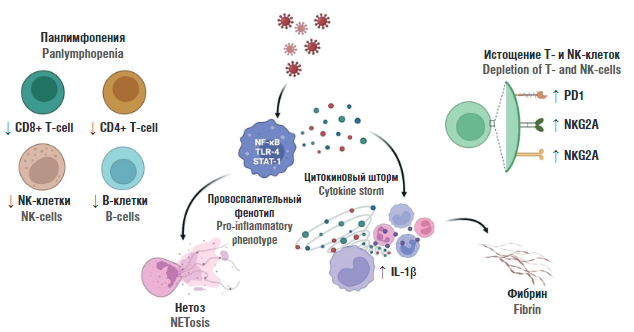
Рисунок 1. Клеточные и молекулярные аспекты патогенеза COVID-19 у беременных [рисунок авторов].
Примечание: PD1 – запрограммированная гибель клеток 1; NKG2A – рецептор естественных клеток-киллеров, TIM-3 – Т-клеточный иммуноглобулин и муциновый домен 3; NF-kB – ядерный фактор «каппа-би»; TRL-4 – толл-подобный рецептор-4; STAT-1 – транскрипционный фактор преобразователей сигналов и активаторов транскрипции типа 1; NK-клетки – естественные киллеры; IL-1β – интерлейкин 1 бета.
Figure 1. Cellular and molecular aspects of COVID-19 pathogenesis in pregnant women [drawn by authors].
Note: PD1 – programmed cell death 1; NKG2A – natural killer group 2 receptor; TIM-3 – T-cell immunoglobulin and mucin domain 3; NF-kB – nuclear factor "kappa-bi"; TRL-4 – toll-like receptor-4; STAT-1 – signal transducer and activator of transcription type 1; NK-cells – natural killers; IL-1β – interleukin 1 beta.
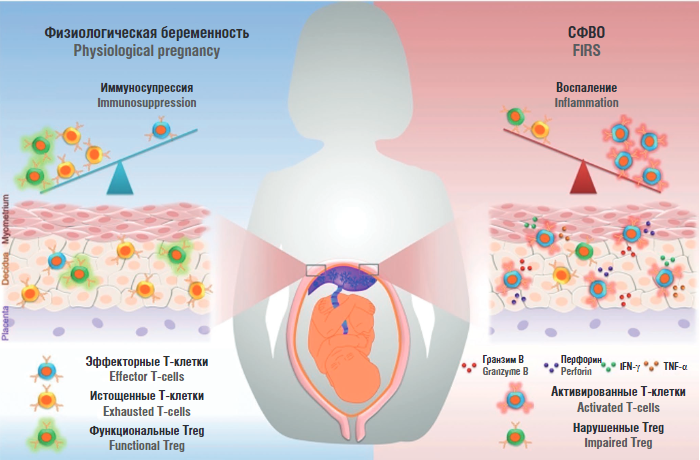
Рисунок 2. Синдром фетального воспалительного ответа (СФВО) [рисунок авторов].
Примечание: IFN-γ – интерферон гамма; TNF-α – фактор некроза опухоли альфа; Treg – Т-регуляторные клетки.
Figure 2. Fetal inflammatory response syndrome (FIRS) [drawn by authors].
Note: IFN-γ – interferon gamma; TNF-α – tumor necrosis factor alpha; Treg – T-regulatory cells.
Материалы и методы / Materials and Мethods
Дизайн исследования / Study design
Исследование проводилось в форме проспективного сравнительного рандомизированного с участием 92 беременных, госпитализированных в Перинатальный центр ГБУЗ ГКБ № 67 им. Л.А. Ворохобова ДЗМ для родоразрешения.
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения в основную группу: возраст более 18 лет; беременные с COVID-19, верифицированным во время гестации по тесту ПЦР; одноплодная беременность; добровольное информированное согласие на участие в исследовании.
Критерии включения в контрольную группу: возраст более 18 лет; одноплодная беременность; физиологическое течение беременности; добровольное информированное согласие на участие в исследовании.
Критерии исключения: наличие активного инфекционного и/или воспалительного процесса; подтверждённый положительный анализ на антитела к ВИЧ; маркёры вирусных гепатитов, сифилиса; перенесшие острую респираторную вирусную инфекцию и вакцинированные; многоплодная беременность; резус- и AB0-изоиммунизации; наличие хромосомных аномалий, генетических мутаций и врожденных пороков развития у плода; отказ от участия в исследовании.
Группы обследованных / Patient groups
В основную группу вошли 62 беременные с перенесенной коронавирусной инфекцией: подгруппу 1 составили 30 беременных, у которых методом полимеразной цепной реакции (ПЦР) определено наличие SARS-CoV-2 за 4–6 нед до родов; подгруппу 2 – 32 беременные, у которых SARS-CoV-2 методом ПЦР был выявлен во время гестации ранее. Контрольная группа была сформирована из 30 здоровых беременных.
Методы исследования / Study methods
Для анализа были собраны венозная кровь беременных и пуповинная кровь их новорожденных детей. Уровень экспрессии клеточных маркеров определяли многоцветной проточной цитометрией с помощью набора антител (Beckman Coulter, США): анти-CD45, меченные Pacific Blue; анти-CD14, меченые флуорохромом APC; анти-CD64 (FcγRI), меченые флуорохромом PE; анти-CD16 (FcγRIII), меченые флуорохромом PC7; анти-CD32 (FcγRII) меченые флуорохромом PC5; анти- CD11b (C3b), меченые флуорохромом PE; анти- CD11c (ITGAX), меченые флуорохромом FITC; анти- CD3-FITC (клон BW264/56), анти-CD45RO-PerCP (UCHL1), анти-CD8-PE (клон BW135/80), анти-CD4-FITC (клон M-T466), анти-CD4-APC (клон M-T466), анти- CD80-PE (клон 2A2), анти-CD86-FITC (клон 3D7), анти- CD25-APC (клон 4E3), анти-CD127-PE (клон MB15-18C9), анти-Foxp3-PE (клон 3G3). При сборе и анализе данных использовали цитометр Navios (Beckman Coulter, США) и программное обеспечение Kaluza (Beckman Coulter, США). При фенотипировании Treg клеток основными ориентирами являлись рецепторные молекулы CD25+ (альфа-цепь рецептора IL-2), низкая экспрессия рецептора к IL-7 (CD127) и продукт гена FОХР3 (англ. forkhead box Р3).
Также был проведен анализ клеточного иммунитета по секреции INF-γ. Для этого в лунки 96-луночного круглодонного планшета вносили 50 мкл цельной крови, 150 мкл среды RPMI-1640 и смесь пептидов (15 а.к.), полностью перекрывающих последовательность S и N-белков SARS-CoV-2. Инкубировали 24 ч при 37 °С и 5 % СО2, отбирали 100 мкл супернатанта и определеяли концентрацию INF-γ методом проточной цитометрии (Beckman Coulter, США).
Цитокин-продуцирующую способность клеток и уровень циркулирующих цитокинов определяли с помощью проточного иммуноферментного анализа (ИФА) с использованием мультиплексного набора реагентов MILLIPLEX® Map (Millipore, США). При сборе и анализе данных использовали анализатор (Luminex, США) с программным обеспечением Bio-Plex Manager 6.0 (Bio-Rad, США). Cпоcобность лимфоцитов продуцировать цитокины оценивали после стимуляции в течение 5 ч с помощью форболмиристат-ацетата (50 нг/мл) и иономицина (2 мкг/мл) в присутствии брефельдина A (10 мкг/мл, Sigma-Aldrich). Клетки инкубировали с V450-меченным анти-IFN-γ (B27) от BD Biosciences и PE-меченным анти-TNF-α (MAb11) от BD Biosciences. При сборе и анализе данных использовали проточный цитометр Navios (Beckman Coulter, США) и программное обеспечение Kaluza (Beckman Coulter, США). Цитокины в культуральных супернатантах измеряли методом ИФА в соответствии со стандартным протоколом. Оптические плотности регис- трировали при 450 нм на микропланшетном ридере (Вектор-Бест, Россия). Концентрации цитокинов рассчитывали путем экстраполяции значений абсорбции по стандартным кривым, где известные концентрации наносили на график абсорбции с использованием встроенного программного обеспечения.
Всем новорожденным перед выпиской было выполнено ультразвуковое исследование вилочковой железы. Данное исследование проводилось одним и тем же специалистом на ультразвуковом аппарате Logiq 500 (General Electric Medical Systems, США) с использованием линейных датчиков с частотой 5–10 МГц.
Этические аспекты / Ethical aspects
Исследование одобрено локальным этическим комитетом ФГАОУ ВО Первый МГМУ имени И.М. Сеченова Минздрава России (Сеченовский Университет), протокол № 04-22 от 16.02.2022. Все участницы исследования подписали информированное добровольное согласие и согласились на включение результатов обследования в научно-исследовательскую работу. Исследование было проведено в соответствии с этическими стандартами Хельсинской декларации Всемирной медицинской ассоциации.
Статистический анализ / Statistical analysis
Статистический анализ включал в себя расчёт абсолютных и относительных частот (% от общего числа наблюдений), медианы (Ме) с интерквартильным интервалом (Q1–Q3). Полученные данные были систематизированы в электронных таблицах Microsoft Office Excel 2021 (Microsoft, США). Статистическая обработка данных выполнена с помощью электронных таблиц и пакета программы IBM SPSS Statistica v.13.0 (StatSoft Inc., США). Оценку на нормальность распределения проводили при помощи теста Харке–Бера (Jarque–Bera test). При сравнении количественных данных применяли критерий Манна–Уитни. Для проверки статистической значимости факторов применяли однофакторный дисперсионный анализ путем расчета точного критерия Фишера, значение которого менее 0,05 свидетельствовало о наличии статистически значимых различий, значение критерия Фишера р более 0,05 – об отсутствии различий.
Результаты и обсуждение/ Results and Discussion
Клинико-анамнестические данные / Clinical and anamnestic data
Данные клинико-анамнестического обследования и перинатальные исходы представлены в таблице 1. Среди обследованных пациенток основной и контрольной групп существенных различий по возрасту и индексу массы тела (ИМТ) выявлено не было. Так, средний возраст матерей подгруппы 1 составил 34 года, ИМТ – 28 кг/м2, в подгруппе 2 – 32 года, ИМТ – 27 кг/м2, в контрольной группе средний возраст также составил 34 года, а ИМТ – 25 кг/м2. Гестационный возраст меньше 37 нед был у 7 из 62 пациенток основной группы и у 1 пациентки из контрольной группы, случаев перинатальной смертности не было.
Анализ содержания цитокинов и цитокин-продуцирующей способности клеток / Assessing cytokine profile and cytokine-producing potential
В таблице 2 представлен сравнительный анализ содержания цитокинов в пуповинной крови новорожденных. У обследованных новорожденных из подгруппы 1 были выявлены значительно более высокие уровни провоспалительных цитокинов, в частности, IL-1α, IL-6, IL-8, IL-10, TNF-α и хемокинов, таких как хемокин-10 (англ. C-X-C motif chemokine ligand 10, CXCL-10) и воспалительный белок макрофагов-1β (англ. macrophage inflammatory protein-1β, MIP-1β) по сравнению с контрольной группой (рис. 3). Содержание цитокинов в периферической крови у новорожденных подгруппы 2 и контрольной группы значимо не различалось. При этом содержание цитокинов в периферической крови у матерей основной группы значимо не отличалось от их концентраций у матерей из контрольной группы на момент родоразрешения.
Определение клеточных маркеров / Assessing surface cell marker expression
Мы проанализировали экспрессию на дендритных клетках маркеров активации CD80 и CD86. У новорожденных от матерей подгруппы 1 в пуповинной крови определялось значительное увеличение экспрессии CD80 и CD86 по сравнению с контрольной группой (рис. 4), а у новорожденных подгруппы 2 достоверных различий с контрольной группой не выявлено. Так, медиана интенсивности флуоресценции (англ. median fluorescence intensity, MFI) маркера активации дендритных клеток CD80 в подгруппе 1 составила 45,2 [ 35; 65,1], а у новорожденных от матерей контрольной группы – 13,8 [ 4,9; 19,8] (р < 0,001; U-test); MFI маркера активации CD86 в подгруппе 1 составила 41,8 [ 36,8; 69,4], а в контрольной группе – 17,8 [ 6,9; 25,1] (р < 0,001; U-test).
В образцах пуповинной крови подгруппы 1 была повышена доля CD4+CCR7+CD45RA T-клеток с сопутствующим снижением доли наивных CD4+CCR7+CD45RA T-клеток по сравнению с контрольной группой (p = 0,018) – 21,0 [ 14; 28]% против 9 [ 2; 13]%, а у новорожденных подгруппы 2 достоверных различий с контрольной группой выявлено не было (рис. 5). В пуповинной крови новорожденных подгруппы 1 относительное количество CD3+CD45RO лимфоцитов было статистически значимо выше (p < 0,001)– 43 [ 31; 57]% против 14 [ 8; 21]% по сравнению с новорожденными контрольной группы.
Определение функциональной активности Тreg клеток / Assessing functional activity of Treg cells
При изучении количественных и функциональных характеристик Тreg клеток у матерей значимых различий между группами установлено не было. Однако у новорожденных было показано, что в подгруппе 1 функциональная активность Тreg была существенно подавлена: коэффициент подавления клеточной пролиферации (S, %) составил 43,8 [ 29,4; 58,6] против 71,2 [ 53,1; 78,6] (p < 0,001) по сравнению с контрольной группой (рис. 6).
При исследовании специфичной Т-клеточной памяти определено, что беременные демонстрируют сильный SARS-CoV-2-специфичный Т-клеточный ответ (рис. 7). Примерно у 1/3 всех новорожденных в образцах пуповинной крови также были выявлены спе- цифичные Т-клетки памяти, что не исключает вероятность внутриутробной передачи инфекции.
Интерес представляет и тот факт, что у всех беременных с тяжелым течением коронавирусной инфекции выявлен слабый Т-клеточный ответ, также как и у их новорожденных (рис. 8, 9). Таким образом, можно предположить, что материнские клетки способны ускорять созревание иммунных клеток у плодов, тем самым обеспечивая существенные факторы роста и дифференцировки.
Повышение уровня материнских провоспалительных цитокинов, вызывающих активацию иммунной системы плода, стало известно как синдром фетального воспалительного ответа (СФВО), но при этом факторы, определяющие его проявление, а именно, ПОН плода и новорождённого, на сегодняшний день достоверно не определены, хотя описываются изменения в вилочковой железе у плода после повышения провоспалительных цитокинов у матери. Обоснованием этого исследования является оценка вилочковой железы плода, а именно, уменьшение ее размера. В соответствии с этой ситуацией мы обнаружили снижение размеров вилочковой железы у новорожденных на фоне COVID-19 у матери (рис. 10).
Наши результаты совпадают с данными мировой литературы о том, что тимус плода активно реагирует на системное материнское воспаление в течение гестационного периода [13][15][16]. Интересно, что гипервоспаление, вызванное высокой циркуляцией провоспалительных цитокинов и хемокинов при тяжелом течении COVID-19, может нарушить плацентарный барьер и способствовать внутриутробной передаче инфекции SARS-CoV-2 [17–19]. Следовательно, прямое цитопатическое действие инфекции SARS-CoV-2 и связанное с ней гипервоспаление во время беременности может вызвать плацентарную дисфункцию и увеличить риск внутриутробной передачи инфекции.
Как известно, чрезмерная продукция цитокинов, а именно, IL-6, IL-10, IL-1, TNF-α, IFN-γ и IL-4, а также хемокинов, таких как CXCL10 и CXCL11, в тяжелых случаях связана с повышенной частотой неблагоприятных исходов [20], а избыточная выработка IL-6 связана с неблагоприятными исходами беременности, включая преждевременные роды, преждевременный разрыв плодных оболочек, хориоамнионит [21]. Установлено, что высокий уровнь IL-6 наблюдается при тяжелых случаях COVID-19 и рассматривается в качестве центрального участника в развитии цитокинового шторма [20][22]. Также определено, что высокий уровень CXCL10 указывает на необычный воспалительный ответ, который проявляется при реакции «трансплантат против хозяина» [23]. Результаты проведенного нами исследования показывают, что в основной группе были обнаружены значительно более высокие уровни IL-6 и CXCL10, что требует обследования и наблюдения этих пациенток в долгосрочной перспективе, особенно в неизвестное постковидное время.
Недавние исследования свидетельствуют о решающей роли Т-клеток в выведении СOVID-19 и защите от развития тяжелых форм. Было показано, что координация адаптивных иммунных реакций, включая реакции CD4+ T-клеток, CD8+ T-клеток и антител, необходима для борьбы с COVID-19. Также было показано, что пиковая тяжесть заболевания обратно коррелирует с частотой встречаемости специфичных к SARS-CoV-2 CD4+ и CD8+ Т-клеток вместо титров антител к SARS-CoV-2 [24]. В других исследованиях Т-клеточный ответ был обнаружен у выздоравливающих пациентов с COVID-19 без отсутствия IgG к SARS-CoV-2 [25], и было продемонстрировано сохранение специфичных Т-клеток памяти у постковидных пациентов через 10 мес после заражения независимо от тяжести заболевания [26]. В совокупности эти исследования убедительно демонстрируют защитную роль Т-клеток при COVID-19. В нашем исследовании мы также выявили специфичный для SARS-CoV-2 Т-клеточный ответ как у беременных, так и у их плодов.
Значимость и ограничения исследования / Significance and limitations of the study
Главной сильной стороной нашего исследования было то, что изучена дизрегуляция клеточного регуляторного звена иммунной системы новорождённого на уровне Тreg лимфоцитов, проведен сравнительный анализ цитокинового профиля матери и новорождённого после перенесенной коронавирусной инфекции, а также определен уровень экспрессии клеточных маркеров. Ограничением нашего исследования является то, что мы не знаем, как долго активация иммунной системы сохраняется после рождения в силу сложностей лабораторного исследования и малого количества крови, которой можно получить у новорождённого.
Таблица 1. Клинико-анамнестическая характеристика и перинатальные исходы.
Table 1. Clinical and anamnestic characteristics and perinatal outcomes.
|
Характеристика Characteristic |
Основная группа / Main group |
Контрольная группа Control group n = 30 |
|
|
Подгруппа 1 Subgroup 1 n = 30 |
Подгруппа 2 Subgroup 2 n = 32 |
||
|
Возраст, лет, Ме Age, years, Ме |
34 |
32 |
34 |
|
Индекс массы тела, Ме Body mass index, Me |
28 |
27 |
25 |
|
Тяжелый COVID-19, n (%) Severe COVID-19, n (%) |
7 (23,3) |
6 (18,75) |
– |
|
Гестационный возраст < 37 нед, n (%) Gestational age < 37 weeks, n (%) |
3 (10,0) |
4 (12,5) |
1 (3,3) |
|
Баллы по шкале Апгар на 5-й минуте Apgar score at 5 minute |
7 |
8 |
9 |
Таблица 2. Концентрация цитокинов и хемокинов в пуповинной крови новорожденных.
Table 2. Cytokines and chemokines level in neonatal umbilical cord blood.
|
Параметр Parameter |
Контрольная группа Control group n= 30 |
Подгруппа 1 Subgroup 1 n = 30 |
р U-test |
||
|
Me |
Q1–Q3 |
Me |
Q1–Q3 |
||
|
GM-CSF |
19,2 |
14,6–28,7 |
23,3 |
15,4–47,1 |
0,582 |
|
IFN-γ |
4,4 |
3,5–6,9 |
6,3 |
3,2–11,9 |
0,436 |
|
IL-1α |
1,8 |
1,2–5,3 |
6,5 |
1,8–21,3 |
0,018 |
|
IL-6 |
2,9 |
1,3–10,1 |
13,8 |
6,1–38,4 |
0,032 |
|
IL-8 |
21,9 |
6,7–116,0 |
52,7 |
23,1–418,3 |
0,061 |
|
IL-10 |
5,4 |
2,1–13,0 |
12,5 |
7,7–49,1 |
0,003 |
|
MIP-1β |
154,8 |
136,1–287,7 |
501,2 |
247,6-1648,1 |
< 0,001 |
|
TNF-α |
12,1 |
9,1–18,3 |
25,2 |
16,9–28,7 |
< 0,001 |
|
СXCL-10 |
25,1 |
9,8–32,1 |
68,4 |
37,1–92,6 |
< 0,001 |
Примечание: GM-CSF – гранулоцитарно-макрофагальный колониестимулирующий фактор; IFN-γ – интерферон гамма; IL – интерлейкин; MIP-1β – воспалительный белок макрофагов-1β; TNF-α – фактор некроза опухоли альфа; СХСL-10 – хемокин 10; выделены значимые различия.
Note: GM-CSF – granulocyte-macrophage colony-stimulating factor; IFN-γ – interferon gamma; IL – interleukin; MIP-1β – macrophage inflammatory protein-1β; TNF-α – tumor necrosis factor alpha; СХСL 10 – chemokine (C-X-C motif) ligand 10; significant differences are highlighted in bold.
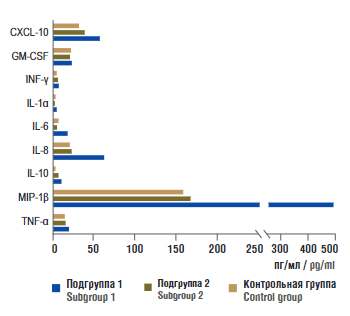
Рисунок 3. Концентрация цитокинов и хемокинов в пуповинной крови новорожденных от SARS-CоV-2-положительных матерей за 4–6 нед до родов (подгруппа 1), SАRS-CoV-2-положительных ранее в течение беременности (подгруппа 2) и матерей контрольной группы.
Примечание: СХСL-10 – хемокин 10; GM-CSF – гранулоцитарно-макрофагальный колониестимулирующий фактор; IFN-γ – интерферон гамма; IL – интерлейкин; MIP-1β – воспалительный белок макрофагов-1β; TNF-α – фактор некроза опухоли альфа.
Figure 3. Cytokines and chemokines level in neonates umbilical cord blood from paired SARS-CoV-2-positive mothers 4–6 weeks before delivery (subgroup 1), SARS-CoV-2-positive mothers earlier during pregnancy (subgroup 2) and control group.
Note: СХСL 10 – chemokine (C-X-C motif) ligand 10; GM-CSF – granulocyte-macrophage colony-stimulating factor; IFN-γ – interferon gamma; IL – interleukin; MIP-1β – macrophage inflammatory protein-1β; TNF-α – tumor necrosis factor alpha.
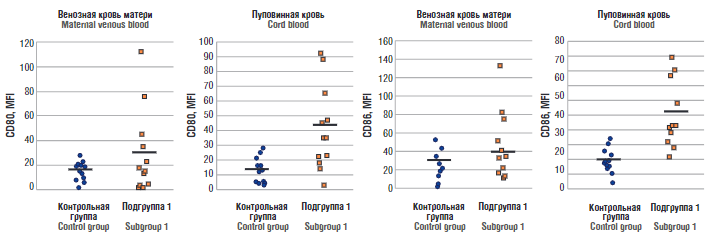
Рисунок 4. Маркеры активации дендритных клеток в образцах пуповинной и периферической крови беременных контрольной группы и подгруппы 1.
Примечание: MFI – медиана интенсивности флуоресценции, обозначена горизонтальной чертой.
Figure 4. Markers of dendritic cell activation in cord and peripheral blood samples of pregnant women in control group and subgroup 1.
Note: MFI – median fluorescence intensity, denoted by a horizontal bar.
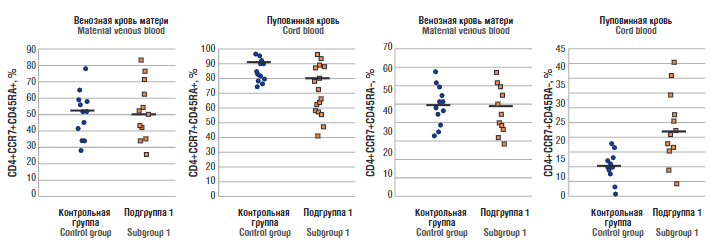
Рисунок 5. Т-клетки центральной памяти в образцах пуповинной и периферической крови беременных контрольной группы и подгруппы 1.
Примечание: горизонтальной чертой обозначена медиана.
Figure 5. Central memory T cells in cord and peripheral blood samples of pregnant women in control group and subgroup 1.
Note: the medians are denoted by a horizontal bar.
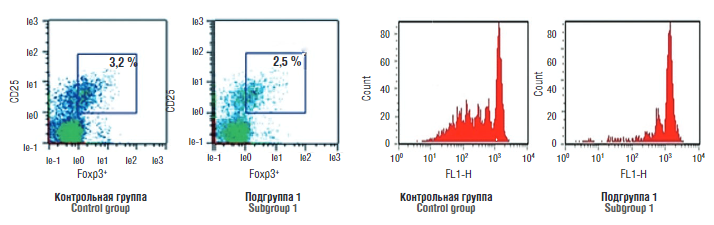
Рисунок 6. Количественная и функциональная характеристика Т-регуляторных клеток.
Figure 6. Regulatory T cell quantitative and functional characterization.
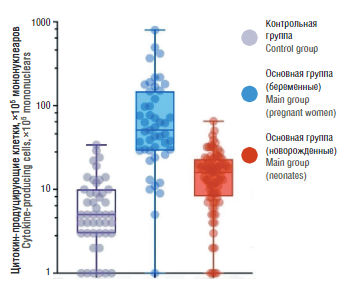
Рисунок 7. Специфичная к SARS-CoV-2 Т-клеточная память в группах исследования.
Figure 7. SARS-CoV-2-specific T-cell memory magnitude in study groups.
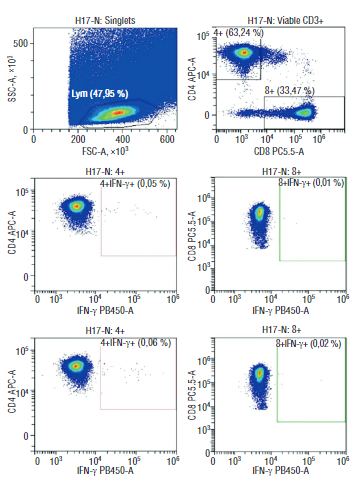
Рисунок 8. Цитофлуориметрическая визуализация субпопуляций Т-клеток к SARS-CоV-2 у плодов после легкого течения COVID-19 у матери.
Figure 8. Flow cytometry imaging of fetal SARS-CoV-2-specific T cell subsets in mild COVID-19 convalescent mothers.
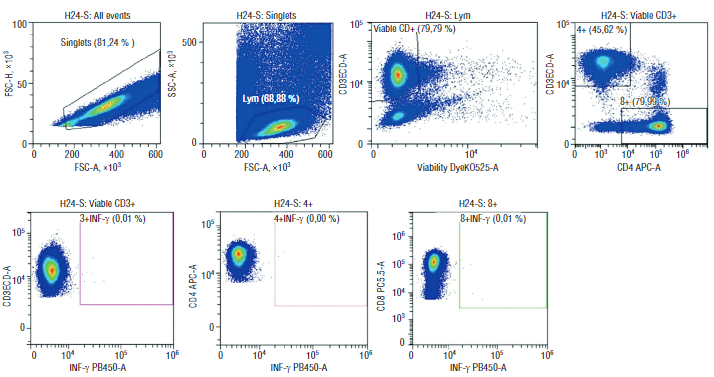
Рисунок 9. Цитофлуориметрическая визуализация субпопуляций Т-клеток к SARS-CоV-2 у плодов после тяжелого течения COVID-19 у матери.
Figure 9. Flow cytometry imaging of fetal SARS-CoV-2-specific T cell subsets in severe COVID-19 convalescent mothers.
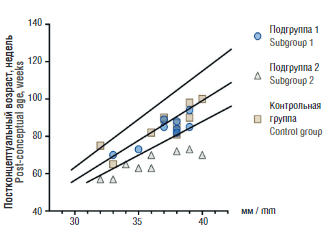
Рисунок 10. Размер вилочковой железы у новорожденных от SARS-CоV-2-положительных матерей за 4–6 нед до родов (подгруппа 1), SАRS-CoV-2-положительных ранее в течение беременности (подгруппа 2) и матерей контрольной группы.
Figure 10. Тhymus gland size in neonates from paired SARS-CoV-2-positive mothers 4–6 weeks before delivery (subgroup 1), SARS-CoV-2-positive mothers earlier during pregnancy (subgroup 2) and control group.
Заключение / Conclusion
Результаты настоящего исследования демонстрируют, что COVID-19 негативно повлиял на иммунную систему плода. Степень тяжести коронавирусной инфекции у беременных не зависит от тяжести СФВО, который, как правило, варьирует от самых незначительных изменений лабораторных показателей до развития сепсиса и септического шока. Таким образом, в клинической практике лучшее, что можно сделать для этих младенцев – это следить за ними как внутриутробно, так и в долгосрочной перспективе.
Список литературы
1. DeBolt C.A., Bianco A., Limaye M.A. et al. Pregnant women with severe or critical coronavirus disease 2019 have increased composite morbidity compared with nonpregnant matched controls. Am J Obstet Gynecol. 2021;510.e1–510.e12. https://doi.org/10.1016/j.ajog.2020.11.022.
2. Mehta P., McAuley D.F., Brown M. et al.; HLH across Speciality Collaboration, UK. COVID-19: consider cytokine storm syndromes and immunosuppression. Lancet. 2020;395(102229):1033–4. https://doi.org/10.1016/s0140-6736(20)30628-0.
3. Gustine J.N., Jones D. Immunopathology of hyperinflammation in COVID-19. Am J Pathol. 2021;191(1):4–17. https://doi.org/10.1016/j.ajpath.2020.08.009.
4. Luo X.-H., Zhu Y., Mao J., Du R.-C. T cell immunobiology and cytokine storm of COVID-19. Scand J Immunol. 2021;93(3):e12989. https://doi.org/10.1111/sji.12989.
5. Muyayalo K.P., Huang D.-H., Zhao S.-J. et al. COVID-19 and Treg/Th17 imbalance: potential relationship to pregnancy outcomes. Am J Reprod Immunol. 2020;84(5):e13304. https://doi.org/10.1111/aji.13304.
6. Gao Y.-M., Xu G, Wang B., Liu B.-C. Cytokine storm syndrome in coronavirus disease 2019: a narrative review. J Intern Med. 2021;289(2):147–61. https://doi.org/10.1111/joim.13144.
7. McElvaney O.J., McEvoy N.L., McElvaney O.F. et al. Characterization of the inflammatory response to severe covid-19 illness. Am J Respir Crit Care Med. 2020;202(6):812–21. https://doi.org/10.1164/rccm.202005-1583OC.
8. Feng X., Li S., Sun Q. et al. Immune-inflammatory parameters in covid-19 cases: a systematic review and meta-analysis. Front Med (Lausanne). 2020;7:301. https://doi.org/10.3389/fmed.2020.00301.
9. Wang J., Jiang M., Chen X., Montaner L.J. Cytokine storm and leukocyte changes in mild versus severe SARS-CoV-2 infection: review of 3939 COVID-19 patients in china and emerging pathogenesis and therapy concepts. J Leukoc Biol. 2020;108(1):17–41. https://doi.org/10.1002/JLB.3COVR0520-272R.
10. Wu R., Wang L., Kuo H.-C.D. et al. An update on current therapeutic drugs treating covid-19. Curr Pharmacol Rep. 2020;6(3):56–70. https://doi.org/10.1007/s40495-020-00216-7.
11. Stafstrom C.E., Jantzie L.L. COVID-19: neurological considerations in neonates and children. Children (Basel). 2020;7(9):133. https://doi.org/10.3390/children7090133.
12. Sinaci S., Ocal D.F., Seven B. et al. Vertical transmission of SARS-CoV-2: a prospective cross-sectional study from a tertiary center. J Med Virol. 2021;93(10):5864–72. https://doi.org/10.1002/jmv.27128.
13. Sule G.A., Ezgi T., Deniz O. et al. Influence of Covid-19 infection on fetal thymus size after recovery. J Perinatal Med. 2022;50(2):139–43. https://doi.org/10.1515/jpm-2021-0322.
14. Sciaky-Tamir Y., Hershkovitz R., Mazor M. et al. The use of imaging technology in the assessment of the fetal inflammatory response syndrome-imaging of the fetal thymus. Prenat Diagn. 2015;35(5):413–9. https://doi.org/10.1002/pd.4560.
15. McCarty K.L., Tucker M., Lee G., Pandey V. Fetal inflammatory response syndrome associated with maternal SARS-CoV-2 infection. Pediatrics. 2021;147(4):e2020010132. https://doi.org/10.1542/peds.2020-010132.
16. Gasthaus C.L., Schmitz R., Hammer K. et al. Influence of maternal HIV infection on fetal thymus size. J Perinat Med. 2019;48(1):67–73. https://doi.org/10.1515/jpm-2019-0060.
17. Fenizia C., Biasin M., Cetin I. et al. Analysis of SARS-CoV-2 vertical transmission during pregnancy. Nat Commun. 2020;11(1):5128. https://doi.org/10.1038/s41467-020-18933-4.
18. Al-Kuraishy H.M., Al-Gareeb A.I., Negm W.A. et al. Ursolic acid and SARS-CoV-2 infection: a new horizon and perspective. Inflammopharmacology. 2022;30(5):1493–501. https://doi.org/10.1007/s10787-022-01038-3
19. Alkazmi L., Al-Kuraishy H.M., Batiha G.E. et al. Roxadustat for SARS-CoV-2 infection: old signaling raised new hopes. Drugs R D. 2022;22(3):183–6. https://doi.org/10.1007/s40268-022-00397-0.
20. Castelli V., Cimini A., Ferri C. Cytokine storm in COVID-19: "When you come out of the storm, you won't be the same person who walked in". Front Immunol. 2020;11:2132. https://doi.org/10.3389/fimmu.2020.02132.
21. Qiu X., Zhang L., Tong Y et al. Interleukin-6 for early diagnosis of neonatal sepsis with premature rupture of the membranes: A meta-analysis. Medicine (Baltimore). 2018;97(47):e13146. https://doi.org/10.1097/MD.0000000000013146.
22. Pedersen S.F., Ho Y.-C. SARS-CoV-2: a storm is raging. J Clin Invest. 2020;130(5):2202–5. https://doi.org/10.1172/JCI137647.
23. Cuvelier G.D.E., Ng B., Abdossamadi S. et al. A diagnostic classifier for pediatric chronic graft-versus-host disease: results of the ABLE/PBMTC 1202 study. Blood Adv. 2022;bloodadvances.2022007715. https://doi.org/10.1182/bloodadvances.2022007715.
24. Moderbacher C.R., Ramirez S.I., Dan J.M. et al. Antigen-specific adaptive immunity to SARS-CoV-2 in acute COVID-19 and associations with age and disease severity. Cell. 2020;183(4):996-1012.e19. https://doi.org/10.1016/j.cell.2020.09.038.
25. Schwarzkopf S., Krawczyk A., Knop D. et al. Cellular immunity in COVID-19 convalescents with PCR-confirmed infection but with undetectable SARS-CoV-2-specific IgG. Emerg Infect Dis. 2021;27(1). https://doi.org/10.3201/2701.203772.
26. Jung J.H., Rha M.-S., Sa M. et al. SARS-CoV-2-specific T cell memory is sustained in COVID-19 convalescent patients for 10 months with successful development of stem cell-like memory T cells. Nat Commun. 2021;12(1):4043. https://doi.org/10.1038/s41467-021-24377-1.
Об авторах
Н. Р. ГашимоваРоссия
Гашимова Нилуфар Рамиль кызы – аспирант кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Л. Л. Панкратьева
Россия
Панкратьева Людмила Леонидовна – д.м.н., доцент, профессор кафедры педиатрии и организации здравоохранения ФГБУ «Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева» Министерства здравоохранения Российской Федерации; врач-неонатолог, врач-гематолог, руководитель научно-клинического центра ГБУЗ «Городская клиническая больница No 67 имени Л.А. Ворохобова Департамента здравоохранения города Москвы»
Scopus Author ID: 7006391091б, Author ID: 697284
117997 Москва, ул. Саморы Машела, д. 1
123423 Москва, ул. Саляма Адиля, д. 2/44
В. О. Бицадзе
Россия
Бицадзе Виктория Омаровна – д.м.н., профессор РАН, профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 6506003478, Researcher ID: F-8409-2017
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Д. Х. Хизроева
Россия
Хизроева Джамиля Хизриевна – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 57194547147, Researcher ID: F-8384-2017
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Н. А. Макацария
Россия
Макацария Наталия Александровна – к.м.н., доцент кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
Researcher ID: F-8406-2017
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
М. В. Третьякова
Россия
Третьякова Мария Владимировна – к.м.н., врач акушер-гинеколог, ассистент кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
А. С. Шкода
Россия
Шкода Андрей Сергеевич – д.м.н., профессор, главный врач
123423 Москва, ул. Саляма Адиля, д. 2/44
К. Н. Григорьева
Россия
Григорьева Кристина Николаевна – ассистент кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья
имени Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
В. И. Цибизова
Россия
Цибизова Валентина Ивановна – к.м.н., врач акушер-гинеколог НИЛ оперативной гинекологии Института перинатологии и педиатрии, врач отделения функциональной ультразвуковой диагностики
197341 Санкт-Петербург, ул. Аккуратова, д. 2
Ж.-К. Гри
Россия
Гри Жан-Кристоф – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова ФГАОУ ВО Первый Московский государственный медицинский университет имени И.М. Сеченова Министерства здравоохранения Российской Федерации (Сеченовский Университет), Москва; профессор гематологии, Университет Монпелье, Монпелье, Франция; иностранный член РАН, Москва
Researcher ID: AAA-2923-2019
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Франция, 34090 Монпелье, ул. Огюста Бруссоне, д. 163
Ф. Э. Якубова
Россия
Якубова Фидан Эльчин кызы – клинический ординатор кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Д. В. Блинов
Россия
Блинов Дмитрий Владиславович – к.м.н., ассистент кафедры спортивной медицины и медицинской реабилитации Института клинической медицины имени Н.В. Склифосовского ФГАОУ ВО Первый Московский государственный медицинский университет имени И.М. Сеченова Министерства здравоохранения Российской Федерации (Сеченовский Университет); руководитель по медицинским и научным вопросам, Институт Превентивной и Социальной Медицины; доцент кафедры спортивной, физической и реабилитационной медицины АНО ДПО «Московский медико-социальный институт имени Ф.П. Гааза»
Scopus Author ID: 6701744871, Researcher ID: E-8906-2017, RSCI: 9779-8290
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
127006 Москва, ул. Садовая-Триумфальная, д. 4–10
123056 Москва, 2-я Брестская ул., д. 5, с. 1–1а
А. Д. Макацария
Россия
Макацария Александр Давидович – д.м.н., профессор, академик РАН, зав. кафедрой акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова ФГАОУ ВО Первый Московский государственный медицинский университет имени И.М. Сеченова Министерства здравоохранения Российской Федерации (Сеченовский Университет); вице-президент Российского общества акушеров-гинекологов (РОАГ); Заслуженный врач Российской Федерации; Почетный профессор Венского Университета
Scopus Author ID: 57222220144, Researcher ID: M-5660-2016
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Рецензия
Для цитирования:
Гашимова Н.Р., Панкратьева Л.Л., Бицадзе В.О., Хизроева Д.Х., Макацария Н.А., Третьякова М.В., Шкода А.С., Григорьева К.Н., Цибизова В.И., Гри Ж., Якубова Ф.Э., Блинов Д.В., Макацария А.Д. Внутриутробная активация иммунной системы плода в ответ на COVID-19 у матери. Акушерство, Гинекология и Репродукция. 2023;17(2):188-201. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.404
For citation:
Gashimova N.R., Pankratyeva L.L., Bitsadze V.O., Khizroeva J.Kh., Makatsariya N.A., Tretyakova M.V., Shkoda A.S., Grigoreva K.N., Tsibizova V.I., Gris J., Yakubova F.E., Blinov D.V., Makatsariya A.D. Intrauterine activation of the fetal immune system in response to maternal COVID-19. Obstetrics, Gynecology and Reproduction. 2023;17(2):188-201. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.404

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































