Перейти к:
Осложнения и исходы беременности у пациенток с носительством антифосфолипидных антител при различных методах лечения
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.414
Аннотация
Введение. Антифосфолипидные антитела (АФА) многосторонне влияют на течение беременности путем нарушения микроциркуляции и системы гемостаза, также повреждая мембрану эндотелия, и в зависимости от срока гестации, на котором было оказано воздействие, приводят к ранним репродуктивным потерям и развитию плацента-ассоциированных осложнений. Планирование и ведение беременности у женщин в случае отсутствия у них критериев полного антифосфолипидного синдрома (АФС) на сегодняшний день является нерешенным вопросом. Отсутствие общепринятых стандартов лечения данной категории пациенток и невозможность обосновать диагноз согласно классификационным критериям АФС вызывает сложности при выборе терапевтической стратегии.
Цель: провести сравнительный анализ осложнений и исходов беременности при носительстве АФА в зависимости от метода терапии.
Материалы и методы. В период 2019–2021 гг. проведено проспективное исследование вступивших в беременность 150 пациенток, имевших отягощенный акушерско-гинекологический анамнез, циркуляцию АФА в крови. Учитывая риски развития акушерских и тромботических осложнений, всем пациенткам назначали профилактические дозы низкомолекулярных гепаринов (НМГ) и низкие дозы ацетилсалициловой кислоты (АСК). Пациентки были разделены на 3 группы с помощью генератора случайных чисел. Группа 1 (n = 50) в дополнение к назначенной терапии НМГ (эноксапарин натрия 40 мг 1 раз в сутки) и АСК (150 мг 1 раз в сутки) получала курсы мембранного плазмафереза (ПФ) по 4 сеанса за 1 курс в 6–8, 12–14 и 22–24 нед беременности; группа 2 (n = 50) получала курсы внутривенных иммуноглобулинов (ВВИГ) в курсовой дозе 300 мл (15 г) в аналогичные сроки; группа 3 (n = 50) не получала дополнительных методов терапии. Проводили сравнительный анализ частоты осложнений беременности – развития задержки роста плода (ЗРП), плода малого веса для гестационного срока, гестационной артериальной гипертензии (АГ), умеренной и тяжелой преэклампсии (ПЭ), анемии и исхода родов.
Результаты. Установлено, что в группе 3 была выше частота встречаемости гестационной АГ (р 2,3 < 0,0001), умеренной ПЭ (р 1,3 = 0,071; р2,3 = 0,0019), плода малого веса для гестационного возраста (р2,3 = 0,0002) и ЗРП (р2,3 = 0,003). В группе 1 по сравнению с группой 2 чаще встречались малого веса для гестационного возраста плод (р1,2 = 0,018) и ЗРП (р1,2 = 0,024), гестационная АГ (р1,2 = 0,0008), анемия (р1,2 < 0,0001) и латентный дефицит железа (р1,2 < 0,0001). Также в группах 2 и 3 чаще встречался внутрипеченочный холестаз при беременности по сравнению с группой 1 (р1,2 = 0,013; р1,3 = 0,003).
Заключение. В группе пациенток, получавших комплексную терапию в виде профилактических доз НМГ, низких доз АСК и курсов ВВИГ, риски развития плацента-ассоциированных осложнений и железодефицитных состояний оказались ниже относительно других групп, что свидетельствует о более высокой эффективности этой схемы терапии. Однако развитие внутрипеченочного холестаза при беременности реже встречалось в группе пациенток, получавших курсы мембранного ПФ, в отличие от применения курсов ВВИГ, что может быть объяснено дополнительным эффектом эфферентных методов терапии и может быть учтено при дифференцированном подходе к ведению пациенток с наличием патологии печени и желчного пузыря.
Ключевые слова
Для цитирования:
Багдасарова Ю.С., Зайнулина М.С., Николаева М.Г. Осложнения и исходы беременности у пациенток с носительством антифосфолипидных антител при различных методах лечения. Акушерство, Гинекология и Репродукция. 2023;17(2):176-187. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.414
For citation:
Bagdasarova Yu.S., Zainulina M.S., Nikolaeva M.G. Complications and outcomes of pregnancy in patients with antiphospholipid antibodies during various treatment methods. Obstetrics, Gynecology and Reproduction. 2023;17(2):176-187. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.414
Введение / Introduction
Антифосфолипидные антитела (АФА) влияют на течение беременности и в зависимости от срока гестации, на котором было оказано воздействие, приводят к ранним или поздним потерям беременности, развитию плацента-ассоциированных осложнений. Наиболее частыми проявлениями гестационных осложнений являются синдром привычной потери плода, неудачи экстракорпорального оплодотворения (ЭКО), преэклампсия (ПЭ), эклампсия, задержка роста плода (ЗРП), преждевременная отслойка нормально расположенной плаценты (ПОНРП) [1].
Основной мишенью АФА в случае акушерского антифосфолипидного синдрома (АФС) является плацента. АФА, фиксируясь на клеточных мембранах, приводят к активации процессов свертывания, нарушению процессов имплантации и инвазии трофо- бласта, нарушению образования синцитиотрофобласта из цитотрофобласта, уменьшают выработку хорионического гонадотропина и прогестерона, ингибируют механизмы ангиогенеза в эндометрии [2].
Имеются данные, что риск развития осложнений, обусловленных циркуляцией АФА, повышается в случае комбинации их разных видов. Наиболее высокий риск патологии беременности отмечается при тройном положительном тесте на АФА [3–5]. По данным A. Rottenstreich с соавт. (2018), у пациенток с тройным положительным тестом акушерские и сосудистые осложнения развивались достоверно чаще, чем у женщин, имеющих одинарный или двойной положительный тест – 42,3 % против 16,4 % соответственно (р = 0,002) [6]. По другим данным, вероятность рождения живого ребенка у женщин с тройным положительным результатом на АФА составляет всего 30 %, даже несмотря на проводимую терапию [7].
Лечение беременных с циркуляцией АФА представляет сложную проблему. Общепринятые подходы к терапии и профилактике осложнений беременности на сегодняшний день не разработаны, несмотря на активное изучение данной проблемы. По литературным данным, при отсутствии лечения прогноз для беременности неблагоприятный – гибель эмбриона или плода достигает 95–98 % случаев [8].
На современном этапе терапия первой линии женщин с акушерским АФС включает комбинацию низких доз ацетилсалициловой кислоты (АСК) в сочетании с профилактическими дозами низкомолекулярного гепарина (НМГ) в течение всего периода беременности и, по крайней мере, в течение 6 нед после родов под контролем показателей системы гемостаза [9–12]. Следует отметить, что такая тактика ведения женщин с наличием АФА является эффективной при условии раннего начала применения препаратов, в I триместре беременности [10].
Антиагрегантная терапия в виде АСК в дозе 75–150 мг/сут назначается совместно с антикоагулянтными препаратами. Метаанализ 5 исследований с участием 334 пациенток с привычным невынашиванием беременности показал, что частота живорождения у женщин, получавших комбинацию нефракционированного гепарина или НМГ с АСК составила 74,3 %, тогда как у женщин, получавших только АСК, 55,9 % [13]. В ряде исследований также продемонстрированы преимущества комбинированной терапии НМГ и АСК по сравнению с монотерапией АСК [13][14].
Одним из методов лечения АФС и носительства АФА, рефракторного к стандартной терапии, является применение внутривенного человеческого иммуноглобулина (ВВИГ) [15][16]. Среди положительных эффектов его применения можно отметить подавление синтеза антител, хорошую переносимость лечения, минимальные побочные эффекты [17].
Перспективным методом лечения является плазмаферез (ПФ). Основой его действия является удаление аутоантител к фосфолипидам, что способствует снижению активности аутоиммунного процесса. По некоторым данным, использование ПФ позволяет снизить уровень АФА в 3–5 и более раз по отношению к исходному уровню, а к концу курса лечения большинство из показателей иммуноглобулинов приближается к физиологической норме [18]. Наиболее целесообразно проводить ПФ перед планируемой беременностью или попыткой ЭКО, либо в I триместре беременности [19][20].
Следует отметить, что в настоящее время ПФ используется не изолированно, а совместно с другими методами лечения АФС и носительства АФА. В литературе приводятся положительные результаты применения ПФ в составе различной комплексной терапии.
По данным Е.С. Орловой и соавт. (2019), при сочетанном применении ПФ и иммунотерапии ВВИГ у беременных происходит более значительное снижение титра АФА по сравнению с пациентками, получавшими изолированно терапию только ВВИГ, или только ПФ, или только стандартную терапию НМГ в сочетании с низкими дозами АСК [21].
A. Ruffatti с соавт. (2016) наблюдали 18 беременностей у 14 женщин с отягощенным акушерско-гинекологическим анамнезом и циркуляцией АФА [22]. Все женщины получали ПФ еженедельно или иммуноадсорбцию каждые 2 нед в дозе 1 г/кг. В 17 (94,4 %) случаях беременность закончилась рождением живого новорожденного между 26-й и 37-й неделей гестации; одна женщина (5,5 %), родившая преждевременно в 24 нед, умерла от сепсиса через неделю после родов. Тяжелых осложнений беременности было всего 2 (11,1 %) случая; побочных эффектов лечения не зарегистрировано.
Цель: провести сравнительный анализ осложнений и исходов беременности при носительстве АФА в зависимости от метода терапии.
Материалы и методы / Materials and Methods
Дизайн исследования / Study design
В период 2019–2021 гг. проведено проспективное исследование вступивших в беременность 150 пациенток, имевших отягощенный акушерско-гинекологический анамнез, циркуляцию АФА в крови. Учитывая риски развития акушерских (ПЭ) и тромботических осложнений, всем пациенткам назначали профилактические дозы НМГ (эноксапарин натрия 40 мг 1 раз в сутки) и низкие дозы АСК (150 мг 1 раз в сутки).
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения: женщины репродуктивного возраста с носительством АФА и волчаночного антикоагулянта (ВА); отягощенный тромботический или акушерско-гинекологический анамнез (ранние и поздние репродуктивные потери, ЗРП, антенатальная гибель плода, ПОНРП, бесплодие, неудачи ЭКО, ПЭ); I триместр беременности; подписанное информированное согласие.
Критерии исключения: тяжелая сопутствующая соматическая патология (декомпенсированная почечная недостаточность, печеночная недостаточность, сердечно-сосудистая недостаточность, сахарный диа- бет 1-го и 2-го типа); наличие эндокринных, генетических, инфекционных и анатомических факторов невынашивания беременности.
Группы обследованных / Study groups
Беременные пациентки с носительством АФА были разделены на 3 группы с помощью генератора случайных чисел. В дополнение к назначенной терапии НМГ (эноксапарин натрия 40 мг 1 раз в сутки) и АСК (150 мг 1 раз в сутки) группа 1 (n = 50) в 6–8 нед, 12–14 нед и 22–24 нед беременности получала курсы мембранного ПФ. Курс состоял из 4 сеансов, за 1 сеанс объем плазмафильтрата составлял 30 % от объема циркулирующей плазмы пациентки, объем инфузионной терапии составлял в 2 раза больше полученного плазмафильтрата. В качестве антикоагулянтов использовали нефракционированный гепарин (3500–5000 ЕД), а также 4 % раствор цитрата натрия в объеме до 100 мл (в зависимости от необходимого объема плазмафильтрата). Группа 2 (n = 50) в аналогичные сроки беременности получала курсы ВВИГ в курсовой дозе 300 мл (15 г); группа 3 (n = 50) не получала дополнительных методов терапии (рис. 1).
Методы обследования / Study methods
Все женщины проходили комплексное клинико- лабораторное обследование, включавшее сбор анамнеза, лабораторные методы: иммуноферментный анализ определения АФА, ВА, клинический и биохимический анализ крови, а также инструментальное исследование, в частности, ультразвуковое исследование, включавшее в себя ультразвуковую фетометрию и доплерометрическое исследование плодовоплацентарного и маточно-плацентарного кровотока (систоло-диастолическое отношение, индекс резистентности, пульсационный индекс).
Этические аспекты / Ethical aspects
Все процедуры, выполненные в данном исследовании, соответствовали этическим стандартам Хельсинской декларации 1964 г. и ее последующим изменениям и сопоставимым нормам этики. Все женщины были проинформированы о характере исследования и подписали информированное согласие на его проведение.
Статистический анализ / Statistical analysis
Статистическая обработка результатов исследования проводилась с использованием методов биостатистики, реализованных в пакетах программ Statistica 6.1 (StatSoft Inc., США). Качественные переменные описаны абсолютными и относительными частотами (процентами), минимальными и максимальными значениями, рассчитывали среднее арифметическое и статистическую ошибку среднего (M ± m). Для межгрупповых сравнений по качественным приз- накам использован точный критерий χ2 или точный критерий Фишера. Гипотезу о равенстве двух значений отвергали при уровне значимости p < 0,05.
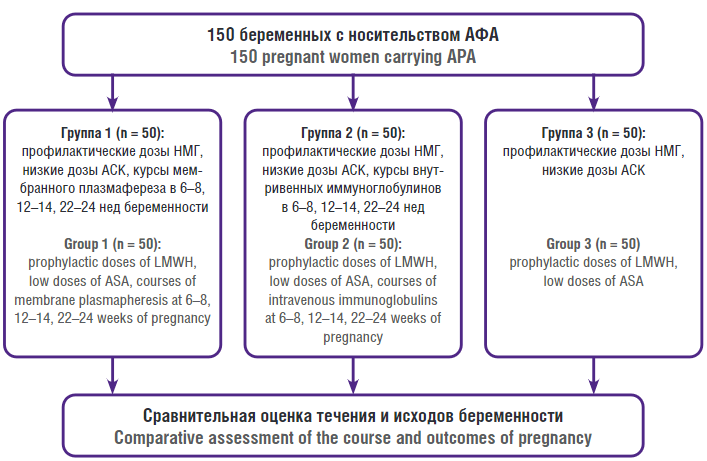
Рисунок 1. Дизайн исследования.
Примечание: АФА – антифосфолипидные антитела; НМГ – низкомолекулярные гепарины; АСК – ацетилсалициловая кислота.
Figure 1. Study design.
Note: APA – antiphospholipid antibodies; LMWH – low molecular weight heparins; ASA – acetylsalicylic acid.
Результаты и обсуждение / Results and Discussion
Клиническая характеристика обследованных пациенток / Clinical characteristics of patients examined
В исследование были включены 150 пациенток, имевших в анамнезе невынашивание беременности, плацента-ассоциированные и тромбоэмболические осложнения, циркуляцию АФА в крови. Средний возраст женщин составил 30,5 ± 2,8 лет.
Частота осложнений беременности в анамнезе у женщин, вступивших в исследование, представлена в таблице 1. Как можно видеть, наиболее часто встречались невынащивание беременности в I триместре, неудачные попытки ЭКО и антенатальная гибель плода.
По наличию сопутствующей экстрагенитальной патологии получены следующие данные, представленные в таблице 2.
Статистически значимых различий между группами не выявлено, таким образом все группы женщин были сопоставимы по возрасту, частоте выявления акушерских осложнений и сопутствующей экстрагенитальной патологии.
Структура и частота осложнений беременности / Pattern and frequency of pregnancy complications
Структура и частота осложнений беременности в группах обследованных пациенток представлена в таблице 3 и на рисунке 2.
Малый для гестационного возраста плод наиболее часто диагностировался в группе 3 при сравнении с группой 2 (р2,3 = 0,0002); при сравнении с группой 1 статистически значимых различий не установлено (р1,3 = 0,170); при сравнении групп 1 и 2 чаще малый для гестационного возраста плод встречался в группе 1 (р1,2 = 0,018).
Встречаемость ЗРП значимо различалась между группами (р < 0,0001). Наиболее часто осложнение выявлено в группе 3 при сравнении с группой 2 (р2,3 = 0,003); при сравнении с группой 1 статистически значимых различий не наблюдалось (р1,3 = 0,150); при сравнении групп 1 и 2 ЗРП чаще встречалась в группе 1 (р1,2 = 0,024).
Развитие гестационной артериальной гипертензии (АГ) значимо различалось между группами (р < 0,0001). Наиболее часто гестационная АГ встречалась в группе 3 при сравнении с группой 2 (р2,3 < 0,0001); при сравнении с группой 1 статистически значимых различий не наблюдалось (р1,3 = 0,089); при сравнении групп 1 и 2 гестационная АГ чаще встречалась в группе 1 (р1,2 = 0,0008).
Развитие умеренной ПЭ значимо различалось между группами (р = 0,007). Наиболее умеренная ПЭ встречалась в группе 3 при сравнении с группами 1 и 2 (р1,3 = 0,071; р2,3 = 0,0019); при сравнении групп 1 и 2 статистически значимых различий не наблюдалось (р1,2 = 0,064). При оценке осложнения беременности в виде тяжелой ПЭ статистически значимых различий между группами беременных не наблюдалось (р = 0,422).
Развитие внутрипеченочного холестаза при беременности значимо различалось между группами (р = 0,007). Наиболее часто осложнение встречалось в группах 2 и 3 при сравнении с группой 1 (р1,2 = 0,013; р1,3 = 0,003); при сравнении групп 2 и 3 статистически значимых различий не наблюдалось (р2,3 = 0,987).
Развитие анемии при беременности значимо различалось между группами (р < 0,0001). Наиболее часто анемия встречалась в группе 1 по сравнению с группами 2 и 3 (р1,2 < 0,0001; р1,3 < 0,0001); при сравнении групп 2 и 3 статистически значимых различий не наблюдалось (р2,3 = 0,897).
При оценке латентного дефицита железа группы значимо различалось между собой (р < 0,0001). Наиболее часто осложнение встречалось в группе 1 по сравнению с группами 2 и 3 (р1,2 < 0,0001; р1,3 < 0,0001); при сравнении групп 2 и 3 статистически значимых различий не наблюдалось (р2,3 = 0,727).
Таким образом, в группе 3 наиболее часто встречались малый для гестационного возраста плод и ЗРП, умеренная ПЭ и гестационная АГ по сравнению с группами 1 и 2.
Сравнение групп 1 и 2 установило, что в группе 1 чаще встречались малый для гестационного возраста плод и ЗРП, гестационная АГ, анемия и латентный дефицит железа, в группе 2 чаще встречался внутрипеченочный холестаз при беременности.
Оценка исходов родов / Assessment of birth outcomes
При оценке исходов родов у пациенток с носительством АФА получены следующие результаты.
В группе 1 роды в срок случились у 47 (94 %) пациенток, 3 (6 %) пациентки родоразрешены путем операции кесарева сечения по поводу тяжелой ПЭ (один случай) и по поводу отсутствия эффекта от лечения умеренной ПЭ (2 случая).
В группе 2 роды в срок случились у 49 (98 %) пациенток: преждевременные роды после 34 нед беременности оперативным путем закончились в одном (2 %) случае по поводу тяжелой ПЭ.
В группе 3 роды в срок случились у 46 (92 %) женщин, у 3 (6 %) пациенток произошли преждевременные роды после 34 нед, показанием явилась тяжелая ПЭ. У одной пациентки случился самопроизвольный выкидыш в сроке 14/15 нед, причиной явился инфекционный фактор (острый метроэндометрит по данным гистологического исследования), пациентка была исключена из исследования.
Статистических различий при преждевременных родах в антропометрических показателях и оценке по шкале Апгар новорожденных не получено, кровопотеря была в пределах физиологических значений.
В таблице 4 представлены данные пациенток, у которых случились срочные роды; значимых различий ни по одному из показателей не обнаружено.
В таблице 5 представлены данные по пациенткам, родоразрешенных через естественные родовые пути и путём операции кесарева сечения. В группе 3 чаще встречалось оперативное родоразрешение по сравнению с группой 1; статистически значимых различий между другими группами не получено.
На сегодняшний день нет единых рекомендаций по лечению пациенток с носительством АФА, что вызывает сложности при выборе тактики ведения беременности у данной группы женщин.
В нашем исследовании в группе пациенток, получавших курсы ВВИГ, частота развития умеренной и тяжелой ПЭ, ЗРП была значимо ниже относительно других групп, что свидетельствует о более высокой эффективности комплексной терапии, использованной у этой группы пациенток. Также следует отметить отсутствие венозных тромбоэмболических осложнений в нашем исследовании, что говорит об эффективной профилактике назначения профилактических доз НМГ.
В литературных источниках имеется мало данных по исследуемой теме. В ряде исследований продемонстрированы преимущества комбинированной терапии НМГ и АСК по сравнению с монотерапией АСК [13][14]. Имеются данные о высокой эффективности и низкой частоте осложнений беременности при применении ВВИГ. По мнению ряда авторов, ВВИГ в последние несколько лет получили широкое распространение в терапии АФС при беременности, особенно в комплексной терапии АФС, рефрактерного к стандартной терапии, и при катастрофическом АФС [22–24].
Таблица 1. Структура осложнений беременности в анамнезе у обследованных пациенток.
Table 1. The pattern of previous pregnancy complications in patients examined.
|
Осложнение беременности Pregnancy complication |
Группа 1 Group 1 (n = 50) n (%) |
Группа 2 Group 2 (n = 50) n (%) |
Группа 3 Group 3 (n = 50) n (%) |
p |
|
Неудачные попытки ЭКО Failed IVF attempts |
13 (26,0) |
10 (20,0) |
8 (16,0) |
p = 0,462 p1,2 = 0,476 p1,3 = 0,220 p2,3 = 0,795 |
|
Невынашивание беременности в I триместре Miscarriage in the first trimester |
27 (54,0) |
30 (60,0) |
27 (54,0) |
p = 0,784 p1,2 = 0,545 p1,3 = 1,000 p2,3 = 0,545 |
|
Невынащивание беременности во II триместре Miscarriage in the second trimester |
6 (12,0) |
6 (12,0) |
8 (16,0) |
p = 0,656 p1,2 = 1,000 p1,3 = 0,774 p2,3 = 0,554 |
|
Антенатальная гибель плода Antenatal fetal death |
7 (14,0) |
8 (16,0) |
3 (6,0) |
p = 0,266 p1,2 = 1,000 p1,3 = 0,318 p2,3 = 0,200 |
|
Преждевременная отслойка нормально расположенной плаценты Premature detachment of a normally located placenta |
2 (4,0) |
1 (5,0) |
4 (8,0) |
p = 0,350 p1,2 = 1,000 p1,3 = 0,678 p2,3 = 0,362 |
|
Малый для гестационного возраста плод Small for gestational age fetus |
1 (5,0) |
2 (40,0) |
1 (5,0) |
p = 0,773 p1,2 = 1,000 p1,3 = 1,000 p2,3 = 1,000 |
|
Задержка роста плода Fetal growth retardation |
7 (14,0) |
3 (6,0) |
3 (6,0) |
p = 0,260 p1,2 = 0,318 p1,3 = 0,318 p2,3 = 1,000 |
|
Преэклампсия Preeclampsia |
3 (6,0) |
3 (6,0) |
6 (12,0) |
p = 0,443 p1,2 = 1,000 p1,3 = 0,487 p2,3 = 0,487 |
Примечание: р – статистическая значимость различий между группами 1, 2, 3; р1,2 – статистическая значимость различий между группами 1 и 2; р1,3 – статистическая значимость различий между группами 1 и 3; р2,3 – статистическая значимость различий между группами 2 и 3; ЭКО – эктракорпоральное оплодотворение.
Note: p – significant differences between groups 1, 2, 3; р1,2 – significant differences between groups 1 and 2; р1,3 – significant differences between groups 1 and 3; р2,3 – significant differences between groups 2 and 3; IVF - in vitro fertilization.
Таблица 2. Структура сопутствующей экстрагенитальной патологии у обследованных пациенток.
Table 2. The pattern of concomitant extragenital pathology in patients examined.
|
Сопутствующая патология Comorbidity |
Группа 1 Group 1 (n = 50) n (%) |
Группа 2 Group 2 (n = 50) n (%) |
Группа 3 Group 3 (n = 50) n (%) |
p |
|
Аутоиммунные заболевания (аутоиммунный тиреоидит) Autoimmune diseases (autoimmune thyroiditis) |
16 (32,0) |
11 (22,0) |
9 (18,0) |
p = 0,265 p1,2 = 0,373 p1,3 = 0,106 p2,3 = 0,461 |
|
Тромбоз глубоких вен при беременности Deep vein thrombosis during pregnancy |
4 (8,0) |
2 (4,0) |
6 (12,0) |
p = 0,337 p1,2 = 0,678 p1,3 = 0,741 p2,3 = 0,269 |
|
Хроническая артериальная гипертензия Chronic arterial hypertension |
3 (6,0) |
4 (8,0) |
2 (4,0) |
p = 0,701 p1,2 = 1,000 p1,3 = 1,000 p2,3 = 0,678 |
|
Хронический холецистит/холецистэктомия Chronic cholecystitis/cholecystectomy |
1 (2,0) |
2 (4,0) |
0 (0) |
p = 0,358 p1,2 = 1,000 p1,3 = 0,495 p2,3 = 0,495 |
|
Бронхиальная астма Bronchial asthma |
1 (2,0) |
1 (2,0) |
0 (0) |
p = 0,602 p1,2 = 1,000 p1,3 = 1,000 p2,3 = 1,000 |
|
Варикозная болезнь Varicose disease |
10 (20,0) |
7 (14,0) |
9 (18,0) |
p = 0,722 p1,2 = 0,595 p1,3 = 1,000 p2,3 = 0,786 |
|
Хронический пиелонефрит Chronic pyelonephritis |
9 (18,0) |
5 (10,0) |
4 (8,0) |
p = 0,266 p1,2 = 0,388 p1,3 = 0,234 p2,3 = 0,786 |
Примечание: р – статистическая значимость различий между группами 1, 2, 3; р1,2 – статистическая значимость различий между группами 1 и 2; р1,3 – статистическая значимость различий между группами 1 и 3; р2,3 – статистическая значимость различий между группами 2 и 3.
Note: p – significant differences between groups 1, 2, 3; р1,2 – significant differences between groups 1 and 2; р1,3 – significant differences between groups 1 and 3; р2,3 – significant differences between groups 2 and 3.
Таблица 3. Структура осложнений беременности в группах обследованных пациенток.
Table 3. Pattern of pregnancy complications in the groups of patients examined.
|
Осложнение Complication |
Группа 1 Group 1 (n = 50) n (%) |
Группа 2 Group 2 (n = 50) n (%) |
Группа 3 Group 3 (n = 50) n (%) |
p |
|
Нарушение гемодинамики 1-ой степени Grade 1 haemodynamic compromise |
21 (42,0) |
11 (22,0) |
30 (61,2) |
р < 0,0001 р1,2 = 0,024 р1,3 = 0,0015 р2,3 = 0,0001 |
|
Малый для гестационного возраста плод Small for gestational age fetus |
11 (22,0) |
5 (10,0) |
21 (42,9) |
р = 0,001 р1,2 = 0,018 р1,3 = 0,170 р2,3 = 0,0002 |
|
Задержка роста плода Fetal growth retardation |
4 (8,0) |
0 (0) |
8 (16,3) |
р < 0,0001 р1,2 = 0,024 р1,3 = 0,150 р2,3 = 0,003 |
|
Гестационная артериальная гипертензия Gestational arterial hypertension |
13 (26,0) |
1 (2,0) |
16 (32,7) |
р < 0,0001 р1,2 = 0,0008 р1,3 = 0,089 р2,3 < 0,0001 |
|
Умеренная преэклампсия Moderate preeclampsia |
7 (14,0) |
2 (4,0) |
13 (26,5) |
р = 0,007 р1,2 = 0,064 р1,3 = 0,071 р2,3 = 0,0019 |
|
Тяжелая преэклампсия Severe preeclampsia |
1 (2,0) |
1 (2,0) |
3 (6,1) |
р = 0,422 |
|
Внутрипеченочный холестаз при беременности Intrahepatic cholestasis during pregnancy |
5 (10,0) |
16 (32,0) |
17 (35,4) |
р = 0,007 р1,2 = 0,013 р1,3 = 0,003 р2,3 = 0,987 |
|
Анемия Anemia |
29 (58,0) |
2 (8,0) |
6 (12,2) |
р < 0,0001 р1,2 < 0,0001 р1,3 < 0,0001 р2,3 = 0,897 |
|
Латентный дефицит железа Latent iron deficiency |
39 (78,0) |
12 (24,0) |
14 (28,6) |
р < 0,0001 р1,2 < 0,0001 р1,3 < 0,0001 р2,3 = 0,727 |
Примечание: р – статистическая значимость различий между группами 1, 2, 3; р1,2 – статистическая значимость различий между группами 1 и 2; р1,3 – статистическая значимость различий между группами 1 и 3; р2,3 – статистическая значимость различий между группами 2 и 3.
Note: p – significant differences between groups 1, 2, 3; р1,2 – significant differences between groups 1 and 2; р1,3 – significant differences between groups 1 and 3; р2,3 – significant differences between groups 2 and 3.
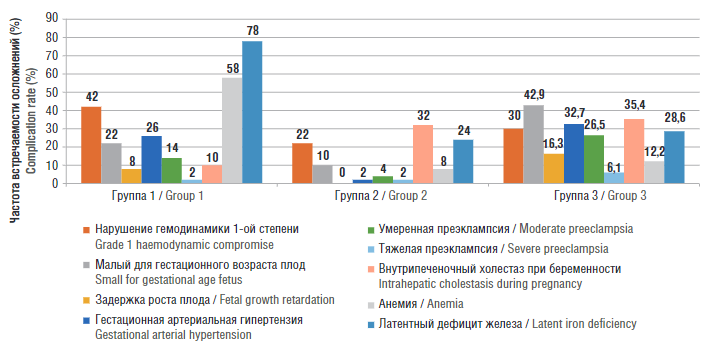
Рисунок 2. Структура осложнений беременности в группах обследованных пациенток.
Figure 2. Pattern of pregnancy complications in the groups of patients examined.
Таблица 4. Исходы срочных родов в группах обследованных пациенток.
Table 4. Outcomes of term pregnancy in the groups of patients examined.
|
Показатель Parameter |
Группа 1 / Group 1 (n = 47) |
Группа 2 / Group 2 (n = 49) |
Группа 3 / Group 3 (n = 46) |
p |
|
Масса тела ребенка, г, M ± m Neonate body weight, g, M ± m Min÷Max |
3312,89 ± 455,08 2250,00÷4380,00 |
3296,51 ± 561,06 2450,00÷4250,00 |
3183,90 ± 426,19 2100,00÷4050,00 |
р > 0,05 |
|
Рост ребенка, см, M ± m Neonate height, cm, M ± m Min÷Max |
50,24 ± 1,81 46,00÷55,00 |
49,63 ± 3,31 47,00÷56,00 |
49,90 ± 1,76 46,00÷55,00 |
р > 0,05 |
|
Оценка по шкале Апгар на 1-й минуте, M ± m 1 minute Apgar score, M ± m Min÷Max |
7,89 ± 0,31 7,00÷8,00 |
7,95 ± 0,30 6,00÷8,00 |
7,98 ± 0,16 7,00÷8,00 |
р > 0,05 |
|
Оценка по шкале Апгар на 5-й минуте, M ± m 5 minute Apgar score, M ± m Min÷Max |
8,84 ± 0,37 8,00÷9,00 |
8,81 ± 0,45 7,00÷9,00 |
8,68 ± 0,47 8,00÷9,00 |
р > 0,05 |
|
Кровопотеря в родах, мл, M ± m Blood loss during childbirth, ml, M ± m Min÷Max |
375,00 ± 152,54 200,00÷830,00 |
378,60 ± 112,09 250,00÷650,00 |
465,85 ± 132,43 250,00÷550,00 |
р > 0,05 |
Примечание: р – статистическая значимость различий между группами 1, 2, 3.
Note: p – significant differences between groups 1, 2, 3.
Таблица 5. Методы родоразрешения в группах обследованных пациенток.
Table 5. Route of delivery in the groups of patients examined.
|
Роды Delivery |
Группа 1 / Group 1 (n = 50) n (%) |
Группа 2 / Group 2 (n = 50) n (%) |
Группа 3 / Group 3 (n = 49) n (%) |
p |
|
Через естественные родовые пути Natural delivery |
30 (60,0) |
29 (58,0) |
20 (40,8) |
р = 0,088 р1,2 = 0,839 р1,3 = 0,046 р2,3 = 0,072 |
|
Путем операции кесарева сечения Cesarian section |
20 (40,0) |
21 (42,0) |
29 (59,2) |
р = 0,142 р1,2 = 0,839 р1,3 = 0,072 р2,3 = 0,110 |
Примечание: р – статистическая значимость различий между группами 1, 2, 3; р1,2 – статистическая значимость различий между группами 1 и 2; р1,3 – статистическая значимость различий между группами 1 и 3; р2,3 – статистическая значимость различий между группами 2 и 3.
Note: p – significant differences between groups 1, 2, 3; р1,2 – significant differences between groups 1 and 2; р1,3 – significant differences between groups 1 and 3; р2,3 – significant differences between groups 2 and 3.
Заключение / Conclusion
Таким образом, в группе пациенток, получавших курсы ВВИГ в дополнение к профилактическим дозам НМГ и низким дозам АСК, риски развития плацента-ассоциированных осложнений и железодефицитных состояний оказались ниже относительно других групп, что свидетельствует о более высокой эффективности комплексной терапии при носительстве АФА. Однако развитие внутрипеченочного холестаза при беременности реже встречалось в группе пациенток, получавших курсы мембранного ПФ, что может быть объяснено дополнительным эффектом эфферентных методов терапии и может быть учтено при дифференцированном подходе к ведению пациенток с наличием патологии печени и желчного пузыря.
Список литературы
1. da Silva Santos T., Ieque A.L., de Carvalho H.C. et al. Antiphospholipid syndrome and recurrent miscarriage: A systematic review and metaanalysis. J Reprod Immunol. 2017;123:78–87. https://doi.org/10.1016/j.jri.2017.09.007.
2. Antovic A., Sennström M., Bremme K., Svenungsson E. Obstetric antiphospholipid syndrome. Lupus Sci Med. 2018;5(1):e000197. https://doi.org/10.1136/lupus-2016-000197.
3. Negrini S., Pappalardo F., Murdaca G. et al. The antiphospholipid syndrome: from pathophysiology to treatment. Clin Exp Med. 2017;17(3):257–67. https://doi.org/10.1007/s10238-016-0430-5.
4. Chighizola C.B., Gerosa M., Meroni P.L. New tests to detect antiphospholipid antibodies: anti-domain I beta-2-glycoprotein-I antibodies. Curr Rheumatol Rep. 2014;16(2):402. https://doi.org/10.1007/s11926-013-0402-7.
5. Вереина Н.К., Чулков Вас.С., Чулков Вл.С., Мовчан Т.В. Взаимосвязь длительной персистенции антифосфолипидных антител с клиническим и лабораторным профилем риска у женщин. Терапия. 2020;6(1):52–8. https://doi.org/10.18565/therapy.2020.1.52-58.
6. Rottenstreich A., Arad A., Terespolsky H. et al. Antiphospholipid antibody profile-based outcome of purely vascular and purely obstetric antiphospholipid syndrome. J Thromb Thrombolysis. 2018;46(2):166–73. https://doi.org/10.1007/s11239-018-1672-8.
7. Saccone G., V. Berghella V., Maruotti G.M. et al. Antiphospholipid antibody profile based obstetric outcomes of primary antiphospholipid syndrome: the PREGNANTS study. Am J Obstet Gynecol. 2017;216(5):525.e1–525.e12. https://doi.org/10.1016/j.ajog.2017.01.026.
8. Czwalinna A., Bergmann F. Prevention of pregnancy complications in antiphospholipid syndrome. Hamostaseologie. 2020;40(2):174–83. https://doi.org/10.1055/a-1113-0689.
9. Ruffatti A., Favaro M., Calligaro A. et al. Management of pregnant women with antiphospholipid antibodies. Expert Rev Clin Immunol. 2019;15(4):347–58. https://doi.org/10.1080/1744666X.2019.1565995.
10. Bates S.M., Greer I.A., Middeldorp S. et al. VTE, thrombophilia, antithrombotic therapy, and pregnancy: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012;141(2 Suppl):e691S–e736S. https://doi.org/10.1378/chest.11-2300.
11. Тетруашвили Н.К., Ионанидзе Т.Б., Агаджанова А.А., Менжинская И.В. Использование бемипарина в лечении акушерского антифосфолипидного синдрома. Гинекология. 2015;17(3):49–51.
12. Tektonidou M.G., Andreoli L., Limper M. et al. EULAR recommendations for the management of antiphospholipid syndrome in adults. Ann Rheum Dis. 2019;78(10):1296–304. https://doi.org/10.1136/annrheumdis-2019-215213.
13. Naru T., Khan R.S., Ali R. Pregnancy outcome in women with antiphospholipid syndrome on low-dose aspirin and heparin: a retrospective study. East Mediterr Health J. 2010;16:308–12.
14. Mohamed K.A.A., Saad A.S. Enoxaparin and aspirin therapy for recurrent pregnancy loss due to anti-phospholipid syndrome (APS). Middle East Fertil Soc J. 2014;19(3):176–82. https://doi.org/10.1016/j.mefs.2013.12.004.
15. Сельков С.А., Зайнулина М.С., Чугунова А.А. и др. Клинико-иммунологическое обоснование использования иммуноглобулинов для внутривенного введения в лечении антифосфолипидного синдрома при беременности. Журнал акушерства и женских болезней. 2012;61(2):11–5.
16. D'Mello R.J., Hsu C.-D., Chaiworapongsa P., Chaiworapongsa T. Update on the use of intravenous immunoglobulin in pregnancy. Neoreviews. 2021;22(1):e7–e24. https://doi.org/10.1542/neo.22-1-e7.
17. Christiansen O.B., Kolte A.M., Krog M.C. et al. Treatment with intravenous immunoglobulin in patients with recurrent pregnancy loss: An update. J Reprod Immunol. 2019;133:37–42. https://doi.org/10.1016/j.jri.2019.06.001.
18. Кравченко Е.Н., Гончарова А.А. Корреляционные связи между показателями активности свертывающей системы крови и содержанием антифосфолипидных антител у женщин с невынашиванием беременности. Гинекология. 2019;21(5):53–8. https://doi.org/10.26442/20795696.2019.5.190668.
19. Rose H.L., Ho W.K. Management of very high risk pregnancy with secondary anti-phospholipid syndrome and triple positivity to the antiphospholipid antibodies. J Thromb Thrombolysis. 2014;38(4):453–6. https://doi.org/10.1007/s11239-014-1080-7.
20. Mayer-Pickel K., Horn S., Lang U., Cervar-Zivkovic M. Response to plasmapheresis measured by angiogenic factors in a woman with antiphospholipid syndrome in pregnancy. Case Rep Obstet Gynecol. 2015;2015:123408. https://doi.org/10.1155/2015/123408.
21. Орлова Е.С., Чепанов С.В., Корнюшина Е.А. и др. Оценка динамики титра антифосфолипидных антител у беременных с различными подходами к терапии антифосфолипидного синдрома. Акушерство и гинекология Санкт-Петербурга. 2019;(2):33.1.
22. Ruffatti A., M. Favaro M., Hoxha A. et al. Apheresis and intravenous immunoglobulins used in addition to conventional therapy to treat high-risk pregnant antiphospholipid antibody syndrome patients. A prospective study. J Reprod Immunol. 2016;115:14–9. https://doi.org/10.1016/j.jri.2016.03.004.
23. Alijotas-Reig J. Treatment of refractory obstetric antiphospholipid syndrome: the state of the art and new trends in the therapeutic management. Lupus. 2013;22(1):6–17. https://doi.org/10.1177/0961203312465782.
24. Tenti S., Cheleschi S., Guidelli G.M. et al. Intravenous immunoglobulins and antiphospholipid syndrome: How, when and why? A review of the literature. Autoimmun Rev. 2016;15(3):226–35. https://doi.org/10.1016/j.autrev.2015.11.009.
Об авторах
Ю. С. БагдасароваРоссия
Багдасарова Юлия Сергеевна – к.м.н., старший лаборант кафедры акушерства, гинекологии и репродуктологии ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова» Министерства здравоохранения Российской Федерации; врач акушер-гинеколог акушерского отделения патологии беременности СПб ГБУЗ «Родильный дом No 6 имени профессора В.Ф. Снегирева»
197022 Санкт-Петербург, ул. Льва Толстого, д. 6/8
192014 Санкт-Петербург, ул. Маяковского, д. 5
М. С. Зайнулина
Россия
Марина Сабировна – д.м.н., профессор кафедры акушерства, гинекологии и репродуктологии ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова» Министерства здравоохранения Российской Федерации; главный врач СПб ГБУЗ «Родильный дом No 6 имени профессора В.Ф. Снегирева»
Scopus Author ID: 37076359000, Researcher ID: B-5746-2018
197022 Санкт-Петербург, ул. Льва Толстого, д. 6/8
192014 Санкт-Петербург, ул. Маяковского, д. 5
М. Г. Николаева
Россия
Николаева Мария Геннадьевна – д.м.н., профессор кафедры акушерства и гинекологии с курсом ДПО ФГБОУ ВО «Алтайский государственный медицинский университет» Министерства здравоохранения Российской Федерации; старший научный сотрудник Алтайского филиала ФГБУ «Национальный медицинский исследовательский центр гематологии» Министерства здравоохранения Российской Федерации
Scopus Author ID: 57191960907, Researcher ID: AAI-6271-2020
656038 Барнаул, пр. Ленина, д. 40
656045 Барнаул, ул. Ляпидевского, д. 1
Рецензия
Для цитирования:
Багдасарова Ю.С., Зайнулина М.С., Николаева М.Г. Осложнения и исходы беременности у пациенток с носительством антифосфолипидных антител при различных методах лечения. Акушерство, Гинекология и Репродукция. 2023;17(2):176-187. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.414
For citation:
Bagdasarova Yu.S., Zainulina M.S., Nikolaeva M.G. Complications and outcomes of pregnancy in patients with antiphospholipid antibodies during various treatment methods. Obstetrics, Gynecology and Reproduction. 2023;17(2):176-187. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.414

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































