Перейти к:
Профиль экспрессии плазматических микроРНК и генов-мишеней у пациенток с осложненным течением беременности
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.413
Аннотация
Цель: сравнительный анализ профиля экспрессии плазматических микроРНК и генов-мишеней у пациенток с осложненным течением беременности.
Материалы и методы. Проведено проспективное наблюдательное сравнительное исследование в параллельных группах. В исследование включены 73 женщины, разделенные на 3 группы: основная группа – 42 пациентки с преэклампсией (ПЭ), группа сравнения – 12 беременных с задержкой роста плода (ЗРП), контрольная группа – 19 клинически здоровых женщин с неосложненным течением беременности. Выполнено обследование, включавшее анализ клинических характеристик и изучение экспрессии микроРНК в плазме крови с помощью метода полимеразной цепной реакции в режиме реального времени.
Результаты. МикроРНК hsa-miR-210-5p и hsa-miR-1972 не были идентифицированы ни в одном образце плазмы. Анализ плазменных микроРНК в основной группе (женщины с ПЭ) показал статистически значимые изменения уровней экспрессии hsa-miR-517a-3p (p = 0,025), hsa-miR-517с-3p (p = 0,036), hsa-miR-574-5p (p = 0,015), hsa-miR-517a-3p (p < 0,001) и повышение miR-20a-5p (р = 0,046) по сравнению с контрольной группой. Значимых различий в профиле экспрессии микроРНК в группе женщин с ЗРП по сравнению с контрольной группой выявлено не было. Проведенная оценка влияния изученных микроРНК на регуляторные сигнальные пути позволила установить, что hsa-miR-miR-146a-5p, -181a-5p, -210-3p, -517a-3p, -517с-3p, -574-3p, -574-5p, -1304-5p являются потенциальными регуляторами каскадов реакций, вовлеченных в патогенез ПЭ.
Заключение. Выявленные изменения содержания циркулирующих в плазме крови микроРНК свидетельствуют о наличии специфических молекулярных изменений на уровне транскриптома при осложнённом течении беременности.
Ключевые слова
Для цитирования:
Пашковский Д.Г., Соловьева Е.В., Рабаданова Ц.Р., Горбунова П.Т., Дубовая А.Б., Муслимова Э.Р., Хороз Э.Э., Карабаш З.С., Сорокина Л.Е. Профиль экспрессии плазматических микроРНК и генов-мишеней у пациенток с осложненным течением беременности. Акушерство, Гинекология и Репродукция. 2023;17(2):231-243. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.413
For citation:
Pashkovsky D.G., Solovieva E.V., Rabadanova Ts.R., Gorbunova P.T., Dubovaya A.B., Muslimova E.R., Khoroz E.E., Karabash Z.S., Sorokina L.E. Expression profile of plasma microRNAs and target genes in patients with complicated pregnancy. Obstetrics, Gynecology and Reproduction. 2023;17(2):231-243. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.413
Введение / Introduction
Акушерские патологии, объединенные в группу «больших акушерских синдромов», включая преэклампсию (ПЭ) и задержку роста плода (ЗРП), до настоящего времени обуславливают высокий процент материнской и перинатальной заболеваемости и смертности [1–5]. Объединить данные осложнения в одну группу позволила возникшая более 10 лет назад концепция об общности патогенетических процессов, ключевая роль в развитии которых принадлежит нарушению плацентации [6].
С клинической точки зрения, проблема ПЭ и ЗРП обусловлена отсутствием полноценных представлений об этиологии, длительно сохраняющейся доклинической стадией, вариабельностью симптомов, зависимостью клинических проявлений от взаимодействия генотипа и факторов внешней среды и/или комплексного материнского и фетального микрохимеризма [7–9]. При этом, несмотря на обширную научно-исследовательскую базу, посвященную данной проблеме, до сих пор досрочное родоразрешение является единственной возможностью предотвращения материнских и перинатальных потерь [10], в связи с чем весьма актуальным остается поиск информативных биомаркеров для прогнозирования, ранней диагностики и минимизации риска материнских и перинатальных осложнений, детерминированного морфофункциональными нарушениями в фетоплацентарной системе [11–16].
Современные исследования продемонстрировали значительную роль микроРНК в регуляции важнейших молекулярно-генетических механизмов, обеспечивающих успешную реализацию всех фундаментальных событий беременности [17][18]. МикроРНК представляют собой класс малых некодирующих молекул рибонуклеиновой кислоты длиной 18–25 нук- леотидов. В последние годы опубликован ряд исследований, показавших ассоциацию некоторых плацентарных и плазменных микроРНК с развитием больших акушерских синдромов [19]. Известно, что микроРНК, дифференциально экспрессирующиеся при ПЭ и ЗРП, вовлечены в регуляцию ряда процессов, включая метаболические изменения, развитие сердечно-сосудистой и репродуктивной систем, иммунный ответ, клеточный цикл, клеточную адгезию и реализацию сигнальных путей, включая трансформирующий фактор роста-бета (англ. transforming growth factor-beta, TGF-β) и митоген-активированную протеинкиназу (англ. mitogen-activated protein kinase, MAPK) [20–22]. Однако, несмотря на имеющуюся весьма обширную исследовательскую базу о роли микроРНК в патогенезе ПЭ и ЗРП, многие вопросы по-прежнему дискутабельны и не до конца изучены.
Цель: сравнительный анализ профиля экспрессии плазматических микроРНК и генов-мишеней у пациенток с осложненным течением беременности.
Материалы и методы / Materials and Methods
Дизайн исследования / Study design
Проведено проспективное наблюдательное сравнительное исследование в параллельных группах. В исследование включены 73 пациентки, наблюдавшиеся на базе Перинатального центра ГБУЗ РК РКБ им. Н.А. Семашко (Симферополь). Все участницы исследования были разделены на 3 группы: в основную группу вошли 42 беременные с ПЭ, в группу сравнения – 12 беременных, у которых беременность осложнилась ЗРП, верифицированной после родов, в контрольную группу – 19 клинически здоровых женщин с неосложненным течением беременности и своевременными родами. Диагноз «ПЭ» и «ЗРП» устанавливали в соответствии с критериями, указанными в Федеральных клинических рекомендациях РОАГ «Гипертензивные расстройства во время беременности, в родах и послеродовом периоде. Преэклампсия. Эклампсия» [23] и «Недостаточный рост плода, требующий предоставления медицинской помощи матери (задержка роста плода)» [24].
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения в основную группу: возраст старше 18 лет; одноплодная беременность в сроки гестации от 22 до 42 нед; наличие ПЭ различной степени тяжести; добровольное информированное согласие на участие в исследовании.
Критерии включения в группу сравнения: возраст старше 18 лет; одноплодная беременность в сроки гестации от 22 до 42 нед; наличие синдрома ЗРП I, II и III степени; симметричная и асимметричная форма задержки развития плода; добровольное информированное согласие на участие в исследовании.
Критерии включения в контрольную группу: возраст старше 18 лет; одноплодная беременность в сроки гестации от 22 до 42 нед; физиологическое течение беременности; добровольное информированное согласие на участие в исследовании.
Критерии исключения: пациентки с декомпенсированными формами экстрагенитальной патологии, инфекционными заболеваниями, многоплодной беременностью; отказ от участия в исследовании.
Методы исследования / Study methods
Всем женщинам, вошедшим в исследование, проведено общепринятое обследование по наблюдению беременности, включавшее сбор и оценку соматического и акушерско-гинекологического анамнеза, лабораторное и инструментальное обследование.
Параметры общеклинического анализа крови определяли на автоматическом гематологическом анализаторе МЕК-6510 (Nihon Kohden, Япония) колориметрическим методом с лаурил сульфат натрием (Sodium Lauryl Sulfat, SLS), использовали метод капиллярной фотометрии (венозная кровь). Биохимический анализ крови с определением содержания общего белка, креатинина, общего билирубина, лактатдегидрогеназы, аланинаминотрансферазы, аспартатаминотрансферазы, глюкозы, С-реактивного белка осуществляли турбидиметрическим методом (венозная кровь) на автоматическом биохимическом анализаторе А-25 (BioSystems, Испания). Параметры системы гемостаза – содержание протромбина по Квику и фибриногена, активированное парциальное тромбопластиновое время, международное нормализованное отношение оценивали клоттинговым методом (венозная кровь) на автоматическом анализаторе Sysmex CA-660 (Sysmex, Япония). Оценку показателей общего анализа мочи проводили методом сухой химии на автоматическом анализаторе Laura XL (Erba, Чехия).
Ультразвуковое исследование органов малого таза и плода с доплерографическим исследованием маточно-плацентарного бассейна выполняли на аппарате Affiniti 50 (Philips, США). При проведении кардиотокографии использовали фетальный монитор (кардио- токограф) Сономед-200 (Спектромед, Россия).
С использованием современных молекулярных методов всем участницам исследования оценивали профиль экспрессии 15 молекул микроРНК, циркулирующих в плазме крови: miR-20a-5p, miR-143-3p, miR-146a-5p, miR-181a-5p, miR-210-3p, miR-210-5p, miR-320а-3p, miR-375-3p, miR-517a-3p, miR-517c-3p, miR-574-3p, miR-574-5p, miR-1304-5p, miR-1972, miR-4498. Выбор указанных микроРНК основывался на опубликованных в литературе данных об их вовлеченности в патологию беременности [25–34].
Выделение РНК из плазмы периферической крови / Peripheral blood plasma RNA isolation
Взятие биоматериала (венозная кровь) осуществляли в вакуумные пробирки Vacuette® с антикоагулянтом (Greiner Bio-One, Австрия). Отделение плазмы из образцов крови выполняли поэтапным центрифугированием. Экстракцию микроРНК из полученной плазмы крови проводили с использованием коммерческого набора miRNeasy Serum/Plasma Kit (Qiagen, Германия) по протоколу фирмы-производителя. На этапе денатурации добавляли 5,6×108 копий синтетической микроРНК cel-miR-39 (Qiagen, Германия), используемой в качестве экзогенного контроля эффективности выделения нуклеиновой ксилоты и синтеза комплиментарной ДНК (кДНК).
Реверс-транскрипция и количественная полимеразная цепная реакция в реальном времени / Reverse transcription and quantitative real-time polymerase chain reaction
Экспрессию выделенных микроРНК оценивали методом полимеразной цепной реакции (ПЦР) с реверс-транскрипцией в режиме реального времени. Реверс-транскрипция осуществлялась согласно инструкции miScript® II RT Kit (Qiagen, Германия) с использованием тест-системы фирмы. ПЦР в режиме реального времени (ПЦР-РВ) проводили на амплификаторе StepOnePlusTM (Applied Biosystems, США) с помощью наборов Qiagen (Германия), содержащих специфические зонды и праймеры к исследуемым молекулам микроРНК и экзогенному контролю (cel-miR-39). Определение степени экспрессированности микроРНК в исследуемых и контрольном образцах относительно референсных микроРНК (cel-miR-39) осуществляли методом 2-ΔΔCT.
Этические аспекты / Ethical aspects
Исследование проведено в соответствии с этическими стандартами Хельсинской декларации Всемирной медицинской ассоциации 1964 г. и ее последующими изменениями. Все участницы исследования подписали добровольное информированное согласие на участие в научно-исследовательской работе и отбор биоматериала для анализа. Исследование одоб- рено локальным этическим комитетом Института «Медицинская академия имени С.И. Георгиевского» ФГАОУ ВО КФУ им. В.И. Вернадского, протокол № 2 от 27.02.2022.
Методы статистического анализа / Statistical analysis
Для проведения статистического анализа полученных данных использовали лицензионный пакет программ Statistica 6.0 (StatSoft Inc., США). Форму распределения количественных данных оценивали с применением критерия Шапиро–Уилка. Описательная статистика данных, имевших нормальное распределение, представлена в формате среднего арифметического и стандартного отклонения (М ± σ). Для представления данных, имевших ненормальное распределение, использовали медиану и квартили в формате Me [Q1; Q3]. Оценку различий несвязанных выборок для нормально распределенных данных проводили с использованием параметрического t-критерия Стьюдента и непараметрического критерия Манна–Уитни, если распределение было отличным от нормального. Величину порогового уровня значимости p-value принимали равной 0,05. Если значение p было меньше 0,001, то p-value указывали в формате p < 0,001.
Оценку влияния изучаемых микроРНК на функционирование сигнальных путей, задействованных в регуляторных процессах при осложненном течении беременности, проводили с использованием программного обеспечения DIANA miRPath v.3.0 (DIANA-Lab, Department of Electrical & Computer Engineering, University of Thessaly, Греция) на основе базы данных Киотской энциклопедии генов и геномов (англ. Kyoto Encyclopedia of Genes and Genomes, KEGG) (Kanehisa Laboratories, Япония) с применением баз данных TargetScan v.7.0 (Whitehead Institute for Biomedical Research, Cambridge, США), TarBase (University of Thessaly, Hellenic Pasteur Institute Verified, IMIS – "Athena" RC, Греция), microT-CDS (University of Thessaly, IMIS – "Athena" RC, Alexander Fleming Biomedical Sciences Research Center, Греция).
Анализ значимости различий степени экспрессируемости исследуемых микроРНК в группах обследуемых выполнен при помощи двухстороннего теста Вилкоксона–Манна–Уитни. МикроРНК считали дифференциально экспрессирующейся при кратности изменений (англ. fold change, FC) в уровнях экспрессии между сравниваемыми группами более чем в 2 раза (соответственно –1 < log2FC > 1); порогом статистической значимости считали p-value < 0,05.
Результаты / Results
Все группы участниц исследования были сопоставимы по исходным клинико-анамнестическим характеристикам (табл. 1).
Между группами обследованных выявлены статистически значимые различия по показателям артериального давления (АД). Средние значения систолического (САД) и диастолического (ДАД) артериального давления у пациенток основной группы были выше относительно группы сравнения (p = 0,01 и p < 0,001, соответственно) и контрольной группы (р = 0,02 и p < 0,001, соответственно). Установленные статистически значимые различия некоторых показателей общеклинического и биохимического анализов крови между группами клинически здоровых женщин с неосложненным течением беременности и беременных с ПЭ не являются клинически значимыми. Все беременные, включенные в исследование, были родоразрешены в среднем в 39,19 [ 37,57; 40,5] нед беременности; в 24 (36,9 %) наблюдениях выполнена операция кесарева сечения. При проведении сравнительного анализа в основной группе по отношению к группе сравнения и контрольной группе определены статистически значимые различия в массе тела новорожденных (р = 0,03 и p = 0,01, соответственно). Все группы были сопоставимы по клиническому статусу новорожденных (p > 0,05 для оценки по шкале Апгар на 1-й и 5-й минутах). Обращает на себя внимание тенденция к более высокой частоте неонатальной заболеваемости в основной группе женщин с ПЭ, не достигающая, однако, статистически значимой разницы в связи с небольшой выборкой.
Результаты определения уровней экспрессии изученных микроРНК в плазме крови беременных представлены в таблице 2. МикроРНК – hsa-miR-210-5p и hsa-miR-1972 не были идентифицированы ни в одном образце плазмы.
Анализ плазменных микроРНК в группе женщин с ПЭ (основная группа) показал значимые изменения уровней экспрессии 9 микроРНК по сравнению с контрольной группой: повышение экспрессии hsa-miR-20a-5p (log2FC = 1,2) и снижение hsa-miR-146a-5p (log2FC = –1,1), hsa-miR-181a-5p (log2FC = –1,5), hsa-miR-210-3p (log2FC = –1,6), hsa-miR-517a-3p (log2FC = –2,7), hsa-miR-517c-3p (log2FC = –1,8), hsa-miR-574-3p (log2FC = –1,1), hsa-miR-574-5p (log2FC = –3,9), hsa-miR-1304-3p (log2FC = –5,3). При этом выбранным критериям значимости различий в уровнях экспрессии между женщинами основной и контрольной групп удовлетворяли только 5 молекул (рис. 1): снижение hsa-miR-517a-3p (p = 0,025), hsa-miR-517с-3p (p = 0,036), hsa-miR-574-5p (p = 0,015), hsa-miR-517a-3p (p = 0,001) и повышение miR-20a-5p (р = 0,046).
Оценка профиля плазматических микроРНК в группе сравнения (женщины с ЗРП) позволила идентифицировать 6 молекул, экспрессия которых имела тенденцию к выраженным изменениям относительно контрольной группы, а именно, повышенные уровни были характерны для hsa-miR-210-3p (log2FC = 2,3), hsa-miR-320а-3p (log2FC = 2,4), hsa-miR-375-3p (log2FC = 4,8), hsa-miR-4498 (log2FC = 1,9), снижение отмечено для hsa-miR-517a-3p (log2FC = –1,2) и hsa-miR-1304-3p (log2FC = –1,8). При этом выявленные различия в уровнях экспрессии данных микроРНК в группе сравнения и контрольной группе были статистически незначимы.
При сравнительном анализе профиля экспрессии микроРНК женщин с осложнённым течением беременности (основная группа и группа сравнения) продемонстрировано выраженное снижение уровней hsa-miR-181a-5p (log2FC= –1,2), hsa-miR-210-3p (log2FC= –3,9), hsa-miR-320a-3p (log2FC= –2,9), hsa-miR-375-3p (log2FC= –5,8), hsa-miR-517a-3p (log2FC= –1,5), hsa-miR-517c-3p (log2FC= –1,4), hsa-miR-574-3p (log2FC= –1,1), hsa-miR-574-5p (log2FC= –3,6), hsa-miR-1304-3p (log2FC= –3,5), hsa-miR-4498 (log2FC= –2,3), при этом полученные данные не достигали статистической значимости.
Проведенный анализ влияния микроРНК на функционирование сигнальных путей, задействованных в регуляторных процессах при осложненном течении беременности, позволил установить, что hsa-miR-miR-146a-5p, -181a-5p, -210-3p, -517a-3p, -517с-3p, -574-3p, -574-5p, -1304-5p являются потенциальными регуляторами каскадов реакций, участвующих в развитии различных инфекционных патологий (hsa05161, hsa05169, hsa05166), процессов канцерогенеза различной локализации (hsa05205, hsa05202, hsa05213, hsa05214, hsa05215, hsa05216, hsa05230, hsa05220, hsa05223, hsa05212, hsa05200, hsa05222, hsa05211, hsa05221, hsa05219, hsa05218), сигнальных путей, регулирующих эмбриогенез, дифференцировку клеток, закладку тканей и органов (hsa04390, hsa05210, hsa04550, hsa04068, hsa04320, hsa00900), а также индуцируемого гипоксией фактора-1 (англ. hypoxia inducible factor-1, HIF-1) (hsa04066), TGF-β (hsa04350), PI3K/AKT/mTOR (hsa04151), реакций, опосредующих метаболизм органических соединений, эстрогена и пролактина (hsa00310, hsa04071, hsa04915, hsa04917), а также являются контроллерами процессов клеточного эндоцитоза (hsa04144), адгезии (hsa04520), клеточного цикла (hsa04110) и реализации р53-опосредованного пути (hsa04115), что в целом сопоставимо с общепринятыми представлениями о развитии ПЭ.
Таблица 1. Клинико-анамнестические характеристики обследованных женщин.
Table 1. Clinical and anamnestic characteristics of women examined.
|
Показатель Parameter |
Основная группа Main group n = 42 |
Группа сравнения Comparison group n = 12 |
Контрольная группа Control group n = 19 |
р |
|
1 |
2 |
3 |
||
|
Возраст, лет, Me [Q1; Q3] Age, years, Me [Q1; Q3] |
29,76 [ 27,85; 31,67] |
30,83 [ 26,58; 35,09] |
28,8 [ 25,62; 31,98] |
p1–2 = 0,625 p1–3 = 0,594 р2–3 = 0,416 |
|
Индекс массы тела, кг/м2, Me [Q1; Q3] Body mass index, kg/m2, Me [Q1; Q3] |
31,17 [ 28,73; 33,62] |
27,8 [ 25,03; 0,57] |
28,17 [ 26,43; 29,90] |
р1–2 = 0,062 р1–3 = 0,045 р2–3 = 0,809 |
|
Преэклампсия в анамнезе, n (%) Preeclampsia in history, n (%) |
3 (7,1) |
0 (0) |
0 (0) |
р1–3 = 0,231 |
|
Хроническая артериальная гипертензия, n (%) Chronic arterial hypertension, n (%) |
7 (16,7) |
1 (8,3) |
0 (0) |
р1–2 = 0,667 р1–3 = 0,005 р2–3 = 0,375 |
|
Пренатальный скрининг, n (%): риск преэклампсии высокий Prenatal screening, n (%): high preeclampsia risk |
28 (66,7) |
2 (16,7) |
0 (0) |
р1–2 = 0,003 р1–3 < 0,001 р2–3 = 0,133 |
|
Манифестация преэклампсии, нед, Me [Q1; Q3] Manifested preeclampsia, gestational age, weeks, Me [Q1; Q3] |
33,79 [ 32,45; 35,12] |
– |
– |
– |
|
Ранняя преэклампсия, n (%) Early preeclampsia, n (%) |
6 (14,3) |
– |
– |
– |
|
Поздняя преэклампсия, n (%) Late preeclampsia, n (%) |
36 (85,7) |
– |
– |
– |
|
Умеренная преэклампсия, n (%) Moderate preeclampsia, n (%) |
38 (90,5) |
– |
– |
– |
|
Тяжелая преэклампсия, n (%) Severe preeclampsia, n (%) |
4 (9,5) |
– |
– |
– |
Таблица 2. Уровни экспрессии микроРНК в плазме крови обследованных женщин.
Table 2. MicroRNAs expression levels in the blood plasma of women examined.
|
МикроРНК miRNA |
log2FC (основная группа/контрольная группа) log2FC (main group/control group) |
p |
log2FC (группа сравнения/контрольная группа) log2FC (comparison group/control group) |
p |
log2FC (основная группа/группа сравнения) log2FC (main group/comparison group) |
p |
|
miR-20a-5p |
1,2 |
0,046 |
0,6 |
0,236 |
0,7 |
0,299 |
|
miR-143-3p |
0,3 |
0,25 |
–0,6 |
0,825 |
0,9 |
0,132 |
|
miR-146a-5p |
–1,1 |
0,068 |
–0,2 |
0,49 |
–0,9 |
0,238 |
|
miR-181a-5p |
–1,5 |
0,081 |
–0,3 |
0,532 |
–1,2 |
0,279 |
|
miR-210-3p |
–1,6 |
0,202 |
2,3 |
0,75 |
–3,9 |
0,173 |
|
miR-320а-3p |
–0,5 |
0,34 |
2,4 |
0,383 |
–2,9 |
0,129 |
|
miR-375-3p |
–0,9 |
1,0 |
4,8 |
0,2 |
–5,8 |
0,222 |
|
miR-517a-3p |
–2,7 |
0,025 |
–1,2 |
0,503 |
–1,5 |
0,244 |
|
miR-517c-3p |
–1,8 |
0,036 |
–0,4 |
0,968 |
–1,4 |
0,178 |
|
miR-574-3p |
–1,1 |
0,291 |
0 |
1,0 |
–1,1 |
0,404 |
|
miR-574-5p |
–3,9 |
0,015 |
–0,2 |
0,761 |
–3,6 |
0,061 |
|
miR-1304-5p |
–5,3 |
< 0,001 |
–1,8 |
0,6 |
–3,5 |
0,25 |
|
miR-4498 |
–0,3 |
1,0 |
1,9 |
0,667 |
–2,3 |
0,4 |
Примечание: FC – кратность изменения, данные представлены в виде логарифмированной по основанию 2 разницы между экспрессией микроРНК; выделены значимые различия.
Note: FC – fold change, data are presented as log2 difference in microRNAs expression; significant differences are highlighted.
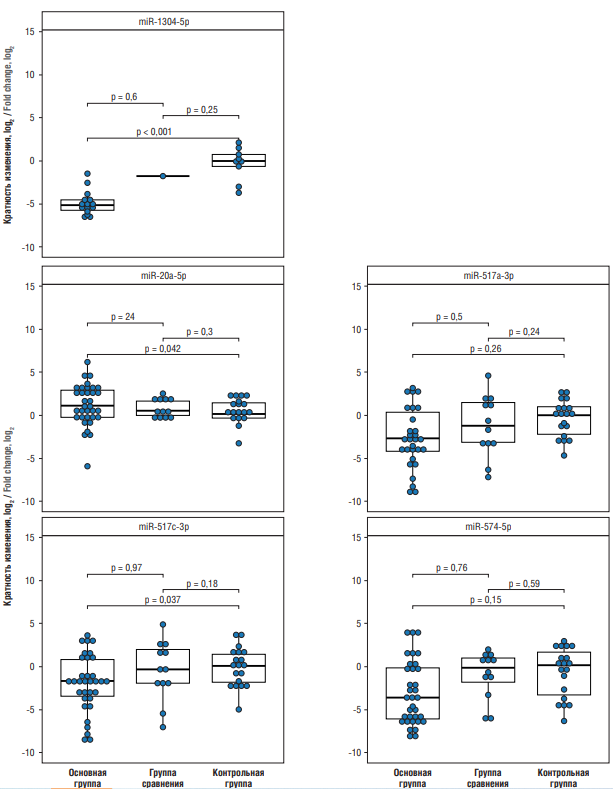
Рисунок 1. Сравнительный анализ экспрессии микроРНК в плазме крови обследованных женщин.
Примечание: данные представлены в виде логарифмированной по основанию 2 разницы между экспрессией микроРНК при преэклампсии (основная группа) и задержке роста плода (группа сравнения) по сравнению с контрольной группой.
Figure 1. Comparative analysis of blood plasma microRNAs expression in women examined.
Note: data are presented as log2 difference between microRNAs expression in preeclampsia (main group) and fetal growth retardation (comparison group) compared to control group.
Обсуждение / Discussion
ПЭ и ЗРП неоднородны по этиологии, а их развитие может быть обусловлено несколькими факторами. У части пациенток ранняя ПЭ развивается вместе с ЗРП, что позволяет предположить совпадение механизмов, лежащих в основе этих осложнений [2]. Хотя ряд исследователей относят ПЭ и ЗРП к истинно «плацентарным заболеваниям», в настоящее время ведутся дискуссии о различии патофизиологии ранних и поздних форм рассматриваемых патологий [35].
Целью настоящего исследования стало изучение молекулярных механизмов развития ПЭ и ЗРП на основании анализа уровня экспрессии циркулирующих в плазме крови микроРНК с помощью метода ПЦР-РВ. Проведенный сравнительный анализ выявил дисрегуляцию экспрессии микроРНК в плазме крови при беременности, осложненной ЗРП и ПЭ.
Особый интерес представляют полученные нами данные относительно отмеченной аберрантной экспрессии микроРНК, кодируемых ассоциированными с беременностью кластерами генов 19-й хромосомы. Согласно данным литературы, кластер микроРНК С19МС играет значимую роль в регуляции эмбрионального развития и клеточной дифференцировке [36]. Известно, что экспрессия молекул микроРНК кластера изменяется на протяжении беременности, а именно, снижается во время I триместра беременности и повышается к концу беременности [37]. По результатам нашего исследования, в отношении микроРНК hsa-miR-181a-5p, hsa-miR-517a-3p, hsa-miR-517c-3p, входящих в кластер С19МС, отмечена тенденция к снижению экспрессии как у женщин с ЗРП, так и с ПЭ. При этом у женщин с ПЭ уровень экспрессии молекул hsa-miR-517a-3p и hsa-miR-517c-3p был статистически значимо ниже по сравнению с женщинами с неосложненным течением беременности. Ранее, для уточнения роли miR-517a/b и miR-517c рабочей группой под руководством L. Anton с соавт. была проведена серия экспериментов in vitro. По итогу выполненных экспериментов доказано, что изменение уровней экспрессии данных микроРНК связано с нарушением инвазии трофобласта и аберрантным высвобождением растворимой fms-подобной тирозинкиназы-1 (англ. soluble fms-like tyrosine kinase-1, sFlt1) – белка, связывающего циркулирующие ангиогенные факторы и блокирующего их способность индуцировать ангиогенез [25].
Еще одной дифференциально экспрессирующейся микроРНК, идентифицированной в нашем исследовании, стала hsa-miR-1304-3p. В доступной литературе мы обнаружили лишь единичные работы, характеризующие функцию данной молекулы. Ранее в работе Y. Zhong с соавт. было продемонстрировано достоверное снижение экспрессии miR-1304 в плазме крови пациенток с ПЭ и указана ключевая роль молекулы в процессах клеточной пролиферации [33]. По нашему мнению, факт контрастирования наших результатов обусловлен неоднозначностью и противоречивостью данных литературы о процессах апоптоза и клеточной пролиферации у пациенток с ПЭ. Так, по данным ряда научных работ, у беременных с ПЭ отмечается гиперэкспрессия биомаркера пролиферативной клеточной активности ki-67 в строме ворсин плаценты и трофобласте [38][39]. Напротив, в аналогичном исследовании I.K. Prusac с соавт. проведенная количественная оценка ядерного антигена ki-67 продемонстрировала отсутствие изменений экспрессии в ворсинах трофобласта [40]. По результатам выполненных исследований, отечественные коллеги пришли к выводу, что эффект ряда биологических факторов (в частности, цитокинов), стимулирующих пролиферацию и миграцию трофобласта у беременных, нивелируется в случае развития ПЭ [41]. Таким образом, сниженный уровень экспрессии hsa-miR-1304-3p укладывается в концепцию, представленную отечественными коллегами, и подчеркивает значение программ клеточного обновления в развитии беременности, осложненной ПЭ.
Интерес в аспекте патогенеза ЗРП и ПЭ представляют также результаты, полученные в отношении уровней экспрессии циркулирующей в плазме крови hsa-miR-20a-5p. Известно, что гиперэкспрессия miR-20a способна значительно подавлять пролиферативную и инвазивную активность клеток трофобласта путем подавления экспрессии транскрипционного фактора FOXA1 (англ. forkhead box protein A1), оказывающего непосредственное влияние на закладку и развитие органов и тканей [26]. Результаты нашего исследования указывают на повышение экспрессии hsa-miR-20а-5р в обеих группах с осложненным течением беременности, при этом в группе с ПЭ оно достигало статистической значимости по отношению к контрольной группе.
Согласно данным литературы, микроРНК miR-146-5p обладает супрессивным потенциалом в отношении процессов пролиферации, миграции, инвазии клеток трофобластов и эпителиально-мезенхимального перехода, что достигается путем ингибирования сигнального пути Wnt2/β-катенин [27]. Ранее в работе I. Hromadnikova с соавт. сообщалось о достоверном снижении значений плазматической miR-146-5p в группе ПЭ с ЗРП и среди женщин, которым потребовалось проведение досрочного родоразрешения в сроке до 34 нед [42]. В отношении hsa-miR-146-5p в нашем исследовании не было получено существенных различий по уровню экспрессии между группами. При этом обращает на себя внимание закономерность в отношении снижения экспрессированности среди женщин с ПЭ и ЗРП.
Несмотря на то что miR-574 является одной из наиболее часто идентифицируемых микроРНК при различных соматических патологиях, о ее роли в развитии акушерской патологии известно недостаточно. Существуют единичные исследования, рассматривающие miR-574 в качестве ключевого модулятора эндотелиальной дисфункции при ПЭ [28]. В нашей работе продемонстрирован достоверно пониженный уровень экспрессии hsa-miR-574-5p в образцах плазмы пациенток с ПЭ с тенденцией к более значимому снижению у женщин с поздней формой этой патологии. Обнаруженные изменения в уровне экспрессии miR-574 при проведении меж- и внутригруппового анализа указывают на кардинальные различия в патофизиологических механизмах, лежащих в основе ЗРП и различных форм ПЭ, и подтверждают возможность рассмотрения поздней ПЭ как чисто материнского синдрома [43].
Примечательно, что молекуле miR-143 традиционно отводят роль в регуляции процессов дифференциации гладкомышечных клеток сосудов. В работе S. Chen с соавт. авторы указывают на гиперэкспрессию miR-143-3р в лейкоцитах периферической крови у пациентов с гипертонической болезнью [44]. В это же время исследование A. Luque с соавт. продемонстрировало связь экспрессии miR-143-3р с выраженностью процессов ангиогенеза, миграции и ремоделирования клеток сосудов [29]. В проведенном нами исследовании получены результаты, указывающие на достоверное снижение экспрессии miR-143-3р в подгруппе пациенток с ранней ПЭ, что подтверждает ведущее значение эндотелиальной дисфункции при формировании патологии позднее 34-й недели.
Неожиданные результаты получены нами в отношении miR-210, которая является одной из наиболее изученных микроРНК в акушерско-гинекологической практике. Ранее учеными уже были предприняты попытки рассмотрения miR-210 в качестве диагностического и прогностического маркера ПЭ [45]. Известно, что miR-210 является членом семейства микроРНК, чувствительных к гипоксии [46]. Эктопическая экспрессия данной молекулы способна оказывать влияние на некоторые клеточные сигнальные пути и вовлечение транскрипционных факторов HIF1α и NF-kB (ядерный фактор каппа В; англ. nuclear factor kappa B), играющих важную роль в регуляции процессов клеточного цикла, митохондриального дыхания, репарации ДНК, ангиогенеза [30]. Результаты нашего исследования указывают на отсутствие экспрессии hsa-miR-210-5p у всех обследованных и повышение уровня hsa-miR-210-3p в группе сравнения по отношению к основной и контрольной группам, не достигающее, однако, статистической значимости.
Имеющиеся различия по сравнению с результатами предыдущих исследований могут быть обусловлены размером выборок, критериями отбора пациенток, различиями в платформах, используемых для измерения экспрессии, а также аналитическими методами, используемыми для выявления дифференциально экспрессированных микроРНК.
Заключение / Conclusion
Таким образом, полученные данные свидетельствуют, что различные осложнения беременности характеризуются специфическими молекулярными изменениями на уровне транскриптома. Изучение профиля плацентарных микроРНК у женщин с ПЭ и ЗРП позволило подтвердить значимость вовлеченности процесса нарушения плацентации в развитие осложнений беременности. Между тем выявленная дисрегуляция в экспрессии молекул микроРНК свидетельствует о существовании альтернативных патофизиологических механизмов, лежащих в основе различных форм ПЭ и ЗРП. Поскольку патологические процессы предшествуют клиническим признакам и симптомам ПЭ или ЗРП, возможно, что микроРНК, идентифицированные в данном исследовании, на ранних сроках могут служить потенциальными биомаркерами неблагоприятного течения беременности. Полученные данные относительно аберрантной экспрессии изучаемых микроРНК требуют последующей верификации на более крупной выборке пациентов с применением альтернативных молекулярно-биологических методов для уточнения влияния идентифицированных молекул на регуляторные сигнальные пути, а также для определения диагностической ценности данных молекул на протяжении всего срока беременности.
Список литературы
1. Di Renzo G.C. The great obstetrical syndromes. J Maternal Fetal Neonatal Med. 2018;22(8):633–5. https://doi.org/10.1080/14767050902866804.
2. Brosens I., Pijnenborg R., Vercruysse L., Romero R. The «Great Obstetrical Syndromes» are associated with disorders of deep placentation. Am J Obstet Gynecol. 2011;204(3):193–201. https://doi.org/10.1016/j.ajog.2010.08.009.
3. Тезиков Ю.В., Липатов И.С., Фролова Н.А. и др. Методология профилактики больших акушерских синдромов. Вопросы гинекологии, акушерства и перинатологии. 2016;(2):20–30. https://doi.org/10.20953/1726-1678-2016-2-20-30.
4. Ковалев В.В., Кудрявцева Е.В., Миляева Н.М., Беломестнов С.Р. Большие акушерские синдромы: «гордиев узел» генных сетей. Уральский медицинский журнал. 2018;(13):40–7. https://doi.org/10.25694/URMJ.2018.13.45.
5. Никитина Н.А., Сидорова И.С., Агеев М.Б. и др. Новые технологии в решении проблем преэклампсии. Акушерство и гинекология. 2022;(10):5–13. https://doi.org/10.18565/aig.2022.10.5-13.
6. Romero R. Prenatal medicine: The child is the father of the man. 1996. J Matern Fetal Neonatal Med. 2009;22(8):636–9. https://doi.org/10.1080/14767050902784171.
7. Волочаева М.В., Баев О.Р. Современные представления о патогенезе задержки роста плода. Акушерство и гинекология. 2021;(8):13–7. https://doi.org/10.18565/aig.2021.8.13-17.
8. Сидорова И.С., Никитина Н.А., Унанян А.Л. и др. Система комплемента при беременности, осложненной преэклампсией. Акушерство и гинекология. 2021;(8):5–12. https://doi.org/10.18565/aig.2021.8.5-12.
9. Игнатко И.В., Казбекова М.Т., Якубова Д.И. и др. Что мы знаем о фетальном и материнском микрохимеризме? Вопросы гинекологии, акушерства и перинатологии. 2021;20(5):87–92. https://doi.org/10.20953/1726-1678-2021-5-87-92.
10. Акушерство. Национальное руководство. Под ред. Э.К. Айламазяна, В.Н. Серова, В.Е. Радзинского, Г.М. Савельевой. М.: ГЭОТАР-Медиа, 2021. 608 с.
11. Сидорова И.С., Никитина Н.А. Преэклампсия как гестационный иммунокомплексный комплементопосредованный эндотелиоз. Российский вестник акушера-гинеколога. 2019;19(1):5–11. https://doi.org/10.17116/rosakush2019190115.
12. Симанов И.В. Факторы риска развития преэклампсии. Справочник врача общей практики. 2019;(1):17–21.
13. Ярыгина Т.А., Батаева Р.С. Методика проведения скринингового исследования в пером триместре беременности с расчетом риска развития преэклампсии и задержки роста плода по алгоритму Фонда медицины плода (Fetal Medicine Foundation). Ультразвуковая и функциональная диагностика. 2018;(4):77–88.
14. Muresan D., Rotar I.C., Stamatian F. The usefulness of fetal Doppler evaluation in early versus late onset intrauterine growth restriction. Review of the literature. Med Ultrason. 2016;18(1):103–9. https://doi.org/10.11152/mu.2013.2066.181.dop.
15. Ohno Y., Terauchi M., Tamakoshi K. et al. The risk factors for labor onset hypertension. Hypertens Res. 2016;39(4):260–5. https://doi.org/10.1038/hr.2015.112.
16. Oudejans C.B., Poutsma A., Michel O.J. et al. Noncoding RNA-regulated gain-of-function of STOX2 in Finnish pre-eclamptic families. Sci Rep. 2016;24(6):32129. https://doi.org/10.1038/srep32129.
17. Hromadnikova I., Kotlabova K., Ondrackova M. et al. Circulating C19MC microRNAs in preeclampsia, gestational hypertension, and fetal growth restriction. Mediators Inflamm. 2013;2013:186041. https://doi.org/10.1155/2013/186041.
18. Noguer-Dance M., Abu-Amero S., Al-Khtib M. et al. The primate-specific microRNA gene cluster (C19MC) is imprinted in the placenta. Hum Mol Genet. 2010;19(18):3566–82. https://doi.org/10.1093/hmg/ddq272.
19. Suarez Y. MicroRNAs as novel regulators of angiogenesis. Circ Res. 2009;104(4):442–54. https://doi.org/10.1161/CIRCRESAHA.108.191270.
20. Enquobahrie D.A., Abetew D.F., Sorensen T.K. et al. Placental microRNA expression in pregnancies complicated by preeclampsia. Am J Obstet Gynecol. 2011;204(2):178.e12–21. https://doi.org/10.1016/j.ajog.2010.09.004.
21. Luo S., Cao N., Tang Y., Gu W. Identification of key microRNAs and genes in preeclampsia by bioinformatics analysis. PLoS One. 2017;12(6):e0178549. https://doi.org/10.1371/journal.pone.0178549.
22. Wu L., Zhou H., Lin H. et al. Circulating microRNAs are elevated in plasma from severe preeclamptic pregnancies. Reproduction. 2012;143(3):389–97. https://doi.org/10.1530/REP-11-0304.
23. Клинические рекомендации – Преэклампсия. Эклампсия. Отеки, протеинурия и гипертензивные расстройства во время беременности, в родах и послеродовом периоде – 2021-2022-2023 (24.06.2021). М.: Министерство здравоохранения Российской Федерации, 2021. 54 с. Режим доступа: http://disuria.ru/_ld/10/1046_kr21O10O16MZ.pdf. [Дата обращения: 25.03.2023].
24. Клинические рекомендации – Недостаточный рост плода, требующий предоставления медицинской помощи матери (задержка роста плода) – 2022-2023-2024 (14.02.2022). М.: Министерство здравоохранения Российской Федерации, 2022. 47 с. Режим доступа: http://disuria.ru/_ld/11/1152_kr22O36p5MZ.pdf. [Дата обращения: 25.03.2023].
25. Anton L., Olarerin-George A.O., Hogenesch J.B., Elovitz M.A. Placental expression of miR-517a/b and miR-517c contributes to trophoblast dysfunction and preeclampsia. PLoS One. 2015;10(3):e0122707. https://doi.org/10.1371/journal.pone.0122707.
26. Wang Y., Zhang Y., Wang H. et al. Aberrantly up-regulated miR-20a in pre-eclampsic placenta compromised the proliferative and invasive behaviors of trophoblast cells by targeting forkhead box protein A1. Int J Biol Sci. 2014;10(9):973–82. https://doi.org/10.7150/ijbs.9088.
27. Peng P., Song H., Xie C. et al. miR-146a-5p-mediated suppression on trophoblast cell progression and epithelial-mesenchymal transition in preeclampsia. Biol Res. 2021;54(1):30. https://doi.org/10.1186/s40659-021-00351-5.
28. Lip S., Boekschoten M., van Pampus M. et al. 103. Dysregulated circulating microRNAs in preeclampsia: the role of miR-574-5p and miR-1972 in endothelial dysfunction. Pregnancy Hypertens. 2018;13:S22. https://doi.org/10.1016/j.preghy.2018.08.068.
29. Luque A., Farwati A., Crovetto F. et al. Usefulness of circulating microRNAs for the prediction of early preeclampsia at first-trimester of pregnancy. Sci Rep. 2014;4:4882. https://doi.org/10.1038/srep04882.
30. Luo R., Shao X., Xu P. et al. MicroRNA-210 contributes to preeclampsia by downregulating potassium channel modulatory factor 1. Hypertension. 2014;64(4):839–45. https://doi.org/10.1161/HYPERTENSIONAHA.114.03530.
31. Huang X., Wu L., Zhang G. et al. Elevated microRNA-181a-5p contributes to trophoblast dysfunction and preeclampsia. Reprod Sci. 2019;26(8):1121–9. https://doi.org/10.1177/1933719118808916.
32. Xie N., Jia Z., Li L. miR-320a upregulation contributes to the development of preeclampsia by inhibiting the growth and invasion of trophoblast cells by targeting interleukin 4. Mol Med Rep. 2019;20(4):3256–64. https://doi.org/10.3892/mmr.2019.10574.
33. Zhong Y., Zhu F., Ding Y. Differential microRNA expression profile in the plasma of preeclampsia and normal pregnancies. Exp Ther Med. 2019;18(1):826–32. https://doi.org/10.3892/etm.2019.7637.
34. Ren Y., Xu Y., Wang Y. et al. Regulation of miR-375 and Sonic hedgehog on vascular endothelial growth factor in preeclampsia rats and its effect on trophoblast cells. Biosci Rep. 2020;BSR20200613. https://doi.org/10.1042/BSR20200613. [Online ahead of print].
35. Awamleh Z., Gloor G.B., Han V.K.M. Placental microRNAs in pregnancies with early onset intrauterine growth restriction and preeclampsia: potential impact on gene expression and pathophysiology. BMC Med Genomics. 2019;12(1):91. https://doi.org/10.1186/s12920-019-0548-x.
36. Morales-Prieto D.M., Ospina-Prieto S., Chaiwangyen W. et al. Pregnancy-associated miRNA-clusters. J Reprod Immunol. 2013;97(1):51–61. https://doi.org/10.1016/j.jri.2012.11.001.
37. Morales-Prieto D.M., Chaiwangyen W., Ospina-Prieto S. et al. MicroRNA expression profiles of trophoblastic cells. Placenta. 2012;33(9):725–34. https://doi.org/10.1016/j.placenta.2012.05.009.
38. Jeschke U., Schiessl B., Mylonas I. et al. Expression of the proliferation marker Ki-67 and of p53 tumor protein in trophoblastic tissue of preeclamptic, HELLP, and intrauterine growth-restricted pregnancies. Int J Gynecol Pathol. 2006;25(4):354–60. https://doi.org/10.1097/01.pgp.0000225838.29127.6
39. Staribratova D., Zaprianov Z., Milchev N. Proliferation of villous trophoblast and stroma in normal and pathologic pregnancies (preeclampsia). Akush Ginekol (Sofiia). 2005;44(2):20–2. [Article in Bulgarian].
40. Prusac I.K., Zekic Tomas S., Roje D. Apoptosis, proliferation and Fas ligand expression in placental trophoblast from pregnancies complicated by HELLP syndrome or pre-eclampsia. Acta Obstet Gynecol Scand. 2011;90(10):1157–63. https://doi.org/10.1111/j.1600-0412.2011.01152.x.
41. Фураева К.Н., Степанова О.И., Овчинникова О.М. и др. Пролиферативная и миграционная активность клеток трофобласта при преэклампсии. Акушерство и гинекология. 2015;(5):49–55.
42. Hromadnikova I., Kotlabova K., Hympanova L., Krofta L. Gestational hypertension, preeclampsia and intrauterine growth restriction induce dysregulation of cardiovascular and cerebrovascular disease associated microRNAs in maternal whole peripheral blood. Thromb Res. 2016;137:126–40. https://doi.org/10.1016/j.thromres.2015.11.032.
43. Ходжаева З.С., Холин А.М., Вихляева Е.М. Ранняя и поздняя преэклампсия: парадигмы патобиологии и клиническая практика. Акушерство и гинекология. 2013;(10):4−11.
44. Chen S., Chen R., Zhang T. et al. Relationship of cardiovascular disease risk factors and noncoding RNAs with hypertension: a case-control study. BMC Cardiovasc Disord. 2018;18(1):58. https://doi.org/10.1186/s12872-018-0795-3.
45. Тolba F.M., Agha A.M., Rachwan M. et al. Evaluation of MicroRNA-210 (miR-210) as a diagnostic and prognostic biomarker in pre-eclampsia pregnancies. Benha Medical Journal. 2020;38(1):79–93. https://doi.org/10.21608/bmfj.2020.120287.
46. Ura B., Feriotto G., Monasta L. et al. Potential role of circulating microRNAs as early markers of preeclampsia. Taiwan J Obstet Gynecol. 2014;53(2):232–4. https://doi.org/10.1016/j.tjog.2014.03.001.
Об авторах
Д. Г. ПашковскийРоссия
Пашковский Дмитрий Геннадьевич – студент
295051 Симферополь, бульвар Ленина, д. 5/7
Е. В. Соловьева
Россия
Соловьева Екатерина Васильевна – студент
295051 Симферополь, бульвар Ленина, д. 5/7
Ц. Р. Рабаданова
Россия
Рабаданова Цибац Рабазановна – студент
295051 Симферополь, бульвар Ленина, д. 5/7
П. Т. Горбунова
Россия
Горбунова Полина Тарасовна – студент
295051 Симферополь, бульвар Ленина, д. 5/7
А. Б. Дубовая
Россия
Дубовая Анастасия Богдановна – студент
295051 Симферополь, бульвар Ленина, д. 5/7
Э. Р. Муслимова
Россия
Муслимова Эмилие Рефатовна – студент
295051 Симферополь, бульвар Ленина, д. 5/7
Э. Э. Хороз
Россия
Хороз Эдие Эльдаровна – студент
295051 Симферополь, бульвар Ленина, д. 5/7
З. С. Карабаш
Россия
Карабаш Зекие Серверовна – студент
295051 Симферополь, бульвар Ленина, д. 5/7
Л. Е. Сорокина
Россия
Сорокина Лея Евгеньевна – аспирант
115478 Москва, Каширское шоссе, 24, корп. 2
Рецензия
Для цитирования:
Пашковский Д.Г., Соловьева Е.В., Рабаданова Ц.Р., Горбунова П.Т., Дубовая А.Б., Муслимова Э.Р., Хороз Э.Э., Карабаш З.С., Сорокина Л.Е. Профиль экспрессии плазматических микроРНК и генов-мишеней у пациенток с осложненным течением беременности. Акушерство, Гинекология и Репродукция. 2023;17(2):231-243. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.413
For citation:
Pashkovsky D.G., Solovieva E.V., Rabadanova Ts.R., Gorbunova P.T., Dubovaya A.B., Muslimova E.R., Khoroz E.E., Karabash Z.S., Sorokina L.E. Expression profile of plasma microRNAs and target genes in patients with complicated pregnancy. Obstetrics, Gynecology and Reproduction. 2023;17(2):231-243. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.413

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































