Перейти к:
Современные представления об этиологии патогенетических механизмов хронического эндометрита
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.362
Аннотация
Введение. В связи со стремительным развитием современных репродуктивных технологий в последние годы большое внимание уделяется пациенткам, основной причиной инфертильности которых (до 55 %) является хронический эндометрит (ХЭ). Ввиду отсутствия ярко выраженных и специфических клинических проявлений, трудоемкости микроскопического исследования, необходимого для диагностики, зачастую ХЭ не уделяется должного клинического внимания. Однако неоспоримая взаимосвязь между ХЭ и состояниями, связанными с бесплодием, такими как неоднократные неудачные имплантации и привычный выкидыш, диктует необходимость расширения знаний об этиологии и патогенезе данной патологии с целью разработки как высокоинформативных методов диагностики, так и для создания эффективных схем терапии.
Цель: проанализировать литературные данные о патогенетических механизмах ХЭ.
Материалы и методы. Поиск литературы проводили в поисковых базах Web of Science, eLIBRARY, Scopus, PubMed/MEDLINE. Отбирали статьи за период 1995–2022 гг., посвященные патогенетическим и морфологическим особенностям ХЭ. Поиск статей проводился по ключевым словам «хронический эндометрит», «плазмоклеточный эндометрит», «рецептивность эндометрия», «бесплодие первичное», «бесплодие вторичное», «окно имплантации». Для исключения пропуска подходящих статей методологический фильтр не применялся. В исследование были включены полнотекстовые источники и литературные обзоры по изучаемой тематике. Из обзора были исключены статьи, не имеющие прямого отношения к тематике ХЭ. Чтобы избежать включения в литературный обзор дублирующихся публикаций, в случае обнаружения двух исследований одних и тех же авторов был изучен период исследования каждого автора, и если даты совпадали, выбирали самую последнюю по дате публикацию.
Результаты. Обобщены новые морфологические, имунногистохимические, генетические и иммунологические аспекты ХЭ. «Золотым стандартом» морфологической диагностики ХЭ является наличие плазматических клеток, однако их сходство с фибробластами затрудняет гистологическое исследование и требует расширения спектра диагностических маркеров. Так, у пациенток с ХЭ отмечается пониженная экспрессия NK-клеток при повышенной экспрессии CD3+, CD+8, CD20+, CD138+ клеток, а также повышение уровней провоспалительных факторов, таких как фактор некроза опухоли-α – в 3 раза, интерлейкина-6 – в 2,7 раза, интерлейкина-8 – в 1,2 раза, интерферона-γ – в 1,4 раза по сравнению со здоровыми женщинами. Особое значение уделяется особенностям рецепторного аппарата при хроническом воспалении в эндометрии в аспекте репродуктивных потерь у инфертильных женщин, при этом благоприятным маркером для успешной беременности является соотношение прогестероновых и эстрогеновых рецепторов в интервале от 2 до 3.
Заключение. Частота ХЭ в структуре причин бесплодия и неблагоприятных репродуктивных исходов может достигать 50 %, однако ввиду сложностей морфологической диагностики верификация данного диагноза затруднена. Освещенный в данном обзоре широкий спектр патогенетических особенностей формирования хронического воспаления в эндометрии может быть перспективен не только для разработки диагностических маркеров, но и для улучшения регенеративной способности эндометрия, что повысит шансы на успешную реализацию репродуктивной функции у инфертильных женщин.
Ключевые слова
Для цитирования:
Галкина Д.Е., Макаренко Т.А. Современные представления об этиологии патогенетических механизмов хронического эндометрита. Акушерство, Гинекология и Репродукция. 2023;17(1):115-126. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.362
For citation:
Galkina D.E., Makarenko T.A. Current concepts on etiology of the pathogenetic mechanisms related to chronic endometritis. Obstetrics, Gynecology and Reproduction. 2023;17(1):115-126. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.362
ВВЕДЕНИЕ / INTRODUCTION
В течение последних нескольких десятилетий внимание репродуктологов обращено на ключевые причины инфертильности женщин, при этом одной из лидирующих причин является хронический эндометрит (ХЭ). Частота этой патологии у пациенток с необъяснимым бесплодием составляет от 40,7 до 55,7 %, в группе женщин с неоднократными неудачными попытками циклов экстракорпорального оплодотворения (ЭКО) – от 13,95 до 57,55 %, а у пациенток с привычным выкидышем на ранних сроках беременности – от 42,9 до 56,0 % [1][2].
В большинстве случаев ХЭ протекает бессимптомно или проявляется нетипично в виде аномальных маточных кровотечений, диспареунии, дискомфорта в области таза и лейкореи [3–5].
Отсутствие ярко выраженной клинической симптоматики и достаточно высокая частота встречаемости ХЭ в группе инфертильных женщин (до 60 %) диктует необходимость разработки современных высокоинформативных диагностических алгоритмов [6]. Следует отметить, что морфологический метод диагностики, который долгое время считался «золотым стандартом», несет в себе невысокую диагностическую ценность [7]. Так, по данным J.C. Kasius с соавт. (2011) и D.B. McQueen с соавт. (2014), частота морфологической верификации ХЭ в биоптатах эндометрия у женщин с бесплодием и с повторными самопроизвольными выкидышами в анамнезе не превышает 10 % [8][9].
Именно поэтому является актуальным поиск новых патогенетически обоснованных морфологических, иммуногистохимических и молекулярно-биологических методов исследования хронического воспалительного процесса в эндометрии, что позволит в последующем разрабатывать эффективные схемы лечения и повысить положительные репродуктивные результаты у данной категории больных [6–9].
Цель: проанализировать литературные данные о патогенетических механизмах ХЭ.
МАТЕРИАЛЫ И МЕТОДЫ / MATERIALS AND METHODS
Поиск научной литературы проводили в поисковых базах Web of Science, eLIBRARY, Scopus, PubMed/ MEDLINE за период 1995–2022 гг. Отбирали работы, посвященные патогенетическим и морфологическим особенностям ХЭ, с использованием алгоритма PRISMA. Поиск статей осуществляли независимо друг от друга 2 исследователя по ключевым словам на русском и английском языках: «хронический эндометрит», «плазмоклеточный эндометрит», «рецептивность эндометрия», «бесплодие первичное», «бесплодие вторичное», «окно имплантации», «chronic endometritis», «plasma cell endometritis», «endometrial receptivity», «primary infertility», «secondary infertility», «implantation window». В случае возникновения разногласий привлекали третьего исследователя. Для исключения пропуска подходящих статей методологический фильтр не применялся. В исследование были включены полнотекстовые источники и литературные обзоры по изучаемой тематике. Из обзора были исключены статьи, не имеющие прямого отношения к тематике ХЭ. Чтобы избежать включения в литературный обзор дублирующихся публикаций, в случае обнаружения двух исследований одних и тех же авторов был изучен период исследования каждого автора, и если даты совпадали, выбирали самую последнюю по дате публикацию. Из анализа исключали исследования, которые были представлены 50 и менее пациентами, что обусловлено необходимостью отбора для анализа возможно более репрезентативных данных. Также не включали в обзор работы с недостаточными данными о ХЭ, отсутствием гистологически подтвержденных диагнозов в случае представления морфологических и иммуногистохимических методов исследования (рис. 1).
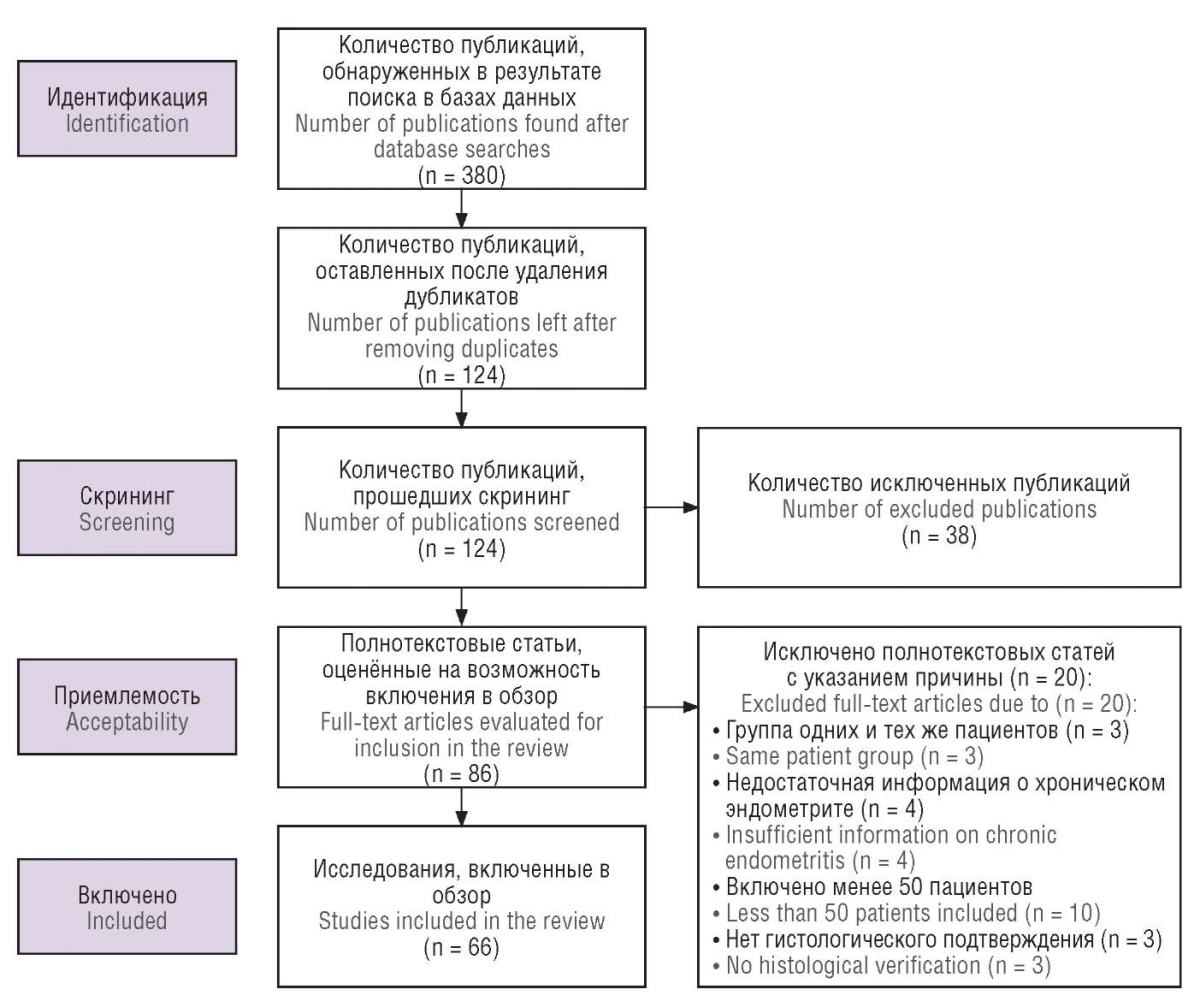
Рисунок 1. Блок-схема отбора публикаций.
Figure 1. A block diagram for publication selection.
РЕЗУЛЬТАТЫ / RESULTS
Морфологические особенности хронического эндометрита / Morphological features of chronic endometritis
С позиции патоморфологии ХЭ представляет собой персистирующее воспалительное состояние эндометрия, при этом верификация диагноза проводится при обнаружении поверхностных отечных трансформаций эндометрия, по наличию инфильтрации эндометрия стромальными плазмоцитами, а также диссоциированным созреванием между эпителием и стромой [10–13].
В настоящее время «золотым стандартом» диагностики ХЭ считается биопсия эндометрия с последующим гистологическим исследованием, при этом основным диагностическим маркером являются обнаруженные в строме эндометрия плазматические клетки [14]. Плазматическая клетка (рис. 2), являясь одним из типов лейкоцитов, происходящих от В-лимфоцитов, по своей функции отвечает за гуморальный иммунитет путем секреции иммуноглобулинов. Однако морфологическое сходство данных клеток с фибробластами ставит под сомнение точность их патоморфологической верификации с использованием традиционного окрашивания гематоксилином и эозином [15–17].

Рисунок 2. Гистологический срез биоптата эндометрия при хроническом эндометрите. Окраска гематоксилином и эозином. Множественная инфильтрация плазматическими клетками [фото авторов].
Figure 2. Histological section of endometrial biopsy in chronic endometritis. Stained with hematoxylin and eosin. Multiple plasmatic cells infiltration [authors' photo].
Также достаточно часто гистологически в базальном слое эндометрия при ХЭ выявляются и другие элементы воспаления, такие как лимфоциты (часто присутствуют в виде лимфоидных агрегатов) и эозинофилы, реактивные изменения желез, включая плоскоклеточные, маточные, и муцинозные метаплазии; при этом в стромальных клетках эндометрия наблюдается разрушение, фиброз и отек [18][19].
Инфекционный фактор в развитии хронического эндометрита / Infectious factor in the developing chronic endometritis
Большинство отечественных и зарубежных авторов сходятся во мнении, что патогенез ХЭ связан с качественным и количественным изменением микробного пейзажа эндометрия, при этом имеет место аномальная пролиферация различных типов микроорганизмов, в основном грамотрицательных и внутриклеточных бактерий (Enterococcus faecalis, микоплазма, уреаплазма, Chlamydia, Escherichia coli и Streptococcus spp.), которые часто сосуществуют в виде микробных сообществ – биопленок [20–23].
Так, по результатам исследования участков гена 16S рибосомальной РНК (рРНК) путем секвенирования Ю.А. Лызиковой (2020) было обнаружено, что у больных в эндометрии при ХЭ наиболее часто идентифицировались следующие микроорганизмы: Corynebacterium spp., Dialister spp., Eubacteriums pp., Bacteroides spp., Leptotrichia spp. и Porphyromonas spp. При этом у четверти пациенток (25,3 %) была обнаружена Prevotella spp. Автор пришла к выводу, что использование метода секвенирования 16S рРНК доказывает факт нестерильности полости матки как у женщин с ХЭ, так и у здоровой группы пациенток; при этом на слизистой полости матки у женщин с ХЭ присутствует генетический материал 41 вида микроорганизмов и их сочетаний [24].
В качестве доказательства инфекционной этиологии ХЭ в ходе исследования K. Kitaya с соавт. (2017) было показано, что циклы приема антибиотиков могут излечить ХЭ у большинства пациентов [25]. Однако необходимо обратить внимание на следующий факт: плазмоклеточный эндометрит, который является морфологической основой ХЭ, не имеет никакой корреляции с бактериальной колонизацией эндометрия или клинической картиной воспалительных заболеваний органов малого таза (ВЗОМТ) [26][27]. Так, по результатам исследования C.L. Haggerty с соавт. (2003), плазмоклеточный эндометрит был гистологически диагностирован лишь у 39 % женщин с различными ВЗОМТ, при том что патогены по результатам бактериологических посевов содержимого полости матки были высеяны у 82 % из них [28].
Противоположного мнения придерживаются С.Е. Cicinelli с соавт. (2008), которые доказали, что инфекционный агент является основой воспалительной болезни матки. Авторами было проанализировано 438 случаев только гистероскопически диагностированного ХЭ и сообщено, что в 73,1 % был выявлен как минимум один патоген. Большинство инфекций эндометрия были обычными бактериальными инфекциями (58 %), включая грамотрицательные бактерии, при этом Ureaplasma urealyticum была обнаружена в 10 % случаев, а Chlamydia trachomatis – в 2,7 % случаев [29].
Грамотрицательная бактериальная колонизация эндометрия способствует снижению частоты имплантации эмбрионов, одновременно увеличивая частоту выкидышей. Эндотоксины грамотрицательных бактерий могут индуцировать преобладающий ответ Т-хелперов (англ. T-helpers, Тh) в decidua, таким образом стимулируя выработку провоспалительных цитокинов; при этом формируется паракринная среда в эндометрии, которая может вызвать повреждение эмбриона, неудачную имплантации или самопроизвольный выкидыш [30–33].
Крайне редкой причиной ХЭ может быть генитальный туберкулез. Так, по данным С.И. Каюковой с соавт. (2011), в общей структуре причин ВЗОМТ генитальный туберкулёз встречается у 10–15 %, а в группе инфертильных женщин – в 15–20 % [34]. Однако в последнее время всё чаще встречается полиорганный, множественный туберкулёз, при этом среди пациенток с генитальным туберкулезом бесплодие диагностируется у 90–97 % [35][36]. Следует отметить, что наиболее часто встречается туберкулез маточных труб (85–90 %), одинаково часто диагностируется туберкулезное поражение яичников (в 10–12 %) и эндометрия (10–15 %) и лишь в 1,5–1,8 % – шейки матки [36]. Однако ввиду отсутствия специфических клинических проявлений (зачастую это лишь жалобы на бесплодие) диагностика генитального туберкулеза крайне затруднена.
С позиции патоморфологии микобактерия туберкулёза вызывает хронический гранулематозный эндометрит, для которого характерна слаборазвитая казеозная гранулема с окружающими ее лимфоцитарными инфильтратами, включая инфильтрацию эндометриальными стромальными плазмоцитами [37][38]. Именно по причине грубых патоморфологических изменений эндометрия на фоне перенесенного туберкулеза фертильность женщин после специфической терапии восстанавливается лишь в 6,7 % случаев [36–38].
В настоящее время в структуре ВЗОМТ доля вирусных инфекций составляет 40–60 % [39][40], однако у каждой третьей пациентки с ХЭ при детекции возбудителя в содержимом полости матки вирусный агент не определяется, что частично объясняется сложностью верификации патогенного агента бактериологическими и/или вирусологическими методами диагностики. Так, Э.Г. Атанесян с соавт. (2018) при анализе 152 результатов бактериологических и вирусологических посевов содержимого полости матки при ХЭ выявили, что у каждой второй пациентки определялась смешанная бактериально-вирусная флора (50 %), в 18 % – только бактериальная и чисто вирусная инфекция – лишь у 9 %; при этом отсутствие инфекционного агента констатировано практически в трети (23 %) случаях [39].
Иммунологические аспекты хронического эндометрита / Immunological aspects of chronic endometritis
Еще одним патогенетическим фактором развития ХЭ и репродуктивных неудач являются нарушения местной иммунной защиты и активация иммунопатологических процессов, обусловленных повышенным синтезом провоспалительных цитокинов [36]. Также существует мнение о том, что хронические ВЗОМТ являются аутоиммунными процессами, которые индуцируются причинным инфекционным агентом, а при продолжающемся влиянии бактериальных и вирусных агентов в дальнейшем протекающие как самоподдерживающаяся патологическая реакция [41][42]. Несомненно, что активация локальных иммунных процессов в эндометрии приводит к нарушению процесса имплантации, что влечет за собой ряд репродуктивных проблем: бесплодие и невынашивание беременности [43][44].
Так, с позиции локального иммунологического статуса было доказано, что секреторная функция эндометрия пациентов с ХЭ демонстрирует значительно более низкую частоту экспрессии NK-клеток (натуральных киллеров; англ. Natural killer cells, NK cells), чем у пациентов без ХЭ – 47,8 % против 67,3 % (р < 0,01). При этом у группы женщин с ХЭ выявлен значительно более высокий процент экспрессии CD3+ клеток, чем в биоптатах у пациенток без ХЭ – 25,0 % против 10,5 % (р < 0,01) [45].
По данным Bulmer J.N. с соавт. (2010), в образцах эндометрия с микрополипами у пациенток с ХЭ отмечалась низкая плотность NK-клеток, что, вероятно, явилось причиной выживания «остаточных» клеток эндометрия, и, вероятно, приводило к развитию полипов слизистой оболочки матки [44].
При проведении иммуногистохимических (ИГХ) исследований биоптатов эндометрия с ХЭ Г.Б. Дикке и В.В. Остроменским (2019) было обнаружено повышение уровней провоспалительных факторов: фактора некроза опухоли-α (англ. tumor necrosis factor-α, TNF-α) – в 3 раза, интерлейкина (англ. interleukin, IL) IL-6 – в 2,7 раза, IL-8 – в 1,2 раза, интерферона-γ (англ. interferon gamma, IFN-γ) – в 1,4 раза в сравнении с группой здоровых женщин, что, несомненно, снижает имплантационную функцию эндометрия [45].
По данным Г.Х. Толибовой с соавт. (2015), при ХЭ по сравнению со здоровыми женщинами концентрация CD8+ (цитотоксических Т-лимфоцитов) была повышена в 5 раз, CD20+ (В-лимфоцитов) – в 4–5 раз, CD138+ (плазмоцитов) – в 5 раз [46].
В исследованиях последних лет большое внимание уделяется роли В-клеток в регенерации и трансформации эндометрия. Так, в здоровом эндометрии их экспрессия не превышает 1 %, тогда как при ХЭ отмечается большое количество В-клеток как в функциональном, так и в базальном слое. Они накапливаются в стромальном отделе эндометрия, мигрируют в зону железистого эпителия и проникают дальше в просвет эндометриальных желез [45]. Так, K. Kitaya и T. Yasuo сообщили, что частота встречаемости В-лимфоцитов была значимо больше в биоптатах эндометрия у женщин с ХЭ, чем в группе здоровых пациенток, а также имела место аномальная экспрессия молекул адгезии и хемокинов [47][48].
Интересные данные получены о том, что в фазу десквамации у женщин с ХЭ отмечаются повышенные уровни провоспалительных цитокинов, включая IL-6, IL-1β и TNF-α, по сравнению с женщинами без ХЭ, при этом представленные результаты отражают дисбаланс цитокинов – Т-хелперов 1-го и 2-го порядка (Th1/Th2) в фазу секреции [49].
В результате изучения генетических факторов C. Di Pietro с соавт. (2013) было выявлено, что в биоптатах эндометрия с наличием хронического воспалительного процесса была повышена экспрессия гена белка, связывающего инсулиноподобный фактор роста-1 (англ. insulin-like growth factor binding protein-1, IGFBP-1), тогда как экспрессии генов инсулиноподобного фактора роста-1 (англ. insulin-like growth factor-1, IGF-1), IL-11 и мРНК (матричная РНК) хемокина CCL4 (англ. C motif chemokine ligand 4) были снижены в сравнении с биоптатами эндометрия в группе здоровых женщин [50]. Известно, что IGF-1 опосредует действие эстрогена на пролиферацию эндометрия, в то время как IGF-2 стимулирует действие прогестерона во время секреторной фазы, способствуя имплантации и инвазии эмбрионов [51][52]. IGFBP-1 секретируется из стромальных клеток эндометрия в процессе децидуализации, оказывая негативное влияние на процесс имплантации эмбриона и противодействуя действию IGF-2, при этом повышенная экспрессия гена IGFBP-1 и снижение экспрессии гена IGF-1 в эндометрии у женщин с ХЭ приводят к неблагоприятным условиям для имплантации и развития эмбриона [51][52].
Особенности рецептивности эндометрия у женщин с хроническим эндометритом / Features of endometrial receptivity in women with chronic endometritis
На сегодняшний день является неоспоримым тот факт, что нарушение рецепторного аппарата эндометрия занимает лидирующую позицию в структуре причинных факторов в группе инфертильных женщин. При этом с морфологических позиций хронический воспалительный процесс в эндометрии снижает экспрессию рецепторов за счет формирования фибропластических изменений в строме и сосудистом компоненте слизистой оболочки матки [53].
Согласно определению, рецептивность подразумевает под собой особое состояние эндометрия в период формирования «окна имплантации», формирующегося в лютеиновую фазу, при котором эндометрий отличается высокими адгезивными свойствами, которые способствуют синхронной имплантации эмбриона [54].
Также следует обратить внимание на то, что на начальных этапах течения ХЭ существует определенный компенсаторный механизм, позволяющий сохранять имплантационную способность эндометрия. Вышеописанное свойство обусловлено согласованностью «работы» всех компонентов иммунной системы матери в отношении патогенных микроорганизмов, которые присутствуют при ХЭ в 96 %. Однако формирование со временем аутоиммунного процесса в эндометрии в совокупности с морфологическими изменениями приводит к критичному нарушению его рецептивности, и как следствие, к бесплодию [55]. При этом имеется достоверная прямая умеренная корреляционная зависимость между длительностью течения ХЭ и частотой развития бесплодия на его фоне [56].
Многими исследованиями доказано, что ведущим маркером оценки рецепторного аппарата эндометрия является отношение прогестероновых рецепторов (ПР) к эстрогеновым (ЭР-α), которое оценивается в среднюю фазу секреции, при этом определяющим прогностическим фактором считается соотношение ПР/ЭР-α в клетках стромы эндометрия [57]. Значение отношения ПР/ЭР-α в диапазоне от 2 до 3 является благоприятным маркером для наступления успешной беременности [58][59].
При оценке патоморфологических особенностей рецепторного аппарата эндометрия у женщин с ХЭ обращает на себя внимание наличие участков повреждения поверхностного слоя эндометрия, нарушение созревания пиноподий к периоду формирования «окна имплантации», снижение экспрессии лейкемия-ингибирующего фактора (англ. leukemia inhibitory factor, LIF) и гиперэкспрессия ЭР-α [59–61].
Установлено, что LIF и муцин 1 играют ключевую роль в имплантации, притягивая бластоцисту к оптимальному месту внедрения в эндометрий [57], тогда как при гипоплазии эндометрия, что имеет место при ХЭ, регистрируется пониженная экспрессия данных маркеров [61–66].
Неполноценность рецепторного аппарата эндометрия является ключевым звеном репродуктивных потерь и неудачных попыток ЭКО у женщин с ХЭ. Так, Л.М. Михалёва с соавт. (2022) в своем исследовании изучали иммунологические механизмы формирования имплантационной несостоятельности эндометрия у женщин с повторными неудачами имплантации (ПНИ) в программах вспомогательных репродуктивных технологий (ВРТ).
При этом было выявлено, что в строме эндометрия у пациенток с ПНИ имеет место иммунологический дисбаланс, основой которого являются сниженные концентрации проангиогенных NK-клеток, регуляторных супрессивных Т-хелперов, а также плотная инфильтрация NK- и Т-клетками. Таким образом, на основании данных о патогенетических механизмах развития ХЭ можно сделать вывод о наличии двух ключевых моментов патогенеза ПНИ: снижение иммунологической толерантности к полуаллогенной бластоцисте и нарушение процессов нормального ангиогенеза в эндометрии [54].
ЗАКЛЮЧЕНИЕ / CONCLUSION
В настоящее время является неоспоримым тот факт, что лидирующую позицию в развитии неполноценности эндометрия с позиций регенерации, трансформации и адгезии занимает ХЭ, при этом частота его среди женщин репродуктивного возраста имеет диапазон от 12 до 68 %. В связи с этим в группе женщин с бесплодием необходимо своевременно диагностировать и лечить ХЭ.
За последние десятилетия во многих исследованиях акцентируется внимание на бессимптомном или волнообразно-прогрессирующем течении ХЭ, при этом очень часто классические морфологические признаки ХЭ могут не определяться. Именно поэтому необходимо расширять спектр диагностических исследований и определять не только микробный и вирусный спектр содержимого полости матки при ХЭ, но и проводить комплексное исследование биоптатов эндометрия с применением иммуногистохимических исследований, а также оценивать состояние рецепторного аппарата к половым гормонам (эстрогену и прогестерону). В последние десятилетия все больше появляется данных о маркерах, отражающих функциональную полноценность эндометрия (LIF, муцин 1 и др.), определение которых позволит повысить информативность диагностики ХЭ.
Так как на сегодняшний день является научно обоснованным факт формирования аутоиммунного воспаления при ХЭ, с целью его патоморфологический верификации рекомендовано проводить расширенное иммуногистохимическое исследование биоптатов эндометрия с определением ряда маркеров, таких как иммунокомпетентные клетки CD3, CD4, CD8, CD20, CD138, CD56, CD68, маркеры эстрогена и прогестерона (ЕР и ПР), маркер пролиферации Ki-67, маркер стволовых клеток эндометрия CD44, сосудистый эндотелиальный фактор CD34 и VEGF (англ. vascular endothelial growth factor; фактор роста эндотелия сосудов), белок p16 и антиапоптотический белок Bcl-2.
Принципиальным вопросом является дальнейшее изучение местного иммунного статуса на уровне эндометрия, корреция которого, возможно, позволит улучшить регенерацию эндометрия и повысить шансы на успешную реализацию репродуктивной функции.
Представленные данные об этиопатогенетических механизмах развития эндометрита должны лечь в основу прегравидарной подготовки женщин с ХЭ, главные положения которой должны включать в себя элиминацию инфекционного фактора, восстановление регенеративной и рецептивной способности эндометрия и повышение устойчивости местного иммунитета к основным патогенам.
Список литературы
1. Vitagliano A., Saccardi C., Litta P., Marco Noventa M. Chronic endometritis: really so relevant in repeated IVF failure? Am J Reprod Immunol. 2017;78(6):1–2. https://doi.org/10.1111/aji.12758.
2. Vitagliano A., Saccardi C., Noventa M. et al. Effects of chronic endometritis therapy on in vitro fertilization outcome in women with repeated implantation failure: a systematic review and meta-analysis. Fertil Steril. 2018;110(1):103–112.e1. https://doi.org/10.1016/j.fertnstert.2018.03.017.
3. Quaas A., Dokras A. Diagnosis and treatment of unexplained infertility. Rev Obstet Gynecol. 2008;1(2):69–76.
4. Cicinelli E., Matteo M., Tinelli R. et al. Chronic endometritis due to common bacteria is prevalent in women with recurrent miscarriage as confirmed by improved pregnancy outcome after antibiotic treatment. Reprod Sci. 2014;21(5):640–7. https://doi.org/10.1177/1933719113508817.
5. Park H.J., Kim Y.S., Yoon T.K. Chronic endometritis and infertility. Clin Exp Reprod Med. 2016;43(4):185–92. https://doi.org/10.5653/cerm.2016.43.4.185.
6. Тапильская Н.И., Толибова Г.Х., Объедкова К.В. и др. Алгоритм диагностики и лечения хронического эндометрита. Акушерство и гинекология. 2022;(S3):16–26.
7. Puente E., Alonso L., Lagana A.S. et al. Chronic endometritis: old problem, novel insights and future challenges. Fertil Steril. 2020;13(4):250–6. https://doi.org/10.22074/ijfs.2020.5779.
8. Kasius J.C., Fatemi H.M., Bourgain C. et al. The impact of chronic endometritis on reproductive outcome. Fertil Steril. 2011;96(6):1451–6. https://doi.org/10.1016/j.fertnstert.2011.09.039.
9. McQueen D.B., Bernardi L.A., Stephenson M.D. Chronic endometritis in women with recurrent early pregnancy loss and/or fetal demise. Fertil Steril. 2014;101(4):1026–30. https://doi.org/10.1016/j.fertnstert.2013.12.031.
10. Cicinelli E., De Ziegler D., Nicoletti R. Chronic endometritis: correlation among hysteroscopic, histologic, and bacteriologic findings in a prospective trial with 2190 consecutive office hysteroscopies. Fertil Steril. 2008;89(3):677–84. https://doi.org/10.1016/j.fertnstert.2007.03.074.
11. Greenwood S.M.M.J. Chronic endometritis: morphologic and clinical observations. Obstet Gynecol. 1981;58(2):176–84.
12. Cravello L., Porcu G., D'Ercole C. et al. Identification and treatment of endometritis. Contracept Fertil Sex. 1997;25(7–8):585–6. [Article in French].
13. Kiviat N.B., Wolner-Hanssen P., Eschenbach D.A. et al. Endometrial histopathology in patients with culture-proved upper genital tract infection and laparoscopically diagnosed acute salpingitis. Am J Surg Pathol. 1990;14(2):167–75. https://doi.org/10.1097/00000478-199002000-00008.
14. Liu Y., Phil M., Chen X. et al. Comparison of the prevalence of chronic endometritis as determined by means of different diagnostic methods in women with and without reproductive failure. Fertil Steril. 2018;109(5):832–9.https://doi.org/10.1016/j.fertnstert.2018.01.022.
15. Bayer-Garner I.B., Korourian S. Plasma cells in chronic endometritis are easily identified when stained with syndecan-1. Mod Pathol. 2001;14(9):877–9. https://doi.org/10.1038/modpathol.3880405.
16. Kannar V., Lingaiah H.K., Sunita V. Evaluation of endometrium for chronic endometritis by using syndecan-1 in abnormal uterine bleeding. J Lab Physicians. 2012;4(2):69–73. https://doi.org/10.4103/0974-2727.105584.
17. Kasius J.C., Broekmans F.J.M., Sie-Go D.M.D.S. et al. The reliability of the histological diagnosis of endometritis in asymptomatic IVF cases: a multicenter observer study. Hum Reprod. 2012;27(1):153–8. https://doi.org/10.1093/humrep/der341.
18. Skala S.L. Endometritis. PathologyOutlines.com website. Режим доступа: https://www.pathologyoutlines.com/topic/uterusendometritis.html. [Дата обращения: 01.10.2022].
19. Nucci M.R. Gynecologic Pathology: A Volume in Foundations in Diagnostic Pathology Series. 2nd Edition. Ed. C. Parra-Herran. Elsevier, 2020. 1040 p.
20. Kamiyama S., Teruya Y., Nohara M., Kanazawa K. Impact of detection of bacterial endotoxin in menstrual effluent on the pregnancy rate in in vitro fertilization and embryo transfer. Fertil Steril. 2004;82(4):788–92. https://doi.org/10.1016/j.fertnstert.2004.01.054.
21. Liu Y., Chen X., Huang J. et al. Comparison of the prevalence of chronic endometritis as determined by means of different diagnostic methods in women with and without reproductive failure. Fertil Steril. 2018;109(5):832–9. https://doi.org/10.1016/j.fertnstert.2018.01.022.
22. Moreno I., Cicinelli E., Garcia-Grau I. et al. The diagnosis of chronic endometritisin infertile asymptomatic women: a comparative study of histology, microbial cultures, hysteroscopy, and molecular microbiology. Am J Obstet Gynecol. 2018;218(6):602.e1–602.e16. https://doi.org/10.1016/j.ajog.2018.02.012.
23. Cicinelli E., De Ziegler D., Nicoletti R.et al. Poor reliability of vaginal and endocervical cultures for evaluating microbiology of endometrial cavity in women with chronic endometritis. Gynecol Obstet Investig. 2009;68(2):108–15. https://doi.org/10.1159/000223819.
24. Лызикова Ю.А. Микробиом полости матки у пациенток с хроническим эндометритом. Вестник ВГМУ. 2020;19(6):79–85. https://doi.org/10.22263/2312-4156.2020.6.79.
25. Kitaya K., Matsubayashi H., Takaya Y. et al. Live birth rate following oral antibiotic treatment for chronic endometritis in infertile women with repeated implantation failure. Am J Reprod Immunol. 2017;78(5):1–8. https://doi.org/10.1111/aji.12719.
26. Andrews W.W., Goldenberg R.L., Hauth J.C. Endometrial microbial colonization and plasma cell endometritis after spontaneous or indicated preterm versus term delivery. Am J Obstet Gynecol. 2005;193(3 Pt 1):739–45. https://doi.org/10.1016/j.ajog.2005.02.128.
27. Korn A.P., Hessol N., Padian N. et al. Commonly used diagnostic criteria for pelvic inflammatory disease have poor sensitivity for plasma cell endometritis. Sex Transm Dis. 1995;22(6):335–4. https://doi.org/10.1097/00007435-199511000-00002.
28. Haggerty C.L., Ness R.B., Amortegui A. et al. Endometritis does not predict reproductive morbidity after pelvic inflammatory disease. Am J Obstet Gynecol. 2003;188(1):141–8. https://doi.org/10.1067/mob.2003.87.
29. Cicinelli E., De Ziegler D., Nicoletti R. et al. Chronic endometritis: correlation among hysteroscopic, histologic, and bacteriologic findings in a prospective trial with 2190 consecutive office hysteroscopies. Fertil Steril. 2008;89(3):677–84. https://doi.org/10.1016/j.fertnstert.2007.03.074.
30. Tortorella C., Piazzolla G., Matteo M. et al. Interleukin-6, interleukin-1β, and tumor necrosis factor α in menstrual euents as biomarkers of chronic endometritis. Fertil Steril. 2014;101(1):242–7. https://doi.org/10.1016/j.fertnstert.2013.09.041.
31. Xu Y., Mei J., Diao L. et al. Chronic endometritis and reproductive failure: Role of syndecan-1. Am J Reprod Immunol. 2020;84(3):e13255. https://doi.org/10.1111/aji.13255.
32. Cicinelli E., Resta L., Nicoletti R. et al. Detection of chronic endometritis at fluid hysteroscopy. J Minim Invasive Gynecol. 2005;12(6):514-8. https://doi.org/10.1016/j.jmig.2005.07.394.
33. Kitaya K., Takeuchi T., Mizuta S. et al. Endometritis: new time, new concept. Fertil Steril. 2018;110(3):344–50. https://doi.org/10.1016/j.fertnstert.2018.04.012.
34. Каюкова С.И., Макаров О.В., Демихова О.В., Корнилова З.Х. Проблемы своевременной диагностики туберкулеза женских половых органов. Туберкулез и болезни легких. 2011;88(3):49–51.
35. Захарова О.В., Диомидова В.Н. Генитальный туберкулез у женщин репродуктивного возраста как фактор, способствующий вторичному бесплодию. Медицинский альманах. 2016;5(45):80–3.
36. Яковлева А.А. Выявление группы повышенного риска генитального туберкулеза у пациенток с бесплодием на этапе общей лечебной сети. Туберкулез и болезни легких. 2014;91(9):86–8.
37. Козырева Е.В., Давидян Л.Ю., Кометова В.В. Хронический эндометрит в аспекте бесплодия и невынашивания беременности. Ульяновский медико-биологический журнал. 2017;(2):56–63. https://doi.org/10.23648/UMBJ.2017.26.6218.
38. Сухих Г.Т., Шуршалина А.В. Хронический эндометрит: руководство. М.: ГЭОТАР-Медиа, 2013. 64 с.
39. Атанесян Э.Г., Пенжоян Г.А., Андреева М.Д. и др. Роль вирусной инфекции у женщин с хроническим воспалительным процессом в эндометрии. Российский вестник акушера-гинеколога. 2018;18(2):104–6. https://doi.org/10.17116/rosakush2018182104-106.
40. Овчарук Э.А., Хадарцева К.А., Овчарук В.Л. Хронические аутоиммунные эндометриты диагностика и лечение (краткое сообщение). Вестник новых медицинских технологий. Электронное издание. 2013;(1):221.
41. Gkrozou F., Tsonis O., Dimitriou E., Paschopoulos M. In women with chronic or subclinical endometritis is hysteroscopy suitable for setting the diagnosis? A systematic review. J Obstet Gynaecol Res. 2020;46(9):1639– 50. https://doi.org/10.1111/jog.14360.
42. Wiesenfeld H.C., Sweet R.L., Ness R.B. et al. Comparison of acute and subclinical pelvis inflammatory disease. Sex Trasm Dis. 2005;32(7):400– 5. https://doi.org/10.1097/01.olq.0000154508.26532.6a.
43. Matteo M., Cicinelli E., Greco P. et al. Abnormal pattern of lymphocyte subpopulations in the endometrium of infertile women with chronic endometritis. Am J Reprod Immunol. 2009;61(5):322–9. https://doi.org/10.1111/j.1600-0897.2009.00698.x.
44. Bulmer J.N., Williams P.J., Lash G.E. Immune cells in the placental bed. Int J Dev Biol. 2010;54(2–3):281–94. https://doi.org/10.1387/ijdb.082763jb.
45. Дикке Г.Б., Остроменский В.В. Нарушение иммунного статуса при хроническом эндометрите и опыт его коррекции посредством локальной цитокинотерапии. Акушерство и гинекология. 2019;(9):139–46. https://doi.org/10.18565/aig.2019.9.139-146.
46. Толибова Г.Х., Траль Т.Г, Клещёв М.А. и др. Эндометриальная дисфункция: алгоритм гистологического и иммуногистохимического исследования. Журнал акушерства и женских болезней. 2015;64(4):69–77.
47. Kitaya K., Yasuo T. Aberrant expression of selectin E, CXCL1, and CXCL13 in chronic endometritis. Mod Pathol. 2010;23(8):1136–46. https://doi.org/10.1038/modpathol.2010.98.
48. Kitaya K., Yasuo T. Immunohistochemistrical and clinicopathological characterization of chronic endometritis. Am J Reprod Immunol. 2011;66(5):410–5. https://doi.org/10.1111/j.1600-0897.2011.01051.x.
49. Li Y., Yu S., Huang C. et al. Evaluation of peripheral and uterine immune status of chronic endometritis in patients with recurrent reproductive failure. Fertil Steril. 2020;113(1):187–196.e1. https://doi.org/10.1016/j.fertnstert.2019.09.001.
50. Di Pietro C., Cicinelli E., Guglielmino M.R. et al. Altered transcriptional regulation of cytokines, growth factors, and apoptotic proteins in the endometrium of infertile women with chronic endometritis. Am J Reprod Immunol. 2013;69(5):509–17. https://doi.org/10.1111/aji.12076.
51. Fazleabas A.T., Kim J.J., Strakova Z. Implantation: embryonic signals and the modulation of the uterine environment. A review. Placenta. 2004;25Suppl A:S26–31. https://doi.org/10.1016/j.placenta.2004.01.014.
52. Lathi R.B., Hess A.P., Tulac S. et al. Dose-dependent insulin regulation of insulin-like growth factor binding protein-1 in human endometrial stromal cells is mediated by distinct signaling pathways. J Clin Endocrinol Metab. 2005;90(3):1599–606. https://doi.org/10.1210/jc.2004-1676.
53. Толибова Г.Х. Сравнительная оценка морфологических критериев эндометриальной дисфункции у пациенток с первичным бесплодием, ассоциированным с воспалительными заболеваниями малого таза, наружным генитальным эндометриозом и миомой матки. Журнал акушерства и женских болезней. 2016;65(6):52–60. https://doi.org/10.17816/JOWD65652-60.
54. Михалёва Л.М., Оразов М.Р., Силантьева Е.С. и др. Повторные неудачи имплантации. Патогенез иммунологических нарушений в эндометрии. Доктор.Ру. 2022;21(1):21–6. https://doi.org/10.31550/1727-2378-2022-21-1-21-26.
55. Ищенко А.И., Унанян А.Л., Коган Е.А. и др. Клинико-анамнестические, иммунологические, эхографические и гистероскопические особенности хронического эндометрита, ассоциированного с нарушением репродуктивной функции. Вестник РАМН. 2018;73(1):5–15. https://doi.org/10.15690/vramn927.
56. Шуршалина А.В., Демура Т.А. Морфофункциональные перестройки эндометрия в «окно имплантации». Акушерство и гинекология. 2011;(7–2):9–13.
57. Аганезов С.С., Аганезова Н.В., Мороцкая А.В., Пономоренко К.Ю. Рецептивность эндометрия у женщин с нарушениями репродуктивной функции. Журнал акушерства и женских болезней. 2017;66(3):135– 42. https://doi.org/10.17816/JOWD663135-142.
58. Marca L.A.A., Gaia G., Renzini M.M. et al. Hysteroscopic findings in chronic endometritis. Minerva Obstet Gynecol. 2021;73(6):790–805. https://doi.org/10.23736/S2724-606X.21.04970-8.
59. Казачков Е.Л., Казачкова Э.А., Воропаева Е.Е. и др. Структурная характеристика рецептивности эндометрия при хроническом эндометрите. Уральский медицинский журнал. 2013;4(109):60–4.
60. Абу-Абдаллах M., Артымук Н.В., Сурина М.Н. Рецептивность эндометрия. Маркеры имплантации. Фундаментальная и клиническая медицина. 2018;3(3):71–7.
61. Гришкина А.А., Чистякова Г.Н., Ремизова И.И., Гиниятова А.А. Экспрессия маркеров LIFR и LIF в эндометрии женщин страдающих гипоплазией эндометрия и бесплодием. Евразийский Союз Ученых. 2018;(3–1):33–5.
62. Михалева Л.М., Болтовская М.Н., Михалев С.А. и др. Клинико-морфологические аспекты эндометриальной дисфункции, обусловленной хроническим эндометритом. Архив патологии. 2017;79(6):22–9. https://doi.org/10.17116/patol201779622-29.
63. Gay C., Hamdaoui N., Pauly V. et al. Impact of antibiotic treatment for chronic endometritis on unexplained recurrent pregnancy loss. J Gynecol Obstet Hum Reprod. 2021;50(5):102034. https://doi.org/10.1016/j.jogoh.2020.102034.
64. Радзинский В.Е., Петров Ю.А., Калинина Е.А. Патогенетические особенности макротипов хронического эндометрита. Казанский медицинский журнал. 2017;98(1):27–34. https://doi.org/10.17750/kmj2017-27.
65. Данилюк С.В., Кирия Д.Г., Долгая О.В., Олейник А.Е. Патогистологические и иммуногистохимические особенности эндометрия при хроническом эндометрите у женщин с бесплодием (обзор литературы). Вестник проблем биологии и медицины. 2020;(4):13–7. https://doi.org/10.29254/2077-4214-2020-4-158-13-17.
66. Margulies S.L., Dhingra I., Flores V. et al. The diagnostic criteria for chronic endometritis: A survey of pathologists. Int J Gynecol Pathol. 2021;1;40(6):556–62. https://doi.org/10.1097/PGP.0000000000000737.
Об авторах
Д. Е. ГалкинаРоссия
Галкина Дарья Евгеньевна – к.м.н., доцент кафедры оперативной гинекологии института последипломного образования
660022 Красноярск, ул. Партизана Железняка, д. 1
Т. А. Макаренко
Россия
Макаренко Татьяна Александровна – д.м.н., профессор, зав. кафедрой оперативной гинекологии института последипломного образования
660022 Красноярск, ул. Партизана Железняка, д. 1
Рецензия
Для цитирования:
Галкина Д.Е., Макаренко Т.А. Современные представления об этиологии патогенетических механизмов хронического эндометрита. Акушерство, Гинекология и Репродукция. 2023;17(1):115-126. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.362
For citation:
Galkina D.E., Makarenko T.A. Current concepts on etiology of the pathogenetic mechanisms related to chronic endometritis. Obstetrics, Gynecology and Reproduction. 2023;17(1):115-126. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.362

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































