Перейти к:
Иммунотромбоз у онкологических больных: вклад внеклеточных ловушек нейтрофилов, ADAMTS-13 и фактора фон Виллебранда
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.364
Аннотация
Внеклеточные ловушки нейтрофилов (англ. neutrophil extracellular traps, NETs) и фактор фон Виллебранда (англ. Von Willebrand factor, vWF) являются неотъемлемыми участниками тромбоза и воспаления у онкологических пациентов. Все больше данных указывает на то, что между NETs и vWF существует активное взаимодействие; некоторые исследования свидетельствуют о том, что NETs вызывают снижение активности металлопротеазы ADAMTS-13 (англ. a disintegrin and metalloprotease with thrombospondin type 1 motif, member 13), являясь звеном патогенеза как тромботических микроангиопатий (ТМА), так и других тромботических осложнений на фоне онкологического процесса.
Цель: оценка взаимодействия NETs, vWF и ADAMTS-13 при злокачественных новообразованиях тела матки, яичников и молочных желез, аденокарциноме цервикального канала.
Материалы и методы. С сентября 2019 г. по июль 2022 г. проведено проспективное контролируемое интервенционное нерандомизированное исследование с участием 106 пациенток в возрасте от 30 до 72 лет, госпитализированных в стационар для планового оперативного лечения. В основную группу вошли 73 пациентки со злокачественными новообразованиями женских половых органов и молочных желез стадий I–III: рак тела матки (подгруппа 1; n = 18), рак яичников (подгруппа 2; n = 21), рак шейки матки – аденокарцинома цервикального канала (подгруппа 3; n = 9), рак молочной железы (подгруппа 4; n = 25). Контрольную группу составили 33 женщины с доброкачественными новообразованиями женских половых органов и молочной железы. У всех пациенток в плазме крови были оценены концентрации цитруллинированного гистона Н3 (англ. citrullinated histone H3, citH3), антигена миелопероксидазы (англ. myeloperoxidase, МРО), vWF, D-димера, активность и содержание ADAMTS-13.
Результаты. Выявлены значимые различия в концентрации маркеров нетоза между группами. Максимальные значения маркеров нетоза имели пациентки с опухолями матки и аденокарциномой цервикального канала. При этом отмечены значимые различия в уровне citH3 среди пациенток с «ранними» (стадия I) и «не ранними» (стадия II–III) формами заболеваний. При оценке концентрации фактора фон Виллебранда (vWF:Aг), антигена (ADAMTS-13:Aг) и активности ADAMTS-13(ADAMTS-13:Aк) были выявлены существенные различия между подгруппами основной группы и контрольной группой (p < 0,0001). Содержание vWF в основной группе было резко повышено на фоне снижения концентрации антигена и активности ADAMTS-13. Корреляционный анализ среди онкологических пациенток основной группы показал, что с увеличением концентрации citH3 повышается концентрация vWF:Aг (ρ = 0,80; р < 0,01) и MПO:Aг (ρ = 0,87; р < 0,01); с ростом концентрации MПO:Aг увеличивается концентрация vWF:Aг (ρ = 0,70; р < 0,01); с увеличением концентрации vWF:Aг снижаются ADAMTS-13:Aк (ρ = –0,43; р < 0,01) и ADAMTS-13:Aг (ρ = –0,42; р < 0,01).
Заключение. Взаимодействие между NETs, vWF и ADAMTS-13 приводит к формированию порочного круга, снижает активность ADAMTS-13, повышая концентрацию vWF в плазме крови, что положительно коррелирует с тяжестью и смертностью при ТМА, остром ишемическом инфаркте и при COVID-19. Ориентация на ось NETs–vWF может проложить новый путь к терапевтическим стратегиям иммунотромбоза при различных заболеваниях, включая онкологические.
Ключевые слова
Для цитирования:
Слуханчук Е.В., Бицадзе В.О., Солопова А.Г., Хизроева Д.Х., Цибизова В.И., Гри Ж., Элалами И., Щербаков Д.В., Панкратьева Л.Л., Ашрафян Л.А., Макацария А.Д. Иммунотромбоз у онкологических больных: вклад внеклеточных ловушек нейтрофилов, ADAMTS-13 и фактора фон Виллебранда. Акушерство, Гинекология и Репродукция. 2022;16(6):648-663. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.364
For citation:
Slukhanchuk E.V., Bitsadze V.O., Solopova A.G., Khizroeva J.Kh., Tsibizova V.I., Gris J., Elalamy I., Shcherbakov D.V., Pankratyeva L.L., Ashrafyan L.A., Makatsariya A.D. Immunothrombosis in cancer patients: contribution of neutrophil extracellular traps, ADAMTS-13 and von Willebrand factor. Obstetrics, Gynecology and Reproduction. 2022;16(6):648-663. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.364
ВВЕДЕНИЕ / INTRODUCTION
Нейтрофилы – наиболее многочисленная подгруппа лейкоцитов в плазме крови. Они играют критически важную роль в реакциях врожденного иммунитета и воспаления. Известно, что противомикробный эффект нейтрофилов основан на двух основных стратегиях: фагоцитоз и дегрануляция. V. Brinkmann с соавт. первыми сообщили о новой антимикробной стратегии нейтрофилов, связанной с формированием внеклеточных ловушек нейтрофилов (англ. neutrophil extracellular traps, NETs), которые представляют собой сетчатые хроматинсодержащие структуры, увешанные гистонами и гранулированными белками – протеазами, высвобождающимися из нейтрофилов во внеклеточное пространство [1][2]. В состав NETs ходят такие протеазы, как нейтрофильная эластаза (англ. neutrophil elastase, NE), миелопероксидаза (англ. myeloperoxidase, MPO), катепсин G (англ. cathepsin, CG), протеиназа-3 (англ. proteinase, PR-3), металлопротеиназа-9 (англ.
metalloproteinase-9, MMP-9) и пептид нейтрофилов человека-1 (англ. human neutrophil peptide-1, HNP-1) [3–5]. Состав, тип белков и посттрансляционные модификации NETs, синтезируемых в результате различных стимуляций, разные [6].
В настоящее время в зоне интереса находятся вопросы взаимодействия между NETs, фактором фон Виллебранда (англ. von Willebrand factor, vWF) и специфической металлопротеазой ADAMTS-13 (англ. a disintegrin and metalloprotease with thrombospondin type 1 motif, member 13) в рамках иммунотромбоза у онкологических пациентов. Все больше исследований показывают, что NETs, также как и vWF, играют важную роль в развитии артериального [7], венозного [8] и рак-ассоциированного тромбоза [9]. NETs напрямую взаимодействуют с vWF путем электростатических взаимодействий [10], и это взаимодействие удерживает их на поверхности эндотелия [11]. NETs напрямую и косвенно снижают активность ADAMTS-13, способствуя образованию сверхкрупных мультимеров vWF (англ. ultra large, UL-vWF). Взаимодействия NETs, vWF и ADAMTS-13 могут образовывать порочный круг, усугубляя развитие тромбоза и воспаления.
Все эти данные демонстрируют необходимость анализа взаимодействий между NETs, vWF и ADAMTS-13 при раке.
Цель: оценка взаимодействия NETs, vWF и ADAMTS-13 при злокачественных новообразованиях тела матки, яичников и молочных желез, аденокарциноме цервикального канала.
МАТЕРИАЛЫ И МЕТОДЫ / MATERIALS AND МETHODS
Дизайн исследования / Study design
С сентября 2019 г. по июль 2022 г. на базах ГБУЗ ГКОБ № 1 ДЗМ и ФГБНУ РНЦХ им. акад. Б.В. Петровского проведено проспективное контролируемое интервенционное нерандомизированное исследование с участием 106 пациенток в возрасте от 30 до 72 лет, госпитализированных в стационар для планового оперативного лечения.
Группы обследованных / Patient groups
В основную группу вошли 73 пациентки со злокачественными новообразованиями женских половых органов и молочных желез стадий I–III: рак тела матки (подгруппа 1; n = 18), рак яичников (подгруппа 2; n = 21), рак шейки матки – аденокарцинома цервикального канала (подгруппа 3; n = 9), рак молочной железы (подгруппа 4; n = 25).
Контрольную группу составили 33 женщины с доброкачественными новообразованиями женских половых органов и молочной железы.
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения в основную группу: наличие злокачественного новообразования яичников, тела матки, шейки матки и молочных желез, подтвержденное данными клинического и инструментального обследования; добровольное информированное согласие на участие в исследовании.
Критерии включения в контрольную группу: наличие доброкачественного новообразования женских половых органов и молочной железы; отсутствие в анамнезе активного рака и онкологических заболеваний, тромбозов и тромбоэмболий, хронических воспалительных заболеваний; добровольное информированное согласие на участие в исследовании.
Критерии исключения: наличие активного инфекционного и/или воспалительного процесса; аллергическая реакция на контрастные вещества, антикоагулянты, препараты химиотерапии; признаки тромботического или геморрагического синдрома на момент первого обследования; отказ от участия в исследовании.
Методы исследования / Study methods
Образцы плазмы получали путем венепункции до оперативного лечения и до назначения антикоагулянтов при поступлении пациента в отделение и хранили при температуре –80° С после центрифугирования. Отбор проб крови производили за сутки до операции натощак сухой стерильной иглой из локтевой вены в пластиковую пробирку в соотношении с антикоагулянтом 9:1. В качестве антикоагулянта использовали 3,8 % раствор трехзамещенного цитрата натрия.
В замороженных образцах плазмы с низким содержанием тромбоцитов определяли концентрацию антигена фактора фон Виллебранда (vWF:Aг), активность ADAMTS-13 (ADAMTS-13:Aк), концентрацию антигена ADAMTS-13 (ADAMTS-13:Aг) с использованием тестов TECHNOZYM® (Technoclone Herstellung von Diagnostika und Arzneimitteln GmbH, Австрия). Согласно данным производителя, нормальным референтным диапазоном для vWF:Aг считается диапазон 0,5–1,5 МЕ/мл (50–150 %), активности ADAMTS-13 – 0,4–1,3 МЕ/мл, антигена ADAMTS-13 – 0,41–1,41 ЕД/мл.
Для определения концентрации в плазме крови антигена миелопероксидазы человека (MРO:Aг) использовали набор для иммуноферментного анализа (ИФА) Hycult Biotech, (Нидерланды), в сооветствии с которым нормальный референтный уровень МРО:Аг составляет 2,56 ± 0,33 нг/мл.
Определение цитруллинированного гистона H3 (англ. citrullinated histone H3, citH3) в плазме крови осуществляли с использованием набора для ИФА Citrullinated Histone H3 ELISA Kit (Cayman Chemical, Ann Arbor, США).
D-димер определяли с помощью имеющегося в продаже иммуноанализа, усиленного латексом (TECHNOLEIA®, реагент Techoclone). Концентрацию D-димера > 250 нг/мл считали патологической в соответствии с данными производителя.
Этические аспекты / Ethical aspects
Исследование проводили согласно требованиям Хельсинской декларации. Все пациентки получили исчерпывающую информацию и подписали форму информированного согласия.
Статистический анализ / Statistical analysis
Статистический анализ включал в себя расчёт описательных статистик: средней (M), медианы (Ме), среднеквадратического отклонения (SD), возраста и индекса массы тела, лабораторных показателей. Оценка на нормальность распределения проводилась при помощи теста Харке–Бера (Jarque–Bera test). Нулевая гипотеза (H0) о том, что остатки значений рассматриваемых показателей групп участников имеют нормальное распределение, была нами отклонена на уровне значимости p ≤ 0,05. Непараметрическая оценка и сравнение значений показателей между группами были проведены при помощи критерия Манна–Уитни для несвязанных выборок (Mann–Whitney U-test). Нулевая гипотеза H0 была сформулирована нами как отсутствие различий между группами пациенток; H0 отклонялась во всех случаях при уровнях значимости p ≤ 0,05. При изучении связей между переменными с точки зрения отражения соответствующих причинноследственных отношений между значениями NETs, ADAMTS-13 и vWF проводился расчет ρ – коэффициента ранговой корреляции Спирмена (Spearman Rank Order Correlations) с фиксацией уровня значимости коэффициента в корреляционной матрице. Обработку данных осуществляли с использованием специализированного программного обеспечения Statistica 7.0 (StatSoft Inc., США).
РЕЗУЛЬТАТЫ / RESULTS
Клинико-анамнестическая характеристика обследованных пациенток / Clinical and anamnestic characteristics of patients examined
Клинико-анамнестические данные обследованных пациенток представлены в таблице 1.
Пациентки основной и контрольной групп достоверно не различались по возрасту и индексу массы тела. Обращает на себя внимание большое количество пациенток с ожирением как в основной, так и в контрольной группе, особенно среди женщин с доброкачественными и злокачественными заболеваниями молочных желез и эндометрия. В основной группе было значимо повышено количество пациенток с анемией, особенно в подгруппах рака эндометрия и рака яичников.
В таблице 2 представлены результаты изученных лабораторных показателей обследованных пациенток.
Таблица 1. Клинико-анамнестическая характеристика обследованных пациенток.
Table 1. Clinical and anamnestic characteristics of females examined.
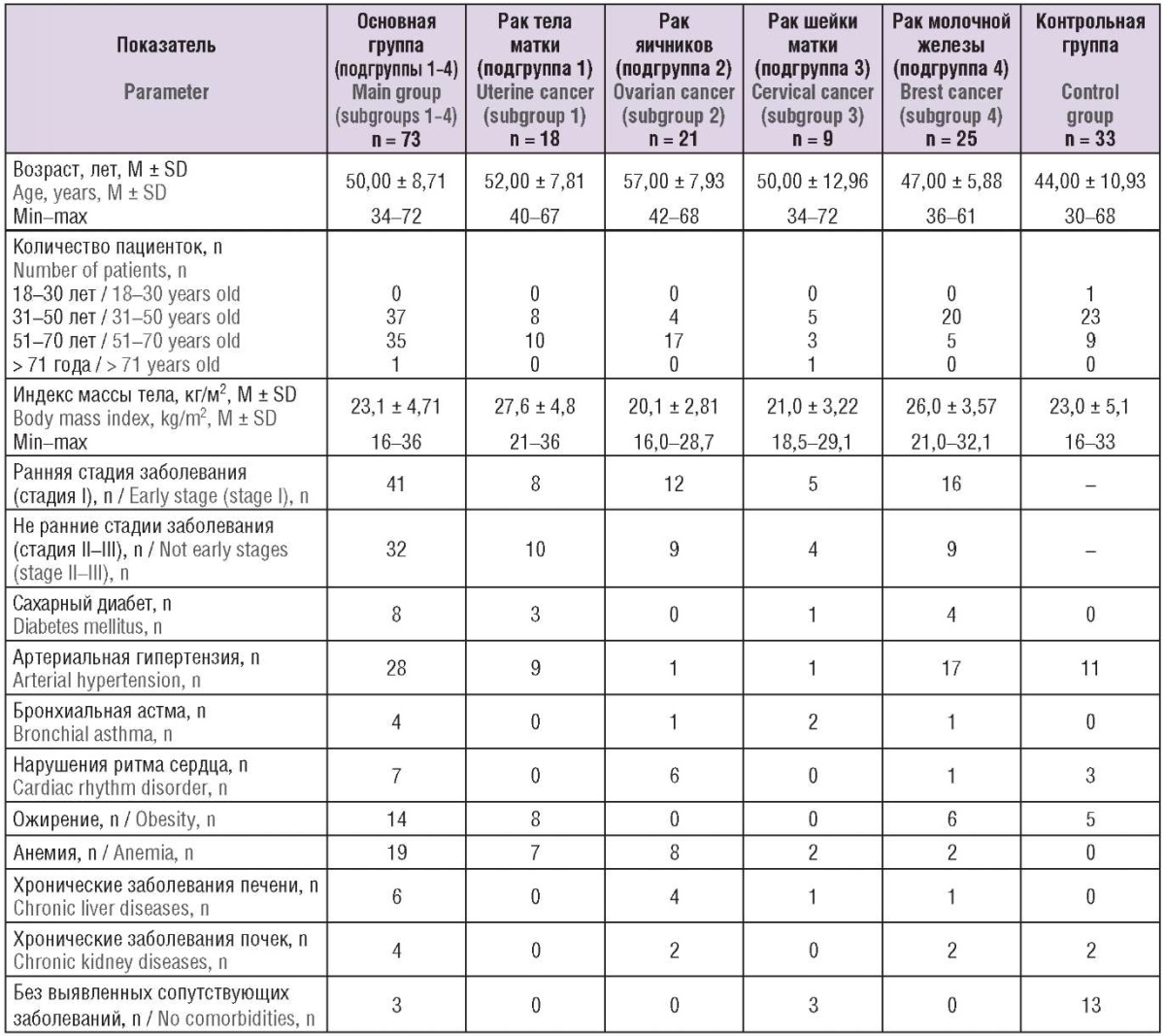
Примечание: ни по одному показателю различия между группами не были статистически значимыми.
Note: no significant inter-group differences found for any parameter.
Таблица 2. Лабораторные показатели крови обследованных пациенток (М ± SD).
Table 2. Laboratory blood parameters of patients examined (M ± SD).
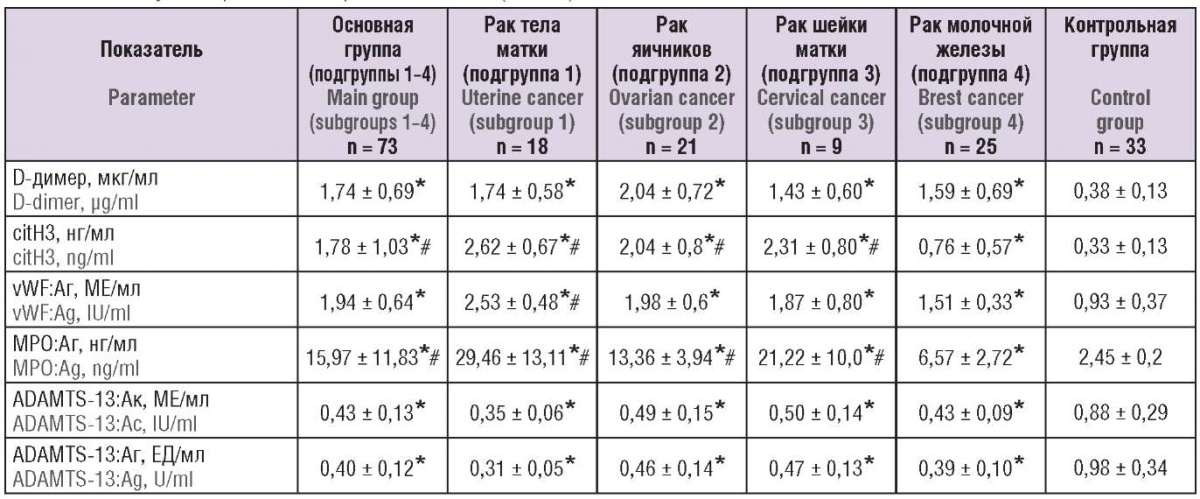
Примечание: *р < 0,05 – различия статистически значимы по сравнению с контрольной группой; #р < 0,05 – различия статистически значимы по сравнению с подгруппой 4; citH3 – цитруллинированный гистон H3; vWF:Aг – антиген фактора фон Виллебранда; MРO:Aг – антиген миелопероксидазы человека; ADAMTS-13:Aк – активность ADAMTS-13; ADAMTS-13:Aг – антиген ADAMTS-13.
Note: *p < 0.05 – significant differences compared to the control group; #p < 0.05 – significant differences compared to subgroup 4; citH3 – citrullinated histone H3; vWF:Ag – von Willebrand factor antigen; MPO:Ag – human myeloperoxidase antigen; ADAMTS-13:Ac – ADAMTS-13 activity; ADAMTS-13:Ag – ADAMTS-13 antigen.
Были выявлены значимые различия в содержании citH3 и антигена МРО человека между основной и контрольной группой (рис. 1, 2). Существенные различия между группами при оценке citH3 определены между пациентками с опухолями тела матки и яичников (р = 0,0135), опухолями тела матки и молочной железы (р < 0,00001), опухолями яичников и молочной железы (р < 0,00001); максимальные значения маркеров нетоза имели пациентки с опухолями тела матки и аденокарциномой цервикального канала, и их концентрации достоверно не различались.
При этом отмечены значимые различия в концентрации citH3 среди пациенток с «ранними» (стадия I) и «не ранними» (стадия II–III) формами заболеваний (рис. 3), а существенных различий в концентрации MPO среди пациенток с «ранними» (стадия I) и «не ранними» (стадия II–III) формами заболеваний не найдено.
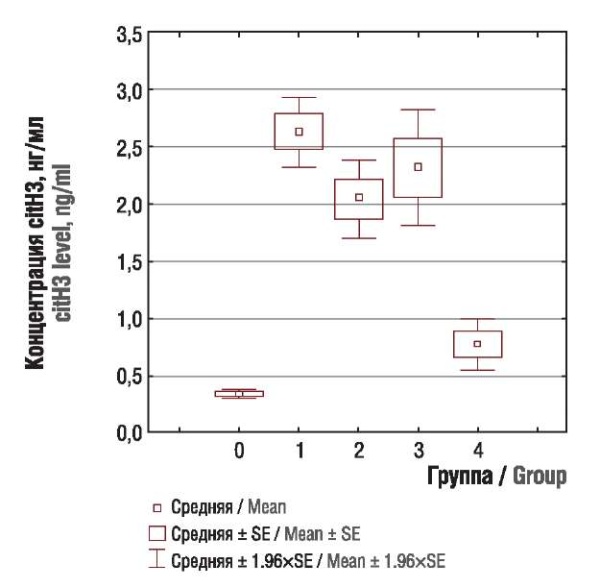
Рисунок 1. Концентрация цитруллинированного гистона H3 (citH3) у пациенток контрольной группы (0) и подгрупп с раком тела матки (1), яичников (2), шейки матки (3), молочной железы (4).
Figure 1. Citrullinated histone H3 (citH3) level in control group (0) and subgroups with uterine (1), ovarian (2), cervical (3), and breast (4) cancer.
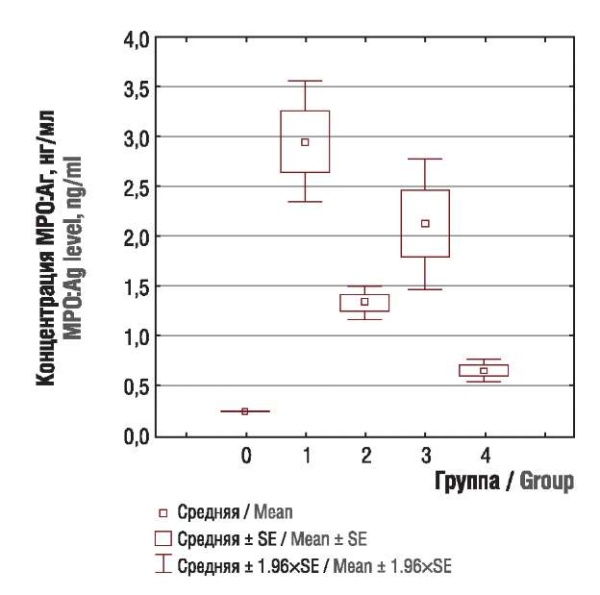
Рисунок 2. Концентрация антигена миелопероксидазы человека (MРO:Aг) у пациенток контрольной группы (0) и подгрупп с раком тела матки (1), яичников (2), шейки матки (3), молочной железы (4).
Figure 2. Human myeloperoxidase antigen (MPO:Ag) level in control group (0) and subgroups with uterine (1), ovarian (2), cervical (3), and breast (4) cancer.
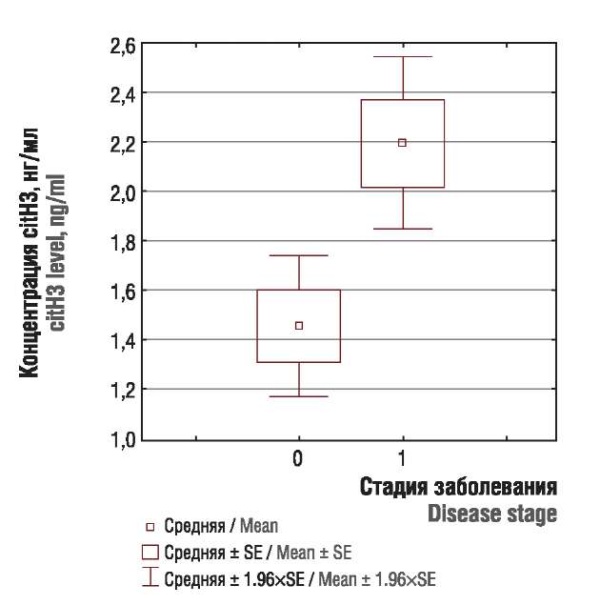
Рисунок 3. Концентрация цитруллинированного гистона H3 (citH3) у пациенток с «ранними» (стадия I; 0) и «не ранними» (стадия II–III; 1) формами заболевания.
Figure 3. Citrullinated histone H3 (citH3) level in patients with "early" (stage I; 0) and "not early" (stages II–III, 1) disease forms.
При оценке концентрации антигена фактора фон Виллебранда (vWF:Aг), антигена (ADAMTS-13:Aг) и активности (ADAMTS-13:Aк) ADAMTS-13 были выявлены значимые различия между основной и контрольной группой (p < 0,0001). Концентрация vWF в подгруппах основной группы была резко повышена (рис. 4) на фоне снижения концентрации антигена (рис. 5) и активности ADAMTS-13 (рис. 6). При сравнении показателей между подгруппами основной группы достоверных различий выявлено не было.
Установлены значимые различия в концентрации vWF:Aг среди пациенток с «ранними» (стадия I) и «не ранними» (стадия II–III) формами заболеваний (рис. 7).
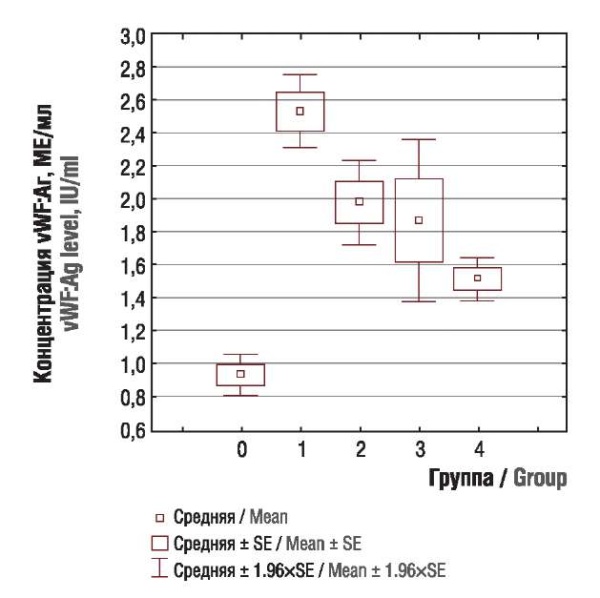
Рисунок 4. Концентрация антигена фактора фон Виллебранда (vWF:Aг) у пациенток контрольной группы (0) и подгрупп с раком тела матки (1), яичников (2), шейки матки (3), молочной железы (4).
Figure 4. Von Willebrand factor antigen (vWF:Ag) level in control group (0) and subgroups with uterine (1), ovarian (2), cervical (3), and breast (4) cancer.
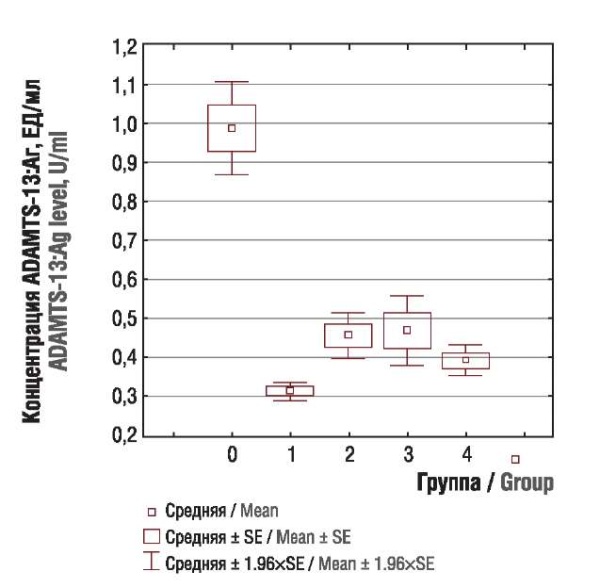
Рисунок 5. Концентрация антигена ADAMTS-13 (ADAMTS-13:Aг) у пациенток контрольной группы (0) и подгрупп с раком тела матки (1), яичников (2), шейки матки (3), молочной железы (4).
Figure 5. ADAMTS-13 antigen (ADAMTS-13:Ag) level in control group (0) and subgroups with uterine (1), ovarian (2), cervical (3), and breast (4) cancer.
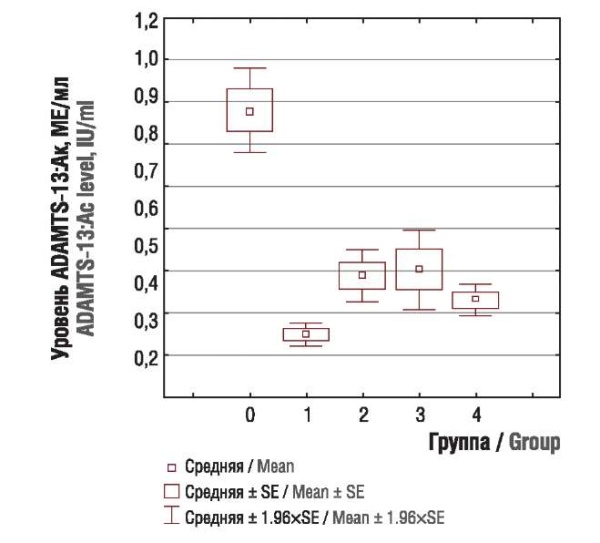
Рисунок 6. Уровень активности ADAMTS-13 (ADAMTS-13:Aк) у пациенток контрольной группы (0) и подгрупп с раком тела матки (1), яичников (2), шейки матки (3), молочной железы (4).
Figure 6. ADAMTS-13 аctivity (ADAMTS-13:Ac) in control group (0) and subgroups with uterine (1), ovarian (2), cervical (3), and breast (4) cancer.

Рисунок 7. Концентрация антигена фактора фон Виллебранда (vWF:Aг) у пациенток с «ранними» (стадия I; 0) и «не ранними» (стадия II–III; 1) формами заболевания.
Figure 7. Von Willebrand factor antigen (vWF:Ag) level in patients with "early" (stage I; 0) and "not-early" (stages II–III, 1) disease forms
Достоверных различий при оценке ADAMTS-13:Aг и ADAMTS-13:Aк среди пациенток с «ранними» (стадия I) и «не ранними» (стадия II–III) формами заболеваний выявлено не было.
Корреляции между содержанием маркеров нетоза, ADAMTS-13:Aк и АDAMTS-13:Аг / A correlation between NETosis markers, ADAMTS-13:Ac and АDAMTS-13:Аg Корреляционный анализ среди онкологических пациенток основной группы (рис. 8) определил, что с увеличением концентрации citH3 повышается концентрация vWF:Aг (ρ = 0,80; р < 0,01) и MПO:Aг (ρ = 0,87; р < 0,01); с ростом содержания MПO:Aг растет уровень vWF:Aг (ρ = 0,70; р < 0,01); с увеличением концентрации vWF:Aг снижаются значения ADAMTS-13:Aк (ρ = –0,43; р < 0,01) и ADAMTS-13:Aг (ρ = –0,42; р < 0,01).
Корреляционный анализ среди пациенток из подгруппы 2 (рак яичника) показал (рис. 9), что с ростом концентрации MРO:Aг снижаются значения ADAMTS-13:Aк (ρ = –0,58; р < 0,01) и ADAMTS-13:Aг (ρ = –0,60; р < 0,01), а также с увеличением концентрации citH3 снижаются уровни ADAMTS-13:Aк (ρ = –0,62; р < 0,01) и ADAMTS-13:Aг (ρ = –0,69; р < 0,01).
С увеличением концентрации citH3 повышается концентрация vWF:Aг (ρ = 0,76; р < 0,01); с увеличением концентрации vWF:Aг снижаются значения ADAMTS-13:Aк (ρ = –0,84; р < 0,01) и ADAMTS13:Aг (ρ = –0,86; р < 0,01).
Корреляционный анализ среди пациенток подгруппы 3 (рак шейки матки) показал корреляцию между уровнями citH3 и vWF:Aг (ρ = 0,83; р < 0,01) и citH3 и MРO:Aг (ρ = 0,84; р < 0,01). Обнаружена корреляционная зависимость в подгруппе 4 (рак молочной железы), где с увеличением концентрации citH3 повышалась концентрация vWF:Aг (ρ = 0,74; р < 0,01).
При оценке уровня Д-димера было выявлено значимое его повышение во всех подгруппах основной группы относительно контрольной, однако корреляционных связей с остальными изученными показателями установлено не было.

Рисунок 8. Корреляция Спирмена между значениями цитруллинированного гистона H3 (citH3), антигена фактора фон Виллебранда (vWF:Aг), активности (ADAMTS-13:Aк) и антигена (ADAMTS-13:Аг) ADAMTS-13 в основной группе.
Figure 8. Spearman correlation between citrullinated histone H3 (citH3), von Willebrand factor antigen (vWF:Ag), ADAMTS-13 activity (ADAMTS-13:Ac) and ADAMTS-13 antigen (ADAMTS-13:Ag) in the main group.
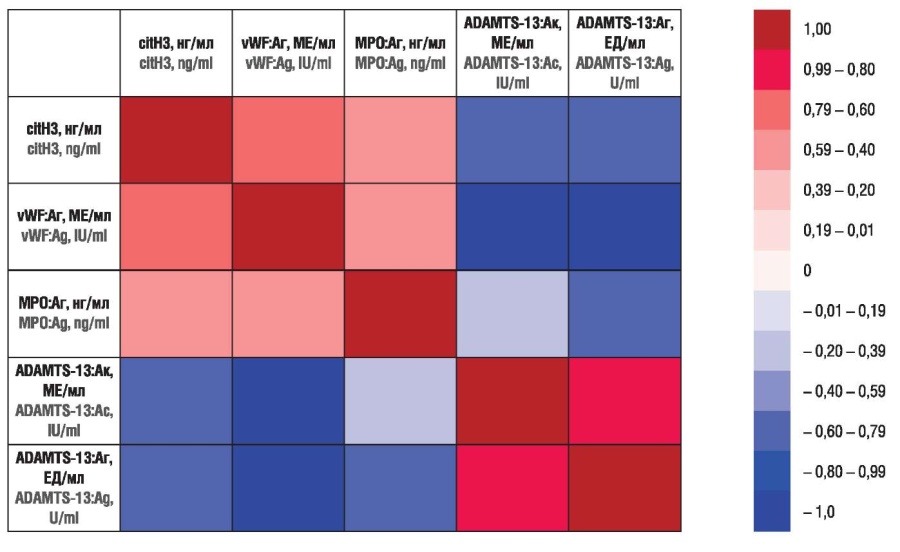
Рисунок 9. Корреляция Спирмена между значениями цитруллинированного гистона H3 (citH3), антигена фактора фон Виллебранда (vWF:Aг), антигена миелопероксидазы человека (MРO:Aг), активности (ADAMTS-13:Aк) и антигена (ADAMTS-13:Аг) ADAMTS-13 в подгруппе 2 (рак яичников).
Figure 9. Spearman correlation between citrullinated histone H3 (citH3), von Willebrand factor antigen (vWF:Ag), human myeloperoxidase antigen (MPO:Ag), ADAMTS-13 activity (ADAMTS-13:Ac), and ADAMTS-13 antigen (ADAMTS-13:Ag) in subgroup 2 (ovarian cancer).
ОБСУЖДЕНИЕ / DISCUSSION
За последнее десятилетие исследования показали, что NETs способствуют тромбообразованию, формированию и распространению артериальных, венозных и опухолевых тромбов. Взаимодействие между NETs и vWF приводит к формированию более крупных сетей, ускоряющих процессы иммунотромбоза при различных заболеваниях.
Как NETs, так и vWF являются участниками тромбоза и воспаления у онкологических больных. В ходе этих процессов происходит сложный ряд событий, включая активацию эндотелия, образование NETs, секрецию vWF и адгезию клеток крови, агрегацию и активацию тромбоцитов. Активность мультимеров vWF регулируется специфической металлопротеазой ADAMTS-13.
Механизмы формирования NETs / Mechanisms of NETs formation
К синтезу NETs, так называемому нетозу, приводят такие стимулы, как бактерии, грибы, вирусы, активированные тромбоциты, а также химические стимулы [4]. Механизм образования NETs сложен и до сих пор не до конца изучен [10]. Нетоз сопровождается дезорганизацией актина с последующим разрушением плазматической мембраны, формированием микровезикул, ремоделированием виментина, дезорганизацией микротрубочек, везикуляцией эндоплазматического ретикулума, деконденсацией хроматина, увеличением проницаемости плазматической мембраны и ядерной оболочки, а затем разрывом ядерной оболочки с освобождением хроматина в цитоплазму и, наконец, разрывом плазматической мембраны и выбросом внеклеточного хроматина. Данный механизм имеет место при суицидальном нетозе. В отличие от суицидального, при витальном нетозе нейтрофилы не подвергаются лизису и продолжают функционировать [11]. Помимо хромосомной ДНК, митохондриальная ДНК представляет собой еще один источник NETs при митохондриальном нетозе [12].
Механизмы NETs-индуцированного тромбоза / Mechanisms of NETs-induced thrombosis
В последние годы NETs были признаны важными участниками процесса тромбообразования, они обнаруживаются в тромбах у пациентов с венозным и артериальным тромбозом [13]. Протромботический эффект NETs проявляется в усилении агрегации тромбоцитов; NETs формируют каркас для привлечения эритроцитов, тромбоцитов и лейкоцитов, а также для связывания белков плазмы, таких как vWF и фибронектин [14]. Этот каркас также способствует отложению фибрина. Два основных компонента NETs – ДНК и гистоны активируют коагуляционный каскад. ДНК NETs способствует формированию тромбина в FXIIили FXI-зависимом пути [15]. Гистоны индуцируют синтез тромбина путем активации тромбоцитов через толл-подобные рецепторы (англ. toll-like receptors, TLRs) TLR2 и TLR4 независимо от FXII [14]. Кроме того, гистоны, особенно Н4, непосредственно взаимодействуют с тромбоцитами и активируют интегрин aIIbb3 на поверхности тромбоцитов, вызывая последующую агрегацию тромбоцитов, опосредованную фибриногеном [16]. Гистоны вызывают серьезное повреждение тканей и тромбоцитопению, а также индуцируют гибель мышей в эксперименте, которая предотвратима с использованием гепарина [16]. Сериновые протеазы NE и CG запускают путь тканевого фактора (англ. tissue factor, TF) и FXII-зависимую коагуляцию [17]. Неконтролируемое образование NETs приводит к повреждению тканей в результате активации воспалительных реакций, способствуя развитию фиброза [18], сепсиса [19], метастазирования опухолей [3], системных воспалительных заболеваний [18], тромбозу [20] и атеросклерозу.
Тканевой фактор является ключевым инициатором внешнего пути свертывания [21]. Нейтрофилы прикрепляются к эндотелию за счет взаимодействия антигена функции лейкоцитов-1 (англ. leukocyte function antigen-1, LFA-1) и молекулы межклеточной адгезии-1 (англ. intercellular adhesion molecule-1, ICAM-1), способствуя дальнейшей экспрессии TF и стимулируя образование фибрина и агрегацию тромбоцитов [22]. Повышенная экспрессия TF и высвобождение NETs с тканевым фактором в составе были обнаружены у пациентов с сепсисом [23], острым инфарктом миокарда [24][25], системной красной волчанкой [26] и COVID-19 [25]. В патогенезе этих заболеваний нейтрофилы выступают в роли источника TF.
Взаимодействие между тромбоцитами и нейтрофилами играет важную роль в развитии NETs-индуцированного тромбоза. Тромбоциты, взаимодействуя с нейтрофилами, приводят к активации нетоза посредством вовлечения комплекса P-селектина/PSGL-1 (англ. P-selectin glycoprotein ligand-1; гликопротеиновый лиганд P-селектина 1), связывания β2-интегринов нейтрофилов с гликопротеином GPIba на поверхности тромбоцитов [27], высвобождая растворимые медиаторы, такие как тромбоцитарный фактор 4/хемокиновый лиганд 4 (С-Х-С мотив) (англ. platelet factor 4/chemokine ligand 4 (C-X-C motif), PF4/CXCL4) [28] и белок 1 высокомобильной группы (high-mobility group protein box 1, HMGB1) [29]. HMGB1 усиливает привлечение нейтрофилов и нетоз [30]; NETs в свою очередь привлекают и активируют больше тромбоцитов. Повышая экспрессию тромбоцитарного P-селектина или путем активации TLR2 и TLR4 [31], гистоны способствуют активации тромбоцитов. Гистоны вызывают агрегацию тромбоцитов путем стимуляции притока ионов кальция и привлечения белков адгезии плазмы [16].
Фактор фон Виллебранда и ADAMTS-13 / von Willebrand factor and ADAMTS-13
Фактор фон Виллебранда – гликопротеин, выделяемый эндотелием [32]. Длинные мультимеры vWF, особенно UL-vWF, проявляют протромботическую активность. Гликопротеин vWF связывает циркулирующие тромбоциты в местах повреждения сосудов и способствует их последующей активации и агрегации [33]. Активность vWF зависит от его размера. Сверхбольшие мультимеры vWF (UL-vWF), высвобождаемые эндотелиальными клетками, могут спонтанно рекрутировать избыточное количество циркулирующих тромбоцитов и других клеток крови, способствуя развитию тромбоза.
Работа vWF регулируется металлопротеазой ADAMTS-13, которая специфически расщепляет пептидную связь Tyr1605-Met1606 в домене А2. Мультимеризация vWF и протеолиз ADAMTS-13 протекают параллельно, что позволяет контролировать размер мультимеров vWF, обеспечивая адекватную адгезию, активацию и агрегацию тромбоцитов. Три домена – A1-A2-A3 необходимы для функционирования vWF, так как они содержит участки связывания GPIba с тромбоцитами (A1), коллагеном субэндотелиального матрикса (А1 и А3) и пептидную связь, расщепляемую ADAMTS-13 (A2). В исследованиях было показано, что vWF участвует также и в привлечении лейкоцитов. Активированные тромбоциты на UL-vWF опосредуют рекрутирование лейкоцитов [2]. Домен D’D3 фактора фон Виллебранда связывается с PSGL-1 лейкоцитов, а также взаимодействует с лейкоцитарным интегрином b2 [34]. При наличии инфекционных агентов мультимеры vWF также связываются с NETs, формируя сеть, которая может привлекать как тромбоциты, так и лейкоциты, способствуя развитию тромбоза [35]. Размер таких тромбов эффективно контролируют ADAMTS-13 и ДНКаза I [36][37]. ADAMTS-13 расщепляет мультимеры vWF, в то время какДНКаза I расщепляет ДНК NETs.
Металлопротеаза ADAMTS-13 расщепляет большие мультимеры vWF на мелкие [38]. Тяжелый дефицит ADAMTS-13 приводит к развитию тромботической тромбоцитопенической пурпуры (ТТП) – заболеванию, характеризующемуся системным микрососудистым тромбозом [39]. ADAMTS-13 представляет собой многодоменный белок, включающий металлопротеазный домен (M), дизинтегриноподобный домен (D), домен тромбоспондина типа 1 (T), домен, богатый цистеином (C), спейсерный домен (S), за которым следуют 7 дополнительных повторов тромбоспондина типа 1 (T2–8) и два CUB (англ. c1r/c1s complement, sea urchin epidermal growth factor, and bone morphogenetic protein; комплемент c1r/c1s, эпидермальный фактор роста морского ежа и костный морфогенетический белок) [40][41]. Различные домены ADAMTS-13 связываются с vWF. Отсутствие спейсерного домена приводит к драматическому снижению его протеолитической активности, а значит, наличие спейсерного домена является жизненно важным [42].
Взаимодействия NETs, vWF и ADAMTS-13: формирование порочного круга / Interplay between NETs, vWF and ADAMTS-13: emerging vicious cycle
Свободно циркулирующая ДНК может напрямую связываться с доменом A1 фактора фон Виллебранда посредством электростатического взаимодействия [43], которое блокируется гепарином [44]. Это взаимодействие не препятствует расщеплению vWF посредством ADAMTS-13. Преинкубация с ДНК значительно ухудшает адгезию тромбоцитов на поверхности vWF, что указывает на то, что ДНК блокирует сайт связывания GPIba в домене A1 фактора фон Виллебранда [34, 44].
Нейтрофильная эластаза NETs, содержащая положительно заряженные фрагменты [45], также способна связываться с vWF посредством электростатического взаимодействия. Фактор фон Виллебранда является ключевым медиатором для рекрутирования лейкоцитов в места повреждения сосудов [46]; vWF клеточного происхождения и vWF тромбоцитарного происхождения также связываются с сетями. Исследования показали, что синтез тромбоцит-индуцированных NETs подавляется при блокировании выделения vWF активированными тромбоцитами [28]. Исследователи предположили, что vWF тромбоцитарного происхождения может быть связующим звеном между активированными тромбоцитами, нейтрофилами и тромбоцит-индуцированным нетозом.
В предыдущих исследованиях уже было показано, что и vWF и NETs обладают провоспалительным эффектом [47][48]. NETs, связанные с vWF, привлекают большее количество лейкоцитов к активированному эндотелию, усиливая инфильтрацию лейкоцитов в окружающие ткани и усиливая провоспалительные эффекты NETs. Таким образом, vWF, высвобождаемый из эндотелиальных клеток и тромбоцитов, взаимодействует с NETs, способствуя прогрессированию тромбоза и воспаления.
NETs модулируют активность как vWF, так и ADAMTS-13. Снижение активности ADAMTS-13 одновременно с повышением концентрации vWF в плазме крови наблюдается при тромботических микроангиопатиях (ТМА), связанных с системным воспалением, например, при тяжелом сепсисе, сепсис-индуцированном диссеминированном внутрисосудистом свертывании крови (ДВС-синдром), злокачественных новообразованиях, аутоиммунных заболеваниях [49].
Активированные нейтрофилы и NETs способствуют образованию дефицита ADAMTS-13. При системном воспалительном ответе активированные нейтрофилы и NETs выделяют различные цитокины, протеазы, пептиды и реактивные формы кислорода, такие как перекись водорода (H2O2) и хлорноватистая кислота (HOCl). Было показано, что некоторые провоспалительные цитокины регулируют высвобождение и расщепление мультимеров vWF в кровотоке [50]. Интерлейкин (англ. interleukin, IL) IL-8, фактор некроза опухоли альфа (англ. tumor necrosis factor alpha, TNF-α) и комплекс IL-6/IL-6-рецептор стимулируют высвобождение мультимеров vWF и его связывание с тромбоцитами на поверхности эндотелиальных клеток. IL-6 подавляет расщепление мультимеров vWF протеазой ADAMTS-13. У пациентов с сепсис-индуцированным ДВС-синдромом в плазме крови определяются низкомолекулярные формы ADAMTS-13, что указывает на связь дефицита ADAMTS-13 больше с протеолизом протеазы в плазме, чем с нарушением ее биосинтеза [51]. Нейтрофильная эластаза и плазмин инактивируют ADAMTS-13 путем протеолиза in vitro [51][52]. Миелопероксидаза катализирует образование HOCl из H2O2 и Cl–, что приводит к окислительному повреждению тканей [53]. HOCl окисляет Met1606 в A2 домене vWF в сайте расщепления ADAMTS-13, превращая метионин в сульфоксид метионина. Окисленный субстрат становится менее доступным для расщепления протеазой ADAMTS-13 [54]. Интересно, что HOCl, генерируемая MPO-H2O2-Cl––системой, окисляет и метионин в ADAMTS-13, значительно снижая ее способность расщеплять мультимеры vWF [55]. Таким образом, как субстрат vWF, так и ADAMTS-13 могут окисляться системой MPO-H2O2-Cl–, высвобождаемой из активированных нейтрофилов и при нетозе, что ведет к снижению активности ADAMTS-13 и повышению концентрации мультимеров vWF в плазме, что в конечном итоге приводит к усилению агрегации тромбоцитов и повышенному микротромбообразованию.
Пептиды нейтрофилов человека (англ. human neutrophil peptides, HNPs), также известные как альфадефенсины, играют важную роль в иммунных реакциях [56]; они обладают не только провоспалительным эффектом, но и прокоагулянтным за счет активации тромбоцитов [57] и гипофибринолитическим [58]. HNPs, высвобождаемые из активированных нейтрофилов и при нетозе, модулируют активность как vWF, так и ADAMTS-13. HNPs на конкурентной основе связываются с A2 доменом vWF и блокируют взаимодействие между ADAMTS-13 и vWF. Повышение концентрации HNPs в плазме крови наблюдается у пациентов с острой ТТП, что говорит о прямой связи между воспалением и дефицитом ADAMTS-13 при острой ТТП [56].
При формировании NETs пептидил-аргинин деиминаза 4 (англ. peptidyl arginine deiminase 4, PAD4) преобразует остатки аргинина в гистонах до остатков цитруллина [59]. PAD4 впоследствии необходима для деконденсации хроматина, высвобождаемого с NETs. Недавно было показано, что PAD4 способна цитруллинировать ADAMTS-13 плазмы на специфические остатки аргинина, что приводит к резкому снижению ферментативной активности ADAMTS-13 [60], при этом уменьшая время свертывания. Цитруллинированная ADAMTS-13 была обнаружена и в плазме крови пациентов с сепсисом [60].
С одной стороны, компоненты NETs подавляют активность ADAMTS-13 за счет окисления, цитруллинирования, протеолиза или конкурентного связывания с субстратом vWF A2, что приводит к увеличению концентрации антигена vWF, способствуя образованию мультимеров UL-vWF и их протромботическим эффектам. С другой стороны, как и ADAMTS-13, несколько протеаз NETs расщепляют vWF, проявляя свой антитромботический эффект. Однако их роль in vivo пока не определена. Изучение этих процессов позволяет пролить свет на взаимосвязь между воспалением, дефицитом ADAMTS-13 и ТМА. Взаимодействие между NETs и vWF подтверждается большим количеством компонентов NETs и активированных нейтрофилов на поврежденной стенке сосуда в непосредственной близости от vWF.
Это взаимодействие NETs-vWF может приводить к формированию порочного круга: опосредованный компонентом NETs дефицит ADAMTS-13 способствует образованию мультимеров UL-vWF, которые в свою очередь привлекают и присоединяют больше активированных нейтрофилов и компонентов NETs к стенке сосуда, усугубляя воспалениe и тромбоз. Таким образом, введение рекомбинантного человеческого ADAMTS-13 и/или ДНКазы I, возможно, является потенциальной терапевтической стратегией лечения ТМА и других системных воспалительных и тромботических осложнений, в том числе и у онкологических пациентов.
Возможные стратегии терапии / Potential therapeutic strategies
NETs и vWF играют решающую роль в патофизиологии острого ишемического инсульта (ИИ), который является основной причиной смерти во всем мире [61]. Большое количество активированных нейтрофилов и NETs выявлено в тромбах, извлеченных у пациентов с ИИ [62]. Разрушение NETs с помощью ДНКазы I или профилактика нетоза под действием Cl-амидина (ингибитора PAD4) значительно снижало интенсивность артериального тромбоза и способствовало поддержанию базального уровня кровотока на мышиных моделях [63]. Недавние клинические исследования также подтвердили, что NETs повышает компактность и стабильность инсультных тромбов, что затрудняет реканализацию сосудов и приводит к худшему клиническому исходу [64].
Фактор фон Виллебранда встраивается в фибриновые сети посредством ковалентного сшивания фактором XIIIa [65] или тромбинзависимым образом [66]. Инфузия рекомбинационного человеческого ADAMTS-13 растворяет устойчивые к тканевому активатору плазминогена (англ. tissue plasminogen activator, t-PA) тромбы и уменьшает размеры участков инфаркта головного мозга на модели мышей [67]. Ориентация на ось NETs–vWF кажется многообещающей и эффективной стратегией внутривенной тромболизисной терапии.
В совокупности и NETs и vWF могут привлекать тромбоциты и лейкоциты, способствуя гиперкоагуляции и лейкоцитарной инфильтрации. Bзаимодействие NETs–vWF приводит к формированию более крупной и стабильной структуры, привлекающей клетки крови и факторы коагуляции в места повреждения сосудов, облегчая взаимодействия между тромбоцитами/лейкоцитами/NETs/фибрин/vWF и способствуя развитию иммунотромбоза.
Возможно, взаимодействие между NETs и vWF способствует артериальным и венозным тромбозам, поддержанию провоспалительного статуса и прогрессированию онкологического процесса. В нашем исследовании было показано достоверное повышение маркеров нетоза у онкологических больных. Активированные нейтрофилы и NETs могут вызывать снижение активности ADAMTS-13, что в данном исследовании подтверждено выявленной корреляционной зависимостью. Чрезмерная активация гранулоцитов с высвобождением протеолитических ферментов увеличивает выделение высокомолекулярного vWF, содержащихся в тельцах Вейбеля–Паладе, что превосходит регуляторную способность молекул ADАМТS-13, на фоне чего происходит снижение концентрации антигена ADAMTS-13. Результаты проведенного исследования показывают, что у онкологических пациентов в циркулирующей крови содержание антигена vWF, МPО и citH3 существенно повышено; при этом с утяжелением стадии заболевания оно значимо растет, что отражает нарастание интенсивности процессов иммунотромбоза. Параллельно отмечено снижение значений ADAMTS-13:Аг и ADAMTS-13:Ак.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Изучение патогенеза иммунотромбоза находится в захватывающей фазе накопления знаний. Бoльшая часть литературы в основном фокусируется на том, какие стимулы могут приводить к нетозу при различных заболеваниях и состояниях, какие субстанции подавляют этот процесс. Необходимы дальнейшие исследования для выявления того, все ли популяции нейтрофилов обладают одинаковыми способностями генерировать сети в ответ на раздражители и для оценки физиологического значения нетоза.
Взаимодействие между NETs, vWF и ADAMTS-13 приводит к формированию порочного круга, снижает активность ADAMTS-13, повышая концентрацию vWF в плазме крови, что положительно коррелирует с тяжестью и смертностью при ТМА, остром ишемическом инфаркте, у онкологических пациентов и при COVID-19. Ориентация на ось NETs–vWF может проложить новый путь к терапевтическим стратегиям иммунотромбоза при различных заболеваниях, включая онкологические. В перспективе интересным является вопрос изучения взаимосвязи vWF и MРO с содержанием циркулирующих провоспалительных цитокинов IL-6, IL-8 и TNF-α. Необходимы дальнейшие проспективные многоцентровые исследования с целью подтверждения полученных данных. Такие исследования могут явиться основой для старта разработок новых терапевтических стратегий. Применение ДНКазы I и ADAMTS-13 является новой потенциальной стратегией терапии. Необходимо проведение дальнейших исследований с последующей разработкой новых препаратов, избирательно воздействующих на связывание NETs–vWF, что может иметь решающее значение для пациентов с приобретенной ТТП.
Список литературы
1. Brinkmann V., Reichard U., Goosmann C. et al. Neutrophil extracellular traps kill bacteria. Science. 2004;303(5663):1532–5. https://doi.org/10.1126/science.1092385.
2. Bernardo A., Ball C., Nolasco L. et al. Platelets adhered to endothelial cellbound ultra-large von Willebrand factor strings support leukocyte tethering and rolling under high shear stress. J Thromb Haemost. 2005;3(3):562–70. https://doi.org/10.1111/j.1538-7836.2005.01122.x.
3. Albrengues J., Shields M.A., Ng D. et al. Neutrophil extracellular traps produced during inflammation awaken dormant cancer cells in mice. Science. 2018;361(6409):eaao4227. https://doi.org/10.1126/science.aao4227.
4. Delgado-Rizo V., Martínez-Guzmán M.A., Iñiguez-Gutierrez L. et al. Neutrophil extracellular traps and its implications in inflammation: an overview. Front Immunol. 2017;8:81. https://doi.org/10.3389/fimmu.2017.00081.
5. Cao W., Pham H.P., Williams L.A. et al. Human neutrophil peptides and complement factor Bb in pathogenesis of acquired thrombotic thrombocytopenic purpura. Haematologica. 2016;101(11):1319–26. https://doi.org/10.3324/haematol.2016.149021.
6. Petretto A., Bruschi M., Pratesi F. et al. Neutrophil extracellular traps (NET) induced by different stimuli: A comparative proteomic analysis. PLoS One. 2019;14(7):e0218946. https://doi.org/10.1371/journal.pone.0218946.
7. Staessens S., Denorme F., Francois O. et al. Structural analysis ofischemic stroke thrombi: histological indications for therapy resistance. Haematologica. 2020;105(2):498–507. https://doi.org/10.3324/haematol.2019.219881.
8. Brill A., Fuchs T., Savchenko A. et al. Neutrophil extracellular traps promote deep vein thrombosis in mice. J Thromb Haemost. 2012;10(1):136–44. https://doi.org/10.1111/j.1538-7836.2011.04544.x.
9. Thålin C., Hisada Y., Lundström S. et al. Neutrophil extracellular traps: villains and targets in arterial, venous, and cancer-associated thrombosis. Arterioscler Thromb Vasc Biol. 2019;39(9):1724–38. https://doi.org/10.1161/ATVBAHA.119.312463.
10. Thiam H.R., Wong S.L., Qiu R. et al. NETosis proceeds by cytoskeleton and endomembrane disassembly and PAD4-mediated chromatin decondensation and nuclear envelope rupture. Proc Natl Acad Sci U S A. 2020;117(13):7326–37. https://doi.org/10.1073/pnas.1909546117.
11. Yipp B.G., Kubes P. NETosis: how vital is it? Blood. 2013;122(16):2784–94. https://doi.org/10.1182/blood-2013-04-457671.
12. Yousefi S., Mihalache C., Kozlowski E. et al. Viable neutrophils release mitochondrial DNA to form neutrophil extracellular traps. Cell Death Differ. 2009;16(11):1438–44. https://doi.org/10.1038/cdd.2009.96.
13. Laridan E., Martinod K., De Meyer S.F. Neutrophil extracellular traps in arterial and venous thrombosis. Semin Thromb Hemost. 2019;45(1):86–93. https://doi.org/10.1055/s-0038-1677040.
14. Hounkpe B.W., Fiusa M.M.L., Colella M.P. et al. Role of innate immunitytriggered pathways in the pathogenesis of Sickle Cell Disease: a meta-analysis of gene expression studies. Sci Rep. 2015;5:17822. https://doi.org/10.1038/srep17822.
15. Gould T.J., Vu T.T., Swystun L.L. et al. Neutrophil extracellular traps promote thrombin generation through platelet-dependent and plateletindependent mechanisms. Arterioscler Thromb Vasc Biol. 2014;34(9):1977–84. https://doi.org/10.1161/ATVBAHA.114.304114.
16. Fuchs T.A., Bhandari A.A., Wagner D.D. Histones induce rapid and profound thrombocytopenia in mice. Blood. 2011;118(13):3708–14. https://doi.org/10.1182/blood-2011-01-332676.
17. Massberg S., Grahl L., von Bruehl M.-L. et al. Reciprocal coupling of coagulation and innate immunity via neutrophil serine proteases. Nat Med. 2010;16(8):887–96. https://doi.org/10.1038/nm.2184.
18. Frangou E., Vassilopoulos D., Boletis J., Boumpas D.T. An emerging role of neutrophils and NETosis in chronic inflammation and fibrosis in systemic lupus erythematosus (SLE) and ANCA-associated vasculitides (AAV): Implications for the pathogenesis and treatment. Autoimmun Rev. 2019;18(8):751–60. https://doi.org/10.1016/j.autrev.2019.06.011.
19. Denning N.-.L, Aziz M., Gurien S.D., Wang P. DAMPs and NETs in sepsis. Front Immunol. 2019;10:2536. https://doi.org/10.3389/fimmu.2019.02536.
20. Doring Y., Soehnlein O., Weber C. Neutrophil extracellular traps in atherosclerosis and atherothrombosis. Circ Res. 2017;120(4):736–43. https://doi.org/10.1161/CIRCRESAHA.116.309692.
21. Grover S.P., Nigel M. Tissue factor: an essential mediator of hemostasis and trigger of thrombosis. Arterioscler Thromb Vasc Biol. 2018;38(7):709–25. https://doi.org/10.1161/ATVBAHA.117.309846.
22. Darbousset R., Thomas G.M., Mezouar S. et al. Tissue factor-positive neutrophils bind to injured endothelial wall and initiate thrombus formation. Blood. 2012;120(10):2133–43. https://doi.org/10.1182/blood-2012-06-437772.
23. Jewkes R., Sikweyiya Y., Morrell R., Dunkle K. Gender inequitable masculinity and sexual entitlement in rape perpetration South Africa: findings of a cross-sectional study. PloS One. 2011;6(12):e29590. https://doi.org/10.1371/journal.pone.0029590.
24. Zhou J., Qu F., Sang X. et al. Acupuncture and auricular acupressure in relieving menopausal hot flashes of bilaterally ovariectomized chinese women: a randomized controlled trial. Evid Based Complement Alternat Med. 2011;2011:713274. https://doi.org/10.1093/ecam/nep001.
25. Skendros P., Mitsios A., Chrysanthopoulou A. et al. Complement and tissue factor-enriched neutrophil extracellular traps are key drivers in COVID-19 immunothrombosis. J Clin Invest. 2020;130(11):6151–7. https://doi.org/10.1172/JCI141374.
26. Frangou E., Chrysanthopoulou A., Kambas K. et al. FP098REDD1/autophagy pathway promotes thromboinflammation and fibrosis in human systemic lupus erythematosus (SLE) by the release of neutrophil extracellular traps (NETs). Nephrol Dial Transplant. 2018;33(suppl_1):i80–i80. https://doi.org10.1093/ndt/gfy104.FP098.
27. Lisman T. Platelet-neutrophil interactions as drivers of inflammatory and thrombotic disease. Cell Tissue Res. 2018;371(3):567–76. https://doi.org/10.1007/s00441-017-2727-4.
28. Carestia A., Kaufman T., Rivadeneyra L. et al. Mediators and molecular pathways involved in the regulation of neutrophil extracellular trap formation mediated by activated platelets. J Leukoc Biol. 2016;99(1):153–62. https://doi.org/10.1189/jlb.3A0415-161R.
29. Maugeri N., Campana L., Gavina M. et al. Activated platelets present high mobility group box 1 to neutrophils, inducing autophagy and promoting the extrusion of neutrophil extracellular traps. J Thromb Haemost. 2014;12(12):2074–88. https://doi.org/10.1111/jth.12710.
30. Gol S., Pena R.N., Rothschild M.F. et al. A polymorphism in the fatty acid desaturase-2 gene is associated with the arachidonic acid metabolism in pigs. Sci Rep. 2018;8(1):14336. https://doi.org/10.1038/s41598-018-32710-w.
31. Semeraro F., Ammollo C.T., Morrissey J.H. et al. Extracellular histones promote thrombin generation through platelet-dependent mechanisms: involvement of platelet TLR2 and TLR4. Blood. 2011;118(7):1952–61. https://doi.org/10.1182/blood-2011-03-343061.
32. Zhou Y.-F., Eng E.T., Zhu J. et al. Sequence and structure relationships within von Willebrand factor. Blood. 2012;120(2):449–58. https://doi.org/10.1182/blood-2012-01-405134.
33. Löf A., Müller J.P., Brehm M.A. A biophysical view on von Willebrand factor activation. J Cell Physiol. 2018;233(2):799–810. https://doi.org/10.1002/jcp.25887.
34. Pendu R., Terraube V., Christophe O.D. et al. P-selectin glycoprotein ligand 1 and β2-integrins cooperate in the adhesion of leukocytes to von Willebrand factor. Blood. 2006;108(12):3746–52. https://doi.org/10.1182/blood-2006-03-010322.
35. Fuchs T.A., Brill A., Duerschmied D. et al. Extracellular DNA traps promote thrombosis. Proc Natl Acad Sci U S A. 2010;107(36):15880–5. https://doi.org/10.1073/pnas.1005743107.
36. Lancellotti S., Basso M., De Cristofaro R. Proteolytic processing of von Willebrand factor by adamts13 and leukocyte proteases. Mediterr J Hematol Infect Dis. 2013;5(1):e2013058. https://doi.org/10.4084/MJHID.2013.058.
37. Weber C., Jenke A., Chobanova V., et al. Targeting of cell-free DNA by DNase I diminishes endothelial dysfunction and inflammation in a rat model of cardiopulmonary bypass. Sci Rep. 2019;9(1):19249. https://doi.org/10.1038/s41598-019-55863-8.
38. South K., Lane D.A. ADAMTS-13 and von Willebrand factor: a dynamic duo. J Thromb Haemost. 2018;16(1):6–18. https://doi.org/10.1111/jth.13898.
39. Scully M., Cataland S.R., Peyvandi F. et al. Caplacizumab treatment for acquired thrombotic thrombocytopenic purpura. N Engl J Med. 2019;380(4):335–46. https://doi.org/10.1056/NEJMoa1806311.
40. Soejima K., Mimura N., Hiroshima M. et al. A novel human metalloprotease synthesized in the liver and secreted into the blood: possibly, the von Willebrand factor-cleaving protease? J Biochem. 2001;130(4):475–80. https://doi.org/10.1093/oxfordjournals.jbchem.a003009.
41. Dong J.-f. Structural and functional correlation of ADAMTS13. Curr Opin Hematol. 2007;14(3):270–6. https://doi.org/10.1097/MOH.0b013e3280d35820.
42. Tao Z., Wang Y., Choi H. et al. Cleavage of ultralarge multimers of von Willebrand factor by C-terminal-truncated mutants of ADAMTS-13 under flow. Blood. 2005;106(1):141–3. https://doi.org/10.1182/blood-2004-11-4188.
43. Huang R.-H., Fremont D.H., Diener J.L. et al. A structural explanation for the antithrombotic activity of ARC1172, a DNA aptamer that binds von Willebrand factor domain A1. Structure. 2009;17(11):1476–84. https://doi.org/10.1016/j.str.2009.09.011.
44. Grässle S., Huck V., Pappelbaum K.I. et al. von Willebrand factor directly interacts with DNA from neutrophil extracellular traps. Arterioscler Thromb Vasc Biol. 2014;34(7):1382–9. https://doi.org/10.1161/ATVBAHA.113.303016.
45. Edwards J.V., Howley P.S. Human neutrophil elastase and collagenase sequestration with phosphorylated cotton wound dressings. J Biomed Mater Res A. 2007;83(2):446–54. https://doi.org/10.1002/jbm.a.31171.
46. Urisono Y., Sakata A., Matsui H. et al. Von Willebrand factor aggravates hepatic ischemia-reperfusion injury by promoting neutrophil recruitment in mice. Thromb Haemost. 2018;118(4):700–8. https://doi.org/10.1055/s-0038-1636529.
47. Gragnano F., Sperlongano S., Golia E. et al. The role of von Willebrand factor in vascular inflammation: from pathogenesis to targeted therapy. Mediators Inflamm. 2017;2017:5620314. https://doi.org/10.1155/2017/5620314.
48. Honda M., Kubes P. Neutrophils and neutrophil extracellular traps in the liver and gastrointestinal system. Nat Rev Gastroenterol Hepatol. 2018;15(4):206–21. https://doi.org/10.1038/nrgastro.2017.183.
49. Farkas P., Csuka D., Mikes B. et al. Complement activation, inflammation and relative ADAMTS13 deficiency in secondary thrombotic microangiopathies. Immunobiology. 2017;222(2):119–27. https://doi.org/10.1016/j.imbio.2016.10.014.
50. Richardson P. Phase II trial of single agent bortezomib (VELCADE^(! R)) in patients with previously untreated multiple myeloma. Blood. 2004;104:100a.
51. Ono T., Mimuro J., Madoiwa S. et al. Severe secondary deficiency of von Willebrand factor–cleaving protease (ADAMTS13) in patients with sepsisinduced disseminated intravascular coagulation: its correlation with development of renal failure. Blood. 2006;107(2):528–34. https://doi.org/10.1182/blood-2005-03-1087.
52. Crawley J.T., Lam J.K., Rance J.B. et al. Proteolytic inactivation of ADAMTS13 by thrombin and plasmin. Blood. 2005;105(3):1085–93. https://doi.org/10.1182/blood-2004-03-1101.
53. Klebanoff S.J. Myeloperoxidase: friend and foe. J Leukoc Biol. 2005;77950:598–625. https://doi.org/10.1189/jlb.1204697.
54. Chen J., Fu X., Wang Y. et al. Oxidative modification of von Willebrand factor by neutrophil oxidants inhibits its cleavage by ADAMTS13. Blood. 2010;115(3):706–12. https://doi.org/10.1182/blood-2009-03-213967.
55. Nishimura K., Sano M., Ohtaka M. et al. Development of defective and persistent Sendai virus vector: a unique gene delivery/expression system ideal for cell reprogramming. J Biol Chem. 2011;286(6):4760–71. https://doi.org/10.1074/jbc.M110.183780.
56. Pillai V.G., Bao J., Zander C.B. et al. Human neutrophil peptides inhibit cleavage of von Willebrand factor by ADAMTS13: a potential link of inflammation to TTP. Blood. 2016;128(1):110–9. https://doi.org/10.1182/blood-2015-12-688747.
57. Quinn K., Henriques M., Parker T. et al. Human neutrophil peptides: a novel potential mediator of inflammatory cardiovascular diseases. Am J Physiol Heart Circ Physiol. 2008;295(5):H1817–24. https://doi.org/10.1152/ajpheart.00472.2008.
58. Higazi A.A., Ganz T., Kariko K., Cines D.B. Defensin modulates tissue-type plasminogen activator and plasminogen binding to fibrin and endothelial cells. J Biol Chem. 1996;271(30):17650–5. https://doi.org/10.1074/jbc.271.30.17650.
59. Wong S.L., Wagner D.D. Peptidylarginine deiminase 4: a nuclear button triggering neutrophil extracellular traps in inflammatory diseases and aging. FASEB J. 2018;32(12):fj201800691R. https://doi.org/10.1096/fj.201800691R. Online ahead of print.
60. Sorvillo N., Mizurini D.M., Coxon C. et al. Plasma peptidylarginine deiminase IV promotes VWF-platelet string formation and accelerates thrombosis after vessel injury. Circ Res. 2019;125(5):507–19. https://doi.org/10.1161/CIRCRESAHA.118.314571.
61. Buchtele N., Schwameis M., Gilbert J.C. et al. Targeting von Willebrand factor in ischaemic stroke: focus on clinical evidence. Thromb Haemost. 2018;118(6):959–78. https://doi.org/10.1055/s-0038-1648251.
62. Laridan E., Denorme F., Desender L. et al. Neutrophil extracellular traps in ischemic stroke thrombi. Ann Neurol. 2017;82(2):223–32. https://doi.org/10.1002/ana.24993.
63. Pena-Martinez C., Duran-Laforet V., Garcia-Culebras A. et al. Pharmacological modulation of neutrophil extracellular traps reverses thrombotic stroke tPA (tissue-type plasminogen activator) resistance. Stroke. 2019;50(11):3228–37. https://doi.org/10.1161/STROKEAHA.119.026848.
64. Novotny J., Oberdieck P., Titova A. et al. Thrombus NET content is associated with clinical outcome in stroke and myocardial infarction. Neurology. 2020;94(22):e2346–e2360. https://doi.org/10.1212/WNL.0000000000009532.
65. Hada M., Kaminski M., Bockenstedt P., McDonagh J. Covalent crosslinking of von Willebrand factor to fibrin. Blood. 1986;68(1):95–101.
66. Miszta A., Pelkmans L., Lindhout T. et al. Thrombin-dependent incorporation of von Willebrand factor into a fibrin network. J Biol Chem. 2014;289(52):35979–86. https://doi.org/10.1074/jbc.M114.591677.
67. Denorme F., Langhauser F., Desender L. et al. ADAMTS13-mediated thrombolysis of t-PA-resistant occlusions in ischemic stroke in mice. Blood. 2016;127(19):2337–45. https://doi.org/10.1182/blood-2015-08-662650.
Об авторах
Е. В. СлуханчукРоссия
Слуханчук Екатерина Викторовна – к.м.н., доцент кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
В. О. Бицадзе
Россия
Бицадзе Виктория Омаровна – д.м.н., профессор РАН, профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 6506003478
Researcher ID: F-8409-2017.
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
А. Г. Солопова
Россия
Солопова Антонина Григорьевна – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 6505479504
Researcher ID: Q-1385-2015.
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Д. Х. Хизроева
Россия
Хизроева Джамиля Хизриевна – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 57194547147
Researcher ID: F-8384-2017.
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
В. И. Цибизова
Россия
Цибизова Валентина Ивановна – к.м.н., врач акушер-гинеколог НИЛ оперативной гинекологии Института перинатологии и педиатрии, врач отделения функциональной ультразвуковой диагностики
197341 Санкт-Петербург, ул. Аккуратова, д. 2
Ж.-К. Гри
Россия
Гри Жан-Кристоф – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова; профессор гематологии, зав. лабораторией гематологии факультета биологических и фармацевтических наук; иностранный член РАН
Scopus Author ID: 7005114260
Researcher ID: AAA-2923-2019.
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
И. Элалами
Россия
Элалами Исмаил – д.м.н., профессор кафедры акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова; профессор медицинского; профессор; директор гематологии Центра Тромбозов
Scopus Author ID: 7003652413
Researcher ID: AAC-9695-2019.
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Д. В. Щербаков
Россия
Щербаков Денис Викторович – к.м.н., доцент кафедры общей гигиены института общественного здоровья имени Ф.Ф. Эрисмана
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Л. Л. Панкратьева
Россия
Панкратьева Людмила Леонидовна – д.м.н., руководитель научно-клинического центра; врач-неонатолог, врач-гематолог, доцент, профессор кафедры педиатрии и организации здравоохранения
Scopus Author ID: 7006391091
Author ID: 697284.
123423 Москва, ул. Саляма Адиля, д. 2/44;
117997 Москва, ул. Саморы Машела, д. 1
Л. А. Ашрафян
Россия
Ашрафян Левон Андреевич – д.м.н., профессор, академик РАН, заслуженный врач РФ, директор Института онкогинекологии и маммологии, зам. директора
Scopus Author ID: 57194173388
117997 Москва, ул. академика Опарина, д. 4
А. Д. Макацария
Россия
Макацария Александр Давидович – д.м.н., профессор, академик РАН, зав. кафедрой акушерства, гинекологии и перинатальной медицины Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 57222220144
Researcher ID: M-5660-2016.
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Рецензия
Для цитирования:
Слуханчук Е.В., Бицадзе В.О., Солопова А.Г., Хизроева Д.Х., Цибизова В.И., Гри Ж., Элалами И., Щербаков Д.В., Панкратьева Л.Л., Ашрафян Л.А., Макацария А.Д. Иммунотромбоз у онкологических больных: вклад внеклеточных ловушек нейтрофилов, ADAMTS-13 и фактора фон Виллебранда. Акушерство, Гинекология и Репродукция. 2022;16(6):648-663. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.364
For citation:
Slukhanchuk E.V., Bitsadze V.O., Solopova A.G., Khizroeva J.Kh., Tsibizova V.I., Gris J., Elalamy I., Shcherbakov D.V., Pankratyeva L.L., Ashrafyan L.A., Makatsariya A.D. Immunothrombosis in cancer patients: contribution of neutrophil extracellular traps, ADAMTS-13 and von Willebrand factor. Obstetrics, Gynecology and Reproduction. 2022;16(6):648-663. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.364

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































