Перейти к:
Тромбовоспаление у онкологических больных
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.355
Аннотация
Исследования патогенеза тромбоза и воспаления и их вклад в прогрессию опухоли и метастазирование у онкологических больных, начатые много десятилетий назад, продолжаются и в наши дни. При этом тромбообразование и воспаление неразрывно связаны друг с другом. Одно из центральных мест в тромбовоспалении занимает потеря нормальной антитромботической и противовоспалительной функций клетками эндотелия, что приводит к нарушению регуляции коагуляции, дисбалансу в системе комплемента, активации тромбоцитов и рекрутированию лейкоцитов в микроциркуляторном русле. Опухолевые клетки сами влияют на систему гемостаза путем высвобождения прокоагулянтных субстанций, активации фибринолиза, протеолиза, повышая активацию и агрегацию тромбоцитов, выделяя молекулы адгезии, секретируя провоспалительные и проангиогенные цитокины. Современные исследования направлены на углубление понимания патогенеза тромбовоспаления в онкологии с особым акцентом на роль тромбоцитов, а также ряда новых участников процесса. Основное внимание уделяется изучению молекулярных механизмов, регулирующих тромбовоспаление при раке, обеспечивая понимание механизмов как воспаления, так и тромбоза как составных частей патогенеза у онкологических больных. Все это даст возможность для создания новых, современных стратегий терапии онкологических больных.
Для цитирования:
Слуханчук Е.В., Бицадзе В.О., Солопова А.Г., Хизроева Д.Х., Гри Ж., Элалами И., Панкратьева Л.Л., Цибизова В.И., Унгиадзе Д.Ю., Ашрафян Л.А., Макацария А.Д. Тромбовоспаление у онкологических больных. Акушерство, Гинекология и Репродукция. 2022;16(5):611-622. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.355
For citation:
Slukhanchuk E.V., Bitsadze V.O., Solopova A.G., Khizroeva J.Kh., Gris J., Elalamy I., Pankratyeva L.L., Tsibizova V.I., Ungiadze J.Yu., Ashrafyan L.A., Makatsariya A.D. Thromboinflammation in oncogynecological patients. Obstetrics, Gynecology and Reproduction. 2022;16(5):611-622. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.355
Введение / Introduction
О том, что тромбоз осложняет течение онкологического процесса, всем известно давно. Взаимосвязь рака и тромбоза имеет двойную направленность [1], так как активация свертывания при раке способствует прогрессии опухоли (рис. 1). Тромбоз может стать первым симптомом онкологического процесса. К сожалению, диагностический поиск, который стартует сразу после тромбоза, если конечно стартует, не всегда повышает выживаемость, так как к этому моменту опухоли обычно уже метастазировали [2]. Первым, кто выявил связь между раком и тромбозом, был Арман Труссо. Под «феноменом Труссо» понимают появление тромбофлебитов на фоне злокачественных новообразований. Он же сообщил и о взаимосвязи между идиопатическим венозным тромбозом и скрытым раком [3].
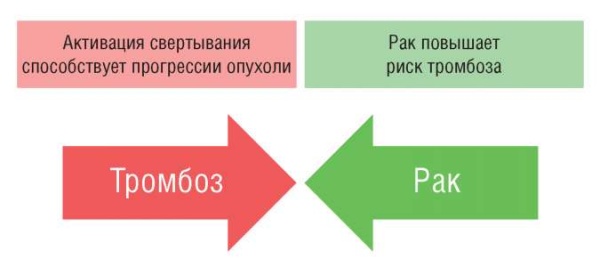
Рисунок 1. Взаимосвязь тромбоза и рака [рисунок авторов].
Figure 1. A relationship between thrombosis and cancer [drawn by authors].
В своем исследовании один из ученых-лидеров в этом направлении Джихан Ай выявил «правило 1/5» [4]. Он показал, что каждый пятый случай тромбоза связан с онкологическим процессом, при этом у одного из пяти онкологических пациентов отмечаются тромботические осложнения. Помимо венозных тромбозов и тромбоэмболий, о которых чаще всего идет речь, у онкологических больных отмечаются и другие тромботические осложнения, такие как артериальные тромбозы, эндокардиты, диссеминированное внутрисосудистое свертывание (ДВС) и мигрирующий поверхностный тромбофлебит (синдром Труссо) [4].
Факторы риска тромбоза у онкологических больных / Thrombosis risk factors in cancer patients
Среди факторов риска тромбоза следует выделить неизменные факторы – пациент-ассоциированные факторы риска, такие как, например, наследственная тромбофилия [5]. Однако, у одного и того же онкологического пациента тромботический риск меняется в процессе развития заболевания в связи с изменением внешних и внутренних факторов, а именно: стадия заболевания, хирургическое вмешательство, продолжительность и вид анестезии, химиотерапия, гормональная терапия, возраст, наличие центральных венозных катетеров, иммобилизация, инфекции, как в случае с прошедшей пандемией COVID-19, когда риски тромботических осложнений у онкологических пациентов выросли в разы [4]. Рак увеличивает риск тромбоза в 4–7 раз, а при ряде опухолей – в 28 раз, все зависит от конкретного органа. Так, при опухолях яичников, мозга, поджелудочной железы и желудка риск тромбоза выше, чем при опухолях молочной железы, головы и шеи, пищевода и предстательной железы. Высокий риск тромбозов имеют онкогематологические пациенты с лимфомами и лейкозами [6]. На тромботический риск влияет распространенность опухоли и гистологический тип, например, плоскоклеточная карцинома легкого менее тромбогенна, чем аденокарцинома легкого. При наличии метастазов риск тромбоза выше, чем при отграниченной опухоли. Метастазирование опухолей и их прогрессия повышают исходный риск тромбозов в 4–12 раз [7].
Важным является раздел факторов риска, связанных с проводимой терапией. Особое значение в увеличении риска тромбоза занимает химиотерапия [8]. В крупном ретроспективном исследовании, проведенном американскими учеными с участием онкологических пациентов различных нозологий на фоне проводимой химиотерапии, было показано, что риск тромботических осложнений прогрессивно нарастает. Особенно высокий риск отмечен при опухолях поджелудочной железы, желудка и легких. Плато или снижение риска отсутствовали в период наблюдения в течение 12 мес [9].
Патогенез рак-ассоциированного тромбоза / Pathogenesis of cancer-associated thrombosis
В патогенезе рак-ассоциированного тромбоза выделяют 3 группы участников: факторы внешней среды, опухоль-ассоциированные и пациент-ассоциированные факторы [7] (рис. 2). Известно, что опухолевая клетка может нарушать баланс в системе гемостаза путем выработки прокоагулянтных субстанций благодаря профибринолитической, пропротеолитической и проагрегантной активности, экспрессируя молекулы адгезии, секретируя провоспалительные и проангиогенные цитокины [10]. Также в настоящее время выявлены новые участники процесса [11] (рис. 3).
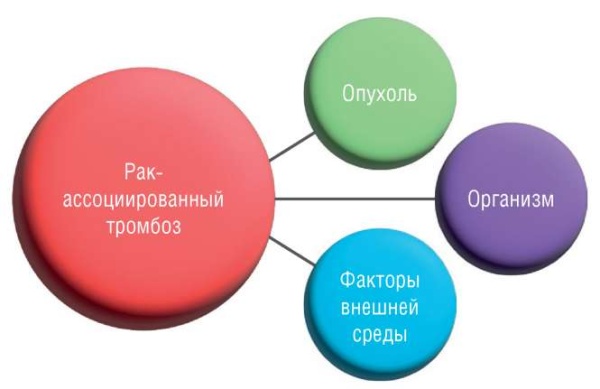
Рисунок 2. Участники патогенеза рак-ассоциированного тромбоза [рисунок авторов].
Figure 2. Players of сancer-associated thrombosis pathogenesis [drawn by authors].
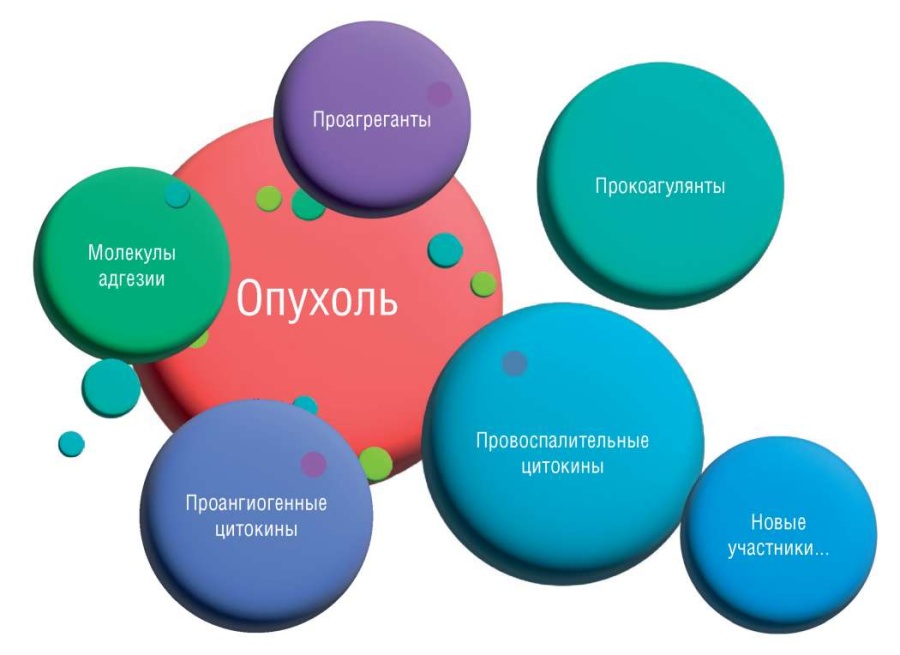
Рисунок 3. Опухоль-ассоциированные факторы патогенеза рак-ассоциированного тромбоза [рисунок авторов].
Figure 3. Tumor-associated factors in the pathogenesis of cancer-associated thrombosis [drawn by authors].
Опухолевая клетка экспрессирует прокоагулянт – цистеиновую протеазу, которая непосредственно активирует фактор X независимо от фактора VII и активирует тромбоциты. Некоторые опухолевые клетки активируют фактор X благодаря фрагментам сиаловой кислоты муцина, продуцируемого аденокарциномами [12].
Тканевой фактор (англ. tissue factor, TF) – трансмембранный гликопротеин субэндотелиального слоя клеток сосудов, который в норме не контактирует с кровью. Контакт возможет в случае повреждения сосуда либо стимуляции высвобождения TF триггерами воспаления [13]. Опухолевые клетки, например, клетки панкреатической аденокарциномы и опухолей яичников, клетки микроокружения опухоли, моноциты способны самостоятельно экспрессировать TF, также им богаты микрочастицы [14]. Механизм действия TF заключается в активации факторов X и IX с последующим образованием тромбина и в конечном итоге фибринового тромба. Помимо протромбогенного эффекта, с TF связывают процессы ангиогенеза, метастазирования и прогрессии опухоли [5]. В исследованиях была продемонстрирована зависимость между количеством определяемого в опухоли TF и степенью ее дифференцировки; в низкодифференцированных опухолях TF оказалось больше [14].
В плазме крови онкологических больных значительно повышено количество биомаркеров генерации тромбина, таких как D-димер и фрагменты протромбина 1+2, концентрация факторов свертывания V, VIII, IX и XI, причем на фоне дефицита естественных антикоагулянтов – антитромбина III, протеина С, протеина S. Опухолевые клетки выделяют как активаторы плазминогена урокиназного (англ. urokinase plasminogen activator, uPA) и тканевого (англ. tissue plasminogen activator, tPA) типов, так и ингибитор активатора плазминогена-1 (англ. plasminogen activator inhibitor-1, PAI-1) [15].
PAI-1 представляет собой основной ингибитор фибринолиза. Его повышение в крови снижает фибринолитическую активность, повышая риск тромбоза. Проведенные исследования продемонстрировали повышенную экспрессию PAI-1 опухолевыми клетками поджелудочной железы на фоне протромботического статуса пациентов. Также было показано, что при проведении курсов химиотерапии бевацизумабом повышается концентрация PAI-1, а повышенный риск тромбоза при этом нивелируется с использованием ингибиторов PAI-1 [16].
Опухоль выделяет провоспалительные цитокины, такие как фактор некроза опухоли-альфа (англ. tumor necrosis factor-alpha, TNF-α), интерлейкин-1 (англ. interleukin-1, IL-1), фактор роста эндотелия сосудов (англ. vascular endothelial growth factor, VEGF), гранулоцитарно-макрофагальный колониестимулирующий фактор (англ. granulocyte-macrophage colonystimulating factor, GM-CSF). Взаимодействуя с другими клетками, опухоль стимулирует выработку провоспалительных цитокинов клетками эндотелия и лейкоцитами. Провоспалительные цитокины стимулируют выработку PAI-1, способствуют экспрессии эндотелием и моноцитами тканевого фактора и снижают выработку тромбомодулина – естественного антикоагулянта клетками эндотелия. Они повреждают клетки эндотелия и формируют протромботическую основу на поверхности сосуда [12].
Опухолевая клетка путем взаимодействия с клетками иммунной системы, макрофагами и моноцитами также оказывает влияние на систему гемостаза. Лейкоцитоз крайне характерен для онкологических пациентов. Степень лейкоцитоза отражает прогноз заболевания [17] и риск присоединения тромбоза [18]. При раке лейкоциты представлены в плазме крови в большом количестве, преимущественно зрелыми нейтрофилами.
Опухолевые клетки способствуют тромбоцитозу и запускают агрегацию тромбоцитов. Они выделяют тромбопоэтин – цитокин, стимулирующий дифференцировку и пролиферацию мегакариоцитов и продукцию тромбоцитов. Опухолевые клетки могут напрямую активировать тромбоциты и усиливать тромбообразование с участием подопланина (англ. podoplanin, PDPN). Повышенная экспрессия его опухолевыми клетками сопряжена с высоким риском тромбоза. Лектиноподобный рецептор-2 С-типа тромбоцитов (англ. C-type lectin-like receptor-2, CLEC-2), взаимодействуя с опухолевым подопланином, усиливает протромботическое состояние и повышает риск метастазирования [19]. Опухолевые клетки также могут вызывать непрямую активацию тромбоцитов путем усиления высвобождения белков внеклеточного матрикса и TF из эндотелиальных клеток, создавая активную поверхность для адгезии тромбоцитов и последующего тромбообразования. Gas6 – витамин К-зависимый лиганд рецептора семейства тирозинкиназ, присутствует как в опухолевых клетках, так и в клетках эндотелия. Gas6 усиливает секрецию простагландина Е2 эндотелием, что приводит к активации тромбоцитов и тромбозу.
Активированные тромбоциты высвобождают в своих α-гранулах проангиогенные факторы, такие как VEGF, эпидермальный фактор роста (англ. epidermal growth factor, EGF), фактор роста фибробластов (англ. fibroblast growth factor, FGF), трансформирующий фактор роста-бета (англ. transforming growth factorbeta, TGF-β), инсулиноподобный фактор роста-1 (англ. insulin-like growth factor-1, IGF-1); микрочастицы тромбоцитов (англ. platelet microparticles, PMPs), на поверхности своей мембраны содержат несколько рецепторов и белки, включая Р-селектин и интегрины, внутри содержат факторы роста, цитокины и провоспалительные молекулы [20]. PMPs также способствуют хемотаксису различных гемопоэтических клеток. Тромбоциты – первые клетки, которые встречают опухолевые клетки в кровотоке; они облегчают метастазирование различными сложными путями [21].
Ранее известные только как участники системы гемостаза – тромбоциты выступают сейчас в ином качестве благодаря тому, что последние годы в результате исследований их поместили в один ряд с важнейшими игроками иммунного ответа [22]. Тромбоциты являются важными участниками противоинфекционного иммунитета, участвуют в патогенезе аутоиммунных и хронических воспалительных заболеваний [23]. Тромбоцитопения, развивающаяся у пациентов с онкологическими заболеваниями, обусловлена не только наличием у них хронического ДВС-синдрома, но и активно происходящими реакциями иммунотромбоза. Термин «иммунотромбоз» впервые предложен В. Engelmann и S. Massberg для обозначения внутреннего эффекторного пути врожденного иммунитета, запускаемого патогенами и поврежденными клетками, результатом которого является уменьшение интенсивности распространения и выживания вторгающихся новых патогенов [24]. Интерес, проявляемый к тромбоцитам, связан еще и с тем, что они могут явиться новой мишенью для разработки противовоспалительной терапии с многообещающими результатами.
Микрочастицы, выделяемые опухолью, представляют собой небольшие мембранные везикулы опухолевых клеток [23]. Прокоагулянтная активность микрочастиц связана с тем, что на их поверхности расположен активный TF и фосфатидилсерин, который предоставляет отрицательно заряженную поверхность для протекания каскада реакций гемостаза [25]. Источниками микрочастиц могут быть и активированные клетки эндотелия, а также моноциты при раке [26]. Воспалительные цитокины, экспрессируемые опухолевыми клетками, приводят к активации клеток эндотелия и моноцитов, стимулируя синтез микрочастиц, содержащих TF [23].
Подопланин представляет собой трансмембранный гликопротеин муцинового типа, который активирует тромбоциты через рецепторы CLEC-2 [27]. Подопланин принимает участие в различных стадиях метастатического каскада: в выходе клеток опухоли через базальную мембрану, в проникновении в соединительную ткань, эпителиально-мезенхимальном переходе и попадании в кровоток путем деградации базальной мембраны кровеносного сосуда [22] (рис. 4).

Рисунок 4. Подопланин и тромбоциты [рисунок авторов].
Примечание: CLEC-2 – лектиноподобный рецептор-2 С-типа тромбоцитов.
Figure 4. Podoplanin and platelets [drawn by authors].
Note: CLEC-2 – C-type lectin-like receptor-2.
Злокачественные клетки подавляют атаки иммунных клеток путем активации и агрегации тромбоцитов с участием подопланина [28]. Агрегация тромбоцитов способствует адгезии опухолевых клеток и образованию эмболов в микроциркуляторном русле с дальнейшей экстравазацией из кровеносного сосуда [29][30].
Связь между экспрессией подопланина и количеством внутриопухолевых внутрисосудистых агрегатов тромбоцитов была доказана в исследовании подопланина при первичных опухолях мозга; экспрессия подопланина была связана со значительно повышенным риском тромбоза у этих пациентов [31]. В другом исследовании снижение количества CLEC-2 рецепторов на поверхности тромбоцитов приводило к снижению тромбообразования, эффект нивелировался введением неизмененных тромбоцитов, при этом концентрация подопланина в сосудистой стенке коррелировала с выраженностью тромбоза [32].
Опухолевые клетки, тромбоциты, цитокины, хемокины и другие агенты взаимодействуют с лейкоцитами и приводят к формированию внеклеточных ловушек нейтрофилов (англ. neutrophil extracellular traps, NETs) [33]. Ловушки являются производными активированных нейтрофилов и состоят из нитей ДНК, гистонов, антимикробных протеинов, которые способны захватывать и удерживать различные патогены до их полного уничтожения [34]. Процесс формирования NETs называется нетоз. Нейтрофилы синтезируют NETs либо в результате выброса ядра целиком (суицидальный нетоз) или части ядра без нарушения целостности клеточной мембраны (витальный нетоз). Вид нетоза зависит от стимулирующего агента. Суицидальный нетоз требует несколько часов для продукции NETs, в то время как витальный нетоз занимает меньше времени. При суицидальном нетозе происходит деконденсация хроматина, растворение ядерной оболочки и выброс содержимого клетки через разрыв клеточной мембраны; витальный нетоз не приводит к разрушению нейтрофила [35]. Выделяемые в составе NETs структуры представлены нитями ДНК, сплетенными в сети с 24 видами протеаз и такими гистонами, как пептидил-аргинин деиминаза 4 (англ. peptidyl arginine deiminase 4, PAD4), эластаза нейтрофилов (англ. neutrophil elastase, NE), миелопероксидаза (англ. myeloperoxidase, MPO) и катепсин G [36]. Опухолевые клетки меняют работу нейтрофилов и способствуют выработке ими NETs, которые в свою очередь окутывают опухолевые клетки, делая их недостижимыми для Т-клеток и NK-клеток (естественные киллеры; англ. natural killer cells) [37].
Хемокины, секретируемые опухолевыми клетками, являются одним из факторов, стимулирующих нетоз [38]. Модель была продемонстрирована в одном из исследований на примере хемокиновых рецепторов CXCR1 (англ. С-Х-С Motif Chemokine Receptor-1) и CXCR2 (англ. С-Х-С Motif Chemokine Receptor-2) [37].
Агонисты CXCR1 и CXCR2 оказались основными медиаторами нетоза, вызванного раком. Сети покрывают опухолевые клетки и защищают их от цитотоксичности иммунных клеток [39]. Опухолевые клетки, защищенные от цитотоксичности с помощью NETs, успешно метастазируют. При использовании ингибиторов PAD4, снижающего интенсивность нетоза, интенсивность метастазирования падала.
NETs влияют на гемостаз различными путями (рис. 5). Гистоны, входящие в состав NETs, активируют клетки эндотелия, приводят к высвобождению фактора фон Виллебранда (англ. von Willebrand factor, vWF), запускают выброс тромбоцитами неорганических полифосфатов, экспозицию мембраносвязанного фосфатидилсерина, вызывают активацию фактора V, тем самым увеличивая активность протромбиназного комплекса, вмешиваются в тромбомодулинопосредованную активацию протеина С [40]. Наибольшим прокоагулянтым эффектом обладают гистоны Н3 и Н4. NETs и сами по себе являются основой для непосредственной агрегации и активации тромбоцитов. Попадая в участок повреждения, NETs привлекают с собой ряд белков, а также факторы свертывания, участвующие в тромбообразовании, такие как vWF, фактор XII, фибриноген и фибронектин [41]. Массивная активация нейтрофилов в процессе цитокинового шторма с выбросом большого количества NETs и неуправляемым течением процессов тромбовоспаления лежат в основе развития эндотелиопатии при COVID-19 [38].
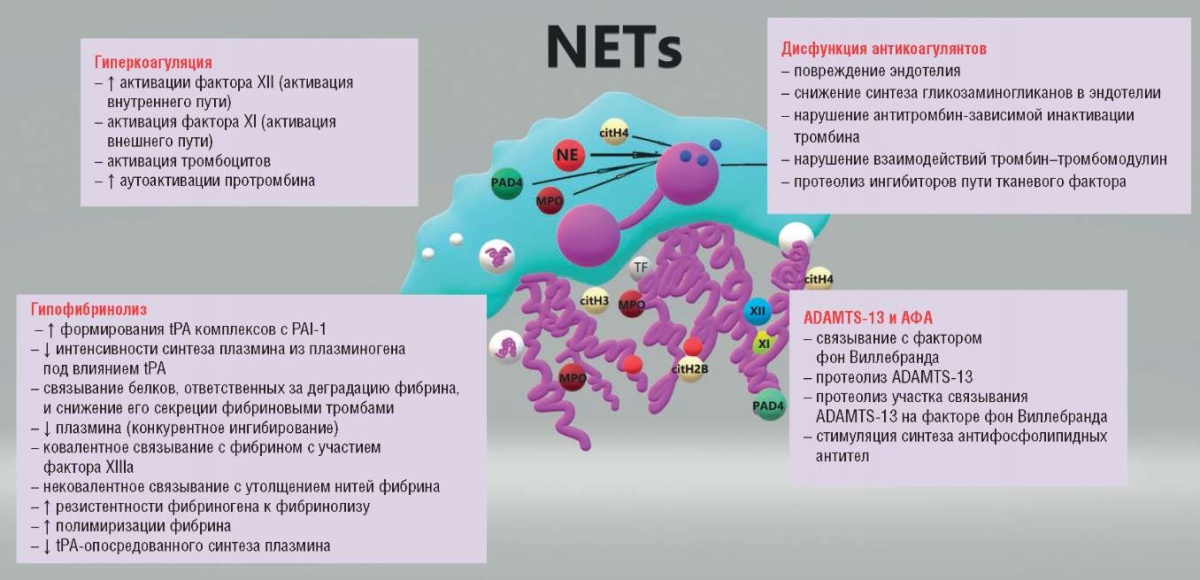
Рисунок 5. Многокомпонентное влияние NETs на гемостаз [рисунок авторов].
Примечание: NETs – внеклеточные ловушки нейтрофилов; tPA – тканевой активатор плазминогена; PAI-1 – ингибитор активатора плазминогена-1; PAD4 – пептидил-аргинин деиминаза 4; NE – эластаза нейтрофилов; MPO – миелопероксидаза; citH4 – цитрулированный гистон Н4; citH2B – цитрулированный гистон Н2В; ADAMTS-13 – дизинтегрин-подобная металлопротеаза с мотивом тромбоспондина 1; АФА – антифосфолипидные антитела; TF – тканевой фактор.
Figure 5. NETs multicomponent influence on hemostasis [drawn by authors].
Note: NETs – neutrophil extracellular traps; tPA – tissue plasminogen activator; PAI-1 – plasminogen activator inhibitor-1; PAD4 – peptidyl arginine deiminase 4; NE – neutrophil elastase; MPO – myeloperoxidase; citH4 – citrullinated histone H4; citH2B – citrullinated histone H2B; ADAMTS-13 – a disintegrin and metalloprotease with thrombospondin type 1 motif; АРА – antiphospholipid antibodies; TF – tissue factor.
Как показали исследования, повышенная активность нейтрофилов с увеличением количества NETs в плаценте связана с тяжелыми осложнениями беременности, такими как преэклампсия (ПЭ), привычное невынашивание и неблагоприятный исход беременности из-за развития аутоиммунных состояний [42][43]. Беременность происходит на фоне провоспалительного статуса, который характеризуется повышенной активацией нейтрофилов, что более выраженно у пациенток с ПЭ [44]. Было продемонстрировано, что активация нейтрофилов через каскад комплемента способствует развитию ПЭ-подобных состояний или состояний, связанных с потерей плода [45]. Последнее подтверждается недавними сообщениями о том, что антифосфолипидные антитела, которые часто обнаруживаются в случаях рецидивирующей потери плода, вызывают нетоз [42].
Фактор фон Виллебранда является полифункциональным гликопротеином острой фазы, который играет одну из основных ролей в первичном гемостазе. В покое vWF находится в составе мультимеров внутри телец Вейбеля-Паладе в клетках эндотелия. Экзоцитоз vWF начинается в ответ на воздействие различных эндогенных стимулов, таких как воспалительные цитокины, гистамин, тромбин, фибрин или экзогенный десмопрессин. Мультимеры vWF обладают огромным потенциалом связывания с тромбоцитами, они высокотромбогенны и потому подвергаются ферментному разрушению на более мелкие фрагменты, обладающие меньшей тромбогенностью, до попадания в кровоток. Резка мультимеров происходит при участии металлопротеазы ADAMTS-13 (англ. a disintegrin and metalloprotease with thrombospondin type 1 motif, member 13) после связывания в области А2 домена vWF. Этот процесс активируют тромбоциты и фактор VIII. Одним из факторов патогенеза тромбоза у онкологических больных является активация эндотелия опухолевыми клетками, что ведет к высвобождению мультимеров vWF, активации ADAMTS-13, а затем, в результате активного потребления, к истощению пула ADAMTS-13 (рис. 6).
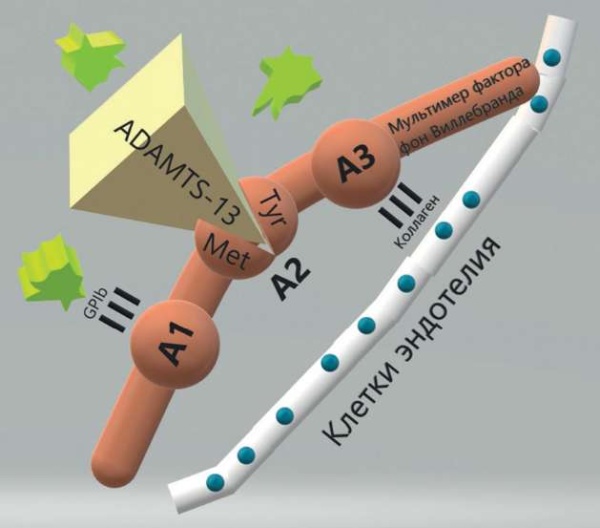
Рисунок 6. Взаимодействие металлопротеазы ADAMTS-13 и фактора фон Виллебранда [рисунок авторов].
Примечание: GP1b – гликопротеин 1b; А1, А2, А3 – домены мультимера фактора фон Виллебранда; ADAMTS-13 – дизинтегрин-подобная металлопротеаза с мотивом тромбоспондина 1; Мet – аминокислота метионин; Tyr – аминокислота тирозин.
Figure 6. Interaction of ADAMTS-13 metalloprotease and von Willebrand factor [drawn by authors].
Note: GP1b – glycoprotein 1b; A1, A2, A3 – domains of von Willebrand factor multimer; ADAMTS-13 – a disintegrin and metalloprotease with thrombospondin type 1 motif; Met – methionine amino acid; Tyr – tyrosine amino acid.
В составе NETs находится PAD4 – фермент, способный модифицировать аргинин в других протеазах. При повышении концентрации PAD4 в процессе опухолевого роста он воздействует на ADAMTS-13, меняя ее строение, снижая тропность к А2 домену vWF, тем самым снижая активность ADAMTS-13 [46] (рис. 7). В условиях SARS-CoV-2-опосредованного поражения эндотелия, как яркого примера иммуновоспаления, происходит потребление ADAMTS-13 избыточными количествами vWF и накопление ультравысокомолекулярных его мультимеров, которые в комплексе с тромбоцитами приводят к микротромбообразованию и полиорганной недостаточности.
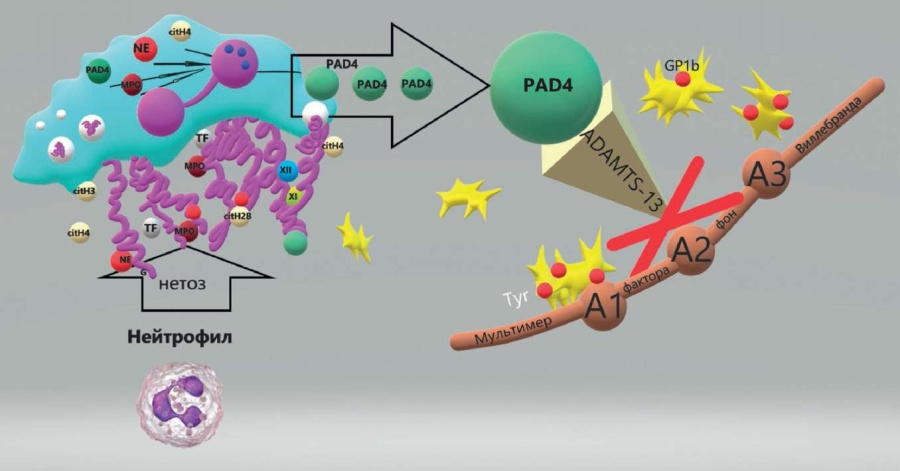
Рисунок 7. Влияние NETs на активность ADAMTS-13 [рисунок авторов].
Примечание: NETs – внеклеточные ловушки нейтрофилов; PAD4 – пептидил-аргинин деиминаза 4; GP1b – гликопротеин 1b; А1, А2, А3 – домены мультимера фактора фон Виллебранда; ADAMTS-13 – дизинтегрин-подобная металлопротеаза с мотивом тромбоспондина 1; Tyr – аминокислота тирозин; NE – эластаза нейтрофилов; MPO – миелопероксидаза; citH4 – цитрулированный гистон Н4; citH2B – цитрулированный гистон Н2В; TF – тканевой фактор.
Figure 7. NETs effect on ADAMTS-13 activity [drawn by authors].
Note: NETs – neutrophil extracellular traps; PAD4 – peptidyl arginine deiminase 4; GP1b – glycoprotein 1b; A1, A2, A3 – domains of von Willebrand factor multimer; ADAMTS-13 – a disintegrin and metalloprotease with thrombospondin type 1 motif; Tyr – tyrosine amino acid; NE – neutrophil elastase; MPO – myeloperoxidase; citH4 – citrullinated histone H4; citH2B – citrullinated histone H2B; TF – tissue factor.
Все вышесказанное далеко не полностью отражает всю полноту картины изменений в системе гемостаза при раке. Опухолевые клетки экспрессируют специфические молекулы адгезии (Е-селектин, P-селектин и другие), которые обеспечивают им фиксацию к стенке кровеносного сосуда, а также взаимодействие с эндотелием, тромбоцитами и лейкоцитами [47][48]. Исследования доказали, что P-селектин у онкологических пациентов является маркером высокого риска тромбозов [48].
Молекулярные фрагменты, ассоциированные с повреждениями (англ. damage-associated molecular patterns, DAMPs), представляют собой гетерогенную группу молекул (гистоны, белки острой фазы и др.), которые опухолевые клетки выделяют в процессе гибели. DAMPs оказывают большое влияние на активацию гемостаза [49].
За последние десятилетия значительно углубились знания о патогенезе тромбоза при раке, выделено большое количество механизмов и участников процесса. В одном из недавних исследований была выдвинута гипотеза, что, возможно, ведущий механизм в каждом конкретном случае, управляющий тромбообразованием, зависит от вида опухоли, например, гранулоцитарный колониестимулирующий фактор (англ. granulocyte colony-stimulating factor, G-CSF) опухолей легких приводит к повышению количества нейтрофилов, и эти нейтрофилы высвобождают NETs, которые увеличивают тромбоз у пациентов с раком легких. Тромбоцитоз является лидирующим механизмом при раке яичников, при этом IL-6 стимулирует гепатоциты к экспрессии тромбопоэтина, который увеличивает продукцию тромбоцитов и усиливает тромбоз.
Опухолевые клетки поджелудочной железы высвобождают микровезикулы (англ. microvesicles, MV) с тканевым фактором (TF + MV) в кровоток, способствуя развитию тромбоза [50]. Опухолевые клетки головного мозга могут высвобождать подопланин-содержащие микровезикулы (PDPN + MV), которые активируют циркулирующие тромбоциты и увеличивают тромбоз у пациентов с опухолями головного мозга [2].
Не только при неинфекционных воспалительных заболеваниях, онкологических заболеваниях, но и при тяжелых инфекциях, в том числе при новой коронавирусной инфекции COVID-19 и сепсисе, системный воспалительный ответ сопровождается выработкой большого количества NETs и активацией многих из вышеуказанных путей с последующим повреждением эндотелия, внутрисосудистым свертыванием и органной дисфункцией, что свидетельствует об общности патогенетических механизмов [51]. С момента старта пандемии COVID-19 появилось большое количество публикаций (описаний клинических случаев и обзорных статей), посвященных нарушению гемостаза и тромбозам. Основополагающими патогенетическими звеньями тяжелого течения COVID-19 в настоящий момент признаны декомпенсация системного воспалительного ответа и протромботическое состояние [52]. В отношении COVID-19 все чаще можно услышать упоминание терминов тромбовоспаление, эндотелиальная дисфунция и иммунотромбоз.
NETs являются одной из причин развития тяжелого течения COVID-19 [53]. Гистоны – основные компоненты NETs обладают цитотоксическим действием, индуцируют повреждение клетки и выявляются в структуре тромбов наряду с тромбоцитами в легких инфицированных пациентов [54]. Избыточная активация нейтрофилов и выработка NETs способствуют острому повреждению ткани легких, микротромбообразованию, кровоизлияниям и легочной недостаточности. Сети хроматина разрушают альвеолярнокапиллярный барьер, приводя к повреждению эндотелия и кровоизлиянию [55].
Именно общность патогенетических механизмов острого инфекционного процесса и опухолевого роста дала возможность продвинуться в понимании патогенеза рака на фоне прошедшей пандемии.
Заключение / Conclusion
Рак-ассоциированный тромбоз – это особый вид протромботического состояния, следовательно, оценка степени риска, мониторинг и ведение должны осуществляться с учетом имеющихся знаний об этиопатогенезе. Воспаление и тромбообразование играют важную роль в прогрессии опухоли и метастазировании у онкологических пациентов. Коронавирусная инфекция стала ярким примером тяжелых состояний, обусловленных иммунотромбозом. Основными звеньями патогенеза тяжелых форм COVID-19 являются внутрисосудостое свертывание на фоне повышенной генерации тромбина, эндотелиопатия на фоне цитокинового шторма, синтез NETs и активация тромбоцитов и системы комплемента. Все это открывает новые горизонты для разработки современных инновационных стратегий лечения онкологических больных.
Список литературы
1. Fernandes C.J., Morinaga L.T., Alves J.L. et al. Cancer-associated thrombosis: the when, how and why. Eur Respir Rev. 2019;28(151):180119. https://doi.org/10.1183/16000617.0119-2018.
2. Hisada Y., Mackman N. Cancer-associated pathways and biomarkers of venous thrombosis. Blood. 2017;130(13):1499–506. https://doi.org/10.1182/blood-2017-03-743211.
3. Trousseau A. Phlegmasia alba dolens. Clinique medicale de l'Hotel-Dieu de Paris. 1865;3:94.
4. Ay C., Pabinger I., Cohen A.T. Cancer-associated venous thromboembolism: burden, mechanisms, and management. Thromb Haemost. 2017;117(2):219–30. https://doi.org/10.1160/TH16-08-0615.
5. Noble S., Pasi J. Epidemiology and pathophysiology of cancer-associated thrombosis. Br J Cancer. 2010;102 Suppl 1(Suppl 1):S2–9. https://doi.org/10.1038/sj.bjc.6605599.
6. Wun T., White R.H. Venous thromboembolism (VTE) in patients with cancer: epidemiology and risk factors. Cancer Invest. 2009;27 Suppl 1:63–74. https://doi.org/10.1080/07357900802656681.
7. Ma S.-N., Mao Z.-X., Wu Y. et al. The anti-cancer properties of heparin and its derivatives: a review and prospect. Cell Adh Migr. 2020;14(1):118–28. https://doi.org/10.1080/19336918.2020.1767489.
8. Lyman G.H., Eckert L., Wang Y. et al. Venous thromboembolism risk in patients with cancer receiving chemotherapy: a real-world analysis. Oncologist. 2013;18(12):1321–9. https://doi.org/10.1634/theoncologist.2013-0226.
9. Lyman G.H. Venous thromboembolism in the patient with cancer: focus on burden of disease and benefits of thromboprophylaxis. Cancer. 2011;117(7):1334–49.https://doi.org/10.1002/cncr.25714.
10. Wun T., White R.H. Epidemiology of cancer-related venous thromboembolism. Best Pract Res Clin Haematol. 2009;22(1):9–23. https://doi.org/10.1016/j.beha.2008.12.001.
11. Falanga A., Marchetti M. Venous thromboembolism in the hematologic malignancies. J Clin Oncol. 2009;27(29):4848–57. https://doi.org/10.1200/JCO.2009.22.8197.
12. De Cicco M. The prothrombotic state in cancer: pathogenic mechanisms. Crit Rev Oncol Hematol. 2004;50(3):187–96. https://doi.org/10.1016/j.critrevonc.2003.10.003.
13. Abdel-Razeq H., Mansour A., Saadeh S.S. et al. The application of current proposed venous thromboembolism risk assessment model for ambulatory patients with cancer. Clin Appl Thromb Hemost. 2018;24(3):429–33. https://doi.org/10.1177/1076029617692880.
14. Hamada K., Kuratsu J., Saitoh Y. et al. Expression of tissue factor correlates with grade of malignancy in human glioma. Cancer. 1996;77(9):1877–83. https://doi.org/10.1002/(SICI)1097-0142(19960501)77:9%3C1877::AID-CNCR18%3E3.0.CO;2-X
15. Dai H., Zhou H., Sun Y. et al. D-dimer as a potential clinical marker for predicting metastasis and progression in cancer. Biomed Rep. 2018;9(5):453–7. https://doi.org/10.3892/br.2018.1151.
16. Chen N., Ren M., Li R. et al. Bevacizumab promotes venous thromboembolism through the induction of PAI-1 in a mouse xenograft model of human lung carcinoma. Mol Cancer. 2015;14:140. https://doi.org/10.1186/s12943-015-0418-x.
17. Granger J.M., Kontoyiannis D.P. Etiology and outcome of extreme leukocytosis in 758 nonhematologic cancer patients: a retrospective, single-institution study. Cancer. 2009;115(17):3919–23. https://doi.org/10.1002/cncr.24480.
18. Blix K., Jensvoll H., Brækkan S.K., Hansen J.-B. White blood cell count measured prior to cancer development is associated with future risk of venous thromboembolism – the Tromsø study. PLoS One. 2013;8(9):e73447. https://doi.org/10.1371/journal.pone.0073447.
19. Shindo K., Aishima S., Ohuchida K. et al. Podoplanin expression in cancerassociated fibroblasts enhances tumor progression of invasive ductal carcinoma of the pancreas. Mol Cancer. 2013;12(1):168. https://doi.org/10.1186/1476-4598-12-168.
20. Mukai M., Oka T. Mechanism and management of cancer-associated thrombosis. J Cardiol. 2018;72(2):89–93. https://doi.org/10.1016/j.jjcc.2018.02.011.
21. Peterson J.E., Zurakowski D., Italiano J.E. et al. VEGF, PF4 and PDGF are elevated in platelets of colorectal cancer patients. Angiogenesis. 2012;15(2):265–73. https://doi.org/10.1007/s10456-012-9259-z.
22. Quintanilla M., Montero-Montero L., Renart J., Martín-Villar E. Podoplanin in inflammation and cancer. Int J Mol Sci. 2019;20(3):707. https://doi.org/10.3390/ijms20030707.
23. Aharon A., Brenner B. Microparticles, thrombosis and cancer. Best Pract Res Clin Haematol. 2009;22(1):61–9. https://doi.org/10.1016/j.beha.2008.11.002.
24. Engelmann B., Massberg S. Thrombosis as an intravascular effector of innate immunity. Nat Rev Immunol. 2013;13(1):34–45. https://doi.org/10.1038/nri3345.
25. Geddings J.E., Mackman N. Tumor-derived tissue factor–positive microparticles and venous thrombosis in cancer patients. Blood. 2013;122(11):1873–80. https://doi.org/10.1182/blood-2013-04-460139.
26. Zarà M., Canobbio I., Visconte C. et al. Molecular mechanisms of platelet activation and aggregation induced by breast cancer cells. Cell Signal. 2018;48:45–53. https://doi.org/10.1016/j.cellsig.2018.04.008.
27. Lowe K.L., Navarro-Nunez L., Watson S.P. Platelet CLEC-2 and podoplanin in cancer metastasis. Thromb Res. 2012;129 Suppl 1:S30–7. https://doi.org/10.1016/S0049-3848(12)70013-0.
28. Lee H.-Y., Yu N.-Y., Lee S.-H. et al. Podoplanin promotes cancerassociated thrombosis and contributes to the unfavorable overall survival in an ectopic xenograft mouse model of oral cancer. Biomed J. 2020;43(2):146–62. https://doi.org/10.1016/j.bj.2019.07.001.
29. Stone R.L., Nick A.M., McNeish I.A. et al. Paraneoplastic thrombocytosis in ovarian cancer. N Engl J Med. 2012;366(7):610–8. https://doi.org/10.1056/NEJMoa1110352.
30. Seyfried T.N., Huysentruyt L.C. On the origin of cancer metastasis. Crit Rev Oncog. 2013;18(1–2):43–73. https://doi.org/10.1615/critrevoncog.v18.i1-2.40.
31. Riedl J., Preusser M., Nazari P.M.S. et al. Podoplanin expression in primary brain tumors induces platelet aggregation and increases risk of venous thromboembolism. Blood. 2017;129(13):1831–9. https://doi.org/10.1182/blood-2016-06-720714.
32. Payne H., Ponomaryov T., Watson S.P., Brill A. Mice with a deficiency in CLEC-2 are protected against deep vein thrombosis. Blood. 2017;129(14):2013–20. https://doi.org/10.1182/blood-2016-09-742999.
33. Efrimescu C.I., Buggy P.M., Buggy D.J. Neutrophil extracellular trapping role in cancer, metastases, and cancer-related thrombosis: a narrative review of the current evidence base. Curr Oncol Rep. 2021;23(10):118. https://doi.org/10.1007/s11912-021-01103-0.
34. Martins-Cardoso K., Almeida V.H., Bagri K.M. et al. Neutrophil extracellular traps (NETs) promote pro-metastatic phenotype in human breast cancer cells through epithelial–mesenchymal transition. Cancers (Basel). 2020;12(6):1542. https://doi.org/10.3390/cancers12061542.
35. Snoderly H.T., Boone B.A., Bennewitz M.F. Neutrophil extracellular traps in breast cancer and beyond: current perspectives on NET stimuli, thrombosis and metastasis, and clinical utility for diagnosis and treatment. Breast Cancer Res. 2019;21(1):145. https://doi.org/10.1186/s13058-019-1237-6.
36. Brinkmann V., Reichard U., Goosmann C. et al. Neutrophil extracellular traps kill bacteria. Science. 2004;303(5663):1532–5. https://doi.org/10.1126/science.1092385.
37. Teijeira Á., Garasa S., Gato M. et al. CXCR1 and CXCR2 chemokine receptor agonists produced by tumors induce neutrophil extracellular traps that interfere with immune cytotoxicity. Immunity. 2020;2(5):856–71.e8. https://doi.org/10.1016/j.immuni.2020.03.001.
38. Zuo Y., Yalavarthi S., Shi H. et al. Neutrophil extracellular traps in COVID-19. JCI Insight. 2020;5(11):e138999. https://doi.org/10.1172/jci.insight.138999.
39. Nie M., Yang L., Bi X. et al. Neutrophil extracellular traps induced by IL8 promote diffuse large B-cell lymphoma progression via the TLR9 signaling. Clin Cancer Res. 2019;25(6):1867–79. https://doi.org/10.1158/1078-0432.CCR-18-1226.
40. Yang D., Liu J. Neutrophil extracellular traps: A new player in cancer metastasis and therapeutic target. J Exp Clin Cancer Res. 2021;40(1):233. https://doi.org/10.1186/s13046-021-02013-6.
41. Thalin C., Hisada Y., Lundstrom S. et al. Neutrophil extracellular traps: villains and targets in arterial, venous, and cancer-associated thrombosis. Arterioscler Thromb Vasc Biol. 2019;39(9):1724–38. https://doi.org/10.1161/ATVBAHA.119.312463.
42. Giaglis S., Stoikou M., Grimolizzi F. et al. Neutrophil migration into the placenta: Good, bad or deadly? Cell Adh Migr. 2016;10(1–2):208–25. https://doi.org/10.1080/19336918.2016.1148866.
43. Marder W., Knight J.S., Kaplan M.J. et al. Placental histology and neutrophil extracellular traps in lupus and pre-eclampsia pregnancies. Lupus Sci Med. 2016;3(1):e000134. https://doi.org/10.1136/lupus-2015-000134.
44. Osorio Y., Bonilla D.L., Peniche A.G. et al. Pregnancy enhances the innate immune response in experimental cutaneous leishmaniasis through hormone-modulated nitric oxide production. J Leukoc Biol. 2008;83(6):1413–22. https://doi.org/10.1189/jlb.0207130.
45. Hahn S., Lapaire O., Than N.G. Biomarker development for presymptomatic molecular diagnosis of preeclampsia: feasible, useful or even unnecessary? Expert Rev Mol Diagn. 2015;15(5):617–29. https://doi.org/10.1586/14737159.2015.1025757.
46. Lam F.W., Cruz M.A., Parikh K., Rumbaut R.E. Histones stimulate von Willebrand factor release in vitro and in vivo. Haematologica. 2016;101(7):e277–9. https://doi.org/10.3324/haematol.2015.140632.
47. Meier T.R., Myers D.D., Wrobleski S.K. et al. Prophylactic P-selectin inhibition with PSI-421 promotes resolution of venous thrombosis without anticoagulation. Thromb Haemost. 2008;99(2):343–51. https://doi.org/10.1160/TH07-10-0608.
48. Ay C., Simanek R., Vormittag R. et al. High plasma levels of soluble P-selectin are predictive of venous thromboembolism in cancer patients: results from the Vienna Cancer and Thrombosis Study (CATS). Blood. 2008;112(7):2703–8. https://doi.org/10.1182/blood-2008-02-142422.
49. Hernandez C., Huebener P., Schwabe R.F. Damage-associated molecular patterns in cancer: a double-edged sword. Oncogene. 2016;35(46):5931–41. https://doi.org/10.1038/onc.2016.104.
50. Tang M., Jiang L., Lin Y. et al. Platelet microparticle-mediated transfer of miR-939 to epithelial ovarian cancer cells promotes epithelial to mesenchymal transition. Oncotarget. 2017;8(57):97464–75. https://doi.org/10.18632/oncotarget.22136.
51. Hindilerden F., Yonal-Hindilerden I., Akar E., Kart-Yasar K. Covid-19 associated autoimmune thrombotic thrombocytopenic purpura: Report of a case. Thromb Res. 2020;195:136–8. https://doi.org/10.1016/j.thromres.2020.07.005.
52. Giamarellos-Bourboulis E.J., Netea M.G., Rovina N. et al. Complex immune dysregulation in COVID-19 patients with severe respiratory failure. Cell Host Microbe. 2020;27(6):992–1000.e3. https://doi.org/10.1016/j.chom.2020.04.009.
53. Middleton E.A., He X.Y., Denorme F. et al. Neutrophil extracellular traps contribute to immunothrombosis in COVID-19 acute respiratory distress syndrome. Blood. 2020;136(10):1169–79. https://doi.org/10.1182/blood.2020007008.
54. Ashar H.K., Mueller N.C., Rudd J.M. et al. The role of extracellular histones in influenza virus pathogenesis. Am J Pathol. 2018;188(1):135–48. https://doi.org/10.1016/j.ajpath.2017.09.014.
55. Gould T.J., Lysov Z., Liaw P.C. Extracellular DNA and histones: doubleedged swords in immunothrombosis. J Thromb Haemost. 2015;13 Suppl 1:S82–91. https://doi.org/10.1111/jth.12977.
Об авторах
Е. В. СлуханчукРоссия
Слуханчук Екатерина Викторовна – к.м.н., доцент кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
В. О. Бицадзе
Россия
Бицадзе Виктория Омаровна – д.м.н., профессор РАН, профессор кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 6506003478
Researcher ID: F-8409-2017
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
А. Г. Солопова
Россия
Солопова Антонина Григорьевна – д.м.н., профессор кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 6505479504
Researcher ID: Q-1385-2015
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Д. Х. Хизроева
Россия
Хизроева Джамиля Хизриевна – д.м.н., профессор кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 57194547147
Researcher ID: F-8384-2017
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Ж.-К. Гри
Россия
Гри Жан-Кристоф – д.м.н., профессор кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова ФГАОУ ВО Первый Московский государственный медицинский университет имени И.М. Сеченова Министерства здравоохранения Российской Федерации (Сеченовский Университет); профессор гематологии, зав. лабораторией гематологии факультета биологических и фармацевтических наук Университета Монпелье и Университетской больницы Нима; иностранный член РАН
Scopus Author ID: 7005114260
Researcher ID: AAA-2923-2019
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
34090, Франция, Монпелье, ул. Огюста Бруссоне, д. 163
И. Элалами
Россия
Элалами Исмаил – д.м.н., профессор кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова ФГАОУ ВО Первый Московский государственный медицинский университет имени И.М. Сеченова Министерства здравоохранения Российской Федерации (Сеченовский Университет); профессор медицинского Университета Сорбонны; директор гематологии Центра Тромбозов, Госпиталь Тенон
Scopus Author ID: 7003652413
Researcher ID: AAC-9695- 2019
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
75006, Франция, Париж, Улица медицинского факультета, д. 12
75020, Франция, Париж, Китайская улица, д. 4
Л. Л. Панкратьева
Россия
Панкратьева Людмила Леонидовна – д.м.н., руководитель научно-клинического центра ГБУЗ «Городская клиническая больница № 67 имени Л.А. Ворохобова Департамента здравоохранения города Москвы»; врач-неонатолог, врач-гематолог, доцент, профессор кафедры педиатрии и организации здравоохранения ФГБУ «Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева» Министерства здравоохранения Российской Федерации
Scopus Author ID: 7006391091
Author ID: 697284
123423 Москва, ул. Саляма Адиля, д. 2/44
117997 Москва, ул. Саморы Машела, д. 1
В. И. Цибизова
Россия
Цибизова Валентина Ивановна – к.м.н., врач акушер-гинеколог НИЛ оперативной гинекологии Института перинатологии и педиатрии, врач отделения функциональной ультразвуковой диагностики
197341 Санкт-Петербург, ул. Аккуратова, д. 2
Д. Ю. Унгиадзе
Грузия
Унгиадзе Джумбер Юрьевич – д.м.н., профессор медицинского факультета, Батумский государственный университет имени Шота Руставели; директор Центра здоровья «Медина» имени Ирис Борчашвили
6010 Батуми, ул. Ниношвили, д. 35
6004 Батуми, проспект Фридон Халваши, д. 237
Л. А. Ашрафян
Россия
Ашрафян Лев Андреевич – д.м.н., профессор, академик РАН, заслуженный врач РФ, директор Института онкогинекологии и маммологии, зам. директора
Scopus Author ID: 57194173388
SPIN-код: 4870-1626
117997 Москва, ул. академика Опарина, д. 4
А. Д. Макацария
Россия
Макацария Александр Давидович – д.м.н., профессор, академик РАН, зав. кафедрой акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 57222220144
Researcher ID: M-5660-2016
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Рецензия
Для цитирования:
Слуханчук Е.В., Бицадзе В.О., Солопова А.Г., Хизроева Д.Х., Гри Ж., Элалами И., Панкратьева Л.Л., Цибизова В.И., Унгиадзе Д.Ю., Ашрафян Л.А., Макацария А.Д. Тромбовоспаление у онкологических больных. Акушерство, Гинекология и Репродукция. 2022;16(5):611-622. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.355
For citation:
Slukhanchuk E.V., Bitsadze V.O., Solopova A.G., Khizroeva J.Kh., Gris J., Elalamy I., Pankratyeva L.L., Tsibizova V.I., Ungiadze J.Yu., Ashrafyan L.A., Makatsariya A.D. Thromboinflammation in oncogynecological patients. Obstetrics, Gynecology and Reproduction. 2022;16(5):611-622. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.355

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































