Перейти к:
Прогностическое значение фактора фон Виллебранда в клинической практике
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.363
Аннотация
Фактор фон Виллебранда (англ. von Willebrand factor, vWF) является мультимерным гликопротеином плазмы, определение которого имеет важное прогностическое значение. В данном литературном обзоре показана взаимосвязь между тяжестью заболеваний и уровнем vWF. Так, например, болезнь Виллебранда характеризуется количественным/качественным генетическим дефицитом vWF, вследствие чего может развиться массивное кровотечение, и знание этого может предупредить развитие грозных осложнений. Не стоит также забывать о возможности развития приобретенного синдрома Виллебранда, который чаще всего возникает в ответ на аутоиммунные заболевания. Существенное повышение уровня vWF в крови во время беременности может свидетельствовать о развитии преэкламспии, а у новорожденных при воздействии дополнительных факторов риска может приводить к тромбозам. У онкологических больных значительное повышение уровня vWF коррелирует с низкой выживаемостью, особенно у пациентов с раком яичников, глиобластомами, раком пищевода и легких. Возникновение новой коронавирусной инфекции COVID-19 позволило по-новому взглянуть на прогностическое значение vWF: так, многочисленные исследования показывают, что повышение в плазме крови vWF:Ag связано с более неблагоприятными исходами у пациентов с COVID-19. В данной статье показана значимость определения уровня vWF, так как ранняя диагностика и лечение смогут улучшить исходы всех этих пациентов.
Ключевые слова
Для цитирования:
Григорьева К.Н., Бицадзе В.О., Хизроева Д.Х., Цибизова В.И., Третьякова М.В., Блинов Д.В., Панкратьева Л.Л., Гашимова Н.Р., Якубова Ф.Э., Антонова А.С., Гри Ж., Элалами И., Макацария А.Д. Прогностическое значение фактора фон Виллебранда в клинической практике. Акушерство, Гинекология и Репродукция. 2022;16(5):588-599. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.363
For citation:
Grigoreva K.N., Bitsadze V.O., Khizroeva J.Kh., Tsibizova V.I., Tretyakova M.V., Blinov D.V., Pankratyeva L.L., Gashimova N.R., Yakubova F.E., Antonova A.S., Gris J., Elalamy I., Makatsariya A.D. Prognostic value of von Willebrand factor in clinical practice. Obstetrics, Gynecology and Reproduction. 2022;16(5):588-599. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.363
Введение / Introduction
Фактор фон Виллебранда (англ. von Willebrand factor, vWF) является гликопротеином плазмы, который производится клетками эндотелия в виде ультракрупных мультимеров, состоящих из повторяющихся мономерных звеньев числом до 40000 кДа в длину, и хранится в специализированных органеллах, известных как тельца Вейбеля-Паладе (Weibel-Palade) [1]. Эндотелиальные запасающие органеллы, называемые тельцами Вейбеля-Паладе, содержат несколько готовых провоспалительных и гемостатических белков, включая Р-селектин, провоспалительные цитокины, агенты, контролирующие тонус сосудов, и vWF [2][3]. Фактор фон Виллебранда играет 2 основные роли в гемостазе человека: во-первых, он «привлекает» и связывает тромбоциты в месте повреждения сосудов, тем самым способствуя агрегации тромбоцитов; во-вторых, vWF действует как защитная молекуланоситель прокоагулянтного фактора VIII (FVIII), что имеет решающее значение для поддержания нормального уровня циркулирующего FVIII [4]. Исследования, которые были основаны на микроскопии с высоким разрешением, продемонстрировали, что при отсутствии повреждения стенки сосуда и в условиях низкого сдвига циркулирующий мультимерный vWF существует в глобулярной или складчатой форме, не допускающей адгезии тромбоцитов. Однако, при высоких скоростях (силах) сдвига или при поврежденной эндотелиальной стенке глобулярный vWF быстро раскручивается и удлиняется, превращаясь в высокоактивную поверхность для адгезии тромбоцитов. В этом развернутом состоянии vWF служит субстратом для металлопротеазы ADAMTS-13 (англ. a disintegrin and metalloprotease with thrombospondin type 1 motif, member 13), основной функцией которой является расщепление гигантских мультимеров vWF [5]. Модуляция уровня антигена плазмы vWF (vWF:Ag) посредством регулируемых путей секреции и ADAMTS-13опосредованного протеолиза имеет важное значение для контроля мультимерного распределения vWF и гемостатической активности. Повышенный уровень vWF:Ag в плазме связан с повышенным риском венозной тромбоэмболии, венозного тромбоза, инсульта и развития ишемической болезни сердца [6][7], в то время как низкий уровень vWF (болезнь Виллебранда, БВ) является наиболее распространенным состоянием нарушения свертываемости крови, которое сопровождается обильным кровотечением и возникает у 0,1–1,0 % людей [8].
Болезнь Виллебранда / Von Willebrand disease
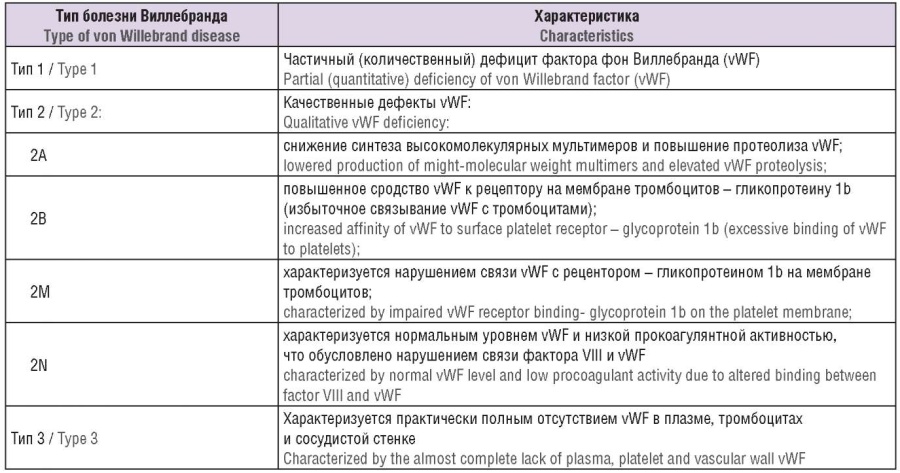
Первое сообщение о БВ было опубликовано в 1926 г. финским врачом-терапевтом Эриком Адольфом фон Виллебрандом (рис. 1). В 1925 г. его попросили осмотреть девочку пяти лет; при сборе анамнеза выяснилось, что из 11 сибсов девочки четверо умерли в раннем возрасте от кровотечений. Позже ученый установил, что многие родственники со стороны матери и отца имели склонность к кровотечениям из кожи, слизистых, а у женщин отмечались меноррагии. Эрик фон Виллебранд отделил данное состояние от классической гемофилии, основываясь на характере наследования, и называл его псевдогемофилией. Однако отсутствие специфических и надежных диагностических тестов и данных об одновременном снижении FVIII привели к диагностической путанице между этими состояниями. В 1950-х годах было показано, что плазма пациентов с тяжелыми формами гемофилии может корригировать болезнь Виллебранда, что привело к различию между этими двумя заболеваниями. В последующие десятилетия был достигнут значительный прогресс в иммунологическом различии между vWF и FVIII, очистке vWF и секвенировании гена vWF, что привело к нашему нынешнему пониманию vWF и молекулярных механизмов, лежащих в основе БВ. В настоящее время БВ подразделяется на 3 типа на основе количественного и качественного дефицита vWF [9–11] (табл. 1). Также важно помнить, что возможно развитие приобретенного синдрома Виллебранда. У таких людей отсутствует генетическое заболевание, которое может повлиять на уровень vWF. Одним из примеров развития приобретенного синдрома Виллебранда является такое аутоиммунное заболевание, как системная красная волчанка, при которой организм вырабатывает антитела против нормальных тканей, иногда включая антитела, направленные против vWF. Антитела связываются с циркулирующим vWF, вследствие чего в кровотоке становится его недостаточно.

Рисунок 1. Эрик Адольф фон Виллебранд (1870–1949).
Figure 1. Erik Adolf von Willebrand (1870–1949).
Таблица 1. Классификация болезни Виллебранда (модифицировано авторами по [12]).
Table 1. Classification of von Willebrand disease (modified by the authors according to [12]).
Болезнь Виллебранда уvженщин репродуктивного возраста / Von Willebrand disease in women of reproductive age
Женщины и мужчины одинаково подвержены болезни Вилленбранда, однако у женщин симптомы кровотечения проявляются чаще и связанны в основном с высокой частотой обильных менструальных кровотечений (ОМК). Данные исследований показывают, что от 5 до 24 % женщин с ОМК имеют тот или иной тип БВ. А обследования женщин с БВ показывают, что у 50–92 % имеются обильные менструальные кровопотери, при этом средний возраст постановки диагноза приблизительно 16 лет. Однако ОМК – не единственная проблема для женщин с БВ [13–15].
Для многих женщин беременность и роды являются серьезной проверкой их системы гемостаза. Несмотря на большие достижения в акушерстве, приблизительно 2–5 % всех родов осложняются послеродовыми кровотечениями. В норме для снижения риска кровотечения во время беременности происходят физиологические изменения, включая повышение уровней vWF и FVIII в плазме [16]. Однако у женщин с БВ эти физиологические изменения притуплены или отсутствуют. У женщин с исходно низким уровнем vWF до беременности скорость его повышения в плазме будет такой же, как и у здоровых сверстниц, увеличиваясь с I триместра и достигая нормального референтного диапазона для небеременных [17]. Однако уровень vWF в плазме будет оставаться ниже, чем у здоровых беременных сверстниц на всех этапах беременности, поэтому использование термина «нормализация» в этом контексте может ввести в заблуждение. Так, физиологическое повышение уровня vWF в плазме представляет собой особую проблему при обследовании женщин с семейным анамнезом БВ типа 1, которые обращаются к врачу впервые во время беременности, поскольку значения vWF в плазме в пределах нормального диапазона не могут исключать болезнь.
Многочисленные исследования выявили у женщин с БВ повышенный риск как первичного, так и вторичного послеродового кровотечения, при этом их частота колеблется от 0 до 59 % и от 2 до 32 % соответственно. Так, A.H. James с соавт. продемонстрировали, что у женщин с БВ в 1,5 раза повышен риск послеродового кровотечения и в 5 раз повышен риск переливания крови после родов, а также выше показатели материнской смертности [18]. Иногда послеродовое кровотечение является триггером для диагностики БВ, при этом БВ выявляется у 49 % женщин, у которых в анамнезе было отмечено тяжелое послеродовое кровотечение [19]. Таким образом, важным этапом является своевременная диагностика БВ, что позволит избежать развития массивной кровопотери при проведении адекватной заместительной терапии.
ADAMTS-13 и фактор фон Виллебранда / ADAMTS-13 and von Willebrand factor
ADAMTS-13 – это цинксодержащая металлопротеаза, которая расщепляет сверхкрупные мультимеры vWF на субъединицы Y1605 и M1606 (pис. 2). Процесс расщепления vWF металлопротеазой ADAMTS-13 запускается при повреждении сосудов, когда сверхкрупные мультимеры vWF высвобождаются из телец Вейбеля-Паладе. ADAMTS-13 способна расщепить vWF, только если тот находится в «раскрытом» состоянии, тем самым предотвращая образование сверхкрупных мультимеров, которые могут достигать несколько миллиметров в длину, если их не контролировать [20][21]. Однако ADAMTS-13 может также связываться с vWF, пока тот находится в глобулярной форме, что приводит к циркуляции комплексов vWF– ADAMTS-13 в кровотоке [22].
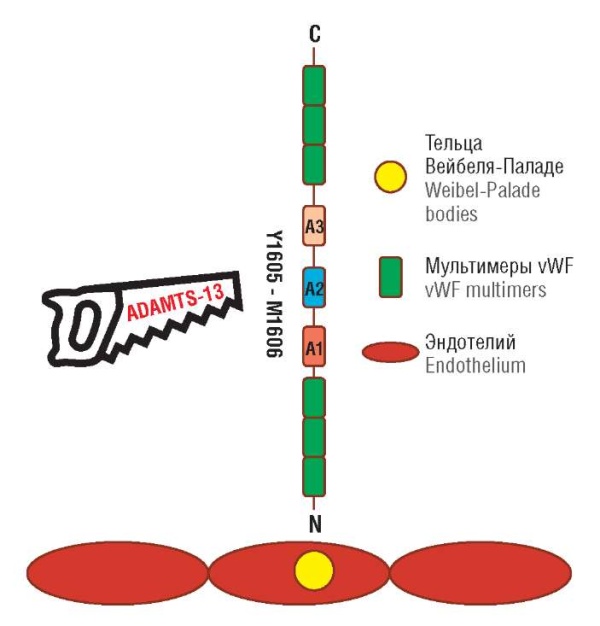
Рисунок 2. Нарезка фактора фон Виллебранда (vWF) металлопротеазой ADAMTS-13 (адаптировано из [25]).
Figure 2. ADAMTS-13-mediated von Willebrand factor cleavage (adapted from [25]).
Часто происходит так, что у пациентов, у которых развилась венозная тромбоэмболия, уровень vWF значительно выше среднего, однако чаще всего это происходит за счет снижения активности ADAMTS-13 [23]. Дефицит ADAMTS-13 приводит к накоплению крупных молекул vWF и в дальнейщем к тромбоцитопении потребления и тромбозу микрососудов [24]. Так, снижение уровня ADAMTS-13 в плазме крови ниже 50 % может наблюдаться при циррозе печени, диссеминированных опухолях и воспалительных заболеваниях. Пациенты с наследственной тромботической тромбоцитопенической пурпурой характеризуются отсутствием или дефицитом протеазы ADAMTS-13, вследствие чего уровень vWF у них гораздо выше. А вот в случае массивного повреждении эндотелия происходит значительный выброс vWF из телец Вейбеля-Паладе; при этом возникает относительная недостаточность металлопротеазы [25].
Повышение уровня фактора фон Виллебранда в плазме крови во время беременности / Elevated serum von Willebrand factor level in pregnancy
Преэклампсия (ПЭ) – тяжелое состояние, которое осложняет большой процент беременностей и является одной из основных причин материнской смертности. По одной из теорий, ПЭ возникает в результате эндотелиальной дисфункции, вследствие чего выделяется большое количество vWF [27]. Многочисленные исследования продемонстрировали, что уровень vWF в плазме крови был значительно выше у беременных с ПЭ по сравнению с женщинами с физиологической беременностью или небеременными [27– 30]. Значительное повышение уровня vWF у пациенток с ПЭ также связано со снижением активности ADAMTS-13; это приводит к тому, что в плазме циркулируют активные сверхкрупные мультимеры vWF.
В недавнем исследовании E. Grandone с соавт. продемонстрировали, что у беременных с COVID-19 повышается соотношение оси vWF/ADAMTS-13, что значимо и независимо от других предикторов приводит к развитию преждевременных родов, поскольку риск удваивается при каждом увеличении соотношения на одну единицу [31].
Повышение уровня фактора фон Виллебранда в плазме крови новорожденных / Elevated neonatal serum von Willebrand factor level
В свёртывающей системе новорожденных и детей более старшего возраста имеются значительные различия. При исследовании системы гемостаза новорожденных большинство исследователей пришло к выводу, что в этом периоде активность ADAMTS-13 ниже, а вот уровень vWF в плазме значительно выше по сравнению с взрослыми. Однако уровень vWF постепенно снижается, достигая уровня взрослых примерно к 6 мес. С другой стороны, неонатальный уровень ADAMTS-13 значительно ниже по сравнению с уровнем взрослых [32]. До конца неясно, почему новорожденные имеют более высокий уровень vWF и более низкую активность ADAMTS-13; предположительно, это физиологическая реакция, которая возникает при подготовке к родам, или же как реакция на стресс после рождения. В норме у здоровых новорожденных нарушение соотношения vWF/ADAMTS-13 не приводит к тромбозам, однако может увеличивать шансы развития тромбозов при воздействии дополнительных факторов риска, таких как гипоксия, сепсис и введение на длительное время внутривенных устройств [33].
Фактор фон Виллебранда в онкологии / Von Willebrand factor in oncology
Связь между раком и активацией коагуляции была установлена еще в 1865 г., когда Armand Trousseau сообщил о развитии осложнений в виде венозной тромбоэмболии (ВТЭ) у пациентов с онкологией. Фактически, ВТЭ встречается у 20 % больных раком и является одной из основных причин смертности [34]. В недавнем исследовании A.L. Palacios-Acedo с соавт. продемонстрировали, что раковые клетки напрямую взаимодействуют с факторами свертывания крови и тромбоцитами, способствуя росту опухоли и образованию метастазов [35]. Кроме того, новые данные свидетельствуют о том, что vWF может модулировать ангиогенез и пролиферацию клеток, что приводит к прогрессированию онкологических заболеваний [36][37]. Несколько исследований показали в плазме прогностическую ценность vWF:Ag, при этом более высокие уровни vWF коррелируют с более низкой выживаемостью у пациентов с раком яичников, глиобластомами, раком пищевода и легких [38–40]. Кроме того, протеомный анализ плазмы определил vWF как биомаркер для раннего выявления рака толстой кишки [41].
Некоторые опухолевые клетки способны продуцировать vWF; более того, экспрессия vWF в опухолевых клетках индуцирует образование эндотелиальных Вейбель-Паладе-подобных органелл, называемых псевдотельцами Вейбеля-Паладе [42]. Также опухолевые клетки, полученные из ткани легкого (A549), клеток предстательной железы (PC3), клеток уротелиальной карциномы (RT4), клеток рака толстой кишки (HT-29) и клеток меланомы (MV3, BLM), были способны стимулировать секрецию vWF из первичных эндотелиальных клеток человека in vitro [43–45]. Таким образом, опосредованная опухолью секреция vWF из эндотелиальных клеток, вероятно, способствует его повышенному уровню в плазме.
Фактор фон Виллебранда также может способствовать метастазированию рака, способен напрямую связываться с различными опухолевыми клетками через ряд интегриновых рецепторов [46]. Кроме того, исследования показали, что некоторые раковые клетки могут экспрессировать рецепторы псевдо-GPIbα для прямой адгезии фактора фон Виллебранда. В частности, С.М. Suter с соат. сообщили о поверхностной экспрессии GPIbα на нескольких культивируемых клетках опухоли молочной железы, а также о положительном окрашивании GPIbα в тканях первичной опухоли молочной железы [47]. Воздействие vWF на эти GPIbα-положительные клетки опухоли молочной железы приводит к увеличению распространения опухолевых клеток посредством перестройки цитоскелета и миграции опухоли in vitro. Экспериментальное исследование метастазирования показало, что лечение анти-vWF (десмопрессин) ингибирует метастазирование в легкие на 64 % для диссеминирующих клеток карциномы толстой кишки, а также клеточных линий меланомы и рака мочевого пузыря Льюиса на 45 и 46 % соответственно. Точно также клетки рака желудка, экспрессирующие vWF, продемонстрировали значительное снижение метастазирования в легкие у мышей, получавших антиvWF [42][48]. Важно отметить, что вклад vWF в распространение рака, по-видимому, специфичен для метастазирования через кровь, а не для лимфатического метастазирования [49]. Механизм, лежащий в основе роли vWF в содействии обсеменению опухолевыми клетками дистальных участков тканей, остается неясным. Однако L. Goertz с соавт. сообщили о наличии внутрипросветных мультимеров vWF в мышиной модели меланомы, которые присутствовали не только в микроциркуляторном русле первичной опухоли, а также в дистальных органах, свободных от опухоли, включая печень, головной мозг и легкие [49]. Эти данные свидетельствуют о том, что даже на ранней стадии заболевания опухоли могут индуцировать системную секрецию vWF из эндотелиальных клеток в местах, в которые часто метастазируют опухоли.
Фактор фон Виллебранда и ишемический инсульт / Von Willebrand factor and ischemic stroke
Все большее количество исследований показывают, что vWF играет важную роль в образовании тромбов при венозных и артериальных тромбозах [50][51]. При ишемическом инсульте (ИИ) vWF тромбоцитарного происхождения вносит значительный вклад в тромбовоспаление [52].
Так, недавний метаанализ, состоящих из 1567 случаев, выявил положительную связь между высоким уровнем vWF и ИИ. Также исследователи обнаружили взаимосвязь между высоким уровнем vWF и летальным исходом от ИИ [53]. В исследованиях D.J. McCabe с соавт. [54] и K.D. Kovacevic с соавт. [55] тоже было продемонстрировано, что высокие уровни vWF в плазме крови и ИИ тесно взаимосвязаны. Однако важно понимать, что не повышение vWF вызывает ИИ, а ИИ приводит к повышению vWF.
Клинические исследования случай–контроль показали связь между повышенным уровнем vWF и снижением ADAMTS-13 при поступлении и последующим наблюдении с тяжестью и риском рецидива [56][57]. Однако до сих пор нет единого мнения о том, можно ли использовать какой-нибудь маркер гемостаза для прогнозирования клинического исхода после инсульта [58].
Фактор фон Виллебранда и COVID-19 / Von Willebrand factor and COVID-19
Пандемия новой коронавирусной болезни 2019 г. – COVID-19, вызванная новым коронавирусом острого тяжелого респираторного синдрома 2 (SARS-CoV-2), затронула десятки миллионов семей во всем мире [59][60]. Основной проблемой COVID-19 являются тромботические и микрососудистые осложнения, которые особенно распространены у пациентов с тяжелой формой течения заболевания и с летальным исходом, несмотря на проведение стандартной тромбопрофилактики и назначение терапевтических доз антикоагулянтов [61][62]. Хорошо известно, что летальные исходы в основном связаны с нарушением функции легких вследствие локальных тромбозов сосудов легких [63]. Однако не стоит забывать, что у пациентов с COVID-19 может возникнуть феномен воспалительного повреждения сосудов без микротромбоза как такового [64]. При тяжелом респираторном синдроме 2 происходит повышенная генерация тромбина, внутрисосудистое свертывание крови в капиллярах, обширное поражение эндотелия, активация макрофагов/моноцитов, выброс избыточного количества провоспалительных цитокинов и активация системы комплемента [65]. R. Seth с соавт. показали, что при коронавирусной инфекции происходит значительное увеличение vWF и снижение металлопротеазы ADAMТS-13 у тяжелых пациентов [66]. К такому же выводу пришли и E.J. Favaloro с соавт. [67]. В 2022 г. X. Xu с соавт. опубликовали в журнале Thrombosis Research результаты метаанализа с участием 3764 пациентов, в котором авторы четко продемонстрировали, что повышение уровня в плазме vWF:Ag связано с неблагоприятными исходами у пациентов с COVID-19 [68]. В.О. Бицадзе с соавт. в одноцентровом ретроспективном наблюдательном исследовании с участием 129 пациентов с тяжелым течением COVID-19 продемонстрировали, что определение МПО в крови имеет прогностическое значение у больных тяжелой формой COVID-19, а концентрации MПO и vWF:Ag являются независимыми предикторами смерти у таких больных, находящихся на искусственной вентиляции лекгих [69].
Гипотетически, если восстановить уровень ADAMTS-13 и/или уменьшить содержание сверхкрупных мультимеров vWF, можно улучшить прогнозы пациентов. Однако на сегодняшний день нет никаких экспериментальных или клинических доказательств, подтверждающих это предположение.
Заключение / Conclusion
Фактор фон Виллебранда является важным предиктором многих состояний. Снижение или повышение уровня vWF должно мониторироваться у пациентов с БВ, ПЭ, ИИ, онкологией, COVID-19, поскольку ранняя диагностика и вовремя начатое лечение смогут улучшить исходы данных состояний.
Список литературы
1. Zhou Y.-F., Eng E.T., Zhu J. et al. Sequence and structure relationships within von Willebrand factor. Blood. 2012;120(2):449–58. https://doi.org/10.1182/blood-2012-01-405134.
2. Nightingale T., Cutler D. The secretion of von Willebrand factor from endothelial cells; an increasingly complicated story. J Thromb Haemost. 2013;11 Suppl 1(Suppl 1):192–201. https://doi.org/10.1111/jth.12225.
3. Valentijn K.M., Sadler J.E., Valentijn J.A. et al. Functional architecture of Weibel-Palade bodies. Blood. 2011;117(19):5033–43. https://doi.org/10.1182/blood-2010-09-267492.
4. Lenting P.J., Christophe O.D., Denis CV. von Willebrand factor biosynthesis, secretion, and clearance: connecting the far ends. Blood. 2015;125(13):2019–28. https://doi.org/10.1182/blood-2014-06-528406.
5. De Ceunynck K., De Meyer S.F., Vanhoorelbeke K. Unwinding the von Willebrand factor strings puzzle. Blood. 2013;121(2):270–7. https://doi.org/10.1182/blood-2012-07-442285.
6. Wieberdink R.G., van Schie M.C., Koudstaal P.J. et al. High von Willebrand factor levels increase the risk of stroke: the Rotterdam study. Stroke. 2010;41(10):2151–6. https://doi.org/10.1161/STROKEAHA.110.586289.
7. Rietveld I.M., Lijfering W.M., le Cessie S. et al. High levels of coagulation factors and venous thrombosis risk: strongest association for factor VIII and von Willebrand factor. J Thromb Haemost. 2019;17(1):99–109. https://doi.org/10.1111/jth.14343.
8. Bowman M., Hopman W.M., Rapson D. et al. The prevalence of symptomatic von Willebrand disease in primary care practice. J Thromb Haemost. 2010;8(1):213–6. https://doi.org/10.1111/j.1538-7836.2009.03661.x.
9. Von Willebrand E.A. Hereditary pseudohaemophilia. Haemophilia. 1999;5(3):223–31; discussion 222. https://doi.org/10.1046/j.1365-2516.1999.00302.x.
10. Verweij C.L., Diergaarde P.J., Hart M., Pannekoek H. Full-length von Willebrand factor (vWF) cDNA encodes a highly repetitive protein considerably larger than the mature vWF subunit. EMBO J. 1986;5(8):1839–47.
11. Sadler J.E. Biochemistry and genetics of von Willebrand factor. Annu Rev Biochem. 1998;67:395–424. https://doi.org/10.1146/annurev.biochem.67.1.395.
12. Mannucci P.M. Treatment of von Willebrand’s disease. N Engl J Med. 2004;351(7):683–94. https://doi.org/10.1056/NEJMra040403.
13. James A.H., Kouides P.A., Abdul-Kadir R. et al. Evaluation and management of acute menorrhagia in women with and without underlying bleeding disorders: consensus from an international expert panel. Eur J Obstet Gynecol Reprod Biol. 2011;158(2):124–34. https://doi.org/10.1016/j.ejogrb.2011.04.025.
14. Govorov I., Ekelund L., Chaireti R. et al. Heavy menstrual bleeding and health-associated quality of life in women with von Willebrand’s disease. Exp Ther Med. 2016;11(5):1923–9. https://doi.org/10.3892/etm.2016.3144.
15. Lavin M., Aguila S., Dalton N. et al. Significant gynecological bleeding in women with low von Willebrand factor levels. Blood Adv. 2018;2(14):1784–91. https://doi.org/10.1182/bloodadvances.2018017418.
16. Nowak-Göttl U., Limperger V., Kenet G. et al. Developmental hemostasis: a lifespan from neonates and pregnancy to the young and elderly adult in a European white population. Blood Cells Mol Dis. 2017;67:2–13. https://doi.org/10.1016/j.bcmd.2016.11.012.
17. James A.H., Konkle B.A., Kouides P. et al. Postpartum von Willebrand factor levels in women with and without von Willebrand disease and implications for prophylaxis. Haemophilia. 2015;21(1):81–7. https://doi.org/10.1111/hae.12568.
18. James A.H., Jamison M.G. Bleeding events and other complications during pregnancy and childbirth in women with von Willebrand disease. J Thromb Haemost. 2007;5(6):1165–9. https://doi.org/10.1111/j.1538-7836.2007.02563.x.
19. Majluf-Cruz K., Anguiano-Robledo L., Calzada-Mendoza C.C. et al. von Willebrand Disease and other hereditary haemostatic factor deficiencies in women with a history of postpartum haemorrhage. Haemophilia. 2020;26(1):97–105. https://doi.org/10.1111/hae.13900.
20. South K., Freitas M.O., Lane D.A. A model for the conformational activation of the structurally quiescent metalloprotease ADAMTS13 by von Willebrand factor. J Biol Chem. 2018;293(4):1149–50. https://doi.org/10.1074/jbc.M117.776732.
21. Plautz W.E., Raval J.S., Dyer M.R. et al. ADAMTS13: origins, applications and prospects. Transfusion. 2018;58(10):2453–62. https://doi.org/10.1111/trf.14804.
22. de Groot R., Lane D.A., Crawley J.T. The role of the ADAMTS13 cysteinerich domain in VWF binding and proteolysis. Blood. 2015;125(12):1968–7. https://doi.org/10.1182/blood-2014-08-594556.
23. Pabinger I., Thaler J., Ay C. Biomarkers for prediction of venous thromboembolism in cancer. Blood. 2013;122(12):2011–8. https://doi.org/10.1182/blood-2013-04-460147.
24. Katneni U.K., Ibla J.C., Hunt R. et al. von Willebrand factor/ADAMTS-13 interactions at birth: implications for thrombosis in the neonatal period. J Thromb Haemost. 2019;17(3):429–40. https://doi.org/10.1111/jth.14374.
25. Schaller M., Studt J.D., Voorberg J., Kremer Hovinga J.A. Acquired thrombotic thrombocytopenic purpura. Development of an autoimmune response. Hamostaseologie. 2013;33(2):121–30. https://doi.org/10.5482/HAMO-12-12-0023.
26. De Young V., Singh K., Kretz C.A. Mechanisms of ADAMTS13 regulation. J Thromb Haemost. 2022 Sep 8. https://doi.org/10.1111/jth.15873. Onlineahead of print.
27. Sánchez-Aranguren L.C., Prada C.E., Riaño-Medina C.E., Lopez M. Endothelial dysfunction and preeclampsia: role of oxidative stress. Front Physiol. 2014;5:372. https://doi.org/10.3389/fphys.2014.00372.
28. Molvarec A., Rigó J., Bõze T. et al. Increased plasma von Willebrand factor antigen levels but normal von Willebrand factor cleaving protease (ADAMTS13) activity in preeclampsia. Thromb Haemost. 2009;101(2):305–11.
29. Aref S., Goda H. Increased VWF antigen levels and decreased ADAMTS13 activity in preeclampsia. Hematology. 2013;18(4):237–41. https://doi.org/10.1179/1607845412Y.0000000070.
30. Sánchez-Luceros A., Meschengieser S.S., Marchese C. et al. Factor VIII and von Willebrand factor changes during normal pregnancy and puerperium. Blood Coagul Fibrinolysis. 2003;14(7):647–5. https://doi.org/10.1097/00001721-200310000-00005.
31. Grandone E., Vimercati А., Sorrentino F. et al. Obstetric outcomes in pregnant COVID-19 women: the imbalance of von Willebrand factor and ADAMTS13 axis. BMC Pregnancy Childbirth. 2022;22(1):142. https://doi.org/10.1186/s12884-022-04405-8.
32. Reiter R.A., Varadi K., Turecek P.L. et al. Changes in ADAMTS13 (vonWillebrand-factor-cleaving protease) activity after induced release of von Willebrand factor during acute systemic inflammation. Thromb Haemost. 2005;93:554–8. https://doi.org/10.1160/TH04-08-0467.
33. Strauss T., Elisha N., Ravid B. et al. Activity of Von Willebrand factor and levels of VWF-cleaving protease (ADAMTS13) in preterm and full term neonates. Blood Cells Mol Dis. 2017;67:14–7. https://doi.org/10.1016/j.bcmd.2016.12.013.
34. Khorana A., Francis C., Culakova E. et al. Thromboembolism is a leading cause of death in cancer patients receiving outpatient chemotherapy. J Thromb Haemost. 2007;5(3):632–4. https://doi.org/10.1111/j.1538-7836.2007.02374.x.
35. Palacios-Acedo A.L., Mege D., Crescence L. et al. Platelets, thromboinflammation, and cancer: collaborating with the enemy. Front Immunol. 2019;10:1805. https://doi.org/10.3389/fimmu.2019.01805.
36. Mochizuki S., Soejima K., Shimoda M. et al. Effect of ADAM28 on carcinoma cell metastasis by cleavage of von Willebrand factor. J Natl Cancer Inst. 2012;104(12):906–22. https://doi.org/10.1093/jnci/djs232.
37. Ishihara J., Ishihara A., Starke R.D. et al. The heparin binding domain of von Willebrand factor binds to growth factors and promotes angiogenesis in wound healing. Blood. 2019;133(24):2559–69. https://doi.org/10.1182/blood.2019000510.
38. Guo R., Yang J., Liu X. et al. Increased von Willebrand factor over decreased ADAMTS-13 activity is associated with poor prognosis in patients with advanced non-small cell lung cancer. J Clin Lab Anal. 2018;32(1):e22219. https://doi.org/10.1002/jcla.22219.
39. Koh S.C., Razvi K., Chan Y. et al. The association with age, human tissue kallikreins 6 and 10 and hemostatic markers for survival outcome from epithelial ovarian cancer. Arch Gynecol Obstet. 2011;284(1):183–90. https://doi.org/10.1007/s00404-010-1605-z.
40. Marfia G., Navone S.E., Fanizzi C. et al. Prognostic value of preoperative von Willebrand factor plasma levels in patients with Glioblastoma. Cancer Med. 2016;5(8):1783–90. https://doi.org/10.1002/cam4.747.
41. Rho J., Ladd J.J., Li C. et al. Protein and glycomic plasma markers for early detection of adenoma and colon cancer. Gut. 2018;67(3):473–84. https://doi.org/10.1136/gutjnl-2016-312794.
42. Yang A.-J., Wang M., Wang Y. et al. Cancer cell-derived von Willebrand factor enhanced metastasis of gastric adenocarcinoma. Oncogenesis. 2018;7(1):12. https://doi.org/10.1038/s41389-017-0023-5.
43. Xu Y., Pan S., Liu J. et al. GATA3-induced vWF upregulation in the lung adenocarcinoma vasculature. Oncotarget. 2017;8(66):110517–29. https://doi.org/10.18632/oncotarget.22806.
44. John A., Robador J.R., Vidal-Y-Sy S. et al. Urothelial carcinoma of the bladder induces endothelial cell activation and hypercoagulation. Mol Cancer Res. 2020;18(7):1099–109. https://doi.org/10.1158/1541-7786.MCR-19-1041.
45. Bauer A.T., Suckau J., Frank K. et al. von Willebrand factor fibers promote cancer-associated platelet aggregation in malignant melanoma of mice and humans. Blood. 2015;125(20):3153–63. https://doi.org/10.1182/blood-2014-08-595686.
46. O’Sullivan J.M., Preston R.J., Robson T., O’Donnell J.S. Emerging roles for von Willebrand factor in cancer cell biology. Semin Thromb Hemost. 2018;44(2):159–66. https://doi.org/10.1055/s-0037-1607352.
47. Suter C.M., Hogg P.J., Price J.T. et al. Identification and characterisation of a platelet GPIb/V/IX-like complex on human breast cancers: implications for the metastatic process. Jpn J Cancer Res. 2001;92(10):1082–92. https://doi.org/10.1111/j.1349-7006.2001.tb01063.x.
48. Yang X., Sun H., Li Z. et al. Gastric cancer-associated enhancement of von Willebrand factor is regulated by vascular endothelial growth factor and related to disease severity. BMC Cancer. 2015;15:80. https://doi.org/10.1186/s12885-015-1083-6.
49. Goertz L., Schneider S.W., Desch A. et al. Heparins that block VEGF-Amediated von Willebrand factor fiber generation are potent inhibitors of hematogenous but not lymphatic metastasis. Oncotarget. 2016;7(42):68527–45. https://doi.org/10.18632/oncotarget.11832.
50. Brill A., Fuchs T.A., Savchenko A.S. et al. Neutrophil extracellular traps promote deep vein thrombosis in mice. J Thromb Haemost. 2012;10(1):136–44. https://doi.org/10.1111/j.1538-7836.2011.04544.x.
51. Staessens S., Denorme F., François O. et al. Structural analysis of ischemic stroke thrombi: histological indications for therapy resistance. Haematologica. 2020;105(2):498–507. https://doi.org/10.3324/haematol.2019.219881.
52. Verhenne S., Denorme F., Libbrecht S. et al. Platelet-derived VWF is not essential for normal thrombosis and hemostasis but fosters ischemic stroke injury in mice. Blood. 2015;126(14):1715–22. https://doi.org/10.1182/blood-2015-03-632901.
53. Sonneveld M., de Maat M.P.M., Leebeek F.W.G. Von Willebrand factor and ADAMTS13 in arterial thrombosis: a systemic review and metaanalysis. Blood Rev. 2014;28(4):167–78. https://doi.org/10.1016/j.blre.2014.04.003.
54. McCabe D.J., Murphy S.J., Starke R. et al. Relationship between ADAMTS13 activity, von Willebrand factor antigen levels and platelet function in the early and late phases after TIA or ischaemic stroke. J Neurol Sci. 2015;348(1–2):35–40. https://doi.org/10.1016/j.jns.2014.10.035.
55. Kovacevic K.D., Mayer F.J., Jilma B. et al. Von Willebrand factor antigen levels predict major adverse cardiovascular events in patients with carotid stenosis of the ICARAS study. Atherosclerosis. 2019;290:31–6. https://doi.org/10.1016/j.atherosclerosis.2019.09.003.
56. Andersson H., Siegerink B., Luken B. et al. High VWF, low ADAMTS13, and oral contraceptives increase the risk of ischemic stroke and myocardial infarction in young women. Blood. 2012;119(6):1555–60. https://doi.org/10.1182/blood-2011-09-380618.
57. Qu L., Jiang M., Qiu W. et al. Assessment of the diagnostic value of plasma levels, activities, and their ratios of von Willebrand factor and ADAMTS13 in patients with cerebral infarction. Clin Appl Thromb Hemost. 2016;22(3):252–9. https://doi.org/10.1177/1076029615583347.
58. Donkel S.J., Benaddi B., Dippel D.W.J. et al. Prognostic hemostasis biomarkers in acute ischemic stroke: a systematic review. Arterioscler Thromb Vasc Biol. 2019;39(3):360–72. https://doi.org/10.1161/ATVBAHA.118.312102.
59. Peeling R.W., Heymann D.L., Teo Y.-Y., Garcia P.J. Diagnostics for COVID19: moving from pandemic response to control. Lancet. 2022;399(10326):757–68. https://doi.org/10.1016/S0140-6736(21)02346-1.
60. Huang C., Wang Y., Li X. et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020;395(10223):497–506. https://doi.org/10.1016/S0140-6736(20)30183-5.
61. Helms J., Tacquard C., Severac F. et al. High risk of thrombosis in patients with severe SARS-CoV-2 infection: a multicenter prospective cohort study. Intensive Care Med. 2020;46(6):1089–98. https://doi.org/10.1007/s00134-020-06062-x.
62. Tang N., Li D., Wang X., Sun Z. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J Thromb Haemost. 2020;18(4):844–7. https://doi.org/10.1111/jth.14768.
63. Loo J., Spittle D.A., Newnham M. COVID-19, immunothrombosis and venous thromboembolism: biological mechanisms. Thorax. 2021;76(4):412–20. https://doi.org/10.1136/thoraxjnl-2020-216243.
64. Cordoro K.M., Reynolds S.D., Wattier R., McCalmont T.H. Clustered cases of acral perniosis: clinical features, histopathology, and relationship to COVID-19. Pediatr Dermatol. 2020;37(3):419–23. https://doi.org/10.1111/pde.14227.
65. Zuo Y., Yalavarthi S., Shi H. et al. Neutrophil extracellular traps (NETs) as markers of disease severity in COVID-19. medRxiv. 2020 Apr 14;2020.04.09.20059626. https://doi.org/10.1101/2020.04.09.20059626. Preprint.
66. Seth R., McKinnon T.A.J., Zhang X.F. Contribution of the von Willebrand factor/ADAMTS13 imbalance to COVID-19 coagulopathy. Am J Physiol Heart Circ Physiol. 2022;322(1):H87–H93. https://doi.org/10.1152/ajpheart.00204.2021.
67. Favaloro E.J., Henry B.M., Lippi G. Increased VWF and decreased ADAMTS-13 in COVID-19: creating a milieu for (micro)thrombosis. Semin Thromb Hemost. 2021;47(4):400–18. https://doi.org/10.1055/s-0041-1727282.
68. Xu X., Feng Y., Jia Y. et al. Prognostic value of von Willebrand factor and ADAMTS13 in patients with COVID-19: A systematic review and metaanalysis. Thromb Res. 2022;218:83–98. https://doi.org/10.1016/j.thromres.2022.08.017.
69. Бицадзе В.О., Хизроева Д.Х., Гри Ж.-К. и др. Патогенетическое и прогностическое значение воспаления и нарушений в оси ADAMTS13/vWF у больных тяжелой формой COVID-19. Акушерство, Гинекология и Репродукция. 2022;16(3):228–43. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.327.
Об авторах
К. Н. ГригорьеваРоссия
Григорьева Кристина Николаевна – ассистент кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
В. О. Бицадзе
Россия
Бицадзе Виктория Омаровна – д.м.н., профессор РАН, профессор кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 6506003478
Researcher ID: F-8409-2017
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Д. Х. Хизроева
Россия
Хизроева Джамиля Хизриевна – д.м.н., профессор кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 57194547147
Researcher ID: F-8384-2017
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
В. И. Цибизова
Россия
Цибизова Валентина Ивановна – к.м.н., врач акушер-гинеколог НИЛ оперативной гинекологии Института перинатологии и педиатрии, врач отделения функциональной ультразвуковой диагностики
197341 Санкт-Петербург, ул. Аккуратова, д. 2
М. В. Третьякова
Россия
Третьякова Мария Владимировна – к.м.н., врач акушер-гинеколог, ассистент кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Д. В. Блинов
Россия
Блинов Дмитрий Владиславович – к.м.н., руководитель по медицинским и научным вопросам, Институт Превентивной и Социальной Медицины; врач-невролог, Клинический Госпиталь Лапино, ГК «Мать и Дитя»
Scopus Author ID: 6701744871
Researcher ID: E-8906-2017
RSCI: 9779-8290
127006 Москва, ул. Садовая-Триумфальная, д. 4–10
143081 Московская область, Одинцовский район, Лапино, 1-е Успенское шоссе, д. 111
Л. Л. Панкратьева
Россия
Панкратьева Людмила Леонидовна – д.м.н., руководитель научно-клинического центра ГБУЗ «Городская клиническая больница № 67 имени Л.А. Ворохобова Департамента здравоохранения города Москвы»; врач-неонатолог, врач-гематолог, доцент, профессор кафедры педиатрии и организации здравоохранения ФГБУ «Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева»
Scopus Author ID: 7006391091
Author ID: 697284
123423 Москва, ул. Саляма Адиля, д. 2/44
117997 Москва, ул. Саморы Машела, д. 1
Н. Р. Гашимова
Россия
Гашимова Нилуфар Рамиль кызы – аспирант кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Ф. Э. Якубова
Россия
Якубова Фидан Эльчин кызы – клинический ординатор кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
А. С. Антонова
Россия
Антонова Александра Сергеевна – ассистент кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Ж.-К. Гри
Россия
Гри Жан-Кристоф – д.м.н., профессор кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова ФГАОУ ВО Первый Московский государственный медицинский университет имени И.М. Сеченова Министерства здравоохранения Российской Федерации (Сеченовский Университет); профессор гематологии, университет Монпелье; иностранный член РАН
Researcher ID: AAA-2923-2019
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
34090, Франция, Монпелье, ул. Огюста Бруссоне, д. 163
И. Элалами
Россия
Элалами Исмаил – д.м.н., профессор кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова ФГАОУ ВО Первый Московский государственный медицинский университет имени И.М. Сеченова Министерства здравоохранения Российской Федерации (Сеченовский Университет); профессор медицинского Университета Сорбонны; директор гематологии Центра Тромбозов, Госпиталь Тенон
Scopus Author ID: 7003652413
Researcher ID: AAC-9695-2019
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
75006, Франция, Париж, Улица медицинского факультета, д. 12
75020, Франция, Париж, Китайская улица, д. 4
А. Д. Макацария
Россия
Макацария Александр Давидович – д.м.н., профессор, академик РАН, зав. кафедрой акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 57222220144
Researcher ID: M-5660-2016
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Рецензия
Для цитирования:
Григорьева К.Н., Бицадзе В.О., Хизроева Д.Х., Цибизова В.И., Третьякова М.В., Блинов Д.В., Панкратьева Л.Л., Гашимова Н.Р., Якубова Ф.Э., Антонова А.С., Гри Ж., Элалами И., Макацария А.Д. Прогностическое значение фактора фон Виллебранда в клинической практике. Акушерство, Гинекология и Репродукция. 2022;16(5):588-599. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.363
For citation:
Grigoreva K.N., Bitsadze V.O., Khizroeva J.Kh., Tsibizova V.I., Tretyakova M.V., Blinov D.V., Pankratyeva L.L., Gashimova N.R., Yakubova F.E., Antonova A.S., Gris J., Elalamy I., Makatsariya A.D. Prognostic value of von Willebrand factor in clinical practice. Obstetrics, Gynecology and Reproduction. 2022;16(5):588-599. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.363

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































