Перейти к:
Карциносаркома яичников (обзор литературы)
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.295
Аннотация
Введение. Несмотря на то что карциносаркома яичников (КСЯ) встречается крайне редко, данное заболевание имеет огромное медико-социальное значение с учетом очень высокой степени общей смертности, рецидивности, метастазирования, экономических расходов на ведение пациентов.
Цель: обобщить современные научные данные о КСЯ.
Материалы и методы. Стратегия поиска полнотекстовых статей на английском языке, опубликованных в PubMed/MEDLINE, Scopus, Web of Science, Google Scholar, была основана на следующих ключевых словах: «ovarian carcinosarcoma», «etiology and pathogenesis», «epidemiology», «classification», «clinical picture», «diagnosis», «treatment». Глубина поиска составила 2010–2022 гг., приоритет был сделан на глубину поиска за последние 5 лет (2017–2022 гг.).
Результаты. Обнаружены 48 статей на английском языке, опубликованные с 2016 по 2022 гг., из них 47 (97,9 %) статей опубликованы за последние 5 лет. Научное знание представлено исследованиями с малой выборкой пациентов и с невысокой доказательной базой. Результаты анализа выявленных публикаций показали ограниченность, фрагментированность и противоречивость научных данных как в вопросах этиологии, патогенеза и лечения, так и влияния стадий КСЯ, возраста и других факторов риска на вероятность рецидивов.
Заключение. Отсутствие обширных клинических исследований и наличие огромного количества спорных моментов можно объяснить малой распространенностью и сложным патогенезом КСЯ. Тем не менее полученные в ходе обобщения научного знания результаты дают реальное представление о современном состоянии мировой науки о данном медико-социальном заболевании и могут быть использованы врачами для улучшения диагностики и лечения пациенток с КСЯ.
Ключевые слова
Для цитирования:
Бейшембаев А.М., Жорданиа К.И., Чой Э.Д., Туркменов А.А., Молдобекова А.К. Карциносаркома яичников (обзор литературы). Акушерство, Гинекология и Репродукция. 2022;16(5):575-587. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.295
For citation:
Beishembaev A.M., Zhordania K.I., Choi E.D., Turkmenov A.A., Moldobekova A.K. Ovarian carcinosarcoma (a literature review). Obstetrics, Gynecology and Reproduction. 2022;16(5):575-587. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.295
Введение / Introduction
Карциносаркома яичников (КСЯ) – злокачественная опухоль, состоящая из карциноматозного (эпителиального) и саркоматозного (мезенхимального) компонентов [1]. Хотя КСЯ составляет 1–3 % в общей структуре раковых заболеваний яичников [2], 5-летняя выживаемость не превышает 30 % [3], а к моменту выявления опухоли у 75 % пациентов диагностируется III–IV стадия заболевания [4–7].
Современное состояние научных знаний о различных аспектах КСЯ является ограниченным и противоречивым. КСЯ – редкое заболевание, в связи с чем в мировой литературе практически нет крупных рандомизированных исследований (в основном, все исследования представлены небольшими клиническими случаями с невысокой доказательной базой).
Нет консенсуса практически ни по одному из аспектов КСЯ. В этиологии КСЯ предложены различные противоречивые теории – конверсионная (моноклональная), комбинационная (моноклональная), коллизионная (биклональная) [1].
В патогенезе КСЯ нет единого понимания по поводу того, какой именно опухолевый компонент (карциноматозный/гомологичный или саркоматозный/ гетерологичный) представляет более пагубное патогенетическое влияние. Так, в одной ретроспективной серии из 5 клинических случаев было отмечено, что именно саркоматозный гетерологичный опухолевый компонент оказывал гораздо более пагубное патогенетическое влияние [4]. Накоплена невысокая доказательная база онкогенов и генов-супрессоров, оказывающих патогенетическое влияние на КСЯ [8]. Это мезотелин [9], микроРНК [10], CUL4B (англ. cullin4B; куллин 4В) [11], DDP9 (англ. dipeptidylpeptidase 9; дипептидилпептидаза 9) [12]. КСЯ приводит к высокой распространенности рецидивов, отсюда актуальны исследования, насколько стадия КСЯ, возраст (и другие факторы) могут вызывать рецидивы [13].
Нет единого консенсуса и по лечению КСЯ [14]. Первичное хирургическое лечение КСЯ включает циторедуктивную хирургию, после которой следует химиотерапия [15]. В химиотерапии терапевтическим агентом первой линии являются препараты платины [16]. Однако общий процент клинического ответа на химиотерапию, основанную на препаратах платины, составляет 25–70 % при средней общей выживаемости в 8–16 мес [14]. Проблема также заключается в увеличивающейся резистентности онкогенов к препаратам платины [17]. Сохраняется высокая потребность в клинических исследованиях альтернативных препаратов второй линии, но доказательная база их эффективности невысокая [14] с процентом объективных клинических ответов в диапазоне 10–25 % [17]. Нет консенсуса по поводу исследуемых терапевтических препаратов второй линии, таких как, например, пазопаниб [18][19], пембролизумаб [14], сацитузумаб говитекан [20], олапариб [21].
Следует отметить актуальность исследований новых альтернативных препаратов не только с точки зрения клинических показателей, таких как общая выживаемость, выживаемость без рецидивов, но также следует отметить и экономическую актуальность (и это в условиях мировой экономической нестабильности и наличия большого количества стран с невысоким уровнем дохода, где сконцентрирован огромный процент мирового населения). В этой связи, положительные результаты исследования химиотерапевтического средства олапариба при раке яичников позволили испанской национальной системе здравоохранения сэкономить 5,4 млн евро в пятилетней перспективе [6]. Несмотря на то что Испания является страной с высоким уровнем экономического благосостояния, данное исследование демонстрирует экономическую актуальность новых препаратов терапии и для стран с более низким уровнем благосостояния.
Следовательно, обобщение современных научных данных о КСЯ является актуальным и полезным не только для исследователей и практикующих врачей (которые имеют прямое отношение к КСЯ), но и для управленцев в национальных системах здравоохранения.
Цель: обобщить современные научные данные о КСЯ.
Материалы и методы / Materials and Methods
Критерии отбора / Selection criteria
Обзор литературы был проведен согласно критериям PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses) с 2010 по 2022 гг., приоритет был сделан на глубину поиска за последние 5 лет (2017–2022 гг.). Были использованы поисковые базы данных PubMed/MEDLINE, Scopus, Web of Science, Google Scholar. Стратегия поиска статей на английском языке была основана на следующих ключевых словах: «ovarian carcinosarcoma», «etiology and pathogenesis», «epidemiology», «classification», «clinical picture», «diagnosis», «treatment». Все статьи, написанные не на английском языке, опубликованные до 2016 г., дублирующие друг друга, статьи, не являющиеся полнотекстовыми, не были включены в настоящий обзор.
В процесс поиска и отбора литературы были привлечены 2 независимых эксперта. Все конфликтные вопросы по отбору данных решались с дополнительным участием третьего эксперта. Первичное количество статей составило 21519. В ходе данного этапа было отсеяно 5519 статей по причине дублирования, осталось 16000. На основе просмотра названий и резюме далее было отсеяно еще 15457 статей. Для оценки соответствия критериям включения было изучено 543 полнотекстовых статьи, из которых далее было отсеяно 495 статей по следующим причинам: n = 194 (методологическая база), n = 231 (недостаточность клинических данных), n = 34 (преждевременная остановка исследований), n = 26 (дублирование), n = 10 (не на английском).
В пул обобщаемых публикаций вошло 48 полнотекстовых статей. Из них 3 статьи не содержали результаты оригинальных исследований: одна статья была панельным опросом, одна статья – систематическим обзором, одна статья – международным проектом по созданию специального геномного атласа. Таким образом, из 48 полнотекстовых статей 45 содержали результаты оригинальных исследований.
Результаты / Results
В обзор вошли 48 полнотекстовых статей, из них 47 (97,9 %) статей опубликованы за последние 5 лет (7 – в 2017 г., 8 – в 2018 г., 13 – в 2019 г., 13 – в 2020 г., 5 – в 2021г., 1 – в 2022 г.) и 1 – в 2016 г. (рис. 1).
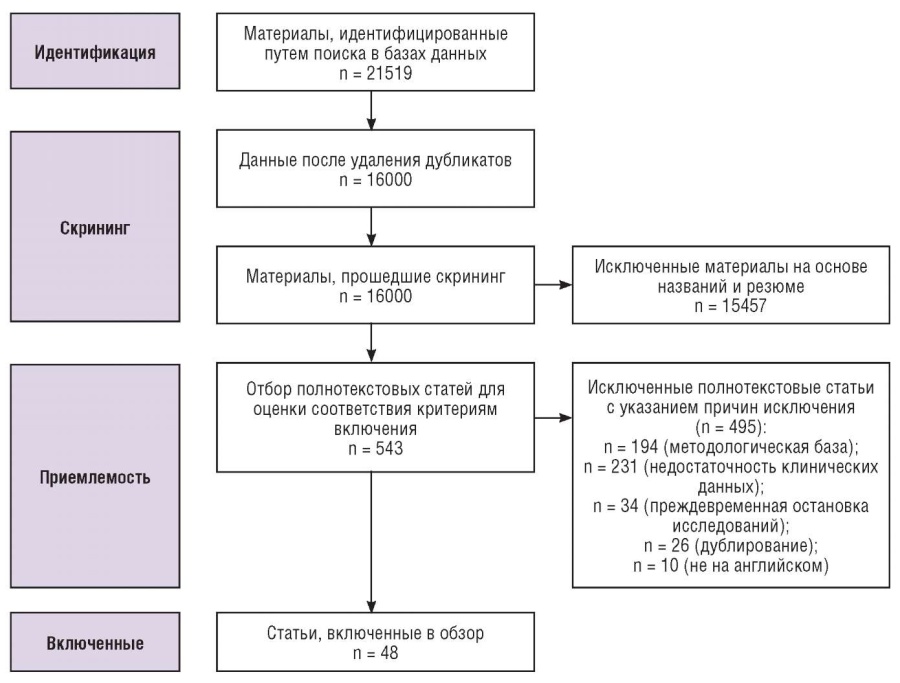
Рисунок 1. Блок-схема отбора публикаций в соответствии с инструкцией PRISMA.
Figure 1. Block diagram for publication selection in accordance with the PRISMA guidelines.
Современное состояние обобщенного научного знания о КСЯ характеризуется наличием большого числа пробелов и противоречивых результатов исследований с невысокой доказательной базой. Все это касается различных сторон КСЯ:
- этиологии (конверсионной/комбинационной/коллизионной этиологических теорий);
- патогенеза (карциноматозного/гомологичного и саркоматозного/гетерологичного опухолевых компонентов, онкогенов и генов-супрессоров, таких как мезотелин, микроРНК, CUL4B, PD-L1 – CD8 Т-лимфоциты, DDP9), влияния различных патогенетических факторов (стадии КСЯ, возраста, статуса курения на вероятность рецидивов);
- лечения (терапевтических агентов первой линии (препаратов на основе платины), препаратов второй линии, таких как пазопаниб, пембролизумаб, сацитузумаб говитекан, олапариб).
Эпидемиология / Epidemiology
Карциносаркома яичников встречается в 1–3 % при злокачественных заболеваниях яичников. Эпителиальный (карциноматозный) компонент опухоли составляет 90 %, а серозный яичниковый рак повышенной тяжести составляет 70 % в карциноматозном компоненте [6].
Общая 5-летняя выживаемость не превышает 30 % [3]. По некоторым сведениям, КСЯ распространена в основном среди женщин в постменопаузе со средним возрастом 65,5 лет [22]. По данным проекта Surveillance, Epidemiology, and Results (Эпиднадзор, эпидемиология и конечные результаты), КСЯ составляет 0,19 на 100 тыс. женщин [14]. На момент поступления пациенток в отделения хирургии 75 % из них уже находятся на III–IV стадии метастазирования [4]. Метастазы лимфоузлов даже первой стадии наблюдаются до 60 % случаях. На момент диагностики в 90 % случаев происходит проникновение КСЯ в другие органы [2]. В двухлетней перспективе в 80 % случаев происходят рецидивы КСЯ, несмотря на проводимую терапию [23].
Этиология и патогенез / Etiology and pathogenesis
Предложены 3 различные этиологические теории возникновения КСЯ: 1) конверсионная теория (моноклональная) – эволюция карциномы приводит к саркоме; 2) комбинационная теория (моноклональная) – саркома и карцинома возникают в результате единой прекурсорной клетки; 3) коллизионная теория (биклональная) – карцинома и саркома возникают независимо друг от друга. Если по данным одних исследователей наиболее вероятна теория комбинационная [1], то по другим данным – конверсионная [24]. Моноклональные теории возникновения КСЯ (комбинационная и конверсионная) могут не быть взаимоисключающими [25]. Одним из самых распространенных аргументов в пользу того, что моноклональные теории более вероятны, чем биклональная, заключается в мутировании гена p53, приводящее к чрезмерной экспрессии, и иммунологическом окрашивании гена p53 как в карциноматозном, так и саркоматозном компоненте (наблюдается стабильное соответствие между двумя компонентами КСЯ в том плане, что экспрессия и иммунологическое окрашивание в обоих компонентах либо положительное, либо отрицательное) [13].
Актуальны споры о патогенезе КСЯ. Ведутся активные дискуссии о том, что представляет более пагубное патогенетическое влияние – карциноматозный/ гомологичный опухолевый компонент или саркоматозный/гетерологичный. Так, в одной ретроспективной серии 5 клинических случаев было отмечено, что именно саркоматозный гетерологичный опухолевый компонент оказывал гораздо более пагубное патогенетическое влияние [4]. В другом исследовании гетерологичный компонент опухоли был также связан с гораздо более серьезным патогенетическим ухудшением, которое привело к плохим показателям выживания без прогрессирования (р = 0,02) и общей выживаемости (р = 0,02) [26]. На процесс патогенеза КСЯ оказывают влияние различные онкогены и гены-супрессоры [27][28], однако степень доказанности крайне низкая [8].
Онкомолекула мезотелин является перспективной патогенетической мишенью в случае КСЯ [9][28]. В исследовании онкомолекулы мезотелина были изучены все существующие виды раковых заболеваний и процент экспрессии онкомолекулы мезотелина. С помощью иммуногистохимии были изучены тканевые микрочипы с включением 12679 опухолей из 122 опухолевых видов и 76 здоровых органов. Наибольшая экспрессия онкомолекулы мезотелина обнаружена в первую очередь в яичниковых карциномах (в серозной – 97 %, светло-клеточной – 83 %, эндометриоидной – 77 %, слизистой – 71 %, карциносаркоме – 65 %). Отсюда последовал вывод о том, что онкомолекулы мезотелина являются перспективными мишенями в основном при нескольких, а не при всех видах раковых заболеваниях [29]. Тем не менее биологический механизм патогенетического влияния онкомолекулы мезотелина на КСЯ остается малоизученным [30–33].
Говоря про систему онкогенов и генов-супрессоров, крайне мало известно о роли PD-L1-пути (англ. рrogrammed death-ligand 1; лиганд рецептора программируемой клеточной гибели 1). Выдвигается гипотеза, что PD-L1-путь подавляет Т-клетки, что резко снижает возможности этих клеток в борьбе с опухолевыми клетками.
Выдвигаются утверждения о патогенетической роли микроРНК при КСЯ [34]. Исследована связь между микроРНК под кодовым названием MIR-502 (англ. microRNA 502; микрорибонуклеиновая кислота 502) и патогенетическими процессами при КСЯ. Показано, что высокая экспрессия MIR-502 (высокий защитный фенотип) повышает общую выживаемость пациентов, а более низкая снижает; таким образом, MIR-502 может служить биомаркером при КСЯ. MIR502 расположена в третьем интроне гена CLCN5 (англ. chloride voltage-gated channel 5; хлоридный канал 5), показывая положительную корреляцию с CLCN5 среди пациентов с КСЯ. При КСЯ экспрессия MIR-502 снижается, на что влияет высокая экспрессия онкогенов CCND1 (англ. cyclin D1; циклин Д1) [15][16], FGF1 (англ. fibroblast growth factor 1; фактор роста фибробластов 1), MYC (англ. myelocytomatosis; миелоцитоматоз) [35], GLI2 (англ. glioma 2; глиома 2) в Hippo (англ. сокр. hippopotamus; гиппопотамус) сигнальном пути [10].
Влияние гена CUL4B (англ. cullin-4B, куллин 4В) на онкогенезис описано в современной литературе [36]. Онкоген CUL4B подавляет экспрессию генов-супрессоров, таких как PTEN (англ. Phosphatase and TENsion; фосфатаза и тенсин), IGFBP3 (англ. insulin-like growth factor-binding protein 3; инсулиноподобный белок 3, связывающий фактор роста) через единое убиквитирование H2AK119 (англ. histone H2AK119; гистон H2AK119). Однако влияние онкогена CUL4B на патогенетическое прогрессирование при КСЯ изучено только в одном недавнем исследовании [37]. Высокая экспрессия гена CUL4B напрямую связана с ухудшением патогенетической картины и прогрессированием заболевания. CUL4B следует рассматривать как потенциальную онкогенетическую мишень в адъювантной терапии КСЯ. Патогенетическое влияние PD-L1 – CD8+ Т-лимфоцитов впервые изучено в исследовании [8] с участием 19 пациенток с КСЯ (рис. 2).
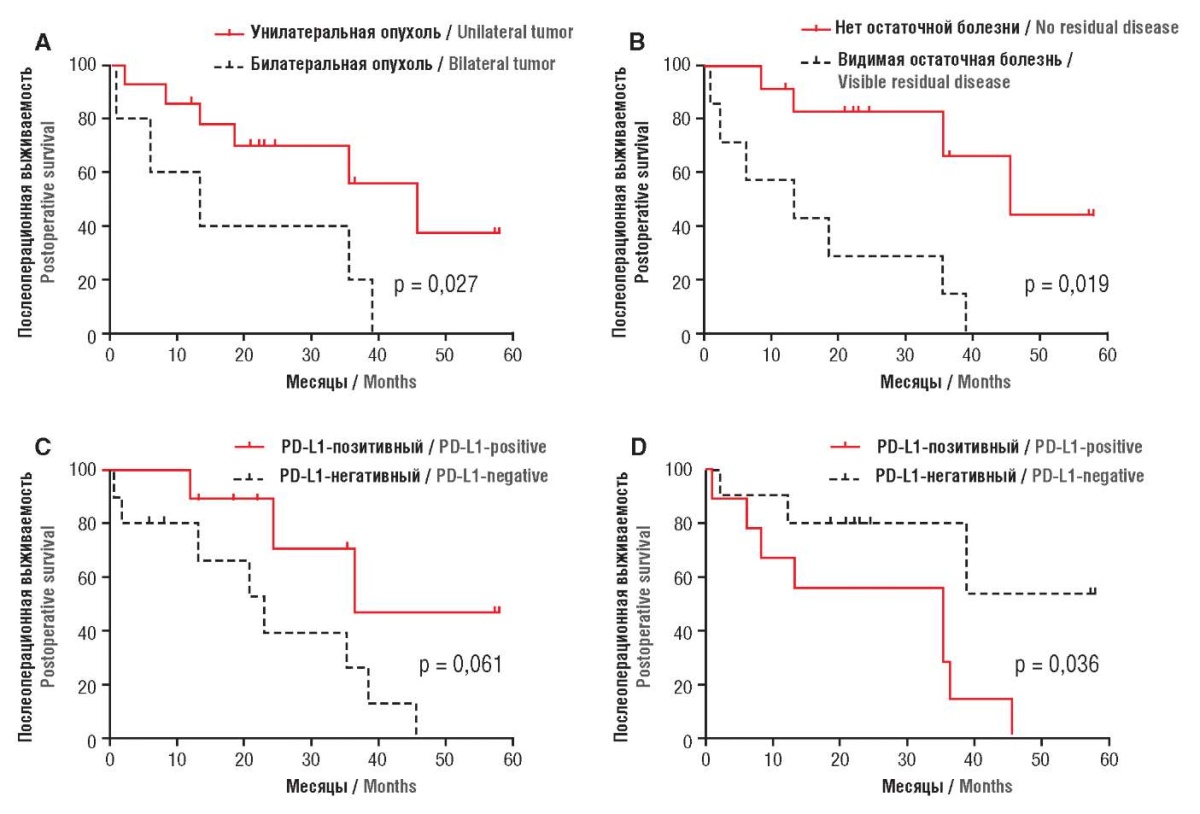
Рисунок 2. Кривые выживаемости Каплана–Мейера пациентов с карциносаркомой яичников [8].
Figure 2. Kaplan–Meier survival curves for patients with ovarian carcinosarcoma [8].
Рисунки 2A и 2B показывают послеоперационную выживаемость пациентов в зависимости от локализации опухоли (унилатеральная или билатеральная), остаточная болезнь (в сравнении с его отсутствием), соответственно. Билатеральные опухоли и наличие остаточной болезни были факторами ухудшения прогноза послеоперационной выживаемости (p = 0,019 и p = 0,027, логарифмический ранговый критерий). Рисунки 2C и 2D показывают кривые послеоперационной выживаемости при мезенхимальной PD-L1позитивной и PD-L1-негативной экспрессии. Интраэпителиальная PD-L1-позитивная экспрессия показывала более благоприятную послеоперационную выживаемость, чем PD-L1-негативная (p = 0,061). Обнаружена статистически значимая разница в послеоперационной выживаемости между мезенхимальной PD-L1-позитивной и PD-L1-негативной экспрессией (p = 0,036).
Умерло 11 (57,9 %) пациенток, выжило 8 (42,1 %). Среднее время послеоперационного наблюдения составило 22,2 мес (диапазон – 1,0–58,0 мес). Средняя общая выживаемость составила 35,5 мес (диапазон – 10,6–60,4 мес), общая трехгодичная выживаемость составила 44,3 %. Девятнадцать пациенток с интраэпителиальной PD-L1-позитивной экспрессией показали более благоприятную послеоперационную выживаемость, чем пациенты с PD-L1-негативной (p = 0,061; рис. 2C). Трехгодичная послеоперационная выживаемость при интраэпителиальной PD-L1-позитивной и PD-L1-негативной экспрессии составила 56,3 и 33,3 %, соответственно. Послеоперационная выживаемость в схожем временном разрезе при мезенхимальной PD-L1-позитивной и PD-L1-отрицательной экспрессии составила 22,2 и 78,8 %, соответственно [8].
Девятнадцать пациенток с интраэпителиальными и мезенхимальными CD8-позитивными тканями (рис. 3) показали более благоприятную послеоперационную выживаемость, чем с CD8-негативными (p = 0,382, рис. 3D и p = 0,024, рис. 3E, соответственно). Трехгодичная послеоперационная выживаемость пациентов с интраэпителиальными CD8-позитивными и CD8-негативными тканями составила 66,7 и 28,6 %, соответственно, в случае с пациентами с мезенхимальными CD8-позитивными и CD8-негативными тканями – 51,6 и 20,0 %, соответственно. Трехгодичная послеоперационная выживаемость пациенток при мезенхимальных CD8-позитивных тканях с унилатеральными и билатеральными опухолями составила 55,0 и 50,0 %, соответственно (p = 0,524). Трехгодичная послеоперационная выживаемость при унилатеральных и билатеральных опухолях мезенхимальных CD8-негативных тканях составила 50,0 и 0 %, соответственно (p = 0,277) [8].
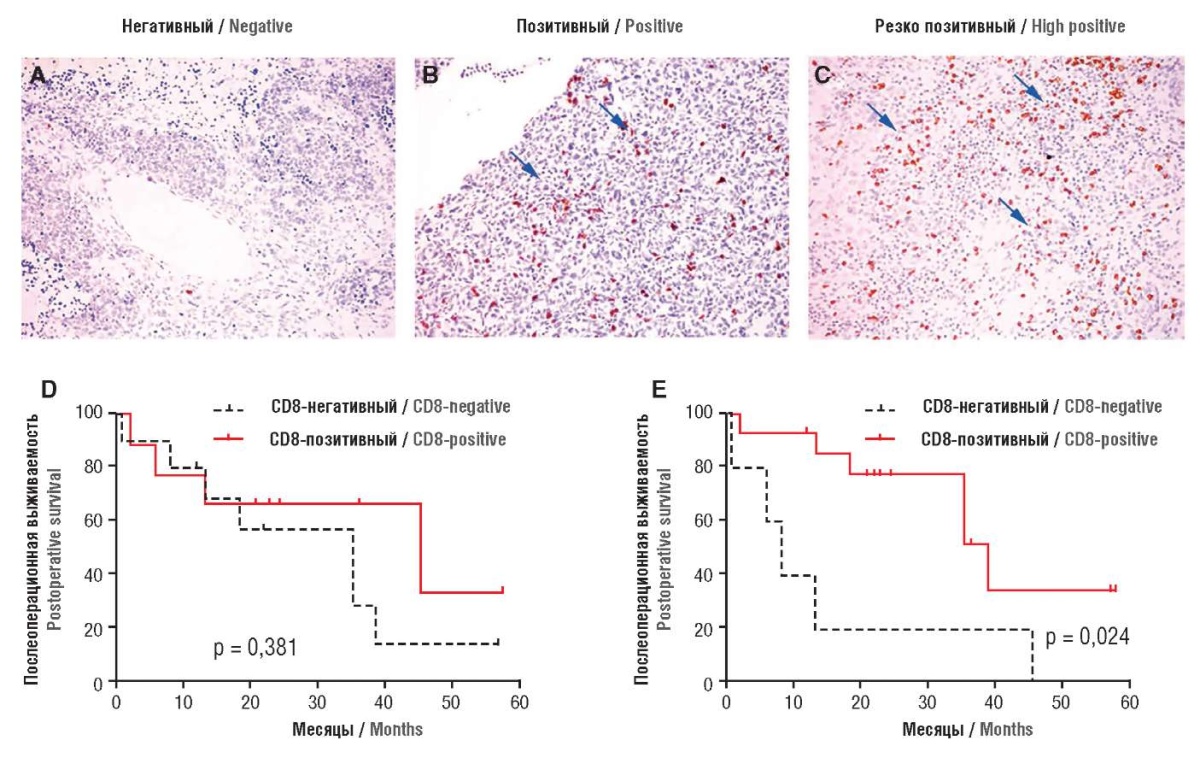
Рисунок 3. Репрезентативное иммуногистохимическое окрашивание CD8-положительных T-лимфоцитов в опухолевой ткани (А, В, С); анализ Каплана–Мейера CD8-позитивных T-лимфоцитов и послеоперационная выживаемость (D, Е) [8].
Примечание: негативное иммуногистохимическое (A) и позитивное (B, C) окрашивание (стрелками показаны интраопухолевые CD8-позитивные T-клетки, увеличение ×200); кривые послеоперационной выживаемости Каплана–Мейера при CD8-позитивных и CD8-негативных T-интраэпителиальных тканях (D); кривые послеоперационной выживаемости Каплана–Мейера при CD8-позитивных и CD8-негативных T-мезенхимальных тканях (E).
Figure 3. Representative immunohistochemical staining of intra-tumoral CD8-positive T-lymphocytes (A, B, C); Kaplan–Meier analysis of CD8-positive T-lymphocytes and postoperative survival (D, E) [8].
Note: negative immunohistochemical (A) and positive (B, C) staining (arrows indicate intra-tumoral CD8-positive T-cells, magnification ×200); Kaplan–Meier postoperative survival curves for CD8-positive and CD8-negative T-intraepithelial tissues (D); Kaplan–Meier postoperative survival curves for CD8-positive and CD8-negative T-mesenchymal tissues (E).
Геномные мутации – явление нередкое при различных раковых заболеваниях яичников. Такие мутации потенциально приводят к деактивации генов супрессоров, чья функция заключается в подавлении онкогенов. Исследование «Геномный раковый атлас» (англ. The Cancer Genome Atlas, TCGA) обнаружило 113 фокальных изменений числа копий ДНК, что только подтверждает тезис о геномных мутациях и их патогенетическое влияние [38]. В данном контексте в одном исследовании впервые изучено патогенетическое влияние гибридного гена DDP9 (англ. dipeptidyl peptidase 9; дипептидилпептидаза 9) на повышение риска рецидивов серозной карциномы яичников высокой степени злокачественности [12]. Гибридный ген включает в себя компоненты двух предыдущих независимых генов, подвергшихся геномному слиянию. Были использованы 2 геномных подхода – микрочипы на уровне экзона и транскриптомное секвенирование.
Вопрос о патогенезе затрагивает не только вышеперечисленные факторы, потому что на патогенез могут оказывать влияние и такие факторы, как стадия КСЯ, возраст и т. д. На этот счет нет единого мнения. КСЯ приводит к высокой распространенности рецидивов, отсюда актуальны исследования про то, насколько стадия КСЯ, возраст (и другие факторы) могут вызывать рецидивы [13].
В одноцентровом ретроспективном исследовании у 27 пациенток с КСЯ были изучены различные факторы патогенеза и их влияние на общую выживаемость и выживаемость без рецидивов. Запущенные стадии заболевания выявлены у 83 %: стадия I – у 7 %, II – у 11 %, III – у 48 %, IV – у 33%. Билатеральные яичниковые массы выявлены у 41 %, левосторонние придаточные/тазовые массы – у 33 %, правосторонние – у 26 %. Среди 27 пациенток 20 получили химиотерапию. Адъювантную химиотерапию получили 17 пациенток. Средняя выживаемость составила 23 мес (1–65 мес), трехгодичная общая выживаемость – 22 % (рис. 4). Не выявлено статистически значимой разницы между общей выживаемостью и стадией заболевания (рис. 5), между общей выживаемостью и билатеральными либо унилатеральными яичниковыми массами (p = 0,69). Общая выживаемость при адъювантной терапии была гораздо выше, чем при ее отсутствии (p = 0,69). Общая выживаемость при рецидивах (у 63 % пациенток) была гораздо хуже, чем при их отсутствии (12,8 и 29,3 мес; p < 0,05). Неожиданным результатом был тот факт, что рецидивы были выявлены у 45 % пациенток с историей курения (p = 0,028) в сравнении с 70,6 % некурящими пациентками. Не выявлена статистически значимая разница (p = 0,93) между стадией заболевания и рецидивами [16].
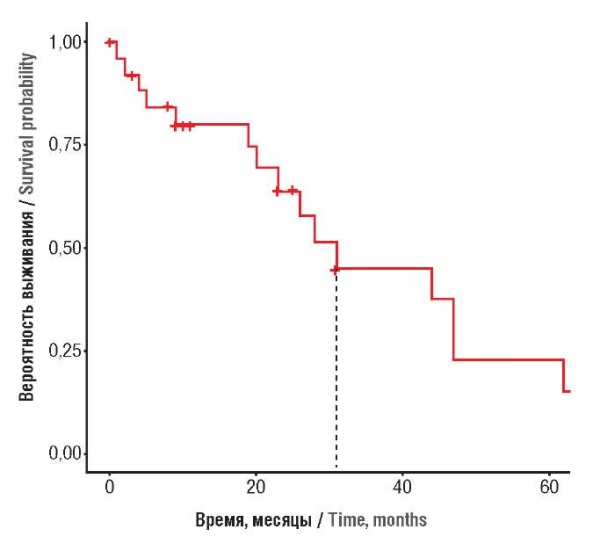
Рисунок 4. Общая выживаемость всех 27 пациенток, включенных в исследование [16].
Примечание: цифрами на оси Y обозначены различные вероятности общей выживаемости во временном диапазоне (в месяцах), указанного на оси X; пунктирной линией обозначено среднее значение (30 мес) во временном диапазоне.
Figure 4. Overall survival of 27 patients enrolled in the study [16].
Note: Y-axis – the numbers indicate various probabilities for temporal overall survival (in months) indicated on the X-axis; the dotted line denotes temporal mean value (30 months).
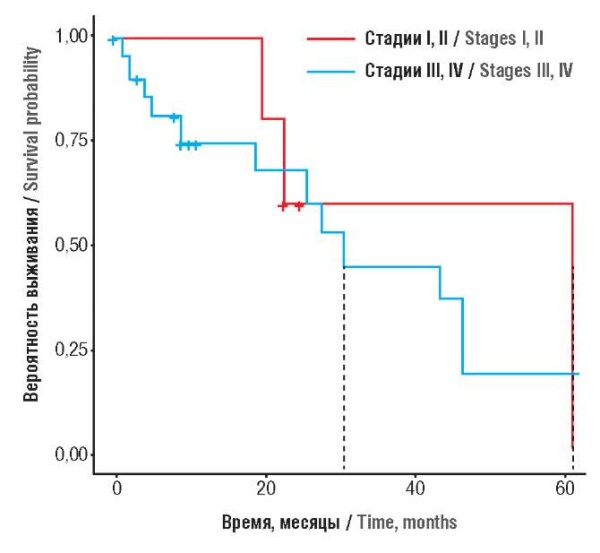
Рисунок 5. Влияние стадии заболевания на вероятность общей выживаемости [16].
Примечание: цифрами на оси Y обозначены различные вероятности общей выживаемости во временном диапазоне (в месяцах), указанного на оси X; не выявлено статистически значимой разницы между стадией заболевания и вероятностью общей выживаемости (p = 0,83).
Figure 5. An impact of the disease stage on the overall survival probability [16].
Note: the numbers on the Y-axis indicate varying time-dependent probabilities for overall survival (in months) indicated on the X-axis; no significant difference between disease stage and overall survival was found (p = 0.83).
Классификация / Classification
Гистологически КСЯ делится на карциноматозный (или эпителиальный – до 90 %) [26] и саркоматозный компоненты (рис. 6), где саркоматозный компонент также делится на гетерологичный и гомологичный подкомпоненты [25].
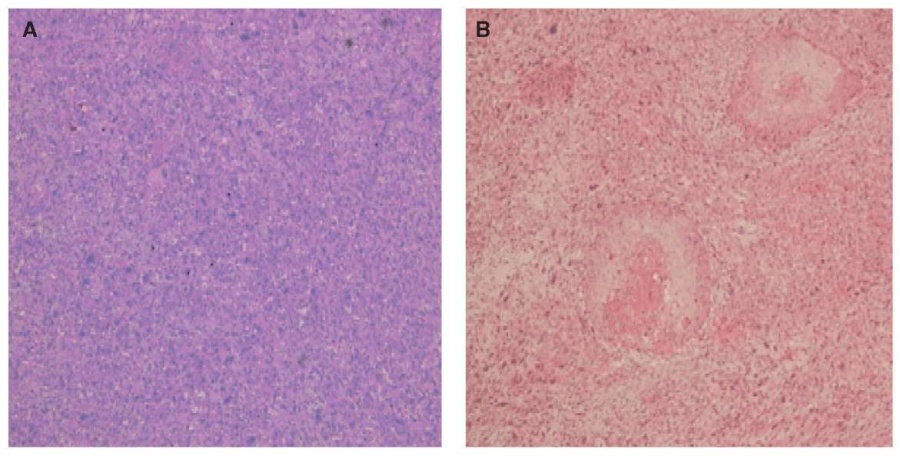
Рисунок 6. Гистология саркоматозного (А) и карциноматозного (В) компонентов карциносаркомы яичников [39].
Примечание: А – гистология саркоматозного компонента отличается основным преобладанием недифференцированной плеоморфной саркомой с ярко выраженной атипией клеток, ×100; В – гистология карциноматозного компонента представлена плоскоклеточной карциномой, ×100.
Figure 6. Histology examination of sarcomatous (A) and carcinomatous (B) components of ovarian carcinosarcoma [39].
Note: A – histology picture of sarcomatous component is characterized mainly by predominant undifferentiated pleomorphic sarcoma with prominent cell atypia, ×100; В – histology picture of carcinomatous component is represented by squamous cell carcinoma, ×100.
Клиническая картина / Clinical picture
Клинические признаки КСЯ неспецифические и могут включать тазовую и абдоминальную боль, раннее насыщение, головокружение, тошноту, вздутие, абдоминальное натяжение, желудочно-кишечные жалобы, потерю веса.
В серии 5 клинических случаев у всех 5 пациенток не были обнаружены специфические признаки КСЯ. У троих наблюдалась абдоминальная боль, у одной – слабость и потеря веса, у другой – асимптоматические симптомы, и масса КСЯ была обнаружена случайно [4].
Говоря про такой клинический признак КСЯ, как абдоминальная боль, в японском клиническом случае приводится случай, связанный с 73-летней женщиной, обратившейся в госпиталь по поводу болей в правом нижнем абдоминальном сегменте. В дальнейшем у нее было обнаружено правое тазовое твердое (солидное) опухолевое образование диаметром 8,0×5,0 см, происходящее из ее правого яичника [40].
Аналогичных случаев с указанием клинических симптомов КСЯ в современной литературе описано сравнительно мало, а причина заключается в малой распространенности заболевания (1–3 %) [6].
Диагностика / Diagnostics
Систематический обзор показал, что мультимодальный скрининг постменопаузальных женщин экономит 9800–81400 евро/QALY (англ. quality adjusted life-year; год жизни с поправкой на качество), генетическое диагностическое исследование – 54000 евро/QALY [41]. Однако на сегодня в диагностике КСЯ очень много «белых (неясных) пятен».
Лабораторная диагностика / Laboratory diagnostics
Повышение экспрессии специфического онкомаркера СА-125 (англ. Cancer Antigen 125; раковый антиген 125) связано с КСЯ. В исследовании уровень СА125 составил 810,75 Ед/мл [4]. Повышение экспрессии онкомаркера СА-153 связано с различными видами онкоболезней. У 80 % пациентов с КСЯ обнаружен повышенный уровень СА-153 [4].
В ходе анализа 19789 клинико-лабораторных результатов сыворотки показана прямая зависимость между высоким уровнем СА-153 и раком яичников [42].
Визуальная диагностика / Visual diagnostics
Как правило, КСЯ – крупные тазовые образования, размерами 10×6 см, 33×22×10 см и т. д. Компьютерная томография (КТ) и магнитно-резонансная томография (МРТ) играют важную роль в визуальной диагностике, однако визуально-диагностических исследований КСЯ крайне мало, они представлены в основном клиническими случаями [39].
В одном клиническом исследовании целью было изучение радиологических данных КТ и МРТ: у 5 пациенток в 100 % случаев обнаружены крупные унилатеральные опухоли диаметром от 11 до 14 см (рис. 7, 8). Не выявлено фактов кальсификации. Твердые опухолевидные компоненты были изо-плотными. МРТ-диагностика проведена у 2 пациенток, у которых обнаружено кровоизлияние. Твердые опухолевидные компоненты в двух случаях показали рестриктивную диффузию. У пациентки 5 выявлена метастазы опухоли в тазовые органы, перитонеальные имплантаты, у пациенток 4 и 1 – тазовые перитонеальные имплантаты, у пациентки 3 – асцит и злокачественность клеток в правой плевральной полости, у пациентки 2 не выявлено метастазов в тазовые органы, метастазы также не выявлены в перитонеальные имплантаты и увеличенные лимфоузлы [4].
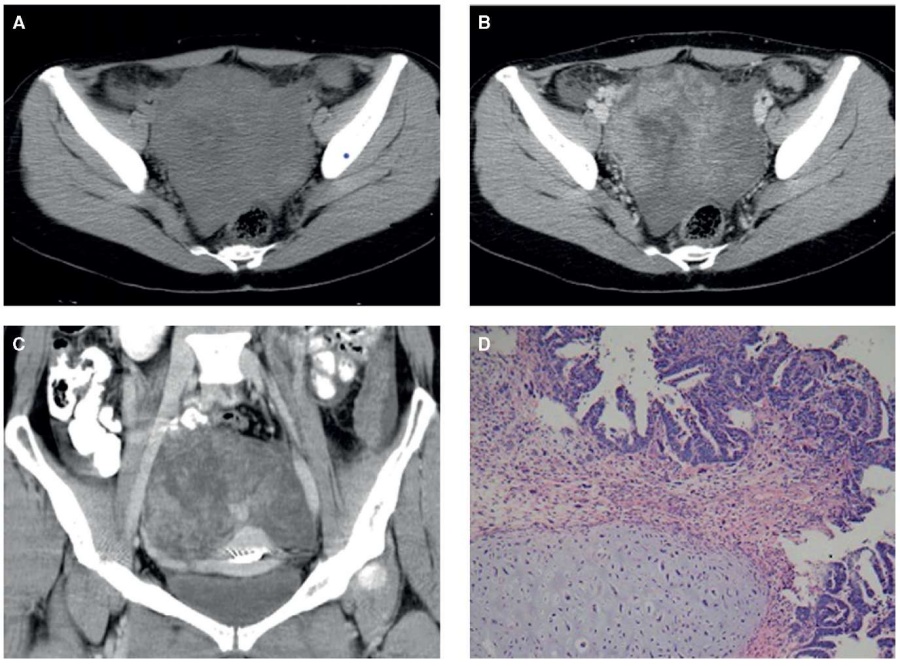
Рисунок 7. Карциносаркома яичников у 50-летней женщины с признаками слабости и потери веса после одного месяца: А – аксиальная компьютерная томография показала твердые образования с неравномерными цистическими площадями или некрозом; В, С – паренхима опухоли со средним гетерогенным увеличением после применения контрастного агента; D – опухоль одновременно карциноматозного и саркоматозного типов [4].
Figure 7. 50-year-old female patient with ovarian carcinosarcoma and signs of weakness and body weight loss one month later: A – axial computed tomography revealed solid masses with irregular cystic areas or necrosis; B, C – tumor parenchyma with average heterogeneous enlargement after contrast agent application; D – tumor of both carcinomatous and sarcomatous types [4].
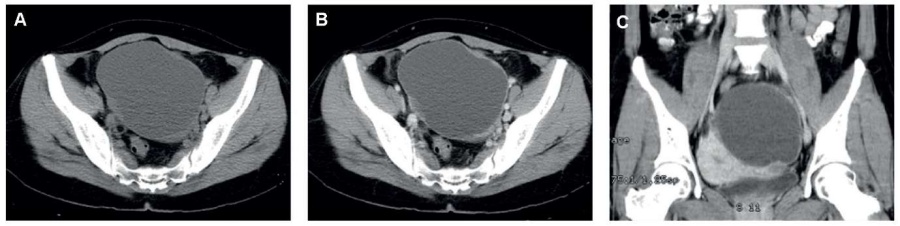
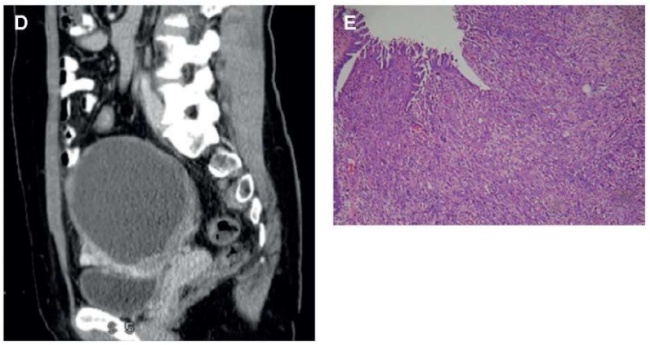
Рисунок 8. Карциносаркома яичников у 44-летней женщины с абдоминальной болью: А – аксиальная компьютерная томография показала опухолевую массу с множественными узлами; В, С, D – паренхима опухоли, после применения контрастного агента выявлено среднее гетерогенное увеличение; Е – бифазная опухоль с карциноматозным и саркоматозным типами [4].
Figure 8. 44-year-old female patient: ovarian carcinosarcoma with abdominal pain: А – аxial computed tomography revealed a tumor mass with multiple nodes; В, С, D – tumor parenchyma after application of a contrast agent, an average heterogeneous increase was observed; Е – biphasic tumor with carcinomatous and sarcomatous types [4].
Лечение / Therapy
В связи с тем, что КСЯ – заболевание редкое, в мировой литературе очень мало исследований и много неясных вопросов о методах лечения [7][14].
Первичное хирургическое лечение КСЯ включает циторедуктивную хирургию, после которой следует химиотерапия [15]. В ретроспективном систематическом обзоре была поставлена цель: изучить клиническую эффективность применения адъювантной химиотерапии после циторедуктивной хирургии; внутривенную химиотерапию на основе препаратов платины получили 74 % пациенток. Основные клинические показатели: средняя общая выживаемость составила 23 мес, трехлетняя выживаемость – 22 мес. Среди 27 пациенток 20 получили химиотерапию. Адъювантную химиотерапию получили 17 пациенток. Общая выживаемость при адъювантной терапии была гораздо выше, чем при ее отсутствии (p = 0,69) [16].
В химиотерапии терапевтическим агентом первой линии являются препараты платины [43]. Общий процент клинического ответа на химиотерапию, основанную на препаратах платины, составляет 25–70 % при средней общей выживаемости в 8–16 мес [14]. Проблема осложняется увеличивающейся резистентностью онкогенов к препаратам платины. В одноцентровом когортном исследовании из 40 пациенток с КСЯ у 30 (75 %) были обнаружены онкогены, резистентные к терапии на основе препаратов платины [17].
С одной стороны, возрастает спрос на терапию второй линии, с другой, доказательная база клинической эффективности данной терапии ограничена [14] с процентом объективных клинических ответов в диапазоне 10–25 % [17].
Другим препаратом второй линии в терапии КСЯ является пазопаниб [18][19]. В серии из 8 клинических случаев, где впервые был применен пазопаниб при рецидивах КСЯ, процент объективных клинических ответов составил 50 %, средняя выживаемость без рецидивов – 2,8 мес [19]. В исследовании в случае комбинированного применения пазопаниба и циклофосфамида (при резистентности онкогенов КСЯ к препаратам на основе платины) средняя общая выживаемость без рецидивов составила 9,5 мес [44].
Описан самый первый случай положительного лечебного применения ингибитора иммунных контрольных точек пембролизумаба в отношении пациентки с КСЯ [14]. В опубликованном позднее наблюдении пациенток, у которых применялся ингибитор иммунных контрольных точек пембролизумаб при рецидивах КСЯ, процент объективных клинических ответов составил < 11,5 %. Однако анализ был основан на небольшой выборке (26 пациенток) [45]. В более масштабном клиническом исследовании (с гораздо более крупной выборкой из 376 пациенток) применения ингибитора иммунных контрольных точек пембролизумаба при рецидивах КСЯ процент объективных клинических ответов составил 7,4 % в когорте А (285 пациенток) и 9,9 % в когорте В (91 пациентка). Пациентки в когорте А получали от одной до трех предшествующих линий лечения в безрецидивный период или бесплатиновый период в промежутке от 3 до 12 мес, а в когорте В пациентки получали от четырех до шести предшествующих линий лечения в безрецидивный период или бесплатиновый период 3 мес [46]. В одноцентровом исследовании комбинированная терапия с использованием пембролизумаба, бевацизумаба, перорального циклофосфамида привела к 47,5 % объективных клинических ответов, клинической пользе в 95,0 %, выживаемости без рецидивов в 90 % [17].
Сакитузумаб говитекан – конъюгат «антитело-лекарственное средство» (КАЛС), направленное против Trop-2 (англ. Trophoblast cell surface antigen 2; поверхностный антиген трофобласта 2), продемонстрировал положительные клинические результаты [18][47][48], однако до недавнего времени не было проведено никаких исследований при КСЯ. В экспериментальном доклиническом исследовании высокая экспрессия Trop-2 обнаружена в 30 % фиксированных в формалине парафинизированных образцах (ФФПО) опухолей КСЯ, в 33 % первичных клеточных линиях КСЯ [20]. Применение сакитузумаба говитекана улучшило общую выживаемость за 90 дней в основной группе по сравнению с контрольной (p < 0,0001) [20].
На сегодня проведены небольшие исследования, в которых изучено влияние опухолевой нагрузки на химиотерапевтическую эффективность применения олапариба, являющегося ингибитором PARP (англ. Poly (ADP-ribose) polymerase; поли (АДФ-рибоза) полимеразы), при рецидивах рака яичников. Однако нет никаких исследований конкретно в случае КСЯ [21]. В серии из 5 клинических случаев впервые был применен олапариб: в трех случаях опухолевая нагрузка была низкая, в двух – высокая. В двух из первых трех случаев применение олапариба привело к частичному химиотерапевтическому ответу. В случаях же с высокой опухолевой нагрузкой влияние олапариба было незначительным [24]. В исследовании 266 пациенток были разделены на 2 группы сравнения (178 в группе олапариба и 88 в группе химиотерапии без препаратов платины). Процент объективных клинических ответов в первой группе был выше, чем во второй – 72,2 % против 51,4 %; отношение шансов (ОШ) = 2,53; 95 % доверительный интервал (ДИ) = 1,40–4,58 (р = 0,002). Процент выживаемости без рецидивов был также выше в первой группе, чем во второй – ОШ = 0,62; 95 % ДИ = 0,43–0,91 (р = 0,013), среднее время выживаемости – 13,4 мес против 9,2 мес [21].
Заключение / Conclusion
На сегодня нет опубликованных обзоров по КСЯ с использованием данных за последние 5 лет. Таким образом, проведенный анализ имеющейся литературы имеет важное значение для практикующих специалистов.
Карциносаркома яичников является редким заболеванием, однако отличается очень высокой смертностью, рецидивностью, метастазами, экономическими тратами, при этом имеется мало клинических исследований конкретно про КСЯ. Имеющиеся исследования спорные и противоречивые. Главной причиной является то, что КСЯ встречается крайне редко. Причиной спорности и противоречивости результатов является то, что заболевание трудно для восприятия и анализа, например, клиническая картина при данном заболевании крайне неспецифическая.
Список литературы
1. Gotoh O., Sugiyama Y., Takazawa Y. et al. Clinically relevant molecular subtypes and genomic alteration-independent differentiation in gynecologic carcinosarcoma. Nat Commun. 2019;10(1):4965. https://doi.org/10.1038/s41467-019-12985-x.
2. Rottmann D., Snir O.L., Wu X. et al. HER2 testing of gynecologic carcinosarcomas: tumor stratification for potential targeted therapy. Mod Pathol. 2020;33(1):118–27. https://doi.org/10.1038/s41379-019-0358-x.
3. Gupta K.K., Gupta V.K., Naumann R.W. Ovarian cancer: screening and future directions. Int J Gynecol Cancer. 2019;29(1):195–200. https://doi.org/10.1136/ijgc-2018-000016.
4. Xu Q., Zhang X., Zou Y. Primitive ovarian carcinosarcoma: a clinical and radiological analysis of five cases. J Ovarian Res. 2020;13(1):129. https://doi.org/10.1186/s13048-020-00728-2.
5. Yue X., Pruemer J.M., Hincapie A.L. et al. Economic burden and treatment patterns of gynecologic cancers in the United States: evidence from the Medical Expenditure Panel Survey 2007–2014. J Gynecol Oncol. 2020;31(4):e52. https://doi.org/10.3802/jgo.2020.31.e52.
6. Delgado-Ortega L., Rubió J.G., de España M.C. et al. Economic impact of olaparib on maintenance treatment of patients with BRCA-mutation positive, platinum-sensitive relapsing high-grade serous epithelial ovarian cancer in Spain. Farm Hosp. 2018;42(3):95–102. https://doi.org/10.7399/fh.10904.
7. Bellone S., Buza N., Choi J. et al. Exceptional response to pembrolizumab in a metastatic, chemotherapy/radiation-resistant ovarian cancer patient harboring a PD-L1-genetic rearrangement. Clin Cancer Res. 2018;24(14):3282–91. https://doi.org/10.1158/1078-0432.CCR-17-1805.
8. Zhu J., Wen H., Ju X. et al. Clinical significance of programmed death ligand-1 and intra-tumoral CD8+ T-lymphocytes in ovarian carcinosarcoma. PLoS One. 2017;12(1):e0170879. https://doi.org/10.1371/journal.pone.017087.
9. Magalhaes I., Fernebro J., Own S.A. et al. Mesothelin expression in patients with high-grade serous ovarian cancer does not predict clinical outcome but correlates with CD11c+ expression in tumor. Adv Ther. 2020;37(12):5023–31. https://doi.org/10.1007/s12325-020-01520-w.
10. Li Y., Wang Q., Ning N. et al. Bioinformatic analysis reveals MIR502 as a potential tumour suppressor in ovarian cancer. J Ovarian Res. 2020;13(1):77. https://doi.org/10.1186/s13048-020-00683-y.
11. Cheng J., Guo J., Wang Z. et al. Functional analysis of Cullin 3 E3 ligases in tumorigenesis. Biochim Biophys Acta Rev Cancer. 2018;1869(1):11–28. https://doi.org/10.1016/j.bbcan.2017.11.001
12. Smebye M.L., Agostini A., Johannessen B. et al. Involvement of DPP9 in gene fusions in serous ovarian carcinoma. BMC Cancer. 2017;17(1):642. https://doi.org/10.1186/s12885-017-3625-6.
13. Kostov S., Kornovski Y., Ivanova Y. et al. Ovarian carcinosarcoma with retroperitoneal para-aortic lymph node dissemination followed by an unusual postoperative complication: A case report with a brief literature review. Diagnostics (Basel). 2020;10(12):1073. https://doi.org/10.3390/diagnostics10121073.
14. Dal Molin G.Z., Abrahão C.M., Coleman R.L., Maluf F.C. Response to pembrolizumab in a heavily treated patient with metastatic ovarian carcinosarcoma. Gynecol Oncol Res Pract. 2018;5(1):6. https://doi.org/10.1186/s40661-018-0063-3.
15. Cortez A.J., Tudrej P., Kujawa K.A., Lisowska K.M. Advances in ovarian cancer therapy. Cancer Chemother Pharmacol. 2018;81(1):17–38. https://doi.org/10.1007/s00280-017-3501-8.
16. Nizam A., Bustamante B., Shan W. et al. Overall survival and adjuvant therapy in women with ovarian carcinosarcoma: A single-institution experience. Diagnostics (Basel). 2019;9(4):200. https://doi.org/10.3390/diagnostics9040200.
17. Zsiros E., Lynam S., Attwood K.M. et al. Efficacy and safety of pembrolizumab in combination with bevacizumab and oral metronomic cyclophosphamide in the treatment of recurrent ovarian cancer: a phase 2 nonrandomized clinical trial. JAMA Oncol. 2021;7(1):78–85. https://doi.org/10.1001/jamaoncol.2020.5945.
18. Bardia A., Mayer I.A., Vahdat L.T. et al. Sacituzumab govitecan-hziy in refractory metastatic triple-negative breast cancer. N Engl J Med. 2019;380(8):741–51. https://doi.org/10.1056/NEJMoa1814213.
19. Nishikawa T., Hasegawa K., Yabuno A. et al. Pazopanib as a second line treatment for uterine and ovarian carcinosarcoma: a single institutional study. J Gynecol Oncol. 2017;28(1):e25. https://doi.org/10.3802/jgo.2017.28.e25.
20. Lopez S., Perrone E., Bellone S. et al. Preclinical activity of sacituzumab govitecan (IMMU-132) in uterine and ovarian carcinosarcomas. Oncotarget. 2020;11(5):560–70. https://doi.org/10.18632/oncotarget.27342.
21. Penson R.T., Valencia R.V., Cibula D. et al. Olaparib versus nonplatinum chemotherapy in patients with platinum-sensitive relapsed ovarian cancer and a germline BRCA1/2 mutation (SOLO3): a randomized phase III trial. J Clin Oncol. 2020;38(11):1164–74. https://doi.org/10.1200/JCO.19.02745.
22. Momenimovahed Z., Tiznobaik A., Taheri S., Salehiniya H. Ovarian cancer in the world: epidemiology and risk factors. Int J Womens Health. 2019;11:287–99. https://doi.org/10.2147/IJWH.S197604.
23. Ni J., Zhou R., Cheng X. et al. Tumor burden is a potential marker of PARP inhibitor effects in ovarian cancer: a head-to-head observational series. J Ovarian Res. 2020;13(1):29. https://doi.org/10.1186/s13048-020-00629-4.
24. Zhao S., Bellone S., Lopez S. et al. Mutational landscape of uterine and ovarian carcinosarcomas implicates histone genes in epithelialmesenchymal transition. Proc Natl Acad Sci U S A. 2016;113(43):12238–43. https://doi.org/10.1073/pnas.1614120113.
25. Boussios S., Karathanasi A., Zakynthinakis-Kyriakou, N. et al. Ovarian carcinosarcoma: Current developments and future perspectives. Crit Rev Oncol Hematol. 2019;134:46–55. https://doi.org/10.1016/j.critrevonc.2018.12.006.
26. Kim H.J., Lee H.-M., Kim M.K. et al. Prognostic assessment of sarcomatous histologic subtypes of ovarian carcinosarcoma. Obstet Gynecol Sci. 2017;60(4):350–56. https://doi.org/10.5468/ogs.2017.60.4.350.
27. Han C.Y., Patten D.A., Richardson R.B. et al. Tumor metabolism regulating chemosensitivity in ovarian cancer. Genes Cancer. 2018;9(5–6):155–75. https://doi.org/10.18632/genesandcancer.176.
28. Lv J., Li P. Mesothelin as a biomarker for targeted therapy. Biomark Res. 2019;7:18. https://doi.org/10.1186/s40364-019-0169-8.
29. Weidemann S., Gagelmann P., Gorbokon N. et al. Mesothelin expression in human tumors: A tissue microarray study on 12,679 tumors. Biomedicines. 2021;9(4):397. https://doi.org/10.3390/biomedicines9040397.
30. Klampatsa A., Dimou V., Albelda S.M. Mesothelin-targeted CAR-T cell therapy for solid tumors. Expert Opin Biol Ther. 2021;21(4):473–86. https://doi.org/10.1080/14712598.2021.1843628.
31. Zhang Q., Liu G., Liu J. et al. The antitumor capacity of mesothelin-CAR-T cells in targeting solid tumors in mice. Mol Ther Oncolytics. 2021;20:556–68. https://doi.org/10.1016/j.omto.2021.02.013.
32. Tokatlian T., Asuelime G.E., Mock J.-Y. et al. Mesothelin-specific CAR-T cell therapy that incorporates an HLA-gated safety mechanism selectively kills tumor cells. J Immunother Cancer. 2022;10(1):e003826. https://doi.org/10.1136/jitc-2021-003826.
33. Shen J., Sun X., Zhou J. Insights into the role of mesothelin as a diagnostic and therapeutic target in ovarian carcinoma. Front Oncol. 2020;10:1263. https://doi.org/10.3389/fonc.2020.01263.
34. Yang W., Ma J., Zhou W. et al. Reciprocal regulations between miRNAs and HIF-1alpha in human cancers. Cell Mol Life Sci. 2019;76(3):453–71. https://doi.org/10.1007/s00018-018-2941-6.
35. Melnik S., Werth N., Boeuf S. et al. Impact of c-MYC expression on proliferation, differentiation, and risk of neoplastic transformation of human mesenchymal stromal cells. Stem Cell Res Ther. 2019;10(1):73. https://doi.org/10.1186/s13287-019-1187-z.
36. Xu Z., Li L., Qian Y. et al. Upregulation of IL-6 in CUL4B-deficient myeloidderived suppressive cells increases the aggressiveness of cancer cells. Oncogene. 2019;38(30):5860–72. https://doi.org/10.1038/s41388-019-0847-x.
37. Duan P.J., Zhao J.H., Xie L.L. Cul4B promotes the progression of ovarian cancer by upregulating the expression of CDK2 and CyclinD1. J Ovarian Res. 2020;13(1):76. https://doi.org/10.1186/s13048-020-00677-w.
38. Hutter C., Zenklusen J.C. The Cancer Genome Atlas: creating lasting value beyond its data. Cell. 2018;173(2):283–5. https://doi.org/10.1016/j.cell.2018.03.042.
39. Daimon A., Fujiwara S., Tanaka Y. et al. A rare case of ovarian carcinosarcoma with squamous cell carcinoma. J Ovarian Res. 2019;12(1):32. https://doi.org/10.1186/s13048-019-0507-3.
40. Niwa K., Mori S., Kuwabara K. et al. Primary ovarian carcinosarcoma: cytological, pathological, immunocytochemical, and immunohistochemical features. Open J Pathol, 2021;11:22–31. https://doi.org/10.4236/ojpathology.2021.111003.
41. Sroczynski G., Gogollari A., Kuehne F. et al. A systematic review on costeffectiveness studies evaluating ovarian cancer early detection and prevention strategies. Cancer Prev Res (Phila). 2020;13(5):429–42. https://doi.org/10.1158/1940-6207.CAPR-19-0506.
42. Li X., Xu Y., Zhang L. Serum CA153 as biomarker for cancer and noncancer diseases. Prog Mol Biol Transl Sci. 2019;162:265–76. https://doi.org/10.1016/bs.pmbts.2019.01.005.
43. Goldenberg D.M., Stein R., Sharkey R.M. The emergence of trophoblast cell-surface antigen 2 (TROP-2) as a novel cancer target. Oncotarget. 2018;9(48):28989–9006. https://doi.org/10.18632/oncotarget.25615.
44. Gulia S., Ghosh J., Bajpai J. et al. Pazopanib and oral cyclophosphamide in women with platinum-resistant or -refractory epithelial ovarian cancer. JCO Glob Oncol. 2020;6:542–7. https://doi.org/10.1200/JGO.19.00331.
45. Varga A., Piha-Paul S.A., Ott P.A. et al. Pembrolizumab in patients (pts) with PD-L1-positive (PD-L1+) advanced ovarian cancer: updated analysis of KEYNOTE-028. J Clin Oncol. 2017;35(15 Suppl):5513. https://doi.org/10.1200/JCO.2017.35.15_suppl.5513.
46. Matulonis U.A., Shapira-Frommer R., Santin A.D. et al. Antitumor activity and safety of pembrolizumab in patients with advanced recurrent ovarian cancer: results from the phase II KEYNOTE-100 study. Ann Oncol. 2019;30(7):1080–87. https://doi.org/10.1093/annonc/mdz135.
47. Gray J.E., Heist R.S., Starodub A.N. et al. Therapy of small cell Lung cancer (SCLC) with a topoisomerase-I-inhibiting antibody-drug conjugate (ADC) targeting trop-2, sacituzumab govitecan. Clin Cancer Res. 2017;23(19):5711–19. https://doi.org/10.1158/1078-0432.CCR-17-0933.
48. Heist R.S., Guarino M.J., Masters G. et al. Therapy of advanced non-smallcell lung cancer with an SN-38-anti-trop-2 drug conjugate, sacituzumab govitecan. J Clin Oncol. 2017;35(24):2790–97. https://doi.org/10.1200/JCO.2016.72.1894.
Об авторах
А. М. БейшембаевКыргызстан
Бейшембаев Алмаз Мукашевич – к.м.н., зав. кафедрой онкологии, гематологии, лучевой диагностики и терапии факультета усовершенствования врачей
720064 Бишкек, ул. Боконбаева, д. 144а
К. И. Жорданиа
Россия
Жорданиа Кирилл Иосифович – д.м.н., профессор, онкогинеколог, ведущий научный сотрудник отделения гинекологии
115478 Москва, Каширское шоссе, д. 24
Э. Д. Чой
Кыргызстан
Чой Эн Джун – д.м.н., и.о. доцента кафедры хирургических и специальных клинических дисциплин
720000 Бишкек, ул. Анкара, 1/17
А. А. Туркменов
Кыргызстан
Туркменов Алыбек Альбертович – к.м.н., и.о. доцента кафедры пропедевтической хирургии
720020 Бишкек, ул. И.К. Ахунбаева, д. 92
А. К. Молдобекова
Кыргызстан
Молдобекова Айпери Кемелбековна – ассистент кафедры хирургических дисциплин
Кант, ул. Гагарина, д. 58
Рецензия
Для цитирования:
Бейшембаев А.М., Жорданиа К.И., Чой Э.Д., Туркменов А.А., Молдобекова А.К. Карциносаркома яичников (обзор литературы). Акушерство, Гинекология и Репродукция. 2022;16(5):575-587. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.295
For citation:
Beishembaev A.M., Zhordania K.I., Choi E.D., Turkmenov A.A., Moldobekova A.K. Ovarian carcinosarcoma (a literature review). Obstetrics, Gynecology and Reproduction. 2022;16(5):575-587. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.295

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































