Перейти к:
Ангиогенные факторы (sFlt-1, PlGF) у беременных с двойней и плацента-ассоциированными осложнениями
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.330
Аннотация
Цель: разработка нормативных значений ангиогенных факторов в динамике беременности у пациенток с двойней и различным типом плацентации для ранней диагностики и оценки степени тяжести преэклампсии (ПЭ).
Материалы и методы. С 2020 по 2021 гг. проведено проспективное исследование: обследовано 93 беременных с двойней – 68 с дихориальной диамниотической (ДХДА) двойней и 25 с монохориальной диамниотической (МХДА) двойней. Все пациентки были разделены на 2 группы: группу I составили 65 беременных двойней без ПЭ; в группу II вошли 28 пациенток с двойней, у которых течение беременности осложнилось ПЭ. В сыворотке крови беременных для диагностики ПЭ и прогнозирования тяжести заболевания в 4 точках гестации (20,0–23,6 нед, 24,0–28,6 нед, 29,0–33,6 нед, 34,0–36,6 нед) исследовали содержание растворимой fms-подобной тирозинкиназы 1 (англ. soluble fms-like tyrosinekinase 1, sFlt-1), плацентарного фактора роста (англ. placental growth factor, PlGF) и их соотношения.
Результаты. Значимой разницы в содержании ангиогенных факторов и в их соотношении у беременных с неосложненной ДХДА и МХДА двойней не выявлено. Вне зависимости от типа плацентации соотношение sFlt-1/PlGF у беременных с двойней и ПЭ уже с 24 нед гестации составляло 103,3, в 20 раз превышая этот показатель при неосложненной двойне. Определены пороговые значения соотношения sFlt-1/PlGF при двойне, позволяющие с высокой степенью достоверности исключить (sFlt-1/PlGF < 21,85; чувствительность 100 %, специфичность 85 %) и поставить (sFlt-1/PlGF > 49,4; чувствительность 71,1 %, специфичность 100 %) диагноз ПЭ. Соотношение sFlt-1/PlGF было выше в группе беременных с тяжелой ПЭ по сравнению с умеренной степенью заболевания на протяжении всех исследованных сроков гестации (р < 0,05). У беременных с ранней ПЭ соотношение ангиогенных факторов превышало верхнее пороговое значение с 24 нед гестации, при поздней ПЭ – с 34,0–36,6 нед. У пациенток с индуцированной двойней по сравнению со спонтанным многоплодием с 24,0–28,6 нед гестации выявлены сушественно более высокие уровни sFlt-1 (18359 ± 8656 пг/мл против 5526 ± 2808 пг/мл; р < 0,001) и соотношения sFlt-1/PlGF (118,0 ± 65,2 против 32,8 ± 18,6; р < 0,03), чаще отмечалась и тяжелая степень ПЭ (42,2 и 22,2 % соответственно; p < 0,05).
Заключение. Разработанные нормативные значения соотношения sFlt-1/PlGF у беременных с двойней и различным типом плацентации могут использоваться не только для постановки диагноза ПЭ, но и для оценки степени тяжести и сроков манифестации заболевания.
Для цитирования:
Курцер М.А., Сичинава Л.Г., Алажажи А.О., Латышкевич О.А., Николаева Е.В. Ангиогенные факторы (sFlt-1, PlGF) у беременных с двойней и плацента-ассоциированными осложнениями. Акушерство, Гинекология и Репродукция. 2022;16(5):541-551. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.330
For citation:
Kurtser M.A., Sichinava L.G., Alazhazhi A.O., Latyshkevich O.A., Nikolaeva E.V. Angiogenic factors (sFlt-1, PlGF) in twin pregnancy with placentaassociated complications. Obstetrics, Gynecology and Reproduction. 2022;16(5):541-551. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.330
Введение / Introduction
На протяжении последних лет набор основных клинических признаков, определяющих преэклампсию (ПЭ) и основанных на классической триаде (артериальная гипертензия, протеинурия, отёки), практически не изменился [1][2]. В тоже время клиническая картина и течение ПЭ вариабельны: от тяжелой и быстро прогрессирующей ранней ПЭ до позднего начала ПЭ, не требующей досрочного родоразрешения. Особенно актуальной остается дифференциальная диагностика ПЭ от соматических масок ПЭ при стертых формах заболевания. Активный поиск дополнительных маркеров, позволяющих прогнозировать развитие ПЭ и оценивать тяжесть заболевания, предпринимали ученые разных стран [1–4]. В настоящее время наиболее изученными и значимыми являются маркеры эндотелиальной дисфункции, среди которых особо признаны факторы ангиогенеза. При одноплодной беременности для диагностики ПЭ и прогнозирования тяжести заболевания установлены пороговые значения (ПЗ) антиангиогенного фактора – растворимой fms-подобной тирозинкиназы 1 (англ. soluble fms-like tyrosinekinase 1, sFlt-1), ангиогенного фактора – плацентарного фактора роста (англ. placental growth factor, PlGF) и их соотношения sFlt-1/PlGF [5–7]. Однако лишь немногие исследования посвящены изучению маркеров ангиогенеза при многоплодии, при котором плацента-ассоциированные осложнения встречаются в 3–4 раза чаще и протекают тяжелее, чем при одноплодной беременности. Не определено влияние типа плацентации у беременных с двойней на концентрацию ангиогенных факторов [5][8–11].
Цель: разработка нормативных значений ангиогенных факторов в динамике беременности у пациенток с двойней и различным типом плацентации для ранней диагностики и оценки степени тяжести ПЭ.
Материалы и методы / Materials and Methods
Дизайн исследования / Study design
Проспективное исследование выполнено на базах кафедры акушерства и гинекологии педиатрического факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (ГБУЗ ЦПСиР ДЗМ и Клинический госпиталь MD Group) с 2020 по 2021 гг. Проведено обследование 93 беременных с двойней; из них 68 с дихориальной диамниотической (ДХДА) двойней и 25 с монохориальной диамниотической (МХДА) двойней. Диагноз двойни и типа плацентации устанавливали в I триместре беременности при ультразвуковом исследовании (УЗИ) в 11,0–13,6 нед на основании количества эмбрионов и визуализации λ- или Т-признака у основания межплодовой перегородки.
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения: ДХДА и МХДА двойни.
Критерии исключения: ДХДА и МХДА двойни с пороками развития одного или обоих плодов; МХДА двойни со специфическими осложнениями (синдром фето-фетальной трансфузии, синдром анемии-полицитемии, синдром обратной артериальной перфузии).
Группы сравнения / Comparison groups
Все пациентки были разделены на 2 группы: группу I составили 65 беременных двойней без ПЭ (неосложненная беременность); в группу II вошли 28 пациенток с двойней, у которых течение беременности осложнилось ПЭ.
Тяжесть ПЭ оценивали на основании следующих критериев:
- умеренная ПЭ – артериальное давление (АД) составляет ≥ 140/90–159/109 мм рт. ст.; протеинурия ≥ 0,3 г/сутки, но ≤ 5 г/сутки;
- тяжелая ПЭ – АД составляет ≥ 160/110 мм рт. ст.; протеинурия ≥ 5 г/сутки или 3 г/л в порциях мочи, полученных дважды с разницей ≥ 4 ч.
Выделяли также раннюю (до 34 нед) и позднюю (после 34 нед гестации) ПЭ.
Методы исследования / Study methods
Содержание sFlt-1 и PlGF в сыворотке крови беременных исследовали в 4 точках гестации (20,0– 23,6 нед, 24,0–28,6 нед, 29,0–33,6 нед, 34,0–36,6 нед) с помощью полностью автоматизированных анализаторов Elecsys для sFlt-1 и PlGF на платформе электрохемилюминесцентного иммуноанализа (анализаторы Сobas e, Roche Diagnostics, Германия).
Этические аспекты / Ethical aspects
Исследование проведено в соответствии с этическими стандартами Хельсинской декларации Всемирной медицинской ассоциации 1964 г. и ее последующими изменениями. Все пациентки подписали добровольное информированное согласие на участие в исследовании и отбор биоматериала для анализа. Исследование одобрено локальным этическим комитетом ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, протокол № 192 от 27.01.2020.
Методы статистического анализа / Statistical analysis
Статистическую обработку полученных данных проводили с использованием методов описательной статистики, данные представлены в виде медианы (Ме). Сравнение данных осуществляли с помощью U-критерия Манна–Уитни для независимых выборок. Различия между группами считали статистически значимыми при p < 0,05.
Для анализа прогностической ценности показателей ангиогенных факторов проводили анализ ROC-кривой (англ. Receiver Operating Characteristic) с построением прогностических моделей на основании данных чувствительности и специфичности и площади под кривой (англ. Area Under Curve, AUC). Качество модели по интервальным значениям AUC расценивали как отличное (0,9–1,0), очень хорошее (0,8–0,9), хорошее (0,7–0,8), среднее (0,6–0,7), неудовлетворительное (0,5–0,6).
Формирование базы данных и все расчеты производили с использованием пакетов программ IBM SPSS Statistics, version 26 (IBM, США), Microsoft Excel 2016 (Microsoft, США).
Результаты и обсуждение / Results and Discussion
Средний возраст беременных в обеих группах значимо не различался, составляя 31,7 ± 3,9 и 33,2 ± 3,3 года. Тяжелая степень ПЭ развилась у 10 из 28 (35,7 %) беременных, умеренная степень заболевания диагностирована у 18 (64,3 %) пациенток. У 9 (32,1 %) пациенток группы II ПЭ развилась на фоне хронической артериальной гипертензии.
Путем кесарева сечения в сроки 32–38 нед были родоразрешены 86 из 93 (92,5 %) беременных. Преждевременные роды в 2 раза чаще были отмечены в группе II по сравнению с неосложненной двойней (73,1 и 36,8 % соответственно).
Содержание антиангиогенного (sFlt-1) и ангиогенного (PlGF) факторов у беременных с неосложненной ДХДА и МХДА двойней / Anti-angiogenic (sFlt-1) and angiogenic (PlGF) factor level in women with uncomplicated DCDA and MCDA twins
Изучение динамики концентрации sFlt-1 при неосложненной МХДА двойне, также как и при ДХДА, показало значимое увеличение (р < 0,05) показателя на протяжении гестации (рис. 1). Особенно выраженное повышение этого антиангиогенного фактора наблюдалось как при ДХДА, так и МХДА двойне к 29,0–33,6 нед гестации (в 1,2–2 раза), а к 37 нед беременности значения sFlt-1 достигали 6340 пг/мл и 5471 пг/мл соответственно. Следует отметить, что во все исследованные сроки гестации значимых различий между показателями sFlt-1 у беременных с неосложненной МХДА и ДХДА двойней выявлено не было (p > 0,05).
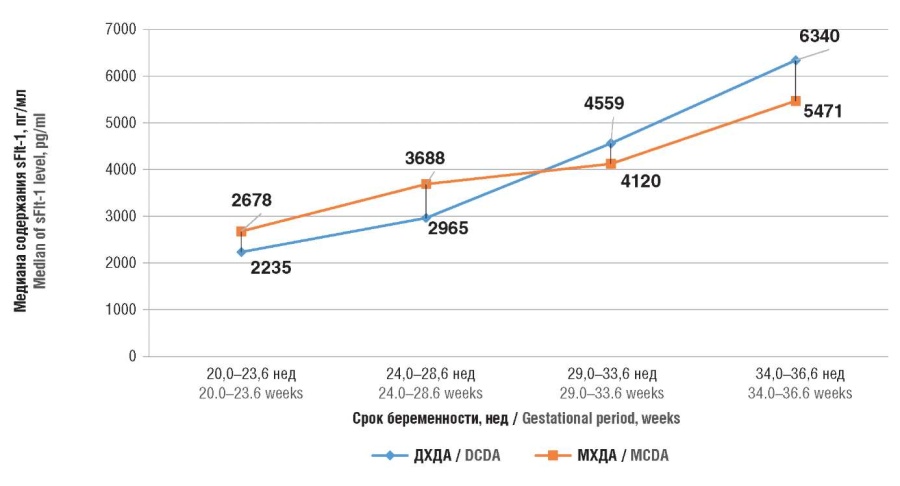
Рисунок 1. Медиана содержания растворимой fms-подобной тирозинкиназы 1 (sFlt-1) у 49 беременных дихориальной диамниотической (ДХДА) двойней и 16 беременных с монохориальной диамниотической (МХДА) двойней без преэклампсии.
Figure 1. Median level of soluble fms-like tyrosine kinase 1 (sFlt-1) in 49 pregnant women with dichorionic diamniotic (DCDA) twins and 16 pregnant women with monochorionic diamniotic (MCDA) twins without preeclampsia.
Что касается PlGF, то его уровень при МХДА двойне практически не менялся в исследованные сроки гестации, как бы находился на «плато», составляя 344,5 пг/мл в 20,0–23,6 нед и 397,2 пг/мл к 34,0–36,6 нед гестации. Несмотря на более высокие показатели этого ангиогенного фактора в течение исследованных сроков при ДХДА двойне, значимые различия между значениями PlGF у беременных ДХДА и МХДА двойней без ПЭ наблюдались лишь в 29–33,6 нед гестации – 617,5 пг/мл против 387,1 пг/мл соответственно (p = 0,036). В отличие от нашего исследования, O. Sanchez с соавт. (2012) указывали на более высокие уровни PlGF при ДХДА двойне по сравнению с МХДА только в I триместре беременности [5].
К 37 нед беременности значения PlGF у пациенток с ДХДА и МХДА двойней без ПЭ не различались – 336,6 пг/мл и 397,2 пг/мл соответственно (р > 0,05). Отсутствие разницы в концентрации плацентарного фактора роста к концу беременности при различных типах плацентации возможно объясняется выявленной нами практически одинаковой массой плацент/ плаценты при МХДА и ДХДА двойне – 782,0 ± 132,3 г и 723,75 ± 129,34 г соответственно (p > 0,05).
Существенных различий в соотношении sFlt-1/PlGF в динамике неосложненной беременности при ДХДА и МХДА двойне мы не выявили, и к 34,0–36,6 нед гестации соотношение ангиогенных факторов составляло 16,1 и 10,8 соответственно (p > 0,05).
Ангиогенные факторы у беременных с двойней и преэклампсией / Angiogenic factors in twin pregnancy with preeclampsia
Учитывая отсутствие значимых различий в маркерах ангиогенеза у беременных с неосложненной ДХДА и МХДА двойней, в дальнейшем эти группы беременных с ПЭ анализировали вместе независимо от типа хориальности. Следует подчеркнуть, что у беременных при дихориальном типе плацентации частота развития ПЭ (67,8 %) была выше, чем при МХДА двойне (32,1 %). По данным ГБУЗ ЦПСиР ДЗМ, с 2014 по 2021 гг. частота ПЭ среди беременных с ДХДА двойней в 3–4 раза превышала таковую при МХДА двойне. Это согласуется и с мнениями О. Sanchez с соавт. (2012) [5] и S. Kozlowski с соавт. (2021) [10], которые также указывали на более высокую частоту ПЭ при ДХДА двойне.
Медиана концентрации sFlt-1 у 28 беременных с ПЭ (группа II) была выше на протяжении всех исследованных сроков гестации по сравнению с группой I. Однако значимые различия в уровне этого антиангиогенного фактора отмечали только с 24 нед гестации – 10934 пг/мл против 3056 пг/мл в группе I (p < 0,001), и максимальный уровень sFlt-1 в группе беременных с ПЭ наблюдался в 29,0–33,6 нед – 14748 пг/мл против 4434 пг/мл в группе с неосложненной двойней (p < 0,001), который сохранялся до 37 нед беременности.
Концентрация PlGF у пациенток с ПЭ (группа II) была значительно снижена, и уже в 20 нед обнаружена значимая разница по сравнению с пациентками группы I – 195,1 и 570,55 пг/мл соответственно (p < 0,001). Но если при неосложненной двойне к 24,0– 28,6 нед гестации наблюдалась тенденция к нарастанию концентрации PlGF (с 570,55 до 653,4 пг/мл), то в группе беременных с ПЭ этот показатель, наоборот, незначительно снижался (с 195,1 до 185,0 пг/мл). Эти изменения в содержании PlGF при осложненной ПЭ беременности можно объяснить переходом именно в эти сроки гестации I плацентарной стадии ПЭ во II материнскую, когда происходят нарушения гестационных изменений спиральных артерий, снижение плацентарной перфузии, что в свою очередь приводит к системной активации эндотелия [12–16].
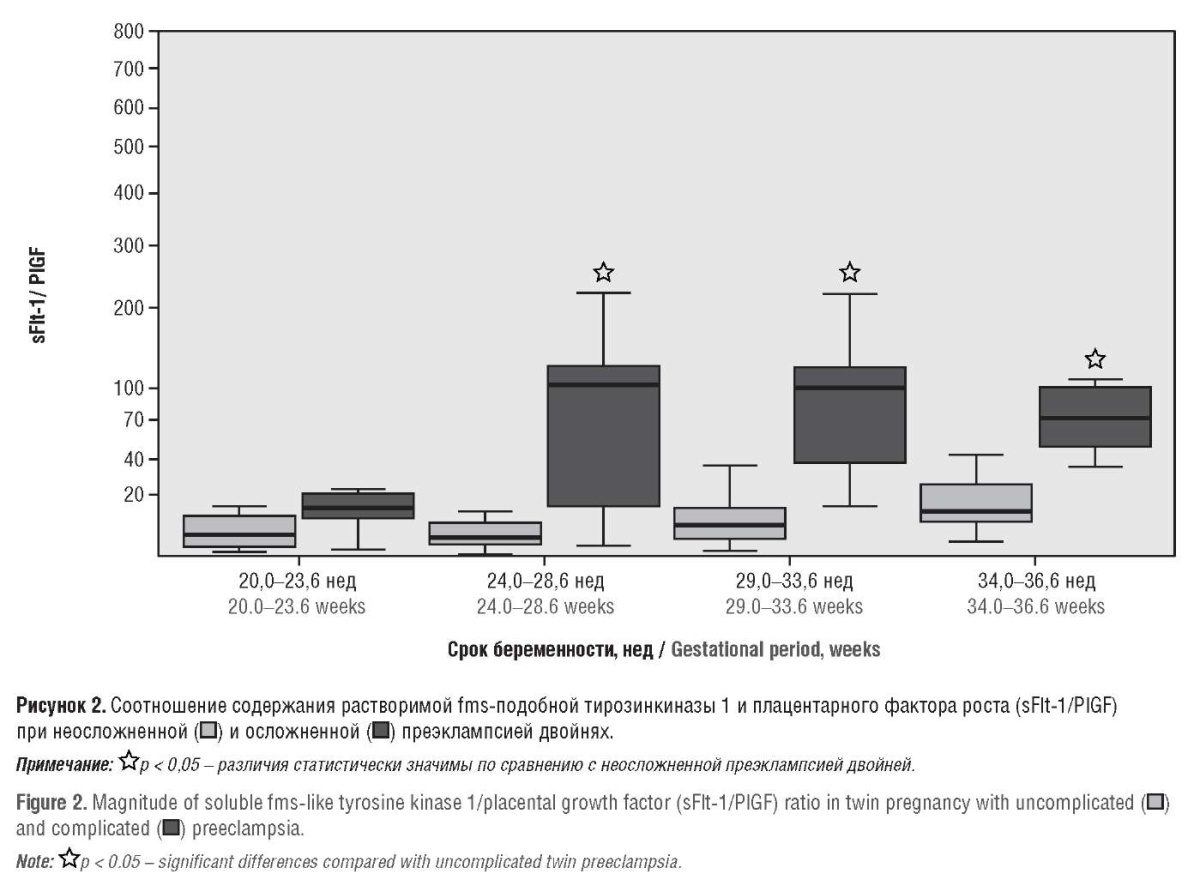
В результате вышеуказанных изменений в содержании антиангиогенного и ангиогенного факторов (увеличение sFlt-1 и снижение PlGF) медиана соотношения sFlt-1/PlGF была значительно выше при беременности двойней, осложненной ПЭ, начиная с 24,0–28,6 нед гестации – 103,13 в группе II против 4,3 в группе I (p < 0,001), и значимые различия этого показателя между группами II и I сохранялись до 34,0–36,6 нед беременности, составляя 69,8 и 13,3 (p < 0,05) соответственно (рис. 2).
Пороговые значения соотношения sFlt-1/PlGF у беременных двойней / Reference values for sFlt-1/PlGF ratio in twin pregnancy
Проведенный ROC-анализ (AUC = 0,974 ± 0,012; 95 % ДИ = 0,950–0,997) позволил с высокой степенью достоверности выбрать нижнее ПЗ соотношения sFlt-1/PlGF, использование которого исключало диагноз ПЭ – 21,85 (чувствительность 100 % и специфичность 85 %). Верхнее ПЗ этого показателя у пациенток с двойней, которое позволило поставить диагноз ПЭ, было определено как 49,4 с чувствительностью 71,1 % и специфичностью 100 % (рис. 3).
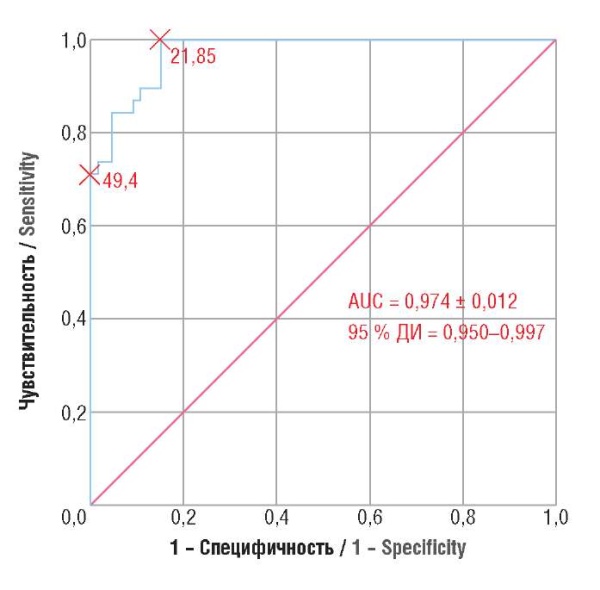
Рисунок 3. ROC-кривая соотношения содержания растворимой fms-подобной тирозинкиназы 1 и плацентарного фактора роста (sFlt-1/PlGF) у беременных двойней (дихориальная диамниотическая + монохориальная диамниотическая).
Figure 3. ROC curve for soluble fms-like tyrosine kinase 1/placental growth factor (sFlt-1/PlGF) ratio in pregnant twins (dichorionic diamniotic + monochorionic diamniotic).
Значения соотношения sFlt-1/PlGF, находящиеся в пределах 21,85–49,4 («серая зона»), как правило, указывали на возможность пролонгирования беременности при тщательном динамическом наблюдении за состоянием матери и плода.
Полученные нами пороговые значения соотношения sFlt-1/PlGF у беременных с двойней вне зависимости от хориальности (нижнее ПЗ – 21,85; верхнее ПЗ – 49,4) практически не отличаются от ранее установленных показателей для ДХДА двойни: нижнее ПЗ – 20,06, верхнее ПЗ – 50,06 [17].
Таким образом, разработанные нами пороговые значения соотношения sFlt-1/PlGF для беременных с двойней указывают на возможность использования этих показателей для диагностики развития ПЭ у беременных как с ДХДА, так и МХДА двойней.
Прогностическая значимость соотношения sFlt-1/PlGF при преэклампсии у беременных двойней / Prognostic importance of sFlt-1/PlGF ratio in twin pregnancy with preeclampsia
Очень важным для определения тактики ведения пациенток с ПЭ является диагностика степени тяжести, а также сроков манифестации заболевания. Мы проанализировали соотношение sFlt-1/PlGF у 10 беременных с тяжелой и у 18 пациенток с умеренной степенью ПЭ с учетом разработанных пороговых значений.
Как видно из рисунка 4, соотношение sFlt-1/PlGF было выше в группе беременных с тяжелой ПЭ по сравнению с таковым при умеренной степени ПЭ на протяжении всех исследованных сроков гестации. Особо значимые различия этого показателя у беременных с тяжелой и умеренной ПЭ наблюдали в 29,0–33,6 нед (121,9 и 45,73 соответственно; p < 0,003), что объясняется выраженным увеличением уровня sFlt-1 при тяжелой ПЭ именно в указанные сроки беременности (30024 пг/мл против 9698,00 пг/мл при умеренной ПЭ; p < 0,0001). Повышенный выброс в кровоток антиангиогенного фактора у беременных с двойней при ПЭ, как и при одноплодной беременности, многие авторы связывают с несколькими причинами: недостаточная инвазия трофобласта, неполноценное ремоделирование спиральных артерий, что в свою очередь приводит к эндотелиальной дисфункции [12–16][18].

Следует подчеркнуть, что при тяжелой ПЭ соотношение sFlt-1/PlGF уже с 20,0–23,6 нед находилось в пределах 21,85–49,4, т. е. в «серой зоне», достигая максимальных значений к 29,0–33,6 нед гестации, что указывало на необходимость тщательного динамического наблюдения за состоянием беременных. К 37 нед беременности значения соотношения sFlt-1/PlGF у пациенток с тяжелой и умеренной степенью ПЭ практически не различались (72,81 и 71,36 соответственно; p > 0,05), но у беременных обеих групп значительно превышали верхнее ПЗ.
У 8 из 10 пациенток с тяжелой ПЭ соотношение sFlt-1/PlGF значительно превышало верхнее ПЗ и находилось в пределах 91–219,5. Особо следует выделить пациентку с ДХДА двойней, у которой соотношение sFlt-1/PlGF исходно составляло 149,3 в 31,4 нед беременности и на фоне ухудшения состояния к 33,3 нед гестации (развитие тяжелой ПЭ с генерализованными отеками, АД более 160/110 мм рт. ст. и протеинурией более 5 г/сутки) достигало значения 708,8, что потребовало экстренного родозразрешения.
Обращали на себя внимание более высокие значения sFlt-1 и соотношения sFlt-1/PlGF с 24,0–28,6 нед гестации у пациенток с индуцированной беременностью по сравнению со спонтанным многоплодием, чаще отмечалась и тяжелая степень ПЭ (42,2 и 22,2 % соответственно; p < 0,05). Наши данные согласуются с исследованием О. Sanchez с соавт. (2012), которые также указывали на разницу в концентрации sFlt-1 у беременных с индуцированной и самопроизвольной двойней [5].
У 5 пациенток, несмотря на умеренную степень ПЭ, соотношение sFlt-1/PlGF значительно превышало верхнее ПЗ (sFlt-1/PlGF > 100), что, по-видимому, следует объяснить сочетанием ПЭ с селективной задержкой роста плодов у этих беременных (дискордантность > 25 % и предполагаемая масса плода с задержкой роста < 10); т. е. эти два плацента-ассоциированных осложнения могут влиять на уровень ангиогенных факторов, что следует учитывать при диагностике ПЭ у беременных с двойней.
На тяжесть и течение ПЭ очень большое влияние оказывает начало манифестации этого плацента-ассоциированного осложнения (ранняя ПЭ – до 34 нед, поздняя ПЭ – после 34 нед). Ранняя ПЭ имеет более тяжелое течение и неблагоприятные исходы, чем поздняя; это касается и исходов беременности и влияния на качество последующей жизни женщины [19–22].
В нашем исследовании медиана соотношения sFlt1/PlGF уже с 24,0–28,6 нед гестации у беременных с ранней ПЭ значительно превышала таковую в группе с поздним началом заболевания (114,55 против 19,8 соответственно; p < 0,05). У беременных с поздней ПЭ соотношение sFlt-1/PlGF выше нижнего ПЗ было отмечено только лишь в 29,0–33,6 нед беременности (рис. 5). Однако к 34,0–36,6 нед соотношение sFlt-1/PlGF практически не различалось у беременных с ранней и поздней ПЭ (71,36 и 78,32 соответственно; p > 0,05). Интересно отметить, что именно в эти сроки, к концу беременности, также отсутствовала разница в соотношении sFlt-1/PlGF у пациенток с тяжелой и умеренной степенью ПЭ.
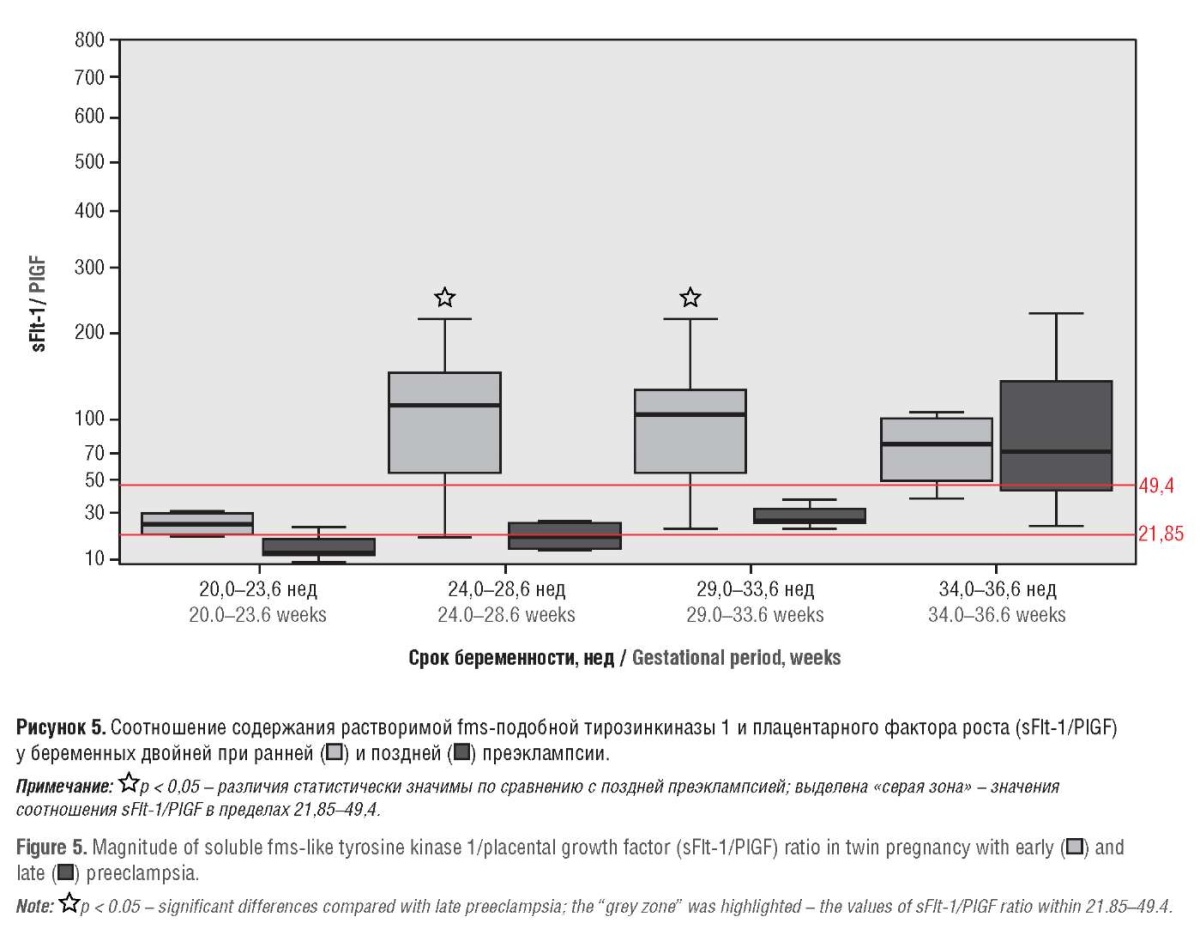
У 13 из 28 (46,4 %) беременных с ПЭ, у которых при первичном обращении соотношение sFlt-1/PlGF находилось в так называемой «серой зоне» (21,85–49,4), в дальнейшем, при повторных исследованиях через 3–4 нед соотношение sFlt-1/PlGF поднималось выше верхнего ПЗ, что сопровождалось манифестацией ПЭ в сроки 28–36 нед беременности. Следует заметить, что у 8 из 13 (61,5 %) беременных, находящихся в «серой зоне», была диагностирована ранняя форма ПЭ, причем у 4 из них – тяжелая степень заболевания. У 5 из 13 (38,5 %) беременных с поздней ПЭ отмечена умеренная степень заболевания.
Заключение / Conclusion
Таким образом, использование соотношения sFlt-1/PlGF показало высокую значимость этого показателя в прогнозировании и диагностике ПЭ у беременных с двойней. Наше исследование демонстрирует отсутствие влияния типа плацентации при двойне на уровень факторов ангиогенеза. Разработанные нами пороговые значения соотношения sFlt-1/PlGF могут использоваться не только для постановки диагноза ПЭ, но и для оценки степени тяжести и сроков манифестации заболевания, позволяя оптимизировать тактику ведения беременных с двойней и ПЭ, что, несомненно, улучшит перинатальные исходы.
Список литературы
1. Сидорова И.С., Никитина Н.А., Унанян А.Л. Преэклампсия и снижение материнской смертности в России. Акушерство и гинекология. 2018;(1):107–12. https://doi.org/10.18565/aig.2018.1.107-112.
2. Курцер М.А., Шаманова М.Б., Синицина О.В. и др. Клиническое обоснование определения соотношения sFlt-1/PlGF с целью раннего выявления и оценки степени тяжести преэклампсии. Акушерство и гинекология. 2018;(11):114–20. https://doi.org/10.18565/aig.2018.11.114-120.
3. Say L., Chou D., Gemmill A. et al. Global causes of maternal death: a WHO systematic analysis. Lancet Glob Health. 2014;2(6):e323–33. https://doi.org/10.1016/S2214-109X(14)70227-X.
4. Redman C.W., Staff A.C. Preeclampsia, biomarkers, syncytiotrophoblast stress, and placental capacity. Am J Obstet Gynecol. 2015;213(4 Suppl):S9.e1, S9–11. https://doi.org/10.1016/j.ajog.2015.08.003.
5. Sánchez O., Llurba E., Marsal G. et al. First trimester serum angiogenic/anti-angiogenic status in twin pregnancies: relationship with assisted reproduction technology. Hum Reprod. 2012;27(2):358–65. https://doi.org/10.1093/humrep/der394.
6. Zeisler H., Llurba E., Chantraine F. et al. Predictive value of the sFlt-1:PlGF ratio in women with suspected preeclampsia. N Engl J Med. 2016;374(1):13–22. https://doi.org/10.1056/NEJMoa1414838.
7. Karumanchi S.A., Maynard S.E., Stillman I.E. et al. Preeclampsia: a renal perspective. Kidney Int. 2005;67(6):2101–13. https://doi.org/10.1111/j.1523-1755.2005.00316.x.
8. Narang K., Szymanski L.M. Multiple gestations and hypertensive disorders of pregnancy: What do we know? Curr Hypertens Rep. 2020;23(1):1. https://doi.org/10.1007/s11906-020-01107-4.
9. Francisco C., Wright D., Benkő Z. et al. Competing-risks model in screening for pre-eclampsia in twin pregnancy according to maternal factors and biomarkers at 11–13 weeks' gestation. Ultrasound Obstet Gynecol. 2017;50(5):589–95. https://doi.org/10.1002/uog.17531.
10. Kozłowski S., Stelmaszczyk-Emmel A., Szymusik I. et al. sFlt-1, not PlGF, is related to twin gestation choronicity in the first and third trimesters of pregnancy. Diagnostics (Basel). 2021;11(7):1181. https://doi.org/10.3390/diagnostics11071181.
11. Phipps E.A., Thadhani R., Benzing T., Karumanchi S.A. Pre-eclampsia: pathogenesis, novel diagnostics and therapies. Nat Rev Nephrol. 2019;15(5):275–89. https://doi.org/10.1038/s41581-019-0119-6. Erratum in: Nat Rev Nephrol. 2019;15(6):386. https://doi.org/10.1038/s41581-019-0156-1.
12. Fisher S.J. Why is placentation abnormal in preeclampsia? Am J Obstet Gynecol. 2015;213(4 Suppl):S115–22. https://doi.org/10.1016/j.ajog.2015.08.042.
13. Волочаева М.В., Баев О.Р. Современные представления о патогенезе задержки роста плода. Акушерство и гинекология. 2021;(8):13–7. https://doi.org/10.18565/aig.2021.8.13-17.
14. Bujold E., Romero R., Chaiworapongsa T. et al. Evidence supporting that the excess of the sVEGFR-1 concentration in maternal plasma in preeclampsia has a uterine origin. J Matern Fetal Neonatal Med. 2005;18(1):9–16. https://doi.org/10.1080/14767050500202493.
15. Nagamatsu T., Fujii T., Kusumi M. et al. Cytotrophoblasts up-regulate soluble fms-like tyrosine kinase-1 expression under reduced oxygen: an implication for the placental vascular development and the pathophysiology of preeclampsia. Endocrinology. 2004;145(11):4838–45. https://doi.org/10.1210/en.2004-0533.
16. Hytten F. Blood volume changes in normal pregnancy. Clin Haematol. 1985;14(3):601–12.
17. Курцер М.А., Сичинава Л.Г., Алажажи А.О. и др. Прогностическая значимость соотношения ангиогенных факторов sFlt-1/PlGF в качестве маркера преэклампсии у беременных двойней. Вопросы гинекологии, акушерства и перинатологии. 2022;21(2):5–13. https://doi.org/10.20953/1726-1678-2022-2-5-12.
18. Faupel-Badger J.M., McElrath T.F., Lauria M. et al. Maternal circulating angiogenic factors in twin and singleton pregnancies. Am J Obstet Gynecol. 2015;212(5):636.e1–8. https://doi.org/10.1016/j.ajog.2014.11.035.
19. Письмо Министерства здравоохрагегия Российской Федерации от 07 июня 2016 г. N 15-4/10/2-3483 «О направлении клинических рекомендаций (протокола лечения) «Гипертензивные расстройства во время беременности, в родах и послеродовом периоде. Преэклампсия. Эклампсия». Клинические рекомендации (Протокол лечения). М., 2016. 40 с. Режим доступа: https://rokb.ru/sites/default/files/pictures/gipertenzivnye_rasstroystva_vo_vremya_beremennosti_v_rodah_i_poslerodovom_periode._preeklampsiya._eklampsiya.pdf. [Дата обращения: 01.06.2022].
20. Рекомендации по лечению артериальной гипертонии. ESH/ESC 2013. Российский кардиологический журнал. 2014;19(1):7–94.
21. Ходжаева З.С., Холин А.М., Вихляева Е.М. Ранняя и поздняя преэклампсия: парадигмы патобиологии и клиническая практика. Акушерство и гинекология. 2013;(10):4–11.
22. Brandão A.H., Evangelista A.A., Martins R.M. et al. Prediction of early and late preeclampsia by flow-mediated dilation of the brachial artery. Radiol Bras. 2014;47(4):206–9. https://doi.org/10.1590/0100-3984.2013.1894.
Об авторах
М. А. КурцерРоссия
Курцер Марк Аркадьевич – д.м.н., профессор, академик РАН, зав. кафедрой акушерства и гинекологии педиатрического факультета ФГАОУ ВО «Российский национальный исследовательский медицинский университет имени Н.И. Пирогова» Министерства здравоохранения Российской Федерации; генеральный директор ГК «Мать и дитя»
117997 Москва, ул. Островитянова, д. 1
117209 Москва, Севастопольский проспект, д. 24, корп. 1
Л. Г. Сичинава
Россия
Сичинава Лали Григорьевна – д.м.н., профессор кафедры акушерства и гинекологии педиатрического факультета
117997 Москва, ул. Островитянова, д. 1
А. О. Алажажи
Россия
Алажажи Анастасия Олеговна – аспирант кафедры акушерства и гинекологии педиатрического факультета
117997 Москва, ул. Островитянова, д. 1
О. А. Латышкевич
Россия
Латышкевич Олег Александрович – к.м.н., доцент кафедры акушерства и гинекологии педиатрического факультета
117997 Москва, ул. Островитянова, д. 1
Е. В. Николаева
Россия
Николаева Елена Вячеславовна – врач клинической лабораторной диагностики, зав. отделением, клинико-диагностическая лаборатория «МД Проект 2000», Клинический Госпиталь MD Group
117209 Москва, Севастопольский проспект, д. 24, корп. 1
Рецензия
Для цитирования:
Курцер М.А., Сичинава Л.Г., Алажажи А.О., Латышкевич О.А., Николаева Е.В. Ангиогенные факторы (sFlt-1, PlGF) у беременных с двойней и плацента-ассоциированными осложнениями. Акушерство, Гинекология и Репродукция. 2022;16(5):541-551. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.330
For citation:
Kurtser M.A., Sichinava L.G., Alazhazhi A.O., Latyshkevich O.A., Nikolaeva E.V. Angiogenic factors (sFlt-1, PlGF) in twin pregnancy with placentaassociated complications. Obstetrics, Gynecology and Reproduction. 2022;16(5):541-551. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.330

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































