Перейти к:
Клиническое значение гемостазиологического скрининга на тромбофилию у беременных с тромбозами в анамнезе
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.361
Аннотация
Введение. Ведение беременности у женщин, перенесших тромбоз, является сложной задачей, так как женщины с предыдущим эпизодом венозных тромбоэмболических осложнений (ВТЭО) имеют в 3–4 раза более высокий риск ВТЭО во время последующих беременностей, чем вне беременности.
Цель: совершенствование программы эффективного дородового консультирования женщин с венозными тромбозами и ишемическими инсультами в анамнезе для предупреждения рецидивов артериальных и венозных осложнений и улучшения исходов беременности для матери и плода.
Материалы и методы. Проведено одноцентровое наблюдательное исследование с участием 50 пациенток с артериальными и венозными тромбозами и осложнениями беременности в анамнезе и 40 пациенток с физиологическим течением беременности. С целью улучшения существующих методов профилактики тромбозов изучены такие факторы риска, как полиморфизмы генов ингибитора активатора плазминогена-1 (англ. plasminogen activator inhibitor-1, PAI-1), фактора коагуляции II (протромбина; F2: Thr165Met), фактора коагуляции I (фибриногена; FGB I/D) как возможные новые кандидаты на роль маркеров риска тромбозов у беременных и родильниц.
Результаты. У 24 (48 %) из 50 женщин с артериальными и венозными тромбозами и осложнениями беременности в анамнезе тромбоэмболические осложнения развились во время беременности. После оценки риска согласно существующим шкалам оценки риска тромбозов только 7 (29,2 %) пациенток были расценены как кандидаты на тромбопрофилактику, они получали антикоагулянтную терапию. Остальные 17 женщин, у которых впоследствии произошел тромбоз, не получали антикоагулянтную терапию. К сожалению, большинство женщин не были обследованы на тромбофилию, несмотря на наличие в анамнезе осложнений беременности (потери плода, преэклампсия, задержка роста плода). Генетическая форма тромбофилии высокого тромбогенного риска встречалась у 5 (20,8 %) из 24 женщин с тромбозами во время беременности (3 – гомозиготные формы мутации фактора V Лейден, 1 – снижение протеина С и 1 – дефицит протеина S и антитромбина). Циркуляция различных видов антифосфолипидных антител встречалась у 13 (54,2 %) из 24 женщин. Гомозиготные формы полиморфизма гена PAI-1 4G/4G (45,8 %) и протромбина F2 Thr165Met (20,8 %) достоверно чаще встречались у женщин с тромбозами и акушерскими осложнениями в анамнезе по сравнению с контрольной группой (p < 0,001 и p = 0,023 соответственно; отношение шансов = 6,744; 95 % доверительный интервал = 1,195–38,056).
Заключение. Во всех случаях при обследовании 24 женщин с тромбозами во время беременности обнаружено наличие генетической или приобретенной тромбофилии высокого тромбогенного риска. После исключения тромбофилии высокого риска есть целый ряд полиморфизмов, которые могут быть новыми кандидатами в качестве фактора риска тромбозов у беременных. Более 50 % случаев тромбозов в нашей работе были связаны с гомозиготным генотипом PAI-1 4G/4G (p < 0,001) и F2 Thr165Met (p < 0,001).
Ключевые слова
Для цитирования:
Хизроева Д.Х., Бабаева Н.Н., Макацария Н.А., Элалами И., Гри Ж. Клиническое значение гемостазиологического скрининга на тромбофилию у беременных с тромбозами в анамнезе. Акушерство, Гинекология и Репродукция. 2022;16(5):528-540. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.361
For citation:
Khizroeva J.Kh., Babaeva N.N., Makatsariya N.A., Elalamy I., Gris J. Clinical significance of hemostasiological screening for thrombophilia in pregnant women with former thrombosis. Obstetrics, Gynecology and Reproduction. 2022;16(5):528-540. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.361
Введение / Introduction
Тромбоз во время беременности является основной причиной заболеваемости и смертности матери и плода. Беременные женщины имеют в 4–5 раз более высокий риск развития тромбозов по сравнению с небеременными женщинами того же возраста с предполагаемой частотой венозных тромбоэмболических осложнений (ВТЭО) примерно 1–2 на 1000 беременностей [1]. Примерно половина эпизодов ВТЭО, связанных с беременностью, происходит во время беременности с более или менее сходным распределением между триместрами, а другая половина – в течение 6 нед после родов. Как результат, ежедневный абсолютный риск наиболее высок в послеродовом периоде, тогда как антенатальный период длится гораздо дольше, чем послеродовой.
Знаменитая классическая триада Вирхова, в основе которой лежат гиперкоагуляция, венозный стаз и эндотелиальное повреждение, и по сей день является универсальной триадой патогенеза ВТЭО и наблюдается даже во время физиологической беременности и родов (рис. 1) [2].
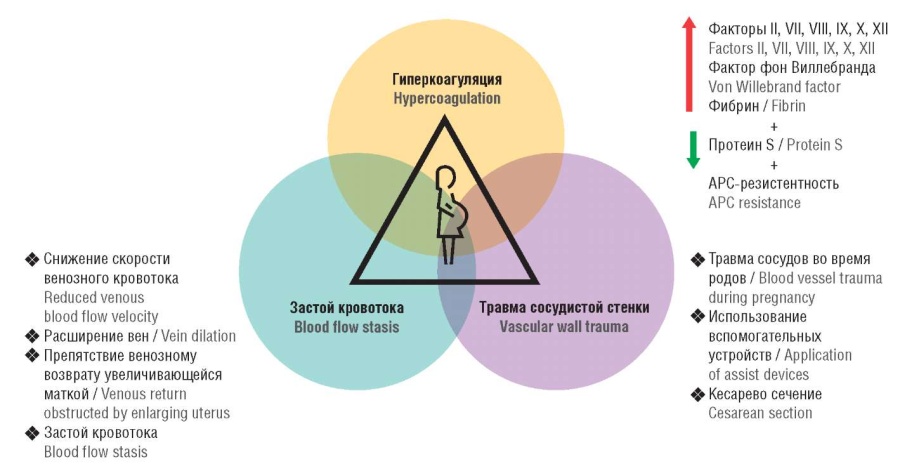
Рисунок 1. Триада Вирхова: акушерские аспекты [рисунок авторов].
Примечание: АРС – активированный протеин С.
Figure 1. The Virchow's triad: obstetrical aspects [drawn by authors].
Note: APC – activated protein C.
Во время беременности происходит прогрессивное увеличение содержания прокоагулянтных факторов свертывания: фактора фон Виллебранда (vWF), факторов (F) VIII, VII, V, X, XII, VII (табл. 1) [3]. Содержание фибриногена заметно растет уже с I триместра и к концу беременности почти в 2 раза превышает концентрацию до беременности. На поздних сроках гестации уровень FVII увеличивается до 10 раз. Не происходит повышения содержания FXI, протромбина, незначительно увеличивается концентрация FIX, уровень FXIII, изначально повышающийся в начальные сроки беременности, вновь возвращается к нормальному в III триместре.
Таблица 1. Физиологическая гиперкоагуляция во время беременности [3].
Table 1. Physiological hypercoagulability during pregnancy [3].
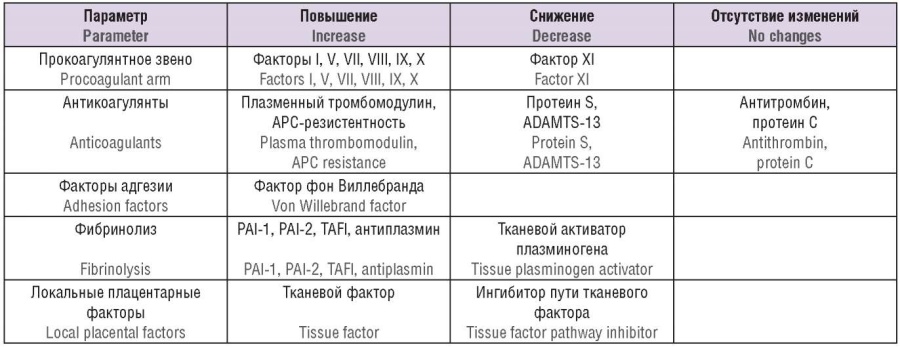
Примечание: АРС – активированный протеин С; PAI-1 – ингибитор активатора плазминогена 1-го типа; PAI-2 – ингибитор активатора плазминогена 2-го типа; TAFI – тромбин-активируемый ингибитор фибринолиза.
Note: APC – activated protein C; PAI-1 – plasminogen activator inhibitor type 1; PAI-2 – plasminogen activator inhibitor type 2; TAFI – thrombin activatable fibrinolysis inhibitor.
На протяжении всей беременности плацента синтезирует и секретирует протеолитически активный белок – металлопротеазу ADAMTS-13 (англ. a disintegrin and metalloprotease with thrombospondin type 1 motif, member 13). Активность ADAMTS-13 в плазме крови начинает снижаться с 12–16-й недели беременности, достигая в III триместре 23 % от первоначального нормального уровня. Белок ADAMTS-13 и матричная рибонуклеиновая кислота (мРНК) экспрессируются главным образом в трофобласте и эндотелии кровеносных сосудов плода. Самое высокое содержание плацентарного ADAMTS-13 наблюдается в I триместре с постепенным снижением во II и III триместрах беременности, что согласуется с прогрессирующим снижением концентрации ADAMTS-13 в плазме крови во время беременности [4].
Одновременно с повышением уровня факторов свертывания крови при беременности наблюдается снижение активности антикоагулянтной системы: развивается резистентность к активированному протеину С (англ. activated protein C, АРС). Начиная с 6–11-й недели беременности, концентрация протеина S снижается и прогрессивно уменьшается с увеличением сроков гестации почти на 40 %. Снижение активности протеина S связано с уменьшением его общей концентрации; в то время как значение протеина C, образующего неактивный комплекс с протеином S, не изменяется. Увеличение резистентности к APC выявляется у 57 % женщин и достигает пика в 28 нед беременности. При этом чем более выражена резистентность к APC до беременности (у пациенток с мутацией FV Leiden), тем в большей степени резистентность к APC проявляется во время беременности. Развитию резистентности к APC во время беременности может способствовать как повышение активности FVIII, так и уменьшение концентрации протеина S. Высокий уровень FVIII и резистентность к АРС являются независимыми факторами, связанными с повышенным риском ВТЭО. Содержание антитромбина III и протеина С при беременности существенно не изменяется [3][5].
При беременности происходит торможение фибринолитической системы, однако работа фибринолиза быстро восстанавливается после родов. Нарушение в системе фибринолиза при беременности связано с постоянной продукцией в плацентарном ложе ингибитора активатора плазминогена-2 (англ. plasminogen activator inhibitor-2, PAI-2) и трехкратным увеличением экспрессии ингибитора активатора плазминогена-1 (англ. plasminogen activator inhibitor-1, PAI-1) на эндотелиальной поверхности. Экспрессия PAI-2 значительно возрастает у беременных с преэклампсией (ПЭ), а также при наличии внутриутробной задержки роста плода (ЗРП). Состояние гипофибринолиза усугубляется при повышении уровня антиплазмина и тромбин-активируемого ингибитора фибринолиза (англ. thrombin activatable fibrinolysis inhibitor, TAFI).
Если в отсутствие беременности в условиях активации тромботических процессов увеличивается как уровень свободного, так и связанного тканевого активатора плазминогена (англ. tissue plasminogen activator, t-PA), то при беременности отмечается уменьшение обеих форм t-PA. Это свидетельствует об уменьшении экспрессии t-PA и его значительном ингибировании за счет связывания с PAI при беременности, что также объясняет состояние гиперкоагуляции у беременных. С увеличением срока беременности наблюдается прогрессивное увеличение продуктов деградации фибрина, в частности D-димера. С одной стороны, это свидетельствует о том, что не происходит полного угнетения фибринолиза. С другой стороны, увеличение D-димера отражает скорее не активность фибринолитической системы, а усиление продукции фибрина. Таким образом, при беременности выявляется одновременно активация коагуляции и усиленная продукция фибрина, а также усиление деградации фибрина, что свидетельствует о готовности формирования во время беременности ДВС-синдрома.
В высокоразвитых странах (США, Великобритания, Германия), одних из немногих стран, которые всесторонне собирают, анализируют и публикуют данные о материнской смертности (http://www.cemd.org.uk/), ВТЭО были наиболее распространенной прямой причиной материнской смертности на протяжении многих лет [6][7]. Венозный тромбоэмболизм возникает в результате тромбоза глубоких вен (ТГВ), но многие тромбозы не распознаются до возникновения ВТЭО. ТГВ также ассоциируется со значительным риском рецидива тромбоза, особенно если в основе тромбоза лежит тромбофилия, а проявлением посттромботического синдрома является недостаточность глубоких вен [7][8]. ВТЭО в случае его нераспознавания несет в себе риск развития последующей легочной гипертензии с повышенным риском разнообразных акушерских осложнений. Кроме того, ВТЭО, связанные с беременностью, позволяют выявить женщин с тромбофилией, которая связана с повышенным риском осложнений беременности. Многие случаи материнской смертности вследствие ВТЭО обусловлены неадекватной терапией, включая неспособность распознать факторы риска ВТЭО, неспособность обеспечить надлежащую тромбопрофилактику для лиц, находящихся в группе риска, неспособность объективно диагностировать ВТЭО и неспособность обеспечить надлежащее лечение.
Факторы риска тромбозов во время беременности / Thrombosis risk factors during pregnancy
Для стратификации риска ВТЭО во время беременности, родов и послеродового периода в мире разработаны различные модели/шкалы оценки риска по выявлению женщин с повышенным риском развития ВТЭО, которые позволяют снизить вероятность тромбозов во время беременности и в послеродовом периоде [9–11].
Наиболее распространенные факторы риска венозных и артериальных тромбозов в общей популяции присутствуют и во время беременности [12]. Традиционно к факторам риска венозных тромбозов относят:
- семейный анамнез ТГВ;
- ТГВ в анамнезе;
- гормональную терапию или применение оральных контрацептивов;
- беременность;
- повреждение стенки сосуда, например, в результате операции, перелома кости или другой травмы;
- иммобилизацию, например, после операции или в длительной поездке;
- наследственные нарушения свертываемости крови;
- центральный венозный катетер;
- пожилой возраст;
- курение;
- избыточный вес или ожирение;
- некоторые заболевания, такие как рак, болезни сердца, легких или болезнь Крона.
Факторы риска артериального тромбоза включают:
- курение;
- сахарный диабет;
- высокое артериальное давление;
- повышенный уровень холестерина;
- недостаток активности и ожирение;
- неправильное питание;
- семейный анамнез артериального тромбоза;
- недостаток движения, например, после операции или в длительной поездке;
- пожилой возраст.
Совокупная оценка этих факторов риска позволила разработать шкалы прогнозирования возникновения ВТЭО в антенатальном или постнатальном периодах [11][13–16]. Эти показатели с учетом полученных баллов позволяют начать профилактику тромбоэмболии низкими дозами антикоагулянтов и способствовать предотвращению повторных ВТЭО во время беременности. При общем количестве баллов более 4 в антенатальном периоде требуется тромбопрофилактика с I триместра; при 3 баллах тромбопрофилактика проводится с 28-й недели. Если количество баллов ≥ 2 в послеродовом периоде, то тромбопрофилактика проводится, как минимум, в течение 10 дней.
Однако, несмотря на разработку и использование различных шкал оценки риска развития ВТЭО у беременных или женщин в послеродовом периоде (в течение 6 нед после родов) и наличие клинических рекомендаций по ведению беременных с тромбозами, случаи рецидива ВТЭО продолжают иметь место и остаются ведущей причиной материнской смертности даже в экономически высоко развитых странах [15][17][18]. Успехи биологии и медицины существенно расширили наши представления о патогенетических механизмах тромбозов. Дефицит ADAMTS-13 является фактором риска развития инфаркта миокарда, инсульта, церебральной ишемии и ПЭ. В многофакторном логистическом регрессионном анализе, проведенном учеными из Центра геморрагических и тромботических заболеваний и Центра гемофилии Медицинского факультета Католического университета Италии [19], у пациентов с циррозом печени только активность ADAMTS-13 (p = 0,007) была независимо и обратно связана с тромбозом воротной вены. Онкологические пациенты, у которых развивается ТГВ, также демонстрируют особую картину: высокие уровни vWF:Ag в плазме и низкие уровни ADAMTS-13 в плазме, что приводит к большому разрыву в соотношении vWF:Ag/ADAMTS-13 и является независимым фактором риска тромбозов [20].
Другим фактором риска тромбозов является воспаление. Хотя о взаимосвязи между воспалением и тромбозом известно давно, исследования в этой области продолжаются. Существует множество системных воспалительных заболеваний, характеризующихся склонностью к тромбообразованию, включая болезнь Бехчета, васкулиты, ассоциированные с антинейтрофильными цитоплазматическими антителами, артериит Такаясу, ревматоидный артрит, системную красную волчанку, антифосфолипидный синдром (АФС), семейную средиземноморскую лихорадку, облитерирующий тромбангиит и воспалительные заболевания кишечника. Воспаление увеличивает прокоагулянтные факторы, а также подавляет естественные антикоагулянтные пути и фибринолитическую активность, вызывая склонность к тромбообразованию. Кроме того, хроническое воспаление может вызвать повреждение эндотелия, приводящее к потере физиологических антикоагулянтных, антиагрегантных и сосудорасширяющих свойств эндотелия.
За последние годы значительно выросло количество факторов риска тромбозов, связанных с активным внедрением новых медицинских технологий, которые еще 30 лет назад не применялись или их роль в возникновении тромбозов не была изучена, например, беременность после вспомогательных репродуктивных технологий (ВРТ), в частности экстракорпорального оплодотворения (ЭКО) [21]. Гиперстимуляция яичников в процессе гормональных протоколов ЭКО провоцирует прокоагулянтные изменения в системе гемостаза и фибринолиза, которые могут привести к тромбозу. Анализ литературы выявил описание различных полиморфизмов, которые предрасполагают к развитию тромбоза, главным образом тех, которые связаны с факторами свертывания, такими как фибриноген, FVIII, FVII, FXIII, рецептор АРС, тромбомодулин, РАI-1, t-PA, TAFI, рецепторы тромбоцитов (GPIIb-IIIa, GPIbIX-V, GPIa-IIa, GPVI и др.) и т. д. [22]. Продолжаются исследования роли многочисленных одиночных и комбинированных генетических вариаций и полиморфизмов, особенно в генах свертывания крови и фибринолиза, а также в генах воспаления и других генах, взаимодействующих с образом жизни и факторами окружающей среды, такими как иммунная и окислительная системы, как факторов риска тромбозов [23].
Цель: совершенствование программы эффективного дородового консультирования женщин с венозными тромбозами и ишемическими инсультами в анамнезе для предупреждения рецидивов артериальных и венозных осложнений и улучшения исходов беременности для матери и плода.
Материалы и методы / Materials and Methods
Дизайн исследования / Study design
Проведено одноцентровое наблюдательное исследование с участием 50 пациенток с артериальными и венозными тромбозами и осложнениями беременности в анамнезе. Все пациентки были обследованы в лаборатории патологии гемостаза на базе Медицинского Женского Центра (Москва) в период с 2018 по 2022 гг. Все женщины находились в репродуктивном возрасте, их возраст колебался от 28 до 37 лет, масса тела – 65,1 ± 1,6 кг, рост – 165,0 ± 1,5 см. Причиной обращения в клинику было планирование следующей беременности.
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения: возраст более 18 лет; наличие в анамнезе ВТЭО, ишемического инсульта; наличие подтвержденной беременности после перенесенного тромботического события; наличие акушерских осложнений в анамнезе; согласие пациентки принять участие в исследовании.
Критерии исключения: геморрагический характер инсульта в анамнезе; тяжелые соматические заболевания в стадии декомпенсации; злокачественные онкологические заболевания; психические заболевания; отказ от участия в исследовании.
Группы сравнения / Comparison groups
Среди обследованных 50 женщин с отягощенным акушерским анамнезом и венозными и артериальными тромбозами в анамнезе, соответствующих критериям включения (группа 1), были выделены 24 женщины, у которых тромбоз произошел во время беременности (группа 2). Контрольную группу составили 40 здоровых беременных женщин.
Методы исследования / Study methods
На первом этапе работы были изучены клиникоанамнестические данные с критической оценкой тромботического анамнеза с определением анатомической локализации предшествующих тромбозов; оценены объем, продолжительность и эффективность предшествующей терапии; проведен анализ сопутствующих заболеваний. Была проведена оценка риска ВТЭО согласно современным Российским клиническим рекомендациям по диагностике, лечению и профилактике ВТЭО [1]. На втором этапе все отобранные для исследования пациенты были обследованы на наличие наследственных и приобретенных форм тромбофилией с определением следующих параметров: антитела к кардиолипину, β2-гликопротеину I и аннексину V с использованием коммерческих наборов для иммуноферментных методов (ORGENTEC, Германия), антитела к фосфатидилсерин-протромбину (Aesku, США), антитромбин (Technoclone, Австрия), протеин С (Aesku, США), протеин S (Aesku, США), генетические мутации в гене фактора FV Leiden (Technoclone, Австрия), в гене протромбина F2 G20210A и гомоцистеин (Axis-Shield, Великобритания).
С целью улучшения существующих методов профилактики тромбозов и улучшения исходов беременности для матери и плода были изучены дополнительные факторы риска, в частности, полиморфизмы генов PAI-1, F2 Thr165Met (Technoclone, Австрия) как возможные новые кандидаты на факторы риска тромбозов у беременных и родильниц.
Плазма крови здоровых женщин (контрольная группа) также была исследована на данные показатели.
Этические аспекты / Ethical aspects
Исследование было одобрено локальным этическим комитетом ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет), протокол № 10-21 от 17.06.2021. Все пациентки, участвовавшие в исследовании, были проинформированы о характере исследования, включении результатов обследования в научно-исследовательскую работу. Получено письменное информированное согласие.
Исследование проведено в соответствии с этическими стандартами Хельсинской декларации Всемирной медицинской ассоциации 1964 г. и ее последующими изменениями.
Статистический анализ / Statistical analysis
Полученные данные были систематизированы в электронных таблицах Microsoft Office Excel 2019 (версия 16.66.1). Далее материалы исследования были подвергнуты статистическому анализу с использованием программы Statistica 13.3 Russian/ English для Windows (StatSoft Inc., США). Переменные сравнивали с помощью методов параметрического и непараметрического анализа. Показатели с нормальным распределением были объединены в вариационные ряды, в которых рассчитывали средние арифметические величины, стандартные отклонения, границы 95 % доверительного интервала (95 % ДИ). Для проверки статистической значимости факторов использовали однофакторный дисперсионный анализ путем расчета точного критерия Фишера, значение которого менее 0,05 свидетельствовало о наличии статистически значимых различий, значение критерия Фишера р > более 0,05 – об отсутствии различий. Сравнение относительных показателей производили с помощью показателей отношения шансов (ОШ) и относительного риска (ОР). Номинальные данные были представлены в виде абсолютных значений и процентных долей. Сравнение номинальных данных проводили при помощи критерия χ2 Пирсона. Вывод о наличии сильной статистической взаимосвязи между исследуемым фактором и исходом делался в том случае, если полученное значение критерия Пирсона превышало критическое значение. Для выявления статистической значимости корреляционной связи между тромбозами и тромбофилическими нарушениями производили расчет коэффициента корреляции Пирсона. Связь являлась статистически значимой при значении коэффициента корреляции р < 0,01.
Результаты и обсуждение / Results and Discussion
Из 50 обследованных женщин с тромбозами и акушерскими осложнениями в анамнезе венозные тромбозы встречались у 43 женщин, в то время как артериальные – у 7 пациенток. У одной из пациенток в анамнезе были одновременно и артериальные и венозные тромботические события.
У женщин наблюдались тромбозы различной локализации (табл. 2), из которых преобладал ТГВ.
Таблица 2. Локализация артериальных и венозных тромбозов у 50 женщин с акушерскими осложнениями и тромбозами.
Table 2. Localization of arterial and venous thrombosis in 50 women with obstetric complications and thrombosis.

Анализ данных показал, что основными факторами риска во время артериальных и венозных тромбозов у обследованных нами женщин были беременность (44 %), прием комбинированных оральных контрацептивов (24 %), оперативное вмешательство (16 %), протокол ЭКО (14 %), аутоиммунные заболевания (14 %), инфекция (10 %), курение (10 %), послеродовый период (8 %), авиаперелет (4 %), катетер (6 %), травма (4 %) и др. К сожалению, 28 из 50 женщин с отягощенным акушерским анамнезом и тромбозами были обследованы на наличие генетической и приобретенной тромбофилии лишь после случившегося тромбоза, несмотря на потери плода в анамнезе. После обследования на приобретенные и наследственные формы тромбофилии факторы риска венозных и артериальных тромбозов распределились следующим образом (табл. 3).
Таблица 3. Факторы риска тромбозов у обследованных пациенток.
Table 3. Thrombosis risk factors in patients examined.

Особого внимания заслуживает группа женщин (n = 24), у которых тромбоз произошел во время беременности. Всем им была проведена оценка риска тромбозов согласно современным российским клиническим рекомендациям «Венозные осложнения во время беременности и послеродовом периоде. Акушерская тромбоэмболия» [16] с целью решения вопроса о целесообразности назначения антикоагулянтной терапии во время следующей беременности. После оценки риска из 24 женщин с тромбозами во время беременности только 7 беременных набрали 4 балла и, соответственно, получали антикоагулянтную терапию; 17 женщинам тромбопрофилактика не проводилась в связи с недостаточным количеством баллов (10 человек получили 3 балла, 3 женщины – 2 балла, 4 пациентки – 1 балл). К сожалению, большинство женщин не были обследованы на наличие тромбофилических нарушений во время или после тромбоза, несмотря на наличие в анамнезе осложнений беременности (потери плода, мертворождение, ЗРП, проведение ВРТ в связи с бесплодием).
Согласно существующим ныне исследованиям, тромбофилия встречается примерно у 50 % женщин с ВТЭО во время беременности [2]. У 9 из 17 женщин, которые не получали антикоагулянты, в нашем исследовании была выявлена тромбофилия высокого риска, к которой относят АФС, гомозиготные формы мутаций в гене FV Лейден и в гене F2 G20210A, или сочетание гетерозиготных форм этих мутаций, а также дефицит антитромбина (может быть приобретенным), дефицит протеинов С и S (могут быть и приобретенными) [24].
Наиболее серьезным гемостазиологическим фактором риска венозных тромбозов у женщин с тромбозами и акушерскими осложнениями в анамнезе (54,2 %) явилась циркуляция антифосфолипидных антител (АФА) (табл. 4). У 5 из 9 женщин с тромбофилией высокого риска был диагностирован АФС (высокие титры антител к кардиолипину, или антитела к β2-гликопротеину 1, или циркуляция волчаночного антикоагулянта) и у 3 – генетическая тромбофилия (гомозиготная форма мутации FV Лейден). У 3 женщин тромбоз произошел на фоне гетерозиготных форм мутации FV Лейден (n = 2) и мутации в гене F2 G20210А (n = 1).
Таблица 4. Исследование тромбофилических дефектов у пациенток с тромбозами и акушерскими осложнениями в анамнезе.
Table 4. Examination of thrombophilic defects in patients with thrombosis and obstetric complications in anamnesis.
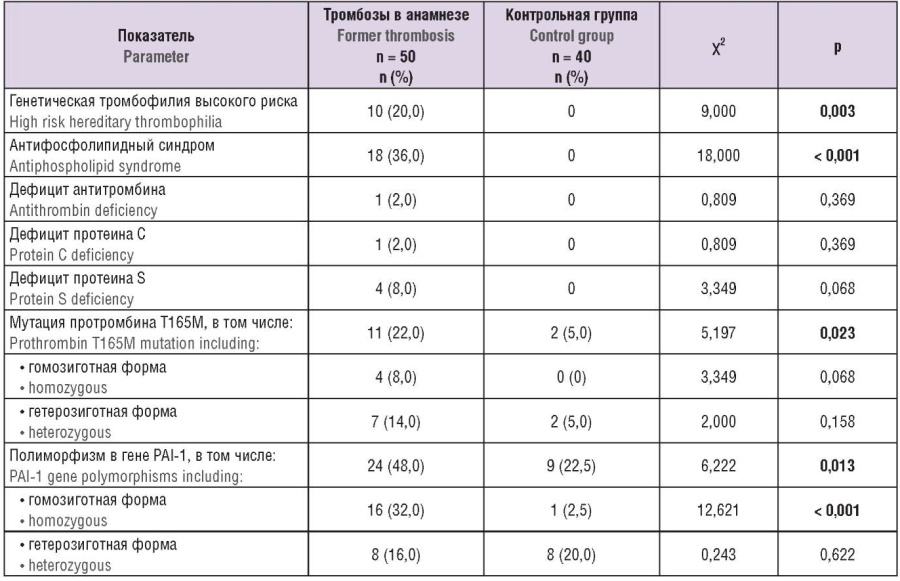
Примечание: PAI-1 – ингибитор активатора плазминогена 1-го типа; n – абсолютные значения признака; выделены значимые различия.
Note: PAI-1 – plasminogen activator inhibitor type 1; n – absolute values; significant differences are highlighted.
Пациенток, у которых не было выявлено тромбофилии высокого тромбогенного риска, обследовали на наличие/отсутствие других полиморфизмов/мутаций в системе гемостаза (в гене протромбина F2 Thr165Met, PAI-1 5G/4G, фибриногена I/D, t-РА, тромбоцитарных рецепторов) и некритериальные АФА – антитела к протромбину, фосфатидилсерин-протромбину, аннексину V, скрининг которых традиционно не проводится, и риск тромбозов которых, соответственно, неизвестен. У одной женщины мы обнаружили некритериальные АФА и у 5 – полиморфизмы генов PAI-1 и F2 T1655 и сильную статистически значимую связь тромбозов с гомозиготной формой мутации в гене протромбина Thr165Met (p = 0,023) и гомозиготным генотипом PAI-1 4G/4G (p < 0,001; ОШ = 6,744; 95 % ДИ = 1,195–38,056).
Тромбопрофилактика / Thromboprophylaxis
Терапевтический подход у женщин с тромбозами в анамнезе включает антикоагулянтную терапию препаратами из группы низкомолекулярных гепаринов (НМГ) или комбинацию НМГ с низкими дозами ацетилсалициловой кислоты (АСК) [25–28].
Для беременных с циркуляцией АФА и перенесших тромбоз в анамнезе терапевтическая, скорректированная доза НМГ плюс низкие дозы АСК является оптимальной терапией во время беременности с последующей пероральной антикоагулянтной терапией минимум в течение 6 нед в послеродовом периоде [29][30]. Женщинам с наследственной тромбофилией высокого риска тромбозов рекомендуется скорректированная антенатальная и постнатальная тромбопрофилактика рецидивов тромбоза на протяжении всей беременности и 6 нед после родов [31][32]. Пациентки с гомозиготными формами полиморфизма генов PAI-1 и F2 Thr165Met должны получать профилактическую антикоагулянтную терапию НМГ на протяжении всей беременности и 6 нед послеродового периода [33].
Заключение / Conclusion
Оценка и контроль исследований, проведенных для выявления этиологического фактора развития тромбоза, позволяют выработать соответствующую стратегию вторичной профилактики. ВТЭО у женщин с тромбофилией отражает многофакторное событие, возникающее в результате взаимодействия генетических и приобретенных факторов риска. Для проведения тромбопрофилактики необходимо установить риск тромбоза у беременных с тромбофилией. Степень риска зависит от лежащих в основе тромбофилических нарушений, анамнеза тромботических событий и дополнительных факторов риска. Помимо первоначальной оценки факторов риска ВТЭО, женщины с предшествующими тромбоэмболическими и акушерскими осложнениями в анамнезе должны быть обследованы на приобретенные и наследственные формы тромбофилии высокого тромбогенного риска (АФС, мутации в генах F5 G1691A и протромбина F2 G20210A, дефицит антитромбина, протеина С, протеина S). В нашем исследовании почти 70% женщин с тромбозами во время беременности не получали антикоагулянтную терапию, так как не были антенатально расценены как кандидаты на проведение тромбопрофилактики, несмотря на использование при их ведении существующих ныне методических рекомендаций по профилактике венозного тромбоэмболизма. У 47,1% женщин, которые не получали антикоагулянтную терапию, была выявлена тромбофилия высокого риска.
После исключения тромбофилии высокого риска есть целый ряд полиморфизмов, которые могут быть новыми кандидатами в качестве фактора риска тромбозов у беременных.
В связи с тем, что гомозиготные формы полиморфизмов генов PAI-1 4G/4G (45,8 %) и протромбина F2 Thr165Met (20,8 %) достоверно чаще встречались у женщин с тромбозами и акушерскими осложнениями в анамнезе по сравнению с контрольной группой (p < 0,001 и p = 0,023 соответственно), мы рекомендуем всем беременным с тромбозами в анамнезе обследование на наличие/отсутствие генотипов PAI-1 и протромбина Thr165Met.
Список литературы
1. Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений (ВТЭО). Флебология. 2015;9(4–2):1–52.
2. Bitsadze V., Khizroeva J., Elalamy I., Makatsariya A. Venous thrombosis risk factors in pregnant women. J Perinat Med. 2020 Oct 26:jpm-2020-0011. https://doi.org/10.1515/jpm-2020-0011. Online ahead of print.
3. Brenner B. Haemostatic changes in pregnancy. Thromb Res. 2004;114(5–6):409–14. https://doi.org/10.1016/j.thromres.2004.08.004.
4. Xiao J., Feng Y., Li X. et al. Expression of ADAMTS13 in normal and abnormal placentae and its potential role in angiogenesis and placenta development. Arterioscler Thromb Vasc Biol. 2017;37(9):1748–56. https://doi.org/10.1161/ATVBAHA.117.309735.
5. Brenner B., Grandone E., Makatsariya A. et al. Approach to the evaluation and treatment of venous thromboembolism in pregnancy. Semin Reprod Med. 2021;39(5–06):186–93. https://doi.org/10.1055/s-0041-1736188.
6. Knight M., Tuffnell D. A view from the UK: The UK and Ireland confidential enquiry into maternal deaths and morbidity. Clin Obstet Gynecol. 2018;61(2):347–58. https://doi.org/10.1097/GRF.0000000000000352.
7. Wik H.S., Jacobsen A.F., Sandvik L., Sandset P.M. Prevalence and predictors for post-thrombotic syndrome 3 to 16 years after pregnancyrelated venous thrombosis: a population-based, cross-sectional, casecontrol study. J Thromb Haemost. 2012;10(5):840–7. https://doi.org/10.1111/j.1538-7836.2012.04690.x.
8. Macklon N.S., Greer I.A. Venous thromboembolic disease in obstetrics and gynaecology: the Scottish experience. Scot Med J. 1996;41(3):83–6. https://doi.org/10.1177/003693309604100305.
9. Cutts B.A., Tran H.A., Merriman E. et al. The utility of the Wells clinical prediction model and ventilation-perfusion scanning for pulmonary embolism diagnosis in pregnancy. Blood Coagul Fibrinolysis. 2014;25(4):375–8. https://doi.org/10.1097/MBC.0000000000000054.
10. Dargaud Y., Rugeri L., Vergnes M.C. et al. A risk score for the management of pregnant womenwith increased risk of venous thromboembolism: a multicentre prospective study. Br J Haematol. 2009;145(6):825–35. https://doi.org/10.1111/j.1365-2141.2009.07698.x.
11. Reducing the risk of venous thromboembolism during pregnancy and the puerperium (Green-top Guideline No. 37a). Royal College of Obstetricians and Gynaecologists, 2015. 40 р. Режим доступа: https://www.rcog.org.uk/media/qejfhcaj/gtg-37a.pdf. [Дата обращения: 25.09.2022].
12. McColl M., Ramsay J.E., Tait R.C. et al. Risk factors for pregnancy associated venous thromboembolism. Thromb Haemost. 1997;78(4):1183–8.
13. Liu S., Rouleau J., Joseph K.S. et al. Epidemiology of pregnancyassociated venous thromboembolism: a population-based study in Canada. J Obstet Gynaecol Can. 2009;31(7):611–20. https://doi.org/10.1016/S1701-2163(16)34240-2.
14. Sultan A.A., West J., Tata L.J. et al. Risk of first venous thromboembolism in and around pregnancy: a population-based cohort study. Br J Haematol. 2012;156(3):366–73. https://doi.org/10.1111/j.1365-2141.2011.08956.x.
15. James A.H., Jamison M.G., Brancazio L.R., Myers E.R. Venous thromboembolism during pregnancy and the postpartum period: incidence, risk factors, and mortality. Am J Obstet Gynecol. 2006;194(5):1311–5. https://doi.org/10.1016/j.ajog.2005.11.008.
16. Клинические рекомендации. Венозные осложнения во время беременности и послеродовом периоде. Акушерская тромбоэмболия. М.: Министерство здравоохранения Российской Федерации, 2022. 99 с. Режим доступа: https://zdrav.khv.gov.ru/sites/files/zdrav/docs/2016/05104b398aef51019755.pdf. [Дата обращения: 25.09.2022].
17. Ewins K., Ní Ainle F. VTE risk assessment in pregnancy. Res Pract Thromb Haemost. 2019;26;4(2):183–92. https://doi.org/10.1002/rth2.12290.
18. Coutts S.B., Wein T.H., Lindsay M.P. Canadian Stroke Best Practice Recommendations: Secondary prevention of stroke guidelines, update 2014. Int J Stroke. 2015;10(3):282–91. https://doi.org/10.1111/ijs.12439.
19. Lancellotti S., Basso M., Veca V. et al. Presence of portal vein thrombosis in liver cirrhosis is strongly associated with low levels of ADAMTS-13: a pilot study. Intern Emerg Med. 2016;11(7):959–67. https://doi.org/10.1007/s11739-016-1467-x.
20. Setiawan B., Permatadewi C.O., de Samakto B. et al. Von Willebrand factor:antigen and ADAMTS-13 level, but not soluble P-selectin, are risk factors for the first asymptomatic deep vein thrombosis in cancer patients undergoing chemotherapy. Thromb J. 2020;18(1):33. https://doi.org/10.1186/s12959-020-00247-6.
21. Grandone E., Di Micco P.P., Villani M. et al.; RIETE Investigators. Venous thromboembolism in women undergoing assisted reproductive technologies: Data from the RIETE Registry. Thromb Haemost. 2018;118(11):1962–8. https://doi.org/10.1055/s-0038-1673402.
22. Lane D.A., Grant P.J. Role of hemostatic gene polymorphisms in venous and arterial thrombotic disease. Blood. 2000;95(5):1517–32.
23. Colucci G., Tsakiris D.A. Thrombophilia screening revisited: an issue of personalized medicine. J Thromb Thrombolysis. 2020;49(4):618–29. https://doi.org/10.1007/s11239-020-02090-y.
24. Gerhardt A., Scharf R.E., Beckman M.W. et al. Prothrombin and factor V mutations in women with thrombosis during pregnancy and the puerperium. N Engl J Med. 2000;342(6):374–80. https://doi.org/10.1056/NEJM200002103420602.
25. Schisterman E.F., Silver R.M., Lesher L.L. et al. Preconception low-dose aspirin and pregnancy outcomes: Results from the EAGeR randomised trial. Lancet. 2014;384(9937):29–36. https://doi.org/10.1016/S0140-6736(14)60157-4.
26. Bell A.D., Roussin A., Cartier R. et al. The use of antiplatelet therapy in the outpatient setting: Canadian Cardiovascular Society guidelines. Can J Cardiol. 2011;27 Suppl A:S1–59. https://doi.org/10.1016/j.cjca.2010.12.015.
27. Datta P., Rewers-Felkins K., Kallem R.R. et al. Transfer of low dose aspirin into human milk. J Hum Lact. 2017;33(2):296–9. https://doi.org/10.1177/0890334417695207.
28. Chan W.S., Rey E., Kent N.E.; VTE in Pregnancy Guideline Working Group; Society of Obstetricians and Gynecologists of Canada. Venous thromboembolism and antithrombotic therapy in pregnancy. J Obstet Gynaecol Can. 2014;36(6):527–53. https://doi.org/10.1016/s1701-2163(15)30569-7.
29. Crowley M.P., Noone C., Higgins J.R., O'Shea S. A multicentre study of thromboprophylaxis in pregnancy. Ir Med J. 2017;110(5):567.
30. Middleton P., Shepherd E., Gomersall J.C. Venous thromboembolism prophylaxis for women at risk during pregnancy and the early postnatal period. Cochrane Database Syst Rev. 2021;3(3):CD001689. https://doi.org/10.1002/14651858.CD001689.pub4.
31. Nichols K.M., Henkin S., Creager M.A. Venous thromboembolism associated with pregnancy: JACC Focus Seminar. J Am Coll Cardiol. 2020;76(18):2128–41. https://doi.org/10.1016/j.jacc.2020.06.090.
32. Bates S.M., Greer I.A., Middeldorp S. et al. VTE, thrombophilia, antithrombotic therapy, and pregnancy: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012;141(2 Suppl):e691S–e736S. https://doi.org/10.1378/chest.11-2300.
33. Sartori M.T., Danesin C., Saggiorato G. et al. The PAI-1 gene 4G/5G polymorphism and deep vein thrombosis in patients with inherited thrombophilia. Clin Appl Thromb Hemost. 2003;9(4):299–307. https://doi.org/10.1177/107602960300900405.
Об авторах
Д. Х. ХизроеваРоссия
Хизроева Джамиля Хизриевна – д.м.н., профессор кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 57194547147
Researcher ID: F-8384-2017.
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Н. Н. Бабаева
Россия
Бабаева Нигяр Наби кызы – аспирант кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Н. А. Макацария
Россия
Макацария Наталия Александровна – к.м.н., доцент кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова
Researcher ID: F-8406-2017
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
И. Элалами
Россия
Элалами Исмаил – д.м.н., профессор кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова ФГАОУ ВО Первый Московский государственный медицинский университет имени И.М. Сеченова Министерства здравоохранения Российской Федерации (Сеченовский Университет); профессор медицинского Университета Сорбонны; директор гематологии Центра Тромбозов, Госпиталь Тенон
Scopus Author ID: 7003652413
Researcher ID: AAC-9695- 2019
119991 Москва, ул. Большая Пироговская, д. 2, стр.
475006, Франция, Париж, Улица медицинского факультета, д. 12
75020, Франция, Париж, Китайская улица, д. 4
Ж-К. Гри
Россия
Гри Жан-Кристоф – д.м.н., профессор кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова ФГАОУ ВО Первый Московский государственный медицинский университет имени И.М. Сеченова Министерства здравоохранения Российской Федерации (Сеченовский Университет); профессор гематологии, зав. лабораторией гематологии факультета биологических и фармацевтических наук Университета Монпелье и Университетской больницы Нима; иностранный член РАН
Scopus Author ID: 7005114260
Researcher ID: AAA-2923-2019
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
34090, Франция, Монпелье, ул. Огюста Бруссоне, д. 163
Рецензия
Для цитирования:
Хизроева Д.Х., Бабаева Н.Н., Макацария Н.А., Элалами И., Гри Ж. Клиническое значение гемостазиологического скрининга на тромбофилию у беременных с тромбозами в анамнезе. Акушерство, Гинекология и Репродукция. 2022;16(5):528-540. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.361
For citation:
Khizroeva J.Kh., Babaeva N.N., Makatsariya N.A., Elalamy I., Gris J. Clinical significance of hemostasiological screening for thrombophilia in pregnant women with former thrombosis. Obstetrics, Gynecology and Reproduction. 2022;16(5):528-540. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.361

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































