Перейти к:
Ретроспективное сравнительное исследование исходов вспомогательных репродуктивных технологий у женщин в программах экстракорпорального оплодотворения с применением рекомбинантных гонадотропинов
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.304
Аннотация
Введение. В настоящее время в программах вспомогательных репродуктивных технологий (ВРТ) используются различные гормональные препараты, что позволяет значительно усовершенствовать схемы для стимуляции суперовуляции.
Цель: провести сравнительный анализ эффективности препаратов рекомбинантного фолликулостимулирующего гормона в программах экстракорпорального оплодотворения (ЭКО) и переноса эмбриона (ПЭ).
Материалы и методы. Проведен ретроспективный анализ 75 амбулаторных карт пациенток, проходивших лечение бесплодия методами ЭКО и ПЭ в условиях рутинной клинической практики с использованием препаратов фоллитропин альфа (Гонал-Ф®), фоллитропин бета (Пурегон®) и нового биоаналогового фоллитропина альфа (Примапур®) для овариальной стимуляции. Женщины были разделены на равные группы по 25 пациенток на каждом из препаратов. Оценивали основные показатели эффективности циклов ЭКО и ПЭ: количество аспирированных ооцитов, количество полученных эмбрионов, процент наступления клинической беременности, а также показатель «Take home baby».
Результаты. Пациентки были сопоставимы по возрасту, гормональному статусу, основным параметрам соматического и гинекологического анамнеза, паритету, факторам бесплодия. Максимальное количество эмбрионов на 5-е сутки, в том числе и эмбрионов «высокого качества», было в группе Примапур® (4,24 ± 0,52), а наименьшее – в группе Пурегон® (2,76 ± 0,37). В группе пациенток, использовавших Примапур®, частота наступления клинической беременности составила 44,0 %, в группе использовавших Гонал-ф® – 48,0 %, а в группе использовавших Пурегон® – 44,0 %, что не являлось статистически значимым различием между группами (p > 0,05). При оценке частоты живорождения существенных различий между группами выявлено не было. Показатель «Take Home Baby» составил 52,0 % в группе Гонал-ф®, 60,0 % – в группе Пурегон® (р > 0,05) и был статистически незначимо выше в группе пациенток, получавших биоаналог фоллитропина альфа (64,0 %).
Заключение. Новый препарат, являющийся биоаналогом фоллитропина альфа, не отличается по клинической эффективности от других гонадотропинов и может использоваться для контролируемой индукции суперовуляции в программах ВРТ.
Ключевые слова
Для цитирования:
Курцер М.А., Касьянова Г.В., Овчинникова М.М., Хетагурова Д.Т. Ретроспективное сравнительное исследование исходов вспомогательных репродуктивных технологий у женщин в программах экстракорпорального оплодотворения с применением рекомбинантных гонадотропинов. Акушерство, Гинекология и Репродукция. 2022;16(3):277-286. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.304
For citation:
Kurtser M.A., Kasyanova G.V., Ovchinnikova M.M., Khetagurova D.T. Retrospective comparative study on artificial reproductive technology outcomes in women undergoing in vitro fertilization with recombinant gonadotropins. Obstetrics, Gynecology and Reproduction. 2022;16(3):277-286. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.304
Введение / Introduction
С целью повышения эффективности экстракорпорального оплодотворения (ЭКО) и переноса эмбриона (ПЭ) в матку до настоящего времени разрабатываются новые лекарственные препараты, а также схемы контролируемой стимуляции суперовуляции. На сегодняшний день фармакологическая индустрия предлагает практикующему врачу определенное разнообразие лекарственных средств, применяемых для индукции суперовуляции, как поставляемые с зарубежного рынка, так и производимые в России.
В настоящее время проблема бесплодия супружеских пар имеет особое значение: по данным Всемирной организации здравоохранения (ВОЗ), частота встречаемости бесплодных браков выше 15 % является критически высокой и оказывает значительное негативное влияние на демографическую ситуацию в государстве [1].
Доля бесплодных браков в Российской Федерации (РФ) достигает 16 % и не имеет тенденции к снижению [2]. По данным ФГБУ НМИЦ АГП им. акад. В.И. Кулакова Минздрава России, в России с 2015 по 2019 гг. бесплодие диагностировали у 7–8 млн женщин и 3–4 млн мужчин [1]. Каждая седьмая супружеская пара в России сталкивается с проблемами зачатия [3], в связи с чем сохранение репродуктивного здоровья, а также преодоление бесплодия среди населения становится главной медицинской и социальной задачей государственного значения, решение которой определяет возможность воспроизводства вида и сохранение генофонда.
Одним из методов, позволяющих преодолеть бесплодие, являются вспомогательные репродуктивные технологии (ВРТ).
Первое успешное лечение бесплодия было осуществлено в естественном менструальном цикле у женщины с трубно-перитонеальным фактором при помощи ЭКО и ПЭ и закончившееся рождением живого ребенка [4].
Однако учитывая то, что при трансвагинальной пункции (TВП) яичников в естественном цикле получают лишь одну яйцеклетку, ЭКО в естественном менструальном цикле считается недостаточно эффективным: от 7 до 21 % против 30–40% в стимулированных протоколах (цит. по [5]). Таким образом, контролируемая стимуляция суперовуляции в программах ВРТ – важнейший этап, определяющий успех лечения бесплодия. Оптимальный выбор гонадотропина, стартовой дозы для овариальной стимуляции в циклах ЭКО является немаловажной и актуальной задачей современной репродуктивной медицины.
Использование различных гонадотропинов для индукции суперовуляции позволило улучшить эффективность метода ЭКО и ПЭ в полость матки.
История применения гонадотропинов для индукции овуляции у женщин началась в 1930 г., когда Cole и Hart использовали для этой цели препараты животного происхождения и обнаружили, что экстракт сыворотки жеребых кобыл (англ. pregnant mare serum gonadotrophin, PMSG) обладает гонадотропной активностью (цит. по [6]).
В 1949 г. итальянский химик P. Donini разработал иную технологию получения гликопротеинов из мочи женщин в постменопаузе, так как определил в ней высокие концентрации фолликулостимулирующего гормона (ФСГ) и лютеинизирующего гормона (ЛГ). Позже появились данные о возможном риске загрязнения данных препаратов частицами вирусного и бактериального происхождения [1].
В 1958 г. был предложен новый метод получения гонадотропинов из гипофиза погибших людей [7]. Но уже с 1990 г. все препараты, сырьем для которых являлись трупные ткани человека и животных (человеческие гипофизарные гонадотропины и гормон роста), были запрещены во всем мире, что повлекло за собой необходимость создания нового класса гонадотропинов [1].
Появление новейших технологий производства рекомбинантных гонадотропинов можно считать революционным шагом в репродуктологии, так как они имеют ряд несомненных преимуществ: их производство не требует сбора мочи, продукт не содержит вирусных, белковых, а также углеводных и стероидных примесей, обладает высокой биохимической однородностью и состоит из наиболее активных фракций гормона, что может способствовать получению большего количества зрелых ооцитов в одном цикле стимуляции и, соответственно, эмбрионов высокого качества.
Цель: провести сравнительный анализ эффективности препаратов рекомбинантного фолликулостимулирующего гормона в программах ЭКО и ПЭ.
МАТЕРИАЛЫ И МЕТОДЫ / MATERIALS AND METHODS
Дизайн исследования / Study design
Проведено ретроспективное неинтервенционное (наблюдательное) анонимное когортное сравнительное исследование применения гонадотропинов в программах ЭКО и ПЭ.
С целью оценки эффективности гонадотропных препаратов в программах ЭКО и ПЭ с февраля по июнь 2020 г. в Клиническом госпитале Лапино группы компаний «Мать и Дитя» проведен ретроспективный анализ 75 амбулаторных карт пациенток, которые проходили лечение бесплодия методами ЭКО и ПЭ с использованием различных гонадотропинов для контролируемой стимуляции суперовуляции.
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения: возраст от 18 до 35 лет; различные факторы бесплодия (трубно-перитонеальный, мужской фактор, сочетанный фактор); концентрация антимюллерова гормона (АМГ) более 1 нг/мл; отсутствие патологии эндометрия.
Критерии исключения: возраст менее 18 и более 35 лет; тяжелый мужской фактор бесплодия (криптозооспермия); необходимость проведения предимплантационного генетического тестирования на анеуплоидии и предимплантационного генетического тестирования на моногенные заболевания (ПГТ-а/ПГТ-м) полученных эмбрионов (по заключению генетика).
Популяция пациенток / Patient cohort
В зависимости от применяемого препарата все обследованные пациентки были ретроспективно распределены на 3 группы.
Группу 1 составили 25 пациенток, которые получали фоллитропин альфа (Гонал-Ф®, Merck, Германия), группу 2 – 25 пациенток, использовавших фоллитропин бета (Пурегон®, MSD, США), группу 3 – 25 пациенток, которым назначали биоаналог фоллитропина альфа (Примапур®, АйВиФарма, Россия).
Перед проведением ЭКО и ПЭ все супружеские пары были обследованы согласно Приказу Минздрава РФ № 107н от 30.08.2012 «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению» [8].
Стимуляция суперовуляции и перенос эмбриона / Superovulation stimulation and embryo transfer
В циклах ЭКО с целью овариальной стимуляции все пациентки получали рекомбинантные гонадотропины в ежедневной дозе 150 МЕ, начиная со 2–3-го дня менструального цикла после проведения ультразвукового исследования (УЗИ) органов малого таза и наличия условий для начала стимуляции.
Мониторинг роста фолликулов проводили 1 раз в 3–4 дня. При достижении фолликулами диаметра 19–20 мм с целью финального дозревания яйцеклеток назначали триггер овуляции – хорионический гонадотропин человека (ХГЧ) в однократной дозе 6–10 тыс. МЕ. Трансвагинальную пункцию выполняли через 36 ч после введения препарата ХГЧ.
Метод оплодотворения полученных ооцитов – ЭКО или интрацитоплазматическая инъекция сперматозоида (ИКСИ) определяли на основании исходов предшествующих циклов ЭКО пациенток, если таковые были, и параметров спермограммы партнера на день оплодотворения.
Какое количество эмбрионов использовать для переноса, решали индивидуально, учитывая анамнез пациенток и качество полученных эмбрионов. После ПЭ в полость матки всем пациенткам назначали поддержку лютеиновой фазы препаратами гестагенов в средних рекомендуемых дозировках. С целью диагностики беременности исследовали кровь на ХГЧ через 11 дней, а также проводили УЗИ органов малого таза через 20–25 дней после ПЭ. При визуализации плодного яйца в полости матки диагностировали клиническую беременность, при наличии сердцебиения у эмбриона – развивающуюся маточную беременность.
Этические аспекты / Ethical aspects
Все пациентки подписали согласие на использование персональных данных, для проведения анализа использовались обезличенные данные, содержащиеся в амбулаторных картах. Все процедуры, выполненные в данном исследовании, соответствовали этическим стандартам Хельсинской декларации Всемирной медицинской ассоциации (Форталеза, Бразилия, 2013 г.).
Статистический анализ / Statistical analysis
В работе применяли методы общей статистики и корреляционного анализа с использованием пакета прикладных программ Excel (Microsoft, США) и пакета программ SPSS Statistics (IBM, США). Для сравнения групп нормально распределенных количественных данных между собой использовали t-критерий Стьюдента. Рассчитывали среднее и стандартную ошибку среднего арифметического (М ± m). Различия считали статистически значимыми при р < 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
Клинико-анамнестическая характеристика обследованных женщин / Clinical and anamnestic characteristics of women examined
С целью определения эффективности гонадотропинов в программах ЭКО и ПЭ в настоящем исследовании проведен сравнительный ретроспективный анализ пациенток по различным параметрам. Известно, что возраст женщины оказывает существенное влияние на эффективность циклов ЭКО и ПЭ [5]. Также, согласно выводам К.В. Краснопольской (2013), у пациенток старше 38 лет эффективность программ ВРТ ниже вследствие сниженного овариального резерва и «бедного» ответа яичников на контролируемую стимуляцию [3]. Данное состояние сопровождается получением меньшего количества яйцеклеток при ТВП, а также их «низким качеством» [5]. Более того, в работе Е.Б. Рудаковой с соавт. описано, что у пациенток старше 38 лет, помимо снижения овариального резерва, происходит резкое ухудшение хромосомного «качества» ооцитов, что проявляется большим количеством эмбрионов с хромосомными поломками, не способными дать здоровую прогрессирующую беременность [9]. По данным литературы, возраст пациенток старше 38 лет – фактор, не поддающийся коррекции и оказывающий значительное отрицательное влияние на эффективность программ ЭКО и ПЭ вне зависимости от метода индукции суперовуляции [10].
Учитывая вышесказанное, в нашем исследовании для исключения отрицательного влияния возраста на оценку фолликулостимулирующей эффективности гонадотропинов все пациентки были в возрасте от 18 до 35 лет. Средний возраст пациенток, пролеченных фоллитропином альфа (группа 1), составил 31,1 ± 5,5 лет, фоллитропином бета (группа 2) – 30,2 ± 4,6 лет, биоаналогом фоллитропина альфа (группа 3) – 31,5 ± 2,7 лет. Статистически значимые различия между сравниваемыми группами отсутствовали (р > 0,05). Известно, что на наступление беременности и ее вынашивание могут оказывать влияние экстрагенитальные и гинекологические заболевания. При анализе анамнеза пациенток не выявлено тяжелых соматических, в том числе аутоиммунных заболеваний, требующих постоянного применения лекарственных препаратов. Частота встречаемости экстрагенитальной патологии соответствовала общепопуляционным значениям (табл. 1).
Таблица 1. Экстрагенитальная патология в группах пациенток.
Table 1. Extragenital pathology in patient groups.
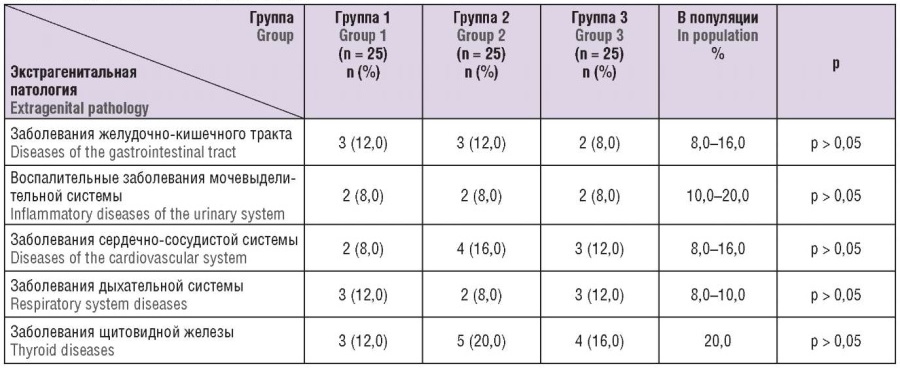
Примечание: р – статистические различия по сравнению с общепопуляционными значениями.
Note: p – significant difference compared to general population.
При анализе данных гинекологической заболеваемости выявляли миому матки, гиперпластические процессы эндометрия, хронический эндометрит (табл. 2). В группе 1 миома матки встречалась у 5 (20,0 %), в группе 2 – у 7 (28,0 %), в группе 3 – у 4 (16,0 %) женщин. Следует отметить, что частота встречаемости миомы матки была незначительно выше в группе 2, не отличаясь тем не менее от общепопуляционных значений, что в свою очередь является прогностически незначимым для эффективности программ ЭКО и ПЭ, так как размеры миоматозных узлов у всех пациенток, вошедших в исследование, не превышали диаметра 45 мм, не деформировали полость матки и не оказывали негативного влияния на наступление беременности.
Таблица 2. Гинекологическая заболеваемость в группах пациенток.
Table 2. Gynecological morbidity in patient groups.
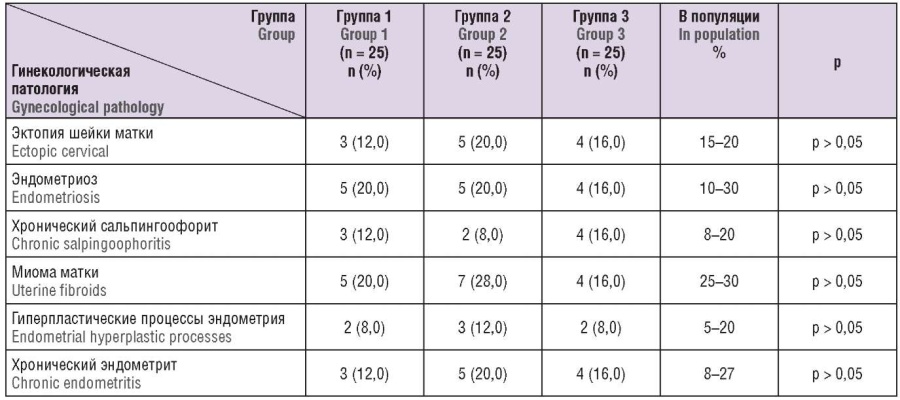
Примечание: р – статистические различия по сравнению с общепопуляционными значениями.
Note: p – significant difference compared to general population.
Гиперпластические процессы эндометрия в анамнезе встречались у 2 (8,0 %) пациенток в группах 1 и 3 и у 3 (12,0 %) пациенток в группе 2.
Хронический эндометрит, к которому относили лейкоцитарную инфильтрацию стромы, выявленную в первую фазу менструального цикла, фиброз стромы, положительный маркер CD-138, верифицировали при помощи пайпель-биопсии эндометрия, показанием для проведения которой было нарушение кровотоков в сосудах матки по данным доплерометрии. Диагноз был поставлен у 3 (12,0 %) пациенток в группе 1, у 5 (20,0 %) в группе 2 и у 4 (16,0 %) в группе 3.
Все пациентки, у которых был гистологически верифицирован хронический эндометрит, в зависимости от морфологической картины проходили необходимое лечение, к которому относится антибактериальная терапия, физиолечение (электроимпульсная терапия, интерференцтерапия, магнитотерапия).
Гормональный статус / Hormonal state
Известно, что при нарушении гормонального статуса в репродуктивной системе женщин положительные исходы ЭКО наблюдались в значительно меньшей степени (15–35 %) [11].
Анализируя гормональный статус обследованных пациенток, следует отметить, что нарушение выработки гормонов щитовидной железы, пролактина отмечалось у пациенток всех трех групп с частотой, не превышающей популяционные значения. Нарушений выработки других гормонов (половых, гонадотропинов) у пациенток, вошедших в исследование, выявлено не было. Все пациентки, которым была необходима коррекция гормонального профиля, проходили лечение совместно с врачами-эндокринологами в Клиническом госпитале Лапино (ГК «Мать и Дитя»).
Уровень АМГ в сыворотке крови является единственным маркером овариального запаса и фактором, определяющим эффективность ЭКО и ПЭ. Концентрация АМГ менее 1,2 нг/мл в сыворотке крови, определяемая перед началом программы ЭКО, считается предиктором «бедного» овариального ответа [5][12].
С целью оценки эффективности гонадотропинов в программах ВРТ, вне зависимости от овариального резерва, в наше исследование включены пациентки с уровнем АМГ не ниже 1 нг/мл (табл. 3).
Таблица 3. Уровень антимюллерова гормона (АМГ) в сыворотке крови пациенток.
Table 3. The level of anti-Mullerian hormone (AMH) in patient blood serum.

Примечание: р – статистические различия между группами.
Note: p – significant inter-group difference.
Как следует из данных таблицы 3, средний уровень АМГ по группам статистически не различался (р > 0,05).
Анализ причин бесплодия / Analyzing infertility causes
При анализе анамнеза пациенток с бесплодием отмечено, что частота первичного и вторичного бесплодия у пациенток не различалась по группам. Первичное бесплодие наблюдалось у 47,3 %, вторичное – у 52,7 %.
Оценивая паритет обследованных пациенток, выявлено, что частота самопроизвольных/артифициальных абортов в анамнезе была незначительна и статистически незначимо выше в группе 2; частота родов живым плодом была несущественно выше в группе 3 (р > 0,05).
Согласно отчету Управления по оплодотворению и эмбриологии человека (Human Fertilisation and Embryology Administration, HFEA) Европейского центра репродукции и эмбриологии, показатель рождения живого ребенка в каждом цикле ЭКО составляет при трубном факторе бесплодия – 13,3 %, при эндометриозе – 15,0 %, при бесплодии неясного генеза – 15,9 %, при мужском факторе бесплодия – 19,6 % [13]. Статистический анализ причин бесплодия у пар представлен в таблице 4. Согласно представленным данным и анализу факторов бесплодия у обследованных пар, можно отметить, что бесплодие сочетанного характера, изолированное мужское и женское бесплодие встречались в каждой группе с одинаковой частотой.
Таблица 4. Факторы бесплодия обследованных пациенток.
Table 4. Infertility factors in patients examined.
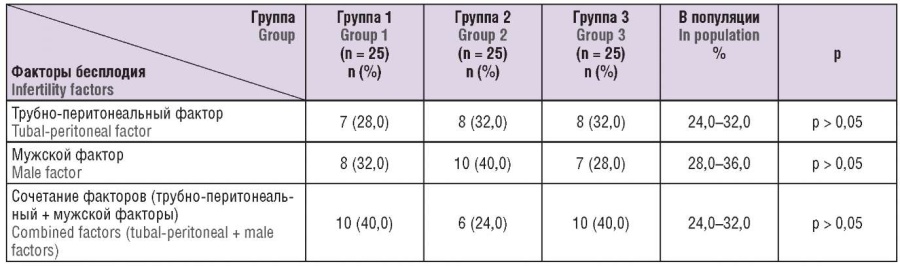
Примечание: р – статистические различия по сравнению с общепопуляционными значениями.
Note: p – significant difference compared to general population.
Таким образом, не выявлено статистически значимых различий пациенток в группах по возрасту, состоянию овариального резерва, экстрагенитальной и гинекологической патологии, а также паритету.
Анализ эффективности используемых гонадотропинов / Analyzing efficacy of gonadotropin use
Учитывая, что все пациентки были сопоставимы по возрасту и овариальному резерву, среднее суммарное количество гонадотропинов, используемых для индукции суперовуляции, в трех группах не различалось и составило в среднем 1500 ± 300–400 МЕ.
Отсутствие клинических различий у пациенток в программах ЭКО и ПЭ в трех группах позволяли сделать акцент именно на сравнении эффективности используемых для овариальной стимуляции гонадотропинов, исключая влияние на наступление беременности других факторов. С этой целью проводился анализ основных показателей эффективности циклов ЭКО и ПЭ (табл. 5).
Таблица 5. Основные показатели эффективности программ экстракорпорального оплодотворения и переноса эмбриона с применением различных гонадотропинов.
Table 5. Major efficacy parameters in in vitro fertilization and embryo transfer protocols assisted with various gonadotropins.
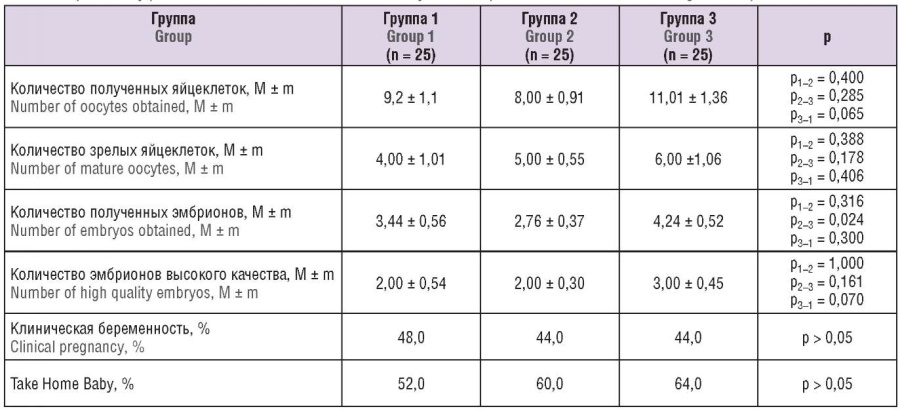
Примечание: р – статистические различия между группами; выделены значимые различия.
Note: p – significant inter-group differences are highlighted in bold.
Одним из факторов, оказывающим влияние на эффективность программ ЭКО и ПЭ, является количество полученных ооцитов при ТВП яичников.
ВОЗ, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (англ. Food and Drug Administration, FDA), Европейское агентство по лекарственным средствам (англ. European Medicines Agency, EMEA), Министерства здравоохранения различных стран предлагали свои критерии, на основании которых биоаналог любого фоллитропина можно считать терапевтически эквивалентным [14]. Терапевтическая эквивалентность – это аналогичные оригинальному препарату эффективность и безопасность у препарата биоаналога.
Доказано, что терапевтическая эквивалентность препаратов во всех трех группах соответствует как российским, так и международным стандартам. Порог эквивалентности сравниваемых гонадотропинов был выбран на основании данных уже существующих международных исследований по эффективности терапии при ВРТ с участием женщин с нормальным овариальным резервом, в циклах с антагонистами гонадотропин-рилизинг-гормона (ГнРГ) и стартовой дозой ФСГ, равной 150 МЕ [7][15–18]. Минимальное количество ооцитов было получено в группе 2, однако это не являлось статистически значимым по сравнению с группами 1 и 3 (табл. 5).
Успех имплантации напрямую зависит от качества переносимых эмбрионов и состояния эндометрия. Для оценки потенциала эмбрионов к имплантации проанализировали их количество и качество (табл. 5). Максимальное количество эмбрионов на 5-е сутки, в том числе и эмбрионов «высокого качества» (бластоциста категории не ниже 3 ВВ), было в группе 3 (Примапур®), а наименьшее – в группе 2 (Пурегон®).
Процент наступления клинической беременности оценивали не ранее, чем на 5-й неделе после переноса эмбриона. В группе пациенток, использовавших Примапур®, частота наступления клинической беременности составила 44,0 %, в группе использовавших Гонал-ф® – 48,0 %, а в группе использовавших Пурегон® – 44,0 %, что не являлось статистически значимым различием между группами (p > 0,05).
В США впервые отметили, что следует внедрить новые критерии оценки эффективности программ ВРТ, поскольку результатом должен считаться родившийся ребенок, а не беременность, шанс наступления которой в последнее время значительно вырос. В клиниках, специализирующихся на ЭКО, стали вводить новые критерии оценки эффективности программ. Таким критерием оценки стал показатель «Take Home Baby», т. е. количество здоровых детей, выписанных домой. Показатель «Take Home Baby» рассчитывается как отношение числа родов с рождением детей, выживших более 27 дней, к числу процедур переноса эмбрионов [19]. В нашем исследовании при оценке частоты живорождения статистически значимых различий между группами выявлено не было. Показатель рождения живого ребенка был незначительно выше в группе пациенток, получавших биоаналог фоллитропина альфа (64,0 %) (табл. 5).
Учитывая что биоаналог фоллитропина альфа производится в РФ по полному циклу от субстанции до готовой лекарственной формы, не требуется дополнительных расходов на его транспортировку и ввоз на территорию РФ, его использование будет являться экономически более целесообразным и минимизировать риски, связанные с возможным нарушением логистических цепочек. Недавнее клинико-экономическое исследование, включившее анализ минимизации затрат и анализ влияния на бюджет, показало, что использование фоллитропина альфа при проведении овариальной стимуляции в популяции женщин с бедным овариальным ответом приводит к экономии бюджетных средств [20].
Ограничения исследования / Study limitations
Малая выборка пациентов обусловлена ограничениями оказания плановой медицинской помощи населению в связи с ростом заболеваемости COVID-19 в стране в период выполнения данной работы, в связи с чем необходимы более масштабные исследования в условиях реальной клинической практики.
ЗАКЛЮЧЕНИЕ / CONCLUSION
В ходе проведенного исследования выявлено, что все используемые в реальной клинической практике фолликулостимулирующие препараты, содержащие фоллитропин альфа, фоллитропин бета и биоаналог фоллитропина альфа, обладали одинаковой терапевтической эффективностью в программах ЭКО и ПЭ.
Новый гонадотропный препарат, созданный в России, являющийся биоаналогом фоллитропина альфа, не отличался по показателям клинической эффективности от других известных оригинальных гонадотропинов и может использоваться для овариальной стимуляции в программах ВРТ, при этом суммарная доза введенного препарата на цикл лечения не отличалась от других сравниваемых гонадотропинов.
Список литературы
1. Чеботникова Т.В. Гонадотропины: история создания. Вестник репродуктивного здоровья. 2008;(1–2):78–9.
2. Назаренко Т.А., Мишиева Н.Г. Бесплодие и возраст: пути решения проблемы. М.: МЕДпресс-информ, 2014. 211 c.
3. Краснопольская К.В., Назаренко Т.А. Клинические аспекты лечения бесплодия в браке. Диагностика и терапевтические программы с использованием методов восстановления естественной фертильности и вспомогательных репродуктивных технологий. М.: ГЕОТАР-Медиа, 2013. 376 с.
4. Gianaroli L., Geraedts J., Veiga A., Simon B. The 'father of IVF' and a founding father of ESHRE. Hum Reprod. 2010;25(12):2933–5. https://doi.org/10.1093/humrep/deq331.
5. Касьянова Г.В., Курцер М.А., Лебедева Е.Г., Младова Е.С. Экстракорпоральное оплодотворение в естественном цикле: за и против. Вопросы гинекологии, акушерства и перинатологии. 2013;12(4):10–16.
6. Назаренко Т.А., Краснопольская К.В. «Бедный ответ». М.: МЕДпресс-информ, 2012. 75 с.
7. Marci R., Caserta D., Lisi F. et al. In vitro fertilization stimulation protocol for normal responder patients. Gynecol Endocrinol. 2013;29(2):109–12. https://doi.org/10.3109/09513590.2012.712002.
8. Приказ Минздрава РФ №107н от 30.08.2012 «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению». М., 2012. 61 с. Режим доступа: https://arhgkb6.ru/media/2019/07/19/1260979371/Prikaz_Minzdrava_Rossii_N_107n_o_poryadke_ispol_zovaniya_VRT.pdf.
9. Рудакова Е.Б., Замаховская Л.Ю., Стрижова Т.В. и др. Исходы экстракорпорального оплодотворения как мультифакторная проблема клинической репродуктологии. Медицинский Совет. 2015;(9):84–91. https://doi.org/10.21518/2079-701X-2015-9-84-91.
10. Кулаков И.И., Леонов Б.В., Кузьмичев Л.Н., Смольникова В.Ю. Лечение женского и мужского бесплодия. Вспомогательные репродуктивные технологии. М.: МИА, 2005. 592 с.
11. Аншина М.Б., Исакова Э.В., Калинина Е.А. и др. Синдром гиперстимуляции яичников. Клинические рекомендации. Проблемы репродукции. 2013;19(2):8-14.
12. Hamdine O., Eijkemans M.J., Lentjes E.W. et al. Ovarian response prediction in GnRH antagonist treatment for IVF using anti-Müllerian hormone. Hum Reprod. 2015;30(1):170–8. https://doi.org/10.1093/humrep/deu266.
13. The Human Fertilization and Embryology Authority (HFEA) of Great Britain Faces Expanding Storage Time for Cryopreserved Human Embryos. Available at: http://hdl.handle.net/10822/890699.
14. Guidance for Industry Bioequivalence Recommendations for Specific Products. U.S. Department of Health and Human Services Food and Drug Administration Center for Drug Evaluation and Research (CDER). June 2010. 7 p. Available at: https://www.fda.gov/media/71401/download.
15. Strowitzki T., Kuczynski W., Mueller A., Bias P. Safety and efficacy of Ovaleap® (recombinant human follicle-stimulating hormone) for up to 3 cycles in infertile women using assisted reproductive technology: a phase 3 open-label follow-up to Main Study. Reprod Biol Endocrinol. 2016;14(1):31. https://doi.org/10.1186/s12958-016-0164-y.
16. Rombauts L. Is there a recommended maximum starting dose of FSH in IVF? J Assist Reprod Genet. 2007;24(8):343–9. https://doi.org/10.1007/s10815-007-9134-9.
17. Rettenbacher M., Andersen A.N., GarciaVelasco J.A. et al. A multi-centre phase 3 study comparing efficacy and safety of Bemfola(®) versus Gonal-f(®) in women undergoing ovarian stimulation for IVF. Reprod Biomed Online. 2015;30(5):504–13. https://doi.org/10.1016/j.rbmo.2015.01.005.
18. Камилова Д.П., Овчинникова М.М., Абляева Э.Ш. и др. Эффективность применения биоаналогового фоллитропина альфа в реальной клинической практике: результаты наблюдательного исследования «ФОЛЛИТРОПИН». Акушерство, Гинекология и Репродукция. 2021;15(1):5–21. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2021.212.
19. Квашнина Е.В., Аскеров Р.А., Маясина Е.Н. Take-home baby – критерий оценки качества технологии ЭКО, оценка группы беременных женщин. Проблемы репродукции. 2012;18(2):68–71.
20. Перова К.А., Щуров Д.Г., Блинов Д.В. и др. Фармакоэкономический анализ применения фоллитропина альфа при использовании вспомогательных репродуктивных технологий. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2022;15(1):40–50. https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.129.
Об авторах
М. А. КурцерРоссия
Курцер Марк Аркадьевич – доктор медицинских наук, профессор, академик РАН, зав. кафедрой акушерства и гинекологии педиатрического факультета
117997 Москва, ул. Островитянова, д. 1
Г. В. Касьянова
Россия
Касьянова Галина Викторовна – врач-репродуктолог
143081 Московская область, Одинцовский район, Лапино, 1-ое Успенское шоссе, д. 111
М. М. Овчинникова
Россия
Овчинникова Мария Михайловна – врач акушер-гинеколог, репродуктолог
143081 Московская область, Одинцовский район, Лапино, 1-ое Успенское шоссе, д. 111
Д. Т. Хетагурова
Россия
Хетагурова Диана Таймуразовна – аспирант
117997 Москва, ул. Островитянова, д. 1
Рецензия
Для цитирования:
Курцер М.А., Касьянова Г.В., Овчинникова М.М., Хетагурова Д.Т. Ретроспективное сравнительное исследование исходов вспомогательных репродуктивных технологий у женщин в программах экстракорпорального оплодотворения с применением рекомбинантных гонадотропинов. Акушерство, Гинекология и Репродукция. 2022;16(3):277-286. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.304
For citation:
Kurtser M.A., Kasyanova G.V., Ovchinnikova M.M., Khetagurova D.T. Retrospective comparative study on artificial reproductive technology outcomes in women undergoing in vitro fertilization with recombinant gonadotropins. Obstetrics, Gynecology and Reproduction. 2022;16(3):277-286. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.304

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































