Перейти к:
Исследование генетической предрасположенности к преждевременному снижению овариального резерва
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.301
Аннотация
Введение. Важным фактором наступления беременности, в том числе и в программах вспомогательных репродуктивных технологий (ВРТ), является нормальный овариальный резерв (ОР), который определяет ответ яичников к развитию фолликула с полноценной яйцеклеткой. Причины преждевременного снижения ОР многофакторны. Заслуживает внимания исследование полиморфизма генов как причины преждевременного снижения ОР.
Цель: определение генетической предрасположенности к преждевременному снижению ОР и создание на основании полученных результатов прогностической модели.
Материалы и методы. Проведено ретроспективное когортное сравнительное исследование. Обследовано 200 пациенток с бесплодием, которые реализовывали репродуктивную функцию с помощью ВРТ. Пациентки были разделены на 2 группы: в группу 1 вошли 100 пациенток с преждевременным снижением ОР, группу 2 составили 100 пациенток с нормальным ОР. Всем пациенткам проведено молекулярно-генетическое исследование. Исследованы генетические полиморфизмы следующих генов: ESR1, ESR2, FSHR, CYP19A.
Результаты. Итоговый клинический фенотип формируется за счет множества факторов – генетических и средовых. Вклад в формирование преждевременного снижения ОР вносят несколько генетических вариантов. Наибольшим синергичным эффектом обладает комбинация генов CYP19A1 и FSHR, которые потенцируют друг друга и предрасполагают к бедному ответу яичников в рамках стимуляции суперовуляции.
Заключение. Перспективным методом индивидуальной оценки ОР, в том числе и преждевременного его снижения, является определение генетических маркеров. Мультилокусный анализ и прогностическая модель на основании сочетания нескольких вариантов полиморфных генов позволят оценить риски преждевременного снижения ОР и индивидуализировать программу ВРТ.
Ключевые слова
Для цитирования:
Кудрявцева Е.В., Курбатова Н.В., Ковалев В.В., Исламиди Д.К. Исследование генетической предрасположенности к преждевременному снижению овариального резерва. Акушерство, Гинекология и Репродукция. 2022;16(3):266-276. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.301
For citation:
Kudryavtseva E.V., Kurbatova N.V., Кovalev V.V., Islamidi D.K. Investigating genetic predisposition to premature decline in ovarian reserve. Obstetrics, Gynecology and Reproduction. 2022;16(3):266-276. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.301
Введение / Introduction
В последние годы имеется стойкая тенденция к увеличению возраста деторождения, при этом отмечено ухудшения гинекологического здоровья женщин репродуктивного возраста в России [1]. Как следствие, наблюдается рост женского бесплодия и увеличивается востребованность вспомогательных репродуктивных технологий (ВРТ) [2].
Важным фактором для успеха программ экстракорпорального оплодотворения (ЭКО) является овариальный резерв (ОР) – функциональный резерв яичников, который определяет способность к развитию фолликула с полноценной яйцеклеткой и к адекватному ответу на введение индукторов овуляции [2][3]. Полноценный ОР в программах ВРТ в значительной степени определяет их успешность. Чаще низкий ОР встречается в позднем репродуктивном возрасте, но в некоторых случаях эта проблема имеет место и у молодых женщин [2][4].
Снижение ОР может быть обусловлено многими факторами, среди которых генетические, инфекционно-токсические, аутоиммунные, психологические, а также ятрогенные. В ряде случаев наблюдается сочетание нескольких причин [5]. Тем не менее ведущим фактором сниженного ОР является старший репродуктивный возраст женщины [2][3]. У большинства женщин резко увеличивается частота элиминации фолликулов в возрасте около 38 лет, и после 40 лет наблюдается сниженный ОР [3][6]. Но под воздействием генетических и средовых факторов снижение ОР может происходить в более молодом возрасте, т. е. происходит преждевременное снижение ОР.
Однако в последнее время снижение ОР встречается и у молодых женщин. По-видимому, основной причиной преждевременного снижения ОР у молодых пациенток является генетическая предрасположенность [3][7][ 8]. Поэтому определение генов-кандидатов, ассоциированных со сниженным ОР, является перспективным методом ранней диагностики данного состояния [7].
В современной научной литературе описано множество генов, наличие полиморфизмов в которых может потенциально влиять на репродуктивную функцию [9], некоторые из них могут рассматриваться в качестве маркеров преждевременного снижения ОР. В частности, одними из хорошо изученных генов являются гены эстрогеновых рецепторов (ESR1 и ESR2), которые играют ключевую роль в фертильности женщины, регулируя действие эстрогенов во всех репродуктивных тканях человека. Гены ESR1 и ESR2 содержат несколько полиморфизмов, которые могут влиять на риск некоторых гинекологических заболеваний, связанных с бесплодием, и исход ЭКО [10]. Есть данные, что некоторые полиморфные варианты гена ESR1 (например генотип T/T, полиморфизм С-397Т) ассоциированы с неудачными исходами стимуляции суперовуляции и программы ЭКО в целом; женщины с генотипом С/С ESR1, напротив, в программах ЭКО демонстрируют созревание большего числа фолликулов, высокую степень зрелости ооцитов и хорошее качество эмбрионов при прочих равных условиях [10– 12]. При этом в ряде работ других авторов такой связи выявлено не было [13][14].
Также противоречивые данные получены при изучении влияния полиморфизма гена ESR2 на результаты стимуляции функции яичников. Некоторые исследователи утверждают, что у пациенток, имеющих гомозиготный полиморфизм А/А гена ESR2 (rs4986938), ответ на овариальную стимуляцию был хуже, им требовались большие дозы препарата фолликулостимулирующего гормона (ФСГ) [15]. Другие же авторы не выявили никакого влияния полиморфизма гена ESR2 на результаты ЭКО [13][14].
Наиболее изученным к настоящему времени является ген рецептора ФСГ – FSHR (англ. folliclestimulating hormone receptor), имеющий важное значение при стимуляции суперовуляции [13][16]. Известно, что физиологическое действие ФСГ зависит от активации его рецептора, который экспрессируется гранулезными клетками [13]. Предполагается, что наличие полиморфизма в гене FSHR может привести к нарушению оогенеза и снижению числа созревающих фолликулов в программах ВРТ [17].
Множество зарубежных работ посвящено изучению гена CYP19A1, который кодирует фермент ароматазу (цитохром 19А1). Фермент ароматаза необходим для реакции биосинтеза эстрогенов из предшественников андрогенов в яичниках и экстрагонадных тканях [18]. Есть данные о его взаимосвязи с эстроген-зависимыми заболеваниями [19]. Соответственно, данный ген также может влиять на функцию яичников и овариальный ответ, особенно во взаимодействии с другими генами [18][20].
Учитывая вышесказанное, возникает необходимость дальнейшего изучения полиморфизма генов для оценки риска генетической предрасположенности к преждевременному снижению ОР.
Цель: определение генетической предрасположенности к преждевременному снижению ОР и создание на основании полученных результатов прогностической модели.
МАТЕРИАЛЫ И МЕТОДЫ / MATERIALS AND METHODS
Дизайн исследования / Study design
На базе кафедры акушерства и гинекологии, трансфузиологии ФГБОУ ВО УГМУ Минздрава России и ООО Медико-фармацевтического центра «Гармония» в 2020–2021 гг. проведено ретроспективное когортное сравнительное исследование.
Обследовано 2 группы пациенток, получавших лечение бесплодия с использованием процедур ВРТ со стимуляцией овуляции: 100 пациенток с преждевременным снижением ОР составили группу 1, 100 пациенток с нормальным ОР – группу 2. Под термином «преждевременное снижение овариального резерва» понимали клиническую ситуацию, при которой у женщин, страдающих бесплодием в возрасте до 40 лет, имелись инструментальные критерии, соответствующие низкому количеству яйцеклеток, в частности, уровень антимюллерова гормона (АМГ) < 1,2 нг/мл и/или количество антральных фолликулов (КАФ) < 5, при этом регистрировался бедный ответ на стимуляцию в программе ЭКО (< 4 ооцитов).
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения в группы определены согласно Болонским критериям и рекомендациям группы POSEIDON [21][22].
Критерии включения: возраст 30–40 лет; наличие показаний для проведения ЭКО; подписанное информированное согласие.
Критерии невключения: возраст менее 30 или более 40 лет; наличие тяжелой экстрагенитальной патологии; оперативное вмешательство на яичниках в анамнезе; эндометриоидные кисты яичников; аномальный кариотип у пациентки; наличие эндокринопатии (сахарный диабет 1-го типа); синдром поликистозных яичников; перенесенный эпидемический паротит; лучевая или химиотерапия в анамнезе.
Критерии исключения: возникновение тяжелого заболевания, возникшего в процессе обследования; отказ пациентки от участия в исследовании. Были сформированы 2 группы: в группу 1 вошли пациентки с уровнем АМГ < 1,2 нг/мл, КАФ < 5; ответом на стимуляцию в программе ЭКО < 4 ооцитов; группу 2 составили женщины с уровнем АМГ ≥ 1,2 нг/мл, КАФ ≥ 5; ответом на стимуляцию в программе ЭКО ≥ 4 ооцитов.
Методы исследования / Study methods
Всем пациенткам проведено молекулярно-генетическое исследование. Для исследования использовали соскоб буккального эпителия. Полученный материал исследовали методом полимеразной цепной реакции в режиме реального времени (ПЦРРВ) на детектирующем амплификаторе ДТ-96 (НПО «ДНК-Технология», Россия) с использованием реагентов и протоколов того же производителя.
Исследование уровня гормонов, которое осуществляли стандартно в утреннее время, натощак на 2–3-й день спонтанного менструального цикла, включало определение значений ФСГ и АМГ. ФСГ определяли на автоматическом хемилюминесцентном анализаторе Immulite 2000 Systems с использованием диагностических наборов реагентов (Siemens, Великобритания). Уровень АМГ определяли хемилюминесцентным методом на иммунохимическом анализаторе DXi Beckman Coulter (Beckman Coulter, США) с использованием реагентов Access AMH (Beckman Coulter, США).
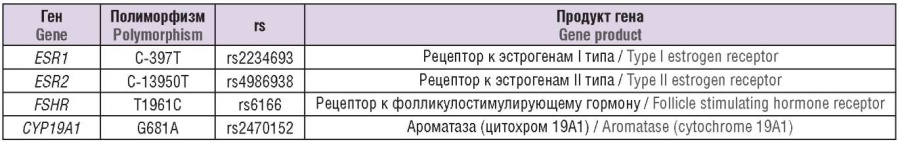
Исследованные гены представлены в таблице 1.
Таблица 1. Исследованные генетические полиморфизмы.
Table 1. Genetic polymorphisms examined.
Для анализа распределения полиморфных генотипов и аллелей исследуемых генов использовались общая, доминантная и мультипликативные модели анализа. При анализе с использованием общей модели оцениваются частоты мажорного гомозиготного, гетерозиготного и полиморфного гомозиготного генотипов. При использовании мультипликативной модели оценивается частота каждого вариантного аллеля. Доминантная модель предполагает, что полиморфный аллель является доминантным, и, следовательно, его значение проявляется при как при гомо-, так и при гетерозиготном носительстве, соответственно частота гетерозигот и полиморфных гомозигот оценивается суммарно.
Этические аспекты / Ethical aspects
Дизайн исследования утвержден локальным этическим комитетом ФГБОУ ВО УГМУ Минздрава России, протокол № 3 от 19.03.2021. Все процедуры и манипуляции, выполненные в данном исследовании, соответствовали этическим стандартам Хельсинской декларации 1964 г. и ее последующим изменениям и сопоставимым нормам этики. Все обследованные женщины подписывали информированное согласие до начала исследования.
Методы статистического анализа / Statistical analysis
Для проведения статистического анализа использовали компьютерную программу Jamovi (The jamovi project, https://www.jamovi.org). Проверка распределения на нормальность проведена с помощью критерия Шапиро–Уилкса. Если распределение соответствовало нормальному, то количественные параметры представляли в виде среднего значения со стандартным отклонением (М ± SD), если нет, то рассчитывали медиану с интерквартильным размахом (Ме [Q1–Q3]). При нормальном распределении для оценки статистической значимости различий между исследуемыми группами использовали критерий Стьюдента, при ненормальном – непараметрический критерий Манна– Уитни, различия считали статистически значимыми при р < 0,05. Для оценки статистической значимости различий между исследуемыми группами по качественным показателям использовали критерий χ2 Пирсона, различия считали статистически значимыми при < 0,05) и рассчитывали отношение шансов (ОШ) с 95 % доверительным интервалом (95 % ДИ).
Было оценено соответствие распределения генотипов выше указанных генов закону (равновесию) Харди– Вайнберга. Для всех генов распределение аллелей соответствовало равновесию Харди–Вайнберга. Соответствие реального распределения генотипов ожидаемому оценивали с помощью критерия χ2 Пирсона.
Для анализа межгенных сочетаний использовали компьютерный анализ методом многофакторного уменьшения размерности (англ. multifactor dimensionality reduction, MDR) с помощью компьютерной программы MDR 2.0 (Source Forge, США). Для оценки вклада каждого отдельного признака (генотипа, сочетания генотипов) в итоговый клинический фенотип использовали показатель энтропии (I).
РЕЗУЛЬТАТЫ / RESULTS
Клиническая характеристика обследованных пациенток / Clinical characteristics of the patients examined
Средний возраст пациенток в группах 1 и 2 статистически не различался и составил 37 [ 34,2–39,0] лет и 36 [ 33,3–39,0] лет (р = 0,06). Различия росто-весовых показателей в группах 1 и 2 были статистически незначимы (р > 0,05): рост – 164 [ 162–168] см и 165 [ 160–170] см, масса тела – 62,5 [ 56,3–70,0] кг и 62,1 [ 56,0–72,9] кг, индекс массы тела (ИМТ) – 23 [ 20,5– 25,0] кг/см2 и 23 [ 20,0–26,7] кг/см2, соответственно.
Возраст менархе в группах 1 и 2 также не различался, составляя 12,9 ± 2,3 лет и 13,1 ± 2,3 лет (р = 0,26). Продолжительность менструального цикла и длительность менструации также были сопоставимы и составили соответственно 27,7 ± 4,7 дней и 5,0 ± 1,29 дней в группе 1 и 28,5 ± 5,6 дней и 5,5 ± 3,2 дней в группе 2 (р > 0,05).
При исследовании гинекологической заболеваемости у ряда пациенток была обнаружена миома матки и аденомиоз. Частота встречаемости гинекологической патологии была сравнима. Так, миома матки встречалась в группе 1 у 6 (6 %), в группе 2 – у 4 (4 %) участниц исследования (χ2 = 0,42; р = 0,52). Аденомиоз в группе 1 диагностирован у 8 (8 %), в группе 2 – у 3 (3%) пациенток (χ2 = 2,41; р = 0,12).
В группе 1 роды в анамнезе были у 33 (33 %), в группе 2 – у 22 (22 %) пациенток (χ2 = 3,03; р = 0,08). Первичным бесплодием в группе 1 страдали 44 (44 %), вторичным – 56 (56 %), в группе 2 – 52 (52 %) и 48 (48 %) женщин (χ2 = 1,28; р = 0,26). У большинства участниц на момент проведения исследования в анамнезе была одна попытка ЭКО; в среднем в группе 1 было 1,32 ± 0,84 попытки, в группе 2 – 1,23 ± 0,86 (р = 0,21).
Таким образом, по основным клиническим параметрам группы были сопоставимы между собой.
В группе 1 был выявлен низкий уровень АМГ, который составил в среднем 0,98 [ 0,53–1,29] нг/мл, в то время как в группе 2 – 3,3 [ 1,25–5,57] нг/мл (р < 0,001). Уровень ФСГ в группах 1 и 2 также значимо различался и был соответственно 7,55 [ 6,2– 11,4] МЕ/мл и 6,30 [ 5,32–8,10] МЕ/мл (р < 0,001).
Результаты анализа распределения генотипов в исследуемых группах (общая и доминантная модели) представлены в таблице 2.
Таблица 2. Распределение частот полиморфных генотипов в исследуемых группах (общая и доминантная модели).
Table 2. Distribution of polymorphic genotype frequencies in the groups examined (general and dominant models).
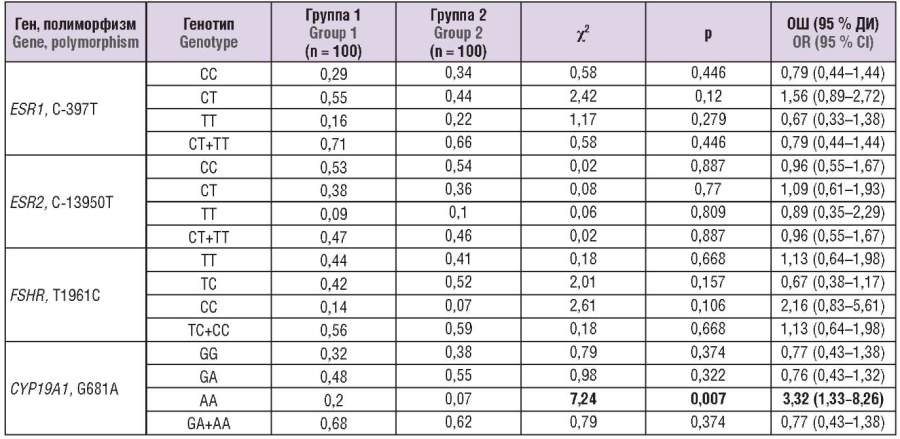
Примечание: ОШ – отношение шансов; ДИ – доверительный интервал; выделены значимые различия.
Note: OR – odds ratio; CI – confidence interval; significant differences are highlighted in bold.
Статистически значимые различия получены только для одного полиморфного варианта – гомозиготного генотипа АА гена CYP19A1. В группе 1 он выявлен у 20 (20 %), а в группе 2 – лишь у 7 (7%) пациенток (χ2 = 7,24; p = 0,01; ОШ = 0,77; 95 % ДИ = 1,33–8,26).
Далее мы провели анализ с помощью мультипликативной модели. Результаты представлены в таблице 3.
Таблица 3. Распределение частот полиморфных аллелей в исследуемых группах (мультипликативная модель).
Table 3. Distribution of polymorphic alleles frequencies in the groups examined (multiplicative model).
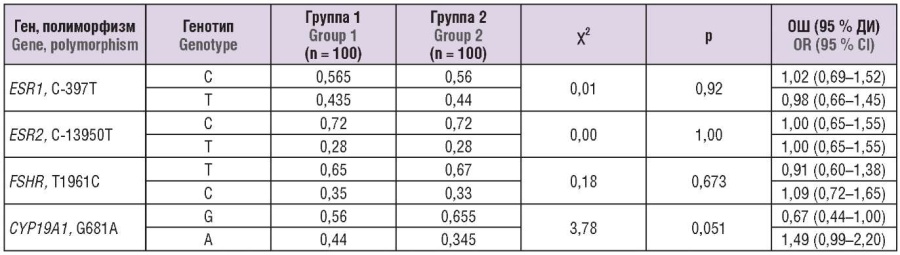
Примечание: ОШ – отношение шансов; ДИ – доверительный интервал.
Note: OR – odds ratio; CI – confidence interval.
При использовании мультипликативной модели значимых различий между исследуемыми группами не выявлено.
Далее мы провели оценку межгенных взаимодействий и сочетаний полиморфных генотипов с помощью MDR-анализа. Результаты двухлокусного анализа проиллюстрированы на рисунке 1.

Рисунок 1. Двухлокусные генетические модели.
Примечание: розовые квадраты – сочетания, повышающие риск, зеленые квадраты – сочетания, снижающие риск; розовые столбцы (слева) – группа 1, зеленые столбцы (справа) – группа 2; 0 – мажорный гомозиготный вариант, 1 – гетерозигота, 2 – полиморфный гомозиготный вариант.
Figure 1. Two-locus genetic models.
Note: color-coding – pink squares are risk-increasing combinations, green squares are risk-reducing combinations; pink columns (left) – Group 1, green columns (right) – Group 2; 0 – major homozygous variant, 1 – heterozygote, 2 – homozygous variant.
Наиболее значимые межгенные сочетания, для которых получены статистически значимые различия, представлены в таблице 4.
Таблица 4. Частота встречаемости наиболее значимых межгенных сочетаний (двухлокусные модели).
Table 4. Prevalence of most important inter-gene combinations (two-locus models).
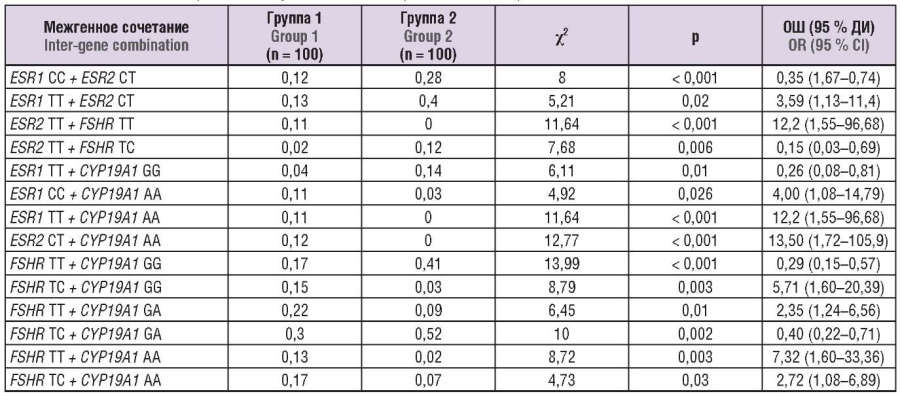
Примечание: ОШ – отношение шансов; ДИ – доверительный интервал.
Note: OR – odds ratio; CI – confidence interval.
Далее мы провели построение трехлокусной и четырехлокусной модели. Наиболее эффективной оказалась трехлокусная модель, включающая гены ESR1, FSHR и CYP19A1 (рис. 2).
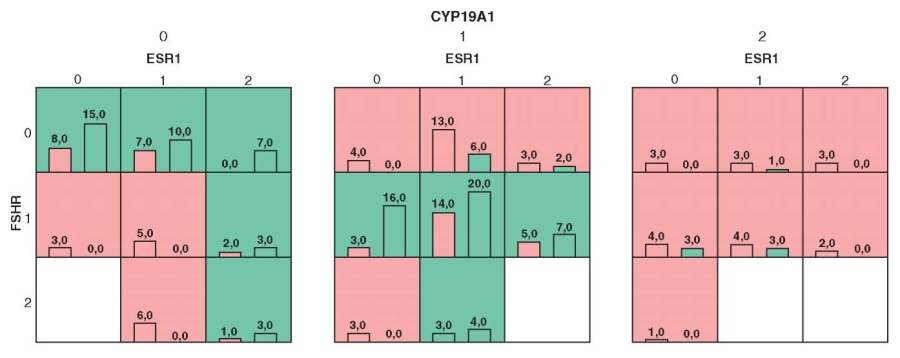
Рисунок 2. Межгенные взаимодействия в риске формирования преждевременного снижения овариального резерва (трехлокусная модель).
Примечание: розовые квадраты – сочетания, повышающие риск, зеленые квадраты – сочетания, снижающие риск; розовые столбцы (слева) – группа 1, зеленые столбцы (справа) – группа 2; 0 – мажорный гомозиготный вариант, 1 – гетерозигота, 2 – полиморфный гомозиготный вариант.
Figure 2. Inter-gene interactions in the risk of premature decline in ovarian reserve (three-locus model).
Note: color-coding – pink squares are risk-increasing combinations, green squares are risk-reducing combinations; pink columns (left) – Group 1, green columns (right) – Group 2; 0 – major homozygous variant, 1 – heterozygote, 2 – polymorphic homozygous variant.
Для оценки эффективности представленной модели использовали коэффициент перекрестной проверки (КПП) и сбалансированную точность предсказания [23]. КПП составил 10/10, сбалансированная точность – 77,8% (χ2 = 39,56; р < 0,001; ОШ = 8,53; 95 % ДИ = 4,19–17,36), чувствительность и специфичность способа – 65,1 % и 84,4 %, соответственно.
Графическое изображение характера взаимодействия полиморфных локусов при преждевременной недостаточности яичников представлено на рисунке 3. Для построения представленной модели использовался метод энтропического моделирования [24][25]. Показатель энтропии указывает силу влияния отдельных генотипов и их сочетаний на реализацию клинического фенотипа – наибольшее влияние имеют показатели с максимальным уровнем энтропии (%).
Анализ уровня энтропии показал, что наиболее весомый вклад в преждевременное снижение ОР вносит ген CYP19A1 (I = 2,7 %). Наибольшим синергичным эффектом обладают комбинации CYP19A1 и FSHR (I = 5,8 %) и ESR1 и ESR2 (I = 3,81 %), умеренный вклад вносит комбинация FSHR и ESR2 (I = 1,39 %).
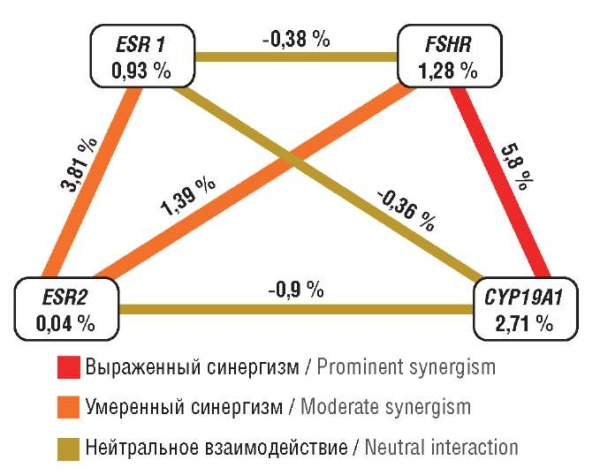
Рисунок 3. Граф генетических полиморфизмов (схема Фрюхтерман-Рейнгольда) [рисунок авторов]. На ребрах графа указаны значения межгенной энтропии, на узлах – значение энтропии для каждого гена.
Figure 3. Genetic polymorphism graph (Fruchterman-Rheingold plot) [drawn by authors]. Inter-gene entropy is depicted on the edges, with gene-specific entropy shown in nodes.
ОБСУЖДЕНИЕ / DISCUSSION
В научных базах данных на сегодняшний день имеется множество исследований, посвященных генетической предрасположенности к нарушению репродуктивной функции и, в частности, к преждевременному снижению ОР [9][15][26][27]. Однако результаты проведенных исследований неоднозначны, ни для одного полиморфного варианта не получено убедительных доказательств касательно его вклада в формирование преждевременного снижения ОР и бедного овариального ответа.
На наш взгляд, проблему составляет тот факт, что на итоговый клинический фенотип влияет множество факторов, как генетических, так и средовых. Поэтому роль каждого отдельного гена может быть не слишком значимой [28]. Мы полагаем, что в прогнозировании мультифакторной патологии, к которой, безусловно, относится бесплодный брак, более эффективными будут мультилокусные модели, учитывающие воздействие сразу нескольких генетических вариантов.
Наше исследование подтвердило это предположение в отношении преждевременного снижения ОР. При анализе отдельных генов мы получили значимые различия только для гена CYP19A1 – гомозиготный вариант АА, который чаще встречался в группе 1, т. е. у пациенток с низким ОР.
Данные, полученные при использовании метода энтропического моделирования, показали, что наибольшим синергичным эффектом обладает комбинация CYP19A1 и FSHR (I = 5,8 %). Такая ассоциация имеет синергичный ответ и свидетельствует о том, что пациентки будут иметь с большей вероятностью низкий ответ яичников, что подтверждается также и в зарубежных исследованиях [20].
Также в нашем исследовании показано, что умеренный вклад в развитие субнормального овариального ответа, который приводит к снижению качества и количества ооцитов во время ВРТ, вносит и комбинация FSHR и ESR2 (I = 1,39 %), что нашло подтверждение в работе А.М. Sindiani с соавт. [29].
ЗАКЛЮЧЕНИЕ / CONCLUSION
Существующие в настоящее время маркеры преждевременного снижения ОР, такие как возраст женщины, уровни АМГ и ФСГ, число антральных фолликулов не всегда способны служить предикторами сниженной фертильности женщины и адекватного ответа на стимуляцию овуляции в программах ЭКО. Полученные нами результаты свидетельствуют о том, что разработка генетических маркеров преждевременного снижения ОР является перспективной предпосылкой для индивидуальной оценки ОР. Проведенный нами мультилокусный анализ и разработанная прогностическая модель сниженного ОР на основании сочетания сразу нескольких вариантов полиморфных генов позволит оценить риски преждевременного снижения ОР, скорректировать репродуктивные планы пациентки и персонифицировать проведение программ ВРТ в случае необходимости.
Список литературы
1. Радзинский В.Е. Портрет современной пациентки. Ориентиры современности. Российский вестник акушера-гинеколога. 2020;20(6):7–11. https://doi.org/10.17116/rosakush2020200617.
2. Буданова М.А. Оценка причин снижения овариального резерва у женщин репродуктивного возраста. Современная наука: актуальные проблемы теории и практики. Серия: естественные и технические науки. 2021;(9):94–102. https://doi.org/10.37882/2223-2966.2021.09.05.
3. Гасымова Д.М., Рухляда Н.Н. Овариальный резерв, опосредованное и непосредственное влияние патологических факторов на него (обзор литературы). Проблемы репродукции. 2017;23(6):7–11. https://doi.org/10.17116/repro20172367-11.
4. Jirge P.R. Poor ovarian reserve. J Hum Reprod Sci. 2016;9(2):63–9. https://doi.org/10.4103/0974-1208.183514.
5. Steiner A.Z. Biomarkers of ovarian reserve as predictors of reproductive potential. Semin Reprod Med. 2013;31(6):437–42. https://doi.org/10.1055/s-0033-1356479.
6. Гаспаров А.С., Дубинская Е.Д., Титов Д.С., Лаптева Н.В. Клиническое значение овариального резерва в реализации репродуктивной функции. Акушерство и гинекология. 2014;(4):11–6.
7. Чернуха Г.Е., Табеева Г.И., Рштуни С.Д. и др. Гены, вовлеченные в развитие преждевременного недостатосночти яичников. Акушерство и гинекология. 2021;(11):71–80. https://doi.org/10.18565/aig.2021.11.71-80.
8. Зенкина В.Г., Солодкова О.А., Божко Г.Г. и др. Молекулярные механизмы оогенеза. Бюллетень сибирской медицины. 2021;20(2):139–47. https://doi.org/10.20538/1682-0363-2021-2-139-147.
9. Ковалев В.В., Кудрявцева Е.В. Молекулярно-генетические девиации и акушерская патология. Акушерство и гинекология. 2020;(1):26–32. https://doi.org/10.18565/aig.2020.1.26-32.
10. Altmäe S., Haller K., Peters M. et al. Allelic estrogen receptor 1 (ESR1) gene variants predict the outcome of ovarian stimulation in in vitro fertilization. Mol Hum Reprod. 2007;13(8):521–6. https://doi.org/10.1093/molehr/gam035.
11. Loutradis D., Theofanakis C., Anagnostou E. et al. Genetic profile of SNP(s) and ovulation induction. Curr Pharm Biotechnol. 2012;13(3):417– 25. https://doi.org/10.2174/138920112799361954.
12. Ayvaz O.U., Ekmekci A., Baltaci V. et al. Evaluation of in vitro fertilization parameters and estrogen receptor alpha gene polymorphisms for women with unexplained infertility. J Assist Reprod Genet. 2009;26(9–10)503–10. https://doi.org/10.1007/s10815-009-9354-2.
13. Altmäe S., Hovatta O., Stavreus-Evers A., et al. Genetic predictors of controlled ovarian hyperstimulation: Where do we stand today? Hum Reprod Update. 2011;17(6):813–28. https://doi.org/10.1093/humupd/dmr034.
14. De Santo I., McCartney A., Midliaccio I. et al. The emerging role of ESR1 mutations in luminal breast cancer as a prognostic and predictive biomarker of response to endocrine therapy. Cancers (Basel). 2019;11(12):1894. https://doi.org/10.3390/cancers11121894.
15. Boudjenah R., Molina-Gomes D., Torre A. et al. Genetic polymorphisms influence the ovarian response to rFSH stimulation in patients undergoing in vitro fertilization programs with ICSI. PLoS One. 2012;7(6):e38700. https://doi.org/10.1371/journal.pone.0038700.
16. Allegra A., Marino A., Raimondo S. et al. The carriers of the A/G–G/G allelic combination of the c.2039 A>G and c.-29 G>A FSH receptor polymorphisms retrieve the highest number of oocytes in IVF/ICSI cycles. J Assist Reprod Genet. 2017;34(2):263–73. https://doi.org/10.1007/s10815-016-0835-9.
17. Лянгасова О.В., Савикина К.Г., Ломтева С.В., Шкурат Т.П. Полиморфные варианты гена FSHR и гормональный профиль программ вспомогательных репродуктивных технологий. Живые и биокосные системы. 2017;(19):6.
18. Praveen V.P., Ladjouze A., Sauter K.-S. et al. Novel CYP19A1 mutations extend the genotype-phenotype correlation and reveal the impact on ovarian function. J Endocr Soc. 2020;4(4):bvaa030. https://doi.org/10.1210/jendso/bvaa030.
19. Кудрявцева Е.В. Роль генов детоксикации в формировании патологии репродуктивной системы. Вестник уральской медицинской академической науки. 2013;(2):106–9.
20. Song D., Huang X.-L., Hong L. et al. Sequence variants in FSHR and CYP19A1 genes and the ovarian response to controlled ovarian stimulation. Fertil Steril. 2019;112(4):749–757.e2. https://doi.org/10.1016/j.fertnstert.2019.05.017.
21. Abu-Musa A., Haahr T., Humaidan P. Novel physiology and definition of poor ovarian response; clinical recommendations. Int J Mol Sci. 2020;21(6):2110. https://doi.org/10.3390/ijms21062110.
22. Alviggi C., Andersen C.Y., Buehler K. et al. A new more detailed stratification of low responders to ovarian stimulation: from a poor ovarian response to a low prognosis concept. Fertil Steril. 2016;105(6):1452–3. https://doi.org/10.1016/j.fertnstert.2016.02.005.
23. Пономаренко И.В. Использование метода Multifactor Dimensionality Reduction (MDR) и его модификаций для анализа ген-генных и генно-средовых взаимодействий при генетико-эпидемиологических исследованиях (обзор). Научные результаты биомедицинских исследований. 2019;5(1):4–21. https://doi.org/10.18413/2313-8955-2019-5-1-0-1.
24. Чакова Н.Н., Ниязова С.С., Комиссарова С.М. Взаимодействие аллельных вариантов генов симпатоадреналовой и ренин-ангиотензин-альдостероновой систем при гипертрофической кардиомиопатии. Молекулярная и прикладная генетика. 2016;20:61–9.
25. Epistasis: methods and protocols (Methods in Molecular Biology, 1253). Eds. J.H. Moore, S.M. Williams. Humana New York, 2015. 360 p. https://doi.org/10.1007/978-1-4939-2155-3.
26. Kim S., Pyun J.-A., Kang H. et al. Epistasis between CYP19A1 and ESR1 polymorphisms is associated with premature ovarian failure. Fertil Steril. 2011;95(1):353–6. https://doi.org/10.1016/j.fertnstert.2010.07.1067.
27. Anagnostou E., Mavrogianni D., Theofanakis C. et al. ESR1, ESR2 and FSH receptor gene polymorphisms in combination: A useful genetic tool for the prediction of poor responders. Curr Pharm Biotechnol. 2012;13(3):426– 34. https://doi.org/10.2174/138920112799361891.
28. Кудрявцева Е.В. Философские, медицинские и юридические аспекты репродуктивной генетики. Уральский медицинский журнал. 2018;(13):54–7. https://doi.org/10.25694/URMJ.2018.13.46.
29. Sindiani A.M., Batiha O., Al-Zoubi E. et al. Association of single-nucleotide polymorphisms in the ESR2 and FSHR genes with poor ovarian response in infertile Jordanian women. Clin Exp Reprod Med. 2021;48(1):69–79. https://doi.org/10.5653/cerm.2020.03706.
Об авторах
Е. В. КудрявцеваРоссия
Кудрявцева Елена Владимировна – доктор медицинских наук, доцент кафедры акушерства и гинекологии
620219, Екатеринбург, ул. Репина, д. 3
Н. В. Курбатова
Россия
Курбатова Наталья Владимировна – врач акушер-гинеколог
620026 Екатеринбург, ул. Тверитина, д. 16
В. В. Ковалев
Россия
Ковалев Владислав Викторович – доктор медицинских наук, профессор, заведующий кафедрой акушерства и гинекологии, трансфузиологии
620219, Екатеринбург, ул. Репина, д. 3
Д. К. Исламиди
Россия
Исламиди Диана Константиновна – кандидат медицинских наук, доцент кафедры акушерства и гинекологии, трансфузиологии ФГБОУ ВО «Уральский государственный медицинский университет» Министерства здравоохранения Российской Федерации, Екатеринбург, Россия; врач акушер-гинеколог ООО Медикофармацевтический центр «Гармония»
620219, Екатеринбург, ул. Репина, д. 3,
620026 Екатеринбург, ул. Тверитина, д. 16
Рецензия
Для цитирования:
Кудрявцева Е.В., Курбатова Н.В., Ковалев В.В., Исламиди Д.К. Исследование генетической предрасположенности к преждевременному снижению овариального резерва. Акушерство, Гинекология и Репродукция. 2022;16(3):266-276. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.301
For citation:
Kudryavtseva E.V., Kurbatova N.V., Кovalev V.V., Islamidi D.K. Investigating genetic predisposition to premature decline in ovarian reserve. Obstetrics, Gynecology and Reproduction. 2022;16(3):266-276. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.301

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































