Перейти к:
Антикоагулянты: методы контроля дозы и ингибиторы
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.293
Аннотация
Антикоагулянты – крайне востребованные препараты в наши дни. Они используются в качестве профилактики тромбоэмболических осложнений при различных заболеваниях и состояниях в общетерапевтической практике, в кардиологии, неврологии, а также в акушерстве при ведении беременности высокого риска. Актуальность вопроса грамотного использования антикоагулянтов вышла на передний план в связи с появлением нового заболевания – коронавирусной инфекции COVID-19 и ее серьезных осложнений в виде развития тромботического шторма, при котором своевременное назначение антикоагулянтной терапии является залогом успеха терапии. Риск кровотечения следует учитывать при использовании любых антикоагулянтов. Пожилой возраст, нарушение функции почек и одновременный прием антиагрегантов являются общими факторами риска кровотечений. При этом лишь для антагонистов витамина К и гепарина имеются специфические антидоты – витамин К и протамин, соответственно. Ингибиторы остальных антикоагулянтов универсальны – это неактивированный или активированный концентрат протромбинового комплекса и рекомбинантный фактор VIIa. Гемодиализ эффективно снижает концентрацию дабигатрана, активированный уголь эффективен в случае недавнего перорального приема липофильных препаратов. Исследования новых антидотов имеющихся в настоящее время антикоагулянтов продолжаются, также как испытания новых видов антикоагулянтов, обладающих достаточной эффективностью в профилактике и лечении тромбоэмболических осложнений при минимальном риске геморрагических. Основным противопоказанием к использованию антикоагулянтов является незнание врачом механизмов действия препарата и возможности подавления его эффекта.
Ключевые слова
Для цитирования:
Бицадзе В.О., Слуханчук Е.В., Хизроева Д.Х., Третьякова М.В., Цибизова В.И., Гашимова Н.Р., Накаидзе И.А., Элалами И., Гри Ж., Макацария А.Д. Антикоагулянты: методы контроля дозы и ингибиторы. Акушерство, Гинекология и Репродукция. 2022;16(2):158-175. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.293
For citation:
Bitsadze V.O., Slukhanchuk E.V., Khizroeva J.Kh., Tretyakova M.V., Tsibizova V.I., Gashimova N.R., Nakaidze I.A., Elalamy I., Gris J., Makatsariya A.D. Anticoagulants: dose control methods and inhibitors. Obstetrics, Gynecology and Reproduction. 2022;16(2):158-175. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.293
Введение / Introduction
Кровотечение является основным побочным эффектом от использования любого антикоагулянта. Риск развития внутричерепного кровоизлияния, желудочно-кишечного или маточного кровотечения зачастую толкает пациента на отказ от лечения.
В рандомизированных клинических исследованиях, касающихся использования антагонистов витамина К (АВК) у пациентов с фибрилляцией предсердий, средняя частота массивных кровотечений составила 2,1 на 100 пациенто-лет [1]. При использовании прямых оральных антикоагулянтов риск развития массивных кровотечений составил 30%, апиксабана – 38% по сравнению с варфарином [2]. Пациенты с венозной тромбоэмболией (ВТЭ) отличаются от популяции пациентов с фибрилляцией предсердий факторами риска кровотечений: более молодой возраст, редкое сочетание с терапией антиагрегантами, сопутствующие онкологические заболевания, более высокие стартовые дозы антикоагулянтов. Риск кровотечения у пациентов, получающих нефракционированный гепарин (НФГ), зависит от исходных характеристик пациента (возраста и сопутствующей патологии), дозы гепарина, сопутствующего приема других антитромботических препаратов, травмы или оперативного лечения в ближайшем прошлом [3]. Рандомизированные контролируемые испытания, в которых сравнивали фондапаринукс с низкомолекулярным гепарином (НМГ) или НФГ, показали одинаковый риск развития массивного кровотечения – от 1 до 2% [4]. Чаще всего источником массивных кровотечений на фоне приема оральных антикоагулянтов является желудочно-кишечный тракт. Антагонисты витамина К широко используются для профилактики и лечения артериальных и венозных тромбозов уже более 50 лет. В последние годы широкое применение получили новые оральные антикоагулянты (НОАК), которые обладают некоторыми преимуществами перед АВК, а именно, более предсказуемой фармакокинетикой и фармакодинамикой, меньшим влиянием лекарственных взаимодействий и пищевого поведения, возможностью использования режимов фиксированных доз и отсутствием необходимости регулярного мониторинга. Однако в отличие от варфарина, у данной группы препаратов отсутствуют специфические ингибиторы, что делает их использование неуправляемым при необходимости быстрой отмены антикоагулянтного действия в связи с развитием кровотечения, либо при необходимости проведения оперативного лечения. Кроме этого, пероральные ингибиторы фактора свертывания Ха (FХа) вызывают меноррагию у 30% молодых женщин, что значительно превышает показатель при приеме варфарина [5]. Это осложнение возможно корректировать транексамовой кислотой, сопутствующей гормональной терапией, либо отменой препарата с возвратом к варфарину. Поиск новых антикоагулянтов с меньшим риском кровотечения важен не только с точки безопасности, но и с точки зрения повышения комплаентности со стороны пациента.
МЕХАНИЗМЫ ДЕЙСТВИЯ РАЗЛИЧНЫХ АНТИКОАГУЛЯНТОВ / ANTICOAGULANTS. MECHANISMS OF ACTION
Антагонисты витамина К / Vitamin K antagonists
Антагонисты витамина К подавляют регенерацию витамина К – кофактора в гамма-карбоксилировании факторов свертывания крови II, VII, IX и X, а также протеинов C, S и Z. Фармакокинетика и фармакодинамика АВК подробно изучены [6]. Антикоагулянтные эффекты варфарина подвержены влиянию генетической изменчивости цитохрома P450 и фермента эпоксидредуктазы витамина К, влиянию лекарственных взаимодействий и продуктов питания. В связи с этим прием варфарина должен сопровождаться постоянным мониторингом международного нормализованного отношения (МНО). Результаты проведенных ранее исследований не продемонстрировали эффективности генотипирования в подборе дозы варфарина и оптимизации варфаринотерапии [7].
Гепарины / Heparins
НФГ представляет собой смесь сульфатированных гликозаминогликанов различной молекулярной массы, которые подавляют ряд факторов свертывания крови после связывания с антитромбином, что вызывает конформационные изменения с усилением эффективности ингибирования в 1000 раз. НМГ синтезируют путем деполимеризации и/или фракционирования НФГ. Он преимущественно подавляет FХа. Фондапаринукс – это пентасахарид, который эффективно связывается с антитромбином и потенциирует его эффект в подавлении FХа. Время полувыведения НФГ после внутривенного введения составляет 1–2 ч, а время полувыведения различных НМГ колеблется от 3 до 12 ч. Ограничения использования гепарина основаны на его фармакокинетических и биофизических свойствах [8]. Фармакокинетические ограничения связаны с различными антикоагулянтными эффектами гепаринов, которые вызваны не зависящим от антитромбина связыванием гепарина с белками плазмы и белками, высвобождаемыми из тромбоцитов и эндотелиальных клеток. Биофизические ограничения включают остеопению и гепарин-индуцированную тромбоцитопению. Эти ограничения менее выражены при использовании НМГ.
Прямые оральные ингибиторы тромбина / Direct oral thrombin inhibitors
Тромбин играет ключевую роль в коагуляционном каскаде, способствуя превращению фибриногена в фибрин, активируя тромбоциты, другие факторы свертывания, путь протеина C и эндотелиальные рецепторы. Ксимелагатран был прототипом первого разработанного перорального препарата этой группы, однако впоследствии был снят с производства в связи с серьезными побочными эффектами со стороны печени [9]. Дабигатрана этексилат – это пролекарство, не имеющее профиля риска своего предшественника, с биодоступностью 6,5%. Его время полувыведения составляет 12–17 ч при условии нормальной функции почек, а концентрация достигает максимума в плазме крови в течение 1,5–3 ч после приема внутрь, 80% выводится почками и 35% связывается с белками плазмы [10]. Дабигатран продемонстрировал эффективность, сравнимую с эноксапарином в отношении профилактики риска тромбозов в послеоперационном периоде после артропластики тазобедренного сустава [11] и коленного сустава [12]. Его эффективность была сравнима с варфарином при неотложной помощи [13] и продленной поддерживающей терапии ВТЭ [14]. По данным исследований, дабигатран не уступал варфарину в профилактике инсульта при фибрилляции предсердий [15]. Дабигатран в настоящее время одобрен в Европе и Северной Америке для профилактики инсульта у пациентов с фибрилляцией предсердий (англ. stroke prophylaxis in atrial fibrillation, SPAF) и для профилактики ВТЭ после обширных ортопедических операций (кроме США).
Оральные ингибиторы фактора Ха / Oral Xa factor inhibitors
Первые препараты этой группы – ривароксабан и апиксабан действуют путем обратимого блока активного участка FХа. Их биодоступность выше, чем у дабигатрана (ривароксабан – 80%, апиксабан – 60%, эдоксабан – 50%). Пиковая концентрация достигается через 1–4 ч. Эффект препаратов меньше зависит от функции почек [16]. Ривароксабан в исследованиях у пациентов после ортопедических операций продемонстрировал более высокую эффективность тромбопрофилактики по сравнению с эноксапарином с аналогичной частотой кровотечений [17]. Его эффективность была также сравнима с использованием варфарина у пациентов с фибрилляцией предсердий [18] и ВТЭ [4]. Препарат одобрен для тромбопрофилактики в ортопедической хирургии, для лечения SPAF и ВТЭ. Апиксабан также оценивался относительно эноксапарина у пациентов, перенесших операцию по замене коленного сустава [19] и тазобедренного сустава [20]. Было показано, что он одинаково эффективен при значительно меньшей частоте кровотечений, оказался более эффективным для профилактики инсульта, чем ацетилсалициловая кислота (АСК) или варфарин, у пациентов с фибрилляцией предсердий с аналогичным (по сравнению с АСК) [15] или превосходящим (по сравнению с варфарином) [21] профилем безопасности. Он не уступал варфарину в лечении ВТЭ и обладал значительно более низкой частотой кровотечений [22]. Апиксабан одобрен в Европе и Северной Америке для SPAF и профилактики ВТЭ после ортопедических операций. Эдоксабан также одобрен как альтернатива варфарину в отношении терапии ВТЭ [23] и фибрилляции предсердий [24] со значительно более низкой частотой кровотечений.
Ингибиторы фактора XIа / Factor XIa inhibitors
Фактор XIа является активно изучаемой потенциальной мишенью для антикоагулянтной терапии. Эти препараты могут быть особенно привлекательными для групп пациентов с высоким риском кровотечения, например, для пациентов с почечной недостаточностью, находящихся на диализе. FXI является частью внутреннего (контактно-активируемого) пути коагуляции, он необходим для роста и стабилизации тромба [25] и может быть активирован как фактором XIIa, так и тромбином [26] через петлю амплификации с положительной обратной связью (рис. 1) [27].
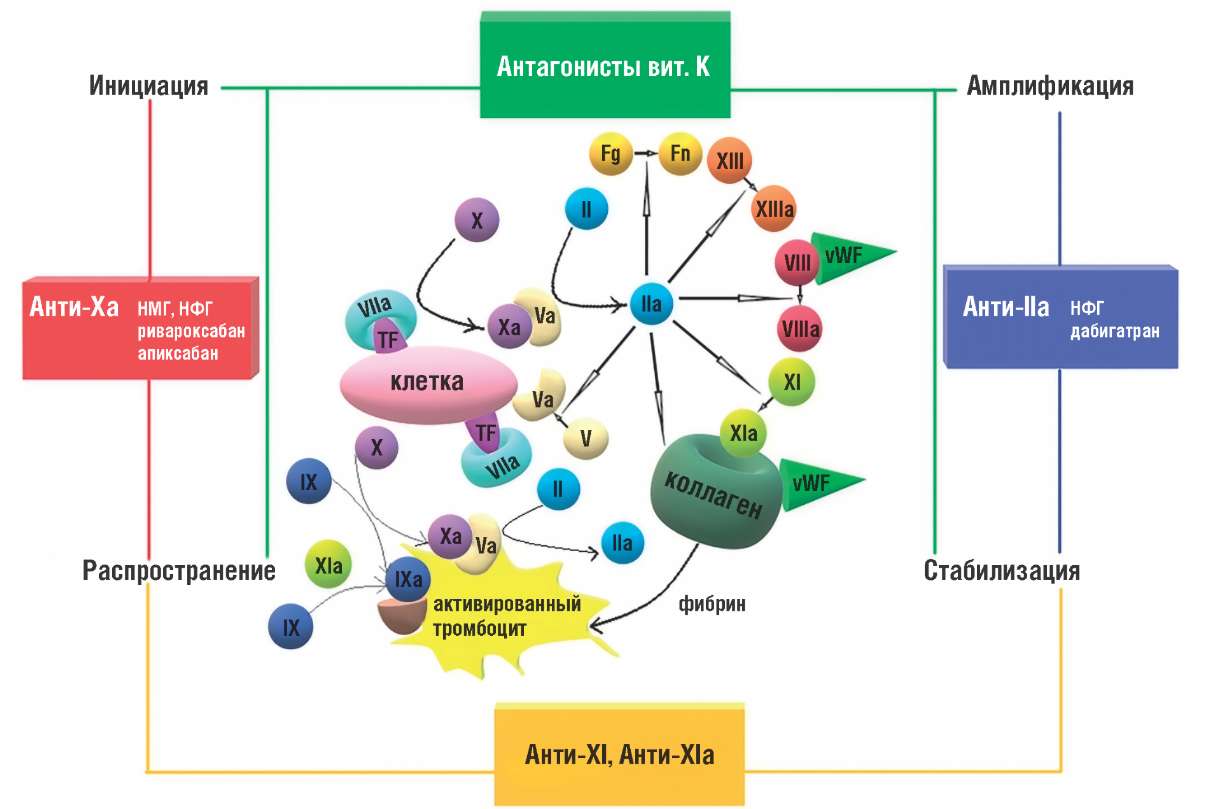
Рисунок 1. Точки приложения антикоагулянтов [27].
Примечание: vWF – фактор фон Виллебранда; TF – тканевой фактор; вит. К – витамин К; Анти-IIa, Анти-Ха, Анти-XI, Анти-XIa – антагонисты факторов IIa, Xa, XI, XIa; НМГ – низкомолекулярный гепарин; НФГ – нефракционированный гепарин; Fg – фибриноген; Fn – фибрин.
Figure 1. Anticoagulant application sites [27].
Note: vWF – von Willebrand factor; TF – tissue factor; вит. К – vitamin K; Анти-IIa, Анти-Ха, Анти-XI, Анти-XIa – antagonists of IIa, Xa, XI, XIa factors; НМГ – low molecular weight heparin; НФГ – unfractionated heparin; Fg – fibrinogen; Fn – fibrin.
Врожденный дефицит FXI встречается в общей популяции редко (около 1 на 1 млн) и наиболее распространен в еврейской общине ашкенази [28]. Он характеризуется относительно легким геморрагическим диатезом, который четко не коррелирует с концентрацией FXI в плазме крови [29]. Спонтанных кровотечений на фоне дефицита не отмечено, что отличает его от дефицита XI, VIII, IX факторов. Редко возникают и спонтанные кровотечения, обычно после травмы или хирургического вмешательства в тканях с высокой фибринолитической активностью, таких как ротовая полость, нос и мочевыводящие пути.
Исследования показали, что дефицит FXI сопутствует снижению частоты сердечно-сосудистых событий (инсульт, транзиторная ишемическая атака и инфаркт миокарда) и ВТЭ [30]. У людей с более низкой концентрацией FXI в плазме крови в результате генетической предрасположенности на 22% снижен риск венозного тромбоза и ишемического инсульта без увеличения риска кровотечений [31].
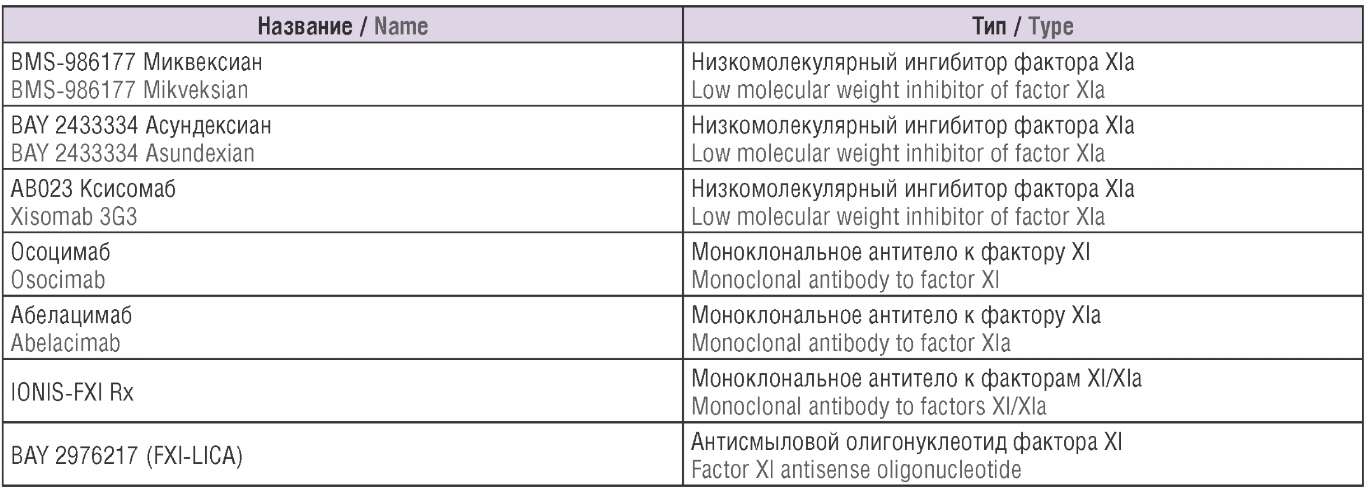
Несколько разрабатываемых препаратов ингибиторов факторов XI и XIa находятся в настоящее время на стадии изучения (табл. 1). К ингибиторам факторов XI и XIa, наиболее изученным в клинических испытаниях, относят антисмысловой олигонуклеотид BAY 2976217 (IONIS FXI-LRx), моноклональные антитела осоцимаб, ксисомаб 3G3 (AB023) и абелацимаб, а также малые молекулы BAY 2433334 и BMS-986177. Считается, что низкомолекулярные ингибиторы имеют низкий почечный клиренс (8–20%), антисмысловые олигонуклеотиды и моноклональные антитела не выводятся почками, что дает дополнительные преимущества для пациентов с почечной недостаточностью, находящихся на гемодиализе [32]. Диализ не удаляет моноклональные антитела или антисмысловые олигонуклеотиды, и нет данных о том, удаляет ли диализ специфические низкомолекулярные ингибиторы. Тот факт, что они прочно связаны с белком, делает этот процесс маловероятным.
Таблица 1. Разрабатываемые препараты ингибиторов XI и XIa факторов.
Table 1. Factors XI and XIa inhibitors under development.
При использовании антисмыслового олигонуклеотида (IONIS-FXI Rx) происходит дозозависимое уменьшение риска артериального и венозного тромбоза без увеличения времени кровотечения на мышиных моделях [33]. Кроме того, введение IONIS-FXI Rx ведет к устойчивому антитромботическому эффекту без увеличения кровотечения в моделях бабуинов [34]. IONIS-FXI Rx оценили в исследовании фазы 2 у пациентов, перенесших плановое одностороннее тотальное эндопротезирование коленного сустава [35]. Пациенты получали IONIS-FXI Rx, 200 или 300 мг эноксапарина (НМГ) в течение 35 дней до операции. IONIS-FXI Rx (300 мг) превосходил эноксапарин в снижении частоты ВТЭ (доза 200 мг не уступала эноксапарину). Обе дозы IONIS-FXI Rx были связаны с численно меньшим числом кровотечений, чем эноксапарин [35].
BAY 2976217 (также известный как FXI-LICA и IONISFXILRx) представляет собой конъюгированную с лигандом версию IONIS-FXI Rx. Безопасность, переносимость, фармакокинетика и фармакодинамика BAY 2976217 были исследованы в двойном слепом плацебо-контролируемом исследовании фазы 1 на здоровых добровольцах [36].
Антитромботическое антитело осоцимаб против FXIa (BAY 1213790) продемонстрировало антитромботические эффекты без значительного увеличения времени кровотечения на модели артериального тромбоза у кроликов. Введение однократной послеоперационной инфузии двойного FXI/FXIa моноклонального антитела – абелацимаба снижало ВТЭ в течение 30 дней после тотального эндопротезирования коленного сустава до 5% (доза 75 мг) и 4% (доза 150 мг) по сравнению с 22% у пациентов, получающих 40 мг эноксапарина подкожно ежедневно. Абелацимаб (30 мг) не уступал эноксапарину (ВТЭ у 13%) [37].
Ингибиторы FXI могут улучшить показатели безопасности по сравнению с другими пероральными антикоагулянтами. Например, в исследовании FOXTROT послеоперационный прием осоцимаба уменьшал количество больших или клинически значимых небольших кровотечений – 0–3% пациентов по сравнению с 6% пациентов в группе эноксапарина [38]. В другом исследовании фазы 2 клинически значимые кровотечения возникали у 3% пациентов, получавших IONISFXI Rx, по сравнению с 8% среди тех, кто получал эноксапарин. Данные исследований у пациентов с механическими клапанами сердца показали, что воздействие на тромбин с помощью дабигатрана неэффективно по сравнению с варфарином [39]. Кроме того, in vitro истощение FXI устраняло индуцированное механическим клапаном образование тромбина [40].
Многоцентровое исследование фазы 2, проведенное у пациентов с почечной недостаточностью, находящихся на гемодиализе, показало, что IONIS-FXI Rx уменьшал свертывание крови на диализной мембране по сравнению со стандартным использованием гепарина, и это требует дальнейшего клинического исследования в данной группе пациентов [41]. Таким образом, существует возможность использовать новые препараты, ингибирующие FXI, у лиц с почечной недостаточностью, находящихся на диализе, не только для профилактики инсульта при фибрилляции предсердий, но и в более широком смысле для предотвращения сердечно-сосудистых осложнений.
МЕТОДЫ КОНТРОЛЯ ДОЗЫ АНТИКОАГУЛЯНТОВ И МОНИТОРИНГ НА ФОНЕ ГЕМОРРАГИЧЕСКИХ ОСЛОЖНЕНИЙ ПРИ ИСПОЛЬЗОВАНИИ РАЗЛИЧНЫХ АНТИКОАГУЛЯНТОВ / METHODS FOR CONTROLLING ANTICOAGULANTS DOSE AND MONITORING HEMORRHAGIC COMPLICATIONS WHILE USING VARIOUS ANTICOAGULANTS
Антикоагулянтная терапия проводится не менее 3 мес после первого эпизода тромбоза, а пациентам с высоким риском рецидива ВТЭ рекомендуется бессрочное (потенциально пожизненное) лечение [42]. Стратификация пациентов в зависимости от риска рецидива ВТЭ проводится прежде всего с определением D-димера – продукта распада фибрина и маркера активации коагуляции.
D-димер / D-dimer
D-димер является глобальным индикатором активации свертывания и фибринолиза, косвенным маркером тромботической активности. Этот продукт распада фибрина образуется за счет последовательного действия тромбина, активированного фактора XIII (FXIIIa) и плазмина [43]. Во-первых, тромбин, образующийся при активации коагуляции, превращает фибриноген в фибрин и активирует FXIII. Во-вторых, FXIIIa ковалентно связывает D-домены в соседних мономерах фибрина. В-третьих, плазмин (образованный на поверхности фибрина в результате активации плазминогена) расщепляет фибрин-субстрат в определенных участках; в процессе расщепления фибрина, поперечно сшитого с помощью FXIIIa, происходит синтез D-димера. D-димер выводится через почки и ретикулоэндотелиальную систему, период полувыведения из плазмы составляет примерно 8 ч. Низкие уровни D-димера могут быть обнаружены в кровотоке в норме, в то время как патологически повышенные уровни могут быть обнаружены при любом состоянии, связанном с усиленным образованием фибрина и фибринолизом [43]. Тесты определения концентрации D-димера лучше всего валидированы для исключения ВТЭ, а также для диагностики и мониторинга диссеминированного внутрисосудистого свертывания крови.
Высокие концентрации D-димера позволяют выделить группу пациентов с высоким риском рецидива, у которых оправдана длительная антикоагулянтная терапия [44]. И наоборот, низкие концентрации D-димера позволяют исключить пациентов с низким риском рецидива, у которых длительная антикоагулянтная терапия может быть неоправданной [45]. Эффективность использования показателя D-димера с целью выделения групп риска рецидивов оценена и подтверждена многими клиническими исследованиями. В большинстве из них концентрация D-димера определялась через 3–4 нед после прекращения антикоагулянтной терапии; в некоторых работах D-димер измеряли последовательно во время и в разное время после прекращения антикоагуляции [46]; наконец, в одном исследовании измерение проводилось только во время антикоагулянтной терапии [47]. Мониторинг уровня D-димера на фоне проведения антикоагулянтной терапии необходим для подбора более корректной и минимальной дозы препарата с последующей оценкой его эффективности и безопасности.
Несмотря на то что использование антикоагулянтов связано с риском кровотечения, они увеличивают выживаемость у пациентов с тяжелой COVID-19-инфекцией. У пациентов с тяжелым течением COVID-19 дозы антикоагулянтов подбираются в том числе и по степени повышения концентрации D-димера.
В случае развития геморрагических осложнений экспресс-тестом при использовании АВК является МНО. Для НОАК следует использовать общие показатели гемостаза, такие как тромбиновое время (TВ), протромбиновое время (ПT) или активированное частичное тромбопластиновое время (АЧТВ), которые могут дать приблизительную качественную оценку эффекта, в меньшей степени для апиксабана и эдоксабана, чем для дабигатрана (с ТВ или АЧТВ) или ривароксабана (с ПT) [48]. В группе пациентов высокого риска тромбоэмболических осложнений (ТЭО) вопрос о возобновлении антикоагулянтной терапии, препаратах и дозах решается в том числе и с оценкой уровня D-димера.
Кровотечение. Определение понятий / Bleeding. Definition of concepts
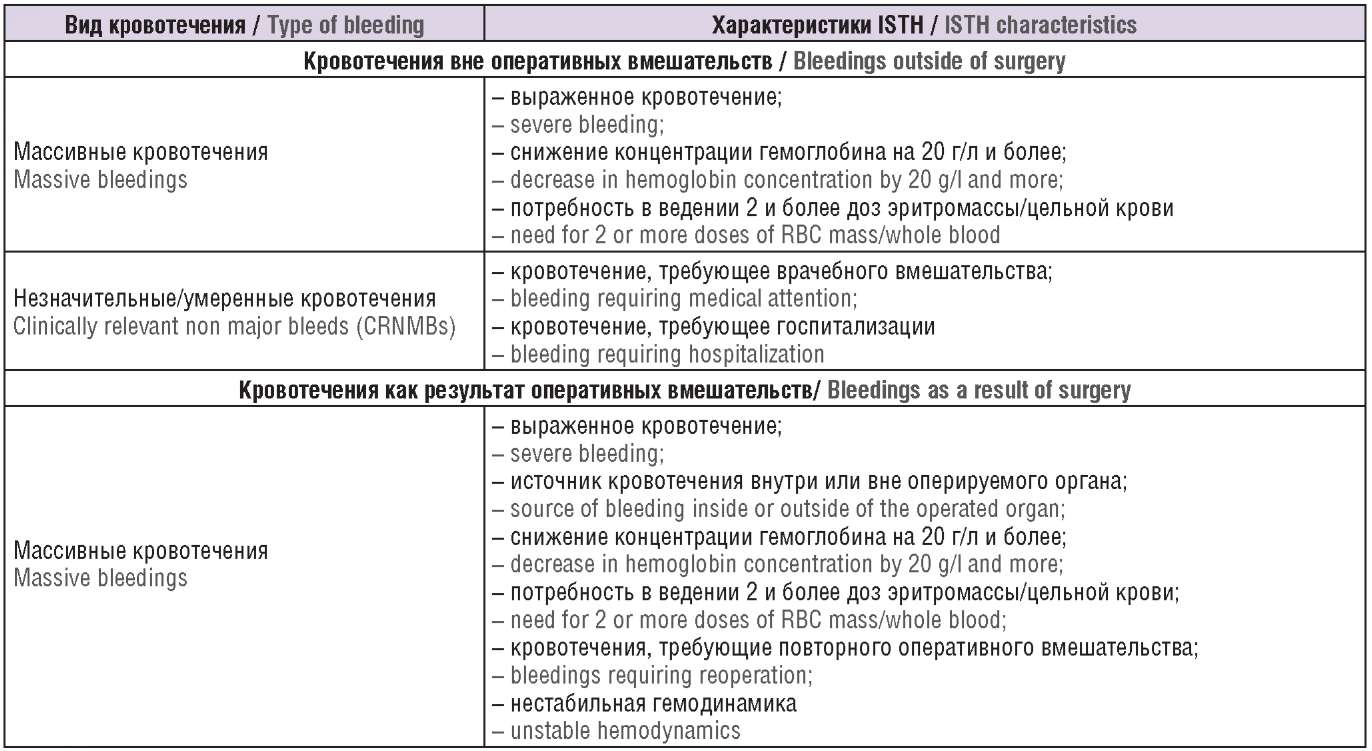
Определение, данное массивному кровотечению Международным обществом по тромбозу и гемостазу (англ. International Society on Thrombosis and Hemostasis, ISTH), широко используется в последнее десятилетие [49]. Существуют и другие виды классификаций тяжести кровотечений. В большинстве определений основным критерием является снижение гемоглобина. Ряд авторов отдельно выделяют угрожающие жизни кровотечения. Выделена также отдельная группа кровотечений – клинически значимые небольшие кровотечения (англ. сlinically relevant non major bleeds, CRNMBs), соответствующие умеренным и незначительным кровотечениям (табл. 2).
Таблица 2. Характеристика кровотечений [49][50].
Тable 2. Bleeding characteristics [49][50].
Частота кровотечений и факторы риска кровотечений при приеме антикоагулянтов / Bleeding frequency and risk factors for bleeding under anticoagulant therapy
Антагонисты витамина К / Vitamin K antagonists
Независимо от выбора антикоагулянта и используемой терапевтической дозы всегда сохраняется риск кровотечения. Использование АВК увеличивает риск массивного кровотечения на 2–3% в год и риск внутричерепного кровоизлияния примерно на 0,2% в год [51]. К основным факторам риска развития кровотечений на фоне антикоагулянтной терапии относят высокие дозы антикоагулянта, одновременный прием препаратов, влияющих на гемостаз, таких как антиагреганты, нестероидные противовоспалительные средства или ингибиторы циклооксигеназы, особенности пациента (возраст, сопутствующие заболевания, такие как гипертоническая болезнь, сахарный диабет, цереброваскулярные заболевания, ишемический инсульт, сердечно-сосудистые заболевания, почечная недостаточность, заболевания печени, злокачественные новообразования и алкоголизм), а также продолжительность терапии [52].
Гепарины / Heparins
Риск массивного кровотечения при использовании гепаринов колеблется от 0 до 2% [52]. Он зависит от дозы антикоагулянтов, основного заболевания, принимаемых других антикоагулянтов. Почечная недостаточность, возраст и пол пациента также считаются факторами риска гепарин-индуцированного кровотечения [52]. НМГ следует использовать с осторожностью у пациентов с нарушением функции почек, так как биоаккумуляция препарата может привести к кровотечению [53]. Профилактические дозы фондапаринукса (2,5 мг/сут) сопряжены с меньшим кровотечением, чем терапевтические дозы НМГ [54], но с таким же риском, как у НФГ [55] и у профилактических доз НМГ [56].
Новые антикоагулянты / New generation anticoagulants
НОАК обладают более коротким периодом полувыведения и более широким терапевтическим окном. Теоретически прогностические факторы риска кровотечения для АВК применимы и к НОАК. Почечная недостаточность – важный фактор, учитывая, что препараты выводятся из организма почками. Независимым фактором риска является возраст [57]. Было показано, что прием дабигатрана в дозе 150 мг дважды в сутки был связан с более высокой частотой кровотечений по сравнению с дозой 110 мг дважды в сутки [58]. Частота серьезных кровотечений составила 3,74 и 2,99% в год при дозе 150 и 110 мг соответственно. Риск кровотечений резко возрастает при сочетании дабигатрана и варфарина с антиагрегантами [59]. Анализ данных об использовании ривароксабана при фибрилляции предсердий показал, что факторами риска кровотечений при его приеме являются пожилой возраст, мужской пол, сахарный диабет, высокий индекс массы тела и низкий клиренс креатинина [60].
Коррекция геморрагических осложнений на фоне антикоагулянтной терапии / Anticoagulant therapy and correction of its hemorrhagic complications
Подход к коррекции геморрагических осложнений на фоне антикоагулянтной терапии должен быть строго персонифицирован в каждом конкретном случае с соблюдением баланса между риском ТЭО, показаниями к антикоагуляции и тяжестью кровотечения, а также степенью неотложности состояния и показаниями к полной отмене используемого препарата. В таблице 3 суммированы основные характеристики представленных на рынке антикоагулянтов и средств, используемых для борьбы с геморрагическими осложнениями.
Таблица 3. Антикоагулянты и их антидоты.
Table 3. Anticoagulants and their antidotes.
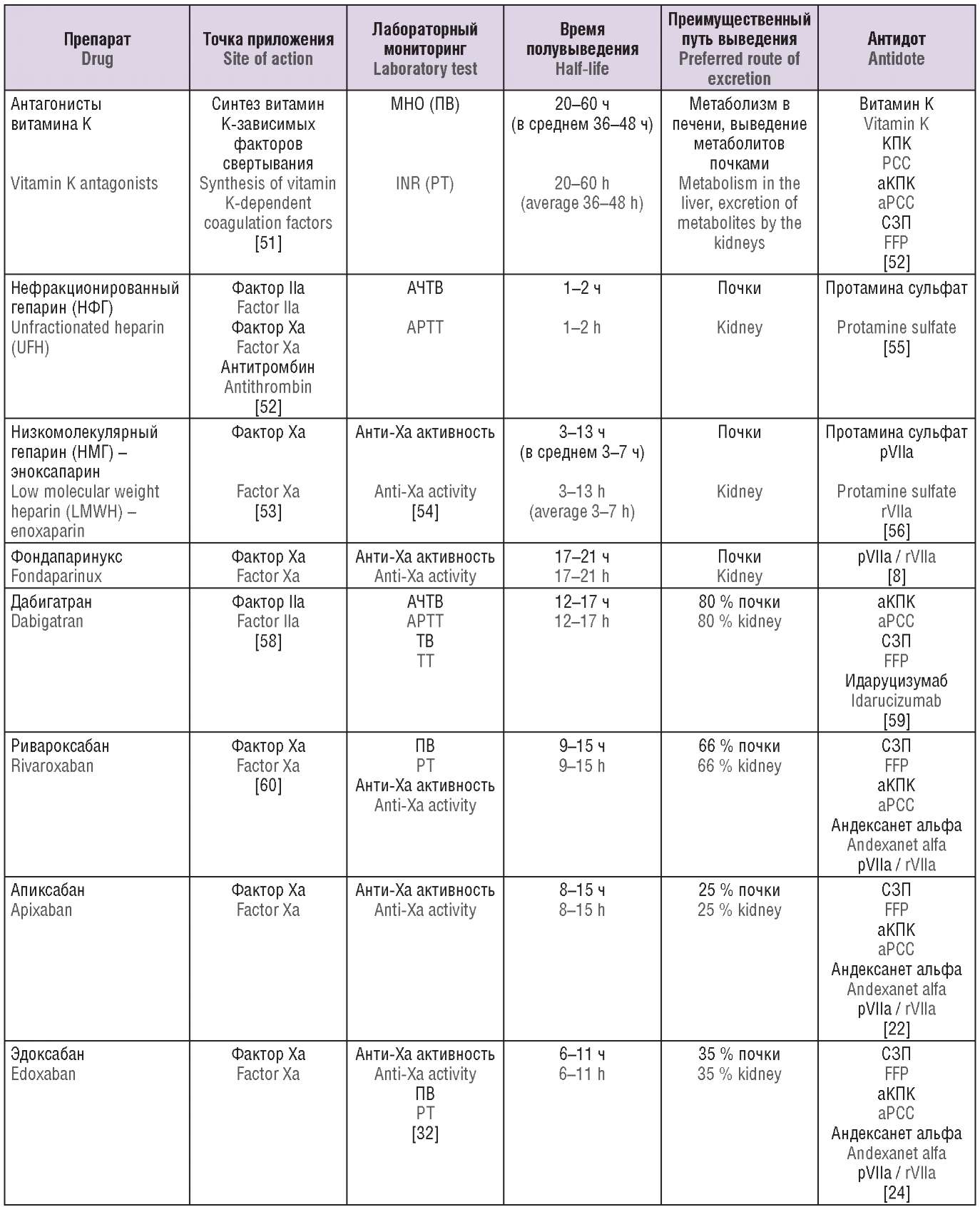
Примечание: МНО – международное нормализованное отношение; АЧТВ – активированное частичное тромбопластиновое время; ПВ – протромбиновое время; ТВ – тромбиновое время, КПК – концентрат протромбинового комплекса; аКПК – активированный концентрат протромбинового комплекса; СЗП – свежезамороженная плазма; рVIIa – рекомбинантный фактор VIIа.
Note: INR – international normalized ratio; APTT – activated partial thromboplastin time; PT – prothrombin time; TT – thrombin time; PCC – prothrombin complex concentrate; aPCC – activated prothrombin complex concentrate; FFP – fresh frozen plasma; rVIIa – recombinant factor VIIa.
Способы коррекции геморрагических осложнений на фоне использования антагонистов витамина К / Methods for correcting hemorrhagic complications upon using vitamin K antagonists
Витамин К / Vitamin K
Витамин К – безопасный, эффективный, надежный и недорогой антидот варфарина. Витамин К может быть использован как перорально, так и внутривенно [61]. Для пациентов без кровотечения с МНО > 4 пероральный прием витамина К в дозе от 1 до 2,5 мг снижает МНО в течение 24 ч [62]. Пероральный прием витамина К возможен и у пациентов с МНО = 5–8, несмотря на высокий риск кровотечения. При развитии кровотечения на фоне приема варфарина прием 2,5 мг витамина К приводит к норме показатель МНО у большинства пациентов. Лишь некоторым пациентам приходится повышать дозу до 10 мг при очень высоких уровнях МНО или сопутствующих нарушениях функции печени (табл. 4).
Таблица 4. Рекомендации по использованию и дозированию витамина К при различных значениях международного нормализованного отношения (МНО) [49][52].
Table 4. Recommendations on usage and dosage of vitamin K for under varying international normalized ratio (INR) [49][52].

Несмотря на то что и пероральная и внутривенная формы витамина К одинаково эффективны для коррекции МНО за 24 ч, внутривенная форма способна сделать это за срок от 6 до 8 ч [63]. В связи с этим в некоторых рекомендациях присутствует внутривенный путь с использованием от 5 до 10 мг препаратов витамина К в виде медленной инфузии (более 30 мин) при массивных кровотечениях на фоне варфарина в сочетании с концентратом протромбинового комплекса (КПК) [64]. Эффективность комбинированного использования достигается тем, что введение КПК обеспечивает временную коррекцию МНО в связи с коротким временем полужизни витамин К-зависимых факторов свертывания, особенно FVII (6 ч). Прием витамина K далее обеспечивает продолжительную коррекцию МНО путем восстановления печеночного синтеза этих факторов свертывания. Обратной стороной использования таких высоких доз витамина К является развитие преходящей АВК-резистентности с последующими трудностями в достижении терапевтических значений МНО.
Свежезамороженная плазма, концентрат протромбинового комплекса / Fresh frozen plasma, prothrombin complex concentrate
Быстрая коррекция гемостаза на фоне кровотечения при использовании варфарина может быть достигнута путем введения функционально активных факторов свертывания крови. Свежезамороженная плазма (СЗП) – это доступное средство, содержащее витамин К-зависимые факторы свертывания. Она используется в больших объемах (> 1500 мл) для достижения значимого увеличения концентрации факторов свертывания в случае продолжающегося кровотечения на фоне отмены варфарина. Проблематичным является быстрое введение больших обьемов у пожилых пациентов. Опасность представляет также и возможность передачи ряда инфекций с донорской плазмой. В отличие от СЗП, КПК содержит факторы II, IX, X и VII примерно в 25 раз более высокой концентрации, чем СЗП, что значительно снижает общий объем инфузии, минимизирует риск перегрузки кровообращения, связанный с переливанием крови, сопутствующим повреждением легких [65]. Существует 2 типа продуктов КПК. Трехфакторный КПК содержит меньшее количество FVII. Исследования показали, что трехфакторный КПК не способен достаточно снижать МНО в связи с более низкой концентрацией FVII. Дополнительное использование СЗП вместе с трехфакторным КПК обеспечивает большее снижение МНО [66]. Эффективность четырехфакторного КПК с большей концентрацией FVII значительно выше, однако следует учитывать возможные тромботические осложнения от использования препарата [67].
Рекомбинантный фактор VIIa / Recombinant factor VIIa
Изучению использования рекомбинантного фактора VIIa (рVIIa) при кровотечениях на фоне приема варфарина посвящено небольшое количество исследований. Одно из них ( ретроспективное) показало, что рVIIa быстро нормализовал МНО, не влияя на показатели смертности [68]. По данным того же исследования, частота ТЭО была выше по сравнению со стандартной терапией. Другое ретроспективное исследование выявило преимущество рVIIa в коррекции МНО по сравнению с КПК при внутричерепных кровоизлияниях на фоне варфарина [69]. В метаанализе было показано, что использование больших доз рVIIa значительно увеличивает риск артериальных, но не венозных ТЭО, особенно у пожилых пациентов [70]. Учитывая ограниченные и разноречивые данные и потенциальный риск, вопрос об использовании рVIIa в терапии кровотечений на фоне использования варфарина остается открытым.
Активированный концентрат протромбинового комплекса / Activated prothrombin complex concentrate
Ретроспективные исследования, посвященные изучению использования активированного КПК в борьбе с геморрагическими осложнениями на фоне использования варфарина, показали, что этот метод эффективнее по сравнению с СЗП снижает МНО без значительных различий в выживаемости [71]. Однако на фоне использования данной группы препаратов также отмечался повышенный риск ТЭО.
Способы коррекции геморрагических осложнений на фоне использования гепаринов / Methods for correcting hemorrhagic complications during heparins’ therapy
Протамина сульфат / Protamine sulfate
Сульфат протамина – это положительно заряженный щелочной белок, производный спермы рыб. Полностью отменяет антикоагулянтный эффект за счет образования комплекса с кислым и отрицательно заряженным гепарином [72]. Сульфат протамина широко применяется при геморрагических осложнениях на фоне использования НФГ уже почти 30 лет. Протамина сульфат полностью подавляет действие НФГ в дозе 1 мг/100 ЕД гепарина, при этом он нейтрализует НМГ или другие гепариноиды, такие как данапароид, лищь частично, так как влияет только на подавление FIIa (тромбина). Протамина сульфат имеет очень короткое время полувыведения (около 7 мин), поэтому для полной отмены НФГ могут потребоваться повторные введения, при этом максимальная доза составляет 50 мг [3]. Для мониторинга эффективности возможно использование АЧТВ [3]. Сульфат протамина лишь частично влияет на анти-Ха активность при использовании НМГ (60–80%) [73]. Таким образом, даже при полной нормализации АЧТВ после введения протамина необходимо измерение анти-Ха активности [73].
На фоне использования протамина сульфата в сердечно-сосудистой хирургии отмечается повышенный риск анафилаксии (примерно 1%), вторичной по отношению к высвобождению гистамина [74]. На фоне его применения также описано развитие тромбоцитопении [75]. Было показано, что использование протамина сульфата может приводить к появлению антител к протамину и гепарину, которые активируют тромбоциты, с чем и связаны эпизоды тромбоцитопении и повышенный риск тромбоэмболии в кардиохирургии [76].
Протамина сульфат вызывает реакции гиперчувствительности, в том числе анафилаксию у пациентов с аллергией на рыбу, с предыдущими воздействиями протамина или протаминсодержащих препаратов, таких как инсулин [72]. Пациентам с известной аллергией на сульфат протамина необходимо предварительно провести терапию стероидами и антигистаминными препаратами [77].
Рекомбинантный фактор VIIa / Recombinant factor VIIa
Большое количество исследований демонстрируют, что рVIIa эффективен при коррекции геморрагических осложнений на фоне НМГ [78][79], фондапаринукса [80] или идрапаринукса [81]. Доза, при которой был достигнут положительный клинический эффект в этих испытаниях, составила 90 мкг/кг. Рекомбинантный фактор VIIa также эффективен при передозировке НМГ у пациентов с предсуществующей гиперкоагуляцией и/или острой ВТЭ [82].
Способы коррекции геморрагических осложнений на фоне использования пентасахаридов / Methods for correcting hemorrhagic complications during pentasaccharides use
Фондапаринукс в настоящее время является единственным антикоагулянтом на основе пентасахаридов, он используется для лечения и профилактики ВТЭ, связывается с антитромбином и ингибирует только FХа [79][83]. Протамин неэффективен в отношении антикоагулянтных эффектов фондапаринукса. Пентасахариды не имеют специфических антидотов. Гемодиализ способен снизить концентрацию в плазме фондапаринукса примерно на 20%. Рекомбинантный VIIa продемонстрировал эффективность у здоровых добровольцев и в исследованиях in vitro [84][85]. Однако ТЭО остаются проблемой для использования рVIIa примерно у 7% пациентов.
Способы коррекции геморрагических осложнений на фоне использования новых оральных антикоагулянтов / Methods for correcting hemorrhagic complications after using new oral anticoagulants
Управление системой гемостаза в условиях приема НОАК должно быть персинифицировано с точки зрения тяжести кровотечения, а также показаний к проведению антикоагуляции, характеристик пациента, таких как возраст, сопутствующие заболевания, времени с момента приема последней дозы, дозы препарата и локализации кровотечения. У пациентов с кровотечением на фоне использования НОАК следует придерживаться стандартной схемы терапии и обследования, включающей адекватную инфузионную терапию и оксигенацию, лабораторную оценку системы гемостаза и общеклинических показателей, таких как общий анализ крови и креатинин. АЧТВ имеет линейную зависимость от концентрации дабигатрана. Нормальные показатели АЧТВ исключают использование НОАК как причину развившегося кровотечения. Нормальный показатель ПВ исключает ривароксабан как причину геморрагии [86].
Простого прекращения приема НОАК может быть достаточно при небольшом кровотечении у пациентов с нормальной функцией почек с учетом короткого времени полувыведения препаратов. Необходимо прекратить сочетанный прием антиагрегантов и антикоагулянтов, по показаниям начать введение специфических или неспецифических кровоостанавливающих средств. По показаниям необходимо использовать и другие гемостатические мероприятия, такие как механическая компрессия, хирургический гемостаз и т. д. Возможно также использовать антифибринолитические препараты при развитии геморрагических осложнений на фоне использования НОАК.
Способы коррекции геморрагических осложнений на фоне использования прямых ингибиторов тромбина / Methods for correction of hemorrhagic complications due to direct thrombin inhibitors
Активированный уголь для перорального применения / Activated oral charcoal
Активированный уголь при пероральном приеме эффективно абсорбирует до 99,9% дабигатрана [87]. Использовать его следует в растворенном виде в подкисленной воде в течение 1–2 ч после приема препарата.
Гемодиализ / Hemodialysis
В связи с тем, что дабигатран неактивно связан с белками плазмы крови (35%), он потенциально может быть удален из циркуляции путем гемодиализа при угрожающем жизни кровотечении, интоксикации или необходимости экстренного оперативного лечения [88]. Было показано, что до 59,3% дабигатрана выводится за 4 ч гемодиализа [89]. Однако необходимость создания центрального венозного доступа катетерами большого диаметра у пациентов на фоне антикоагулянтной терапии является дополнительным фактором риска и ограничением данной стратегии.
Концентрат протромбинового комплекса и активированный концентрат протромбинового комплекса / Prothrombin complex concentrate and activated prothrombin complex concentrate
В нескольких исследованиях доказана эффективность КПК при геморрагических осложнениях на фоне дабигатрана у мышей, крыс и кроликов [90]. В исследованиях с участием здоровых добровольцев мужского пола не было получено достоверных данных об эффективности КПК на фоне осложнений приема дабигатрана [91]. Следовательно, в настоящее время нет доказательств эффективности использования КПК при кровотечениях на фоне приема дабигатрана. При этом перспективным видится использование активированного КПК [92], о чем свидетельствуют в частности исследования при желудочно-кишечных кровотечениях, внутричерепных кровоизлияниях на фоне приема дабигатрана [93][94]. Важным объектом для дальнейших исследований является повышенный риск тромботических осложнений на фоне использования активированного КПК.
Активированный рекомбинантный фактор VIIa / Activated recombinant factor VIIa
На мышиных моделях продемонстрирована эффективность рVIIa с частичной нормализацией АЧТВ на фоне приема дабигатрана [95]. Однако другие исследования на животных моделях [90], а также исследования рVIIa ex vivo не подтвердили нейтрализующего дабигатран эффекта [92].
Идаруцизумаб / Idarucizumab
Идаруцизумаб – антидот дабигатрана представляет собой фрагмент моноклонального Fab-антитела, который связывается с дабигатраном и меняет его антикоагулянтные свойства [96]. Антидот следует вводить в виде болюсной дозы 5 г внутривенно, он одобрен к использованию при массивных кровотечениях, а также при необходимости проведения экстренного оперативного лечения с целью предотвращения массивной интраоперационной кровопотери.
Способы коррекции геморрагических осложнений на фоне использования ингибиторов фактора Xa / Methods for correcting hemorrhagic complications during therapy with factor Xa inhibitors
Стратегия относительно прямых ингибиторов FХа аналогична дабигатрану, кроме того факта, что прямые ингибиторы FХа хорошо связываются с белками плазмы и плохо удаляются из кровообращения при гемодиализе.
Активированный уголь для перорального применения / Activated oral charcoal
Достоверных данных об эффективности использования активированного угля в качестве антидота ривароксабана на данный момент нет. Показано, что эффект апиксабана может быть прерван путем перорального приема активированного угля у собак даже через 3 ч после приема внутрь [97].
Концентрат протромбинового комплекса / Prothrombin complex concentrate
Исследования, проведенные на животных, продемонстрировали эффективность КПК при геморрагических осложнениях на фоне приема ривароксабана и апиксабана [98]. Исследования in vitro с использованием плазмы человека продемонстрировали эффективность КПК в отношении нормализации лабораторных показателей [91][99]. Два проспективных когортных исследования оценивали эффективность и безопасность КПК для лечения массивных кровотечений у пациентов, принимающих апиксабан или ривароксабан [100][101]. В шведском исследовании эффективность препарата составила 69% [100]. Большинство пациентов в исследуемой группе имели внутричерепные кровоизлияния (61,5%), два пациента перенесли ишемический инсульт в течение 30 дней после использования препарата. В канадском исследовании эффективность составила 68%, 8% пациентов имели эпизод тромбоэмболии и 14% умерли в течение 30 дней после использования данного метода [101].
Активированный концентрат протромбинового комплекса и активированный рекомбинантный фактор VIIa / Activated prothrombin complex concentrate and activated recombinant factor VIIa
Активированный КПК и активированный рVIIa продемонстрировали свою эффективность при использовании эдоксабана и ривароксабана на животных моделях [91][102].
Универсальные антидоты новых оральных антикоагулянтов / Universal antidotes of new oral anticoagulants
Андексанет альфа / Andexanet alfa
Новый рекомбинантный протеин андексанет альфа (PRT064445или PRT4445) структурно меняет FХа, делая его гемостатически неактивным [103][104]. Андексанет альфа – это неактивная форма FХа, который действует как «приманка», связываясь и подавляя работу ингибиторов FХа, а также фондапаринукса и НМГ [105]. Эффективность препарата изучена и подтверждена только у пациентов с массивным кровотечением, не нуждающихся в экстренной хирургии.
PER977 – еще одна небольшая синтетическая молекула, которая рассматривается как потенциальный антидот для нескольких НОАК, включая дабигатран, ривароксабан, апиксабан и эдоксабан [106]. На животных моделях, а также на моделях плазмы человека ex vivo обработанный препарат продемонстрировал свою эффективность.
Тактика ведения пациентов при геморрагических осложнениях / Management of patients with hemorrhagic complications
Основные принципы борьбы с кровотечением / Fundamentals of bleeding control
При возникновении геморагических осложнений на фоне проведения антикоагулянтной терапии в первую очередь следует собрать подробный анамнез как от самого пациента, так и от его родственников. Какой антикоагулянт получает пациент? Когда была использована последняя доза? Принимает ли пациент также АСК или другие препараты, подавляющие функцию тромбоцитов? Есть ли у пациента заболевания почек?
Основные подходы к терапии геморрагических осложнений, связанных с использованием антикоагулянтов, аналогичны основным принципам ведения геморрагических осложнений другой этиологии (рис. 2). В первую очередь, это действия, направленные на остановку или уменьшение кровотечения, включая местный гемостаз (компрессия при артериальном кровотечении, тампонада носовой полости, введение зонда Блэкмора при кровотечении из варикозно расширенных вен пищевода при недоступности срочной эндоскопии) и коррекция последствий кровопотери (оксигенотерапия, внутривенная инфузионная терапия, другие виды поддержки гемодинамики, гемотрансфузия). Транексамовую кислоту следует использовать при кровотечениях, связанных с травмой [107]. При этом транексамовая кислота противопоказана при гематурии в связи с риском тромбообразования в просвете мочеточника и гидронефрозом. Прием любого антикоагулянта, антиагреганта или нестероидного противовоспалительного средства должен быть прекращен. Активированный уголь снижает эффект всех НОАК, а следовательно, может использоваться в течение нескольких часов в случае кровотечения на фоне передозировки или случайного приема этих средств.

Рисунок 2. Стратегия борьбы с геморрагическими осложнениями на фоне противотромботической терапии [рисунок авторов].
Примечание: НФГ – нефракционированный гепарин; НМГ – низкомолекулярные гепарины; НПВС – нестероидные противовоспалительные средства; МНО – международное нормализованное отношение; АЧТВ – активированное частичное тромбопластиновое время; анти-Ха – анти-Xa активность; ПВ – протромбиновое время; ТВ – тромбиновое время; вит. К – витамин К; КПК – концентрат протромбинового комплекса; аКПК – активированный концентрат протромбинового комплекса; СЗП – свежезамороженная плазма; ПС – протамина сульфат; рVIIa – активированный рекомбинантный фактор VIIа.
Figure 2. Strategy for managing hemorrhagic complications during antithrombotic therapy [drawn by authors].
Note: НФГ – unfractionated heparin; НМГ – low molecular weight heparins; НПВС – non-steroidal anti-inflammatory drugs; МНО – international normalized ratio; АЧТВ – activated partial thromboplastin time; анти-Ха – anti-Xa activity; ПВ – prothrombin time; ТВ – thrombin time; вит. К – vitamin K; КПК – prothrombin complex concentrate; аКПК – activated prothrombin complex concentrate; СЗП – fresh frozen plasma; ПС – protamine sulfate; рVIIa – activated recombinant factor VIIa.
Для подбора оптимальной терапии на следующем этапе необходима комплексная оценка системы гемостаза.
Внутричерепные кровоизлияния / Intracranial hemorrhage
Эвакуация субдуральной или внутримозговой гематомы должна проводиться только после окончания антикоагулянтного эффекта препарата на фоне его полной отмены [108]. Прерывистая пневматическая компрессия должна параллельно использоваться для предотвращения ВТЭ [108]. У стабильных пациентов профилактическое использование НМГ и гепарина возможно через 2–4 дня после эпизода кровотечения [109]. Решение о возобновлении полноценной антикоагуляции должно приниматься на основе оценки риска ТЭО и риска повторного внутричерепного кровоизлияния. Оптимальные сроки для возобновления антикоагулянтной терапии, которые были изучены только с АВК, составляют 8 нед [110]; они короче при посттравматическом внутримозговом кровоизлиянии [111], но дольше при субдуральной гематоме (которая имеет более высокий риск рецидива) или амилоидной ангиопатии. Для пациентов с варфарин-ассоциированным внутричерепным кровоизлиянием возможен переход на НОАК в связи с их более низкими рисками развития внутричерепных кровоизлияний. Для пациентов с внутричерепными гематомами на фоне использования НОАК следует рассмотреть возможность возобновления приема уменьшенной дозы. Во всех случаях принятию решения должна предшествовать комплексная лабораторная оценка системы гемостаза, в том числе и с оценкой концентрации D-димера в плазме крови.
Желудочно-кишечные кровотечения / Gastrointestinal bleeding
Желудочно-кишечный тракт – наиболее частый источник массивных кровотечений на фоне приема антикоагулянтов, при этом желудочно-кишечные кровотечения могут быть маркерами опухолевого процесса. В связи с этим на первом месте при развившемся желудочно-кишечном кровотечении стоит эндоскопическое исследование как для выявления источника кровотечения, так и для его остановки. Последнее может быть достигнуто путем местного введения адреналина, коагуляции, абляции, наложения гемоклипсы при очень глубоких язвах с видимым кровеносным сосудом, аргоноплазменной коагуляции в случае ангиодисплазии или эктазии сосудов антрального отдела желудка, склеротерапии и перевязки при варикозном расширении вен пищевода [112]. При кровотечении из язвы желудка показано внутривенное введение ингибитора протонной помпы. Использование нестероидных противовоспалительных средств следует исключить. Оптимальным временем для возобновления антикоагуляции является 3–6 нед после эпизода кровотечения из верхних отделов желудочно-кишечного тракта после детальной лабораторной оценки системы гемостаза, в том числе и с оценкой концентрации D-димера [113]. Досрочное возобновление антикоагулянтной терапии может быть рассмотрено в случае, если риск тромбоэмболии высок.
При всех геморрагических осложнениях на фоне антикоагулянтной терапии необходим мультидисциплинарный подход с привлечением как профильного специалиста, так и специалиста по гемостазу, невролога и/или кардиолога для оптимизации гемостатического лечения и сроков начала профилактики тромбоэмболии.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Сложность и многогранность антитромботической терапии растет с появлением все новых и новых препаратов. Кровотечение – грозное осложнение от использования всех антикоагулянтов. Антидоты – ценное дополнение к арсеналу средств, используемых в терапии геморрагических осложнений антикоагулянтов, однако их важность не следует переоценивать. Их эффективность и безопасность не подтверждена рандомизированными контролируемыми исследованиями. Все это говорит о том, что знания факторов риска развития геморрагических осложнений на фоне приема различных антикоагулянтов, показаний к их использованию, особенностей мониторинга их эффективности и безопасности, возможностей полной отмены их действия в случае необходимости крайне важны для практикующих врачей различных специальностей.
Клинические испытания проходят новые антикоагулянты, направленные против факторов свертывания XI и XII. Среди препаратов, в настоящее время разрабатываемых для купирования эффектов НОАК, рассматривают антитела, антисмысловые олигонуклеотиды, аптамеры, антагонисты полианионов. Основной целью разработки новых антикоагулянтов является сохранение тромбопрофилактического эффекта при низком риске кровотечений.
Список литературы
1. Lopes L., Spencer F.A., Neumann I. et al. Bleeding risk in atrial fibrillation patients taking vitamin K antagonists: systematic review and metaanalysis. Clin Pharmacol Ther. 2013;94(3):367–75. https://doi.org/10.1038/clpt.2013.99.
2. Chai-Adisaksopha C., Crowther M., Isayama T., Lim W. The impact of bleeding complications in patients receiving target-specific oral anticoagulants: a systematic review and meta-analysis. Blood. 2014;124(15):2450–8. https://doi.org/10.1182/blood-2014-07-590323.
3. Garcia D.A., Baglin T.P., Weitz J.I., Samama M.M. Parenteral anticoagulants: antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest. 2012;141(2 Suppl):e24S–e43S. https://doi.org/10.1378/chest.11-2291.
4. Buller H.R., Davidson B.L., Decousus H. et al. Fondaparinux or enoxaparin for the initial treatment of symptomatic deep venous thrombosis: a randomized trial. Ann Intern Med. 2004;140(11):867–73. https://doi.org/10.7326/0003-4819-140-11-200406010-00007.
5. Beyer-Westendorf J., Michalski F., Tittl L. et al. Management and outcomes of vaginal bleeding and heavy menstrual bleeding in women of reproductive age on direct oral anti-factor Xa inhibitor therapy: a case series. Lancet Haematol. 2016;3(10):e480–e488. https://doi.org/10.1016/S2352-3026(16)30111-9.
6. Gong I.Y., Schwarz U.I., Crown N. et al. Clinical and genetic determinants of warfarin pharmacokinetics and pharmacodynamics during treatment initiation. PloS One. 2011;6(11):e27808. https://doi.org/10.1371/journal.pone.0027808.
7. Pirmohamed M., Burnside G., Eriksson N. et al. A randomized trial of genotype-guided dosing of warfarin. N Engl J Med. 2013;369(24):2294– 303. https://doi.org/10.1056/NEJMoa1311386.
8. Hirsh J., Anand S.S., Halperin J.L., Fuster V. Guide to anticoagulant therapy: Heparin: a statement for healthcare professionals from the American Heart Association. Circulation. 2001;103(24):2994–3018. https://doi.org/10.1161/01.cir.103.24.2994.
9. Olsson S.B., Executive Steering Committee of the SPORTIF III Investigators. Stroke prevention with the oral direct thrombin inhibitor ximelagatran compared with warfarin in patients with non-valvular atrial fibrillation (SPORTIF III): randomised controlled trial. Lancet. 2003;362(9397):1691–8. https://doi.org/10.1016/s0140-6736(03)14841-6.
10. Stangier J., Rathgen K., Stahle H. et al. The pharmacokinetics, pharmacodynamics and tolerability of dabigatran etexilate, a new oral direct thrombin inhibitor, in healthy male subjects. Br J Clin Pharmacol. 2007;64(3):292–303. https://doi.org/10.1111/j.1365-2125.2007.02899.x.
11. Eriksson B.I., Dahl O.E., Huo M.H. et al. Oral dabigatran versus enoxaparin for thromboprophylaxis after primary total hip arthroplasty (RE-NOVATE II). Thromb Haemost. 2011;105(4):721–9. https://doi.org/10.1160/TH10-10-0679.
12. Eriksson B., Dahl O., Rosencher N. et al. Oral dabigatran etexilate vs. subcutaneous enoxaparin for the prevention of venous thromboembolism after total knee replacement: the RE-MODEL randomized trial. J Thromb Haemost. 2007;5(11):2178–85. https://doi.org/10.1111/j.1538-7836.2007.02748.x.
13. Schulman S., Kearon C., Kakkar A.K. et al. Dabigatran versus warfarin in the treatment of acute venous thromboembolism. N Engl J Med. 2009;361(24):2342–52. https://doi.org/10.1056/NEJMoa0906598.
14. Schulman S., Kearon C., Kakkar A.K. et al. Extended use of dabigatran, warfarin, or placebo in venous thromboembolism. N Engl J Med. 2013;368(8):709–18. https://doi.org/10.1056/NEJMoa1113697.
15. Connolly S.J., Ezekowitz M.D., Yusuf S. et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med. 2009;361(12):1139–51. https://doi.org/10.1056/NEJMoa0905561.
16. Samama M.M. The mechanism of action of rivaroxaban – an oral, direct Factor Xa inhibitor – compared with other anticoagulants. Thromb Res. 2011;127(6):497–504. https://doi.org/10.1016/j.thromres.2010.09.008.
17. Kakkar A.K., Brenner B., Dahl O.E. et al. Extended duration rivaroxaban versus short-term enoxaparin for the prevention of venous thromboembolism after total hip arthroplasty: a double-blind, randomised controlled trial. Lancet. 2008;372(9632):31–9. https://doi.org/10.1016/S0140-6736(08)60880-6.
18. Patel M.R., Mahaffey K.W., Garg J. et al. Rivaroxaban versus warfarin in nonvalvular Atrial fibrillation. N Engl J Med. 2011;365(10):883–91. https://doi.org/10.1056/NEJMoa1009638.
19. Lassen M.R., Raskob G.E., Gallus A. et al. Apixaban versus enoxaparin for thromboprophylaxis after knee replacement (ADVANCE-2): a randomised double-blind trial. Lancet. 2010;375(9717):807–15. https://doi.org/10.1016/S0140-6736(09)62125-5..
20. Lassen M.R., Gallus A., Raskob G.E. et al. Apixaban versus enoxaparin for thromboprophylaxis after hip replacement. N Engl J Med. 2010;363(26):2487–98. https://doi.org/10.1056/NEJMoa1006885.
21. Granger C.B., Alexander J.H., McMurray J.J. et al. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med. 2011;365(11):981–92. https://doi.org/10.1056/NEJMoa1107039.
22. Agnelli G., Buller H.R., Cohen A. et al. Oral apixaban for the treatment of acute venous thromboembolism. N Engl J Med. 2013;369(9):799–808. https://doi.org/10.1056/NEJMoa1302507.
23. Hokusai-VTE Investigators; Buller H.R., Decousus H., Grosso M.A. et al. Edoxaban versus warfarin for the treatment of symptomatic venous thromboembolism. N Engl J Med. 2013;369(15):1406–15. https://doi.org/10.1056/NEJMoa1306638.
24. Giugliano R.P., Ruff C.T., Braunwald E. et al. Edoxaban versus warfarin in patients with atrial fibrillation. N Engl J Med. 2013;369(22):2093–104. https://doi.org/10.1056/NEJMoa1310907.
25. Weitz J.I., Chan N.C. Advances in antithrombotic therapy. Arterioscler Thromb Vasc Biol. 2019;39(1):7–12. https://doi.org/10.1161/ ATVBAHA.118.310960.
26. Pirlog A.-M., Pirlog C.D., Maghiar M.A. DOACs vs vitamin K antagonists: a comparison of phase III clinical trials and a prescriber support tool. Open Access Maced J Med Sci. 2019;7(7):1226–32. https://doi.org/10.3889/oamjms.2019.289.
27. Hellenbart E.L., Faulkenberg K.D., Finks S.W. Evaluation of bleeding in patients receiving direct oral anticoagulants. Vasc Health Risk Manag. 2017;13:325–42. https://doi.org/10.2147/VHRM.S121661.
28. Wheeler A.P., Gailani D. Why factor XI deficiency is a clinical concern. Expert Rev Hematol. 2016;9(7):629–37. https://doi.org/10.1080/17474086.2016.1191944.
29. Gomez K., Bolton-Maggs P. Factor XI deficiency. Haemophilia. 2008;14(6):1183–9. https://doi.org/10.1111/j.1365-2516.2008.01667.x.
30. Preis M., Hirsch J., Kotler A. et al. Factor XI deficiency is associated with lower risk for cardiovascular and venous thromboembolism events. Blood. 2017;129(9):1210–5. https://doi.org/10.1182/blood-2016-09742262.
31. Georgi B., Mielke J., Chaffin M. et al. Leveraging human genetics to estimate clinical risk reductions achievable by inhibiting factor XI. Stroke. 2019;50(11):3004–12. https://doi.org/10.1161/STROKEAHA.119.026545.
32. Mavromanoli A.C., Barco S., Konstantinides S.V. Antithrombotics and new interventions for venous thromboembolism: Exploring possibilities beyond factor IIa and factor Xa inhibition. Res Pract Thromb Haemost. 2021;5(4):10.1002/rth2.12509. https://doi.org/10.1002/rth2.12509.
33. Yau J.W., Liao P., Fredenburgh J.C. et al. Selective depletion of factor XI or factor XII with antisense oligonucleotides attenuates catheter thrombosis in rabbits. Blood. 2014;123(13):2102–7. https://doi.org/10.1182/blood-2013-12-540872.
34. Crosby J.R., Marzec U., Revenko A.S. et al. Antithrombotic effect of antisense factor XI oligonucleotide treatment in primates. Arterioscler Thromb Vasc Biol. 2013;33(7):1670–8. https://doi.org/10.1161/ATVBAHA.113.301282.
35. Buller H.R., Bethune C., Bhanot S. et al. Factor XI antisense oligonucleotide for prevention of venous thrombosis. N Engl J Med. 2015;372(3):232–40. https://doi.org/10.1056/NEJMoa1405760.
36. Eikelboom J., Floege J., Thadhani R. et al. Anticoagulation in patients with kidney failure on dialysis: factor XI as a therapeutic target. Kidney Int. 2021;100(6):1199–207. https://doi.org/10.1016/j.kint.2021.08.028.
37. Verhamme P., Yi B.A., Segers A. et al. Abelacimab for prevention of venous thromboembolism. N Engl J Med. 2021;385(7):609–17. https://doi.org/10.1056/NEJMoa2105872.
38. Weitz J.I., Bauersachs R., Becker B. et al. Effect of osocimab in preventing venous thromboembolism among patients undergoing knee arthroplasty: the FOXTROT randomized clinical trial. JAMA. 2020;323(2):130–9. https://doi.org/10.1001/jama.2019.20687.
39. Eikelboom J.W., Connolly S.J., Brueckmann M. et al. Dabigatran versus warfarin in patients with mechanical heart valves. N Engl J Med. 2013;369(13):1206–14. https://doi.org/10.1056/NEJMoa1300615.
40. Jaffer I.H., Stafford A.R., Fredenburgh J.C. et al. Dabigatran is less effective than warfarin at attenuating mechanical heart valve-induced thrombin generation. J Am Heart Assoc. 2015;4(8):e002322. https://doi.org/10.1161/JAHA.115.002322.
41. Bethune C., Walsh M., Jung B. et al. Pharmacokinetics and pharmacodynamics of Ionis-FXIRx, an antisense inhibitor of factor XI, in patients with end-stage renal disease on hemodialysis. Blood. 2017;130(Suppl 1):1116. https://doi.org/10.1182/BLOOD.V130.SUPPL_1.1116.1116.
42. Kearon C., Akl E.A., Ornelas J. et al. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016;149(2):315–52. https://doi.org/10.1016/j.chest.2015.11.026.
43. Tripodi A. D-dimer testing in laboratory practice. Clin Chem. 2011;57(9):1256–62. https://doi.org/10.1373/clinchem.2011.166249.
44. Palareti G., Cosmi B., Legnani C. et al. D-dimer testing to determine the duration of anticoagulation therapy. N Engl J Med. 2006;355(17):1780–9. https://doi.org/10.1056/NEJMoa054444.
45. Douketis J., Tosetto A., Marcucci M. et al. Patient-level meta-analysis: effect of measurement timing, threshold, and patient age on ability of D-dimer testing to assess recurrence risk after unprovoked venous thromboembolism. Ann Intern Med. 2010;153(8):523–31. https://doi.org/10.7326/0003-4819-153-8-201010190-00009.
46. Palareti G., Cosmi B., Legnani C. et al. D-dimer to guide the duration of anticoagulation in patients with venous thromboembolism: a management study. Blood. 2014;124(2):196–203. https://doi.org/10.1182/blood-2014-01-548065.
47. Rodger M.A., Kahn S.R., Wells P.S. et al. Identifying unprovoked thromboembolism patients at low risk for recurrence who can discontinue anticoagulant therapy. CMAJ. 2008;179(5):417–26. https://doi.org/10.1503/cmaj.080493.
48. Douxfils J., Gosselin R.C. Laboratory assessment of direct oral anticoagulants. Semin Thromb Hemost. 2017;43(3):277–90. https://doi.org/10.1055/s-0036-1597296.
49. Schulman S., Kearon C., Subcommittee on Control of Anticoagulation of the Scientific and Standardization Committee of the International Society on Thrombosis and Haemostasis. Definition of major bleeding in clinical investigations of antihemostatic medicinal products in non-surgical patients. J Thromb Haemost. 2005;3(4):692–4. https://doi.org/10.1111/j.1538-7836.2005.01204.x.
50. Kaatz S., Ahmad D., Spyropoulos A., Schulman S., Subcommittee on Control of Anticoagulation. Definition of clinically relevant non-major bleeding in studies of anticoagulants in atrial fibrillation and venous thromboembolic disease in non-surgical patients: communication from the SSC of the ISTH. J Thromb Haemost. 2015;13(11):2119–26. https://doi.org/10.1111/jth.13140.
51. Douketis J.D., Arneklev K., Goldhaber S.Z. et al. Comparison of bleeding in patients with nonvalvular atrial fibrillation treated with ximelagatran or warfarin: assessment of incidence, case-fatality rate, time course and sites of bleeding, and risk factors for bleeding. Arch Intern Med. 2006;166(8):853–9. https://doi.org/10.1001/archinte.166.8.853.
52. Schulman S., Beyth R.J., Kearon C., Levine M.N. Hemorrhagic complications of anticoagulant and thrombolytic treatment: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest. 2008;133(6):257S–298S. https://doi.org/10.1378/chest.08-0674.
53. Crowther M., Lim W. Low molecular weight heparin and bleeding in patients with chronic renal failure. Curr Opin Pulm Med. 2007;13(5):409– 13. https://doi.org/10.1097/MCP.0b013e328216430d.
54. Fifth Organization to Assess Strategies in Acute Ischemic Syndromes Investigators; Yusuf S., Mehta S.R., Chrolavicius S. et al. Comparison of fondaparinux and enoxaparin in acute coronary syndromes. N Engl J Med. 2006;354(14):1464–76. https://doi.org/10.1056/NEJMoa055443.
55. Yusuf S., Mehta S.R., Chrolavicius S. et al. Effects of fondaparinux on mortality and reinfarction in patients with acute ST-segment elevation myocardial infarction: the OASIS-6 randomized trial. JAMA. 2006;295(13):1519–30. https://doi.org/10.1001/jama.295.13.joc60038.
56. Turpie A.G., Bauer K.A., Eriksson B.I., Lassen M.R. Fondaparinux vs enoxaparin for the prevention of venous thromboembolism in major orthopedic surgery: a meta-analysis of 4 randomized double-blind studies. Arch Intern Med. 2002;162(16):1833–40. https://doi.org/10.1001/archinte.162.16.1833.
57. Reilly P.A., Lehr T., Haertter S. et al. The effect of dabigatran plasma concentrations and patient characteristics on the frequency of ischemic stroke and major bleeding in atrial fibrillation patients: the RE-LY Trial (Randomized Evaluation of Long-Term Anticoagulation Therapy). J Am Coll Cardiol. 2014;63(4):321–8. https://doi.org/10.1016/j.jacc.2013.07.104.
58. Connolly S.J., Wallentin L., Ezekowitz M.D. et al. The long-term multicenter observational study of dabigatran treatment in patients with atrial fibrillation (RELY-ABLE) study. Circulation. 2013;128(3):237–43. https://doi.org/10.1161/CIRCULATIONAHA.112.001139.
59. Dans A.L., Connolly S.J., Wallentin L. et al. Concomitant use of antiplatelet therapy with dabigatran or warfarin in the Randomized Evaluation of Long-Term Anticoagulation Therapy (RE-LY) trial. Circulation. 2013;127(5):634–40. https://doi.org/10.1161/CIRCULATIONAHA.112.115386.
60. Halperin J.L., Halperin JL, Wojdyla D. et al. Efficacy and safety of rivaroxaban compared with warfarin among elderly patients with nonvalvular atrial fibrillation in the Rivaroxaban Once Daily, Oral, Direct Factor Xa Inhibition Compared With Vitamin K Antagonism for Prevention of Stroke and Embolism Trial in Atrial Fibrillation (ROCKET AF). Circulation. 2014;130(2):138–46. https://doi.org/10.1161/CIRCULATIONAHA.113.005008.
61. Crowther M.A., Douketis J.D., Schnurr T. et al. Oral vitamin K lowers the international normalized ratio more rapidly than subcutaneous vitamin K in the treatment of warfarin-associated coagulopathy: a randomized, controlled trial. Ann Intern Med. 2002;137(4):251–4. https://doi.org/10.7326/0003-4819-137-4-200208200-00009.
62. DeZee K.J., Shimeall W.T., Douglas K.M. et al. Treatment of excessive anticoagulation with phytonadione (vitamin K): a meta-analysis. Arch Intern Med. 2006;166(4):391–7. https://doi.org/10.1001/.391.
63. Watson H.G., Baglin T., Laidlaw S.L. et al. A comparison of the efficacy and rate of response to oral and intravenous Vitamin K in reversal of over-anticoagulation with warfarin. Br J Haematol. 2001;115(1):145–9. https://doi.org/10.1046/j.1365-2141.2001.03070.x.
64. Holbrook A., Schulman S., Witt D.M. et al. Evidence-based management of anticoagulant therapy: antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians EvidenceBased Clinical Practice Guidelines. Chest. 2012;141(2 Suppl):e152S– e184S. https://doi.org/10.1378/chest.11-2295.
65. Makris M., Greaves M., Phillips W.S. et al. Emergency oral anticoagulant reversal: the relative efficacy of infusions of fresh frozen plasma and clotting factor concentrate on correction of the coagulopathy. Thromb Haemost. 1997;77(3):477–80.
66. Holland .L, Warkentin T.E., Refaai M. et al. Suboptimal effect of a threefactor prothrombin complex concentrate (Profilnine-SD) in correcting supratherapeutic international normalized ratio due to warfarin overdose. Transfusion. 2009;49(6):1171–7. https://doi.org/10.1111/j.1537-2995.2008.02080.x.
67. Dentali F., Marchesi C., Pierfranceschi M.G. et al. Safety of prothrombin complex concentrates for rapid anticoagulation reversal of vitamin K antagonists. A meta-analysis. Thromb Haemost. 2011;106(3):429–38. https://doi.org/10.1160/TH11-01-0052.
68. Nishijima D.K., Dager W.E., Schrot R.J., Holmes J.F. The efficacy of factor VIIa in emergency department patients with warfarin use and traumatic intracranial hemorrhage. Acad Emerg Med. 2010;17(3):244– 51. https://doi.org/10.1111/j.1553-2712.2010.00666.x.
69. Pinner N.A., Hurdle A.C., Oliphant C. et al. Treatment of warfarin-related intracranial hemorrhage: a comparison of prothrombin complex concentrate and recombinant activated factor VII. World Neurosurg. 2010;74(6):631–5. https://doi.org/10.1016/j.wneu.2010.06.030.
70. Levi M., Levy J.H., Andersen H.F., Truloff D. Safety of recombinant activated factor VII in randomized clinical trials. N Engl J Med. 2010;363(19):1791–800. https://doi.org/10.1056/NEJMoa1006221.
71. Wojcik C., Schymik M.L., Cure E.G. Activated prothrombin complex concentrate factor VIII inhibitor bypassing activity (FEIBA) for the reversal of warfarin-induced coagulopathy. Int J Emerg Med. 2009;2(4):217–25. https://doi.org/10.1007/s12245-009-0125-8.
72. Pai M., Crowther M.A. Neutralization of heparin activity. Handb Exp Pharmacol. 2012;(207):265-77. https://doi.org/10.1007/978-3-64223056-1_11.
73. van Veen J.J., Maclean R.M., Hampton K.K. et al. Protamine reversal of low molecular weight heparin: clinically effective? Blood Coagul Fibrinolysis. 2011;22(7):565–70. https://doi.org/10.1097/MBC.0b013e3283494b3c.
74. Nybo M., Madsen J.S. Serious anaphylactic reactions due to protamine sulfate: a systematic literature review. Basic Clin Pharmacol Toxicol. 2008;103(2):192–6. https://doi.org/10.1111/j.1742-7843.2008.00274.x.
75. Horrow J.C. Protamine: a review of its toxicity. Anesth Analg. 1985;64(3):348–61.
76. Bakchoul T., Zollner H., Amiral J. et al. Anti-protamine-heparin antibodies: incidence, clinical relevance, and pathogenesis. Blood. 2013;121(15):2821–7. https://doi.org/10.1182/blood-2012-10-460691.
77. Longstaff C., Hogwood J., Gray E. et al. Neutralization of the anticoagulant effects of heparin by histones in blood plasma and purified systems. Thromb Haemost. 2016;115(3):591–9. https://doi.org/10.1160/TH15-03-0214.
78. Chan S., Kong M., Minning D. et al. Assessment of recombinant factor VIIa as an antidote for bleeding induced in the rabbit by low molecular weight heparin. J Thromb Haemost. 2003;1(4):760–5. https://doi.org/10.1046/j.1538-7836.2003.00101.x.
79. Lauritzen B., Hedner U., Johansen P. et al. Recombinant human factor VIIa and a factor VIIa-analogue reduces heparin and low molecular weight heparin (LMWH)-induced bleeding in rats. J Thromb Haemost. 2008;6(5):804–11. https://doi.org/10.1111/j.1538-7836.2008.02933.x.
80. Bijsterveld N.R., Moons A.H., Boekholdt S.M. et al. Ability of recombinant factor VIIa to reverse the anticoagulant effect of the pentasaccharide fondaparinux in healthy volunteers. Circulation. 2002;106(20):2550–4. https://doi.org/10.1161/01.cir.0000038501.87442.02.
81. Bijsterveld N.R., Vink R., van Aken B.E. et al. Recombinant factor VIIa reverses the anticoagulant effect of the long-acting pentasaccharide idraparinux in healthy volunteers. Br J Haematol. 2004;124(5):653–8. https://doi.org/10.1111/j.1365-2141.2003.04811.x.
82. Firozvi K., Deveras R.A.E., Kessler C.M. Reversal of low-molecular-weight heparin-induced bleeding in patients with pre-existing hypercoagulable states with human recombinant activated factor VII concentrate. Am J Hematol. 2006;81(8):582–9. https://doi.org/0.1002/ajh.2065.
83. Nagler M., Haslauer M., Wuillemin W.A. Fondaparinux – data on efficacy and safety in special situations. Thromb Res. 2012;129(4):407–17. https://doi.org/10.1016/j.thromres.2011.10.037.
84. Gerotziafas G.T., Depasse F., Chakroun T. et al. Recombinant factor VIIa partially reverses the inhibitory effect of fondaparinux on thrombin generation after tissue factor activation in platelet rich plasma and whole blood. Thromb Haemost. 2004;91(3):531–7. https://doi.org/10.1160/TH03-07-0483.
85. Lisman T., Bijsterveld N., Adelmeijer J. et al. Recombinant factor VIIa reverses the in vitro and ex vivo anticoagulant and profibrinolytic effects of fondaparinux. J Thromb Haemost. 2003;1(11):2368–73. https://doi.org/10.1046/j.1538-7836.2003.00536.x.
86. Akwaa F., Spyropoulos A.C. Treatment of bleeding complications when using oral anticoagulants for prevention of strokes. Curr Treat Options Cardiovasc Med. 2013;15(3):288–98. https://doi.org/10.1007/s11936013-0238-5.
87. van Ryn J., Stangier J., Haertter S. et al. Dabigatran etexilate – a novel, reversible, oral direct thrombin inhibitor: interpretation of coagulation assays and reversal of anticoagulant activity. Thromb Haemost. 2010;103(6):1116–27. https://doi.org/10.1160/TH09-11-0758.
88. Stangier J., Rathgen K., Stahle H., Mazur D. Influence of renal impairment on the pharmacokinetics and pharmacodynamics of oral dabigatran etexilate: an open-label, parallel-group, single-centre study. Clin Pharmacokinet. 2010;49(4):259–68. https://doi.org/10.2165/11318170-000000000-00000.
89. Khadzhynov D., Wagner F., Formella S. et al. Effective elimination of dabigatran by haemodialysis. A phase I single-centre study in patients with end-stage renal disease. Thromb Haemost. 2013;109(4):596–605. https://doi.org/10.1160/TH12-08-0573.
90. Zhou W., Schwarting S., Illanes S. et al. Hemostatic therapy in experimental intracerebral hemorrhage associated with the direct thrombin inhibitor dabigatran. Stroke. 2011;42(12):3594–9. https://doi.org/10.1161/STROKEAHA.111.624650.
91. Eerenberg E.S., Kamphuisen P.W., Sijpkens M.K. et al. Reversal of rivaroxaban and dabigatran by prothrombin complex concentrate: a randomized, placebo-controlled, crossover study in healthy subjects. Circulation. 2011;124(14):1573–9. https://doi.org/10.1161/CIRCULATIONAHA.111.029017.
92. Marlu R., Hodaj E., Paris A. et al. Effect of non-specific reversal agents on anticoagulant activity of dabigatran and rivaroxaban. Thromb Haemost. 2012;108(2):217–24. https://doi.org/10.1160/TH12-03-0179.
93. Dager W.E., Gosselin R.C., Roberts A.J. Reversing dabigatran in lifethreatening bleeding occurring during cardiac ablation with factor eight inhibitor bypassing activity. Crit Care Med. 2013;41(5):e42–6. https://doi.org/10.1097/CCM.0b013e31827caaa3.
94. Schulman S., Ritchie B., Goy J.K. et al. Activated prothrombin complex concentrate for dabigatran-associated bleeding. Br J Haematol. 2014;164(2):308–10. https://doi.org/10.1111/bjh.12620.
95. van Ryn J., Schurer J., Kink-Eiband M., Clemens A. The successful reversal of dabigatran-induced bleeding by coagulation factor concentrates in a rat tail bleeding model do not correlate with ex vivo markers of anticoagulation. Blood. 2011;118(21):2316. https://doi.org/10.1182/blood.V118.21.2316.2316.
96. Pollack C.V., Reilly P.A., van Ryn J. et al. Idarucizumab for dabigatran reversal – full cohort analysis. N Engl J Med. 2017;377(5):431–41. https://doi.org/10.1056/NEJMoa1707278.
97. Zhang D., Frost C.E., He K. et al. Investigating the enteroenteric recirculation of apixaban, a factor Xa inhibitor: administration of activated charcoal to bile duct-cannulated rats and dogs receiving an intravenous dose and use of drug transporter knockout rats. Drug Metab Dispos. 2013;41(4):906–15. https://doi.org/10.1124/dmd.112.050575.
98. Godier A., Miclot A., Le Bonniec B. et al. Evaluation of prothrombin complex concentrate and recombinant activated factor VII to reverse rivaroxaban in a rabbit model. Anesthesiology. 2012;116(1):94–102. https://doi.org/10.1097/ALN.0b013e318238c036.
99. Fukuda T., Honda Y., Kamisato C. et al. Reversal of anticoagulant effects of edoxaban, an oral, direct factor Xa inhibitor, with haemostatic agents. Thromb Haemost. 2012;107(2):253–9. https://doi.org/10.1160/TH11-090668.
100. Majeed A., Agren A., Holmstrom M. et al. Management of rivaroxabanor apixaban-associated major bleeding with prothrombin complex concentrates: a cohort study. Blood. 2017;130(15):1706–12. https://doi.org/10.1182/blood-2017-05-782060.
101. Schulman S., Gross P.L., Ritchie B. et al. Prothrombin complex concentrate for major bleeding on factor Xa inhibitors: a prospective cohort study. Thromb Haemosts. 2018;118(5):842–51. https://doi.org/10.1055/s-0038-1636541.
102. Gruber A., Marzec U.M., Buetehorn U., Hanson S., Perzborn E. Potential of activated prothrombin complex concentrate and activated factor VII to reverse the anticoagulant effects of rivaroxaban in primates. Blood. 2008;112(11):3825. https://doi.org/10.1182/blood.V112.11.3825.3825.
103. Lu G., DeGuzman F.R., Hollenbach S.J. A specific antidote for reversal of anticoagulation by direct and indirect inhibitors of coagulation factor Xa. Nat Med. 2013;19(4):446–51. https://doi.org/10.1038/nm.3102.
104. Mark C., Kitt M.M., Vandana M. et al. A phase 2 randomized, doubleblind, placebo-controlled trial demonstrating reversal of rivaroxabaninduced anticoagulation in healthy subjects by andexanet alfa (PRT064445), an antidote for FXa inhibitors. Blood. 2013;122(21):3636. https://doi.org/10.1182/BLOOD.V122.21.3636.3636.
105. Connolly S.J., Crowther M., Eikelboom J.W. et al. Full study report of andexanet alfa for bleeding associated with factor Xa inhibitors. N Engl J Med. 2019;380(14):1326–35. https://doi.org/10.1056/NEJMoa1814051.
106. Laulicht B., Bakhru S., Lee C. et al. Small molecule antidote for anticoagulants. Circulation. 2012;126(Suppl 1):11395.
107. HALT-IT Trial Collaborators. Effects of a high-dose 24-h infusion of tranexamic acid on death and thromboembolic events in patients with acute gastrointestinal bleeding (HALT-IT): an international randomised, double-blind, placebo-controlled trial. Lancet. 2020;395(10241):1927– 36. https://doi.org/10.1016/S0140-6736(20)30848-5.
108. Hemphill J.C., Greenberg S.M., Anderson C.S. et al. Guidelines for the management of spontaneous intracerebral hemorrhage: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2015;46(7):2032–60. https://doi.org/10.1161/STR.0000000000000069.
109. Lansberg M.G., O'Donnell M.J., Khatri P. et al. Antithrombotic and thrombolytic therapy for ischemic stroke: antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012;141(2 Suppl):e601S–e636S. https://doi.org/10.1378/chest.11-2302.
110. Pennlert J., Overholser R., Asplund K. et al. Optimal timing of anticoagulant treatment after intracerebral hemorrhage in patients with atrial fibrillation. Stroke. 2017;48(2):314–20. https://doi.org/10.1161/STROKEAHA.116.014643.
111. Nielsen P.B., Larsen T.B., Skjoth F., Lip G.Y. Outcomes associated with resuming warfarin treatment after hemorrhagic stroke or traumatic intracranial hemorrhage in patients with atrial fibrillation. JAMA Intern Med. 2017;177(4):563–70. https://doi.org/10.1001/jamainternmed.2016.9369.
112. Gralnek I.M., Dumonceau J.-M., Kuipers E.J. et al. Diagnosis and management of nonvariceal upper gastrointestinal hemorrhage: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy. 2015;47(10):a1–a46. https://doi.org/10.1055/s-0034-1393172.
113. Majeed A., Wallvik N., Eriksson J. et al. Optimal timing of vitamin K antagonist resumption after upper gastrointestinal bleeding. Thromb Haemost. 2017;117(3):491–9. https://doi.org/10.1160/TH16-07-0498.
Об авторах
В. О. БицадзеРоссия
Бицадзе Виктория Омаровна – д.м.н., профессор РАН, профессор кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 6506003478
Researcher ID: F-8409-2017
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Е. В. Слуханчук
Россия
Слуханчук Екатерина Викторовна – к.м.н., доцент кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова; врач акушер-гинеколог отделения абдоминальной хирургии и онкологии 2
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
119991 Москва, Абрикосовский пер., д. 2
Д. Х. Хизроева
Россия
Хизроева Джамиля Хизриевна – д.м.н., профессор кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 57194547147
Researcher ID: F-8384-2017
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
М. В. Третьякова
Россия
Третьякова Мария Владимировна – к.м.н., врач акушер-гинеколог, ассистент кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
В. И. Цибизова
Россия
Цибизова Валентина Ивановна – к.м.н., врач акушер-гинеколог НИЛ оперативной гинекологии Института перинатологии и педиатрии, врач отделения функциональной ультразвуковой диагностики
197341 Санкт-Петербург, ул. Аккуратова, д. 2
Н. Р. Гашимова
Россия
Гашимова Нилуфар Рамиль кызы – аспирант кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
И. А. Накаидзе
Россия
Накаидзе Инга Александровна – аспирант кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
И. Элалами
Франция
Элалами Исмаил – д.м.н., профессор кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова; профессор медицинского Университета Сорбонны; директор гематологии Центра Тромбозов
Scopus Author ID: 7003652413
Researcher ID: AAC-96952019.
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
75006 Париж, Улица медицинского факультета, д. 12
75020 Париж, Китайская улица, д. 4
Ж.-К. Гри
Франция
Гри Жан-Кристоф – д.м.н., профессор кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова; профессор гематологии, зав. лабораторией гематологии факультета биологических и фармацевтических наук Университета Монпелье и Университетской больницы Нима
Scopus Author ID: 7005114260
Researcher ID: AAA-2923-2019
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
34090 Монпелье, ул. Огюста Бруссоне, д. 163
А. Д. Макацария
Россия
Макацария Александр Давидович – д.м.н., профессор, академик РАН, зав. кафедрой акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова
Scopus Author ID: 57222220144
Researcher ID: M-5660-2016
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Рецензия
Для цитирования:
Бицадзе В.О., Слуханчук Е.В., Хизроева Д.Х., Третьякова М.В., Цибизова В.И., Гашимова Н.Р., Накаидзе И.А., Элалами И., Гри Ж., Макацария А.Д. Антикоагулянты: методы контроля дозы и ингибиторы. Акушерство, Гинекология и Репродукция. 2022;16(2):158-175. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.293
For citation:
Bitsadze V.O., Slukhanchuk E.V., Khizroeva J.Kh., Tretyakova M.V., Tsibizova V.I., Gashimova N.R., Nakaidze I.A., Elalamy I., Gris J., Makatsariya A.D. Anticoagulants: dose control methods and inhibitors. Obstetrics, Gynecology and Reproduction. 2022;16(2):158-175. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.293

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































