Перейти к:
Персонифицированная программа комплексной реабилитации после хирургического лечения рака эндометрия: результаты проспективного рандомизированного сравнительного исследования
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.318
Аннотация
Цель: оценить эффективность персонифицированной программы комплексной реабилитации у больных после оперативного лечения рака эндометрия (РЭ).
Материалы и методы. В исследовании приняла участие 61 пациентка репродуктивного возраста (44,46 ± 3,84 лет) после радикального лечения эндометриоидной аденокарциномы. Сформировано 2 группы: группа I «активной» реабилитации с комплексной программой восстановительных мероприятий (n = 29), группа II «пассивной» реабилитации со стандартным ведением послеоперационного периода в соответствии с объемами и сроками, определенными клиническими рекомендациями (n = 32). Качество жизни (КЖ) определяли с помощью комплекса опросников: функциональная оценка терапии рака для пациентов с раком эндометрия (англ. Functional Assessment of Cancer Therapy for Patients with Endometrial Cancer, FACT-En), модифицированный менопаузальный индекс Куппермана–Уваровой (ММИ), индекс женской сексуальной функции (англ. The Female Sexual Function Index, FSFI), госпитальная шкала тревоги и депрессии (англ. Hospital Anxiety and Depression Scale, HADS). Предусматривалось 4 визита пациента: на первой неделе и через 3, 6, 12 мес после операции, соответственно.
Результаты. В группе I к 12-му месяцу наблюдения ММИ снизился с 40,75 ± 5,69 баллов до 26,45 ± 4,84 баллов, что соответствовало легкой степени тяжести постовариоэктомического синдрома (ПОЭС), тогда как в группе II – с 39,62 ± 5,37 баллов до 36,15 ± 4,06 баллов, что соответствовало ПОЭС средней степени тяжести. Через 1 год после хирургического лечения пациентки группы I отметили практически полное восстановление сексуальной функции по шкале FSFI (24,93 ± 2,86 баллов), в то время как в группе II зафиксированы гораздо более низкие показатели (13,39 ± 2,55 баллов; p < 0,001). Максимальные значения по шкале HADS выявлены у всех участниц на первой неделе после операции – свыше 11 баллов, что соответствует клинически выраженной тревоге и депрессии. Через 6 и 12 мес зарегистрировано отсутствие выраженных симптомов в группе I (менее 7 баллов по каждому показателю), тогда как в группе II через 1 год наблюдения отмечали субклинической уровень тревоги и депрессии. По опроснику FACT-En в группе I продемонстрировано значительно более высокое КЖ по сравнению с группой II во время 4-го визита – 141,31 ± 6,45 баллов и 112,84 ± 6,48 баллов, соответственно.
Заключение. Разработанный комплекс «активной» персонифицированной реабилитации показал высокую эффективность у больных РЭ после радикального лечения по сравнению с пациентами со стандартным ведением восстановительного периода. Использование данной программы в течение 12 мес позволило минимизировать негативные проявления ПОЭС, оказало положительное влияние на психоэмоциональное состояние, достоверно повысило сексуальную функцию и КЖ. Организация комплексной реабилитации после оперативного лечения РЭ должна стать одним из приоритетных направлений здравоохранения.
Ключевые слова
Для цитирования:
Санджиева Л.Н., Солопова А.Г., Блинов Д.В., Сон Е.А., Галкин В.Н., Алексеев А.Б. Персонифицированная программа комплексной реабилитации после хирургического лечения рака эндометрия: результаты проспективного рандомизированного сравнительного исследования. Акушерство, Гинекология и Репродукция. 2022;16(2):143-157. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.318
For citation:
Sandzhieva L.N., Solopova A.G., Blinov D.V., Son E.A., Galkin V.N., Alekseev A.B. Personalized comprehensive rehabilitation program after surgical treatment of endometrial cancer: results of a prospective randomized comparative study. Obstetrics, Gynecology and Reproduction. 2022;16(2):143-157. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.318
Введение / Introduction
Ежегодно в мире выявляется более 417 тыс. новых случаев рака эндометрия (РЭ), а уровень смертности достигает 97 тыс. [1]. РЭ чаще встречается среди женщин старше 60 лет, однако с ростом числа метаболических нарушений заболеваемость увеличивается и среди пациенток репродуктивного возраста [2]. По данным статистики Российской Федерации, в 2019 г. зарегистрировано 27151 больных с впервые выявленным новообразованием эндометрия, из которых 5,1% – пациентки репродуктивного возраста [3]. У данной группы радикальное лечение приводит к появлению постовариоэктомического синдрома (ПОЭС), сексуальной дисфункции, психоэмоциональным расстройствам, хронической боли, снижению социальной активности, что ведет к ухудшению качества жизни (КЖ) [4–10]. Резкое снижение уровня половых гормонов сопровождается вегетососудистыми, нейроэндокринными и нейропсихическими расстройствами, влияющими на системные функции организма: возникновение сердечно-сосудистых заболеваний; изменения опорно-двигательного аппарата (остеопороз); урогенитальные нарушения, связанные с сексуальной дисфункцией; нейро-когнитивные и психические расстройства, включая тревогу и депрессию [11–13]. Вследствие дефицита уровня эстрогенов развивается атрофия и снижение эластичности влагалища, что проявляется сухостью, зудом, жжением, а также диспареунией [5]. Развитие сексуальной дисфункции в репродуктивном возрасте может иметь серьезные негативные последствия для самооценки, партнерских отношений, интимной жизни [12].
Таким образом, сочетание двух факторов – повышение частоты встречаемости РЭ среди женщин репродуктивного возраста и высокая десятилетняя безрецидивная выживаемость при выявлении на ранней стадии – обращают внимание исследователей не только на количество, но и на качество прожитых лет жизни [14]. Стандартное ведение послеоперационного периода не позволяет в полной мере компенсировать возникающие нарушения. Для купирования и минимизации последствий радикального лечения возникает потребность в мультидисциплинарном и персонифицированном подходе, который возможно организовать, используя программы комплексной реабилитации, положительно влияющие на КЖ пациентки в различных его аспектах [4][15].
Цель: оценить эффективность персонифицированной программы комплексной реабилитации у больных после оперативного лечения РЭ.
МАТЕРИАЛЫ И МЕТОДЫ / MATERIALS AND METHODS
В проспективном рандомизированном сравнительном исследовании приняла участие 61 женщина. Набор пациентов проводился на клинической базе ГБУЗ г. Москвы ГКОБ №1 ДЗМ.
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения: возраст старше 18 лет; гистологически верифицированный диагноз эндометриоидной аденокарциномы высокой или умеренной степени дифференцировки IА стадии; наличие одного или нескольких сопутствующих гинекологических заболеваний – доброкачественные овариальные кисты, аденомиоз, миома матки, патология шейки матки (дисплазия II и III степени); подписанное информированное согласие на участие в исследование.
Критерии исключения: наследственные формы рака (синдром Линча); сопутствующие экстрагенитальные онкологические процессы; тяжелые соматические и психические заболевания (в том числе выраженные когнитивные нарушения); пропуск хотя бы одного визита в установленное время.
Этапы исследования / Study stages
Срок наблюдения составил 1 год, в ходе исследования было предусмотрено 4 визита: на первой неделе (визит 0) и через 3 (визит 1), 6 (визит 2) и 12 мес (визит 3) после операции.
В соответствии с клиническими рекомендациями [16] пациенткам выполнена гистерэктомия с двухсторонней сальпингоофорэктомией с дальнейшим гистологическим исследованием удаленных препаратов. Была верифицирована эндометриоидная аденокарцинома высокой или умеренной степени дифференцировки IА стадии. Во время «визита 0», помимо стандартного клинического обследования, ультразвукового исследования (УЗИ) органов малого таза и магнитно–резонансной томографии, женщинам проводилось специальное исследование с помощью комплекса тест-опросников: функциональная оценка терапии рака для пациентов с раком эндометрия (англ. Functional Assessment of Cancer Therapy for Patients with Endometrial Cancer, FACT-En) для определения общего КЖ; модифицированный менопаузальный индекс Куппермана–Уваровой (ММИ) для оценки степени проявлений хирургической менопаузы; индекс женской сексуальной функции (англ. The Female Sexual Function Index, FSFI) для распознавания проблем интимного характера; госпитальная шкала тревоги и депрессии (англ. Hospital Anxiety and Depression Scale, HADS) для определения психоэмоционального состояния. В соответствии с принципами рандомизации методом конвертов было сформировано 2 группы: группа I (основная группа) «активной» реабилитации с комплексной программой восстановительных мероприятий (n = 29) и группа II (группа сравнения) «пассивной» реабилитации со стандартным ведением послеоперационного периода в соответствии с объемами и сроками, определенными клиническими рекомендациями (n = 32). На «визите 1» в группе I производилась коррекция мер реабилитации на основании данных клинического осмотра, инструментальных и лабораторных методов исследования.
Комплексная программа реабилитации / Comprehensive rehabilitation program
Для группы I мультидисциплинарная команда специалистов (акушер-гинеколог, онколог, врач физической и реабилитационной медицины, сексолог, психолог/ психотерапевт, невролог, диетолог и др.) разработала комплекс, включающий модификацию образа жизни: рациональное питание («Противораковая диета»), адекватная физическая нагрузка, контроль массы тела, восстановление микробиоценоза влагалища; использование лубрикантов, эмолентов, упражнения для тренировки мышц тазового дна; терренкур; климатои ландшафтотерапия; фитотерапия; медикаментозная поддержка; физиотерапевтические процедуры; индивидуальная и групповая психотерапевтическая работа; информационная поддержка. Группу II вели, принимая во внимание положения клинических рекомендаций по лечению рака тела матки и саркомы матки [16].
Опросники и шкалы / Questionnaires and scoring scales
Опросник FACT-En дает возможность в целом оценить уровень жизни больных с новообразованием эндометрия за последние 7 дней, состоит из 5 шкал и 43 вопросов. Суммарные значения достигают от 0 до 172 баллов. Референсных значений не представлено, однако, чем выше балл, тем лучше КЖ.
ММИ Куппермана–Уваровой позволяет проанализировать нейровегетативные, психоэмоциональные и метаболические расстройства. Суммарный балл ММИ ≥ 11 – проявления ПОЭС отсутствуют; 12–34 – легкая степень выраженности; 35–58 – средняя; > 58 – тяжелая.
При оценке сексуальной функции опросником FSFI индекс < 26,55 баллов свидетельствует о нарушениях в интимной сфере. Все вопросы нацелены на выявление особенностей сексуальной жизни в течение предыдущих 4 нед.
По шкале HADS значения от 0 до 7 баллов соответствуют «отсутствию выраженных симптомов тревоги и депрессии», от 8 до 10 – «субклинически выраженной тревоге/депрессии» и от 11 до 21 – «клинически выраженной тревоге/депрессии». Опросник оценивает уровень психоэмоциональных расстройств на момент его заполнения и в течение предшествующих 7 дней.
Этические аспекты / Ethical aspects
Исследование выполнено в соответствии с этическими стандартами Хельсинкской декларации 1964 г. и ее последующими изменениями или сопоставимыми нормами этики. Протокол исследования № 10-18 от 07.11.2018 одобрен локальным этическим комитетом ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет). Все участницы подписали добровольное информированное согласие.
Статистический анализ / Statistical analysis
Анализ данных проводился с использованием программы Statistica 10.0 (StatSoft Inc., США). Описательная статистика представлена в виде M ± σ, где М – среднее значение, а σ – стандартное отклонение. Для определения различий между полученными результатами лечения в различные сроки наблюдения относительно исходных значений в каждой группе применялся t-критерий Стьюдента для повторных измерений (зависимых выборок). Для оценки значимости различий результатов в исследуемых группах и подгруппах между собой на каждом сроке наблюдения использовался t-критерий Стьюдента для независимых переменных. Статистическая значимость различий была принята за p < 0,05.
РЕЗУЛЬТАТЫ / RESULTS
Пациентки обеих групп были сопоставимы по возрасту, индексу массы тела, количеству детей, уровню образования, трудовому статусу, сопутствующей гинекологической патологии. Средний возраст составил 44,46 ± 3,84 лет. Все женщины имели как минимум одного ребенка. Высшее образование имели 75,41% пациенток и 95,08% – трудовой статус. Подробное распределение по сопутствующим гинекологическим заболеваниям представлено в таблице 1. При этом следует отметить, что у 45 (73,77%) женщин была выявлена только одна из представленных патологий, у 12 (19,67%) участниц – сочетание 2 нозологических единиц, у 4 (6,56%) пациенток наблюдалось одновременно 3 сопутствующих гинекологических заболевания. Кроме того, у 39 (63,93%) участниц выявлено ожирение I степени, у 14 (22,95%) – II степени. У 37 (60,66%) женщин зарегистрирована высокодифференцированная аденокарцинома по результатам гистологического исследования, у 24 (39,34%) – умеренно-дифференцированная.
Таблица 1. Структура сопутствующих гинекологических заболеваний среди участниц исследования.
Table 1. Pattern of comorbid gynecological diseases found in female patients examined.

Шкала функциональной оценки качества жизни больных раком эндометрия / Functionally assessed quality of life in patients with endometrial cancer
В ходе анализа ответов на опросник FACT-En выявлены статистически значимые различия между группами на сроках 3, 6, 12 мес после операции (p < 0,001). Рассматривая динамику в течение 1 года, наблюдали значимые различия между группами: показатели увеличились на 34,6 баллов в основной группе, а в группе сравнения – на 21,3 баллов (p < 0,05). В течение 1 года у женщин с «активной» реабилитацией было отмечено повышение физического состояния на 9,55 баллов, а у пациенток с «пассивной» реабилитацией этот показатель составил всего 5,68 баллов (p < 0,001); параметры социально-семейного и эмоционального благополучия в группе I увеличились на 6,38 балла и 6,44 балла соответственно, а в группе II социально-семейное благополучие повысилось на 2,35 балла. Однако по шкале эмоционального состояния в группе II, напротив, наблюдалось снижение показателя на 2,69 балла через 1 год после операции, что, на наш взгляд, может быть связано со страхом рецидива заболевания.
В группе I в ходе активных реабилитационных мероприятий через 3 мес отмечалось значительное повышение КЖ и сохранялась положительная тенденция через 12 мес (p < 0,001). В группе II также наблюдалось улучшение КЖ вследствие естественного восстановления функций организма, однако рост показателей происходил не так быстро, как в основной группе. Таким образом, группа «активной» реабилитации продемонстрировала более высокое КЖ по сравнению с «пассивной» на сроках 3, 6, 12 мес после операции (p < 0,001) (табл. 2).
Таблица 2. Динамика показателей по опроснику FACT-En (функциональная оценка терапии рака для пациентов с раком эндометрия) в группах участниц.
Table 2. Dynamic changes in parameters assessed by the FACT-En questionnaire (Functional Assessment of Cancer Therapy for Patients with Endometrial Cancer) in patient groups.
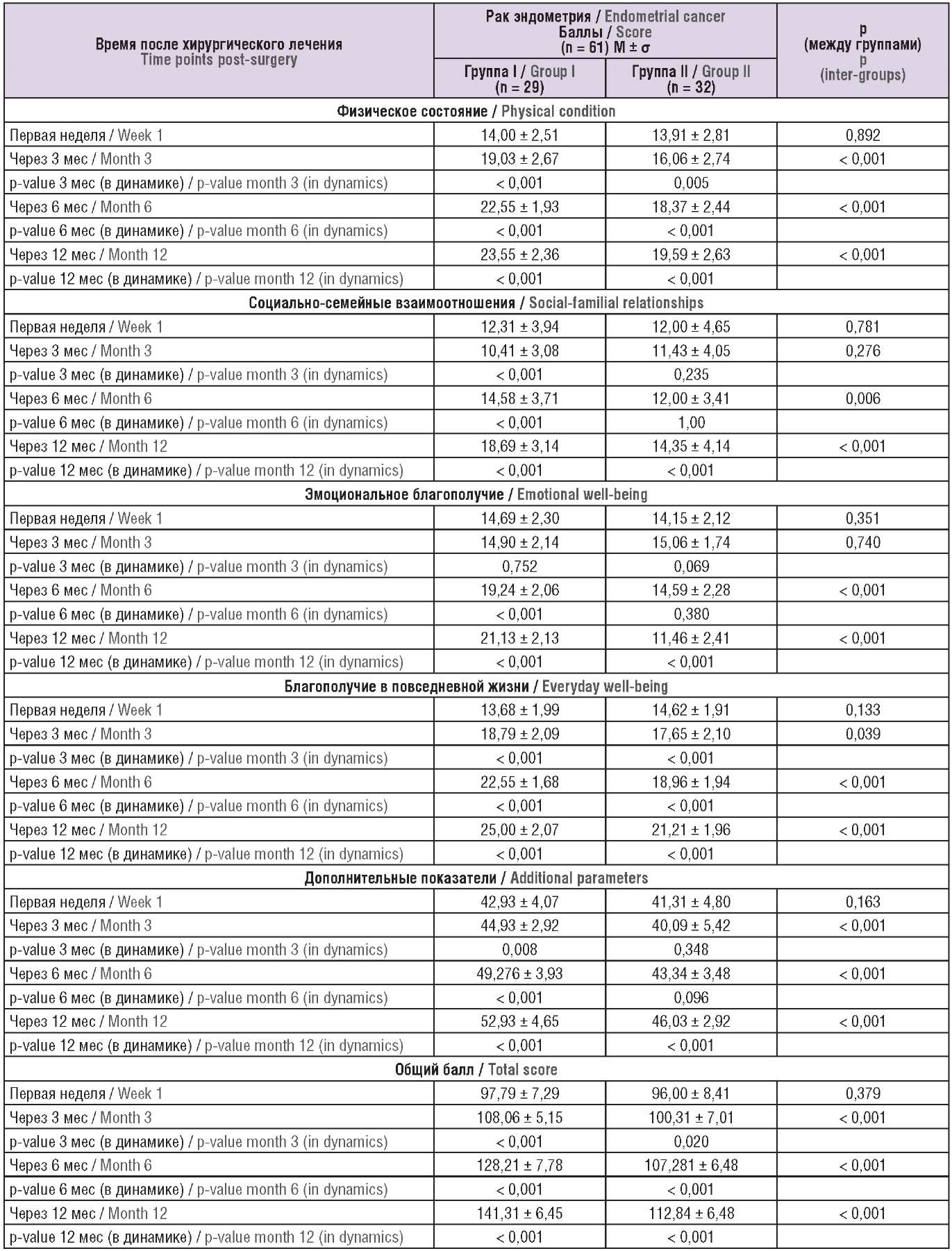
Примечание: p – t-тест Стьюдента для повторных измерений.
Note: p – repeated measures Student's t-test.
Модифицированный менопаузальный индекс / Modified menopausal index
У 61 (100,0%) пациентки на первой неделе после операции выявлены проявления хирургической менопаузы различной степени тяжести: у 18 (29,51%) женщин – легкой степени, у 33 (54,10%) – средней степени, у 10 (16,39%) – тяжелые нарушения. Появление первых признаков ПОЭС пациентки отмечали у себя уже в первую неделю после оперативного вмешательства и включали нейровегетативные расстройства – приливы жара, потливости, приступы сердцебиения и головные боли. В вечернее время эти нарушения усиливались, что вело к расстройствам сна, усталости и ухудшало психоэмоциональное состояние.
К 3-му месяцу наблюдения в обеих группах отсутствовало статистически значимое снижение показателей, которые по-прежнему соответствовали среднему течению ПОЭС. Происходило снижение частоты выявления нейровегетативных нарушений, однако нарастала степень метаболических расстройств в обеих группах за счет появления сухости влагалища, жажды и мышечно-суставных болей. К концу 12-го месяца в группе «пассивной» реабилитации метаболические нарушения были статистически значимо выше, чем в группе «активной» (p = 0,002) за счет усугубления атрофии гениталий, увеличения массы тела. Статистически значимые различия по ММИ наблюдались между группами через 6 мес (p < 0,001): показатели соответствовали легкой степени в группе I, в то время как пациентки группы II демонстрировали проявления средней степени тяжести. В этот период пациентки группы I отмечали уменьшение нейровегетативных симптомов: приливов жара, повышенной потливости, головных болей, сонливости, учащенного сердцебиения. В группе больных с «активной» реабилитацией на фоне применения разработанного восстановительного комплекса в течение 12 мес отмечено снижение среднего ММИ на 14,33 балла (35,82%) – с 40,75 баллов до 26,42 баллов (p < 0,001). В группе «пассивной» реабилитации также наблюдалась тенденция к снижению показателя к 12-му месяцу на 3,47 балла (8,75%) – с 39,62 до 36,15 баллов, однако клинически он соответствовал средней степени выраженности ПОЭС (табл. 3).
Таблица 3. Динамика показателей ММИ (модифицированный менопаузальный индекс Куппермана–Уваровой) в группах участниц.
Table 3. Dynamic changes in parameters assessed by the MMI (Kupperman-Uvarova Modified Menopausal Index) in patient groups.

Примечание: p – t-тест Стьюдента для повторных измерений.
Note: p – repeated measures Student's t-test.
Мы сравнили тяжесть климактерических симптомов на первой неделе после операции и через 3, 6, 12 мес после операции между группами в зависимости от вида реабилитации. Со временем степень тяжести симптомов уменьшалась у всех участниц (p < 0,001), однако при «активной» реабилитации изменения были более выраженными, и к концу наблюдения нарушения соответствовали легкой степени, в то время как степень проявлений ПОЭС в группе II достигала средней степени тяжести. Оценивая динамику общего балла ММИ, можно сделать вывод, что проведение комплекса «активной» реабилитации способствовало облегчению проявлений хирургической менопаузы у больных РЭ.
Индекс женской сексуальной функции / The Female Sexual Function Index
На первой неделе после операции у всех участниц регистрировали сексуальную дисфункцию (10,38 ± 2,11 баллов в основной группе и 10,51 ± 2,12 баллов в группе сравнения), что связано с проведением хирургического вмешательства и подготовкой к нему в предшествующие 4 недели. Через 3 мес в обеих группах наблюдали повышение общего показателя FSFI до 11,08 ± 1,76 и 11,40 ± 2,50 баллов соответственно, что обусловлено возобновлением сексуальной активности. Статистически значимые различия между группами определены на сроке 6 мес и составляли 17,55 ± 3,52 баллов в группе «активной» реабилитации и 11,48 ± 3,05 баллов в группе «пассивной» реабилитации (p < 0,001). После проведения программы комплексной реабилитации в сроке 12 мес наблюдения сексуальная функция женщин в основной группе повысилась до 24,93 ± 2,86 баллов, тогда как в группе сравнения отмечалась значительная сексуальная дисфункция (13,39 ± 2,55 баллов) (p < 0,001). В процессе восстановительных мероприятий у пациенток из группы «активной» реабилитации улучшилась лубрикация, усилилось возбуждение и влечение, отмечалось более частое наступление оргазма, уменьшились проявления боли, что способствовало более выраженному повышению сексуальной функции по сравнению с группой «пассивной» реабилитации. Статистически значимая разница между группами (p < 0,001) установлена на сроке 6 и 12 мес (табл. 4).
Таблица 4 (начало). Динамика показателей по опроснику FSFI (индекс женской сексуальной функции) в группах участниц.
Table 4 (beginning). Dynamic changes in parameters assessed by the FSFI questionnaire (The Female Sexual Function Index) in patient groups.

Примечание: p – t-тест Стьюдента для повторных измерений.
Note: p – repeated measures Student's t-test.
Таблица 4 (окончание). Динамика показателей по опроснику FSFI (индекс женской сексуальной функции) в группах участниц.
Table 4 (ending). Dynamic changes in parameters assessed by the FSFI questionnaire (The Female Sexual Function Index) in patient groups.
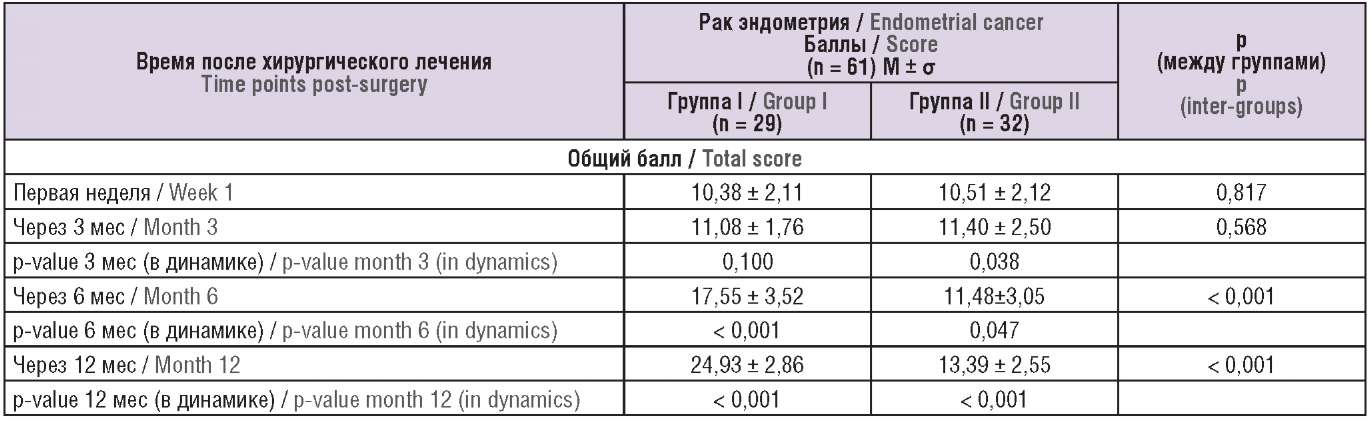
Примечание: p – t-тест Стьюдента для повторных измерений.
Note: p – repeated measures Student's t-test.
Госпитальная шкала тревоги и депрессии / Hospital Anxiety and Depression Scale
Непосредственно после операции (на первой неделе) показатели по шкале HADS имели максимальные значения за весь период наблюдения и соответствовали клинически выраженной тревоге и депрессии. Спустя 3 мес наблюдения у всех женщин была зафиксирована субклиническая форма тревожно-депрессивных расстройств. Достоверные различия между группами зафиксированы на сроке 6 и 12 мес (p < 0,001) после хирургического лечения: в группе I отмечалось двукратное снижение показателей уровня тревоги и депрессии, соответствовавшие нормальным значениям, в то время как в группе II к концу срока наблюдения зафиксированы более высокие значения, соответствовавшие субклинической тревоге и депрессии (табл. 5). Вероятно, это связано со страхом рецидива у данных пациенток.
Таблица 5. Динамика показателей по шкале HADS (госпитальная шкала тревоги и депрессии) в группах участниц.
Table 5. Dynamic changes in parameters assessed by the HADS scale (Hospital Anxiety and Depression Scale) in patient groups.

Примечание: p – t-тест Стьюдента для повторных измерений.
Note: p – repeated measures Student's t-test.
Достигнутые клинико-функциональные показатели через 6 и 12 мес после радикального лечения свидетельствуют об эффективности разработанного комплекса реабилитационных мероприятий, позволяющего снизить уровень тревожно-депрессивных расстройств.
ОБСУЖДЕНИЕ / DISCUSSION
В настоящее время во всем мире растет интерес к реабилитации как к неотъемлемой части организации процесса ведения пациентов. Реабилитация позволяет смягчить неблагоприятные последствия широкого спектра патологических состояний, включая онкологические заболевания репродуктивной системы. Сама постановка диагноза онкогинекологического заболевания, дальнейшее противоопухолевое лечение оказывают влияние на психологическое, физиологическое и социальное благополучие как в краткосрочной, так и в долгосрочной перспективе [5][6][9]. Однако, клинических исследований, в рамках которых изучается эффективность реабилитации у пациентов с РЭ, пока мало. Поэтому полученные нами результаты приобретают особую актуальность.
Мы использовали разработанный для оценки качества жизни онкологических больных, проходящих клинические испытания противораковой терапии, опросник FACT со шкалой дополнительных показателей для пациентов с РЭ (FACT-En). Последняя версия данного опросника за счет оптимизирования структуры и сокращения его элементов позволяет выполнять оценку с высокой точностью, благодаря чему набирает популярность во всем мире. FACT-En дает возможность получить валидные результаты по РЭ. В исследовании Н. Gao с соавт. средний общий балл по FACT-G составил 86 баллов, физическое функционирование – 26 баллов, благополучие в повседневной жизни – 20 баллов, социальное благополучие – 21 балл и эмоциональное благополучие – 21 балл. К сожалению, в данном исследовании не была оценена шкала дополнительных показателей для РЭ [17]. К концу 12-го месяца наблюдения в группе «активной» реабилитации мы получили более высокое КЖ (141,31 ± 6,45 баллов), чем в группе сравнения (112,84 ± 6,48 баллов) (p < 0,001). В исследовании N.Onujiogu с соавт. общий показатель КЖ по FACT-En составил 151 (105–171) баллов, т. е. несколько выше полученных нами результатов, что может быть связано с разным возрастом включенных пациентов (там средний возраст составлял 59,5 лет), различными стадиями заболеваниями (I–IIIa стадии РЭ) и сроком давности проведенного хирургического лечения (1–5 лет) [18].
Радикальное хирургическое лечение РЭ у женщин репродуктивного возраста вызывает органические нарушения со стороны половых органов, неблагоприятно сказывается на самооценке, негативно влияет на интимную сферу и КЖ. Сексуальная дисфункция представляет сложный комплекс из нескольких составляющих причин, однако зачастую больные нуждаются в доступных и простых методах по ее восстановлению [19]. В нашем исследовании мы использовали опросник FSFI, который показывает уровень сексуальной функции в предшествующие 4 недели. На первой неделе после операции все включенные в наше исследование пациентки (100,0%) отмечали сексуальную дисфункцию, что связано с подготовкой к оперативному вмешательству и с самой операцией. К концу исследования на сроке 12 мес в группе «активной» реабилитации удалось достичь практически полного восстановления сексуальной функции (24,93 ± 2,86 баллов), тогда как в группе сравнения продолжало регистрироваться наличие значительной сексуальной дисфункции (13,39 ± 2,55 баллов). Наиболее часто пациентки с «пассивной» реабилитацией отмечали снижение влечения, сухость влагалища, диспареунию, трудности с ощущением возбуждения, оргазма и удовольствия. Это согласуется с результатами других авторов, где распространенность сексуальных нарушений у онкогинекологических больных после лечения составляет от 61 до 97% [20–22] и более 50% из них вовсе не имеют половых контактов после операции. В недавнем исследовании Н. Gao с соавт., где оценивали сексуальную функцию и КЖ у пациентов с РЭ после хирургического вмешательства, 89% участников сообщили о той или иной форме сексуальной дисфункции, и боль была наиболее частой жалобой [17]. Согласно исследованию V. Karataşlı с соавт., уровень сексуальной дисфункции у больных РЭ после хирургического лечения очень высок (94,5%), а показатель составил 16,7 ± 8,5 баллов у женщин с I степенью ожирения, однако там сроки наблюдения составили около 35 мес (от 12 до 240 мес после лечения), а средний возраст – 56,8 ± 8,8 лет [6]. В исследовании N. Onujiogu с соавт., также средний балл по опроснику FSFI составил 16,6 баллов, что соответствовало сексуальной дисфункции [18].
Учитывая эти данные, важным аспектом реабилитации пациенток с РЭ является коррекция нарушений сексуальной сферы. В связи с этим нами был предложен комплекс реабилитационных мероприятий, который позволяет минимизировать и компенсировать данные расстройства. Психосексуальная реабилитация пары позволяет восстановить приемлемый уровень КЖ не только женщины, но и ее партнера [23]. Сконцентрированность врачей на непосредственном лечении опухоли, отсутствие необходимых знаний в этом вопросе, нехватка времени на приеме и стеснение женщин обсуждать проблемы интимной сферы могут представлять дополнительные трудности в коррекции психосоциальных расстройств и сексуальной функции [17][24]. Поэтому в реабилитацию женщин репродуктивного возраста необходимо включать консультацию сексолога, психотерапевта, восстановительные мероприятия по коррекции сексуальной дисфункции.
Начало проявлений ПОЭС отмечалось на первой неделе после овариэктомии. Ведущими симптомами являлись нарушения вегетососудистой регуляции, характеризовавшиеся приступами приливов жара, потливости, покраснения лица, учащенного сердцебиения, болей в области сердца, головных болей, гипертонических кризов. Как и при климаксе, тяжесть ПОЭС определяется частотой и интенсивностью приливов [11][12]. Пациентки, прошедшие программу комплексной персонифицированной реабилитации после радикального хирургического лечения, имели течение ПОЭС более легкой формы по сравнению с женщинами «пассивной» реабилитации. В целом, тяжесть симптомов уменьшалась с течением времени после операции, однако у участниц с «пассивной» реабилитацией их выраженность существенно не изменилась.
Полученные нами результаты соответствуют данным мировой литературы: распространенность психоэмоциональных расстройств среди больных РЭ крайне высока [25][26]. Выбранный нами подход к терапии и коррекции тревожных расстройств и депрессии определялся необходимостью комплексного воздействия на эти осложнения, как главное препятствие на пути социализации и возвращения пациенток к нормальной жизни. Результаты нашего исследования согласуются с данными зарубежных и отечественных авторов, согласно которым одним из самых эффективных методов воздействия на психоэмоциональную сферу является сочетание групповых и индивидуальных консультаций с психотерапевтом [17][18].
В работе S. Sanjida с соавт. распространенность тревоги была самой высокой до операции (клинически значимая тревога ≥ 11 баллов у 16%, n = 51/318; субклиническая тревога – у 19%, n = 59/318), а затем снижалась с течением времени вплоть до 6-го месяца после операции (клиническая – у 11,4%, n = 12/289; субклиническая – у 10%, n = 28/289). Средний балл тревоги составлял 6,6 баллов в начале исследования, а затем постепенно снижался до 3,6 баллов через 6 мес после операции. Для депрессии наблюдался пик через 1 неделю после операции (3,6 баллов). В этот момент распространенность депрессии с оценкой ≥ 11 баллов составляла 6% (n = 18/314), а затем снизилась, и на 6-м месяце после операции составила 2,1 балл [26]. Через 3 года после постановки диагноза распространенность депрессии достигла 15% среди женщин с РЭ и 7% в контрольной группе. В течение первого года после постановки диагноза РЭ женщины имели повышенный в 2 раза риск применения антидепрессантов по сравнению со здоровыми женщинами. Риск применения антидепрессантов сохранялся до 5 лет после лечения у женщин с РЭ. Женщины, у которых диагностирован гинекологический рак, имеют повышенный риск депрессии по сравнению со здоровыми женщинами [27].
Преимущества и недостатки исследования / Advantages and disadvantages of the study
Преимуществом нашего исследования является то, что оно имеет проспективный интервенционный дизайн, что позволило сравнить исследуемые показатели в параллельных группах. Такой подход помогает лучше понять предикторы, ухудшающие КЖ больных РЭ в послеоперационном периоде, а также как комплексная программа реабилитации влияет на КЖ пациенток, предотвращая негативные последствия проведенного оперативного лечения. Наши результаты могут служить клиническим ориентиром для дальнейших разработок реабилитационных мероприятий для пациенток с РЭ.
Наше исследование также имеет некоторые ограничения: во-первых, данные были получены с помощью анкет, заполненных пациентками самостоятельно, т. е. присутствовал элемент субъективной оценки. Мы попытались нивелировать данный недостаток тем, что была и объективная оценка (измерение артериального давления для внесения в данные анкеты, измерение индекса массы тела, оценка сухости кожных покровов, степени атрофии стенок влагалища и др.). Во-вторых, в нашем исследовании была относительно небольшая выборка пациентов, обусловленная ограничением набора по времени. Однако статистическая мощность исследования была достаточной и не снизила достоверность полученных результатов. Тем не менее следует провести более масштабные клинические исследования, посвященные эффективности реабилитационных мероприятий после хирургического лечения РЭ.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Радикальное хирургическое лечение больных РЭ репродуктивного возраста приводит к появлению тревоги и депресии, нейровегетативным, метаболическим, сексуальным расстройствам, что существенно снижает КЖ. Разработанная программа комплексной персонифицированной реабилитации была успешно апробирована и валидирована, показав высокую эффективность у больных РЭ после радикального хирургического лечения по сравнению с пациентами, к ведению которых в восстановительном периоде применялся стандартных подход. Было продемонстрировано, что комплексная реабилитация в течение 12 мес позволяет снизить негативные проявления ПОЭС, улучшить психоэмоциональное состояние, ускорить восстановление сексуальной функции, тем самым повышая КЖ пациенток репродуктивного возраста с РЭ в более короткие сроки. Полученные результаты свидетельствуют о значимом положительном влиянии «активной» тактики ведения больных на течение послеоперационного периода и открывают новые горизонты для развития современных подходов к реабилитации с целью более быстрого восстановления пациенток.
Такая тактика позволит значимо уменьшить бремя онкогинекологических заболеваний и оптимизировать затраты государственной системы здравоохранения на ведение таких пациенток. Поэтому создаваемые на основе междисциплинарного взаимодействия онкогинекологов и врачей смежных специальностей программы персонифицированной комплексной реабилитации должны являться строго предпочтительным направлением в организации медицинской помощи женщинам после хирургического лечения рака эндометрия.
Список литературы
1. Sung H., Ferlay J., Siegel R.L. et al. Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2021;71(3):209–49. https://doi.org/10.3322/caac.21660.
2. Kiesel L., Eichbaum C., Baumeier A. et al. Obesity epidemic – the underestimated risk of endometrial cancer. Cancers (Basel). 2020;12(12):3860. https://doi.org/10.3390/cancers12123860.
3. Злокачественные новообразования в России в 2019 году (заболеваемость и смертность). Под ред. А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой. М.: МНИОИ им. П.А. Герцена – филиал ФГБУ НМИЦ радиологии Минздрава России, 2020. 252 с.
4. Власина А.Ю., Идрисова Л.Э., Солопова А.Г. и др. Реабилитация онкогинекологических больных после противоопухолевой терапии: пути решения. Акушерство, Гинекология и Репродукция. 2020;14(1):44–55. https://doi.org/10.17749/2313-7347.2020.14.1.44-55.
5. Rizzuto I., Oehler M.K., Lalondrelle S. Sexual and psychosexual consequences of treatment for gynaecological cancers. Clin Oncol (R Coll Radiol). 2021;33(9):602–7. https://doi.org/10.1016/j.clon.2021.07.003.
6. Karataşlı V., Can B., Çakır İ., et al. Life quality of endometrioid endometrial cancer survivors: a cross-sectional study. J Obstet Gynaecol. 2020;41(4):621–5. https://doi.org/10.1080/01443615.2020.1787969.
7. Zandbergen N., Rooij B., Vos C.M. et al. Changes in health-related quality of life among gynecologic cancer survivors during the two years after initial treatment: A longitudinal analysis. Acta Oncologica. 2019;58(5):790–800. https://doi.org/10.1080/0284186X.2018.1560498.
8. Wang B., Li B., Shuai T. et al. Risk factors for anxiety and depression in Chinese patients undergoing surgery for endometrial cancer. Can J Physiol Pharmacol. 2020;98(1):1–5. https://doi.org/10.1139/cjpp-2019-0302.
9. Heo J., Chun M., Oh E.-T., Noh O.K. Psychiatric comorbidities among endometrial cancer survivors in South Korea: a nationwide populationbased, longitudinal study. J Gynecol Oncol. 2019;30(2):e15. https://doi.org/10.3802/jgo.2019.30.e15.
10. Солопова А.Г., Блинов Д.В., Бегович Ё. и др. Неврологические расстройства после гистерэктомии: от патогенеза к клинике. Эпилепсия и пароксизмальные состояния. 2022;14(1):54–64. https://doi.org/10.17749/2077-8333/epi.par.con.2022.115.
11. Stanisz M., Panczyk M., Kurzawa R., Grochans E. The effect of prophylactic adnexectomy on the quality of life and psychosocial functioning of women with the BRCA1/BRCA2 mutations. Int J Environ Res Public Health. 2019;16(24):4995. https://doi.org/10.3390/ijerph16244995.
12. Harris M.G. Sexuality and menopause: unique issues in gynecologic cancer. Semin Oncol Nurs. 2019;35(2):211–16. https://doi.org/10.1016/j.soncn.2019.02.008.
13. Блинов Д.В., Акарачкова Е.С., Ампилогова Д.М. и др. Депрессия у женщин в менопаузе: организация междисциплинарного подхода в лечении и перспективы реабилитации. Акушерство, Гинекология и Репродукция. 2021;15(6):738–54. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2021.280.
14. Ульрих Е.А., Тамбиева З.А., Урманчеева А.Ф., Кутушева Г.Ф. Качество жизни онкогинекологических больных: количественные методики определения. Акушерство и Гинекология Санкт-Петербурга. 2020;(1–2):30–4.
15. Smith S.R., Zheng J.Y., Silver J. et al. Cancer rehabilitation as an essential component of quality care and survivorship from an international perspective. Disabil Rehabil. 2018;42(1):8–13. https://doi.org/10.1080/09638288.2018.1514662.
16. Рак тела матки и саркомы матки. Клинические рекомендации. M.: Минздрав РФ, 2020. 64 c. Режим доступа: https://old.oncologyassociation.ru/files/clinical-guidelines-2020/rak_tela_matki_i_sarkomy_matki.pdf.
17. Gao H., Xiao M., Bai H., Zhang Z. Sexual function and quality of life among patients with endometrial cancer after surgery. Int J Gynecol Cancer. 2017;27(3):608–12. https://doi.org/10.1097/igc.0000000000000905.
18. Onujiogu N., Johnson T., Seo S. et al. Survivors of endometrial cancer: who is at risk for sexual dysfunction? Gynecol Oncol. 2011;123(2):356–9. https://doi.org/10.1016/j.ygyno.2011.07.035.
19. Roberts K., Chong T., Hollands E. et al. Screening for sexual health concerns in survivors of gynecological cancer. Support Care Cancer. 2020;28(2):599–605. https://doi.org/10.1007/s00520-019-04872-4.
20. Hosseini S.E., Ilkhani M., Rohani C. et al. Prevalence of sexual dysfunction in women with cancer: A systematic review and metaanalysis. Int J Reprod Biomed. 2022;20(1):1–12. https://doi.org/10.18502/ijrm.v20i1.10.
21. Maiorino M.I., Chiodini P., Bellastella G. et al. Sexual dysfunction in women with cancer: a systematic review with meta-analysis of studies using the Female Sexual Function Index. Endocrine. 2016;54(2):329–41. https://doi.org/10.1007/s12020-015-0812-6.
22. Natavio K.A., Billod J.A. Sexual dysfunction among patients with endometrial cancer at a tertiary training public institution: A crosssectional study. Philipp J Obstet Gynecol. 2021;45:223–8. https://doi.org/10.4103/pjog.pjog_39_21.
23. Boa R., Grénman S. Psychosexual health in gynecologic cancer. Int J Gynaecol Obstet. 2018;143 Suppl 2:147–52. https://doi.org/10.1002/ijgo.12623.
24. Блинов Д.В., Солопова А.Г., Плутницкий А.Н. и др. Организация здравоохранения в сфере реабилитации пациенток с онкологическими заболеваниями репродуктивной системы. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2022;15(1):119–30. https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.132.
25. Ferrandina G., Petrillo M., Mantegna G. et al. Evaluation of quality of life and emotional distress in endometrial cancer patients: a 2-year prospective, longitudinal study. Gynecol Oncol. 2014;133(3):518–25. https://doi.org/10.1016/j.ygyno.2014.03.015.
26. Sanjida S., Kissane D., McPhail S.M. et al. Anxiety and depression in patients with early stage endometrial cancer: A longitudinal analysis from before surgery to 6-month post-surgery. J Psychosoc Oncol Res Pract. 2019;1(3):e13. https://doi.org/10.1097/or9.0000000000000013.
27. Horsboel T.A., Kjaer S.K., Johansen C. et al. Increased risk for depression persists for years among women treated for gynecological cancers – a register-based cohort study with up to 19-years of follow-up. Gynecol Oncol. 2019;153(3):625–32. https://doi.org/10.1016/j.ygyno.2019.03.259.
Об авторах
Л. Н. СанджиеваРоссия
аспирант кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова
РИНЦ SPIN-код: 7228-3726
Россия, 119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
А. Г. Солопова
Россия
д.м.н., профессор кафедры акушерства и гинекологии Клинического института детского здоровья имени
Н.Ф. Филатова
Scopus Author ID: 6505479504. Researcher ID: Q-1385-2015
Россия, 119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Д. В. Блинов
Россия
к.м.н., руководитель по медицинским и научным вопросам; врач-невролог, Клинический Госпиталь Лапино
Scopus Author ID: 6701744871. Researcher ID: E-8906-2017. RSCI: 9779-8290
Россия, 127006 Москва, ул. Садовая-Триумфальная, д. 4–10
Россия, 143081 Московская область, Одинцовский район,
Лапино, 1-ое Успенское шоссе, д. 111
Е. А. Сон
Россия
к.м.н., доцент кафедры факультетской терапии № 1 Института клинической медицины имени Н.В. Склифосовского
Scopus Author ID: 19837664400
Россия, 119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
В. Н. Галкин
Россия
д.м.н., профессор, главный врач
Россия, 105005 Москва, Бауманская ул., д. 17/1
А. Б. Алексеев
Россия
студент 6-го курса Международной школы «Медицина будущего»
Россия, 119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Рецензия
Для цитирования:
Санджиева Л.Н., Солопова А.Г., Блинов Д.В., Сон Е.А., Галкин В.Н., Алексеев А.Б. Персонифицированная программа комплексной реабилитации после хирургического лечения рака эндометрия: результаты проспективного рандомизированного сравнительного исследования. Акушерство, Гинекология и Репродукция. 2022;16(2):143-157. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.318
For citation:
Sandzhieva L.N., Solopova A.G., Blinov D.V., Son E.A., Galkin V.N., Alekseev A.B. Personalized comprehensive rehabilitation program after surgical treatment of endometrial cancer: results of a prospective randomized comparative study. Obstetrics, Gynecology and Reproduction. 2022;16(2):143-157. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.318

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































