Перейти к:
Характеристики рецептивности эндометрия у женщин с различной толщиной эндометрия
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.303
Аннотация
Цель: оценить экспрессию рецепторов эстрогенов (ER) и прогестерона (PR) в эндометрии в период «окна имплантации» у женщин с репродуктивными дисфункциями в анамнезе при различной толщине эндометрия.
Материалы и методы. Проведено проспективное одноцентровое когортное сравнительное исследование. В основную группу вошли 52 пациентки с гипопластическим (< 7 мм по данным ультразвукового исследования в преовуляторные дни) эндометрием, в группу сравнения – 62 женщины с нормальной толщиной эндометрия; женщины обеих групп имели репродуктивные дисфункции неясного генеза. Контрольную группу составили 16 здоровых фертильных женщин. Проводили аспирационную биопсию эндометрия на 6–8-й день после овуляции с одномоментным получением образца периферической крови для определения уровней эстрадиола (E2) и прогестерона (P). Эндометриальные биоптаты исследовали гистологическим и иммунногистохимическим (экспрессия ER и PR) методами.
Результаты. Все женщины имели овуляторный цикл, уровень прогестерона в сыворотке крови ≥ 16,1 нмоль/л (6–8-й день после овуляции) и нормоэстрогенемию. Отношение Е2/Р было сходным во всех когортах (p > 0,05). Показатели эндометриальной экспрессии ER и PR, сходные со здоровыми женщинами, выявлены у 21 % (у 11 из 52) и 32 % (у 20 из 62) женщин основной группы и группы сравнения соответственно. У остальных 79 % (у 41 из 52) женщин с «тонким» эндометрием (основная группа) и 68 % (у 42 из 62) пациенток с нормальной толщиной эндометрия (группа сравнения) показатели экспрессии ER и PR в железах и строме эндометрия были с достоверными различиями (p < 0,05) по всем значениям (кроме PR в строме эндометрия) от показателей здоровых женщин (контрольная группа), но без соответствующих различий между данными когортами (p > 0,05) независимо от толщины эндометрия.
Заключение. У женщин с репродуктивными нарушениями в анамнезе показатели эндометриальной экспрессии ER и PR, сходные с таковыми у женщин без репродуктивных проблем, отмечены при «тонком» (< 7 мм) эндометрии на 50 % реже, чем при нормальной толщине слизистой оболочки матки. В то же время «тонкий» эндометрий не является абсолютным предиктором нарушений гормонально-рецепторных характеристик эндометрия: в каждом пятом случае определены сходные со здоровыми женщинами значения эндометриальной экспрессии ER и PR.
Ключевые слова
Для цитирования:
Аганезова Н.В., Аганезов С.С., Гогичашвили К.Э. Характеристики рецептивности эндометрия у женщин с различной толщиной эндометрия. Акушерство, Гинекология и Репродукция. 2022;16(2):108-121. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.303
For citation:
Aganezova N.V., Aganezov S.S., Gogichashvili K.E. Characteristics of endometrial receptivity in women with different endometrial thickness. Obstetrics, Gynecology and Reproduction. 2022;16(2):108-121. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.303
Введение / Introduction
Нарушения репродуктивной функции у женщин, такие как невынашивание беременности и бесплодие, являются значимыми проблемами для медицины и всего социума. Частота бесплодных браков в Российской Федерации достигает 24 % [1]. Треть инфертильных пар сталкиваются с репродуктивными проблемами «неясного генеза». За последние годы отмечается тенденция к увеличению частоты идиопатических потерь беременности. По данным Европейского общества репродукции человека и эмбриологии (англ. European Society of Human Reproduction and Embryology, ESHRE), каждая пятая беременность прерывается досрочно [2]. Своевременное выявление и коррекция нарушений функционирования женской репродуктивной системы остается важной задачей для медицины в целом. Этиопатогенез таких нарушений многокомпонентен. В литературе описано множество причин снижения фертильности у женщин [3–5]. Наименее изученным предрасполагающим фактором гравидарных неудач является эндометриальная дисфункция [6–8].
Эндометрий – это специализированная совокупность клеток, которая претерпевает циклическую трансформацию в течение всего менструального цикла под воздействием половых стероидных гормонов – эстрадиола (E2) и прогестерона (P) [9–11]. Данные изменения эндометрия необходимы для подготовки слизистой оболочки матки к возможной имплантации плодного яйца [12]. Толщина эндометрия отражает интенсивность процессов в пролиферативную фазу цикла. Считается, что к 11–13-у дню менструального цикла (при его длительности 28 дней) толщина эндометрия должна составлять 7 мм и более [13–15]. Существует когорта женщин, у которых величина М-эхо в указанные сроки не достигает 7 мм, что определяется как гипопластический эндометрий [6][8][16][17]. В литературе нет достаточной информации, является ли «тонкий» эндометрий безусловным прогностическим фактором репродуктивных неудач [18][19].
Считается, что наиболее благоприятные условия для имплантации бластоцисты создаются во время «окна имплантации», которое наступает на 6–8-й день после овуляции [9][12][20]. Совокупность морфофункциональных характеристик слизистой матки, необходимых для процессов имплантации плодного яйца, определяют как рецептивность эндометрия [7][9][21][22].
Одной из причин репродуктивных неудач может быть нарушение гормонально-рецепторных взаимодействий в эндометрии [3][23]. Так, например, повышенная экспрессия эстрогеновых рецепторов (англ. Estrogen Receptor, ER) с одновременной высокой экспрессией прогестероновых рецепторов (англ. Progesterone Receptor, PR) в среднюю секреторную фазу не соответствует нормальным характеристикам рецепторности эндометрия, необходимым для успешной имплантации плодного яйца. Также, существенно сниженная экспрессия рецепторов стероидных гормонов (ER, PR) в фолликулярную фазу менструального цикла не является адекватной характеристикой эндометрия при понимании стимулирующего эффекта эстрогенов на данные процессы [7][20][22].
Большинство изучений эндометриальных образцов проводят женщинам с несколькими эпизодами репродуктивных неудач при использовании вспомогательных репродуктивных технологий (ВРТ). У женщин с репродуктивными дисфункциями в циклах естественного зачатия таких исследований существенно меньше. Нет достаточных данных о рецептивности эндометрия у женщин с «синдромом гипопластического эндометрия» [6][15][16]. Дискутабельным остается вопрос, является ли «тонкий» эндометрий (по данным ультразвукового исследования (УЗИ) в преовуляторный период) самостоятельным показанием к углубленному исследованию биоптатов слизистой тела матки.
Цель: оценить экспрессию ER и PR в эндометрии в период «окна имплантации» у женщин с репродуктивными дисфункциями в анамнезе при различной толщине эндометрия.
МАТЕРИАЛЫ И МЕТОДЫ / MATERIALS AND METHODS
Дизайн исследования / Study design
На клинической базе кафедры акушерства и гинекологии ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России – СПб ГБУЗ «Центр планирования семьи и репродукции» проведено проспективное когортное сравнительное исследование. В период с 2016 по 2021 гг. обследовано 130 женщин, из которых были сформированы 3 группы: основная группа – 52 женщины с «тонким» эндометрием, группа сравнения – 62 женщины с нормальным по толщине эндометрием (в обеих группах – женщины с невынашиванием беременности и бесплодием неясного генеза в анамнезе); контрольная группа – 16 здоровых фертильных женщин.
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения в основную группу: репродуктивный возраст 20–40 лет; наличие репродуктивных дисфункций в анамнезе неясного генеза (бесплодие, невынашивание беременности до 12 нед гестации); нормальный уровень гонадотропинов, пролактина, тиреотропного гормона в крови; овуляторный менструальный цикл; «тонкий» эндометрий (толщина эндометрия < 7 мм на 11–13-й день менструального цикла при его длительности 28 дней по данным УЗИ); наличие подписанного информированного согласия.
Критерии включения в группу сравнения: репродуктивный возраст 20–40 лет; наличие репродуктивных дисфункций в анамнезе неясного генеза (бесплодие, невынашивание беременности до 12 нед гестации); нормальный уровень гонадотропинов, пролактина, тиреотропного гормона в крови; овуляторный менструальный цикл; нормальная толщина эндометрия по данным УЗИ; наличие подписанного информированного согласия.
Критерии включения в контрольную группу: репродуктивный возраст 20–40 лет; отсутствие нарушений репродуктивной функции в анамнезе; наличие подписанного информированного согласия.
Критерии исключения: соматические заболевания в стадии декомпенсации или нестойкой ремиссии; системные аутоиммунные заболевания (системная красная волчанка, ревматоидный артрит и др., за исключением аутоиммунного тиреоидита при эутиреозе); злокачественные опухоли в настоящее время и/или в анамнезе; гормон-продуцирующие опухоли в прошлом/ настоящем; ожирение (индекс массы тела ≥ 30 кг/м2); факторы повышенного риска тромботических осложнений в личном и семейном анамнезе (в том числе выявленные генетические маркеры наследственных тромбофилий); аномалии развития матки; эндометриоз; наличие миоматозных узлов диаметром 30 мм и более, наличие субмукозной миомы матки; прием препаратов половых гормонов менее, чем за 3 мес до включения в исследование.
Методы исследования / Study methods
Метод анкетирования / Questionnaire method
Нами были разработаны специальные карты-анкеты (клинико-анамнестический метод), которые состояли из 5 разделов и включали 303 вопроса: первый раздел посвящен психосоциальным характеристикам пациенток, второй раздел включал вопросы о семейном анамнезе, остальные 3 раздела освещали вопросы личного акушерско-гинекологического и соматического анамнеза, а также включали объективные данные женщин, являвшихся участницами исследования.
Гормональное обследование / Hormone testing
Для определения уровней гормонов в периферической крови были использованы иммуноферментный и хемилюминесцентный методы. Уровни фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ) определяли в крови, полученной из локтевой вены на 2–3-й день менструального цикла (д.м.ц.); значения общего тестостерона (T), свободного тестостерона (FTest), дегидроэпиандростерона-сульфата (ДГЭА-С), 17-гидроксипрогестерона (17-ОНР) оценивали на 3-5–й д.м.ц.; концентрацию пролактина, тиреотропного гормона (ТТГ) и свободного тироксина (FT4) – в любой д.м.ц. Гормональное обследование проводили при помощи тест-систем компаний «АлкорБио», Россия (ФСГ, ЛГ, ДГЭА-С, 17-ОНР, пролактин, ТТГ, FT4), «DRG Diagnostics», Германия (FTest), «Beckman Coulter», США (эстрадиол, прогестерон).
Ультразвуковое мониторирование роста фолликула, М-эхо, овуляции / Ultrasound monitoring of follicle growth, M-echo, ovulation
Всем испытуемым проводили ультразвуковое мониторирование роста фолликула и овуляции, отслеживали толщину эндометрия в двух менструальных циклах подряд и в менструальном цикле, в котором была выполнена биопсия эндометрия. Нормальной толщиной эндометрия по данным УЗИ на 11–13-й д.м.ц. считали величину М-эхо ≥ 7 мм.
На 6–8-й день после овуляции (д.п.о.) всем пациенткам проводили аспирационную пайпель-биопсию эндометрия. В течение менструального цикла, в котором выполняли биопсию эндометрия, женщины использовали барьерный метод контрацепции. Инвазивное внутриматочное вмешательство было выполнено при нормобиоценозе урогенитального тракта у всех участниц. Для биопсии эндометрия использовали специальный урогенитальный зонд типа Pipelle (Jiangsu Suyun Medical Materials Co. Ltd., Китай).
В день проведения биопсии эндометрия получали образец периферической крови для определения уровней эстрадиола (E2) и прогестерона (Р).
Оценка экспрессии эстрогеновых и прогестероновых рецепторов в эндометрии / Expression of endometrial estrogen and progesterone receptors
Исследование образцов эндометрия проводили на базе ФГБУ «Всероссийский центр экстренной и радиационной медицины имени А.М. Никифорова» МЧС России (заведующая патологоанатомическим отделением к.м.н. В.Н. Эллиниди). Использовали гистологический и иммуногистохимический методы исследования. Из образцов эндометрия были сформированы парафиновые блоки (использовали гистопроцессор Leica ASP200, Германия), с которых в дальнейшем выполняли срезы толщиной 3–5 мкм при помощи микротома Microm HM 340E (Thermo Scientific, США). Срезы окрашивали эозином и гематоксилином для проведения гистологического исследования.
Применяли иммуногистохимическую методику окрашивания биоматериала для оценки экспрессии рецепторов половых стероидов в железах и в строме эндометрия при помощи полимерного EnVision-метода с применением системы визуализации (DakoCytomation, Дания). Для окрашивания использовали моноклональные мышиные антитела к рецепторам эстрогенов (clone 1D5, RTU, DakoCytomation, Дания), моноклональные антитела к рецепторам прогестерона (clonePgR 636, RTU, DakoCytomation, Дания).
Счет ER и PR в эндометрии определяли при помощи микроскопа Leica DM200 и рассчитывали H-score (англ. Histochemical Score): H-score = 1 ˣ (% клеток со слабо окрашенными ядрами) + 2 ˣ (% клеток с умеренно окрашенными ядрами) + 3 ˣ (% клеток с сильно окрашенными ядрами). Значения H-score были в диапазоне от 0 до 300 [5][7].
Этические аспекты / Ethical aspects
Дизайн исследования утвержден локальным этическим комитетом ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России (протокол № 10 от 09.11.2016, протокол № 8 от 11.11.2020), соответствует Хельсинской декларации Всемирной медицинской ассоциации «Этические принципы проведения медицинских исследований с участием человека в качестве субъекта» (последняя редакция 2013 г., Форталеза, Бразилия). Все обследованные женщины подписывали информированное согласие до начала исследования.
Статистический анализ / Statistical analysis
Полученные результаты были обработаны в программе Statistica portable v.13.5 (TIBCO Software Inc., США). Количественные показатели оценивали при помощи непараметрических методов (критерии Краскела–Уоллиса, Манна–Уитни); количественные данные представлены в формате M ± m (среднее ± статистическая ошибка среднего). Для изучения статистических взаимосвязей между показателями использовали непараметрический коэффициент корреляции Спирмена. Различия считали значимыми при p < 0,05.
РЕЗУЛЬТАТЫ / RESULTS
Средний возраст женщин основной группы составил 32,5 ± 0,6 лет, группы сравнения – 33,1 ± 0,6 лет, контрольной группы – 32,5 ± 0,6 лет (p > 0,05). Средний возраст менархе пациенток основной группы составил 12,6 ± 0,2 года (от 10 до 16 лет), группы сравнения – 12,8 ± 0,1 года (от 11 до 15 лет), контрольной группы – 12,9 ± 0,7 года (от 11 до 15 лет) (p > 0,05). Длительность менструального цикла составляла в основной группе 31,0 ± 0,6 дней, в группе сравнения – 30,2 ± 0,8 дней, в контрольной группе – 30,9 ± 0,9 дней (p > 0,05).
Все женщины, включенные в исследование, имели нормальные значения гонадотропных гормонов, пролактина, исследованных андрогенов, гормонов, характеризующих функцию щитовидной железы; у всех выявлен овуляторный менструальный цикл и нормоэстрогенемия. Соответствующие показатели были сравнимы у женщин всех трех групп (табл. 1).
Таблица 1. Содержание гормонов в периферической крови в цикле проведения биопсии эндометрия у обследованных женщин с различной толщиной эндометрия (M ± m).
Table 1. Peripheral blood serum hormone level during endometrial biopsy testing in women with varying endometrial thickness (M ± m).

Примечание: E2 – эстрадиол; P – прогестерон; ФСГ – фолликулостимулирующий гормон; ЛГ – лютеинизирующий гормон; 17-ОНР – 17-гидроксипрогестерон; ДГЭА-С – дегидроэпиандростерона-сульфат; FTest – свободный тестостерон; ТТГ – тиреотропный гормон; FT4 – свободный тироксин; д.п.о. – день после овуляции; д.м.ц. – день менструального цикла.
Note: E2 – estradiol; P – progesterone; FSH – follicle stimulating hormone; LH – luteinizing hormone; 17-OHP – 17-hydroxyprogesterone; DHEA-S – dehydroepiandrosterone sulfate; FTest –free testosterone; TSH – thyroid-stimulating hormone; FT4 – free thyroxine; d.а.o. – the day after ovulation; d.m.c. – day of the menstrual cycle.
На 6–8-й д.п.о. всем женщинам выполняли биопсию эндометрия с гистологическим и иммуногистохимическим исследованием (экспрессия ER, PR) эндометриальных образцов. У женщин контрольной группы были следующие характеристики рецепторного аппарата эндометрия: низкая экспрессия ER, PR в железах, снижение экспрессии ER в строме и высокая экспрессия PR в строме эндометрия. Проводили сравнительный анализ показателей экспрессии ER и PR в эндометрии в зависимости от толщины слизистой оболочки тела матки. По всем показателям (кроме PR в строме) определены существенные различия (р < 0,01) между женщинами с репродуктивными неудачами в анамнезе и здоровыми женщинами из группы контроля, но без значимых различий (р > 0,05) в группах с различной толщиной эндометрия (табл. 2).
Таблица 2. Показатели счета рецепторов эстрогенов (ER) и прогестерона (PR) в эндометрии у обследованных женщин с различной толщиной эндометрия (M ± m).
Table 2. Quantification of estrogen (ER) and progesterone (PR) receptors in the endometrium of women with varying endometrial thickness (M ± m).
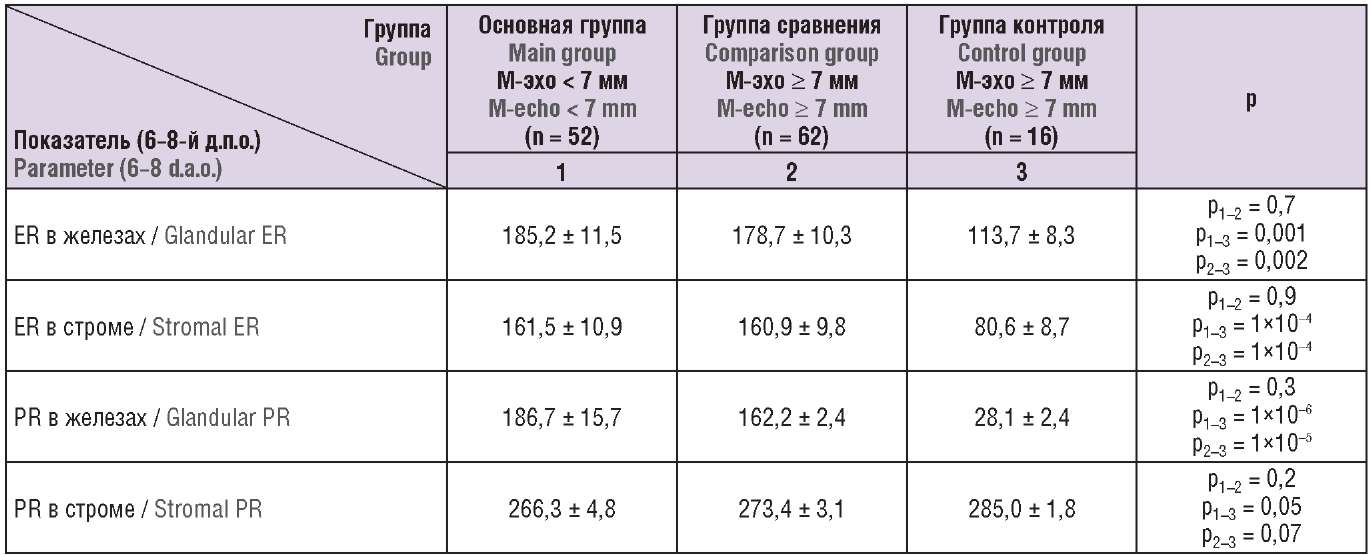
Примечание: д.п.о. – день после овуляции.
Note: d.а.o. – the day after ovulation.
По результатам гистологического исследования образцов эндометрия у всех женщин контрольной группы (n = 16) имели место полноценные секреторные преобразования слизистой оболочки матки. В основной группе эндометрий средней фазы секреции определялся у 25 % женщин (у 13 из 52), в группе сравнения – у 39 % женщин (у 24 из 62). При указанных гистологических характеристиках эндометрия уровни E2 и Р в крови у соответствующих пациенток не различались (p > 0,05) (табл. 3).
Таблица 3. Содержание половых стероидных гормонов в периферической крови в цикле проведения биопсии эндометрия у обследованных женщин с различной секреторной трансформацией эндометрия (M ± m).
Table 3. Level of sex steroid hormones in peripheral blood serum of women with varying secretory transformation of the endometrium (M ± m).

Примечание: E2 – эстрадиол; P – прогестерон; д.п.о. – день после овуляции.
Note: E2 – estradiol; P – progesterone; d.а.o. – the day after ovulation.
Был проведен сравнительный анализ результатов иммуногистохимического исследования пайпель-биоптатов эндометрия в соотношении с данными гистологического заключения. Не было выявлено различий (p > 0,05) показателей экспрессии ER, PR (значения H-score в диапазоне от 0 до 300) при полноценной секреторной трансформации эндометрия у женщин основной группы и группы сравнения независимо от толщины эндометрия и при сравнении с контрольной группой. Также не выявлено существенных различий счета ER, PR в эндометрии при неполноценных секреторных эндометриальных преобразованиях у женщин основной группы и группы сравнения независимо от толщины эндометрия. При сравнительном анализе показателей эндометриальной экспрессии ER, PR в случаях различных вариантов трансформации эндометрия (полноценной и неполноценной) у женщин в основной группе и группе сравнения различия были статистически значимы (р < 0,05) (табл. 4).
Таблица 4. Показатели счета рецепторов эстрогенов (ER) и прогестерона (PR) в эндометрии у обследованных женщин с различной секреторной трансформацией эндометрия (M ± m).
Table 4. Quantification of estrogen (ER) and progesterone (PR) receptors in the endometrium of women with varying endometrial secretory transformation (M ± m).

Эндометриальная экспрессия ER, PR у здоровых фертильных женщин имела следующие характеристики: низкую экспрессию ER, PR в железах, снижение ER в строме, высокую экспрессию PR в строме эндометрия. Описанные динамические изменения экспрессии ER, PR в эндометрии были условно определены как полноценный вариант гормонально-рецепторных характеристик слизистой тела матки (иммунофенотип 1, ИФТ-1). Сходные с группой контроля показатели счета ER, PR были отмечены у 21 % (n = 11) женщин с «тонким» эндометрием и у 32 % (n = 20) женщин из группы сравнения с нормальной толщиной эндометрия. Соответственно, в 79 % (n = 41) случаев у пациенток основной группы и в 68 % (n = 42) у пациенток группы сравнения были установлены отличные от здоровых женщин варианты гормонально-рецепторных характеристик эндометрия, характеризующиеся изолированной или сочетанной гиперэкспрессией стероидных рецепторов в железах и/или строме слизистой тела матки (иммунофенотип 2,3,4; ИФТ-2,3,4) [22].
В ряде случаев определяли несоответствие гистологических характеристик эндометрия и его рецепторности. При полноценной секреторной трансформации слизистой тела матки были отмечены варианты эндометриальной экспрессии ER и PR, отличные (ИФТ-2,3,4) от здоровых женщин: в основной группе – 15 % случаев (у 2 из 13), в группе сравнения – 33 % случаев (у 8 из 24). И наоборот, при отставании секреторных преобразований эндометрия от соответствующих дней менструального цикла имела место сходная с группой контроля экспрессия ER и PR: в основной группе – 3 % (у 1 из 39), в группе сравнения – 10 % (у 4 из 38).
Пациентки были разделены на подгруппы в зависимости от толщины эндометрия (М-эхо < 7 мм и М-эхо ≥7 мм) и варианта гормонально-рецепторного статуса эндометрия (ИФТ-1 и ИФТ-2,3,4). Значения гонадотропинов, пролактина, половых стероидов, гормонов щитовидной железы в крови не различались (p > 0,05) в подгруппах женщин с различной толщиной эндометрия (табл. 5).
Таблица 5. Содержание гормонов в периферической крови в цикле проведения биопсии эндометрия у обследованных женщин с различными значениями М-эхо и различными вариантами гормонально-рецепторного статуса эндометрия (M ± m).
Table 5. Peripheral blood serum level of hormones during endometrial biopsy testing in women with varying M-echo and types of hormonereceptor status in the endometrium (M ± m).

Примечание: E2 – эстрадиол; P – прогестерон; ФСГ – фолликулостимулирующий гормон; ЛГ – лютеинизирующий гормон; 17-ОНР – 17-гидроксипрогестерон; ДГЭА-С – дегидроэпиандростерона-сульфат; FTest – свободный тестостерон; ТТГ – тиреотропный гормон; FT4 – свободный тироксин; ИФТ – иммунофенотип; д.п.о. – день после овуляции; д.м.ц. – день менструального цикла.
Note: E2 – estradiol; P – progesterone; FSH – follicle stimulating hormone; LH – luteinizing hormone; 17-OHP – 17-hydroxyprogesterone; DHEA-S – dehydroepiandrosterone sulfate; FTest – free testosterone; TSH – thyroid-stimulating hormone; FT4 – free thyroxine; IPhT – immunophenotype; d.а.o. – the day after ovulation; d.m.c. – day of the menstrual cycle.
Экспрессия PR в строме эндометрия у женщин в исследуемых подгруппах не различалась (p > 0,05) (табл. 6). Экспрессия ER и PR в железах, ER в строме эндометрия у пациенток основной группы и группы сравнения с нарушенным эндометриальным «ответом» (ИФТ-2,3,4) существенно отличалась от таковой у пациенток основной группы и группы сравнения с нормальными гормон-рецепторными эндометриальными характеристиками (ИФТ-1) и у женщин контрольной группы (ИФТ-1) (p < 0,01). Показатели счета рецепторов половых стероидов не различались у женщин с различной толщиной эндометрия и репродуктивными дисфункциями в прошлом, имеющих полноценный гормонально-рецепторный эндометриальный «ответ», и у здоровых женщин (р > 0,05) (табл. 6).
Таблица 6. Показатели счета рецепторов эстрогенов (ER) и прогестерона (PR) в эндометрии у обследованных женщин с различными вариантами гормонально-рецепторного статуса эндометрия (M ± m).
Table 6. Quantification of estrogen (ER) and progesterone (PR) receptors in the endometrium of women with varying types of endometrial hormone-receptor status (M ± m).
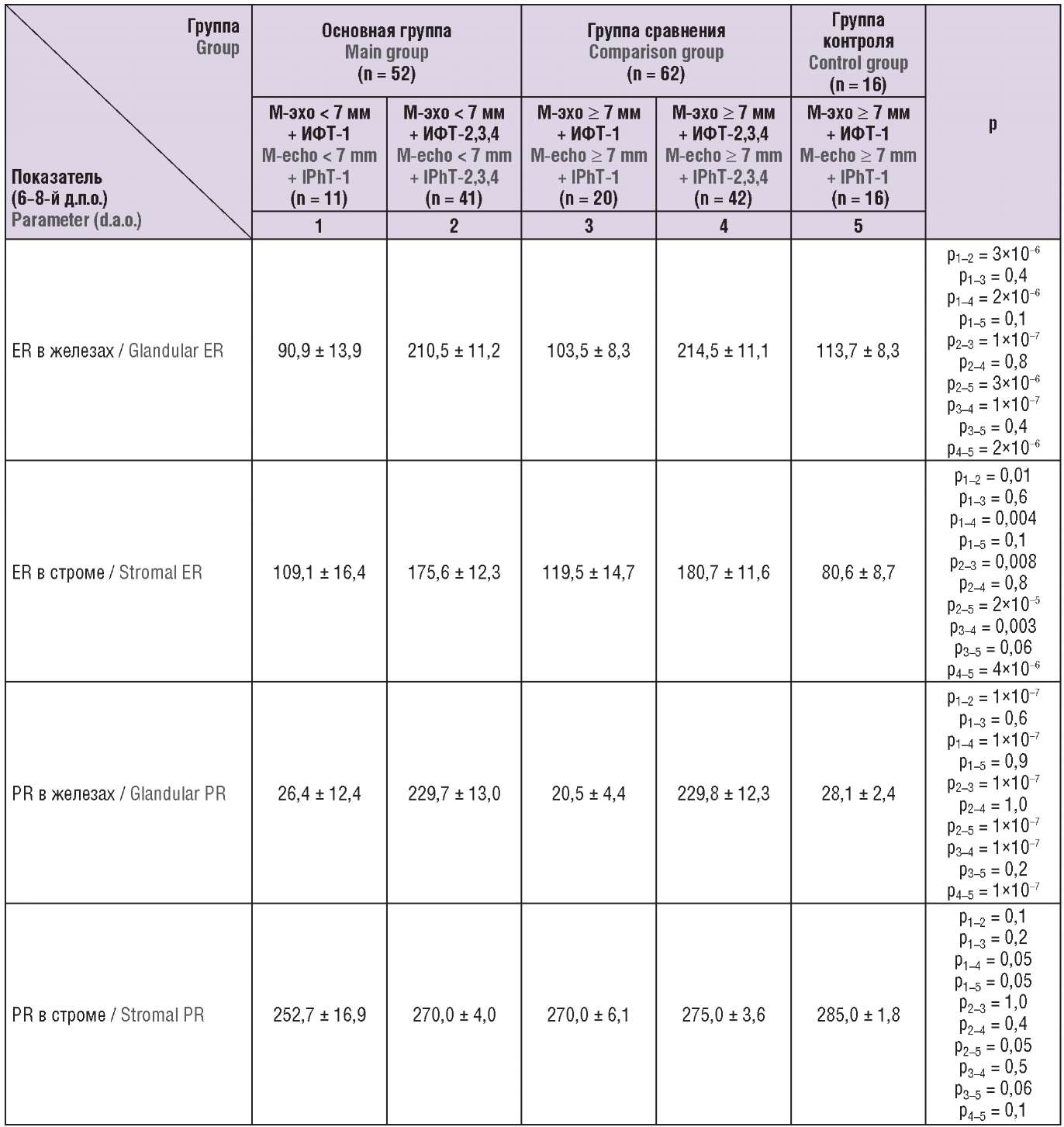
Примечание: ИФТ – иммунофенотип; д.п.о. – день после овуляции.
Note: IPhT – immunophenotype; d.а.o. – the day after ovulation.
ОБСУЖДЕНИЕ / DISCUSSION
В литературных источниках описано, что отличная от нормальной толщина эндометрия может быть прогностическим фактором для успеха/неудачи наступления и исхода беременности [6][16]. Эндометрий, толщина которого в фолликулярную фазу в преовуляторные дни по данным УЗИ менее 7 мм, считается «тонким», что снижает вероятность наступления беременности [6][15][16]. В то же время в других источниках описаны случаи успешного наступления беременности и при более гипопластическом эндометрии – при его толщине 4–5 мм [24][25]. Подобные противоречивые данные являются основанием для постановки вопроса: каково значение гипопластичного эндометрия в аспекте нарушений эндометриальной рецептивности?
Ведущее значение в успешном наступлении беременности имеет комплекс структурно-функциональных характеристик эндометрия, которые объединены в понятие «рецептивность эндометрия» [5][7][9]. В литературе описано, что для достаточной фазовой трансформации эндометрия важен не только уровень половых гормонов в периферической крови, но и полноценное взаимодействие половых стероидов с эндометриальными рецепторами [21][22]. Известно, что эстрадиол стимулирует новообразование собственных рецепторов, а также рецепторов прогестерона. Прогестерон, в свою очередь, подавляет экспрессию собственных рецепторов и рецепторов эстрадиола [3][7][20][26]. В литературе не описаны гормонально-рецепторные характеристики эндометрия при его толщине менее 7 мм.
Многие исследователи считают, что полноценная секреторная трансформация эндометрия реализуется в большинстве случаев при нормальной толщине эндометрия [27]. Применение в клинической практике иммуногистохимического метода исследования экспрессии рецепторов половых стероидов в эндометрии позволило получить новые данные о влиянии эстрадиола и прогестерона на слизистую оболочку матки, в том числе и при гипопластическом эндометрии [3][10][7][27]. Показано, что для полноценной рецептивности слизистой тела матки важно не абсолютное значение половых стероидов в крови, а их адекватное функциональное взаимодействие со своими ядерными рецепторами [5][7][20].
Мы провели сравнительный анализ показателей счета рецепторов половых стероидных гормонов в эндометрии при различной толщине эндометрия у женщин с репродуктивными дисфункциями неясного генеза в анамнезе и у здоровых женщин без неудач репродукции; также провели более детальный анализ в подгруппах при различных гистологических и гормонально-рецепторных характеристиках эндометрия в соотношении с толщиной слизистой оболочки матки.
В группах женщин с репродуктивными неудачами в анамнезе и у здоровых женщин не было выявлено ассоциаций значений E2 и P в периферической крови (в случае нормоэстрогенемии и овуляторных значений Р) с вариантами рецепторных характеристик эндометрия, а также с толщиной эндометрия.
В нашем исследовании при проведении дополнительного анализа было продемонстрировано отсутствие различий в содержании E2, P в крови, соотношения E2/P при различных морфологических характеристиках эндометрия. Полученные нами результаты согласуются с мнением M.H. Saxtorph с соавт. (2020), которые отметили, что уровни прогестерона в среднюю фазу менструального цикла не коррелировали с характеристиками (гистологическими, иммунологическими) рецептивности эндометрия [28], и с данными G. Barrenetxea с соавт. (2021), которые написали, что определение уровней прогестерона в крови у пациенток не были полезны для прогнозирования рецептивности слизистой оболочки матки [29]. Также полученные в текущем исследовании данные согласуются с результатами наших предыдущих научных работ об отсутствии ассоциаций между значениями уровня среднелютеинового прогестерона и показателями (счет ER, PR) рецепторности (компонент рецептивности) эндометрия [30].
Данные рутинного гистологического исследования биоптатов эндометрия отражают эффекты E2, P с точки зрения фазовой трансформации эндометрия. В то же время определенная субъективность данного объективного метода, а также некоторые противоречия результатов гистологического и иммуногистохимического методов исследования биоптатов эндометрия не позволяют полностью оценить состояние слизистой тела матки у когорты женщин с неясными репродуктивными дисфункциями. При иммуногистохимическом анализе эндометриальных образцов есть возможность получить более глубокую информацию об особенностях гормонально-рецепторных характеристик эндометрия.
При определении счета рецепторов половых стероидов в соотношении с гистологическим заключением было выявлено, что у большинства женщин основной группы и группы сравнения с полноценной секреторной трансформацией эндометрия была соответствующая здоровым женщинам экспрессия рецепторов эстрогенов и прогестерона. Однако в 15 % случаев (2 из 13 женщин) в основной группе и в 35 % случаев (8 из 24 женщин) в группе сравнения в среднесекреторной фазе трансформации эндометрия выявлены показатели счета рецепторов половых стероидов, не соответствующие таковым у женщин контрольной группы, что позволяет при иммуногистохимическом исследовании диагностировать у таких женщин недостаточность лютеиновой фазы на эндометриальном уровне. В ряде случаев у женщин с неполноценной секреторной трансформацией эндометрия по данным гистологического заключения (1 % женщин в основной группе и 10 % женщин в группе сравнения) были показатели экспрессии ER, PR как у здоровых женщин из группы контроля.
Изолированный гистологический метод исследования эндометриальных биоптатов является рутинным методом исследования эндометрия при репродуктивных дисфункциях, но в ряде случаев этих данных недостаточно для детального понимания рецепторных характеристик эндометрия, особенно в случае репродуктивных неудач неясного генеза. Именно сочетанное морфологическое (гистологическое и иммуногистохимическое) исследование биоптатов эндометрия создает более ясное представление о рецепторности эндометрия.
Мы выявили, что и при «тонком» эндометрии возможны нормальные гормонально-рецепторные взаимодействия в слизистой оболочке матки, хотя это встречается в 1,5 раза (на 50 %) реже, чем при нормальной толщине эндометрия: 21 % случаев (у 11 из 52 женщин) в основной группе и 32 % (у 20 из 62 женщин) в группе сравнения. Таким образом, в исследованной когорте женщин у каждой пятой участницы с «тонким» эндометрием показатели экспрессии ER и PR соответствовали таковым у здоровых женщин без репродуктивных неудач. В то же время две трети женщин в исследованных когортах с репродуктивными дисфункциями имели неполноценные гормонально-рецепторные характеристики эндометрия. Значения экспрессии ER, PR в этих случаях не имели достоверных различий в зависимости от толщины эндометрия. Подобных сведений в специальной литературе мы не обнаружили.
В целом, по результатам проведенного нами исследования отмечено, что толщина эндометрия по данным УЗИ в преовуляторный период не является наиважнейшей характеристикой эндометрия. Иммуногистохимический метод оценки экспрессии ER, PR предоставляет более детальные сведения об эндометрии, чем сочетанные ультразвуковые и гистологические данные. Сам по себе гипопластический эндометрий без анамнеза репродуктивных дисфункций не является показанием для углубленного исследования его биоптатов. Именно анамнез нарушения реализации репродуктивной функции (в том числе анамнез привычного невынашивания беременности ранних сроков) является основанием для более детального изучения эндометриальных образцов. Это соответствует рекомендациям ESHRE [2].
ЗАКЛЮЧЕНИЕ / CONCLUSION
Толщина эндометрия не является характеристикой, безусловно определяющей особенности рецептивности эндометрия. При «тонком» эндометрии (< 7 мм на 11–13-й день по данным УЗИ при длительности менструального цикла 28–30 дней) возможны рецепторные характеристики слизистой тела матки, сходные с таковыми у женщин без репродуктивных неудач (по результатам данного исследования – в 21 % случаев). В то же время нормальные гормонально-рецепторные взаимодействия при гипопластическом эндометрии отмечены в 1,5 раза (на 50 %) реже, чем при нормальной толщине эндометрия у женщин с репродуктивными дисфункциями в анамнезе. Таким образом, «тонкий» эндометрий предопределяет бóльший процент женщин с нарушениями гормонально-рецепторного статуса эндометрия, но не является абсолютным признаком нарушений эндометриальной рецепторности. Сочетанное (гистологическое и иммуногистохимическое) исследование биоптатов эндометрия позволяет оценить соответствие гормонально-рецепторных характеристик слизистой оболочки матки (как компонента эндометриальной рецептивности) таковым у здоровых женщин.
Список литературы
1. Клинические рекомендации. Женское бесплодие (первичное и вторичное). 2021–2022–2023 (24.06.2021). М.: Министерство здравоохранения Российской Федерации, 2021. 50 с. Режим доступа: https://moniiag.ru/wp-content/uploads/2019/07/Klinicheskie-rekomendatsii.-ZHenskoe-besplodie.pdf.
2. ESHRE Guideline Group on RPL; Atik R.B, Christiansen O.B., Elson J. et al. ESHRE guideline: recurrent pregnancy loss. Hum Reprod Open. 2018;2018(2):hoy004. https://doi.org/10.1093/hropen/hoy004.
3. Аганезов С.С., Пономаренко К.Ю., Мороцкая А.В., Аганезова Н.В. Экспрессия стероидных рецепторов в эндометрии у женщин с нарушениями в репродуктивной системе. Wschodnioeuropejskie Czasopismo Naukowe. 2016;12(1):90–3.
4. Лещенко О.Я. Хронический эндометрит и репродуктивные нарушения: версии и контраверсии. Бюллетень сибирской медицины. 2020;19(3):166–76. https://doi.org/10.20538/1682-0363-2020-3-166-176.
5. Пономаренко К.Ю. Характеристика гормон-рецепторного аппарата эндометрия у женщин с нарушениями репродуктивной функции: Автореф. дис… канд. мед. наук. Санкт-Петербург, 2018. 25 с.
6. Оразов М.Р., Радзинский В.Е., Хамошина М.Б. и др. Тайны репродуктивных неудач: «тонкий» эндометрий. Оперативная гинекология. 2018;(2):7–17.
7. Кузьмина А.В. Характеристика протеомного уровня рецептивности эндометрия у женщин с нарушениями репродуктивной функции: Автореф. дис… канд. мед. наук. Санкт-Петербург, 2020. 24 с.
8. Попова М.В., Луцик В.В., Рыкова Д.В. и др. Тонкий эндометрий как причина репродуктивных потерь и неудачных попыток ЭКО (обзор литературы). Медико-социальные проблемы семьи. 2020;25(1):86–9.
9. Paulson R.J. Introduction: Endometrial receptivity: evaluation, induction and inhibition. Fertil Steril. 2019;111(4):609–10. https://doi.org/10.1016/j.fertnstert.2019.02.029.
10. Dvoran M., Vodieka J. Implantation and diagnostics of endometrial receptivity. Ceska Gynekol. 2018;83(4):291–8.
11. Fox C., Morin S., Jeong J.W. et al. Local and systemic factors and implantation: what is the evidence? Fertil Steril. 2016;105(4);873–84. https://doi.org/10.1016/j.fertnstert.2016.02.018.
12. МороцкаяА.В. Молекулярные факторы рецептивности эндометрия. Журнал акушерства и женских болезней. 2017;66S:128–9.
13. Onogi S., Ezoe K., Nishihara S. et al. Endometrial thickness on the day of the LH surge: an effective predictor of pregnancy outcomes after modified natural cycle-frozen blastocyst transfer. Hum Reprod Open. 2020;2020(4):hoaa060. https://doi.org/10.1093/hropen/hoaa060.
14. Bu Z., Hu L., Yang X., Sun Y. Cumulative live birth rate in patients with thin endometrium: a real-world single-center experience. Front Endocrinol (Lausanne). 2020;11:469. https://doi.org/10.3389/fendo.2020.00469.
15. Xi J., Cheng J., Jin C.C. et al. Electroacupuncture improves pregnancy outcomes in rats with thin endometrium by promoting the expression of pinopode related molecules. Biomed Res Int. 2021;2021:6658321. https://doi.org/10.1155/2021/6658321.
16. Mouhayar Y., Franasiak J.M, Sharara F.I. Obstetrical complications of thin endometrium in assisted reproductive technologies: a systematic review. J Assist Reprod Genet. 2019;36(4):607–11. https://doi.org/10.1007/s10815-019-01407-y.
17. Zhang J., Sun Y.F., Xu Y.M. et al. Effect of endometrium thickness on clinical outcomes in luteal phase short-acting GnRH-a long protocol and GnRH-Ant protocol. Front Endocrinol (Lausanne). 2021;12:578783. https://doi.org/10.3389/fendo.2021.578783.
18. Luo X., Li Y., Zheng H. et al. Thicker endometrium on hCG trigger day improves the live birth rate of fresh cleavage embryo transfer in GnRH-agonist regimen of normogonadotrophic women. Ann Transl Med. 2021;9(10):856. https://doi.org/10.21037/atm-21-1922.
19. Karavani G., Alexandroni H., Sheinin D. et al. Endometrial thickness following early miscarriage in IVF patients – is there a preferred management approach? Reprod Biol Endocrinol. 2021;19(1):93. https://doi.org/10.1186/s12958-021-00780-7.
20. Мелкозерова О.А., Башмакова Н.В., Есарева А.В. Проблемы коммуникации эмбриона и эндометрия: маркеры нарушений и механизмы влияния. Российский вестник акушера-гинеколога. 2016;16(5):29–36. https://doi.org/10.17116/rosakush201616529-36.
21. Пономаренко К.Ю. Рецептивность эндометрия у женщин с нарушениями в репродуктивной системе. Журнал акушерства и женских болезней. 2017;66(4):90–7. https://doi.org/10.17816/JOWD66490-97.
22. Аганезов С.С., Эллиниди В.Н., Пономаренко К.Ю. и др. Особенности гормон-рецепторного взаимодействия в эндометрии при овуляторном менструальном цикле у женщин с нарушением репродуктивной функции. Вестник Российской военно-медицинской академии. 2018;(2):63–7. https://doi.org/10.17816/brmma12236.
23. Пальцев М.А., Кветной И.М., Полякова В.О. и др. Молекулярные аспекты эндометриальной дисфункции. В кн: Молекулярная морфология и прикладные аспекты нейроиммуноэндокринологии. М.: АО «Шико», 2015:239–52.
24. Sundstrom P. Establishment of a successful pregnancy following in-vitro fertilization with an endometrial thickness of no more than 4 mm. Human Reprod. 1998;13(6):1550–2. https://doi.org/10.1093/humrep/13.6.1550.
25. Check J.H., Dietterich C., Check M.L., Katz Y. Successful delivery despite conception with a maximal endometrial thickness of 4 mm. Clin Exp Obstet Gynecol. 2003;30(2–3):93–4.
26. Аганезов С.С., Эллиниди В.Н., Мороцкая А.В. и др. Особенности эндометриальной экспрессии лейкемия-ингибирующего фактора у женщин с различным эстроген-прогестерон-рецепторным статусом эндометрия. Акушерство, Гинекология и Репродукция. 2019;13(2):85–94. https://doi.org/10.17749/2313-7347.2019.13.2.085-094.
27. Gao M., Cao C., Zhang X. et al. Abnormal expression of estrogen receptor is associated with thin endometrium. Gynecol Endocrinol. 2019;35(6):544–47. https://doi.org/10.1080/09513590.2018.1554035.
28. Saxtorph M.H., Persson G., Hallager T. et al. Are different markers of endometrial receptivity telling us different things about endometrial function? Am J Reprod Immunol. 2020;84(6):e13323. https://doi.org/10.1111/aji.13323.
29. Barrenetxea G., Romero I., Celis R. et al. Correlation between plasmatic progesterone, endometrial receptivity genetic assay and implantation rates in frozen-thawed transferred euploid embryos. A multivariate analysis. Eur J Obstet Gynecol Reprod Biol. 2021;263:192–97. https://doi.org/10.1016/j.ejogrb.2021.05.047.
30. Аганезов С.С., Кузьмина А.В., Эллиниди В.Н. и др. Экспрессия рецепторов эстрогенов и прогестерона в эндометрии у женщин с нарушениями репродуктивной функции при различной функциональной активности желтого тела яичника. Гинекология. 2021;23(6):516–23. https://doi.org/10.26442/20795696.2021.6.201068.
Об авторах
Н. В. АганезоваРоссия
д.м.н., профессор кафедры акушерства и гинекологии
SPIN: 2961-5377
191015 Санкт-Петербург, Кирочная ул., д. 41
С. С. Аганезов
Россия
к.м.н., доцент кафедры акушерства и гинекологии
SPIN: 8186-6778
191015 Санкт-Петербург, Кирочная ул., д. 41
К. Э. Гогичашвили
Россия
аспирант кафедры акушерства и гинекологии
SPIN: 8683-2954
191015 Санкт-Петербург, Кирочная ул., д. 41
Рецензия
Для цитирования:
Аганезова Н.В., Аганезов С.С., Гогичашвили К.Э. Характеристики рецептивности эндометрия у женщин с различной толщиной эндометрия. Акушерство, Гинекология и Репродукция. 2022;16(2):108-121. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.303
For citation:
Aganezova N.V., Aganezov S.S., Gogichashvili K.E. Characteristics of endometrial receptivity in women with different endometrial thickness. Obstetrics, Gynecology and Reproduction. 2022;16(2):108-121. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.303

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































