Перейти к:
Оценка факторов риска и прогнозирование преждевременной недостаточности яичников
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2021.273
Аннотация
В настоящее время проблема преждевременной недостаточности яичников (ПНЯ) находится в эпицентре внимания акушеров-гинекологов во всем мире. Ранняя диагностика данной патологии необходима для предупреждения развития серьезных патологических состояний. Систематизация современных представлений о лабораторных, инструментальных методах диагностики ПНЯ, оценка диагностической ценности таких показателей, как фолликулостимулирующий гормон, антимюллеров гормон, а также подсчет антральных фолликулов яичников, определение интраовариального кровотока, объема яичников с помощью методик ультразвуковой диагностики, которые в дальнейшем можно использовать в качестве прогностических критериев ПНЯ, является чрезвычайно важным направлением. На основании полученных данных раннее выявление ПНЯ может привести к созданию новых прогностических стратегий.
Ключевые слова
Для цитирования:
Ткаченко Л.В., Гриценко И.А., Тихаева К.Ю., Свиридова Н.И., Гаврилова И.С., Долгова В.А. Оценка факторов риска и прогнозирование преждевременной недостаточности яичников. Акушерство, Гинекология и Репродукция. 2022;16(1):73-80. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2021.273
For citation:
Tkachenko L.V., Gritsenko I.A., Tikhaeva K.Yu., Sviridova N.I., Gavrilova I.S., Dolgova V.A. Assessment of risk factors and prediction of premature ovarian failure. Obstetrics, Gynecology and Reproduction. 2022;16(1):73-80. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2021.273
Введение / Introduction
Согласно руководству Европейского общества репродукции человека и эмбриологии (англ. European Society of Human Reproduction and Embryology, ESHRE), преждевременная недостаточность яичников (ПНЯ) является симптомокомплексом, проявляющимся олиго/аменореей более 4 мес и уровнем фолликулостимулирующего гормона (ФСГ) свыше 25 МЕ/мл у женщин в возрасте до 40 лет [1]. ПНЯ – это актуальная проблема для женщин всего мира. По результатам последнего масштабного исследования, распространенность ПНЯ значительна, увеличивается с 0,01 % (в возрасте до 20 лет) до 1,0 % (у лиц старше 30 лет) и составляет 3,7 % среди женщин в постменопаузе [2][3].
Среди причин ПНЯ выделяют [2][4]:
- генетические аномалии (мутации в генах BMP-15 и DIAPH2, FMR1 Х-хромосомы, аутосомные нарушения в генах GDF9, ESR1, NOBOX, FSHR, LHR, FSH, GALT, AIRE, NOGGIN, CYP19A1, FOXL2);
- метаболические нарушения (галактоземия, вызванная недостатком галактозо-1-фосфат уридилтрансферазы);
- воздействие токсических веществ (полициклических ароматических углеводородов, бисфенола-А, фталатов);
- химиотерапевтическое лечение, операции на органах малого таза;
- вирусные агенты.
У пациенток с ПНЯ чаще возникают сердечно-сосудистые заболевания, диабет 2-го типа и остеопороз. В связи с этим особенно важна своевременная диагностика патологии и выявление факторов, свидетельствующих о высоком риске возникновения ПНЯ.
Следует отметить, что в Российской Федерации на данный момент не разработаны клинические рекомендации по ведению пациенток с ПНЯ.
Диагностика преждевременной недостаточности яичников / Diagnostics of premature ovarian failure
Существуют достоверные критерии диагностики ПНЯ и снижения овариального резерва: лабораторные и инструментальные тесты.
Лабораторные методы диагностики преждевременной недостаточности яичников / Laboratory methods for diagnostics of premature ovarian failure
Диагноз ПНЯ устанавливается на основании результатов изучения уровня ФСГ. Рекомендовано проведение двух исследований с интервалом не менее 4 мес. По рекомендациям ESHRE, достоверным считается показатель ФСГ < 25 МЕ/мл и до 40 МЕ/мл – уровня, соответствующего менопаузе [1][5]. Для подтверждения диагноза в зависимости от жалоб пациенток, личного и семейного анамнеза рекомендовано проводить дифференциальную диагностику с заболеваниями:
- щитовидной железы – определяя содержание тиреотропного гормона, свободного тироксина, антител к тиреоидной пероксидазе;
- гиперпролактинемией – оценивают уровень пролактина;
- врожденной гиперплазией коры надпочечников – определяют свободную фракцию тестостерона, кортизол, 17-ОН прогестерон;
- формами синдрома поликистозных яичников (СПКЯ).
Определение уровня ФСГ является проверенным методом, однако и он имеет ряд недостатков: чувствителен только на стадии значительного снижения овариального резерва, зависит от применяемой гормональной терапии, дает ложноположительный результат при опухолях гипофиза, изменяется в соответствии с циклическими и суточными колебаниями [6]. В связи с этим оценка только уровня ФСГ не всегда эффективна, поэтому в современной клинической практике все чаще исследуют антимюллеров гормон (АМГ).
Антимюллеров гормон – это гликопротеид, синтезирующийся в гранулезных клетках преантральных и антральных фолликулов яичника. Выработка АМГ начинается на 36-й неделе развития плода, увеличивается в подростковом возрасте и приблизительно в 25 лет достигает максимума, а затем снижается в течение всей жизни и практически не обнаруживается в период менопаузы [7].
АМГ принимает участие в регуляции фолликулогенеза и через уменьшение экспрессии факторов роста оказывает стимулирующее воздействие на фолликулы. Уровень АМГ является показателем овариального резерва женщины, его возможно определять в любой день менструального цикла, так как он вырабатывается в фолликулах без рецепторов к ФСГ и относительно независим от количества экспрессируемых гонадотропинов [8].
При оценке результатов исследования уровня АМГ необходимо учитывать, что этот показатель повышается при СПКЯ и понижается при приеме комбинированных оральных контрацептивов, перенесенных оперативных вмешательствах на органах малого таза. Также снижение уровня АМГ отмечается при мутации гена рака молочной железы 1 (англ. breast cancer 1, BRCA1) и премутации гена FMR1 [8]. Оценка АМГ ограничивается сравнительно высокой стоимостью проведения анализа.
Прогностическая ценность АМГ доказана в результате исследования X. Jiao с соавт. Подтверждено, что уровень АМГ, ингибина В, ФСГ и количество антральных фолликулов возможно использовать в качестве чувствительных маркеров на ранней клинической стадии снижения овариального резерва. Сывороточный АМГ вместе с числом антральных фолликулов обладает высокой чувствительностью и специфичностью и на данный момент является наиболее надежным показателем [9]. Также возможность изучения уровня АМГ в качестве маркера оккультной формы ПНЯ доказана в ходе исследования исследователей под руководством Л.А. Марченко, в результате которого были выявлены следующие критерии постановки диагноза: показатель АМГ ниже возрастной нормы и обнаружение аномального числа СGG-повторов в гене FMR1 [8].
Уровень АМГ используется не только для диагностики ПНЯ, но и признан достоверным маркером старения яичников, может быть использован в качестве лабораторного критерия прогноза наступления менопаузы. Согласно исследованию И.И. Гузова с соавт. установлены следующие нормы уровня АМГ для женщин в соответствии с возрастом [10]:
- 18–25 лет – 0,47–11,17 нг/мл;
- 26–30 лет – 0,52–11,03 нг/мл;
- 31–35 лет – 0,05–11,61 нг/мл;
- 36–40 лет – 0,03–6,60 нг/мл;
- 41–45 лет – 0,00–3,27 нг/мл;
- 46 лет и более – 0,00–1,15 нг/мл.
Инструментальные методы диагностики преждевременной недостаточности яичников / Instrumental methods for diagnostics of premature ovarian failure
Оценка антральных фолликулов / Assessment of antral follicles
Самым распространенным инструментальным методом выявления ПНЯ является трансвагинальный ультразвуковой подсчет количества антральных фолликулов. Это неинвазивное, легко выполняемое обследование, которое может быть использовано для оценки резерва каждого яичника отдельно.
Многие исследования подтвердили прогностическую ценность изучения антральных фолликулов и сывороточного АМГ. Преимущество ультразвукового исследования (УЗИ) перед лабораторным исследованием заключается в возможности одновременно с подсчетом антральных фолликулов оценить структуру яичников, маточных труб и матки, выявить возможные патологии. Если проведение инструментальной диагностики затруднено, то измерение АМГ может оценить овариальный резерв.
При УЗИ, как правило, оценивают антральные фолликулы диаметром 2–10 мм. Частично фолликулы меньшего размера тоже могут быть обнаружены во время осмотра. Однако их включение в общий подсчет остается спорным, и в большинстве случаев они не учитываются [11]. Также есть мнение, что истинный овариальный резерв возможно определить, оценивая фолликулы диаметром 5–6 мм, но их дифференциация увеличивает время исследования и не подкрепляется доказательной базой [12].
Для выполнения исследования используются 2Dи 3D-режимы. При 2D-УЗИ подсчет антральных фолликулов проводят в режиме реального времени или на сохраненных записях. При 3D-УЗИ наиболее распространен подсчет вручную, но также возможно применение автоматического расчета на основе сонографии (Voluson E6, Healthcare, США) [12].
В результате УЗИ оценивают количество антральных фолликулов. На данный момент международный стандарт не разработан. В среднем нормой считают 3–8 антральных фолликулов в каждом яичнике. Также количество антральных фолликулов менее 4 свидетельствует о повышенном риске наступления менопаузы в течение 7 лет [13].
Определение интраовариального кровотока / Determination of intraovarian blood flow
Овариальный резерв женщины зависит от интраовариального кровотока. Окклюзия сосудов и вызванное этим гипоксическое повреждение яичников является ранним маркером преждевременного снижения овариального резерва. В связи с этим важна своевременная диагностика интраовариального кровотока. Интенсивность васкуляризации оценивается с помощью 3D-эхографической энергетической доплерометрии. Однако существенный недостаток данного метода – высокая стоимость диагностики, в связи с чем исследование не распространено.
Также в клинической практике используют трансвагинальное УЗИ в 2D-режиме в сочетании с цветовым доплеровским картированием. Данное исследование не дает точного результата. Определяемый пульсационный индекс (ПИ) и индекс резистентности (ИР) могут быть в пределах нормы при сниженном овариальном резерве.
Р.Е. Игнатьевой с соавт. предложен способ, при котором на 3–5-й день менструального цикла проводится цветовое доплеровское картирование кровотока артерий стромы яичников, при этом измеряется соотношение ПИ и ИР для каждого яичника отдельно. В норме это значение менее 1,8; если результат больше, диагностируют снижение овариального резерва [14].
Оценка объема яичников / Ovarian volume assessment
Оценка объема яичников с помощью трансвагинальной ультразвуковой диагностики является методом исследования овариального резерва. Это простое исследование, однако его проведение не должно исключать оценку лабораторных критериев диагностики ПНЯ, данных анамнеза и инструментальных методов. При оценке измерения объема яичников необходимо учитывать, что данный показатель увеличивается при СПКЯ и уменьшается при приеме оральных контрацептивов [15].
Важно отметить, что определение интраовариального кровотока и объема яичников не рекомендованы ESHRE в рамках оценки овариального резерва.
Критерии прогнозирования преждевременной недостаточности яичников / Criteria for predicting premature ovarian failure
Если в отношении критериев диагностики ПНЯ существуют четкие рекомендации, то в отношении прогноза рисков ПНЯ и сроков истощения яичников таковые отсутствуют.
Результаты многих исследований доказали наличие семейного характера случаев ПНЯ у близких родственниц. Раннее развитие менопаузы у матери, бабушки, сестры, тети связано с 6-кратным увеличением риска ПНЯ [16, 17].
При изучении анамнеза пациентов с ПНЯ частыми являются случаи образования функциональных кист в подростковом и юношеском возрасте. Снижение овариального резерва зависит от клинического течения ПНЯ: при осложненном варианте отмечается большее уменьшение количества антральных фолликулов, объема яичников [18].
При сборе индивидуального анамнеза значимо изучение заболеваний репродуктивной и нерепродуктивных систем.
Заболевания репродуктивной системы / Diseases of the reproductive system
Распространенной патологией среди женщин репродуктивного возраста являются функциональные кисты яичников. Одним из вариантов лечения является эндоскопическая цистэктомия. В недавнем исследовании проводилась оценка овариального резерва женщин, перенесших лапароскопическую цистэктомию. Выявлено, что наибольшее снижение овариального резерва характерно для пациенток с осложненным течением заболевания или повторными оперативными вмешательствами на органах малого таза [18]. В связи с этим можно предположить, что развитие функциональных кист яичников является фактором развития ПНЯ.
Неоднозначное мнение складывается в отношении изменения овариального резерва при СПКЯ. Согласно исследованию А.К. Ahmad с соавт., у женщин с СПКЯ обнаруживаются более высокие исходные значения
всех маркеров овариального резерва (сывороточный АМГ, число антральных фолликулов яичников, объем яичников) по сравнению с контрольной группой. В то же время у пациенток с СПКЯ выявлен более быстрый темп снижения уровня АМГ и замедленное снижение объема яичников, существенного различия в снижении активных форм кислорода по сравнению с контрольной группой не обнаружено [19]. Полученные данные ставят под сомнение отсутствие корреляции между СПКЯ и развитием ПНЯ.
В работе M.L Pan с соавт. выяснено, что частота встречаемости ПНЯ у лиц с СПКЯ составляет 3,73 % против 0,44 % у женщин без этой патологии. В связи с этим авторы предлагают рассматривать СПКЯ как начальную стадию развития ПНЯ [20]. Противоречивость результатов исследований взаимосвязи СПКЯ и ПНЯ показывает необходимость более детального изучения данной проблемы.
Заболевания нерепродуктивных систем / Diseases of the non-reproductive systems
Многие заболевания аутоиммунного характера можно рассматривать в качестве фактора развития ПНЯ. В исследовании G.R.V. Ferreira с соавт. оценена зависимость наступления ПНЯ у лиц с диагнозом «ювенильный идиопатический артрит» (ЮИА). Обнаружено снижение уровня АМГ, что позволяет говорить о зависимости овариального резерва от развития ЮИА [21]. В исследовании B. Grossmann с соавт. выявлено, что болезнь Хашимото – самая распространенная аутоиммунная патология, ассоциированная с ПНЯ, и наблюдается у 32,7 % обследованных женщин [22].
Существенную распространенность в структуре заболеваний, наблюдаемых при ПНЯ, имеет аутоиммунный полигландулярный синдром (АПС) 3-го типа. Для данной патологии характерно сочетание ПНЯ, болезни Хашимото и недостаточности коры надпочечников. АПС был выявлен в 33,7 % случаев [23].
На рисунке 1 приведена схема, в которой отражены перспективные направления для улучшения качества медицинской помощи пациентам с ПНЯ.
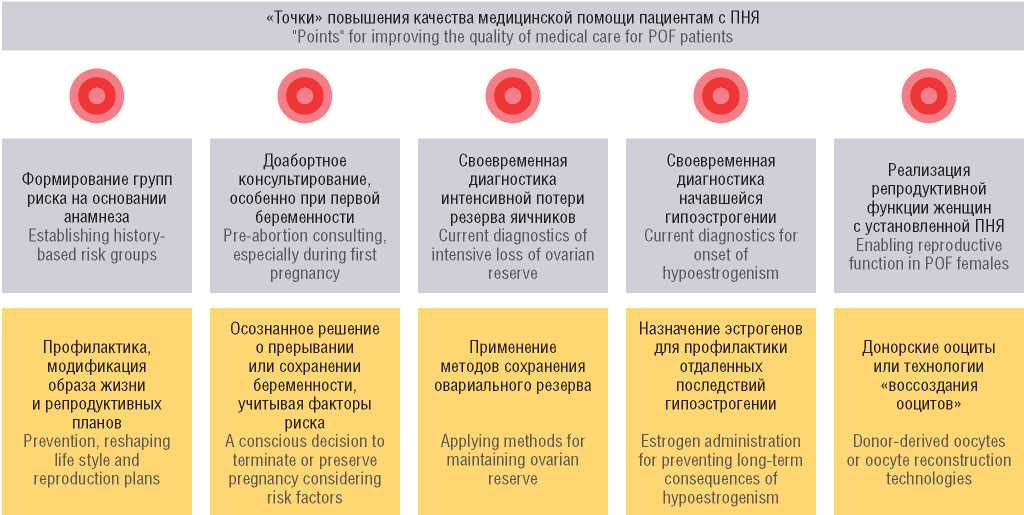
Рисунок 1. Перспективы повышения качества медицинской помощи пациентам с преждевременной недостаточностью яичников (ПНЯ) [рисунок авторов].
Figure 1. Perspectives to increase quality of medical care for patients with premature ovarian failure (POF) [drawn by authors].
Заключение / Conclusion
Раннее выявление ПНЯ может привести к созданию новых прогностических стратегий, а также к разработке алгоритмов ведения пациенток с данной патологией и сохранению здоровья женщины, предотвращая развитие серьезных заболеваний сердечно-сосудистой, опорно-двигательной, эндокринной систем. Поэтому необходима идентификация факторов риска и разработка критериев предикции ПНЯ.
Наличие факторов высокого риска развития ПНЯ у пациентки должно являться показанием для детальной оценки овариального резерва с применением имеющихся лабораторных и инструментальных методов, что позволит выработать тактику дальнейшего наблюдения или своевременного вмешательства.
Информированность женщины о наличии у нее риска ПНЯ позволит ей осознанно избегать дополнительных негативных влияний (курения, алкоголя, стресса), принимать обоснованное решение о репродуктивных планах и их сроках, а возможно, прибегнуть к применению методов криоконсервации ооцитов в том случае, если риски ПНЯ чрезвычайно высоки.
На наш взгляд, немаловажной является возможность оценки овариального резерва у женщин, планирующих прервать первую беременность. Информированность о наличии рисков ПНЯ может повлиять на решение женщины о сохранении беременности.
Оценка факторов риска и при необходимости оценка овариального резерва должны стать частью диспансеризации женщины от менархе до достижения возраста физиологической менопаузы.
Список литературы
1. European Society for Human Reproduction and Embryology (ESHRE) Guideline Group on POI; Webber L., Davies M., Anderson R. et al. ESHRE Guideline: management of women with premature ovarian insufficiency. Hum Reprod. 2016;5(31):926–37. https://doi.org/10.1093/humrep/dew027.
2. Cordts E.B., Christofolini D.M., Dos Santos A.A. et al. Genetic aspects of premature ovarian failure: a literature review. Arch Gynecol Obstet. 2011;283(3):635–43. https://doi.org/10.1007/s00404-010-1815-4.
3. Golezar S., Ramezani Tehrani F., Khazaei S. et al. The global prevalence of primary ovarian insufficiency and early menopause: a meta-analysis. Climacteric. 2019;22(4):403–11. https://doi.org/10.1080/13697137.2019.1574738.
4. Panay N., Anderson R.A., Nappi R.E. et al. Premature ovarian insufficiency: an International Menopause Society White Paper. Climacteric. 2020;23(5):426–46. https://doi.org/10.1080/13697137.2020.1804547.
5. Nguyen H.H., Milat F., Vincent A. Premature ovarian insufficiency in general practice: meeting the needs of women. Aust Fam Physician. 2017;46(6):360–6.
6. Салимова М.Д., Наделяева Я.Г., Данусевич И.Н. Современные представления о клинико-диагностических критериях преждевременной недостаточности яичников (обзор литературы). Acta biomedica scientifica. 2020;5(6):42–50. https://doi.org/10.29413/ABS.2020-5.6.5.
7. Granger E., Tal R. Anti-Müllerian hormone and its predictive utility in assisted reproductive technologies outcomes. Clin Obstet Gynecol. 2019;62(2):238–56. https://doi.org/10.1097/GRF.0000000000000436.
8. Марченко Л.А., Машаева Р.И. Клинико-лабораторные критерии оккультной формы преждевременной недостаточности яичников. Гинекология. 2018;20(6):73–6. https://doi.org/10.26442/20795696.2018.6.180069.
9. Jiao X., Meng T., Zhai Y. et al. Ovarian reserve markers in premature ovarian insufficiency: within different clinical stages and different etiologies. Front Endocrinol (Lausanne). 2021;12:601752. https://doi.org/10.3389/fendo.2021.601752.
10. Гузов И.И., Печерина Е.Ю., Ружанская А.В. и др. Определение референтных интервалов антимюллерова гормона, специфичных для российской популяции. Лабораторная служба. 2019;8(2):25–35. https://doi.org/10.17116/labs2019802125.
11. Martins W.P., Jokubkiene L. Assessment of the functional ovarian reserve. In: Managing Ultrasonography in Human Reproduction. Eds. S. Guerriero, J.L. Alcazar, W.P. Martins. Springer International Publishing, 2016. 3–12. https://doi.org/10.1007/978-3-319-41037-1_1.
12. Coelho Neto M.A., Ludwin A., Borrell A. et al. Counting ovarian antral follicles by ultrasound: a practical guide. Ultrasound Obstet Gynecol. 2018;51(1):10–20. https://doi.org/10.1002/uog.18945.
13. Depmann M., Broer S.L., van der Schouw Y.T. et al. Can we predict age at natural menopause using ovarian reserve tests or mother’s age at menopause? A systematic literature review. Menopause. 2016;23(2):224– 32. https://doi.org/10.1097/GME.0000000000000509.
14. Игнатьева Р.Е., Густоварова Т.А., Дмитриева Е.В. Способ оценки состояния овариального резерва яичников. Патент РФ № 2646572 C1, 05.03.2018. Бюл. № 7. 9 с. Режим доступа: https://patents.s3.yandex.net/RU2646572C1_20180305.pdf.
15. Agarwal A., Agarwal S., Verma A., Shukla R.C. Total basal ovarian volume as a marker of ovarian reserve: myth or reality. J Clin Diagn Res. 2018;12(2):TC13–TC16. https://doi.org/10.7860/JCDR/2018/31482.11211.
16. Moreau J., Gatimel N., Cohade C. et al. Mother's age at menopause but not own age at menarche has an impact on ovarian reserve. Gynecol Endocrinol. 2018;34(8):664–5. https://doi.org/10.1080/09513590.2018.1428300.
17. Mishra G.D., Chung H.F., Cano A. et al. EMAS position statement: predictors of premature and early natural menopause. Maturitas. 2019;123:82–8. https://doi.org/10.1016/j.maturitas.2019.03.008.
18. Волченок Д.А., Тихоновская О.А., Петров И.А. и др. Состояние овариального резерва у пациенток с функциональными кистами яичников. Journal of Siberian Medical Sciences. 2019;(1):18–27. https://doi.org/10.31549/2542-1174-2019-1-18-27.
19. Ahmad A.K., Kao C.N., Quinn M. et al. Differential rate in decline in ovarian reserve markers in women with polycystic ovary syndrome compared with control subjects: results of a longitudinal study. Fertil Steril. 2018;109(3):526–31. https://doi.org/10.1016/j.fertnstert.2017.11.012.
20. Pan M.L., Chen L.R., Tsao H.M., Chen K.H. Polycystic ovarian syndrome and the risk of subsequent primary ovarian insufficiency: a nationwide population-based study. Menopause. 2017;24(7):803–9. https://doi.org/10.1097/GME.0000000000000832.
21. Ferreira G.R.V., Tomioka R.B., Aikawa N.E. et al. Ovarian reserve in young juvenile idiopathic arthritis patients. Modern Rheumatology. 2019;29(3):447–51. https://doi.org/10.1080/14397595.2018.1465646.
22. Grossmann B., Saur S., Rall K. et al. Prevalence of autoimmune disease in women with premature ovarian failure. Eur J Contracept Reprod Health Care. 2020;25(1):72–5. https://doi.org/10.1080/13625187.2019.1702638.
23. Szlendak-Sauer K., Jakubik D., Kunicki M. et al. Autoimmune polyglandular syndrome type 3 (APS-3) among patients with premature ovarian insufficiency (POI). Eur J Obstet Gynecol Reprod Biol. 2016;203:61–5. https://doi.org/10.1016/j.ejogrb.2016.05.023.
Об авторах
Л. В. ТкаченкоРоссия
д.м.н., профессор, зав. кафедрой акушерства и гинекологии Института непрерывного медицинского
ифармацевтического образования; научно-исследовательская группа «Репродуктивная медицина и репродуктивная генетика»,
400131 Волгоград, площадь Павших Борцов, д. 1
И. А. Гриценко
Россия
к.м.н., доцент кафедры акушерства и гинекологии Института непрерывного медицинского и фармацевтического образования; научно-исследовательская группа «Репродуктивная медицина и репродуктивная генетика»,
400131 Волгоград, площадь Павших Борцов, д. 1
К. Ю. Тихаева
Россия
к.м.н., доцент кафедры патофизиологии, клинической патофизиологии; научно-исследовательская группа «Репродуктивная медицина и репродуктивная генетика»,
400131 Волгоград, площадь Павших Борцов, д. 1
Н. И. Свиридова
Россия
д.м.н., доцент кафедры акушерства и гинекологии Института непрерывного медицинского и фармацевтического образования; научно-исследовательская группа «Репродуктивная медицина и репродуктивная генетика»,
400131 Волгоград, площадь Павших Борцов, д. 1
И. С. Гаврилова
Россия
к.филос.н., доцент кафедры медико-социальных технологий с курсом педагогики и образовательных технологий дополнительного профессионального образования; научно-исследовательская группа «Репродуктивная медицина и репродуктивная генетика»,
400131 Волгоград, площадь Павших Борцов, д. 1
В. А. Долгова
Россия
студент 4-го курса лечебного факультета; научно-исследовательская группа «Репродуктивная медицина и репродуктивная генетика»,
400131 Волгоград, площадь Павших Борцов, д. 1
Рецензия
Для цитирования:
Ткаченко Л.В., Гриценко И.А., Тихаева К.Ю., Свиридова Н.И., Гаврилова И.С., Долгова В.А. Оценка факторов риска и прогнозирование преждевременной недостаточности яичников. Акушерство, Гинекология и Репродукция. 2022;16(1):73-80. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2021.273
For citation:
Tkachenko L.V., Gritsenko I.A., Tikhaeva K.Yu., Sviridova N.I., Gavrilova I.S., Dolgova V.A. Assessment of risk factors and prediction of premature ovarian failure. Obstetrics, Gynecology and Reproduction. 2022;16(1):73-80. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2021.273

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































