Перейти к:
Металлопротеиназы как биохимические маркеры патологии беременности
https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.275
Аннотация
Успехи современной биологии существенно обогатили представление ученых о патогенетической основе ряда заболеваний, в том числе и в акушерско-гинекологической практике. Несмотря на это, этиология и патогенез некоторых состояний еще не до конца известны. Одним из направлений является изучение металлопротеиназ при беременности, в частности, это касается возникновения такого грозного осложнения, как преэклампсия, диагностика и значения которой постоянно меняются. Преэклампсия – это заболевание, которое приводит к нарушению течения беременности, а иногда даже к летальному исходу матери и/или плода. На данный момент не существует ее специфического лечения, однако ранее прогнозирование имеет решающее значение для более благоприятного исхода матери и плода. Учитывая то, что активность металлопротеиназ способна влиять на инвазию трофобласта и ремоделирование спиральных артерий, знания об этих процессах очень важны.
Для цитирования:
Григорьева К.Н., Бицадзе В.О., Хизроева Д.Х., Третьякова М.В., Блинов Д.В., Макацария Н.А., Цибизова В.И., Накаидзе И.А., Гашимова Н.Р., Грандоне Э., Макацария А.Д. Металлопротеиназы как биохимические маркеры патологии беременности. Акушерство, Гинекология и Репродукция. 2022;16(1):38-47. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.275
For citation:
Grigorieva K.N., Bitsadze V.O., Khizroeva J.Kh., Tretyakova M.V., Blinov D.V., Makatsariya N.A., Tsibizova V.I., Nakaidze I.A., Gashimova N.R., Grandone E., Makatsariya A.D. Metalloproteinases as biochemical markers of pregnancy pathology. Obstetrics, Gynecology and Reproduction. 2022;16(1):38-47. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.275
Введение / Introduction
Металлопротеиназы – это семейство цинк-зависимых эндопептидаз, включающее в себя матриксные металлопротеиназы (ММП), белковые пептидазы ADAM (англ. a disintegrin and metalloproteinase; дезинтегрин и металлопротеиназа) и ADAMTS (англ. a disintegrin and metalloproteinase with trombospondin motifs; дезинтегрин и металлопротеиназа с тромбоспондиновыми мотивами), участвующие в деградации белков внеклеточного матрикса (ВКМ). Последний представляет собой сеть макромолекул, в которой наиболее распространенной молекулой является коллаген. Металлопротеиназы выполняют множество функций: они регулируют активность других протеиназ, факторов роста, хемокинов и клеточных рецепторов, а также могут влиять на такие процессы, как миграция, дифференциация, пролиферация и выживание клеток [1]. На сегодняшний день известно 28 ММП, 21 ADAM и 19 ADAMTS (им присвоены номера от 1 до 20; номер 11 был пропущен, так как было обнаружено, что он уже был внесен в этот перечень ранее под номером 5). Активность металлопротеиназ жестко регулируется протеолитической системой активации и ингибирования, а нарушение ее работы может привести к различным заболеваниям.
Внеклеточный матрикс / Extracellular matrix
Внеклеточный матрикс представляет собой сеть макромолекул, состоящую из множества компонентов: волокон (коллаген, эластин, ламинин и фибронектин), протеогликанов, гликопротеинов и полисахаридов (гиалуроновая кислота), которые регулируют миграцию, рост и дифференцировку клеток [2]. Матриксные металопротеиназы активно участвуют в процессах изменения ВКМ, разрушая его основные структурные компоненты. Для нормальной работы ВКМ необходим баланс между активностью ММП и механизмами ингибирования. Нарушение этого равновесия может привести к различным заболеваниям, таким как онкологические, сердечно-сосудистые и нейродегенеративные заболевания, артрит и фиброзные нарушения [3–9]. ММП в организме ингибируются α2-макроглобулином и семейством тканевых ингибиторов металлопротеиназ (ТИМП) [10]. На данный момент выделяют 4 основных типа ТИМП, при этом они не специфичны для каждой ММП, хотя наблюдается определенная корреляция связывания; так, например, ТИПМ-2 c ММП-2, ТИПМ-1 c ММП-9 [11].
Матриксные металлопротеиназы / Matrix metalloproteinases
Матриксные металлопротеиназы входят в семейство внеклеточных цинк-зависимых эндопептидаз, способных разрушать все типы белков внеклеточного матрикса.
История открытия матриксных металлопротеиназ / A history of discovering matrix metalloproteinases
Впервые ММП были описаны в 1949 г. [12][13] как деполимеризующие ферменты, которые, как предполагалось, способствовали росту опухоли за счет образования стромы соединительной ткани с мелкими более рыхлыми кровеносными сосудами [14]. В 1962 г. J. Gross и С.M. Lapierre выделили коллагеназу ММП, которую охарактеризовали как фермент, ответственный за резорбцию хвоста головастика [15]. На сегодняшний день насчитывается 28 ММП, из них как минимум 23 экспрессируются в тканях человека. ММП включают коллагеназы, желатиназы, стромелизины, матрилизины и ММП мембранного типа [16] (табл. 1).
Таблица 1. Классификация матриксных металлопротеиназ (ММП) [16].
Table 1. Classification of matrix metalloproteinases (MMP) [16].
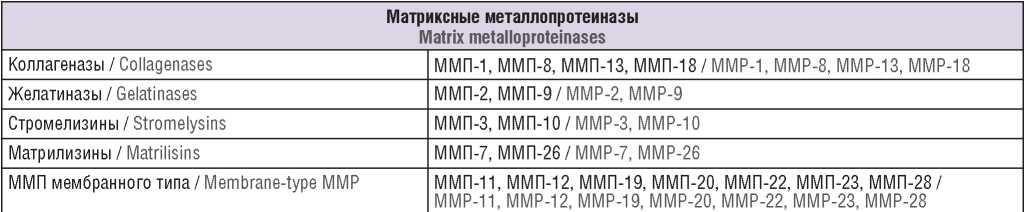
ММП участвуют во многих биологических процессах, таких как восстановление и ремоделирование тканей, эмбриогенез, ангиогенез, пролиферация и миграция клеток, заживление ран, апоптоз, а также они способны влиять на процессы невынашивания беременности и разрастания эндометрия [17–19].
Матриксные металлопротеиназы и беременность / Matrix metalloproteinases and pregnancy
Инвазивное поведение трофобластов обусловлено их способностью секретировать ММП, а строгий баланс между ММП и их ингибиторами способствует нормальному течению беременности. На ранних сроках основную роль в успешной инвазии цитотрофобластов играют желатиназы ММП-2 и ММП-9, так как именно они участвуют в деградации коллагена IV типа, который является основным компонентом базальной мембраны матери [20, 21]. Накопление коллагена приводит к нарушению ремоделирования сосудов и миграции клеток. Активные формы ММП-2 и ММП-9, экспрессируемые клетками плода во время наступления беременности, были обнаружены в плаценте женщин [22], мышей [23], коров [24], овец [25] и кобыл [26].
В 2017 г. M. Laskowska было проведено исследование содержания ММП-2 и ММП-9 у пациенток с развитием клинической картины ранней и поздней преэклампсии (ПЭ). На основании своего исследования автор пришел к выводу, что повышенная концентрация ММП-2 и снижение уровня ММП-9 связаны с развитием ранней и поздней ПЭ [27]. Y. Yu с соавт. также подтвердили, что снижение экспрессии ММП-9 подавляет инвазивные способности трофобластов [28]. Однако N.M. Eleuterio с коллегами показали, что именно увеличение сывороточного содержания ММП-2 и ММП-9 влияет на возникновение ПЭ и исход беременности в целом [29]. Необходимо учитывать, что провоспалительные цитокины и бактериальные протеазы способны индуцировать синтез и секрецию ММП-9 [30]. Повышение концентрации ММП-2 при ПЭ объясняется тем, что ММП-2 способствует изменению функции сосудов за счет расщепления вазоактивных пептидов, что приводит к сужению сосудов и снижению вазодиллятации. М. Montagnana с соавт. отметили, что уровень ММП-9 значительно выше у беременных с физиологической беременностью [31]. В 2011 г. С. Oddsdottir с соавт. в своей статье сообщили об отсутствии изменений ММП-9 у кобыл, однако снижение активности ММП-2 во время беременности, по их мнению, приводило к преждевременным родам [32]. В 2018 г. S. Senapati с соавт. установили, что у пациенток с «криопереносом» частота развития ПЭ статистически ниже, чем у пациенток со «свежим» переносом бластоцисты. При исследовании данного факта они установили, что у пациенток с криопереносом отмечалась повышенная экспрессия ряда генов, в том числе генов, кодирующих ММП-2 [33]. Повышение во время беременности ММП может быть связано и с гормонами (эстрогеном и прогестероном), так как именно эти гормоны усиливают экспрессию ММП-2 и ММП-9 в матке у девственных крыс [34]. На активность ММП также оказывают влияние тканевые ингибиторы металлопротеиназ; так, повышенная активность ТИМП-2 усиленно блокирует МПП-2, тем самым нарушая инвазию цитотрофобластов [35]. ММП способствуют деградации ВКМ, а снижение содержания ММП-2 и ММП-9, как предположили в своем исследовании W. Li и его коллеги, может привести к повышенному отложению коллагена, что может препятствовать росту, пролиферации и миграции клеток и привести к нарушению васкуляризации плаценты [36]. Их теорию также подтвердили G.A. Cabral-Panhego с соавт. [37].
На сегодняшний день нет рекомендаций, доказывающих преимущества оценки ММП у беременных, как предиктора развития ПЭ. Однако дальнейшее изучение этой темы может способствовать более благоприятному исходу у таких пациенток. Определение уровня ММП является достаточно новым и перспективным направлением во всех отраслях медицины. Так, в 2021 г. D.A. de Sousa с коллегами опубликовали интересное исследование, в котором показали, что повышение уровня циркулирующей MMП-9 является одним из предикторов, участвующим в повреждении гематоэнцефалического барьера у пациентов с паренхиматозным поражением головного мозга, возникшего вследствие церебрального венозного тромбоза. Кроме того, они обнаружили, что пациенты, достигшие ранней реканализации, демонстрируют значительно более низкие уровни ММП-9 на 8-й день после начала антикоагулянтной терапии [38].
Металлопротеиназы ADAMTS / ADAMTS metalloproteinases
ADAMTS – дезинтегрин и металлопротеиназа с тромбоспондиновыми мотивами осуществляет множество функций в процессах морфогенеза тканей и воспаления, а также участвует в «построении» сосудов.
Как члены семейства металлопротеиназ, ADAMTS играют важную роль в ремоделировании ВКМ [39]. Ферментативная активность этих протеаз подавляется ТИМП-3 [40]. Впервые гены ADAMTS были открыты в 1997 г. К. Kuno с соавт. у пациентов с раком толстой кишки [41]. Позже выяснилось, что ADAMTS играют активную роль в процессах женской репродуктивной системы [42]. В 2005 г. S. Porter и его коллеги идентифицировали ADAMTS-1, -4, -5, -8 и -9 в матке и плаценте [43]. На сегодняшний день существует несколько исследований, доказывающих участие ADAMTS в процессах имплантации и плацентации. Нарушение регуляции или функциональные изменения ADAMTS зачастую связаны с развитием такого грозного осложнения, как ПЭ [44][45]. M.N. Kalem с соавт. опубликовали свое исследование, в котором показали, что уровень ADAMTS-1, -4, -12 и -13 в пуповинной и материнской крови у пациенток с развившейся ПЭ был ниже по сравнению с контрольной группой [46]. E. Gokdemir с коллегами также отметили снижение уровня ADAMTS-12 в сыворотке крови у пациенток с ПЭ. По их мнению, дефицит ADAMTS-12 способен вызвать дефектную инвазию трофобласта, аномальное ремоделирование спиральных артерий и нарушение развития плаценты [47].
Металлопротеиназа ADAMTS-13 / ADAMTS-13 metalloproteinase
Наверное, самая изученная металлопротеиназа на данный момент – это ADAMTS-13. Как известно, она является важной частью системы гемостаза. В 2001 г. ученые выяснили, что она способна отщеплять фрагменты от мультимерной молекулы фактора фон Виллебранда (vWF) [48][49]. Именно определение взаимоотношения ADAMTS-13/vWF служит основным маркером фактора риска развития тромбозов. У новорожденных детей, как показывают немногочисленные исследования, более высокий уровень vWF, при этом активность ADAMTS-13 значительно ниже [50–53]. У здоровых новорожденных соотношение ADAMTS-13/vWF в норме не приводит к тромбозам, однако это может при воздействии дополнительных факторов риска, таких как гипоксия, сепсис и введение на длительное время внутривенных устройств, привести к осложнениям.
Также ученые полагают, что важным прогностическим маркером служит определение уровня ADAMTS-13 у беременных, так как она играет важную роль при нормальной беременности и патогенезе осложнений, связанных с беременностью. Считается, что ADAMTS-13 способствует инвазии, миграции, пролиферации и формированию трофобласта. S. Aref и H. Goda продемонстрировали, что активность ADAMTS-13 была значительно снижена в группе женщин, находящихся «в положении» с ПЭ, по сравнению со здоровыми беременными и небеременными [54]. Эти результаты согласуются с данными А. Stepanian с соавт., которые утверждали, что низкий уровень активности ADAMTS-13 коррелировал с развитием ПЭ [55]. J. Xiao с коллегами в своем исследовании отметили значительно более низкие уровни ADAMTS-13 в тканях ворсинок плаценты у пациенток с тяжелой ПЭ, чем в контрольной группе. Они полагали, что снижение синтеза и секреции ADAMTS-13 в плацентах пациенток с тяжелой ПЭ может быть связано с гипоксией тканей и ишемией плаценты, вызванной гипертонией [56]. ADAMTS-13 экспрессируется в эндотелии трофобластов и кровеносных сосудов плода. Во время беременности плацента человека синтезирует и секретирует активную протеолитическую ADAMTS-13. В норме ADAMTS-13 вырабатывается на самом высоком уровне в I триместре и постепенно снижается в плазме во II и III триместрах беременности [50].
При многих состояниях отмечается снижение уровня ADAMTS-13 и повышение vWF. Так, например, у больных с сепсисом отмечается снижение ADAMTS-13, что приводит к тромботической микроангиопатии [57][58]. Скорее всего, это связано с воспалением, из-за которого из эндотелия выделяется большое количество vWF, который потребляет и истощает доступную ADAMTS-13. Также отмечено нарушение соотношения ADAMTS-13/vWF у пациентов с острым инфарктом миокарда, ишемическим инсультом и у онкологических больных, у которых возникновение венозной тромбоэмболии приводит к большему количеству летальных исходов [55][59–63]. Пациенты с сепсисом склонны к снижению уровня ADAMTS-13. Чем ниже уровень ADAMTS-13, тем выше риск развития смерти у пациентов с сепсисом и септическим шоком в связи с усугублением выраженности протромботического статуса [64].
Металлопротеиназы ADAM / ADAM metalloproteinases
ADAM – дезинтегрин и металлопротеиназа также относится к семейству цинк-зависимых белковых пептидаз, способных отщеплять внеклеточных фрагмент мембранных белков.
На данный момент имеется очень мало данных, указывающих на роль металлопротеиназ ADAM в развитии осложнений беременности. Известно, что ADAM-12 регулирует миграцию и инвазию трофобласта в матку во время развития плаценты [65][66]. Было проведено несколько исследований, где оценивался уровень ADAM-12 в I триместре беременности. На основании этих данных можно предположить, что ADAM-12 является потенциальным биомаркером плацентарной недостаточности [67–69]. М. Kokozidou и его коллеги в своем исследовании с помощью иммуногистохимического анализа показали, что ADAM-12 присутствовала в слое ворсинчатого трофобласта в плаценте в III триместре беременности [70].
Заключение / Conclusion
Таким образом, металлопротеиназы играют важнейшую роль в патологических процессах, в том числе и в акушерско-гинекологической практике. Металлопротеиназы участвуют в процессе инвазии трофобласта и ремоделировании спиральных артерий, а нарушения имплантации на ранних сроках способны повлиять на течение и исход беременности в целом. Снижение/повышение уровня металлопротеиназ является важным маркером, который может сопутствовать развитию такого грозного осложнения, как преэклампсия: перенесенная преэклампсия способна привести к проблемам со здоровьем в будущем как для матери, так и для плода. Кроме того, немаловажным является определение прогностического значения уровня металлопротеиназ для принятия решения о тактике ведения беременных. Также на сегодняшний день активно проводятся клинические исследования, в которых ингибиторы ММП являются терапевтическими средствами. Необходимы дальнейшие исследования для внедрения данных энзимов в клиническую практику. Мы надеемся, что в будущем оценка уровня металлопротеиназ в ранние сроки беременности и вовремя начатое лечение смогут помочь тысячам женщин пройти один из важнейших этапов их жизни без осложнений.
Список литературы
1. Baker A.H., Edwards D.R., Murphy G. Metalloproteinase inhibitors: biological actions and therapeutic opportunities. J Cell Sci. 2002;115(Pt 19):3719–27. https://doi.org/10.1242/jcs.00063.
2. Liu J., Khalil R.A. Matrix metalloproteinase inhibitors as investigational and therapeutic tools in unrestrained tissue remodeling and pathological disorders. Prog Mol Biol Transl Sci. 2017;148:355–420. https://doi.org/10.1016/bs.pmbts.2017.04.003.
3. Radisky E.S., Raeeszadeh-Sarmazdeh M., Radisky D.C. Therapeutic potential of matrix metalloproteinase inhibition in breast cancer. J Cell Biochem. 2017;118(11):3531–48. https://doi.org/10.1002/jcb.26185.
4. Khalil R.A. Matrix metalloproteinases and tissue remodeling in health and disease: cardiovascular remodeling. Prog Mol Biol Transl Sci. 2017;147:1–308.
5. Singh D., Srivastava S.K., Chaudhuri T.K., Upadhyay G. Multifaceted role of matrix metalloproteinases (MMPs). Front Mol Biosci. 2015;2:19. https://doi.org/10.3389/fmolb.2015.00019.
6. Craig V.J., Zhang L., Hagood J.S., Owen C.A. Matrix metalloproteinases as therapeutic targets for idiopathic pulmonary fibrosis. Am J Respir Cell Mol. 2015;53(5):585–600. https://doi.org/10.1165/rcmb.2015-0020TR.
7. Rivera S., Garcia-Gonzalez L., Khrestchatisky M., Baranger K. Metalloproteinases and their tissue inhibitors in Alzheimer’s disease and other neurodegenerative disorders. Cell Mol Life Sci. 2019;76(16):3167– 91. https://doi.org/10.1007/s00018-019-03178-2.
8. Azevedo A., Prado A.F., Antonio R.C. et al. Matrix metalloproteinases are involved in cardiovascular diseases. Basic Clin Pharmacol Toxicol. 2014;115(4):301–14. https://doi.org/10.1111/bcpt.12282.
9. Mahalanobish S., Saha S., Dutta S., Sil P.C. Matrix metalloproteinase: An upcoming therapeutic approach for idiopathic pulmonary fibrosis. Pharmacol Res. 2020;152:104591. https://doi.org/10.1016/j.phrs.2019.104591.
10. Woessner J.F. MMPs and TIMPs – an historical perspective. Mol Biotechnol. 2002;22(1):33–49. https://doi.org/10.1385/MB:22:1:033.
11. Yu W.H., Yu S., Meng Q. et al. TIMP-3 binds to sulfated glycosaminoglycans of the extracellular matrix. J Biol Chem. 2000;275(40):31226–32. https://doi.org/10.1074/jbc.M000907200.
12. Gersh I., Catchpole H.R. The organization of ground substance and basement membrane and its significance in tissue injury disease and growth. Am J Anat. 1949;85(3):457–521. https://doi.org/10.1002/aja.1000850304.
13. Zitka O., Kukacka J., Krizkova S. et al. Matrix metalloproteinases. Cur Med Chem. 2010;17(31):3751–68. https://doi.org/10.2174/092986710793213724.
14. Verma R.P., Hansch C. Matrix metalloproteinases (MMPs): chemicalbiological functions and (Q)SARs. Bioorg Med Chem. 2007;15:2223–68. https://doi.org/10.1016/j.bmc.2007.01.011.
15. Gross J., Lapierre С.M. Collagenolytic activity in amphibian tissues: a tissue culture assay. Proc Natl Acad Sci U S A. 1962;48(6):1014–22. https://doi.org/10.1073/pnas.48.6.1014.
16. Raffetto J.D., Khalil R.A. Matrix metalloproteinases and their inhibitors in vascular remodeling and vascular disease. Biochem Pharmacol. 2008;75(2):346–59. https://doi.org/10.1016/j.bcp.2007.07.004.
17. Tallant C., Marrero A., Gomis-Rüth F.X. Matrix metalloproteinases: fold and function of their catalytic domains. Biochim Biophys Acta. 2010;1803(1):20–8. https://doi.org/10.1016/j.bbamcr.2009.04.003.
18. Tokuhara C.K., Santesso M.R., de Oliveira G.S.N. et al. Updating the role of matrix metalloproteinases in mineralized tissue and related diseases. J Appl Oral Sci. 2019;27:e20180596. https://doi.org/10.1590/1678-7757-2018-0596.
19. Fischer T., Senn N., Riedl R. Design and structural evolution of matrix metalloproteinase inhibitors. Chemistry. 2019;25(34):7960–80. https://doi.org/10.1002/chem.201805361.
20. Ulbrich S.E., Meyer S.U., Zitta K. et al. Bovine endometrial metallopeptidases MMP14 and MMP2 and the metallopeptidase inhibitor TIMP2 participate in maternal preparation of pregnancy. Mol Cell Endocrinol. 2011;332(1–2):48–57. https://doi.org/10.1016/j.mce.2010.09.009.
21. Zhang X., Qi C., Lin J. Enhanced expressions of matrix metalloproteinase (MMP)-2 and -9 and vascular endothelial growth factors (VEGF) and increased microvascular density in the endometrial hyperplasia of women with anovulatory dysfunctional uterine bleeding. Fertil Steril. 2010;93(7):2362–7. https://doi.org/10.1016/j.fertnstert.2008.12.142.
22. Goldman S., Weiss A., Eyali V., Shalev E. Differential activity of the gelatinases (matrix metalloproteinases 2 and 9) in the fetal membranes and decidua, associated with labour. Mol Hum Reprod. 2003;9(6):367–73. https://doi.org/10.1093/molehr/gag040.
23. Teesalu T., Masson R., Basset P. et al. Expression of matrix metalloproteinases during murine chorioallantoic placenta maturation. Dev Dyn. 1999;214(3):248–58. https://doi.org/10.1002/(SICI)1097-0177(199903)214:33.0.CO;2-N.
24. Kizaki K., Ushizawa K., Takahashi T. et al. Gelatinase (MMP-2 and -9) expression profiles during gestation in the bovine endometrium. Reprod Biol Endocrinol. 2008;6:66. https://doi.org/10.1186/1477-7827-6-66.
25. Vagnoni K.E., Zheng J., Magness R.R. Matrix metalloproteinases-2 and -9, and tissue inhibitor of metalloproteinases-1 of the sheep placenta during the last third of gestation. Placenta. 1998;19(7):447–55. https://doi.org/10.1016/s0143-4004(98)91037-2.
26. Vagnoni K.E., Ginther O.J., Lunn D.P. Metalloproteinase activity has a role in equine chorionic girdle cell invasion. Biol Reprod. 1995;53(4):800–5. https://doi.org/10.1095/biolreprod53.4.800.
27. Laskowska M. Altered maternal serum matrix metalloproteinases MMP-2, MMP-3, MMP-9, and MMP-13 in severe early- and late-onset preeclampsia. BioMed Res Int. 2017:2017:6432426. https://doi.org/10.1155/2017/6432426.
28. Yu Y., Wang L., Liu T., Guan H. MicroRNA-204 suppresses trophoblastlike cell invasion by targeting matrix metalloproteinase-9. Biochem Biophys Res Commun. 2015;463(3):285291. https://doi.org/10.1016/j.bbrc.2015.05.052.
29. Eleuterio N.M., Palei A.C., Rangel Machado J.S. et al. Positive correlations between circulating adiponectin and MMP2 in preeclampsia pregnant. Pregnancy Hypertens. 2015;5(2):205–8. https://doi.org/10.1016/j.preghy.2015.03.001.
30. Woessner J.F. The family of matrix metalloproteinases. Ann N Y Acad Sci. 1994;732:11–21. https://doi.org/10.1111/j.1749-6632.1994.tb24720.x.
31. Montagnana M., Lippi G., Albiero A. et al. Evaluation of metalloproteinases 2 and 9 and their inhibitors in physiologic and pre-eclamptic pregnancy. J Clin Lab Anal. 2009;23(2):88–92. https://doi.org/10.1002/jcla.20295.
32. Oddsdottir C., Riley S.C., Leask R. et al. Dynamics of activities of matrix metalloproteinases9 and-2, and the tissue inhibitors of MMPs in fetal fluid compartments during gestation and at parturition in the mare. Theriogenology. 2011;75(6):1130–8. https://doi.org/10.1016/j.theriogenology.2010.11.02.
33. Senapati S., Wang F., Ord T. et al. Superovulation alters the expression of endometrial genes critical to tissue remodeling and placentation. J Assist Reprod Genet. 2018;35(10):1799–808. https://doi.org/10.1007/s10815-018-1244-z.
34. Dang Y., Li W., Tran V., Khalil R.A. EMMPRIN-mediated induction of uterine and vascular matrix metalloproteinases during pregnancy and in response to estrogen and progesterone. Biochem Pharmacol. 2013;86(6):734–47. https://doi.org/10.1016/j.bcp.2013.06.030.
35. Isaka K., Usuda S., Ito H. et al. Expression and activity of matrix metalloproteinase 2 and 9 in human trophoblasts. Placenta. 2003;24(1):53–64. https://doi.org/10.1053/plac.2002.0867.
36. Li W., Mata K.M., Mazzuca M.Q., Khalil R.A. Altered matrix metalloproteinase-2 and -9 expression/activity links placental ischemia and anti-angiogenic sFlt-1 to uteroplacental and vascular remodeling and collagen deposition in hypertensive pregnancy. Biochem Pharmacol. 2014;89(3):370–85. https://doi.org/10.1016/j.bcp.2014.03.017.
37. Cabral-Pacheco G.A., Garza-Veloz I., Castruita-De la Rosa C. et al. The roles of matrix metalloproteinases and their inhibitors in human diseases. Int J Mol Sci. 2020;21(24):9739. https://doi.org/10.3390/ijms21249739.
38. de Sousa D.A., Pereira-Santos M.C., Serra-Caetano A. et al. Matrix metalloproteinase-9 levels are associated with brain lesion and persistent venous occlusion in patients with cerebral venous thrombosis. Thromb Haemost. 2021;121(11):1476–82. https://doi.org/10.1055/s-0041-1726094.
39. Mochizuki S., Okada Y. ADAMs in cancer cell proliferation and progression. Cancer Sci. 2007;98(5):621–8. https://doi.org/10.1111/j.1349-7006.2007.00434.x.
40. Kelwick R., Desanlis I., Wheeler G.N., Edwards D.R. The ADAMTS (A Disintegrin and Metalloproteinase with Thrombospondin motifs) family. Genome Biol. 2015;16(1):113. https://doi.org/10.1186/s13059-015-0676-3.
41. Kuno K., Kanada N., Nakashima E. et al. Molecular cloning of a gene encoding a new type of metalloproteinase disintegrin family protein with thrombospondin motifs as an inflammation associated gene. J Biol Chem. 1997;272(1):556–62. https://doi.org/10.1074/jbc.272.1.556.
42. Apte S.S. A disintegrin-like and metalloprotease (reprolysin-type) with thrombospondin type 1 motif (ADAMTS) superfamily: functions and mechanisms. J Biol Chem. 2009;284(46):31493–7. https://doi.org/10.1074/jbc.R109.052340.
43. Porter S., Clark I.M., Kevorkian L., Edwards D.R. The ADAMTS metalloproteinases. Biochem J. 2005;386(Pt 1):15–27. https://doi.org/10.1042/BJ20040424.
44. Lee S.-Y., Lee H.-S., Gil M. et al. Differential expression patterns of a disintegrin and metalloproteinase with thrombospondin motifs (ADAMTS) -1, -4, -5, and -14 in human placenta and gestational trophoblastic diseases. Arch Pathol Lab Med. 2014;138(5):643–50. https://doi.org/10.5858/arpa.2012-0227-OA.
45. Chaemsaithong P., Madan I., Romero R. et al. Characterization of the myometrial transcriptome in women with an arrest of dilatation during labor. J Perinat Med. 2013;41(6):665– 81. https://doi.org/10.1515/jpm-2013-0086.
46. Kalem M.N., Kalem Z., Yüce T., Soylemez F. ADAMTS 1, 4, 12, and 13 levels in maternal blood, cord blood, and placenta in preeclampsia. Hypertens Pregnancy. 2018;37(1):9–17. https://doi.org/10.1080/10641955.2017.1397690.
47. Gokdemir I.E., Ozdegirmenci O., Elmas B. et al. Evaluation of ADAMTS12, ADAMTS16, ADAMTS18 and IL-33 serum levels in pre-eclampsia. J Matern Fetal Neonatal Med. 2016;29(15):2451–6. https://doi.org/10.3109/14767058.2015.1087497.
48. Fujikawa K., Suzuki H., McMullen B., Chung D. Purification of human von Willebrand factor cleaving-protease and its identification as a new member of the metalloproteinase family. Blood. 2001;98(6):1662–6. https://doi.org/10.1182/blood.v98.6.1662.
49. Gerritsen H.E., Robles R., Lämmle B., Furlan M. Partial amino acid sequence of purified von Willebrand factor-cleaving protease. Blood. 2001;98(6):1654–61. https://doi.org/10.1182/blood.v98.6.1654.
50. Feys H.B., Canciani M.T., Peyvandi F. et al. ADAMTS13 activity to antigen ratio in physiological and pathological conditions associated with an increased risk of thrombosis. Br J Haematol. 2007;138(4):534–40. https://doi.org/10.1111/j.1365-2141.2007.06688.x.
51. Hellstrom-Westas L., Ley D., Berg A.-C. et al. VWF cleaving protease (ADAMTS13) in premature infants. Acta Paediatr. 2005;94(2):205–10. https://doi.org/10.1111/j.1651-2227.2005.tb01892.x.
52. Strauss T., Elisha N., Ravid B. et al. Activity of Von Willebrand factor and levels of VWF-cleaving protease (ADAMTS13) in preterm and full term neonates. Blood Cells Mol Dis. 2017;67:14–7. https://doi.org/10.1016/j.bcmd.2016.12.013.
53. Kulkarni A.A., Osmond M., Bapir M. et al. The effect of labour on the coagulation system in the term neonate. Haemophilia. 2013;19(4):533–8. https://doi.org/10.1111/hae.12115.
54. Aref S., Goda H. Increased VWF antigen levels and decreased ADAMTS13 activity in preeclampsia. Hematology. 2013;18(4):237–41. https://doi.org/10.1179/1607845412Y.0000000070.
55. Stepanian A., Cohen-Moatti M., Sanglier T. et al. Von Willebrand factor and ADAMTS13: a candidate couple for preeclampsia pathophysiology. Arterioscler Thromb Vasc Biol. 2011;31(7):1703–9. https://doi.org/10.1161/ATVBAHA.111.223610.
56. Xiao J., Feng Y., Li X. et al. Expression of ADAMTS13 in normal and abnormal placentae and its potential role in angiogenesis and placenta development. Arterioscler Thromb Vasc Biol. 2017;37(9):1748–56. https://doi.org/10.1161/ATVBAHA.117.309735.
57. Laurence J. Atypical hemolytic uremic syndrome (aHUS): making the diagnosis. Clin Advs Hematol Oncol. 2012;10(10 Suppl 17):1–12.
58. Ono T., Mimuro .J, Madoiwa S. et al. Severe secondary deficiency of von Willebrand factor-cleaving protease (ADAMTS13) in patients with sepsisinduced disseminated intravascular coagulation: its correlation with development of renal failure. Blood. 2006;107(2):528–34. https://doi.org/10.1182/blood-2005-03-1087.
59. Rutten B., Maseri A., Cianflone D. et al. Plasma levels of active Von Willebrand factor are increased in patients with first ST-segment elevation myocardial infarction: a multicenter and multiethnic study. Eur Heart J Acute Cardiovasc Care. 2015;4(1):64–74. https://doi.org/10.1177/2048872614534388.
60. Макацария А.Д., Элалами И., Воробьев А.В. и др. Тромботическая микроангиопатия у онкологических больных. Вестник РАМН. 2019;74(5):323–32. https://doi.org/10.15690/vramn1204.
61. Andersson H.M., Siegerink B., Luken B.M. et al. High VWF, low ADAMTS13, and oral contraceptives increase the risk of ischemic stroke and myocardial infarction in young women. Blood. 20129;119(6):1555–60. https://doi.org/10.1182/blood-2011-09-380618.
62. Koo B.H., Oh D., Chung S.Y. et al. Deficiency of von Willebrand factorcleaving protease activity in the plasma of malignant patients. Thromb Res. 2002;105(6):471–6. https://doi.org/10.1016/s0049-3848(02)00053-1.
63. Lancellotti S., Basso M., Veca V. et al. Presence of portal vein thrombosis in liver cirrhosis is strongly associated with low levels of ADAMTS-13: a pilot study. Intern Emerg Med. 2016;11(7):959–67. https://doi.org/10.1007/s11739-016-1467-x.
64. Бицадзе В.О., Суконцева Т.А., Акиньшина С.В. и др. Септический шок. Акушерство, Гинекология и Репродукция. 2020;14(3):314–26. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2020.169.
65. Aghababaei M., Perdu S., Irvine K., Beristain A.G. A disintegrin and metalloproteinase 12 (ADAM12) localizes to invasive trophoblast, promotes cell invasion and directs column outgrowth in early placental development. Mol Hum Reprod. 2014;20(3):235–49. https://doi.org/10.1093/molehr/gat084.
66. Biadasiewicz K., Fock V., Dekan S. Extravillous trophoblast-associated ADAM12 exerts pro- invasive properties, including induction of integrin beta 1-mediated cellular spreading. Biol Reprod. 2014;90(5):101. https://doi.org/10.1095/biolreprod.113.115279.
67. Yu N., Cui H., Chen X., Chang Y. First trimester maternal serum analytes and second trimester uterine artery Doppler in the prediction of preeclampsia and fetal growth restriction. Taiwan J Obstet Gynecol. 2017;56(3):358–61. https://doi.org/10.1016/j.tjog.2017.01.009.
68. El-Sherbiny W., Nasr A., Soliman A. Metalloprotease (ADAM12-S) as a predictor of preeclampsia: correlation with severity, maternal complications, fetal outcome, and Doppler parameters. Hypertens Pregnancy. 2012;31(4):442–50. https://doi.org/10.3109/10641955.2012.690059.
69. Karagiannis G., Akolekar R., Sarquis R. et al. Prediction of small-forgestation neonates from biophysical and biochemical markers at 11-13 weeks. Fetal Diagn Ther. 2011;29(2):148–54. https://doi.org/10.1159/000321694.
70. Kokozidou M., Drewlo S., Bartz C. et al. Complex patterns of ADAM12 mRNA and protein splice variants in the human placenta. Ann Anat. 2011;193(2):142–8. https://doi.org/10.1016/j.aanat.2010.12.002.
Об авторах
К. Н. ГригорьеваРоссия
ординатор кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова,
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
В. О. Бицадзе
Россия
д.м.н., профессор РАН, профессор кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова,
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Д. Х. Хизроева
Россия
д.м.н., профессор кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова,
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
М. В. Третьякова
Россия
к.м.н., врач акушер-гинеколог, ассистент кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова, 119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Д. В. Блинов
Россия
к.м.н., руководитель по медицинским и научным вопросам, 127006 Москва, ул. Садовая-Триумфальная, д. 4–10;
врач-невролог, 143081 Московская область, Одинцовский район, Лапино, 1-ое Успенское шоссе, д. 111
Н. А. Макацария
Россия
к.м.н., доцент кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова,
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
В. И. Цибизова
Россия
к.м.н., акушер-гинеколог НИЛ оперативной гинекологии;
врач отделения функциональной и ультразвуковой диагностики, 197341 Санкт-Петербург, ул. Аккуратова, д. 2
И. А. Накаидзе
Россия
аспирант кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова,
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Н. Р. Гашимова
Россия
аспирант кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова,
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Э. Грандоне
Италия
д.м.н., профессор кафедры акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова, 119991 Москва, ул. Большая Пироговская, д. 2, стр. 4;
руководитель отделения тромбозов и гемостаза, 71013 Сан-Джованни-Ротондо, Viale Cappuccini, д. 1
А. Д. Макацария
Россия
д.м.н., профессор, академик РАН, зав. кафедрой акушерства и гинекологии Клинического института детского здоровья имени Н.Ф. Филатова,
119991 Москва, ул. Большая Пироговская, д. 2, стр. 4
Рецензия
Для цитирования:
Григорьева К.Н., Бицадзе В.О., Хизроева Д.Х., Третьякова М.В., Блинов Д.В., Макацария Н.А., Цибизова В.И., Накаидзе И.А., Гашимова Н.Р., Грандоне Э., Макацария А.Д. Металлопротеиназы как биохимические маркеры патологии беременности. Акушерство, Гинекология и Репродукция. 2022;16(1):38-47. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.275
For citation:
Grigorieva K.N., Bitsadze V.O., Khizroeva J.Kh., Tretyakova M.V., Blinov D.V., Makatsariya N.A., Tsibizova V.I., Nakaidze I.A., Gashimova N.R., Grandone E., Makatsariya A.D. Metalloproteinases as biochemical markers of pregnancy pathology. Obstetrics, Gynecology and Reproduction. 2022;16(1):38-47. (In Russ.) https://doi.org/10.17749/2313-7347/ob.gyn.rep.2022.275

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































